Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.81 no.1 Vicente López ene./jun. 2012
ARTÍCULOS ORIGINALES
Producción de biomasa y rendimiento en judía verde (Phaseolus vulgaris L.) cv. Strike en respuesta a la fertilización fosforada
Biomass production and yield of green beans (Phaseolus vulgaris L.) cv. Strike in response to phosphate fertilization
Salinas1 R, E Sánchez2, JM Ruíz3, MT Lao1, L Romero3
1 Universidad de Almería, Campus de Excelencia Internacional del Sector Agroalimentario (CeiA3). Departamento de Producción Vegetal. Ctra. Sacramento s/n. La Cañada de San Urbano. C.P. 04120, Almería, España.
2 Facultad de Ciencias Agrotecnológicas, Universidad Autónoma de Chihuahua, Ciudad Universitaria s/n (Campus Universitario I), Chihuahua, Chih. México.
3 Universidad de Granada, Departamento de Fisiología Vegetal. Av. Fuente Nueva s/n, C.P. 18071, Granada, España. e-mail: lromero@ugr.es
Address Correspondence to: M.T. Lao, e-mail: mtlao@ual.es
Recibido / Received 17.II.2011.
Aceptado / Accepted 22.VII.2011.
Resumen. El objetivo del presente trabajo fue determinar el impacto de la deficiencia de fósforo, el nivel adecuado o la toxicidad de este macronutriente en la producción de biomasa total y el rendimiento en judía verde (Phaseolus vulgaris L.) cv. 'Strike'. El experimento se realizó en cámara de cultivo, en macetas con sustrato (vermiculita). Los niveles de fósforo en la solución nutritiva fueron: P1: 0,5 mM; P2: 1 mM; P3: 2 mM; P4: 4 mM; P5: 6 mM, y P6: 8 mM. La concentración P3 (2 mM) fue considerada como la óptima. La influencia del fósforo fue significativa, provocando un aumento progresivo en la concentración total de este elemento en la planta. Con el tratamiento P6 se obtuvo la mayor concentración de fósforo en la planta y con P1 la más baja. Los resultados indican que la producción de biomasa de hojas, pecíolos y tallos fue más sensible a la deficiencia que a la toxicidad de fósforo. Sin embargo, la disminución de biomasa radical se produjo a medida que aumentó la concentración de fósforo en el medio. La aplicación de las tasas más altas de fósforo fueron las que redujeron más los rendimientos, siendo éstos más sensibles a la toxicidad que a la deficiencia de fósforo.
Palabras clave: Fósforo; Deficiencia; Toxicidad; Solución nutritiva; Rendimientos.
Abstract. We determined the (1) deficiency, (2) apropriate level and (3) toxiticity of phosphorus on the total biomass production and yield of judía verde (Phaseolus vulgaris L.) cv. 'Strike'. Studies were conducted in a growth chamber using pots. Phosphorus levels in the nutrient solution were P1: 0.5 mM; P2: 1 mM; P3: 2 mM; P4: 4 mM; P5: 6 mM, and P6: 8 mM. The optimum phosporus concentration was P3. As soil phosphorus concentration increased, concentration of this nutrient also increased in the plant. Leaf, petiole and shoot biomasses were more sensitive to deficiency than to toxicity of phosphorus. However, root biomass decreased as concentration of phosphorus increased in the nutrient solution. Yields were reduced most by the higher phosphorus concentrations, and they were more sensitive to toxicity than to deficiency of this nutrient.
Keywords: Phosphorus; Deficiency; Toxicity; Nutrient solution; Yield.
INTRODUCCIÓN
A nivel mundial, son quince las hortalizas que ocupan alrededor del 60,7% de la superficie de cultivos hortícolas (FAOSTAT, 2009). Entre ellas, la judía verde (España); ejote (México); habichuelas (Colombia); chauchas (Argentina); porotos verdes (Chile) (Phaseolus vulgaris L.) se encuentra en la undécima posición, con una superficie global de 1.218.956 hectáreas, o el 2,3% de la superficie total de cultivos hortícolas en el mundo (FAO, 2007). Además, la judía verde ha sido uno de los principales cultivos en invernadero en la cuenca mediterránea (López et al., 2008). Aunque las legumbres son citadas a menudo como un complemento a los cereales, en términos de concentración de aminoácidos, también constituyen una contribución especialmente importante a la nutrición mediante el suministro de micronutrientes (Blair et al., 2009).
El fósforo (P) es uno de los macronutrientes esenciales y está directa o indirectamente involucrado en diversos procesos fisiológicos y bioquímicos importantes en las plantas, siendo parte integrante del metabolismo de la energía, componente de los ácidos nucleicos y de las membranas (Marschner, 1995). Además, los niveles de P regulan la expresión de un gran número de genes, incluyendo aquellos involucrados en el metabolismo de la fotosíntesis y del carbono. Igualmente, forma parte de los fosfolípidos, desempeñando un papel relevante en la integridad de la membrana y su función (Raghothama y Karthikeyan, 2005). Igualmente, la fosforilación y defosforilación de las proteínas son fundamentales para las vías de transducción de señales en las plantas. Por otra parte, la homeostasis del fosfato en el cloroplasto regula el transporte de azúcares fosforilados a través de la membrana y la síntesis de almidón (Karthikeyan et al., 2007).
La baja disponibilidad de P es uno de los principales factores que limitan la producción de cultivos en la mayor parte del planeta (Lynch y Deikman, 1998; Vance et al, 2003; Raghothama y Karthikeyan, 2005). Una de las respuestas típicas a un bajo nivel de P en el medio son los cambios en la arquitectura y la producción de biomasa radical (Henry et al., 2010). Además, se ha observado que el área foliar se reduce significativamente con la falta de fósforo en la judía común (Olivera et al., 2004). No obstante, algunos estudios han determinado que el hábito de crecimiento de los brotes (hábito determinado o indeterminado) juega un papel complejo e importante en la adaptación a la deficiencia de P, y a los cambios en la arquitectura de la raíz (longitud y densidad) (Cichy et al., 2009). Las variaciones en la absorción de P y su concentración en el interior de la planta también se han relacionado con diferencias genotípicas en la judía común (Henry et al., 2010).
Niveles excesivos de P disponible en el medio pueden interferir con la absorción de Zn o Fe (Marschner, 1995) y, en consecuencia, pueden alterar la producción de biomasa. Además, Adams (2004) indicó que las deficiencias de Zn o de Fe son más frecuentes cuando existen altas concentraciones de P en el medio. Debido a que la fisiología de la toxicidad del P no es conocida totalmente, las interacciones del P con el Zn o el Fe pueden causar síntomas que reflejen carencias de micronutrientes (Robson y Pitman, 1983; Marschner, 1995; Lambers et al, 2002), aunque realmente su origen podría estar en una toxicidad debido a los altos niveles de P. De este modo, es probable que estudios que han descrito deficiencias de micronutrientes hayan sido, de hecho, un reflejo de síntomas de toxicidad debido a altos niveles de P (Shane et al., 2003).
La acción del ser humano ha acelerado el ciclo natural del P debido a (1) la entrada de fósforo en la biosfera, con P obtenido desde yacimientos minerales, y (2) el movimiento del fósforo desde sistemas terrestres hacia ecosistemas acuáticos. Aunque es probable que menos del 5% del fósforo utilizado como fertilizante en las zonas templadas llegue hasta los ecosistemas acuáticos cada año, es una cantidad suficiente para causar grandes cambios en esos ambientes (Bennett y Carpenter, 2002). Adicionalmente, resulta preocupante el uso continuo de fertilizantes fosforados debido a su contenido de metales pesados como el arsénico, cadmio, cromo, plomo y vanadio (Juárez y Andreu, 1996; Salinas et al., 2006).
La fertilización y el riego por goteo pueden aumentar la absorción de P y afectar la distribución de P en el suelo o en el sustrato (Palacios-Díaz et al., 2009). Por ejemplo, el riego por goteo contribuyó a aumentar hasta un 38% la absorción de P en un cultivo de tomate industrial (Zhang et al., 2009). Sin embargo, pocos estudios se han realizado para conocer el nivel de P adecuado, deficiente o excesivo en judía verde en una solución nutritiva sobre un sustrato como la vermiculita. De este modo, el objetivo del presente trabajo fue determinar, en cámara de cultivo, el rango de concentración de P en una solución nutritiva que permite obtener la mayor cantidad de biomasa en plantas de judía verde cv. 'Strike', estableciendo, además, niveles de deficiencia o de toxicidad de fósforo.
MATERIALES Y MÉTODOS
Diseño del ensayo y toma de muestras. Las plantas de judía verde (Phaseolus vulgaris L.) cv. 'Strike' fueron sembradas y cultivadas en cámara de cultivo bajo condiciones controladas, con una humedad relativa del 60 a 80%, temperatura de 28 °C/22 °C (día/ noche), fotoperíodo de 16/8 h (día/noche), y una intensidad lumínica de 350 µmol/m2s (medida en la parte superior de las plantas con un sensor cuántico LI-190SA, LI-COR Inc., Lincoln, NE, USA). Se cultivaron cuatro plantas por maceta, con capacidad de 8 L cada maceta, con vermiculita. Durante 20 días (incluidos 8 días de germinación), antes de los tratamientos experimentales, las plantas recibieron una solución nutritiva de 6 mM NH4NO3; 1,6 mM K2HPO4; 2,4 mM K2SO4; 1,25 mM CaCl2·2H2O; 1,4 mM MgSO4·7H2O; 5 µM Fe-EDDHA; 2 µM MnSO4·H2O; 1 µM ZnSO4·7H2O; 0,25 µM CuSO4·5H2O; 0,3 µM (NH4)6Mo7O24·4H2O y 5 µM H3BO3 (Sánchez et al., 2004). La solución nutritiva (pH 6,0-6,1) fue renovada cada 3 días desde el comienzo hasta el final del ensayo.
A los 21 días de efectuada la siembra, se aplicaron durante 40 días (hasta la cosecha) los diferentes tratamientos de dosis de P en forma de KH2PO4 y H3PO4 (P1: 0,5 mM; P2: 1 mM; P3: 2 mM; P4: 4 mM; P5: 6 mM y P6: 8 mM). La concentración de P3 (2 mM) fue considerada óptima; P2 deficiente, P1 muy deficiente, y P4 a P6 tóxicas a muy tóxicas. La toma de muestras se realizó a los 60 días después de la siembra, una vez alcanzada la madurez fisiológica y por lo tanto la formación del fruto (vaina y semillas). Se efectuó la partición de los órganos en raíces, tallos, hojas, vainas y semillas.
El material vegetal fue lavado tres veces en agua destilada, luego descontaminado con un detergente no iónico al 1% (Wolf, 1982) y secado en papel filtro. Una submuestra de los diferentes órganos fue secada en aire forzado a 70 °C durante 24 h, y luego molida en un molino Wiley. Estas muestras se utilizaron para el análisis del P en la planta, y la determinación del peso seco de cada órgano.
Análisis de las Plantas. Cuantificación del P total. La extracción de P total en los diferentes órganos siguió el método de Hogue et al. (1970). A 0,1 mL de muestra de tejido digerido se agregaron 3,9 mL de agua desionizada y 6,0 mL de reactivo de P. Después de 60 minutos, el contenido de P fue determinado colorimétricamente a 420 nm.
Análisis estadístico. El diseño experimental fue de seis bloques completos aleatorizados. Las repeticiones, seis por tratamiento, fueron distribuidas al azar en la cámara de cultivo, cada una de ellas con cuatro plantas (en macetas individuales) con un total de 24 plantas por cada tratamiento. Se utilizó un análisis de la varianza para valorar el nivel de significación de los tratamientos. Para comparar la diferencia entre los valores medios de los tratamientos se utilizó el test de mínimas diferencias de Fisher (LSD) con un nivel de significación de 0,05. Para el análisis estadístico se utilizó el paquete Statgraphic 5.1.
RESULTADOS Y DISCUSIÓN
Las dosis de fósforo influyeron en la producción de biomasa, con un efecto diferente entre las partes aérea y subterránea. Así, mientras que la masa de las raíces disminuyó a medida que aumentó la dosis de P, los órganos aéreos alcanzaron una producción máxima de biomasa con el tratamiento P3, 2 mM de H3PO4 (Fig. 1). Las hojas completas (hojas y pecíolos) y tallos de la planta alcanzaron los valores más bajos de peso seco con P1 (0,5 mM de H3PO4), siendo estos órganos de judía verde más susceptibles a la falta de P que a niveles excesivos o tóxicos. Sin embargo, la menor producción de frutos se obtuvo con el máximo nivel de P: 8 mM de H3PO4 (Fig. 1).
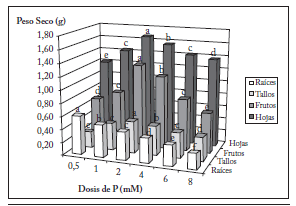
Fig. 1. Dosis de P y su efecto sobre la producción de biomasa de diferentes órganos de judía verde. Para cada órgano letras distintas reflejan diferencias a p<0,05.
Fig. 1. Phosphorus levels and their effect on the biomass production of different organs in P. vulgaris. Different letters within each organ indicate significant differences at p<0.05.
La producción máxima de biomasa de todos los órganos aéreos se obtuvo con el tratamiento P3 (2 mM de P). El óptimo suministro de P aumentó en un 27% la biomasa de las hojas, un 46% la biomasa de las vainas y un 51% la biomasa de los tallos, al comparar P3 con P1 (0,5 mM de P). La producción de biomasa de los órganos aéreos (hojas completas y tallos) también disminuyó con un nivel de P excesivo o tóxico, aunque con una intensidad menor que con los valores deficientes de P. Así, al comparar el tratamiento P3 con P6 (8 mM de P), la biomasa de las hojas disminuyó un 18%, la de los tallos un 24%, y la de los frutos un 51% (Fig. 1). En las raíces, se alcanzó el valor más bajo de producción de biomasa con la concentración más elevada de P (8 mM de H3PO4), disminuyendo un 61% la biomasa total al comparar P1 con respecto a P6 (Fig. 1).
Los niveles de fósforo regulan la expresión de un gran número de genes, incluidos aquellos que participan en la fotosíntesis y el metabolismo del carbono (Raghothama y Karthikeyan, 2005). Si no existe un adecuado nivel de P (tratamientos P1 y P2), estos dos procesos se ven restringidos, con una consiguiente disminución en la producción de biomasa. Por otra parte, la deficiencia de P conlleva una inducción o represión de más de 1.000 genes implicados en diversos procesos. Por ejemplo, la inducción de genes implicados en la absorción de P, la movilización de P orgánico, la conversión de los intermediarios fosforilados glucolíticos a carbohidratos y ácidos orgánicos y la sustitución del P que contienen los fosfolípidos con galactolípidos. Podemos además mencionar la represión de los genes implicados en la síntesis de ácidos nucleicos (Morcuende et al., 2007). Estos procesos podrían influir en la baja producción de biomasa de los órganos aéreos.
Con respecto a los altos niveles de P disponible en el medio, es probable que la fisiología de la toxicidad del P todavía no se entienda lo suficiente. Como resultado es probable que las interacciones del P con el Zn o el Fe provoquen síntomas similares a los de deficiencias de micronutrientes (Robson y Pitman, 1983; Marschner, 1995; Lambers et al, 2002), aunque realmente su origen podría estar en la toxicidad del P. De esta manera, Sánchez et al. (2009) han encontrado efectos de toxicidad por P en plantas de judía verde a niveles superiores a 3,20 mM de H3PO4. Estos autores han informado una gran reducción de la biomasa con altos niveles de P (6,40 mM). Estos niveles de P determinaron una mínima actividad enzimática relacionada con la asimilación de NO3- lo que, finalmente, se tradujo en una mínima síntesis de compuestos orgánicos nitrogenados implicados en el crecimiento y en el desarrollo de las plantas.
La deficiencia de P está asociada con un mayor crecimiento de la raíz (Beebe et al. 2006). De este modo, las relaciones que se registraron entre el crecimiento de la parte aérea y el crecimiento de las raíces fueron de 3,5; 5,3; 8,0; 8,3; 8,2 y 10,0 desde P1 a P6, respectivamente. Sin embargo, el crecimiento de las raíces de los cultivares de P. vulgaris de crecimiento determinado es más sensible a los bajos niveles de P que el de los cultivares de crecimiento indeterminado (Cichy et al., 2009). En nuestro estudio, la variedad de judía verde 'Strike' tiene un hábito de crecimiento determinado, lo que probablemente contribuyó a que el crecimiento de las raíces fuese significativamente más elevado ante la deficiencia de P.
La reducción en un 61% en la producción de biomasa de la raíz, al comparar P1 con P6 (Fig. 1) concuerda con las respuestas fisiológicas en plantas con deficiencia de P que muestran una mayor proporción raíz/brotes (Lynch, 1995). La longitud de los pelos de la raíz contribuye a la adquisición de P (Zhu et al., 2010). De este modo, la selección de plantas de judía verde con un mayor crecimiento de la raíz, podría ser una estrategia para incrementar la absorción de P y el rendimiento (Araújo et al., 2005).
Hubo un aumento progresivo del contenido total de P en los diferentes órganos en la medida que se incrementó la concentración de P en la solución nutritiva (Fig. 2). Este resultado está en concordancia con Lee et al. (1990): un aumento de la concentración externa de P produce un incremento de las concentraciones de P en la planta.

Fig. 2. Contenido de P en hojas, raíces y frutos (peso del órgano X concentración de P) bajo diferentes dosis de fósforo en la solución nutritiva.
Fig. 2. Phosphorus content in leaves, roots and fruits (organ weight x P concentration in that organ) under different concentrations of P in the nutrient solution.
La máxima acumulación de P en las raíces se produjo con el tratamiento P5 (6 mM de H3PO4), declinando la acumulación de P en dicho órgano con el tratamiento P6. La disminución de la biomasa radical registrada con el tratamiento P6 contribuyó a determinar una reducción en la extracción del P total. Por lo tanto, una dosis excesiva o tóxica de P en el medio influyó en la disminución de la biomasa de raíz y, finalmente, en la absorción de P (Fig. 2).
La máxima producción de biomasa de toda la planta (hojas, frutos, tallos, raíces) se obtuvo con el tratamiento 2 mM de P (Fig. 3). Con este tratamiento se obtuvo también la máxima producción de frutos (Fig. 1). Estos resultados indican que la dosis óptima de fósforo para esta variedad de judía verde, bajo las condiciones de cultivo estudiadas, fue de 2 mM de H3PO4.

Fig. 3. Producción de biomasa y contenido de P total en hojas de judía verde bajo diferentes dosis de fósforo.
Fig. 3. Biomass production and total P content on leaves of P. vulgaris under various phosphorus concentrations.
Al comparar la producción de biomasa con la concentración de P total en las hojas, se observó que la cantidad máxima de biomasa se alcanzó con una concentración de 449 mg de P por g de peso seco (Fig. 3).
Se determinó la existencia de un óptimo suministro de P para alcanzar una máxima producción de biomasa en las judías verdes. Esto destaca la importancia de efectuar suministros de P adecuados en P. vulgaris para alcanzar niveles adecuados de cosecha. Es de tener en cuenta, sin embargo, que si los suministros de P son excesivos (es decir, tóxicos) se producirán reducciones en la producción de biomasa. Los estudios efectuados se realizaron en macetas; por lo tanto es necesaria la realización de estudios de campo para dilucidar los efectos de la aplicación de P al suelo sobre el rendimiento de P. vulgaris a escalas mayores.
REFERENCIAS
1. Adams, P. (2004). Aspectos de la nutrición mineral en cultivos sin suelo en relación al suelo, en: Tratado de Cultivo sin Suelo, ed. Urrestarazu, M. 81-111. Ediciones Mundi-Prensa, Madrid, España. [ Links ]
2. Araújo, A.P., I. Ferreira y M. Grandi (2005). Inheritance of root traits and phosphorus uptake in common bean (Phaseolus vulgaris L.) under limited soil phosphorus supply. Euphytica 145: 33-40. [ Links ]
3. Beebe, S.E., M. Rojas-Pierce, X. Yan, M.W. Blair, F. Pedraza, F. Muñoz, J. Tohme y J.P. Lynch (2006). Quantitative trait loci for root architecture traits correlated with phosphorus acquisition in common bean. Crop Science 46: 413-423. [ Links ]
4. Bennett, E. y S.R. Carpenter (2002). P soup: Humanity's impact on the phosphorus cycle. World Watch 15: 24-32. [ Links ]
5. Blair, M.W., C. Astudillo, M.A. Grusak, R. Graham y S.E. Beebe (2009). Inheritance of seed iron and zinc concentrations in common bean (Phaseolus vulgaris L.). Molecular Breeding 23: 197-207. [ Links ]
6. Cichy, K.A., S.S. Snapp y M.W. Blair (2009). Plant growth habit, root architecture traits and tolerance to low soil phosphorus in an Andean bean population. Euphytica 165: 257-268. [ Links ]
7. FAO (2007). http://faostat.fao.org [ Links ]
8. FAOSTAT (2009). http://faostat.fao.org [ Links ]
9. Henry, A., N.F. Chaves, P.J.A. Kleinman y J.P. Lynch (2010). Will nutrient-efficient genotypes mine the soil? Effects of genetic differences in root architecture in common bean (Phaseolus vulgaris L.) on soil phosphorus depletion in a low-input agroecosystem in Central America. Field Crops Research 115: 67-78. [ Links ]
10. Hogue, E., G.E. Wilcow y D.J. Cantliffe (1970). Effect of soil P on phosphate fraction in tomato leaves. Journal of The American Society for Horticultural Science 95: 174-176. [ Links ]
11. Juárez, M. y J.S. Andréu (1996). Fósforo en Agricultura. Universidad de Alicante, España. 135 p. [ Links ]
12. Karthikeyan, A.S., D.K. Varadarajan, A. Jain, M.A. Held, N.C. Carpita y K.G. Raghothama (2007). Phosphate starvation responses are mediated by sugar signaling in Arabidopsis. Planta 225: 907-918. [ Links ]
13. Lambers, H., D. Juniper, G.R. Cawthray, E.J. Veneklaas y E. Martínez-Ferri (2002). The pattern of carboxylate exudation in Banksia grandis (Proteaceae) is affected by the form of phosphate added to the soil. Plant and Soil 238: 111-122. [ Links ]
14. Lee, R.B., R.G. Ratcliffe y T.E. Southon (1990). Measurements of the cytoplasmic and vacuolar Pi content of mature maize roots: relationships with phosphorus status and phosphate fluxes. Journal of Experimental Botany 41: 1063-1078. [ Links ]
15. López, J.C., A. Baille, S. Bonachela y J. Pérez-Parra (2008). Analysis and prediction of greenhouse green bean (Phaseolus vulgaris L.) production in a Mediterranean climate. Biosystems Engineering 100: 86-95. [ Links ]
16. Lynch, J. (1995). Root architecture and plant productivity. Plant Physiology 109: 7-13. [ Links ]
17. Lynch, J.P. y J. Deikman (1998). Phosphorus in Plant Biology: Regulatory Roles in Molecular, Cellular, Organismic, and Ecosystem Processes. Volume 19 of Current Topics in Plant Physiology. American Society of Plant Physiologists, Rockville, MD, USA. [ Links ]
18. Marschner, M. (1995). Mineral Nutrition of Higher Plants, 2nd edn, Academic Press Limited, London, UK. [ Links ]
19. Morcuende, R., R. Bari, I. Gibbon, W. Zheng, B. Datt Pant, O. Bläsing, B. Usadel, T. Czechowski, M.K. Udvardi, M. Stitt y W.R. Scheible (2007). Genome-wide reprogramming of metabolism and regulatory networks of Arabidopsis in response to phosphorus. Plant, Cell and Environment 30: 85-112. [ Links ]
20. Olivera, M., N. Tejera, C. Iribarne, A. Ocaña y C. Lluch (2004). Growth, nitrogen fixation and ammonium assimilation in common bean (Phaseolus vulgaris): Effect of phosphorus. Physiologia Plantarum 121: 498-505. [ Links ]
21. Palacios-Díaz, M.P., V. Mendoza-Grimón, J.R. Fernández-Vera, F. Rodríguez-Rodríguez, M.T. Tejedor-Junco Y J.M. Hernández- Moreno (2009). Subsurface drip irrigation and reclaimed water quality effects on phosphorus and salinity distribution and forage production. Agricultural Water Management 96: 1659-1666. [ Links ]
22. Raghothama, K.G. y A.S. Karthikeyan (2005). Phosphate acquisition. Plant and Soil 274: 37-49. [ Links ]
23. Robson, A.D. y M.G. Pitman (1983). Interaction between nutrients in higher plants. Encyclopedia of Plant Physiology, pp. 147-180. [ Links ]
24. Salinas, R., M.T. Lao y L. Romero (2006). Phosphorus and its use in agriculture. Recent Research Developed in Nutrition 7: 1-45. [ Links ]
25. Sánchez, E., G. Ávila-Quezada, A.A. Gardea, E. Muñoz, J.M. Ruiz y L. Romero (2009). Nitrogen metabolism in roots and leaves of green bean plants exposed to different phosphorus doses. Phyton, International Journal of Experimental Botany 78: 11-16. [ Links ]
26. Sánchez, E., R.M. Rivero, J.M. Ruiz y L. Romero (2004). Yield and biosynthesis of nitrogenous compounds in fruits of green bean (Phaseolus vulgaris L.) cv Strike, in response to increasing N fertilization. Journal of the Science of Food and Agriculture 84: 575-580. [ Links ]
27. Shane, M.W., M. De Vos, S. De Roock, G.R. Cawthray y H. Lambers (2003). Effects of external phosphorus supply on internal phosphorus concentration and the initiation, growth and exudation of cluster roots in Hakea prostrata R.Br. Plant and Soil 248: 209-219. [ Links ]
28. Vance, C.P., C. Uhde-Stone y D.L. Allan (2003). Phosphorus acquisition and use: Critical adaptations by plants for securing a non renewable resource. New Phytologist 157: 423-447. [ Links ]
29. Wolf, B. (1982). A comprehensive system of leaf analyses and its use for diagnosing crop nutrient status. Communications in Soil Science and Plant Analysis 13: 1035-1059. [ Links ]
30. Zhang, T.Q., C.S. Tan y K. Liu (2009). Phosphorus and potassium application to processing tomatoes grown with drip irrigation. Acta Horticulturae 823: 97-102. [ Links ]
31. Zhu, J., C. Zhang y J.P. Lynch (2010). The utility of phenotypic plasticity of root hair length for phosphorus acquisition. Functional Plant Biology 37: 313-322. [ Links ]














