Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.81 no.1 Vicente López ene./jun. 2012
ARTÍCULOS ORIGINALES
Interrelación entre fósforo, Bacillus subtilis y Glomus fasciculatum con la calidad en Lilium
Interrelationship between phosphorus, Bacillus subtilis and Glomus fasciculatum with Lilium quality
Rubí Arriaga M1, A González Huerta1, V Olalde Portugal2, BG Reyes Reyes3, AM Castillo González4, DJ Pérez López1, LI Aguilera Gómez5
1 Centro de Investigación y Estudios Avanzados en Fitomejoramiento, Universidad Autónoma del Estado de México (UAEMEX). Toluca, Estado de México. C.P. 50200. México.
2 Laboratorio de Bioquímica Ecológica, Departamento de Biotecnología y Bioquímica. CINVESTAV-IPN. Unidad Irapuato. Irapuato, Guanajuato. C.P. 36500. México.
3 Instituto de Ciencias Agropecuarias y Rurales (ICAR), UAEMEX. Toluca, Estado de México. C.P. 50200. México.
4 Universidad Autónoma Chapingo. Texcoco, Estado de México. C.P. 56230.
5 Facultad de Ciencias, UAEMEX. Toluca, Estado de México. C.P. 50200. México.
Address Correspondence to: Martín Rubí, e-mail: mrubia@uaemex.mx. Tel.: 052-7222965518, ext.127. Mm
Recibido / Received 2.VI.2011.
Aceptado / Accepted 15.VII.2011.
Resumen. Lilium es una especie ornamental cuya producción y comercialización adquiere mayor importancia económica día a día, en virtud de su aceptación en los mercados. El cultivo se ha sometido a un sistema intensivo de producción, carente de recomendaciones precisas de nutrición, basado en la utilización indiscriminada de fertilizantes químicos. Esto obliga a los productores a implementar procesos de producción sustentables sin afectar la calidad del producto, toda vez que los consumidores del mundo prefieren cada vez más productos que hayan sido cultivados correctamente. Los objetivos de este estudio fueron evaluar los efectos principales y las interacciones de la aplicación de fósforo y la inoculación con Glomus fasciculatum y Bacillus subtilis, sobre la calidad comercial de flores de Lilium híbrido oriental Showwinner. En 2008, se evaluaron 12 tratamientos en condiciones de invernadero utilizando un arreglo factorial 2x3x2, que corresponden a inoculados y no inoculados y 0, 22 y 44 µg/mL de fósforo. El tratamiento que combinó G. fasciculatum con 22 µg/mL de fósforo y B. subtilis presentó correlación positiva con peso seco de raíz, altura de la planta, diámetro del tallo, peso seco del tallo, ancho de pétalo, diámetro de la flor, peso seco de la flor, color y vida de la flor, período de floración, tasa fotosintética y concentración en los tallos de zinc (Zn), nitrógeno (N), fósforo (P), cobre (Cu) y potasio (K). Los microorganismos rizósfericos utilizados interactuaron positivamente para mejorar la calidad de la flor de Lilium sp. con una dosis intermedia de fósforo.
Palabras clave: Bacillus subtilis; Glomus fasciculatum; Fósforo; Calidad de flor; Lilium.
Abstract. Lilium is an ornamental species which production and commercialization have a greater daily economical importance because of its acceptance by the market. Crop of Lilium is currently under an intensive production system based upon an indiscriminate use of chemical fertilizers, without precise plant nutrition recommendations. Because of this, producers are forced to set up sustainable production processes without affecting the quality of the product, since worldwide consumers prefer products that have been correctly harvested. Objectives of this study were to assess the main effects and the interactions of phosphorus applications and the inoculation with Glomus fasciculatum and Bacilllus subtilis, on the commercial flower quality of Lilium oriental hybrid Showwinner. In 2008, 12 treatments were assessed in a greenhouse under a factorial arrangement 2×3×2, that corresponded to the treatments: inoculated and non-inoculated and 0, 22 and 44 µg/mL of phosphorus. The treatment that combined G. fasciculatum with 22 µg/mL of phosphorus and B. subtilis showed a positive correlation with root dry weight, plant height, stem diameter, stem dry weight, petal wide, flower diameter, flower dry weight, flower color and briskness, flowering period, photosynthetic rate and stem zinc (Zn), nitrogen (N), phosphorus (P), copper (Cu) and potassium (K) concentrations. Inoculation with the study rhizosphere microorganisms plus using an intermediate phosphorus concentration interacted positively to improve Lilium flower quality.
Keywords: Bacillus subtilis; Glomus fasciculatum; Phosphorus; Flower quality; Lilium.
INTRODUCCIÓN
En la floricultura comercial, las plantas bulbosas ocupan un lugar importante y Lilium se ubica en segundo lugar. Esto es debido a la elegancia, el encanto y la versatilidad de usos de sus flores, así como a la producción de flores de corte y plantas en maceta. En México ocupa el quinto sitio de importancia en la producción de ornamentales (Gómez, 2009).
Las especies del género Lilium están formadas por un bulbo constituido por catáfilas que almacenan reservas nutricionales. Estas catáfilas son responsables de la emergencia del brote y la emisión de raíces adventicias del tallo, lo que permite asegurar el desarrollo de la planta (Bañón et al., 1993). Sin embargo, es necesaria la aplicación de nutrimentos para asegurar la calidad de flor comercial como resultado del esquema intensivo de producción al que se hayan sometido. En Lilium existen pocos estudios de nutrición (Betancourt et al., 2005), y los máximos niveles de producción están respaldados por el uso intensivo y excesivo de fertilizantes químicos (Ortega et al., 2006; Álvarez et al., 2008). La producción de esta especie se ubica en las zonas aledañas al eje neo-volcánico, con predominancia de suelos andosol (Sotelo et al., 2011). En estos suelos, el fósforo tiene una capacidad elevada de adsorberse y fijarse, y erróneamente los productores lo subsanan con elevadas aplicaciones. Esta forma de producción ha provocado una acentuada degradación física, química y biológica de los suelos, contaminado el ambiente y los mantos freáticos, y convirtiéndose en una seria amenaza por su alto grado de toxicidad (Cardoso y Kuyper, 2006).
El incremento en el uso de fertilizantes en la producción de ornamentales ha sido acompañado por un aumento en el consumo de formas no renovables de energía; la producción industrial de fertilizantes no podrá satisfacer las necesidades de una población mundial en aumento (Atkinson et al., 2005; Chang et al., 2010). En este sentido los biofertilizantes son un componente vital de los sistemas sustentables, al constituir un medio económicamente atractivo y ecológicamente aceptable de reducir los insumos externos para mejorar la cantidad y calidad de los recursos internos (Bhromsiri y Bhromsiri, 2010).
Se presenta un modelo que combina Bacillus subtilis-Glomus fasciculatum-fósforo. El objetivo principal fue estudiar sus efectos individuales, las interacciones entre los tres factores y sus interrelaciones sobre las variables de crecimiento y calidad de flor en Lilium. Con esta finalidad, se siguió la evaluación e interpretación de la técnica multivariada descripta por Sánchez (1995), y aplicada por Rubí et al. (2009) y González et al. (2010). Los resultados permiten dar a conocer alternativas nutricionales a los agricultores para el desarrollo del cultivo, sin grandes costos económicos ni ambientales.
MATERIALES Y MÉTODOS
El estudio se desarrolló en invernadero de mayo a octubre de 2008, en el municipio de Coatepec Harinas, Estado de México, México (2169 m.s.n.m.; 18° 54' 26'' N, 99° 47' 03' O). La temperatura promedio fue de 36 °C en el día y 11 °C durante la noche.
Se plantaron bulbos vernalizados, en contenedores de plástico importados de Holanda, calibre 16/18 de Lilium, híbrido oriental Showwinner, lavados y desinfectados previamente con Cloramina T al 2% durante 5 min y enjuagados con agua estéril. Como sustrato se utilizó una mezcla 1:1 de suelo con arena de río, esterilizado a una presión de 120 kg/cm2 por una hora en tres días consecutivos, pH = 5,9; 2,1% de materia orgánica y 18,4 mg/mL de P.
La inoculación micorrízica se realizó al plantar el bulbo. Se utilizaron 100 g de inóculo constituido de un suelo limoso con 73 esporas/g de Glomus fasciculatum, y fragmentos de raíz con 50% de colonización. En cada contenedor se colocaron 250 g de sustrato y se aplicaron 50 g de inóculo. El bulbo, al cual se le retiraron las raíces primarias para evitar la presencia de hongos micorrízicos nativos, se plantó a 10 cm de la superficie y se cubrió con 500 g de sustrato; el resto del inóculo se depositó en el nivel en que se produce el sistema radical secundario, finalmente se adicionaron 250 g del sustrato. La rizobacteria se aplicó 30 días después de la plantación utilizando 1 mL de una suspensión con 1x107 ufc*mL de B. subtilis BEB-lSbs (BS-13) (absorbancia 0,1 a 535 nm) por contenedor, donada por el Laboratorio de Bioquímica Ecológica del CINVESTAV IPN, Unidad Irapuato, que ha demostrado inducir el desarrollo de la planta (Cárdenas et al., 2007; Rubí et al., 2009). Las plantas fueron regadas con 100 mL de agua destilada cada cuatro días a partir de la plantación y fertilizadas semanalmente con 200 mL por maceta de la solución nutritiva Long Ashton (LANS), la cual se ajustó al nivel de fósforo definido por el tratamiento (Hewitt, 1966).
Los 12 tratamientos (combinación de cada nivel de los tres factores en estudio) fueron evaluados en un diseño experimental completamente al azar, con arreglo factorial 2x2x3; en el factor A se consideraron plantas con y sin G. fasciculatum, en el factor B se incluyeron plantas con y sin B. subtilis y en el factor C se evaluaron tres niveles de fósforo en LANS (0, 22 y 44 µg/mL). Para altura de planta y diámetro del tallo se utilizaron 10 unidades experimentales por tratamiento y cada contenedor con una planta fue una unidad experimental.
Las variables evaluadas incluyeron altura de planta (cm), diámetro de tallo (mm), días a antesis (siete repeticiones), período de floración (10 repeticiones), vida de la flor (15 repeticiones), diámetro de la flor en cm (10 repeticiones) y ancho de pétalo en cm (30 repeticiones). La colonización de raíz por G. fasciculatum se determinó en porcentaje en una muestra de raíces constituida por tres unidades experimentales por tratamiento siguiendo el método de Phillips y Hayman (1970). Al mismo tiempo, la colonización radical por B. subtilis Beb-13 se cuantificó al final del experimento por el método de dilución decimal de vaciado en placa y se expresó en unidades formadoras de colonias (ufc/g de suelo). Para ello, antes del estudio, se realizó una suspensión del sustrato que se calentó 20 min a 70 °C. Se realizaron diluciones decimales seriadas, se sembraron en un medio papa dextrosa agar y se incubó a 37 °C durante 48 h. Después de esto se verificó la no existencia de colonias productoras de pigmento negro, el cual es característico de la cepa B. Subtilis Beb-13. Al final del estudio se cuantificó B. Subtilis Beb-13, de la misma manera que el sustrato, para lo cual se muestreó suelo de la rizósfera, realizándose diluciones decimales seriadas hasta 10-7; se sembraron por la técnica de dispersión en la superficie en cajas de petri, que contenían papa dextrosa agar y se incubaron a 37 °C por 48 h para cuantificar las ufc posteriormente.
Se determinó la concentración en ppm de P, K, Ca, Mg, Fe, Cu, Zn, Mn y B en la parte aérea vegetativa (Alcántar y Sandoval, 1999); la de N se determinó con el método micro Kjeldahl. Para este grupo de variables se utilizaron tres repeticiones por tratamiento. Con un espectrofotómetro de esfera X-Rite, modelo SP 62 se obtuvieron los valores de tres repeticiones por tratamiento de cromatividad (c) y ángulo Hue o matiz (h) para determinar el color de la flor (Kabelka et al., 2004). La tasa fotosintética, estimada en tres repeticiones y en tres unidades experimentales por tratamiento, se registró en µmol/m2 s con el sistema portátil (SPF) LI-6400 (LI-COR) a los 115 días de la plantación de 10 am a 12 pm. A los 170 días de plantado el bulbo, después de secarse a 75 °C por 72 horas en un horno de circulación forzada (Ríos Rocha, Mod. HSCF), se determinaron los pesos secos en g de raíz, parte aérea vegetativa y flores, empleando siete repeticiones por tratamiento.
Los datos se sometieron a un análisis de varianza y a la comparación de medias de tratamientos con la prueba de la diferencia mínima significativa (DMS) al nivel de significancia del 5%. Los datos de colonización (%) se transformaron a ![]() y los de macroelementos a ppm. Además se usó el análisis de componentes principales (ACP), descripto por Sánchez (1995) y aplicado por González et al. (2010). Esta metodología multivariada permite la inspección de una matriz de datos para el cálculo de varianzas y correlaciones aproximadas; los tratamientos se asignan a las hileras y las variables a las columnas. En una gráfica del biplot se representó simultáneamente, en no más de dos dimensiones, el mayor porcentaje de la variación de los datos originales, para determinar visualmente si existieron patrones entre los tratamientos como resultado de los valores de las variables; qué variables separaron los grupos definidos y qué relación existió entre las variables. El ACP se obtuvo con el programa desarrollado por Sánchez (1995), escrito en el lenguaje matricial del Sistema de Análisis Estadístico (SAS/IML) y la gráfica del biplot se generó con el programa Excel (González et al., 2010).
y los de macroelementos a ppm. Además se usó el análisis de componentes principales (ACP), descripto por Sánchez (1995) y aplicado por González et al. (2010). Esta metodología multivariada permite la inspección de una matriz de datos para el cálculo de varianzas y correlaciones aproximadas; los tratamientos se asignan a las hileras y las variables a las columnas. En una gráfica del biplot se representó simultáneamente, en no más de dos dimensiones, el mayor porcentaje de la variación de los datos originales, para determinar visualmente si existieron patrones entre los tratamientos como resultado de los valores de las variables; qué variables separaron los grupos definidos y qué relación existió entre las variables. El ACP se obtuvo con el programa desarrollado por Sánchez (1995), escrito en el lenguaje matricial del Sistema de Análisis Estadístico (SAS/IML) y la gráfica del biplot se generó con el programa Excel (González et al., 2010).
RESULTADOS
Glomus fasciculatum favoreció significativamente el crecimiento de la planta al ejercer un efecto positivo sobre su altura (AP) y diámetro del tallo (DT), que se reflejó en un aumento del peso seco de la parte aérea vegetativa (PT) de las plantas inoculadas superior al 15% con respecto a las no inoculadas (Tabla 1). En B. subtilis el peso seco de la parte aérea vegetativa de las plantas inoculadas superó casi en 9% al de las no inoculadas (Tabla 2). En peso seco de raíz (PR) también se detectó un efecto significativo para ambos inóculos: las plantas inoculadas con G. fasciculatum y B. subtilis superaron en 19 y 11%, respectivamente, a las no inoculadas. Los efectos del fósforo fueron significativos en AP, DT, PT y PR en dosis de 22 µg/mL (Tabla 3).
Tabla 1. Efecto de Glomus fasciculatum (Factor A) sobre las variables evaluadas.
Table 1. Effect of Glomus fasciculatum (Factor A) on study variables.

Continuación Tabla 1. Efecto de Glomus fasciculatum (Factor A) sobre las variables evaluadas.
Continuation Table 1. Effect of Glomus fasciculatum (Factor A) on study traits.

Tabla 2. Efecto de Bacillus subtilis (Factor B) sobre las variables evaluadas.
Table 2. Effect of Bacillus subtilis (Factor B) on study traits.

Continuación Tabla 2. Efecto de Bacillus subtilis (Factor B) sobre las variables evaluadas.
Continuation Table 2. Effect of Bacillus subtilis (Factor B) on study traits.

Tabla 3. Efecto del fósforo (Factor C) sobre las variables evaluadas.
Table 3. Effect of phosphorus (Factor C) on study traits.

Continuación Tabla 3. Efecto del fósforo (Factor C) sobre las variables evaluadas.
Continuation Table 3. Effect of phosphorus (Factor C) on study traits.
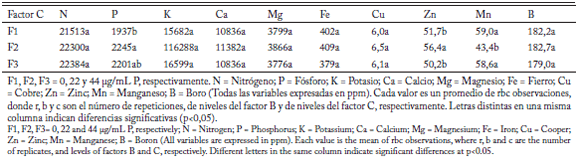
Ambos microorganismos afectaron significativamente los siguientes parámetros: ancho de pétalo (PE), diámetro de la flor (DF), peso seco de la flor (PF), color de la flor (CH) y vida de la flor (VF) (Tablas 1 y 2). Estas variables también se vieron afectadas significativamente por el fósforo en dosis de 22 µg/mL (Tabla 3).
Glomus fasciculatum afectó significativamente las concentraciones de K, Ca, Fe, Mn y B, del tallo pero B. subtilis no mostró significancia para los elementos analizados (Tablas 1 y 2 continuación). La dosis de 22 µg/mL de fósforo presentó significancia estadística para P y Zn (Tabla 3).
Las plantas inoculadas con G. fasciculatum tuvieron un mayor porcentaje de colonización (C G fs, 41,8%) que aquellas sin inocular (S G fs, 0%). Las dosis de 0 y 22 µg/mL de fósforo tuvieron un porcentaje de infección similar (22 y 24%, respectivamente), pero superaron significativamente a la de 44 µg/mL (17%) (Tablas 1 y 3). La inoculación con B. subtilis (23,7%) superó estadísticamente al control (18%) (Tabla 2).
Las plantas inoculadas con G. fasciculatum presentaron una tasa fotosintética 13,5% mayor que las no inoculadas. Las dosis de 0 y 22 µg/mL de P, con valores de 7,6 y 8,2 µmol/m2 s de fijación neta de carbono resultaron estadísticamente iguales pero superaron significativamente a la de 44 µg/mL (6,3 µmol/m2s). Las inoculadas con B. subtilis presentaron una tasa fotosintética 16,1% superior a las no inoculadas.
Análisis de componentes principales. Esta metodología multivariada explicó el 63,9% de la variación original en los componentes principales 1 (44,7%) y 2 (19,2%). Los tratamientos T8 (sin G. fasciculatum, 00 µg/mL P, sin B. subtilis) y T3 (G. fasciculatum, 22 µg/mL de P, con B. subtilis) con valores negativos y positivos, respectivamente, explicaron la mayor variabilidad asociada al CP1. La variabilidad representada en el CP2 se asoció negativamente con T5 (G. fasciculatum, 44 µg/mL de P, con B. subtilis), y positivamente con T7 (sin G. fasciculatum, 00 µg/mL de P, con B. subtilis) y T9 (sin G. fasciculatum, 22 µg/mL de P, con B. subtilis) (Fig. 1).

Fig. 1. Interrelación entre los 12 tratamientos asociados a la aplicación de G. fasciculatum, fósforo y B. subtilis y las 25 variables registradas en Lilium cv Showwinner.
Fig. 1. Interrelationship among 12 treatments associated with the application of G. fasciculatum, phosphorus and B. subtilis in relation to 25 study traits in Lilium sp. cv Showwinner.
En el biplot también se detectó correlación positiva entre vida de la flor (VF), ancho de pétalo (PE), diámetro de la flor (DF), peso seco de la flor (PF), peso seco de raíz (PR), peso seco del tallo (PT), altura de la planta (AP), diámetro del tallo (DT), tasa fotosintética (TF), color de la flor ángulo hue (CH) y N y Zn, con valores positivos en los CP1 y CP2. Mn, B, Fe, Ca y Mg, con correlaciones positivas, presentaron valores negativos en la CP1 y positivos en la CP2. En ambas coordenadas negativas de los CP1 y CP2 sólo se identificó a días a antesis (AN). Colonización en raíz por G. fasciculatum (CM), relación peso seco de raíz/peso seco de la parte aérea vegetativa (RT), P, Cu y K con correlaciones positivas, tuvieron coordenadas positivas en el CP1 y negativas en el CP2 (Fig. 1).
El tratamiento T3 (G. fasciculatum, 22 µg/mL de P, con B. subtilis) mostró correlación positiva con la mayoría de las variables y con T4 (G. fasciculatum, 22 µg/mL de P, sin B. subtilis) y T2 (G. fasciculatum, 00 µg/mL de P, sin B. subtilis), los cuales interaccionaron positivamente con la colonización en raíz por G. fasciculatum (CM), relación peso seco de la raíz/ peso seco de la parte aérea vegetativa (RT) y P, Cu y K. Los tratamientos T7 (sin G. fasciculatum, 00 µg/mL de P, con B. subtilis), T8, T11 y T12 se correlacionaron positivamente con Mn, B, Fe, Ca y Mg. También hubo correlación positiva entre T10 (sin G. fasciculatum, 22 µg/mL de P, sin B. subtilis) y T6 (G. fasciculatum, 44 µg/mL de P, sin B. subtilis) con AN.
DISCUSIÓN
La promoción del crecimiento en Lilium originada por G. fasciculatum coincide con los resultados de Anushri et al. (2002) y Rubí et al. (2009), quienes señalaron que los hongos MA favorecen el crecimiento en Lilium sp. El mayor peso seco de raíz observado en las plantas inoculadas con G. fasciculatum podría estar relacionado con el incremento de peso seco que los hongos MA provocan en el sistema radical de las plantas. Esta respuesta, sumada al abundante micelio intra y extraradical que desarrollan las MA, establece un enlace entre el suelo y las plantas donde actúan como una extensión de la superficie radical, y favorece los procesos de absorción y movilización de agua, nutrientes y reguladores del crecimiento (Ferrol et al., 2002; Marulanda et al., 2009). Efectos similares en la promoción del crecimiento de la planta por la misma cepa de B. subtilis han sido reportados por Cárdenas et al. (2007) en Tagetes erecta, quienes lo atribuyeron a la participación de esta rizobacteria en la síntesis de auxinas y secreción de pequeños péptidos de actividad deaminasa ACC (Jimenéz, 2004). Resultados afines también fueron obtenidos en crisantemo (Chrysanthemum spp.) con Bacillus spp. (Doung, 2005) y azafrán (Crocus sativus) (Sharaf et al., 2008). Estos autores coinciden en señalar que el mecanismo de estimulación del crecimiento no es del todo conocido, pero diferentes especies de Bacillus participan en la producción de ácido giberélico, ácido indol 3 acético y citocininas, que pueden ser los agentes estimulantes del crecimiento observado, además de su capacidad para solubilizar fosfato (Aslantas et al., 2007; Bhromsiri y Bhromsiri, 2010).
Aunque la mejora en el crecimiento es importante, la calidad de la flor en Lilium impacta directamente en el valor del precio de venta. De esta manera, ancho de pétalo (PE), diámetro de flor (DF), peso seco de flor (PF), vida de flor (VF) y color de flor (CH) resultan fundamentales para incrementar los ingresos de los floricultores.
La coinoculación con G. fasciculatum y B. subtilis estimuló todos los indicadores de calidad de la flor de Lilium; T3 fue el mejor tratamiento (G. fasciculatum, 22 mg/mL de P, con B. subtilis), seguido de T4 (G. fasciculatum, 22 mg/mL de P, sin B. subtilis) y T2 (G. fasciculatum, 00 mg/mL de P, sin B. subtilis) que permitieron la mejor expresión de 19 de las 25 variables evaluadas. Ancho de pétalo (PE), diámetro (DF), peso seco (PF), vida (VF) y color de la flor (CH) y período de floración (F) están vinculadas a una mejor calidad comercial; la apariencia es el medio para juzgar la calidad de un producto (Olalde y Mena, 2009); ésta está caracterizada principalmente por ausencia de defectos, mayor tamaño y mejor apariencia en forma y color. En el presente estudio un mayor peso seco de la flor reflejó un mayor tamaño de este órgano, respaldado por los mayores valores de (PE) y (DF). Esto, sumado a la mayor intensidad en el color (mayores valores del ángulo hue) atribuible a una mayor concentración de antocianinas (Schwinn y Davies, 2004) también se reflejó en flores con pigmentación más intensa, y con mayores oportunidades de ingresar a mercados más exigentes, donde los consumidores demandan flores prácticamente perfectas. Una mayor vida de la flor implica más días con flores con condiciones aceptables para su comercialización. El incremento en el período de floración señala mayor tiempo en que las plantas florecen, por lo que también es un parámetro de significativo valor en la producción y comercialización de Lilium sp. Estos resultados concuerdan con los de Cárdenas et al. (2007) en T. erecta. Estos autores detectaron mejoras significativas en la calidad de la flor lo que se puede explicar por las estrechas correlaciones que se observaron entre las variables señaladas en nuestro estudio con el peso seco de la raíz. Este último indica una mayor superficie de absorción la cual puede atribuirse a la presencia de los microorganismos en estudio. Zaidi y Khan (2006) y Javot et al. (2007) coincidieron en señalar que la micorrización amplía el sistema de absorción de las plantas e incrementa la absorción de las raíces, por lo que es un importante mecanismo para maximizar el uso sustentable de los fertilizantes fosfatados. La rizobacteria también favorece la actividad micorrizica, dado que si el fosfato liberado por la bacteria es tomado por el micelio micorrizico puede resultar sinergismo cooperativo que mejora la adquisición de fósforo por la planta (Toljander et al., 2007). La participación de elementos como Zn, Cu, N y K resultaron fundamentales en los efectos observados en el presente estudio como lo demuestra su ubicación en el biplot de la Figura 1, y en cuya absorción las MA juegan un papel preponderante (Cavagnaro, 2008; Atul-Nayyar et al., 2009). Además, el peso seco del tallo contribuyó a que la altura de la planta y el diámetro del tallo estuvieron estrechamente relacionados entre sí y con el tratamiento T3. Estas correlaciones también sugieren una mejora en la tasa fotosintética, lo cual concuerda con lo indicado por Aboul (1996): una mayor altura de la planta muy probablemente reflejó una mayor superficie foliar, como consecuencia del aporte mineral y hormonal de los endófitos, o bien a un incremento de clorofila. Zaidi y Khan (2006) reportaron incrementos superiores al 50% de este compuesto en una leguminosa conocida como mungo debido a la combinación de G. fasciculatum con B. subtilis. También se observó una mayor colonización por G. fasciculatum en presencia de B. subtilis, que indica un efecto de sinergismo.
La estrecha correlación entre Zn con las variables del crecimiento y de la calidad de la flor y con los mejores tratamientos (3 y 4) puede atribuirse a (1) la afinidad que presentan las MA para absorberlo (Cavagnaro, 2008), y (2) que este elemento es un componente esencial de casi 300 enzimas. El Zn juega papeles catalíticos, co-catalíticos o estructurales en muchas enzimas de las plantas como anhidrasas, isomerasas, deshidrogenasas, aldolasas, fosfotransferasas, carboxilasas y ribonucleasas, por lo que tiene una significativa participación en la respiración y en el metabolismo de los carbohidratos. La aldosa regula la transferencia de fotosintatos C3 del cloroplasto al citoplasma, y la fructosa 1,6 bifosfatasa, enzima clave en la participación de azúcares de C6 en el cloroplasto y citoplasma, interviene en el control hormonal. Esto se debe a que esta última enzima ejerce una influencia positiva en la formación de auxinas y en la síntesis de la clorofila y de proteínas debido a su función como componente estructural de los ribosomas y participación en su estabilidad. El Zn juega un papel crítico en el desarrollo reproductivo de las plantas, prevención del estrés hídrico y protección contra efectos tóxicos de especies reactivas al oxígeno (ROS) al cumplir con importantes funciones antioxidantes. Este nutriente protege a las plantas del daño oxidativo al reducir la acelerada producción de ROS, al inhibir la actividad de la NADPH oxidasa que cataliza la producción de iones superóxido, y por su rápida detoxificación. Asimismo, es un constituyente de las zinc-metaloenzimas, y juega un importante papel en el mantenimiento de la integridad estructural de biomembranas (Sharma, 2006; Cavagnaro, 2008).
El N es un elemento esencial de los aminoácidos, los cuales forman los péptidos y las proteínas, además de tener importancia relevante en la síntesis enzimática y en todo el metabolismo. El N se encuentra también en las purinas y las pirimidinas de los ácidos nucleicos, esenciales para la síntesis de proteínas, así como en las porfirinas de las clorofilas y en los fitocromos que son esenciales para la fotosíntesis y la respiración, así como en coenzimas, nucleótidos, amidas y ureidos (Chang et al., 2010; Fageria, 2010). Las hifas de la micorriza pueden transportar nitrógeno del suelo a las raíces, por lo que la participación de éstas en la absorción de N es un hecho (Azcón et al., 2008; Atul-Nayyar et al., 2009): esto podría explicar la posición de este elemento en el biplot de la Figura 1.
El P forma parte de los ácidos nucleicos y participa en la síntesis de proteínas, es constituyente del ATP y de muchas coenzimas (NAD y FAD) indispensables en muchas reacciones redox. Éste interviene en todos los procesos metabólicos de transferencia de energía. Se localiza, entre muchos otros compuestos, en los fosfolípidos que participan activamente en la formación de las membranas, tanto a nivel de mitocondrias y cloroplastos, como de plasmalema y otros organelos. Se encuentra además como constituyente de nucleoproteínas y participa también en la división celular y en la transferencia de las características hereditarias por los cromosomas, como constituyente del ADN y del ARN. Se presenta en otros compuestos "ricos en energía" como guanina trifosfato (GTP), uridina trifosfato (UTP) y citocina trifosfato (CTP) que unen procesos endergónicos a procesos exergónicos (intercambio de energía). La fotosíntesis, la glucólisis, el ciclo de Krebs, la b-oxidación, la oxidación directa de la glucosa y la descomposición de los carbohidratos son procesos que involucran reacciones de fosforilación (Fageria, 2010). Lo anterior justifica la participación de este elemento en los resultados obtenidos, dado que es el elemento principalmente relacionado con los microorganismos utilizados (Scagel y Schreiner, 2006; Artursson et al., 2006; Javot et al., 2007).
El Cu es constituyente de la plastocianina, que funciona como un transportador móvil de electrones, ligando el fotosistema II al fotosistema I, y participa en el transporte no cíclico de electrones del agua al NADP. La plastocianina acepta electrones del complejo del citocromo b6f y dona estos al PSI, los cuales son transferidos a la ferredoxina, habilitándola para funcionar como un fuerte reductante, capaz de reducir el NADP+. Además, se involucra en el transporte cíclico de electrones asociados con el PSI mediando la producción de ATPasa, y favorece el movimiento de las moléculas de plastoquinona durante el transporte de electrones en el PSII (Sharma, 2006).
La relación estrecha entre K con las variables de calidad de flor (Fig. 1), pone de manifiesto la participación de los microorganismos utilizados en la absorción de este elemento (Bhromsiri y Bhromsiri, 2010). El K es un activador de enzimas y osmoregulador; este nutriente (1) es indispensable en la fotosíntesis debido a que la fosforilación fotosintética como la oxidativa en la respiración lo requieren para realizarse, (2) promueve una eficiente movilización de fotosintatos desde las hojas, (3) favorece la liberación de las proteínas sintetizadas por los ribosomas, (4) facilita la unión del ARNm con el ribosoma, y (5) es esencial para el uso eficiente del N. El NO3 es tomado por las raíces de las plantas vía un proceso activo y su absorción puede ser afectada por la influencia del K en la movilización de fotosintatos necesarios para apoyar dicho proceso: esto contribuiría a explicar la relación que presenta con Cu y P (Fig. 1). Sin embargo, el K tiene efectos antagonistas en la absorción de Ca, Mg y B; en altas concentraciones, puede disminuir la absorción de otros iones (Chang et al., 2010). La disminución en la absorción de Ca cuando se incrementa la concentración de K puede estar relacionada con la competencia entre ambos iones: esto contribuiría a explicar la ubicación del Ca en el biplot que refleja una relación importante con las variables de calidad de flor. El efecto depresivo de K en la absorción de Mg a altas concentraciones puede ser interpretado como un resultado de la competencia por los compuestos metabólicos producidos, donde una reducción en la movilización de las raíces al tallo parece ser la fuente del antagonismo K/ Mg (Fig. 1).
La correlación significativa entre Zn y N (Fig. 1) puede atribuirse a que al favorecer el N el crecimiento de la planta, se incremente la demanda por Zn. Además, ambos son importantes en la síntesis de auxinas; el triptófano, precursor de las auxinas indólicas, se forma a partir del N y el Zn. Estos nutrientes resultan por lo tanto indispensables en las reacciones enzimáticas que dan lugar al triptófano; una deficiencia en este elemento resulta en una baja formación del precursor de auxinas y en menor crecimiento (Fageria, 2010).
La mayor interacción entre P y Zn ocurre a nivel metabólico de la planta (Cardoso y Kuyper, 2006). Gran parte del Zn, en los tejidos de las plantas, es almacenado en complejos fitato-proteinas Zn, para su posterior removilización en el interior de la planta. Se ha especulado que una vez que el P se ha incorporado al citosol, después de lo cual el fósforo que es requerido para mantener las funciones celulares es transportado al interior de la vacuola del hongo (donde se sintetiza polifosfato), el Zn tiene el potencial para actuar como un contador de iones polifosfato lo que contribuye a mantener el balance de cargas en la vacuola. También se ha documentado un incremento en la absorción de Zn en el suelo en respuesta a la fertilización fosfatada; se sugiere que la absorción de P en las superficies de los óxidos de Fe y Al incrementa las cargas negativas en ellos. Esto resulta finalmente en un aumento en la absorción de Zn, fenómeno que puede explicarse en el presente trabajo (Fig. 1), gracias a la participación de B. subtilis. Bacillus subtilis pudo incrementar la concentración de P en el suelo (Artursson, 2006), y G. fasciculatum mejoró la absorción de Zn (Cavagnaro, 2008).
La relación Zn/Cu se basa en que ambos son componentes esenciales y activadores de numerosas enzimas, como la Zn/Cu superóxido dismutasa la cual contrarresta el daño de las especies reactivas de oxígeno (ROS) (Sharma, 2006). Esto podría explicar su correlación positiva con la tasa fotosintética y con las variables de crecimiento y calidad de flor que se observan en la Figura 1.
El N favorece la absorción de P por las plantas al incrementar el crecimiento de la raíz y aumentar su capacidad para absorber y movilizar P. Además, se reduce el pH del suelo como resultado de la absorción de NH4+ e incremento de la solubilidad de fertilizantes fosfatados (Fageria, 2010), actividad a la que puede sumarse la participación de B. subtilis (Aslantas et al., 2009). El incremento en crecimiento requiere de N y P, basado en la inferencia de un efecto de sinergismo mutualista que originó la estimulación del crecimiento y el mejoramiento de la absorción de ambos elementos.
Nuestros resultados concuerdan con los obtenidos por Rubí et al. (2009) e incrementan las evidencias de la importancia de considerar nutrientes como Zn y Cu, además de N, P y K, y avalan los efectos de la biofertilización en la producción del Lilium, que se traduce en un mejor estado nutricional de la planta y mejor calidad de la flor.
La inoculación con G. fasciculatum y B. subtilis con 22 µg/ mL de P (T3) produjo flores de mayor calidad, en comparación con el control (T8) y contribuyó a un óptimo crecimiento de las plantas; esto reduciría el uso de fertilizantes químicos y disminuiría los problemas de contaminación ambiental en esta región de México.
En este sentido, al tratarse de un endófito, la estimulación de los diferentes órganos del vegetal tiende a producir un marcado efecto benéfico en la asociación planta-microorganismo. Esto se debe a que un aumento en la superficie foliar asimiladora y en los órganos de transporte de agua y nutrientes, generalmente se traduce en una mayor cantidad de fotosintatos en el sistema. Esto a su vez constituye la reserva energética para la multiplicación y el normal funcionamiento solubilizador de P y estimulador del crecimiento de B. subtilis.
Por otra parte, el macrosimbionte desencadena el conjunto de mecanismos fisiológico-bioquímicos involucrados en la división celular, la estimulación del crecimiento vegetal y el mejoramiento de la calidad de la flor, al recibir por parte del microorganismo los niveles de P y fitoreguladores (auxinas, giberelinas y citocininas) adecuados.
La coinoculación G. fasciculatum-B. subtilis con la aplicación de 22 µg/mL de P mejoró el vigor de la planta, la absorción de nutrientes y la calidad de la flor en Lilium en suelo esterilizado, siendo más efectiva que las inoculaciones simples. Este resultado puede considerarse de interés para futuras investigaciones en Lilium, en otras bulbosas e incluso en otras ornamentales, como una alternativa para reducir el uso de fertilizantes fosfatados, que actualmente ha causado serios problemas.
AGRADECIMIENTOS
Al personal de los laboratorios de Bioquímica Ecológica del CINVESTAV del IPN Unidad Irapuato y de Nutrición Vegetal del ICAR de la UAEMEX.
REFERENCIAS
1. Aboul, N.A. (1996). Effects of vesicular-arbuscular mycorrhiza on Tagetes erecta and Zinnia elegans. Mycorrhiza 6: 61-64. [ Links ]
2. Alcántar, G.G. y M.V. Sandoval (1999). Manual de análisis químico de tejido vegetal. Sociedad Mexicana de la Ciencia del Suelo, A. C. Publicación Especial 10. Chapingo, México.156 p. [ Links ]
3. Álvarez, S.M.E., R.T. Maldonado, R.M. García, G.V. Almaguer, J.A. Rupit y F.E. Zavala (2008). Suministro de Calcio en el desarrollo y nutrición de Lilium asiático. Agrociencia 42: 881-889. [ Links ]
4. Anushri, V.M., P. Sharma, A. Adholeya, V. Dhawan y P.S. Srivastava (2002). Enhanced growth of micropropagated bulblets of Lilium sp. inoculated with arbuscular mycorrhizal fungi at different P fertility levels in an alfisol. Journal of Horticultural Science and Technology 77: 258-263. [ Links ]
5. Artursson, V., R.D. Finlay y J.K. Jansson (2006). Interaction between arbuscular mycorrhizal fungi and bacteria and their potential for stimulating plant growth. Environmental Microbiology 8: 1-10. [ Links ]
6. Aslantas, R., C. Ramazan y S. Fikrettin (2007). Effect of plant growth promoting rhizobacteria on young apple tree growth and fruit yield under orchard conditions. Scientia Horticulturae 111: 371-377. [ Links ]
7. Atkinson, D., K.E. Black, L.A. Dawson, Z, Dunziger, C.A. Watson y S.A. Wilson (2005). Prospects, advantages and limitations of future crop production systems dependent upon the management of soil processes. Annals of Applied Biology 146: 203-215. [ Links ]
8. Atul, N.A., Hamel, C., Hanson, K. y J. Germida (2009). The arbuscular mycorrhizal simbiosis links N mineralization to plant demand. Mycorrhiza 19: 239-246. [ Links ]
9. Azcón, R., R. Rodríguez, E.L. Amora y E. Ambrosano (2008). Uptake and metabolism of nitrate of mycorrhiza plants as affected by water availability and N concentration in soil. European Journal and Soil Science 59: 131-138. [ Links ]
10. Bañón, A.S., R.D. Cifuentes, B.G. González y H.I. Fernández (1993). Lilium. En: pp. 71-158. Gerbera, Lilium, Tulipán y Rosa. Segunda edición. Ediciones Mundi Prensa. Madrid, España. 412 p. [ Links ]
11. Betancourt, O.M., M.N.M. Rodríguez, M.V. Sandoval y E.A. Gaytan (2005). Fertilización foliar, una herramienta en el desarrollo del cultivo de Lilium cv. Stargeizer. Revista Chapingo Serie Horticultura 11: 371-378. [ Links ]
12. Bhromsiri, C. y A. Bhromsiri (2010). The effect of plant growth-promoting rhizobacteria and arbuscular mycorhizal fungi on the growth, development and nutrient uptake on different vetiver ecotypes. Thai Journal of Agricultural Science 43: 239-249. [ Links ]
13. Cárdenas, F.A., A.L. Estrada y V.P. Olalde (2007). Yield and quality enhancement of marigold flower by inoculation with Bacillus subtilis and Glomus fasciculatum. Journal of Sustentability Agriculture 31: 21-31. [ Links ]
14. Cardoso, I.M. y T.W. Kuyper, (2006). Mycorrhizas and tropical soil fertility. Agricultural Ecosystem Environment 116: 72-84. [ Links ]
15. Cavagnaro, R.T. (2008). The role of arbuscular mycorrhizas in improving plant zinc nutrition under low soil zinc concentrations: a review. Plant Soil 304: 315-325. [ Links ]
16. Chang, K.H., Y.W. Rung, Ch.Ch. Keng, F.H. Ting, y S.Ch. Ren (2010). Effects of chemical and organic fertilizer on the growth, flower quality and nutrient uptake of Anthurium andreanum, cultivated for cut flower production. Scientia Horticulturae 125: 434- 441. [ Links ]
17. Doung, T.N. (2005). Positive effects of Bacillus spp. on the growth of Chrisanthemum spp. in vitro and ex vitro. Propagation of Ornamental Plants 5: 146-150. [ Links ]
18. Fageria, N.K. (2010). Use of nutrient in crops plants. CRC Press. Taylor and Francis Group. USA. 448 p. [ Links ]
19. Ferrol, N., J.M. Barea y C. Azcón-Aguilar (2002). Mechanism of nutrient transport across interfaces in arbuscular mycorrhizas. Plant and Soil 244: 231-237. [ Links ]
20. Gómez, G.A.A. (2009). La situación de las flores de corte mexicanas dentro de la política comercial internacional de México. TECSISTECATL 2: 1-30. [ Links ]
21. González, A., D.J. Pérez., J.C. Sahagún, O. Franco, E.J. Morales, M. Rubí, F. Gutiérrez y A. Balbuena (2010). Aplicación y comparación de métodos univariados para evaluar la estabilidad de maíces del Valle de Toluca-Atlacomulco, México. Agronomía Costarricense 34: 129-143. [ Links ]
22. Hewitt, E.J. (1966). Sand and water culture methods used in the study of plant nutrition. Commonwealth Agricultural Bureaux of Horticulture. Technical Communication. [ Links ]
23. Javot, H., N. Pumplin y M.J. Harrison (2007). Phosphate in the arbuscular mycorrhizal symbiosis: transport properties and regulatory roles. Plant Cell and Environment 30: 310-322. [ Links ]
24. Jiménez, D.R. (2004). Péptidos secretados por Bacillus subtilis que modifican la arquitectura de la raíz de Arabidopsis thaliana. Ph D Thesis. CINVESTAV- Irapuato, Guanajuato, México. 85 p. [ Links ]
25. Kabelka, E., W. Yang y D.M. Francis (2004). Improved tomato fruit color within an inbred backcross line derived from Lycopersicum esculentum and L. hirsutum involves the interaction of loci. Journal American Society for Horticultural Science 129: 250-257. [ Links ]
26. Marulanda, M., J.M. Barea y R. Azcón (2009). Stimulation of plant growth and drought tolerance by native microorganisms (AM fungi and bacteria) from dry environments: mechanism related to bacterial effectiveness. Journal Plant Growth Regulation 28: 115-124. [ Links ]
27. Olalde, P.V y V.H.G. Mena (2009). Rhizosphere microorganisms and their effect on fruit quality. En: Post harvest biology and technology of fruits, vegetables and flowers. Ed. Gopinadhan, P., Dennis, P. Murr, Avtar, K. Anda & Susan Lorie. 482 p. [ Links ]
28. Ortega, B.R., M.B. Correa y E.M. Olate (2006 ). Determinación de las curvas de acumulación de nutrientes en tres cultivares de Lilium spp. para flor de corte. Agrociencia 40:77-88. [ Links ]
29. Phillips, J.M. y S.D. Hayman (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of interaction. Transactions of the British Mycological Society 55: 158-161. [ Links ]
30. Rubí, A.M., A.H. González, A.M.G. Castillo, V.P. Olalde, B.G.R. Reyes y L.I.G. Aguilera (2009). Respuesta de Lilium sp. al fósforo y su relación con Glomus fasciculatum y Bacillus subtilis. Phyton, International Journal of Experimental Botany 78: 91-100. [ Links ]
31. Sánchez, G.J.J. (1995). El análisis biplot en clasificación. Revista Fitotecnia Mexicana 18: 188-203. [ Links ]
32. Scagel, C. F. y P.R. Schreiner (2006). Phosphorus supply alters tuber composition, flower production, and mycorrhizal responsiveness of container-grown hybrid Zantedeschia. Plant and Soil 283: 323- 337. [ Links ]
33. Schwinn, K. y M.K. Davies (2004). Flavonoids. Plant pigment and manipulation. En: Kevin D. (ed). Annual Plant Reviews 14: 92- 107. [ Links ]
34. Sharaf, E.M., S. Elkholy, J.A. Fernández, H. Junge, R. Cheetham, J. Guardiola y P. Weather (2008). Bacillus subtilis FZB24 affects flower quantity and quality of saffron (Crocus sativus L.). Planta Médica 74: 1316-1320. [ Links ]
35. Sharma, C. P. (2006). Plant micronutrients. Science Publishers. United States of América. India. 265 p. [ Links ]
36. Sotelo, R.E.D., H.A. González, B.G.M. Cruz, S.F. Moreno y C.G. Cárdenas. (2011). La clasificación FAO-WRB y los suelos del estado de México. Revista Mexicana de Ciencias Forestales 2: 3-15. [ Links ]
37. Toljander, J.F., B.D. Lindahl, L.R. Paul, M. Elfstrand y R.D. Finlay (2007). Influence of arbuscular mycorhizal mycelial exudates on soil bacterial growth and community structure. FEMS Microbiol Ecology 61: 295-304. [ Links ]
38. Zaidi, A. y S.M. Khan (2006). Co-inoculation effect of phosphate solubilizing microorganisms and Glomus fasciculatum on Green Gram-Bradyrhizobium symbiosis. Turkey Journal for Agriculture 30: 223-230. [ Links ]














