Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.81 no.1 Vicente López ene./jun. 2012
ARTÍCULOS ORIGINALES
Cambios fisiológicos en algodón transgénico inoculado con Trichoderma spp.
Physiological changes in transgenic cotton inoculated with Trichoderma spp.
Vargas-Bejarano E, V Méndez-Trujillo, JC Vázquez Angulo, D González-Mendoza, O Grimaldo Juarez
Instituto de Ciencias Agrícolas de la Universidad Autónoma de Baja California (ICA-UABC), Tel.: + 52 (686)523-00; Fax +52(686)523-02-17, Carretera a Delta s/n C.P. 21705, Ejido Nuevo León, Baja California, México.
Address Correspondence to: Daniel González Mendoza, e-mail: daniasaf@gmail.com
Recibido / Received 27.VII.2011.
Aceptado / Accepted 12.IX.2011.
Resumen. Se realizó la inoculación de plántulas transgénicas de algodón con la cepa ICA 4 de Trichoderma sp. con el objetivo de identificar su efecto en el desarrollo fisiológico de las plantas. Los resultados indicaron que plántulas de algodón transgénico inoculadas presentaron mayor desarrollo con respecto a las plantas no inoculadas. Los valores del rango de crecimiento relativo, tiempo de duplicación, altura, y número de hojas, (0,04 g/g dia; 16,88 días; 17,16 cm y 4,2, respectivamente) fueron significativamente superiores a los observados en las plantas no inoculadas (0,03 g/g dia; 24,38 días; 12,33 cm y 2,6, respectivamente). Con respecto a la arquitectura radical, las plántulas inoculadas mostraron un mayor porcentaje de raíces de 2º (46%), 3º (73%) y 4º (98%) orden con respecto a las plantas testigos. Lo anterior indica que la inoculación de Trichoderma cepa ICA 4 puede favorecer el desarrollo de la arquitectura radicular y generar un mejor aprovechamiento de nutrientes. Futuros estudios deben ser encaminados en evaluar la expresión de genes involucrados en la biosíntesis de fitohormonas que podrían estar involucrados en el desarrollo radical.
Palabras clave: Algodón transgénico; Trichoderma spp; Arquitectura de la raíz; Valle de Mexicali.
Abstract. We performed the inoculation of transgenic cotton seedlings with Trichoderma sp. strain ICA 4 to evaluate its effects on the physiological development of seedlings. Inoculated seedlings of transgenic cotton had higher development than non-inoculated seedlings. The range of values for relative growth, doubling time, height and number of leaves (0.04 g/g d; 16.88 days; 17.16 cm and 4.2, respectively) were significantly higher that those observed in non-inoculated plants (0.03 g/g day; 24.38 days; 12.33 cm and 2.6, respectively). Regarding radical architecture, inoculated seedlings with Trichoderma strain ICA 4 showed a higher percentage of roots of 2nd (46%), 3rd (73%) and 4th (98%) order with respect to control plants. This indicates that inoculation of Trichoderma strain ICA 4 can promote better nutrient use. Future studies should be designed to evaluate the expression of genes involved in the biosynthesis of plant hormones that could be involved in root development.
Keywords: Transgenic cotton; Trichoderma spp.; Root architecture; Valley of Mexicali.
INTRODUCCIÓN
El valle de Mexicali se caracteriza por ser una zona con gran actividad agrícola con una capa arable de 210930 ha. Entre los principales cultivos que son sembrados en el valle de Mexicali se encuentran, entre otros, alfalfa, trigo y algodón. En el caso de este último, en los últimos años se ha sembrado el algodón transgénico Bollgard, que expresa la endotoxina Cry1Ac. Este tipo de algodón transgénico se ha utilizado en México desde 1996 para el control del gusano rosado, el gusano tabacalero y el gusano bellotero, produciendo un incremento en el rendimiento y una disminución del uso de agroquímicos para el control de plagas (Teran-Vargas et al., 2005). El uso de esta biotecnología es una gran promesa para mejorar la producción algodonera en México y en el mundo. Sin embargo, existen estudios en donde se mencionan los riesgos potenciales del cultivo del algodón transgénico, como la generación de resistencia a insectos y efectos sobre la comunidad microbiana de la rizósfera (Bruinsma et al., 2005; Marchetti et al., 2007; Thomazoni et al., 2010). Por otro lado, estudios recientes han mostrado la presencia de efectos negativos de las plantas transgénicas sobre microorganismos benéficos como los hongos micorrízicos arbusculares (Liu, 2010). En el caso de hongos microparásitos (e.g., Trichoderma) se está estudiando su aplicación como un hongo promotor de crecimiento (HPRC) en plantas no transgénicas. Esto es debido a la capacidad de estos organismos de producir hormonas de crecimiento, favorecer la solubilización de minerales y la inducción de resistencia sistémica (de Santiago et al., 2011). Sin embargo, actualmente, no existen estudios disponibles encaminados a determinar el impacto de los HPRC, específicamente Trichoderma spp., en el desarrollo fisiológico de plantas transgénicas (e.g., algodón). Por lo tanto, el objetivo de este estudio fue evaluar el efecto de la inoculación con Trichoderma spp. en el desarrollo fisiológico de plántulas de algodón transgénico (Bollgard).
MATERIALES Y MÉTODOS
Germinación de semillas de algodón. Las semillas transgénicas de algodonero Bollgard® fueron proporcionadas por productores del sistema producto algodonero de Baja California, México. Estas semillas fueron desinfectadas superficialmente con una solución de NaOCl (Clorox) al 0,5% por 3 min seguido de cuatro lavados con agua estéril desionizada. Después de desinfectadas y lavadas, 100 semillas se colocaron individualmente en cajas de Petri estériles (100 x 20 mm) con papel de filtro húmedo, y se mantuvieron en una cámara de crecimiento (LAB LINE INSTRUMENTS Serie 798-001) a una temperatura de 35 °C, con fotoperíodo de 12-h de luz:oscuridad y 60% de humedad relativa.
Formulación del inoculante. Para la elaboración del inoculante se utilizó la cepa de Trichoderma longibrachiatum ICA 4, la cual fue previamente caracterizada molecularmente y registrada en el Genebank con clave HQ667667. Esta cepa fue proporcionada por el cepario del laboratorio de Biotecnología del Instituto de Ciencias Agrícolas de la Universidad Autónoma de Baja California. La formulación del inoculante se llevó a cabo a partir de un proceso de escalamiento que consistió en los siguientes pasos: a) inoculación de 5 mL de una suspensión de micelio y esporas (concentración aproximada de 1 x 103 esporas/ mL de agua) a frascos de 350 mL con 100 gramos de arroz estéril con 20% de humedad; b) los frascos con arroz previamente inoculados con el hongo se incubaron por siete días a 32 ± 2 °C en una cámara de crecimiento Lumistell (ICP-19) con 40% de humedad relativa; c) una vez finalizado el período de incubación previamente descrito, se procedió a mezclar 50 gramos del arroz inoculado con el hongo con 250 gramos de suelo estéril, y se le adicionó agua estéril y carbonato de calcio para obtener un suelo con 30% de humedad y pH 7,0, respectivamente. El suelo se dejó en incubación en completa oscuridad por siete días a 30 ± 2 °C, previo a su utilización como inoculante.
Inoculación de plántulas. Luego de trascurridos 15 días desde la germinación, las plántulas se inocularon adicionando 2 gramos del inoculante al sistema radical al momento del trasplante a macetas de 0,3 L que contenían una mezcla comercial de suelo para horticultura (peat moss 20% y agrolita 30%). Las plántulas se mantuvieron en una cámara de crecimiento con un rango de temperatura entre 28 y 35 °C durante el día, y entre 24 y 26 °C durante la noche. Se usó un fotoperíodo de 12-h luz:oscuridad y un 60% de humedad relativa. Las plantas establecidas en la cámara de crecimiento se sometieron a un régimen de riego diario con agua destilada y se fertilizaron semanalmente con una solución nutritiva Hoagland's. A los 30 días posteriores a la inoculación se colectaron de manera aleatoria 10 plántulas inoculadas y 10 no inoculadas, para su posterior análisis fisiológico.
Determinación de los parámetros de crecimiento. Los parámetros de crecimiento evaluados en las plántulas de algodón transgénico a los 30 días posteriores a la inoculación fueron: rango de crecimiento relativo (RCR); tiempo de duplicación (TD); altura (H); número de hojas (Ho), y arquitectura radical (número de raíces de 1º, 2º y 3º orden).
El RCR se define como el rango de incremento de la masa seca, por unidad de masa, por unidad de tiempo (g/g día), y se calculó de acuerdo a lo reportado por González-Mendoza et al. (2007):

Donde:
M0 = la masa inicial de la plántulas a los 15 días de crecimiento,
M1 = es la masa final después de 30 días de crecimiento,
t1 = días de crecimiento.
El TD fue el tiempo requerido por la planta para duplicar su crecimiento, expresado en días. Esta variable se calculó de acuerdo a lo reportado por González-Mendoza et al. (2007):

La altura de plántula se midió de la base del tallo al ápice de la hoja más joven usando una regla de 30 cm. Finalmente, la evaluación in situ de la arquitectura de la raíz se evaluó mediante el conteo del número de raíces de 1º, 2º 3º y 4º orden, utilizando un estereomicroscopio AFX-II (Nikon, Tokio).
Análisis estadístico. El experimento fue realizado completamente al azar con 10 repeticiones.
El análisis de los datos obtenidos se realizó utilizando la prueba t de Student con un nivel de significación del contraste: a = 0,05. Se utilizó el paquete estadístico Statistica AX versión 6.1.
RESULTADOS Y DISCUSIÓN
La inoculación de las plántulas de algodón transgénico con Trichoderma cepa ICA 4 tuvo un efecto significativo en el crecimiento de las mismas. Esto se debió a que las variables rango de crecimiento relativo (RCR), altura (H), y número de hojas (Ho) fueron estadísticamente superiores en las plántulas inoculadas que en las no inoculadas, mientras que el tiempo de duplicación (TD) fue significativamente inferior (Tabla 1, Fig. 1). Resultados similares han sido reportados por Antúnez et al. (2001) y James y Drenovsky (2007). Por otra parte, aun cuando existen factores externos como la humedad y concentración de nutrientes del suelo que puede influir en la topología del sistema radical (Cruz et al., 2004), la RCR también está relacionada con la proporción de biomasa que corresponde a las raíces (Antúnez et al., 2001). En este sentido, la inoculación de las plantas con la cepa de Trichoderma spp. mostró un incremento en el número de raíces de 2º, 3º y 4º orden con respecto a las plantas no inoculadas (46%, 73% y 98%, respectivamente: Tabla 2, Fig. 2). Resultados similares han sido reportados por Bae et al. (2009). Estos autores observaron un incremento en peso fresco, peso seco y contenido de agua en las raíces al inocular plantas de Theobroma cacao con una cepa de Trichoderma hamatum. Además, Shanmugaiah et al. (2009) reportaron que la inoculación de plántulas de algodón convencional con Trichoderma viride favoreció la longitud de raíz y la germinación, lo cual se reflejó en un mayor vigor de las plantas inoculadas. Por otra parte, microorganismos benéficos -como los hongos micorrizicos arbusculares- podrían influir en la biosíntesis de reguladores de crecimiento (fitohormonas), favoreciendo el incremento o reducción de raíces laterales (auxinas), y la densidad y longitud de los pelos radicales (etileno) (Freire et al., 2000). Aunque la estimulación de fitohormonas en la raíz no se determinó, se podría sugerir que la cepa de Trichoderma elegida podría originar un proceso similar a lo reportado por estos autores, estimulando la biosíntesis de fitohormonas, principalmente de auxinas y etileno, afectando así el desarrollo del sistema radical de las plantas de algodón transgénico. De tal forma, podemos sugerir que el modo de acción de la cepa ICA 4 sobre las plántulas de algodón transgénico consistiría en: a) la generación de un sistema radical fuerte y bien definido, que podría proporcionar un mayor anclaje de la planta; b) desarrollo de raíces laterales extensas y abundantes para proporcionar un mayor acceso a nutrientes y de agua superficial. Esto a su vez tendría efectos sobre la altura de la planta, el número de hojas, etc. Para un mejor entendimiento de este proceso, futuros estudios deberían ser encaminados a (1) evaluar la expresión de genes involucrados en la biosíntesis de fitohormonas que podrían estar involucradas en el desarrollo radical, y (2) estudiar los efectos de la inoculación de las plántulas de algodón transgénico con la cepa de Trichoderma evaluada sobre el desarrollo y productividad en condiciones controladas de campo.
Tabla 1. Variables de crecimiento en plantas de algodón transgénico
control e inoculadas con Trichoderma cepa ICA 4, a los 30
días luego de la inoculación.
Table 1. Growth variables in transgenic cotton plants inoculated and
non-inoculated by Trichoderma cepa ICA 4 after 30 days of inoculation.
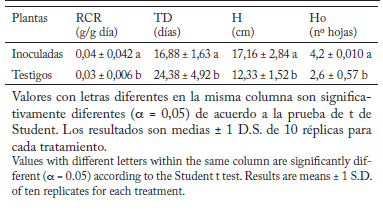

Fig. 1. Efecto de Trichoderma cepa ICA 4 a los 30 días de la inoculación de plantas de algodón transgénico.
Fig. 1. Effect of Trichoderma strain ICA 4 after 30 days from inoculation of transgenic cotton plants.
Tabla 2. Arquitectura de raíz en algodón transgénico, en plantas
inoculadas y no inoculadas, a los 30 días de inoculación con
Trichoderma cepa ICA 4.
Table 2. Root architecture of inoculated and non-inoculated, transgenic
cotton plants after 30 days from inoculation with Trichoderma strain ICA 4.


Fig. 2. Arquitectura de la raíz en plantas de algodón transgénico inoculadas y no inoculadas (A) y porcentaje de raíces de 2º, 3º y 4º orden (B) a los 30 días después de la inoculación con Trichoderma cepa ICA 4.
Fig. 2. Root architecture on inoculated and non-inoculated, transgenic cotton plants (A), and percentage of roots of 2nd, 3rd and 4th order (B) after 30 days from inoculation with Trichoderma strain ICA.
CONCLUSIONES
Se desarrolló un inoculante a base de la cepa de Trichoderma ICA 4, de fácil producción, que representa una alternativa para ser empleada en la producción de plántulas de algodón transgénico en el valle de Mexicali, México. El presente trabajo es un primer paso para la realización de estudios más amplios en donde se aborden experimentos del uso del inoculante en la producción a nivel de parcelas demostrativas del cultivo del algodón transgénico en el valle de Mexicali, B.C.
AGRADECIMIENTOS
Se agradece el apoyo recibido por la 15ª Convocatoria Interna de Apoyo a Proyectos de Investigación de la Universidad Autónoma de Baja California y al Subsistema Nacional de Recursos Genéticos (SUBNARGEM).
REFERENCIAS
1. Antúnez, I., E.C. Retamosa y R. Villar (2001). Relative growth rate in phylogenetically related deciduous and evergreen woody species. Oecologia 128: 172-180. [ Links ]
2. Bae, H., R.C. Sicher, M.S Kim, S.H. Kim, M.D. Strem, R.L. Melnick y B.A. Bailey (2009). The beneficial endophyte Trichoderma hamatum isolate DIS 219b promotes growth and delays the onset of the drought response in Theobroma cacao. Journal of Experimental Botany 60: 3279-3295. [ Links ]
3. Bruinsma. M., G.A. Koalchuk y J.A. van Veen (2005). Effects of genetically modified plants on microbial communities and processes in soil. Plant and Soil 37: 329-337. [ Links ]
4. Cruz, C., J.J. Green, C.A. Watson, F. Wilson y M.A. Martins-Loucao (2004). Functional aspects of root architecture and mycorrhizal inoculation with respect to nutrient uptake capacity. Mycorrhiza 14: 177-184. [ Links ]
5. de Santiago, A, J.M. Quintero, M. Aviles y A. Delgado (2011). Effect of Trichoderma asperellum strain T34 on iron, copper, manganese, and zinc uptake by wheat grown on a calcareous medium. Plant and Soil 342: 97-104. [ Links ]
6. Espinosa-Victoria, D., D. González-Mendoza, J. Placencia de la P. y R. García-Espinosa (2004). Reducción de la incidencia de Phytophthora capsici leo en el sistema radical de plántulas de chile premicorrizadas con Glomus intraradices. Terra Latinoamericana 22: 317-326. [ Links ]
7. Freire, C.A. (2000). Effects of arbuscular mycorrhizal fungi on tree growth, leaf water potential, and levels of 1-aminocyclopropane-1-carboxylic acid and ethylene in the roots of papaya under water-stress conditions. Mycorrhiza 10: 11-17. [ Links ]
8. González-Mendoza, D, V. Ceja-Moreno, G. Gold-Bouchot, R.M. Escobedo-Gracia Medrano, M. Del-Río, D. Valdés-Lozano y O. Zapata-Pérez (2007). The influence of radical architecture on cadmium bioaccumulation in the black mangrove Avicennia germinans L. Chemosphere 67: 330-334. [ Links ]
9. James, J.J. y R.E Drenovsky (2007). A basis for relative growth rate differences between native and invasive forb seedlings. Rangeland Ecology & Management 60: 395-400. [ Links ]
10. Li, X., B. Liu, S. Heia, D. Liu, Z. Han, K. Zhou, J. Cui, J. Luo y Y. Zheng. (2009). The effect of root exudates from two transgenic insectresistant cotton lines on the growth of Fusarium oxysporum. Transgenic Research 18: 757-767. [ Links ]
11. Liu, W. (2010). Do genetically modified plants impact arbuscular mycorrhizal fungi? Ecotoxicology 19: 229-238. [ Links ]
12. Lopez-Bucio, J., E. Hernández-Abreu, L. Sánchez-Calderón, M.F. Nieto-Jacobo, J. Simpson y L. Herrera-Estrella (2002). Phosphate availability alters architecture and causes changes in hormone sensitivity in the Arabidopsis root system. Plant Physiology 129: 244-256. [ Links ]
13. Marchetti, E., C. Accinelli, V. Talamè y R. Epifani (2007). Persistence of Cry toxins and cry genes from genetically modified plants in two agricultural soils. Agronomy Sustentable Development 27: 231-236. [ Links ]
14. Reffye, P., E. Heuvelink y D. Barthelemy (2008). Plant Growth Models. Encyclopedia of Ecology. 2837 p. [ Links ]
15. Shanmugaiah, V., N. Balasubramanian, S. Gomathinayagam, P.T. Monoharan y A. Rajendran (2009). Effect of single application of Trichoderma viride and Pseudomonas fluorences on growth promotion in cotton plants. African Journal of Agricultural Research 4: 1220-1225. [ Links ]
16. Terán-Vargas, A.P., J.C. Rodrígues, C.A. Blanco, J.L. Martinez- Carrillo, J. Cibrián-Tovar, H. Sánchez-Arroyo, L.A. Rodríguez- Del-Bosque y D. Stanley (2005). Bollgard cotton and resistance of tobacco budworm (Lepidoptera: Noctuidae) to conventional insecticides in southern Tamaulipas, Mexico. Journal of Economic Entomology 98: 2203-2209. [ Links ]
17. Thomazoni, D., P.E. Degrande, P.J. Silvie y F. Odival (2010). Impact of Bollgard (R) genetically modified cotton on the biodiversity of arthropods under practical field conditions in Brazil. African Journal of Biotechnology 9: 6167-6176. [ Links ]














