Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.82 no.1 Vicente López jun. 2013
ARTÍCULOS ORIGINALES
Evaluación biológica de polen apícola de plantas nativas de Chile
Biological evaluation of bee pollen from native Chilean plants
Montenegro G, R Pizarro, E Mejías, S Rodríguez
Departamento de Ciencias Vegetales, Facultad de Agronomía e Ingeniería Forestal, Pontificia Universidad Católica de Chile. Avenida Vicuña Mackenna 4860, Macul, Santiago, Chile.
Address Correspondence to: Gloria Montenegro, e-mail: gmonten@uc.cl
Recibido / Received 10.I.2012.
Aceptado / Accepted 29.VIII.2012.
Resumen. El polen apícola ha ganado creciente interés en las últimas décadas por sus diferentes propiedades, tanto terapéuticas, antioxidativas, antifúngicas, anticariogénicas y por su potencial uso como alimento funcional en la industria alimentaria dadas sus propiedades nutricionales. En este contexto, es necesario identificar los componentes químicos de los extractos de polen, con distinto origen botánico, sosteniendo la hipótesis que los subproductos apícolas heredan las características y propiedades bioactivas de las plantas desde las cuales provienen. El propósito de este estudio fue realizar una caracterización química de muestras de pólenes apícolas colectados por Apis mellifera L. desde plantas nativas de la zona central de Chile, y establecer propiedades derivadas de la presencia de ciertos compuestos. A partir de los extractos de polen apícola fueron cuantificadas las concentraciones de pigmentos, fenoles totales y proteínas. El análisis de la actividad antioxidante se realizó mediante la aplicación de la técnica FRAP y la evaluación de capacidad antirradicalaria se efectuó a través de DPPH. Los resultados indican que Cryptocarya alba (Mol.) Looser fue la fuente de polen preferida por las abejas. Los extractos de polen provenientes de Colliguaya odorífera Mol. y Kageneckia oblonga R. et P. registraron los mayores contenidos de fenoles totales. La actividad antioxidante fue principalmente expuesta por C. odorifera y Quillaja saponaria Mol. Tanto la composición de compuestos fenólicos como la capacidad antioxidante se presentan estrechamente asociadas al origen botánico de las muestras analizadas.
Palabras clave: Apis mellifera; Caracterización química; Chile; Polen corbicular; Plantas nativas; Evaluación biológica.
Abstract. Bee pollen has gained increased interest in recent decades due to its therapeutic, antioxidant, antifungal and anticariogenic properties, as well as its potential use as a functional food product in the food industry because of its nutritional properties. Terefore, it is necessary to identify the chemical components of pollen extracts with diferent botanical origin, supporting the hypothesis that bee products inherit the characteristics and bioactive properties from the plants they come from. The purpose of this study was to conduct a chemical characterization of samples of pollen collected by Apis mellifera L. from plants native to central Chile, and also to establish properties based on the presence of certain compounds. Pigment, total phenols and protein concentrations were quantifed from bee pollen extracts. The antioxidant activity analysis was performed using the FRAP technique and the antiradical capacity was estimated using DPPH. The results indicated that Cryptocarya alba (Mol.) Looser was the pollen source preferred by bees. Pollen extracts from Colliguaja odorifera Mol. and Kageneckia oblonga R. et P. recorded the highest total phenolic content. The antioxidant activity was primarily displayed by C. odorifera and Mol. Te composition of phenolic compounds and the antioxidant capacity were found to be closely associated with the botanical origin of the samples analyzed.
Keywords: Apis mellifera; Chemical characterization; Chile; Pollen load; Native plants; Biological evaluation.
INTRODUCCIÓN
Actualmente, en gran parte del orbe, se ha incrementado el uso de compuestos biológicamente activos (antibacterianos, antifúngicos, antioxidantes, etc.) provenientes de fuentes naturales, tanto con fines terapéuticos como profilácticos. Asociado a esta mayor demanda, se registra un aumento constante y sostenido en la búsqueda de fuentes naturales que contengan cantidades significativas de tales compuestos. Los productos apícolas (miel, polen y propóleos) constituyen un grupo destacado de productos naturales, que representan ricas fuentes de compuestos potencialmente bioactivos (Ferreres et al., 1994; Marcucci, 1995; Mizrahi y Lensky, 1997; Molan, 2001; Gheldof y Engeseth, 2002; Gheldof et al., 2002; Muñoz et al., 2007; Peña 2008; Izuta et al., 2009; Abouda et al., 2011).
La flora chilena ha mostrado ser una buena fuente de recursos para la actividad apícola (Montenegro, 2000; Muñoz et al., 2001a; Montenegro et al., 2001; Montenegro et al., 2003; Montenegro et al., 2005). Dado el alto grado de endemismo de la vegetación de Chile central (Arroyo and Cavieres, 1997) es razonable pensar que a partir de ella se podrían obtener productos apícolas con propiedades únicas e irrepetibles. En tal sentido, se ha investigado la composición química y las propiedades de tales compuestos presentes en la miel y propóleos (Ávila et al., 1992; Muñoz et al., 2001b, Muñoz et al., 2007, Montenegro et al., 2008, Montenegro et al., 2009), pero aún no se ha puesto mayor atención en la composición química y propiedades del polen corbicular proveniente de plantas nativas y endémicas de Chile.
La abeja colecta el polen con el fin de obtener nutrientes necesarios para la mantención de la colmena, principalmente proteínas y lípidos. El polen colectado es mezclado con néctar y saliva, con el fin de otorgarle adherencia, y es acumulado en una especie de bolsillo rodeado de pelos, ubicado en la tibia del tercer par de patas, llamado corbícula. Por ello, a estas pequeñas bolitas de polen acumulado se les conoce como polen corbicular.
Al igual que en otros productos de la colmena, la presencia de compuestos químicos en el polen depende directamente del origen botánico que posee. En la literatura disponible existen diversos estudios realizados sobre pólenes apícolas, cuyo objetivo es la caracterización de su composición química (Vásquez et al., 2007; Chang et al., 2008; Maróstica et al., 2008; Modro et al., 2009; Carpes et al., 2009; Mărgăoan et al., 2010). En su contenido, se describen múltiples familias de compuestos orgánicos que le otorgan la capacidad de tolerar diferentes tipos de estrés, como el daño oxidativo provocado por la radiación UV o la deficiencia hídrica. En este grupo de compuestos se distinguen principalmente proteínas e hidratos de carbono, y metabolitos secundarios como pigmentos y ácidos fenólicos hidrosolubles (Dobson, 1988; Ivleva et al., 2005; Carpes et al., 2007; Schulte et al., 2008; Schulte et al., 2009). Otros atributos descritos para los componentes del polen apícola son la actividad antitumoral y anticoagulante (Furusawa et al., 1995; Zhang et al., 1995; Jaton et al., 1997; Yang et al., 2007).
La actividad antioxidante del polen apícola se relaciona con la capacidad que tienen ciertos compuestos presentes en su contenido, de contrarrestar el daño oxidativo provocado por especies radicalarias (Basim et al., 2006; Almaraz-Abarca et al., 2007). De esta forma, estos compuestos reaccionan con los radicales libres, evitando que otras moléculas, de gran importancia biológica (ej., ácidos nucleicos y proteínas), sufran degradaciones y denaturalizaciones, debido a dichos radicales.
A pesar de la relevancia de las características químicas de los constituyentes del polen apícola, no existe suficiente información sobre los niveles de actividad asociados al contenido de flavonol y al perfil bioquímico del polen apícola de diferente origen botánico. Es por ello que se planteó el presente estudio, con el propósito de caracterizar extractos de polen apícola provenientes de especies de plantas nativas de la zona central del país colindantes a apiarios, de acuerdo a la concentración de compuestos orgánicos presentes en su contenido. Además, se propuso evaluar las actividades antioxidantes y antirradicalarias de estos extractos, de manera de correlacionar estas propiedades con la presencia de los compuestos determinados a través del proceso de caracterización química.
MATERIALES Y MÉTODOS
Descripción del área de estudio. El área de estudio donde se obtuvieron las muestras de polen abarca aproximadamente entre los 32° 45' y los 35° 40' LS (Fig. 1), caracterizado por un clima mediterráneo, en Chile Central, con inviernos fríos y lluviosos y veranos calurosos y secos, con tendencia semiárida por el norte, y húmeda por el sur (Di Castri y Hajek, 1976). Desde el punto de vista botánico, el área de estudio corresponde a la región del matorral y bosque esclerófilo (Gajardo, 1994).

Fig. 1. Mapa de distribución y ubicación de los sitios de muestreo.
Fig. 1. Distribution and location map of sampling sites.
Muestreo de polen. El muestreo de polen se realizó estableciendo 5 colmenas, en 12 puntos ubicados entre las regiones V de Valparaíso y VII del Maule (Fig. 1), en zonas dominadas por flora nativa. Para ello, se instalaron trampas de polen en la piquera de cada colmena, durante una hora (entre las 11 y 12 horas), y entre octubre de 2009 y enero de 2010 (Tabla 1). Pasado ese tiempo, se juntaron los pólenes colectados por cada colmena, para generar la muestra del apiario, obteniéndose finalmente 17 muestras de polen corbicular, para su análisis posterior.
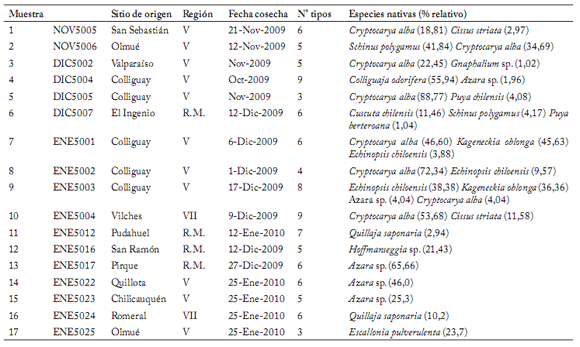
Tabla 1. Sitio de origen, fecha de cosecha, composición y especies nativas en cada muestra de polen analizada. Entre paréntesis, porcentaje de participación de la especie en la muestra.
Table 1. Site of origin, harvest date, composition and native species for each analyzed pollen sample. In parenthesis, the percentage participation of the species in the sample.
En esos mismos puntos se efectuó una colecta de todas las plantas encontradas en flor, coincidentes con las fechas de muestreo de polen. El polen fresco extraído de las flores de las plantas colectadas en terreno permitió formar una colección de referencia para identificar (por comparación) el polen extraído de las colmenas. Esta colección fue depositada en la palinoteca del Laboratorio de Botánica de la Facultad de Agronomía e Ingeniería Forestal de la Pontificia Universidad Católica de Chile.
Características botánicas de las muestras de polen. El origen botánico del polen contenido en las corbículas se identificó mediante el método de Gómez - Ávila (Montenegro et al., 1992). Brevemente, cada muestra de polen fue pesada, siendo las corbículas posteriormente separadas por color y tamaño. Cada uno de estos grupos de polen fue pesado, determinándose su frecuencia relativa al calcular el porcentaje que su peso representaba dentro del peso de la muestra completa. Finalmente, de cada uno de estos grupos se realizaron 3 preparaciones para microscopio óptico a partir de 3 corbículas distintas, tomando un trocito de cada una, disgregándola sobre un cubreobjetos, con ayuda de una aguja de disección y etanol de 70°, tiñéndola con fucsina diamante, y montándola con gelatina glicerinada. La identificación de los pólenes se logró mediante su comparación con las preparaciones de la palinoteca.
Preparación de extractos del polen apícola. Se obtuvieron extractos acuosos a través de la resuspensión de las muestras de polen, utilizando el siguiente procedimiento: se disolvieron 500 mg de una muestra de polen en 1,0 mL de agua, a pH 2. La mezcla obtenida se dejó en reposo a temperatura ambiente por 5 min, y luego fue suspendida mediante agitación durante 2 min hasta obtener una suspensión, con valores de pH comprendidos entre 4,5 y 5,5.
Características químicas de las muestras de polen. Se caracterizaron químicamente tres muestras de polen apícola del mismo origen botánico nativo, cada una de ellas con tres repeticiones. A partir de la suspensión, se determinó la concentración de compuestos fenólicos hidrosolubles y la actividad antirradicalaria y antioxidante. Además, se determinó la presencia de proteínas totales y pigmentos. Se compararon los resultados de dichos análisis entre los pólenes de los distintos orígenes botánicos identificados.
La evaluación de los compuestos fenólicos hidrosolubles se obtuvo a través del método colorimétrico Folin-Ciocalteau (Singleton y Rossi, 1965; Buratti et al., 2007). Se utilizó ácido gálico (Sigma Aldrich) como estándar de calibración. La lectura de las muestras se realizó a 765 nm.
La actividad antioxidante (FRAP) se determinó mediante un ensayo de la capacidad antioxidante/ reductora del ion férrico en el complejo formado con 2,4,6 - tripyridyl - s- triazine (TPTZ), que se transforma a su forma ferrosa, en la presencia de antioxidantes. Se mezclaron 200 μL de extracto de polen con 1,8 mL de reactivo FRAP (2,5 mL TPTZ 10 mM en 40 mM HCl + 2,5 mL FeCl3 20 Mm + 25 mL bufer acetato 0,3 M pH 3,6). Las muestras fueron incubadas por 15 minutos a 37 °C. Posteriormente, se determinó la absorbancia a 593 nm. Se utilizó FeSO4 *7 H2O (100-1000 μM) como estándar de calibración (Bertoncelj et al., 2007; Mejías y Montenegro, 2012).
La determinación de la actividad antirradicalaria se realizó mediante el método colorimétrico del 1,1 difenil-2- picril hidrazilo (DPPH). Se mezclaron 0,75 mL de extracto de polen con 1,5 mL de una solución de DPPH 0,02 mg/mL. En seguida, las muestras fueron incubadas por 15 minutos a temperatura ambiente. La determinación de la absorbancia se realizó a 517 nm. El capacidad antirradicalaria se estimó mediante una curva de calibración de ácido ascórbico 0 -10 μg/ mL (Meda et al., 2005; Mejías y Montenegro, 2012).
La determinación de proteínas en muestras de polen se realizó mediante el método de Bradford (Bradford, 1976; Zor y Selinger, 1996). Se utilizó seroalbumina de bovino (BSA) como estándar de calibración. Las absorbancias de las muestras y estándares se obtuvieron a 595 nm.
Se determinó la presencia de licopeno y betacaroteno. El licopeno fue extraído agregando 8,0 mL de Butil-Hidroxitolueno (BHT) 0,05% en acetona, a la suspensión de polen, y adicionando posteriormente 2,5 mL de etanol y 12 mL de hexano. Se utilizó licopeno de tomate liofilizado (Sygma) como estándar de calibración. Las lecturas de las muestras y estándares se efectuaron a 540 nm.
La determinación de betacaroteno se realizó mediante extracción con acetona (5,0 mL) y éter de petróleo (12 mL). Se utilizó betacaroteno (Sygma) como estándar de calibración. La absorbancia de las muestras se obtuvo a 430 nm.
Análisis estadístico. Se consideró como unidad experimental cada grupo de polen corbicular que, luego de ser separado de la muestra original e identificado, correspondiera a una especie nativa. Los valores medios de cada uno de los análisis químicos se compararon mediante ANOVA y posteriormente, dependiendo de su significación, se realizó el test de comparaciones múltiples de Tukey - Kramer, utilizando el programa estadístico XLSTAT 2011.
RESULTADOS Y DISCUSIÓN
Características botánicas de las muestras de polen. Las 17 muestras colectadas estuvieron compuestas por una mezcla que fluctuó entre 3 y 9 tipos de corbículas distintas, es decir, morfos polínicos diferentes (promedio: 5,8 tipos por muestra, Tabla 1).
Cryptocarya alba fue claramente la preferida por la abeja en la época de colecta utilizada, siendo la especie nativa presente en mayor cantidad de muestras (8 muestras: 1, 2, 3, 5, 7, 8, 9 y 10), y con la más alta frecuencia relativa porcentual en 6 de ellas. Además, fue la especie más importante en la formación de las cargas corbiculares en la suma de las 17 muestras analizadas, estimándose como la más importante fuente de polen elegida por las abejas, en las zonas y fechas de muestreo.
En segundo lugar de importancia se observa la presencia de polen de una especie del género Azara, la cual se encuentra presente en 5 muestras, siendo el polen dominante en dos de ellas (muestras 13 y 14). Otras dos especies (Echinopsis chiloensis y Kagenecki oblonga) también son destacables, pues aparecen en más de una muestra y con altos porcentajes de participación (Tabla 1), y representan importantes fuentes de polen para la actividad apícola en Chile Central. Es importante mencionar la baja presencia y preponderancia de polen de Quillaja saponaria en las muestras (la cual sólo se vio presente en las muestras 11 y 16, con un bajo porcentaje relativo, en ambos casos), considerando que esta especie ha sido identificada previamente, como la mayor y más importante fuente de néctar para la elaboración de miel en la zona central de Chile (Montenegro et al., 2003, 2005, 2009).
El examen microscópico de todas las muestras de polen mostró que las cargas corbiculares fueron homogéneas, compuestas principalmente por granos de polen de una misma especie de planta.
Características químicas de las muestras de polen. En la Tabla 2 se presentan los valores obtenidos de compuestos fenólicos hidrosolubles, actividad antioxidante (FRAP) y actividad antirradicalaria (DPPH) en las muestras de polen analizadas.
Tabla 2. Concentración de fenoles, actividad antioxidante (FRAP) y actividad antirradicalaria (DPPH) en las muestras de polen apícola analizadas, provenientes de plantas nativas.
Table 2. Phenol concentration, antioxidant activity (FRAP) and antiradical activity (DDPH) in analyzed bee pollen samples from native plants.

Letras distintas indican diferencias significativas, según la prueba de Tukey- Kramer (p<0,05).
La mayor concentración de compuestos fenólicos se registró en la especie Q. saponaria (quillay), con cifras estadísticamente significativas respecto al resto de las especies. Los menores valores se obtuvieron en las especies E. chiloensis (quisco) y Schinus polygamus (huingán), con una media de 7,12 y 7,13 respectivamente. Estos valores presentan diferencias significativas respecto al resto de las especies nativas.
Se ha sugerido que las plantas con hojas presentan mayores concentraciones de compuestos antioxidantes debido a que captan mayor cantidad de radiación solar (Gao et al., 2010). E. chiloensis es una planta áfila de la familia Cactaceae, razón por la cual no es sorprendente su menor concentración de compuestos antioxidantes.
S. polygamus (Anacardiaceae) presenta características morfológicas y de distribución similares a Q. saponaria (Quillajaceae). Sin embargo, S. polygamus florece a mediados de primavera, época en la cual la radiación solar aún no ha llegado a sus niveles más altos. El quillay florece a fines de primavera y comienzos de verano, época en que los niveles de radiación solar aumentan considerablemente. Así, al momento de florecer, Q. saponaria recibe una mayor radiación que S. polygamus en la misma etapa fenológica, lo cual podría explicar las diferencias encontradas entre sus concentraciones de compuestos fenólicos.
El metabolismo secundario de las plantas donde se originaron los pólenes sometidos a estudio es lo que determina la cantidad y naturaleza de los compuestos fenólicos presentes en su composición (Gould y Lister, 2006). El rol que cumplirían estos compuestos, en el polen, no han sido determinados con exactitud. Hay evidencias que sugieren que los favonoides estarían involucrados en la protección contra el estrés provocado por la radiación UV.
En la evaluación de la actividad antioxidante (FRAP), los valores más altos los presentó Colliguaja odorifera (colliguay), con una diferencia estadísticamente significativa respecto a las especies restantes. E. chiloensis registró el valor más bajo en esta actividad, también diferente estadísticamente de las otras plantas. La baja actividad antioxidante de esta especie podría estar relacionada con la concentración disminuida de compuestos fenólicos, detectada para las muestras de esta especie.
Del mismo modo, la caracterización química de los extractos de plantas responsables del origen botánico de las muestras de polen, sometidas a estudio en este trabajo, han presentado interesantes actividades antioxidantes. En especies tales como Q. saponaria es posible establecer una correlación entre las propiedades biológicas de la planta de origen y el polen que se ha obtenido a partir de ella (Muñoz et al., 2007).
Los resultados obtenidos para las actividades antioxidantes y antirradicalarias (FRAP y DPPH), para el polen de esta especie, sugieren que esta propiedad biológica es heredada desde la fuente floral específica.
Los resultados de FRAP (Tabla 2) señalan una actividad específica para cada polen asociada a su origen botánico. Del número total de especies estudiadas, 5 presentaron actividad FRAP superior a 20 mM eq Fe+2 por gramo de polen (S. polygamus, P. chilensis, C. odorifera, C. alba y Q. saponaria). Para los valores obtenidos en el ensayo FRAP, en estas 5 muestras se encontraron diferencias significativas.
El análisis de la actividad antirradicalaria (DPPH), mostró que los pólenes poseen un comportamiento radicalario constante, sin diferencias significativas entre las muestras estudiadas, evidenciando que éste no dependería directamente del origen botánico. Es probable que la capacidad de mitigar el efecto de especies radicalarias se deba a la sumatoria de componentes que el polen posee, más que a un grupo particular de compuestos.
La Tabla 3 muestra los resultados obtenidos en la determinación de pigmentos en las muestras de polen apícola sometidas a estudio. En 9 de las 15 muestras sometidas a análisis, se observó al menos uno de los dos pigmentos evaluados en la caracterización química de los pólenes estudiados. En cuanto a la presencia de betacaroteno y licopeno, S. polygamus y Azara sp., respectivamente, registraron niveles significativamente más altos de estos compuestos en las muestras analizadas.
Tabla 3. Concentraciones de betacaroteno y licopeno en muestras de polen apícola analizadas.
Table 3. Beta carotene and lycopene concentrations in analyzed bee pollen samples.
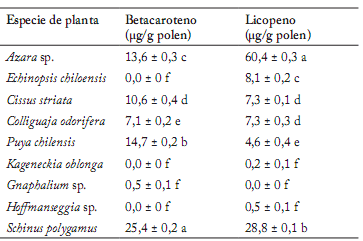
Letras distintas indican diferencias significativas según la prueba de Tukey-Kramer (p≤0,05).
Es importante destacar que los valores de pigmentos obtenidos en este estudio son comparables con aquellos reportados en investigaciones realizadas en otros alimentos, como frutas y mariscos (Dragovic-Uzelac et al., 2007; Melendez-Martinez et al., 2004; Li et al., 2010). De esta manera, el polen con contenido de pigmentos puede ser clasificado como fuente natural de ellos, pudiendo ser incluido en la dieta humana.
Por otra parte, en aquellas muestras en que no fue posible detectar licopeno y betacaroteno, la presencia de pigmentos no puede ser descartada. Tales resultados indicarían la existencia de otras moléculas pertenecientes a la misma familia de estos compuestos, los que no pueden ser extraídos y detectados a través de métodos analíticos sencillos. En el futuro, la ayuda de diversas técnicas cromatográficas de alta sensibilidad, facilitará la identificación con mayor precisión de la naturaleza química de tales pigmentos.
La Tabla 4 muestra los resultados obtenidos en la determinación del porcentaje de proteínas presentes en la composición de cada polen nativo estudiado. Los porcentajes significativamente mayores fueron registrados para C. alba, E. chiloensis y P. chilensis, cuyos valores resultaron ser estadísticamente iguales entre sí. Estas diferencias significativas entre los porcentajes de proteína, obtenidos para cada muestra, sería otro factor relacionado con las variaciones resultantes del ensayo FRAP.
Tabla 4. Porcentaje de proteínas en las muestras de polen nativo analizadas.
Table 4. Protein percentage in analyzed native pollen samples.

Letras distintas corresponden a diferencias significativas según la prueba de Tukey-Kramer (p≤0,05).
Cabe destacar que la presencia de pigmentos también contribuye a la actividad antioxidante de un polen dado, determinada por sus compuestos fenólicos hidrosolubles. No obstante, la presencia de micronutrientes y proteínas también pueden ayudar a modular dicha propiedad. No existen mayores antecedentes que relacionen la posible interacción de los compuestos presentes en el polen con la eficiencia de la capacidad antioxidante observada, o de alguna otra propiedad de interés. Es necesario considerar que, al igual que la variabilidad establecida para la presencia de pigmentos, la presencia y actividad de compuestos antioxidantes también puede estar influenciada por factores tales como las condiciones ambientales y el grado de contaminación presente en zonas cercanas a la ubicación de las colmenas (Almaraz-Abarca et al., 2007; Saxena et al., 2010).
Sobre la base de la información química resultante, es posible identificar las fuentes de polen apícola más favorables a la obtención de propiedades biológicas de interés.
El consumo natural de polen apícola proveniente de plantas nativas reconocidas por sus propiedades químicas, constituiría una buena alternativa nutricional y un valor agregado en la producción de polen por pequeños apicultores.
Por otro lado, las especies vegetales registradas aquí como buenas fuentes de polen, se encuentran con problemas de conservación en Chile Central debido a perturbaciones de origen antrópico, por lo que la caracterización que se entrega podría apoyar el desarrollo de los programas de manejo de flora nativa existentes.
AGRADECIMIENTOS
La presente investigación contó con el financiamiento de los proyectos: FONDEF D08I1080, FIA PYT-2009-0118, FONDECYT-REGULAR 2011, Project 1110808 de la autora Gloria Montenegro y FONDECYT Postdoctoral Grant Number 3110070 del autor Enrique Mejías.
REFERENCIAS
1. Abouda, Z., I. Zerdani, I. Kalalou, M. Faid y M.T. Ahami (2011). The antibacterial activity of moroccan bee bread and bee-pollen (fresh and dried) against pathogenic bacteria. Research Journal of Microbiology 6: 376-384. [ Links ]
2. Almaraz-Abarca, N., M. da Graça Campos, J.A. Ávila-Reyes, N. Naranjo-Jiménez, J. Herrera Corral y L.S. González-Valdez (2007). Antioxidant activity of polyphenolic extract of monofloral honeybee collected pollen from mesquite (Prosopis juliflora, Leguminosae). Journal of Food Composition and Analysis 20: 119-124. [ Links ]
3. Arroyo, M.T.K. y L. Cavieres (1997). The Mediterranean-type climate flora of Central Chile: What do we know and how can we assure its protection? En: Timmermann B.N. y G. Montenegro (eds.). Aspectos Ambientales, Éticos, Ideológicos y Políticos en el debate sobre la bioprospección y uso de recursos genéticos en Chile. Noticiero de Biología 5: 48-56. [ Links ]
4. Ávila, G., G. Montenegro y M. Gómez (1992). Importancia relativa de la especies cuyo polen es utilizado por Apis mellifera en el área de la Reserva Nacional Los Ruiles, VII región de Chile. Acta Botánica Malacitana 17: 167-174. [ Links ]
5. Basim, E., H. Basim y M. Öscan (2006). Antibacterial activities of Turkish pollen and propolis extracts against plant bacterial pathogens. Journal of Food Engineering 77: 992-996. [ Links ]
6. Bertoncelj J., U. Dobersek, M. Jamnik y T. Golob (2007). Evaluation of the phenolic content, antioxidant activity and colour of Slovenian honey. Food Chemistry 105(2): 822-828. [ Links ]
7. Bradford, M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Analytical Biochemistry 72: 248-254. [ Links ]
8. Buratti, S., S. Benedetti y M.S. Cosio (2007). Evaluation of the antioxidant power of honey, propolis and amperometric flow injection analysis. Talanta 71: 1387-1392 [ Links ]
9. Carpes, S.T., G.B. Mourão, S.M. de Alencar y M.L. Masson (2009). Chemical composition and free radical scavenging activity of Apis mellifera bee pollen from Southern Brazil. Brazilian Journal of Food Technology 12: 220-229. [ Links ]
10. Carpes, S.T., R. Begnini, S.M. de Alencar y M.L. Masson (2007). Study of preparations of bee pollen extracts antioxidant and antibacterial activity. Ciênc. Agrotec., Lavras 31: 1818-1825. [ Links ]
11. Chang, R., D. Piló-Veloso, S.A.L. Morais y E.A. Nascimento (2008). Analysis of a Brazilian green propolis from Baccharis dracunculifolia by HPLC-APCI-MS and GC-MS. Revista Brasileira de Farmacognosia 18: 549-556. [ Links ]
12. Di Castri, F. y E. Hajek (1976). Bioclimatología de Chile, Ediciones Universidad Católica de Chile, Santiago. 171 p. [ Links ]
13. Dobson, H.E.M (1988). Survey of Pollen and Pollenkitt Lipids. Chemical Cues to Flower Visitors? American Journal of Botany 75: 170-182. [ Links ]
14. Dragovic-Uzelac, V., B. Levaj, V. Mrkic, D. Bursac y M. Boras (2007). The content of polyphenols and carotenoids in three apricot cultivars depending on stage of maturity and geographical region. Food Chemistry 102: 966-975. [ Links ]
15. Ferreres, F., P. Andrade y F.A. Tomás-Barberan (1994). Flavonoids from Portuguese heather honeys. Lebensm. Unters. Forsch. 199: 32-37. [ Links ]
16. Furusawa, E., S.C. Chou, A. Hirazumi y A. Melera (1995). Antitumour potential of pollen extract on Lewis lung carcinoma implanted intraperitoneally in syngeneic mice. Phytotherapy Research 9: 255-259. [ Links ]
17. Gajardo, R. (1994). La Vegetación Natural de Chile. Clasificación y Distribución Geográfica. Editarial Universitaria, Santiago, Chile. 165 p. [ Links ]
18. Gao, W., D. Schmoldt, y J.R. Slusser (2010). UV radiation in global climate change. Tsinghua University Press, Beijing. 544 p. [ Links ]
19. Gheldof, N. y N.J. Engeseth (2002). Antioxidant capacity of honeys from various floral sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in human serum samples Journal of Agricultural and Food Chemistry 50: 3050-3055. [ Links ]
20. Gheldof, N., X.H. Wang y N.J. Engeseth (2002). Identification and quantification of antioxidant components of honeys from various floral sources Journal of Agricultural and Food Chemistry 50: 5870-5877. [ Links ]
21. Gould, K.S. y C. Lister (2006). Flavonoid functions in plants. pp. 397-441. En: O.M. Andersen y K.R. Markham (eds.). Flavonoids, chemistry, biochemistry and applications. Taylor and Francis Group, Boca Raton, FL. [ Links ]
22. Ivleva, N.P., R. Niessner y U. Panne (2005). Characterization and discrimination of pollen by Raman microscopy. Analytical and Bioanalytical Chemistry 381: 261-267. [ Links ]
23. Izuta, H., Y. Narahara, M. Shimazawa, S. Mishima, S. Kondo y H. Hara (2009). 1,1-Diphenyl-2-picrylhydrazyl radical scavenging activity of bee products and their constituents determined by ESR. Biological Pharmaceutical Bulletin 32: 1947-1951. [ Links ]
24. Jaton, J-C., K. Roulin, K. Rose, F.M. Sirotnak, A. Lewenstein, G. Brunner, C.P. Fankhauser y U. Burger (1997). The secalosides, novel tumor cell growth inhibitory glycosides from a pollen extract. Journal of Natural Products 60: 356-360. [ Links ]
25. Li, N., J. Hu, S. Wang, Cheng, X. Hu, Z. Lu., Z. Lin, W. Zhu y Z. Bao (2010). Isolation and identification of the main carotenoid pigment from the rare orange muscle of the Yesso scallop. Food Chemistry 118: 616-619. [ Links ]
26. Marcucci, M.C. 1995. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie 26: 83-99 [ Links ]
27. Mărgăoan, R., L. Mărghitaş, D. Dezmirean, C. Mihai y O. Bobiş (2010). Bee collected pollen. General aspects and chemical composition. Bulletin UASVM Animal Science and Biotechnologies 67: 254-259. [ Links ]
28. Maróstica, M.R., A. Daugsch, C.S. Moraes, C.L. Queiroga, G.M. Pastore y Y.K. Park (2008). Comparison of volatile and polyphenolic compounds in Brazilian green propolis and its botanical origin Baccharis dracunculifolia. Ciênc. Tecnol. Aliment., Campinas 28: 178-181. [ Links ]
29. Meda, A., C.E. Lamien, M. Romito, J. Millogo y O.G. Nacoulma (2005). Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan honey, as well as their radical scavenging activity. Food Chemistry 91(3): 571-577. [ Links ]
30. Mejias, E. y G. Montenegro (2012). The antioxidant activity of Chilean honey and bee pollen produced in the Llaima Volcano's zones. Journal of Food Quality. 35: 315-322. [ Links ]
31. Melendez-Martinez, A., M. Vicario y F. Heredia (2004). Importancia nutricional de los pigmentos carotenoides. ALAN. 4: 149-155. [ Links ]
32. Mizrahi, A. y Y. Lensky (1997). Bee products: properties, applications and apitherapy. Springer-Verlag. 269 p. [ Links ]
33. Modro, A., I. Silva, C. Luz y D. Message (2009). Analysis of pollen load based on color, physicochemical composition and botanical source. Anais da Academia Brasileira de Ciências 81: 281-285. [ Links ]
34. Molan, P. (2001). Why honey is efective as a medicine - 2. The scientific explanation of its effects. Bee World 82: 22-40. [ Links ]
35. Montenegro, G., M. Gómez y G. Ávila (1992). Importancia relativa de la especies cuyo polen es utilizado por Apis mellifera en el área de la Reserva Nacional Los Ruiles, VII región de Chile. Acta Botánica Malacitana 17: 167-174. [ Links ]
36. Montenegro, G. (2000). Chile, nuestra flora útil. Guía de usoapícola, alimentario, medicinal folclórica, artesanal y ornamental. Colección en Agricultura Ediciones Universidad Católica de Chile. 267 p. [ Links ]
37. Montenegro, G., R.C. Peña, A.M. Mujica y R. Pizarro (2001). Botanical resources for propolis in an apiary network in central Chile. Phyton Revista Internacional de Botánica Experimental 70: 191-201. [ Links ]
38. Montenegro, G., R. Pizarro, G. Ávila, R. Castro, C. Ríos, O. Muñoz, F. Bas y M. Gómez (2003). Origen botánico y propiedades químicas de las mieles de la Región Mediterránea Árida de Chile. Ciencia e Investigación Agraria 30: 161-174. [ Links ]
39. Montenegro, G., R. Pizarro, G. Ávila, O. Muñoz, A.M. Mujica y F. Bas (2005). Determination of the botanical origin and some chemical properties of honeys from the central zone of Chile. Phyton Revista Internacional de Botánica Experimental 74: 213-223. [ Links ]
40. Montenegro, G., M. Gómez, R. Pizarro, G. Casaubon y R.C. Peña (2008). Implementación de un panel sensorial para mieles chilenas. Ciencia e Investigación Agraria 35: 51-58. [ Links ]
41. Montenegro, G., F. Salas, R.C. Peña y R. Pizarro (2009). Actividad antibacteriana y antifúngica de mieles monoflorales de Quillaja saponaria Mol., especie endémica de Chile. Phyton Revista Internacional de Botánica Experimental 78: 141-146. [ Links ]
42. Muñoz, O., R.C. Peña, E. Ureta y G. Montenegro (2001a). Propolis from chielan mattorral hives. Zeitschrift für Naturforschung C-A J. Biosci 56: 269-272. [ Links ]
43. Muñoz, O., R.C. Peña, E. Ureta, G. Montenegro, C. Caldwell y B.N. Timmermann (2001b). Phenolic compounds of propolis from central Chilean matorral. Zeitschrift für Naturforschung C-A J. Biosci. 56: 273-277. [ Links ]
44. Muñoz, O., S. Copaja, H. Speisky, R.C. Peña y G. Montenegro (2007). Content of flavonoids and phenolic compounds in chilean honeys. Orac index. Química Nova 30: 848-851. [ Links ]
45. Peña, R.C. (2008). Estandarización en propóleos: antecedentes químicos y biológicos. Ciencia e Investigación Agraria 35: 17-26. [ Links ]
46. Saxena, S., S. Gautam y A. Sharma (2010). Physical, biochemical and antioxidant properties of some Indian honeys. Food Chemistry 118: 391-397. [ Links ]
47. Schulte, F., J. Mader, L.W. Kroh, U. Panne y J. Kneipp (2009). Characterization of pollen carotenoids with in situ and high-performance thin-layer chromatography supported resonant raman spectroscopy. Analytical Chemistry 81: 8426-8433. [ Links ]
48. Schulte, F., J. Lingott, U. Panne y J. Kneipp (2008). Chemical characterization and classification of pollen. Analytical Chemistry 80: 9551-9556. [ Links ]
49. Singleton, V. y J. Rossi (1965). Colorimetry of total phenolics with phosphomolybdic - phosphotungstic acid reagent. American Journal of Enology and Viticulture 16: 144 - 158. [ Links ]
50. Vásquez, A., M. Cala, I. Miranda, G. Tafurt, J. Martínez y E. Stashenko (2007). Actividad antioxidante y contenido total de fenoles de los extractos etanólicos de Salvia aratocensis, Salvia sochensis, Bidens reptons y Montanoa ovalifolia. Scientia et Technica 13: 205-207. [ Links ]
51. Yang, X., D. Guo, J Zhang y M. Wu (2007). Characterization and anti-tumor activity of pollen polysaccharide. International Inmunopharmacology 7: 401-408. [ Links ]
52. Zhang, X., F.K. Habib, M. Ross, U. Burger, A. Lewenstein, K. Rose y J-C. Jaton (1995). Isolation and characterization of a cyclic hydroxamic acid from a pollen extract, which inhibits cancerous cell growth in vitro. Journal of Medicinal Chemistry 38: 735-738. [ Links ]
53. Zor, T. y Z. Selinger (1996). Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Analytical Biochemistry 236: 302-308. [ Links ]














