Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Phyton (Buenos Aires)
versão On-line ISSN 1851-5657
Phyton (B. Aires) vol.82 no.1 Vicente López jun. 2013
ARTÍCULOS ORIGINALES
Producción de biomasa y carotenoides de Dunaliella tertiolecta en medios limitados en nitrógeno
Production of biomass and carotenoids of Dunaliella tertiolecta in nitrogen-limited cultures
López-Elías JA1, D Fimbres-Olivarría3, LA Medina-Juárez1, A Miranda-Baeza2, LR Martínez-Córdova1, DMA Molina-Quijada3
1 Universidad de Sonora, DICTUS, Colosio s/n entre Reforma y Sahuaripa, Col. Centro CP 83000, Hermosillo, Sonora, México. Apdo Postal 1819.
2 Centro de Estudios Superiores del Estado de Sonora, Unidad Navojoa; Carretera a Huatabampo y Periférico Sur, Navojoa, Sonora. México C.P. 85870.
3 Estudiante del Posgrado en Biociencias del Departamento de Investigaciones Científicas y Tecnológicas de la Universidad de Sonora.
Address Correspondence to: José A. López-Elías, e-mail: jalopez@guayacan.uson.mx
Recibido / Received 23.V.2012.
Aceptado / Accepted 9.VIII.2012.
Resumen. Las microalgas tienen un contenido alto de compuestos antioxidantes (carotenoides, ficobilinas y ácidos grasos) que son utilizados en la industria biotecnológica. En condiciones de estrés, las células de Dunaliella aumentan su contenido de carotenoides. Por tal razón, se evaluó el crecimiento, la biomasa y la producción de carotenoides en cultivos masivos de Dunaliella tertiolecta Butcher bajo condiciones controladas (interior) y al exterior, empleando medios limitantes en nitrógeno. El medio control fue f/2 (nitratos: 75 g/L) y los medios experimentales limitados en nitrógeno fueron f/4 (nitratos: 37,5 g/L), f/6 (nitratos: 25 g/L) y f/8 (nitratos: 18,75 g/L). Las mayores concentraciones celulares fueron encontradas en los medios f/2 al interior (1,28 x 106 cél/mL) y al exterior (0,76 x 106 cél/mL). La biomasa seca aumentó en ambas condiciones de cultivo conforme se disminuyó la concentración de nitrógeno [100 a 217 picogramos (pg)/cél al interior, y 230 a 355 pg/cél al exterior]. La mayor concentración de carotenoides totales se encontró en el medio f/8 mientras que la mayor productividad se obtuvo en el medio f/2 al interior, con rendimientos de 0,03 mg/L de zeaxantina, 9,19 mg/L de luteína, 19,56 mg/L de clorofila b; 1,62 mg/L de clorofila a y 5,40 mg/L de β-caroteno. Se concluye que la concentración de carotenoides aumenta cuando D. tertiolecta es cultivada en un medio limitado en nitrógeno, aunque su densidad poblacional disminuye considerablemente.
Palabras clave: Dunaliella; Carotenoides; Medios de cultivo; Limitación de nitrógeno.
Abstract. Microalgae have a high content of antioxidant compounds (carotenoids, phycobilins and fatty acids) used in biotechnology industry. Under stress conditions Dunaliella cells produce more carotenoids. Because of this, we evaluated growth, biomass and carotenoid production under control (indoor) and outdoor conditions using mass cultures of Dunaliella tertiolecta Butcher, under nitrogenlimited media. Control medium was f/2 (nitrates: 18.75 g/L), and limited media were f/4 (nitrates: 37.5 g/L), f/6 (nitrates: 25 g/L) and f/8 (nitrates: 18.75 g/L). The highest cell concentrations were found in cultures using medium f/2 maintained indoor (1.28 x 106 cells/mL) and outdoor (0.76 x 106 cell/mL). Dry biomass increased in both culture conditions when nitrogen decreased in the medium (Indoor: 100 to 217 pg/cell, and Outdoor: 230 to 355 pg/cell). The highest concentration of total carotenoids was found using medium f/8 whereas the highest productivity was obtained using medium f/2 achieving yields of 0.03 mg/L of zeaxanthin, 9.19 mg/L lutein, 19.56 mg/L chlorophyll b, 1.62 mg/L chlorophyll a and 5.40 mg/Lβ-carotenoids. In conclusion, carotenoid concentration increased in nitrogen-limited cultures, but cell density decreased under such conditions.
Keywords: Dunaliella; Carotenoids; Culture media; Nitrogen limitation.
INTRODUCCIÓN
En la actualidad se han caracterizado alrededor de 600 carotenoides naturales, entre ellos el β-caroteno, que es reconocido como el de mayor importancia por su actividad antioxidante (Rao et al., 2006). Las especies del género Dunaliella han sido reconocidas como la mayor fuente natural de β-caroteno, empleado en la industria nutracéutica y farmacéutica (Gómez-Luna, 1997; Hernández-Nazario et al, 1999).
Una característica importante del género Dunaliella es la acumulación de β-caroteno como una respuesta fisiológica a condiciones estresantes durante su cultivo (Romero et al., 2008). Dichos factores estresantes incluyen aumento de la salinidad, intensidad luminosa, temperatura y/o limitación de nutrientes (Guevara et al., 2005); sin embargo, a pesar de que existe una gran cantidad de información relacionada con la producción de este compuesto, se conoce muy poco sobre la obtención de otros carotenoides que también son de importancia comercial tales como luteína, zeaxantina, astaxantina, entre otros, que tienen propiedades bioactivas (Abd El-Baky et al., 2007).
En este sentido es importante llevar a cabo investigaciones con la finalidad de establecer las condiciones óptimas que permitan alcanzar una mayor productividad de biomasa en los cultivos de diversas microalgas; la limitación de nitrógeno en el medio de cultivo, entre otros factores, puede influir en su crecimiento y composición bioquímica (Bermudez et al., 2002). Para optimizar la producción de carotenoides, no basta producir biomasa, sino que se requiere además, determinar las condiciones ambientales que estimulen su biosíntesis dentro de las células. Por lo anterior, el presente trabajo tuvo como objetivo evaluar el crecimiento, la biomasa y la producción de carotenoides en cultivos masivos de Dunaliella tertiolecta Butcher, bajo condiciones de laboratorio y al exterior, empleando medios de cultivo limitados en nitrógeno.
MATERIALES Y MÉTODOS
Selección de la muestra y diseño del cultivo. La especie seleccionada para esta investigación fue la microalga marina Dunaliella tertiolecta Butcher, proveniente del cepario del Departamento de Investigaciones Científicas y Tecnológicas de la Universidad de Sonora (DICTUS). Se utilizó un diseño factorial 2 X 4, en el cual la microalga fue cultivada en cuatro medios de cultivo los cuales consistieron en un control y tres tratamientos limitados en nitrógeno, bajo dos condiciones de cultivo (interior y exterior). Los cultivos se desarrollaron en recipientes de 20 litros de capacidad. Cada tratamiento se realizó por cuadriplicado. Los tratamientos al interior se mantuvieron con aireación, temperatura e iluminación constante; mientras que los cultivos al exterior se mantuvieron aireados y protegidos con malla sombra fuera de las instalaciones del DICTUS durante el verano.
Los medios de cultivo utilizados fueron el medio f/2 de Guillard y Ryther (1962) como medio control (nitratos: 75 g/L) (Tabla 1) y los medios f/4 (nitratos: 37,5 g/L), f/6 (nitratos: 25 g/L) y f/8 (nitratos: 18,75 g/L) como medios limitantes en nitrógeno; con una salinidad de 38‰. Los cultivos que crecieron en los cuatro medios se inocularon con un promedio de 40000 cél/mL y fueron mantenidos por 7-10 días, realizando conteos celulares diarios, y mediciones de luz (Extech Instruments), temperatura y pH (Hanna Instruments pHep). La biomasa (mg/L, pg/cél) fue determinada al final de la fase logarítmica. Los conteos celulares se llevaron a cabo con un hematocitómetro de 0,1 mm de profundidad en un microscopio compuesto usando muestras previamente fijadas con lugol al 1% (Andersen, 2005).
Tabla 1. Soluciones madre para preparar el medio de cultivo f/2. Para preparar un litro de medio, agregar 1 mL de cada una de las soluciones 1; 2,2 y 3,2 a 1 litro de agua de mar filtrada (Guillard y Ryther, 1962).
Table 1. Stock solutions to prepare f/2 medium. To prepare one liter of medium, add 1 mL of each of the solutions 1, 2.2 and 3.2 to 1 liter of filtered seawater (Guillard y Ryther, 1962).

* Las algas verdes como las del género Dunaliella al no poseer pared celular no requieren silicatos para su cultivo.
Determinación de peso seco y cenizas. La biomasa se determinó gravimétricamente por diferencia de peso entre el filtro de fibra de vidrio GFC con y sin muestra de microalga. Se filtraron 250 mL de cultivo y los filtros se secaron en una estufa convencional a una temperatura de 60 °C por 6-8 h (Sorokin, 1973). Para la determinación de cenizas se utilizó una mufla a 480 °C por 8 h, y la materia orgánica fue obtenida mediante la diferencia entre el peso seco y las cenizas, utilizando una balanza analítica (METTLER Modelo AJ100).
El peso seco en picogramos/células se determinó relacionando la biomasa seca con la concentración celular en un volumen conocido, aplicando la siguiente fórmula:
![]()
Carotenoides totales. Para la extracción de carotenoides se filtraron entre 20 y 30 mL del cultivo al final de la fase logarítmica; posteriormente los carotenoides fueron extraídos con acetona al 90% (Romero et al., 2008). La cuantificación de carotenoides totales se realizó con un espectrofotómetro (CARY 100 BIO UV-Visible Spectrophotometer), utilizando β-caroteno como estándar.
Identificación de pigmentos. La identificación de los pigmentos presentes en Dunaliella se llevó a cabo mediante HPLC de fase inversa a 450 nm, utilizando un modelo Varian 9050 equipado con un detector ultravioleta (UV-Visible), una bomba ternaria y una columna Supelcosil C18 (30 cm×4,6 mm 5-μm tamaño de partícula, Supelco, Bellefonte, PA, USA). Se utilizó una fase móvil de acetona-agua con un flujo de 1,7 mL/min y un loop de 100 μL, empleando una rampa de elusión para la identificación de pigmentos de acuerdo a Mínguez-Mosquera y Hornero-Méndez (1993). Se utilizaron cinco estándares: luteína, zeaxantina, β-caroteno, clorofila a y clorofila b.
Análisis estadístico. Los datos de la concentración celular fueron analizados con estadística descriptiva, además de realizar un análisis de varianza de dos vías (medios de cultivo y edad) para determinar las diferencias entre tratamientos en cuanto a la concentración celular, biomasa seca y pigmentos (pg/cél y mg/L). Para determinar diferencias en la producción de carotenoides bajo las dos condiciones de cultivo se utilizó la prueba de Tukey de comparación de medias (Zar, 1999).
RESULTADOS
Temperatura, iluminación y pH. La iluminación y la temperatura en los medios de cultivo al interior se mantuvieron constantes con 116 ± 8 μmoles/m2/seg y 26 ± 1 °C, respectivamente. En los cultivos al exterior la iluminación máxima promedio fue de 139 ± 22 μmoles/m2/seg y la mínima de 9 ± 2 μmoles/m2/seg, mientras que la temperatura varió de 29,1 ± 1,7 a 40 ± 3 °C. El pH tendió a incrementarse desde el inicio hasta el final del periodo de cultivo con un valor inicial de 8,7 y final de 9,0 al interior, mientras que al exterior la variación fue de 7,6 a 8,5.
Concentraciones celulares. En el interior, los medios con mayor cantidad de nitrógeno disponible presentaron un rápido crecimiento poblacional hasta el día 5 y 6, con densidades finales de 1,28 x 106 cél/mL (f/2) y 0,93 x 106 cél/mL (f/4); en los medios con mayor limitación de nitrógeno, el crecimiento poblacional fue menor, llegando a 0,56 x 106 cél/mL (f/6) y 0,47 x 106 cél/mL (f/8) (Fig. 1). Los tratamientos f/4, f/6 y f/8 fueron menores comparados con el medio control (f/2) al final de la fase logarítmica (F (3, 15) = 27,7; p<0,05) (Tabla 2).

Fig. 1. Concentraciones celulares diarias en los medios de cultivo (a) f/2, f/4, y (b) f/6, f/8 al interior.
Fig. 1. Daily cell concentrations in the culture media (a) f/2, f/4, and (b) f/6, f/8 indoor.
Tabla 2. Promedio ± desviación estándar de la concentración celular (cél/mL), peso seco, materia orgánica y carotenoides totales de los cultivos al interior y exterior en los medios f/2, f/4, f/6 y f/8 en la fase log final.
Table 2. Mean ± standard deviation of cell concentration (cell/mL), dry weight, organic matter, and total carotenoids of indoor and outdoor cultures with f/2, f/4, f/6 and f/8 at the end of the log phase.

Letras distintas indican diferencias significativas (p<0,05).
Diferent letters mean significant differences (p<0.05).
En el exterior el crecimiento poblacional fue menor en comparación con los cultivos al interior, con tendencia ascendente hasta el día 6, alcanzando 0,76 x 106 cél/mL en el medio f/2. En los medios limitantes en nitrógeno, se obtuvieron concentraciones finales de 0,72 x 106 (f/4); 0,62 x 106 (f6), y 0,65 x 106 cél/mL (f/8) (Fig. 2). No se encontraron diferencias significativas (p>0,05) entre el medio control f/2 y f/4; sin embargo, hubo diferencias (p<0,05) entre el medio control f/2 y los medios f/6 y f/8 al final de la fase logarítmica (Tabla 2).
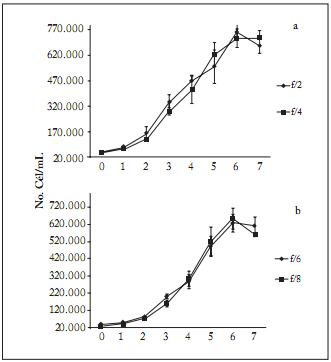
Fig. 2. Concentraciones celulares diarias en los medios de cultivo a) f/2, f/4, y b) f/6, f/8 al exterior.
Fig. 2. Daily cell concentration in the culture mediums a) f/2, f/4, and b) f/6, f/8 outdoor.
Al comparar las densidades obtenidas en la fase logarítmica final entre los medios al interior y exterior, se encontró que los del interior fueron significativamente superiores (F (3, 15) =15,19, p<0,05) (Tabla 2).
Producción de biomasa seca La producción de biomasa seca por célula en los cultivos al interior fue aumentando de 100 a 217 pg/cél, mientras que en el exterior pasó de 230 a 355 pg/cél, conforme disminuía la cantidad de nitrógeno en el medio de cultivo (Tabla 2).
Contenido de carotenoides totales. La concentración de carotenoides totales en pg/cél aumentó al ir disminuyendo la concentración de nitrógeno en el medio de cultivo en ambas condiciones; sin embargo en el exterior se encontraron las concentraciones menores (F (1, 24) = 3,54, p<0,05). En estas condiciones la menor concentración (12,77 pg/cél) se obtuvo en el medio control (f/2), mientras que el medio f/8 al interior produjo la mayor concentración de carotenoides totales (46,09 pg/cél) (Tabla 2).
Producción de pigmentos por célula. Los pigmentos más abundantes fueron la clorofila b y la luteína, en ambos casos las células produjeron mayores cantidades en los cultivos al interior (Tabla 2). La clorofila b presentó un intervalo de 16,05 pg/cél (f/2) a 42,49 pg/cél (f/8) al interior; mientras que al exterior fue de 20,16 pg/cél (f/2) a 27,51 pg/cél (f/6). La luteína varió de 5,91 pg/cél (f/4) a 10,31 pg/cél (f/6) en los cultivos al interior y de 4,99 pg/cél (f/8) a 5,66 pg/cél (f/2) en el exterior (Tabla 3). El siguiente pigmento en orden de abundancia fue el β-caroteno. Los tratamientos al interior tuvieron un intervalo de 2,83 pg/cél (f/4) a 5,57 pg/cél (f/8), mientras que los del exterior de 3,95 pg/cél (f/2) a 4,47 pg/cél (f/6). En los cultivos al exterior la limitación de nitrógeno no produjo un efecto significativo en la producción de β-caroteno (Tabla 3). La clorofila a presentó niveles de 0,42 pg/cél (f/4) a 1,81 pg/cél (f/8) en el interior y de 0,92 pg/cél (f/2) a 1,46 pg/cél (f/8) en el exterior (Tabla 3). En ambas condiciones de cultivo se observó que la limitación en nitrógeno provocó un efecto significativo en la producción de éste pigmento.
Tabla 3. Promedio ± desviación estándar de la concentración de pigmentos (pg/cél) en los medios de cultivo f/2, f/4, f/6 y f/8 al interior y exterior en la fase logarítmica final.
Table 3. Mean ± standard deviation of pigment concentrations (pg/cell) in the culture media f/2, f/4, f/6 and f/8 indoor and outdoor at the end of the log phase.

Letras distintas indican diferencias significativas (p<0,05).
Diferent letters mean significant differences (p<0.05).
La zeaxantina presentó las concentraciones mínimas en los tratamientos al interior, el intervalo varió de 0,020 pg/ cél (f/8) a 0,068 pg/cél (f/6), y en el exterior de 0,001 pg/cél (f/4) a (f/8) a 0,011 pg/cél (f/2). En los cultivos al exterior la limitación de nitrógeno no causó un efecto significativo en la producción de zeaxantina (Tabla 3).
Producción de pigmentos por unidad de volumen. La concentración celular alcanzada en la fase logarítmica final fue significativamente superior en el medio f/2 al compararlo con los medios limitados en nitrógeno; por otro lado, al comparar las condiciones al interior y al exterior, se comprobó que al interior permiten alcanzar mayores densidades celulares (Tabla 2). Sin embrago, considerando la masa seca alcanzada, se observó que el medio f/2 tiene el menor rendimiento y que los cultivos al exterior producen mayor biomasa (Tabla 2).
Las cantidades producidas de clorofila b fueron las mayores, mientras que las más bajas fueron las de Zeaxantina. Las concentraciones intermedias fueron registradas para β-carotenos y luteína, con las concentraciones más altas al interior y en el medio f/2 (Tabla 4).
Tabla 4. Promedio ± desviación estándar de la producción de pigmentos (mg/L) en los cultivos al interior y exterior en la fase logarítmica final.
Table 4. Mean ± standard deviation of pigment production (mg/L) in indoor and outdoor cultures at the end of the log phase.

Letras distintas indican diferencias significativas (p<0,05).
Diferent letters mean significant differences (p<0.05).
DISCUSIÓN
Temperatura, iluminación y Ph. Las condiciones ambientales de temperatura, pH e iluminación fueron las adecuadas para el cultivo y crecimiento de Dunaliella (Ben-Amotz y Avron, 1989; Nelson et al., 1992; Bolch, 2004). A pesar que los cultivos al exterior alcanzaron temperaturas cercanas a los 40 °C, no se presentó un aumento en la salinidad debido a que los cultivos estaban cubiertos con tapa de plástico y se mantuvieron protegidos con malla sombra para evitar las altas tasas de evaporación; además, los cultivos estuvieron expuestos aproximadamente 2 horas a estas temperaturas durante el transcurso del día para posteriormente descender alrededor de los 30 °C.
Concentraciones celulares. Fazeli et al. (2006) reportaron que con las especies D. tertiolecta y D. salina cultivadas en laboratorio bajo condiciones de estrés salino, se obtuvieron concentraciones celulares entre 0,24 y 1,85 x 106 cél/mL, las cuales son similares a las obtenidas en el presente estudio. Por otro lado se ha documentado que la deficiencia de nitrógeno limita el crecimiento poblacional de las microalgas, las cuales presentan densidades bajas durante su cultivo (García-González et al., 2001; Hosseini y Shariati, 2009), como ocurrió en el presente estudio con D. tertiolecta.
La densidad celular al interior fue mayor que al exterior, debido a que al interior las condiciones de temperatura e iluminación fueron constantes, mientras que al exterior fueron variables, sobre todo en la intensidad de luz. Vásquez-Suárez et al. (2007) encontraron que Dunaliella salina cultivada al exterior bajo condiciones naturales durante el verano alcanzó una concentración de 0,36 x 106 cél/mL, similar a los alcanzados en esta investigación; sin embargo, reportaron concentraciones aun mayores para otra cepa de esta misma especie (1,6 x 106 cél/mL), mientras que para las microalgas Dunaliella bardawil y D. viridis reportaron concentraciones de 2 y 3,9 x 106 cél/mL, respectivamente. Esto indica que no todas las cepas de Dunaliella, poseen la capacidad de responder de forma similar a las mismas condiciones de cultivo (Borowitzka y Borowitzka, 1988).
Producción de biomasa seca. A pesar que las condiciones de verano son extremas, con temperaturas elevadas, se tuvo una cantidad de biomasa seca de hasta un 49,5% mayor al exterior que en condiciones controladas al interior. López-Sánchez (1999) estudió la variación estacional de la producción de biomasa en cultivos de dos especies de microalgas (Dunaliella y Chaetoceros), en laboratorio e invernadero, encontrando en Dunaliella que los valores de biomasa seca fueron similares a los reportados en esta investigación para el medio control, pero inferiores a los medios f/4, f/6 y f/8.
Fimbres-Olivarría et al. (2010), encontraron que la producción de biomasa de Dunaliella sp. aumentó conforme disminuyó la cantidad de nitrógeno en el medio de cultivo. Autores como Tillberg y Rowley (1989) y Said (2009), que estudiaron el efecto de la limitación de fósforo en el medio de cultivo en las especies Scenedesmus y D. parva, respectivamente, observaron que esta condición provoca cambios morfológicos, y un incremento en el tamaño celular. Es posible que la viabilidad de ciertos nutrientes como lo es en nitrógeno, tenga un efecto sobre rutas anabólicas de las microalgas.
Contenido de carotenoides totales. La cantidad de carotenoides totales fue aproximadamente el 47% menor al exterior que al interior; sin embargo, debido a que la producción en biomasa fue mayor al exterior, la cosecha de los carotenoides fue similar en ambos tratamientos, aunque mayor a concentraciones más limitantes de nitratos. En resultados obtenidos por Serpa-Ibáñez y Calderón-Rodríguez (2005), al analizar la concentración de carotenoides en cuatro cepas de D. salina cultivadas a cuatro salinidades, reportaron valores muy por debajo (2,5 - 17,8 pg/cél) de los obtenidos en esta investigación. Otros autores como Fazeli et al. (2006) reportaron concentraciones de carotenoides desde 0,9 hasta 8,5 pg/cél s en dos especies de Dunaliella expuestas a condiciones de estrés salino. Cifuentes et al. (1996), al cultivar Dunaliella salina en diferentes medios bajo condiciones de laboratorio, reportaron concentraciones similares a las obtenidas en esta investigación, con valores de 42 a 79 pg/cél utilizando un medio de cultivo natural enriquecido con una baja concentración de nitratos y de 11 a 38 pg/cél en un medio con una mayor concentración de nitratos.
La cantidad y forma química del nitrógeno influye en la producción de carotenoides. En 2006, Serpa-Ibáñez y Calderón-Rodríguez evaluaron el efecto de diferentes fuentes de nitrógeno en el contenido de carotenoides de cuatro cepas de Dunaliella salina, reportando diferencias significativas atribuidas a la forma química biodisponible para las algas.
Producción de pigmentos por célula. La concentración de clorofila b en los medios de cultivo al interior aumentó en relación inversa con la cantidad de nitrógeno en el medio. Serpa-Ibáñez y Calderón-Rodríguez (2005) analizaron el efecto del estrés por salinidad en cuatro cepas de D. salina, encontrando concentraciones de clorofila b entre 2,7 y 6,03 pg/cél; estos valores son menores si se les compara con los obtenidos en este trabajo tanto al interior como al exterior.
En los cultivos al exterior la limitación de nitrógeno no produjo un efecto significativo en la producción de luteína. La cantidad más alta de luteína y clorofila b se explica debido a que estos pigmentos son los más abundantes y característicos de las clorofitas (Jodlowska y Latala, 2003).
Las concentraciones obtenidas en el presente estudio de β-carotenos, se encuentran dentro de los valores reportados por Romero et al. (2008), quienes cuantificaron los carotenoides totales y β-caroteno presentes en dos cepas de D. salina.
Fazeli et al. (2006) reportaron concentraciones de clorofila a de 0,96 pg/cél para D. tertiolecta y de 1,91 para D. salina cultivadas bajo condiciones de estrés salino (NaCl: 1,5 M) e iluminación de 150 μmol/m2s; estos valores concuerdan con los encontrados en este trabajo.
Producción de pigmentos por unidad de volumen. Al relacionar las densidades celulares (cél/L) con la cantidad de pigmentos producidos en cada célula (pg/cél), se obtiene el rendimiento neto de pigmentos por unidad de volumen. En términos de productividad ésta variable indica el medio de cultivo más adecuado y las mejores condiciones para la producción de pigmentos. Bajo este enfoque, el mejor medio de cultivo fue el f/2 al interior, con rendimientos de 0,03 mg/L de zeaxantina, 9,19 mg/L de luteína, 19,56 mg/L de clorofila b, 1,62 mg/L de clorofila a y 5,40 mg/L de β-caroteno.
Por otro lado, al comparar la productividad del medio f/2 al interior con f/2 al exterior se estimó que el mismo medio de cultivo produce entre 2,12 y 6 veces más dependiendo del pigmento.
A pesar que el número de células es mayor en el medio f/2 al interior, la biomasa es menor en comparación con los cultivos crecidos en medios limitados. Estos resultados parecieran contradictorios, sin embargo reflejan que las células sujetas a estrés por carencia de nitrógeno, tienden a ser de mayor tamaño. Tillberg y Rowley (1989) y Said (2009) describieron éste fenómeno en Scenedesmus y Dunaliella parva cuando fueron cultivadas en medios carentes de fósforo. Es posible también que al disminuir la división celular debido a la falta de determinados nutrientes, la menor densidad y mayor espacio dentro del medio de cultivo, tenga un efecto positivo sobre la ganancia de biomasa de las microalgas.
En términos prácticos, las células con mayor cantidad de carotenoides podrían tener un mayor potencial en el mercado para consumo humano, a pesar que presenten un menor crecimiento, ya que se trata de un producto con altos contenidos de carotenoides en un volumen relativamente pequeño. No obstante, esta hipótesis deberá ser probada en futuros experimentos.
En conclusión, la concentración de carotenoides aumentó cuando Dunaliella tertiolecta fue cultivada en un medio limitado en nitrógeno, pero disminuyó considerablemente su densidad poblacional, mientras que al comparar entre las dos condiciones de cultivo se encontró que son mayores al interior que al exterior.
REFERENCIAS
1. Abd El-Baky, H.H., F.K. El Baz y G.S. El-Baroty (2007). Production of Carotenoids from Marine Microalgae and its Evaluation as Safe Food Colorant and Lowering Cholesterol Agents. American-Eurasian Journal of Agriculture and Environmental Science 2: 792-800. [ Links ]
2. Andersen, R.A. (2005). Algal culturing techniques. Elsevier Academic Press. USA. 578 p. [ Links ]
3. Ben-Amotz, A. y M. Avron (1989). The biotechnology of mass culturing Dunaliella for products of commercial interest. En: Creswell, R. C., Rees, T. A. & Shah, N. (eds), pp. 90-114. Algal and Cyanobacterial Biotechnology Longman Scientific and Technical Press U.K. [ Links ]
4. Bermudez, J.L., C. Lodeiros y E. Morales (2002). Biomass production of the marine microalga Chroomonas sp. as a function of pH, luminic intensity, and salinity. Boletín de Investigaciones Marinas y Costeras 31: 167-185. [ Links ]
5. Bolch, C. (2004). Lecture notes: KQA 201-Intensive Algal Culture. School of Aquaculture, University of Tasmania, Launceston, Australia, pp. 1-4. [ Links ]
6. Borowitzka, M.A. y L.J. Borowitzka (1988). Dunaliella. En: Borowitzka, M.A. y Borowitzka, L. J. (eds), pp. 27-58. Micro-algal biotechnology. Cambridge Univ. Press, Cambridge, New York, USA. [ Links ]
7. Cifuentes, A.S., M. González, O. Parra y M. Zúñiga (1996). Cultivo de cepas de Dunaliella salina (Teodoresco 1905) en diferentes medios bajo condiciones de laboratorio. Revista Chilena de Historia Natural 69: 105-112. [ Links ]
8. Fazeli, M.R., T. Hossein, S. Nasrin y J. Hhossein (2006). Carotenoids acumulation by Dunaliella tertiolecta (Lake Urmia isolate) and Dunaliella salina (ccap 19/18 & wt) under stress conditions. Journal of Biological Sciences 14: 146-150. [ Links ]
9. Fimbres-Olivarría D., L.R. Mercado Castillo, A. Murguía López, J.A. López Elías (2010). Crecimiento y biomasa de Dunaliella sp. cultivada en medios limitantes en nitrógeno. BIOtecnia 12: 58-66. [ Links ]
10. García-González, M., J.C. Manzano, J. Moreno y M.G. Guerrero (2001). Biotecnología del cultivo de Dunaliella salina en el litoral andaluz. Junta de Andalucía, Pesca y Acuicultura. 160 p. [ Links ]
11. Gómez-Luna, L.M. (1997). Cultivo y aplicación de las microalgas Dunaliella salina y Chlorella vulgaris en Cuba. Tesis de Doctorado. Universidade da Coruña. 231 p. [ Links ]
12. Guevara, M., C. Lodeiros y O. Gómez (2005). Carotenogénesis de cinco cepas del alga Dunaliella sp. (Chlorophyceae) aisladas de lagunas hipersalinas de Venezuela. Revista de Biología Tropical 53: 331-337. [ Links ]
13. Guillard, R.L. y J.H. Ryther (1962). Studies on marine planktonic diatoms I. Cyclotella nana Husted and Detonula confervacea (Cleve) Gran. Canadian Journal of Microbiology 8: 229-239. [ Links ]
14. Hernández-Nazario, L., M.M. Quintana-Cabrales, H. Morris-Quevedo y M. Fernández-González (1999). Contenido de algunas vitaminas en cultivos de microalga Chlorella sp. Revista Cubana de Alimentación y Nutrición 13: 9-13. [ Links ]
15. Hosseini Tafreshi, A. y M. Shariati (2009). Review Article: Dunaliella biotechnology: methods and applications. Journal of Applied Microbiology 107: 14-35. [ Links ]
16. Jodlowska, S. y S. Latala (2003). Simultaneous Separation of Chlorophylls and Carotenoids by RP-HPLC in Some Algae and Cyanobacteria from the Southern Baltic. Oceanological and Hydrobiological Studies 32: 81-89. [ Links ]
17. López-Sánchez, A.L. (1999). Variación estacional de la producción de biomasa y de la calidad de la composición bioquímica de dos especies de microalgas cultivadas en laboratorio e invernadero. Tesis de Licenciatura. Departamento de Ciencias Químico Biológicas. Universidad de Sonora. 123 p. [ Links ]
18. Mínguez-Mosquera, M.I. y D. Hornero-Mendez (1993). Separation and quantification of the carotenoid pigments in red peppers (Capsicum annum L.), paprika, and oleoresin by reversed-phase HPLC. Journal of Agricultural and Food Chemistry 41: 1616-1620. [ Links ]
19. Nelson, J.R., S. Guarda, L.E. Cowell y P.B. Heferman (1992). Evaluation of microalgal clones for mass cultura in a subtropical greenhouse bivalve hatchery: growth rates and biochemical composition at 30 °C. Aquaculture 106: 357-377. [ Links ]
20. Rao, R.A., R. Sarada, V. Baskaran y G.A. Ravishankar (2006). Antioxidant Activity of Botryococcus braunii Extract Elucidated in Vitro Models. Journal of Agricultural and Food Chemistry 54: 4593-4599Links ] Helvetica, sans-serif">.
21. Romero, L., M. Guevara, H. D'Armas y C. Lodeiros (2008). Cuantificación de Carotenoides Totales y β-caroteno en dos Cepas de Dunaliella salina (Chlorophyta, Vovlocales) Aisladas de Lagunas Hipersalinas de Venezuela. Boletín del Instituto Oceanográfico de Venezuela 47: 67-76.
22. Said, H.S. (2009). Changes in levels of cellular constituents of Dunaliella parva associated with inorganic phosphate depletion. Middle-East Journal of Scientific Research 4: 94-99. [ Links ]
23. Serpa-Ibáñez, R.F. y A. Calderón-Rodríguez (2005). Efecto del estrés por salinidad en cuatro cepas de Dunaliella salina Teod. en el Perú. Ecología Aplicada 4: 127-133. [ Links ]
24. Serpa-Ibáñez, R.F. y A. Calderón-Rodríguez (2006). Efecto de diferentes fuentes de nitrógeno en el contenido de carotenoides y clorofila de cuatro cepas peruanas de Dunaliella salina Teod. Ecología Aplicada 5: 93-99. [ Links ]
25. Sorokin, C. (1973). Dry weight, packed volume and optical density. En: Stein, J. R. (ed), pp. 448. Handbook of Physiological Methods. Culture Methods and Growth Measurement. Cambridge University, Press. Cambridge. [ Links ]
26. Tillberg, J.E. y J.R. Rowley (1989). Physiological and structural effects of phosphorus starvation on the unicellular green alga Scenedesmus. International Journal for Plant Biology 75: 315-324. [ Links ]
27. Vásquez-Suárez, A., M. Guevara, G. Salazar, B. Arredondo-Vega, R. Cipriani, N. Lemus y C. Lodeiros (2007). Crecimiento y composición bioquímica de cuatro especies de Dunaliella para ser utilizadas en acuicultura. Boletín del Centro de Investigaciones Biológicas 41: 181-194. [ Links ]
28. Zar, J.H. (1999). Bioestadisical Analysis, 4th ed. Prentice-Hall, Englewood Cliffs, New Jersey. 663 p. [ Links ]














