Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.83 no.1 Vicente López jun. 2014
ARTÍCULOS ORIGINALES
Carotenoides, capacidad antioxidante y compuestos volátiles del aroma durante la maduración de jitomate
Carotenoid content, antioxidant capacity and volatile compounds of the aroma during tomato ripening
López-Vidal1 O, H Escalona-Buendía2, C Pelayo-Zaldívar2, J Cruz-Salazar1, JM Villa-Hernández1, F Rivera-Cabrera1, O Villegas-Torres3, I Alia-Tejacal3, L J Pérez-Flores1, F Díaz de León-Sánchez1
1 Departamentos de Ciencias de la Salud. Universidad Autónoma Metropolitana. Av. San Rafael Atlixco 186, Col. Vicentina, C.P. 09340, Iztapalapa, D.F. México.
2 Departamento de Biotecnología. Universidad Autónoma Metropolitana. Av. San Rafael Atlixco 186, Col. Vicentina, C.P. 09340, Iztapalapa, D.F. México.
Address Correspondence to: F Díaz de León-Sánchez, e-mail: fdls@xanum.uam.mx
Recibido / Received 26.I.2013.
Aceptado / Accepted 22.XII.2013.
Resumen. El jitomate acumula altos niveles de carotenoides durante su maduración. Éstos, además de su función como pigmentos, nutrientes y antioxidantes, son precursores de algunos compuestos volátiles importantes en el aroma de estos frutos. Por ello, en este trabajo se estudió la capacidad antioxidante, los niveles de licopeno y ß-caroteno y la producción de sustancias aromáticas provenientes de la vía de carotenoides en frutos de jitomate de la variedad 7705, en diferentes estados de maduración. Los resultados mostraron un aumento significativo (p<0,05) de licopeno y ß-caroteno (22,1 y 2,9 veces, respectivamente) desde el estado de madurez verde al rompiente. Entre los estados de madurez naranja y rojo, los niveles de licopeno se incrementaron y los de ß-caroteno disminuyeron. En relación a la capacidad antioxidante se observó un incremento de 1,6 veces desde el estado de madurez verde al rompiente, sin observarse cambios entre los estados naranja y rojo. La mayor capacidad antioxidante observada en las últimas etapas de maduración se correlacionó con la acumulación de los pigmentos licopeno y ß-caroteno que participan en diversos mecanismos antioxidantes. Por otra parte, en los niveles de los volátiles del aroma de jitomate provenientes del metabolismo de carotenoides, se observó un incremento significativo (p<0,05) de 4,7 veces para 6 metil-5-hepten-2-ona, de 3,8 veces para la ß-damascenona y de aproximadamente 2 veces para la ß-ionona y la geranilacetona en el estado de madurez rojo en comparación con el estado verde. El aumento observado en los volátiles podría ser explicado debido a que en los dos últimos estados de madurez (naranja y rojo) se acumulan los precursores licopeno y ß-caroteno, a partir de los cuales se sintetizan los apocarotenoides volátiles aquí estudiados.
Palabras clave: Solanum lycopersicum; Licopeno; ß-caroteno; Capacidad antioxidante; Carotenoides.
Abstract. During ripening, tomato fruit accumulates high levels of carotenoids. These compounds, besides their function as pigments, nutrients and antioxidants, are precursors of some important volatile compounds for the development of the characteristic aroma of these fruits. In the present work, the antioxidant capacity, lycopene and ß-carotene levels, and the production of aromatic substances derived from the carotenoid biosynthetic pathway were analyzed in the tomato cultivar 7705 at different ripening stages. Results showed a significant (p<0.05) increase of lycopene and ß-carotene (22.1 and 2.9 fold, respectively) from the mature green to the breaker stage. Lycopene levels increased and those of ß-carotene decreased from the light red to the red ripening stages. There was a 1.6 fold increase of the antioxidant capacity from the mature green to the breaker stage, with no changes between the light red to the red stage. The highest antioxidant capacity observed in the last stages of ripening correlated with the accumulation of lycopene and ß-carotene pigments which participate in several antioxidant mechanisms. On the other hand, levels of the volatile compounds of the tomato aroma derived from the carotenoid metabolism signifcantly increased (p<0.05) in red tomatoes compared to mature green fruits (4.7 fold for 6-methyl-5-hepten-2-one, 3.8 fold for damascenone and approximately twicefold for ß-ionone and geranyl acetone). The increase in the volatile compoundss might be explained by the lycopene and ß-carotene accumulation in the last ripening stages (light red and red), which are the precursors of the volatile apocarotenoids.
Keywords: Solanum lycopersicum; Lycopene; ß-carotene; Antioxidant capacity; Carotenoids.
INTRODUCCIÓN
El jitomate (Solanum lycopersicum) es una hortaliza popular en todo el mundo cuya producción se incrementa año a año. Su popularidad se debe principalmente a su color atractivo, su valor nutricional, su aroma y su versatilidad de uso. Durante 2011, la producción mundial de jitomate fue de 159 millones de toneladas, siendo México el décimo productor (FAOSTAT 2011).
La mayoría de los trabajos de investigación en jitomate se han enfocado en analizar y seleccionar variedades con características de calidad visualmente atractivas (ej., tamaño, color, textura). Por otra parte, se han efectuado pocos estudios acerca de las características relacionadas con su sabor y aroma (Baldwin et al., 1991). En los últimos años, in embargo, se ha observado una tendencia mundial a pagar un mayor precio por aquellos productos con un mejor sabor y aroma (Bruhn et al., 1991). En este sentido, Kader (2003, 2008) mencionó que el primer atributo de calidad que se pierde durante el almacenamiento es el aroma.
El sabor del jitomate se debe tanto a la interacción entre los azúcares y los ácidos orgánicos como a la presencia de aproximadamente 400 compuestos volátiles (Baldwin et al., 2000). Los azúcares como la glucosa y la fructosa, así como los ácidos orgánicos (ej., ácido cítrico) son percibidos por receptores de la lengua. Por otra parte, los compuestos volátiles son detectados por receptores del sistema olfatorio nasal. La contribución de los compuestos volátiles al sabor aún no se conoce bien (Mathieu et al., 2009).
La sensibilidad humana a los compuestos volátiles varía enormemente, y se ha propuesto que el impacto de un compuesto volátil sobre el sabor está determinado tanto por su concentración como por su umbral de olor (Baldwin et al., 2000). Basado en estos factores, se han identificado un conjunto de aproximadamente 30 compuestos volátiles que contribuyen de manera significativa al aroma del jitomate, y a los que se les denomina volátiles de impacto (Mathieu et al., 2009). Una combinación en proporciones apropiadas de estos compuestos produce el aroma típico del jitomate maduro fresco (Baldwin et al., 2000). Los compuestos volátiles se sintetizan a partir de lípidos, aminoácidos, carotenoides, ligninas y terpenos (Lewinsohn et al., 2005).
Los carotenoides son constituyentes importantes del aroma de flores y frutos (Bramley, 2002; Lewinsohn et al., 2005). Los apocarotenoides son terpenos derivados del rompimiento oxidativo de los carotenoides, y se encuentran entre los compuestos volátiles de impacto del aroma de jitomate (Mathieu et al., 2009). El aroma de los apocarotenoides cíclicos como la ß-ionona y la ß-damascenona se describe como floral/frutal; los humanos somos muy sensibles a estos volátiles, a pesar de que su concentración es muy baja (White, 2002). Los apocarotenoides lineales como la 6-metil-5-hepten-2-ona y la geranilacetona también se caracterizan por notas aromáticas frutal/floral, aunque sus umbrales de olor son significativamente superiores a los de los apocarotenoides cíclicos (White, 2002). Tanto los apocarotenoides cíclicos como los lineales de jitomate se generan directamente de los carotenos por la actividad enzimática de dos dioxigenasas: LeCCD1A y LeCCD1B (Klee, 2010). Se han estudiado los volátiles del aroma de frutos de líneas de introgresión de S. Penneli y S. Lycopersicum, observándose que los volátiles derivados de carotenoides se acumulan en las etapas finales de maduración (Tieman et al., 2006).
Las plantas, al igual que todos los organismos aerobios, producen especies reactivas de oxígeno (ERO) (Vranova et al., 2002) en distintos compartimentos celulares como resultado de reacciones de diferentes rutas metabólicas (Rinalducci et al., 2008). Los organismos aerobios han desarrollado sistemas antioxidantes enzimáticos y no enzimáticos, que en conjunto mantienen las ERO en bajas concentraciones. De esta manera se protege a las células del daño que pueden causar dichas especies reactivas de oxígeno a las biomoléculas, permitiendo su función como moléculas de señalización en procesos de desarrollo (Shao et al., 2008).
La maduración de frutos se ha descrito como un proceso oxidativo en frutos climatéricos como el jitomate (Brennan y Frenkel, 1977; Rogiers et al., 1998; Jiménez et al., 2002). Como resultado, se considera que las ERO y los sistemas antioxidantes están involucrados en el proceso de maduración.
El jitomate contiene diferentes clases de sustancias con propiedades antioxidantes tales como los carotenoides, particularmente el licopeno, la vitamina C, los fenoles y los tocoferoles (Beecher, 1997). El licopeno es el principal carotenoide presente en el jitomate, constituyendo más del 80% del total de estos compuestos en el estado de maduración rojo, y es el responsable de su color característico (Nguyen y Schwartz, 1999). En los últimos años, se ha reportado la importancia del consumo de jitomate en la salud humana, por el papel relevante del licopeno en la prevención de ciertos tipos de cáncer, especialmente el de próstata (La Vecchia, 1997; Nguyen y Schwartz, 1999; Giovannuci, 2005).
Un parámetro importante que determina el valor nutricional de un fruto como alimento funcional es su capacidad antioxidante, es decir, su capacidad para secuestrar o prevenir la formación de radicales libres, disminuyendo así el daño por estrés oxidante (Zanfni et al., 2010). Existen diferentes maneras de cuantificar la capacidad antioxidante total, dependiendo de los compuestos antioxidantes predominantes presentes. El ensayo de DPPH (2,2-difenil-2-picril-hidracilo) es un método simple y exacto para determinar la capacidad antioxidante en extractos vegetales (Mahattanatawee, 2006).
Por otra parte, Abushita et al. (1997) reportaron que la cantidad de moléculas antioxidantes en los frutos de jitomate puede ser afectada por diversos factores tales como la ubicación geográfica y los factores ambientales durante el cultivo, la época de cosecha, las condiciones de almacenamiento, y el estado de maduración en el cual se encuentran los frutos.
La relación entre la producción de compuestos volátiles, carotenoides y la capacidad antioxidante durante la maduración de consumo del jitomate no está bien entendida. El objetivo del presente trabajo fue determinar los niveles de licopeno y ß-caroteno, la capacidad antioxidante y la producción de compuestos volátiles del aroma provenientes de la vía de carotenoides en el jitomate saladette variedad 7705, cosechado en diferentes etapas de maduración.
MATERIALES Y MÉTODOS
Material biológico. Se utilizaron frutos de jitomate saladette de la variedad 7705 provenientes del estado de Hidalgo, que fueron cultivados en invernaderos comerciales. Los frutos se cosecharon el mismo día del inicio del experimento seleccionándolos visualmente en los estados de madurez verde, rompiente, naranja y rojo según la Tabla de Estados de Maduración (Cantwell, 2012). Se seleccionaron 30 frutos de jitomate en cada etapa de maduración, de los cuales se tomaron dos lotes independientes de 15 frutos. El primer lote se utilizó para determinar los parámetros de calidad y del segundo se extrajo el jugo y el pericarpio para realizar las determinaciones de los parámetros bioquímicos. La unidad experimental fue la mezcla homogénea de 5 frutos de cada uno de los estados de maduración con tres repeticiones. Las muestras de jitomate (tejido de pericarpio y jugo) se congelaron con N2 líquido y se almacenaron a -70 °C hasta su posterior uso.
Determinación de parámetros de calidad. Para la determinación de color se utilizó un colorímetro ColorFlex 45/0 (HunterLab, 114 Sunset Hills Road, Reston, VA 20190). Se determinaron los tres parámetros que definen el color: luminosidad (L*), cromaticidad o saturación (C*) y tinte o matiz (h). La firmeza se determinó en los mismos frutos utilizados previamente para determinar los parámetros de color. Para ello, se utilizó un penetrómetro (Efe-Gi, Milan, Italy), midiéndose la fuerza en kg necesaria para que el punzón penetrara el pericarpio, en tres diferentes puntos del fruto. Posteriormente, los kg fuerza fueron transformados a Newtons (N). Los sólidos solubles totales (SST) se determinaron utilizando un refractómetro manual (Atago Co. Ltd, Tokyo, Japan). Para la determinación se tomó una gota de jugo y se colocó en el refractómetro, previamente calibrado con agua destilada. Para la determinación de la ácidez titulable (AT) se tomó una alícuota de 4 mL del extracto de jugo de jitomate y se añadieron 20 mL de agua bidestilada más 2 gotas de fenolftaleína (0,1% v/v). Se homogeneizó con agitación constante y se tituló con NaOH a 0,1 N hasta que la mezcla viró a color rosa, calculándose el porcentaje de ácido cítrico, el ácido más abundante en jitomate, con los mL de NaOH gastados.
Determinación de los niveles de licopeno y ß-caroteno. Se obtuvo el jugo de 7,5 g de tejido (pericarpio) de cada uno de los estados de maduración, utilizando un exprimidor de cítricos comercial y filtrándolo con organza. Se tomaron 3 mL del jugo obtenido que se homogeneizaron con 0,0025 g de butilhidroxitolueno (BHT), y se colocaron en un matraz Erlenmeyer de 25 mL cubierto con papel aluminio para prevenir la fotooxidación. Posteriormente, se agregaron 10 mL de la siguiente mezcla de disolventes (Hexano/Acetona/Etanol 50:25:25, v/v/v) y se agitó por 15 min a 20 °C utilizando un orbital shaker (Lab Line-Instruments, Inc., Melrose Park, Ill. USA). Se agregaron 1,5 mL de agua y se agitó nuevamente por 5 min. De las capas formadas, se extrajo la capa superior de hexano que contiene el licopeno y el ß-caroteno utilizando una pipeta Pasteur. Esta capa fue colocada en un matraz aforado de 10 mL cubierto con papel aluminio. Se realizó una segunda extracción del residuo con el mismo procedimiento. Las dos fases orgánicas recuperadas se mezclaron y se aforaron a 10 mL con hexano. Posteriormente, se tomaron 2 mL de las muestras de hexano y se filtraron utilizando filtros de 0,45 ìm (Gelman Acrodis TM GHP No.13, Pall Corporation, Exton, PA). Luego se inyectaron a un cromatógrafo de líquidos de alta resolución (HPLC Waters 600, Milford, MA., USA) equipado con un detector de arreglo de fotodiodos (Waters 2996, Milford, MA., USA). Se utilizó una columna Phenomenex C18 (2) 100A con 150 x 4.6 mm, 5 µm y una precolumna Phenomenex C18 de 5 µm (Phenomenex Inc. Torrance, CA. USA). Se realizaron corridas isocráticas con una velocidad de flujo de 0,5 mL/min, utilizando como fase móvil una mezcla de acetonitrilo/metanol/diclorometano 43:43:14 v/v/v. Las concentraciones de licopeno y de ß-caroteno de las muestras de jitomate se cuantificaron utilizando curvas patrón elaboradas con estándares comerciales (Sigma-Aldrich, St. Louis, MO, USA).
Capacidad antioxidante. La determinación de la capacidad antioxidante se basó en la evaluación de la capacidad del extracto de jugo de jitomate para secuestrar radicales libres de acuerdo al método descrito por Brand-Williams et al. (1995). Este método el cual utiliza una solución de DPPH (2,2-difenil-2-picril-hidracilo) 0,6 mM en metanol. Se utilizaron diferentes diluciones del jugo (1:1 o 1:10) con metanol al 80% (v/v). La mezcla de reacción contenía 50 mL de ácido ascórbico o de jugo de jitomate y 950 mL de la solución de DPPH. La capacidad antioxidante fue medida como la disminución de la absorbancia a 515 nm. Los resultados fueron expresados como la capacidad antioxidante en equivalentes de ácido ascórbico mM (CAEA).
Cuantificación de los compuestos volátiles del aroma de jitomate. Para el aislamiento, separación y cuantificación de los componentes volátiles del jugo de jitomate se utilizó la técnica de microextracción en fase sólida (SPME por sus siglas en inglés Solid Phase Micro Extraction), la cual permite un muestreo rápido. Se colocaron 3 mL de muestra de jugo de jitomate en un vial de vidrio de 10 mL y se mezclaron con 2 g de NaCl y 40 µL de una solución de nonanol (50 ppm) como estándar interno. El vial fue cerrado con un septo y sellado herméticamente. Se agitó durante un minuto en un vórtex y se colocó en una parrilla multiblock para mantenerlo a una temperatura constante de 35 °C. Se insertó una fibra para SPME de 50/30 µm DVB-CAR-PDMS (Supelco Bellefonte, PA, USA) dentro del vial y se expuso durante 10 min en el espacio de cabeza para adsorber y concentrar los aromas presentes. Finalmente, la fibra fue desorbida térmicamente a 250 °C durante 5 min en el inyector del cromatógrafo de gases.
El análisis de los compuestos volátiles del aroma del jitomate se realizó en un cromatógrafo de gases (Hewlett Packard 5800 serie II, Palo Alto, USA) utilizando una columna D-B-WAXTER, con una longitud de 60 m, 0,32mm de diámetro interno y 1 mm de fase estacionaria (J & W Scientific. Folson, USA), y un detector de ionización de fama (FID). Se utilizó el siguiente programa de temperatura: inicio a 60 °C durante 90 min; posteriormente se incrementó a 230 °C a razón de 2°C/min manteniendo esta temperatura durante 15 min. Las temperaturas del inyector y del detector fueron de 250 y 280°C, respectivamente. La identificación de los compuestos del aroma (6-metil-5-hepten-2-ona, geranilacetona, ß-ionona y la ß-damascenona) se hizo por comparación con estándares químicos comerciales.
Análisis estadístico. Para el análisis estadístico de los datos se usó el programa Statgraphics Plus para Windows 4.0 (StatPoint Inc., Herndon, USA). Cada variable de respuesta fue expuesta a un análisis de varianza simple, considerando el estado de madurez como factor de estudio en cuatro niveles: verde, rompiente, naranja y rojo. Cuando hubo diferencias significativas (p=0,05), se realizaron pruebas de comparación múltiple de Tukey (a=0,05).
RESULTADOS Y DISCUSIÓN
Parámetros de calidad. Los resultados obtenidos mostraron que el ángulo hue (h) y la luminosidad (L*) disminuyeron significativamente (p<0,05) a medida que el estado de madurez del jitomate cambió de verde a rojo (Tabla 1). No se observaron diferencias significativas (p>0,05) en la cromaticidad (C*) en ninguno de los estados de maduración estudiados.
Tabla 1. Parámetros de calidad durante la maduración de jitomate 7705.
Table 1. Quality parameters during ripening in tomato '7705'.
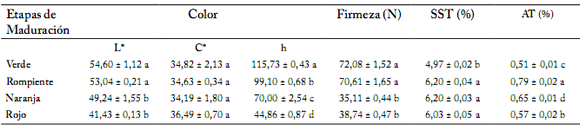
Cada valor es la media de tres repeticiones ± error estándar. Valores seguidos por letras diferentes indican diferencias significativas de acuerdo a la comparación múltiple de Tukey (a=0,05).
La firmeza disminuyó conforme los frutos fueron madurando (Tabla 1). Sin embargo, no se encontraron diferencias significativas entre los estados de madurez verde y rompiente ni entre los estados naranja y rojo. Se observó que la mayor disminución (49,7%) ocurrió entre los estados de maduración rompiente y naranja (Tabla 1).
Conforme avanzó la maduración, los SST de la variedad 7705 aumentaron significativamente (p<0,05) entre los estados verde y rompiente, y no se observaron diferencias significativas (p>0,05) entre los estados de madurez rompiente naranja y rojo. Por su parte, la AT se incrementó significativamente (p<0,05) entre los estados de maduración verde y rompiente, disminuyendo posteriormente de manera significativa entre los estados rompiente y rojo (Tabla 1). Estos resultados coinciden con lo reportado para jitomates de las variedades V.R. Moscow, Walter y Río Grande por Dalalet al. (1965) y Zambrano et al. (1996).
Niveles de licopeno y ß-caroteno. Durante la última década, se ha reportado que el licopeno previene el desarrollo de algunos tipos de cáncer, principalmente el de próstata, y de enfermedades cardiovasculares. Debido a esto, el consumo de jitomate y de sus productos derivados en la dieta es importante (La Vecchia, 1997; Nguyen y Schwartz, 1999; Giovannuci 2005). Los niveles de licopeno determinados [en gramos de peso fresco (g PF)] en los frutos de jitomate en estado de maduración verde fueron de 6,4 µg/g PF. Posteriormente, se observó un incremento significativo (p<0,05), alcanzando niveles de 142,8 µg/g PF en el estado rompiente. Estos niveles se mantuvieron en el estado naranja y aumentaron nuevamente (p<0,05) en el estado rojo, alcanzando 236,75 µg/g PF. Es importante resaltar que los niveles de licopeno se incrementaron en promedio 36,7 veces del estado de madurez verde al estado de madurez rojo (Fig. 1A).
Fig. 1. Niveles de licopeno (A) ß-caroteno (B) y capacidad antioxidante total (C) durante la maduración del jitomate '7705'. Los resultados en (C) son expresados como capacidad antioxidante en equivalentes de ácido ascórbico (CAEA) mM/mL. Cada valor es la media de tres repeticiones ± error estándar. Valores seguidos por la misma letra no son diferentes de acuerdo a la comparación múltiple de Tukey (ß=0,05).
Fig. 1. Levels of lycopene (A), ß-carotene (B) and antioxidant capacity (C) during ripening of tomato '7705'. Results in (C) are expressed as ascorbic acid equivalent antioxidant capacity (AEAC) mM/mL. Values are the mean of three replicates ± standard error. Values followed by the same letter are not significantly different according to the Tukey's multiple comparison (ß=0.05).

Los niveles de ß-caroteno fueron de 0,8 µg/g PF en los jitomates en el estado de madurez verde. En los estados de madurez rompiente y naranja se observó un aumento significativo de 2,7 veces, alcanzando en promedio niveles de 2,27µg/g PF. Sin embargo, no se encontraron diferencias significativas entre estos dos estados. Posteriormente, los niveles deß-caroteno disminuyeron significativamente a 1,52 µg/g PF en el estado de madurez rojo (Fig.1B).
La mayor acumulación de licopeno y ß-caroteno ocurrió entre las etapas de maduración verde y rompiente (Fig. 1A y 1B). Estos resultados coinciden con el aumento en licopeno observado por Liu et al. (2012) en jitomates cv. Zhenfen 202, cosechados en estado de maduración verde y madurados a 20 °C. Mientras los niveles de licopeno (Fig. 1A) aumentaron durante todo el proceso de maduración del jitomate, los niveles del ß-caroteno presentaron un pico en los estados de madurez rompiente y naranja, y luego disminuyeron en el estado de maduración rojo (Fig. 1B). En la ruta de biosíntesis de los carotenoides, el licopeno es el precursor inmediato delß-caroteno. Los resultados obtenidos en el presente estudio podrían explicarse por la regulación diferencial de la expresión génica de la enzimas que participan en esta vía metabólica observada por Ronen et al. (1999) en jitomate cv M82. Estos autores encontraron que durante la maduración aumenta la expresión de los genes de las enzimas fitoenosintetasa y fitoenodesaturasa, involucradas en la síntesis de licopeno. Al mismo tiempo, disminuye o desaparece la expresión de los genes de las enzimas licopeno ciclasas ß y ε que convierten el licopeno en caroteno ß o δ.
Al comparar los niveles máximos de ambos pigmentos en el estado de madurez rojo podemos apreciar que hay alrededor de 236 µg/g PF de licopeno versus 1,52 µg/g PF de ß-caroteno, es decir una relación de 99 a 1%. Estos resultados concuerdan con los reportados por Nguyen y Schwartz (1999) y Periago (2001). Estos autores informaron que los niveles de licopeno representaron aproximadamente del 80-90%, y los deß-caroteno del 1-2%, de los carotenoides que se encuentran durante la última etapa de maduración en distintas variedades de jitomate. Es importante considerar que el contenido total de licopeno varía significativamente en función de la variedad de jitomate, el grado de madurez y las condiciones ambientales de cultivo (Periago, 2001).
Capacidad antioxidante. Como se mencionó previamente, un parámetro importante que determina el valor nutricional de un fruto como alimento funcional es su capacidad antioxidante (Zanfini et al., 2010). En este trabajo se encontró que la capacidad antioxidante total en el estado verde fue de 18,27 mM/mL, incrementándose significativamente (1,6 veces) en el estado de maduración rompiente. En estados de maduración posteriores (naranja y rojo) los niveles de la capacidad antioxidante total fueron similares, no observándose diferencias significativas (p>0,05) entre estos estados de maduración (Fig. 1C). El incremento en la capacidad antioxidante observado entre las etapas de maduración verde y rompiente (Fig. 1C) podría explicarse por la acumulación de licopeno y ß-caroteno detectada en estas mismas etapas (Fig. 1A y 1B). Es interesante señalar que a pesar del aumento en la capacidad antioxidante durante la maduración se detectó un mayor daño en biomoléculas (lipoperoxidación y proteínas oxidadas) en estado de maduración rojo (datos no mostrados). Esto corrobora los reportes de que el proceso de maduración es un proceso oxidativo. Los resultados de este trabajo sugieren que los pigmentos licopeno y ß-caroteno tienen un papel predominante como mecanismos antioxidantes de detoxificación de las ERO durante las fases tardías de la maduración. Al mismo tiempo, los mismos concuerdan con resultados de nuestro grupo de trabajo en relación a que los sistemas enzimáticos antioxidantes (glutatión reductasa, ascorbatoperoxidasa, tioredoxina) operan en las primeras etapas de maduración, disminuyendo en las últimas etapas (datos no mostrados).
Es importante mencionar que existen pocos estudios acerca de los cambios en el estado oxidativo de sistemas antioxidantes y capacidad antioxidante durante la maduración de frutos. El aumento en la capacidad antioxidante observado en este trabajo en frutos de jitomate cosechados en distintas etapas de maduración coincide con resultados informados por Liu et al. (2012) en jitomate cv. Zhenfen 202, cosechado en estado verde y madurado a 20 °C. Estos autores también encontraron una correlación entre la capacidad antioxidante del jitomate y los niveles de licopeno durante la maduración del jitomate.
Compuestos volátiles del aroma. El sabor (gusto y aroma) es un atributo al que se le ha dado cada vez más importancia en la calidad de los frutos de jitomate ya que influye en la aceptación del consumidor. En el presente trabajo se determinaron los niveles de cuatro compuestos volátiles del aroma provenientes del rompimiento oxidativo de los carotenoides (6-metil-5-hepten-2-ona, geranilacetona, ß-ionona y ß-damascenona) durante la maduración de una variedad de jitomate de amplio consumo en México. Se encontró que en los frutos en estado de maduración verde, los niveles de 6-metil-5-hepten-2-ona y geranilacetona (7 ng/g PF y 4 ng/g PF, respectivamente) fueron significativamente mayores que los de los otros dos volátiles analizados: ß-ionona (1 ng/g PF), y ß-damascenona (que no se detectó) (Fig. 2). Durante la maduración se observó que los niveles de los cuatro compuestos volátiles estudiados se incrementaron significativamente alcanzando sus máximos valores en el estado rojo de maduración (31 ng/g PF; 7,9 ng/g PF; 2,5 ng/g PF y 3,8 ng/g PF, respectivamente) (Fig. 2). Mathieu et al. (2009) explican el hecho de que los niveles de 6-metil-5-hepten-2-ona y geranilacetona sean siempre mayores que los de ß-ionona y ß-damascenona, debido a que los dos primeros se sintetizan a partir de una poza de carotenoides diferente a la de los segundos. Mientras que la 6-metil-5-hepten-2-ona y la geranilacetona provienen del licopeno o precursores de éste, la ß-ionona y la ß-damascenona provienen del ß-caroteno.
Fig. 2. Niveles de los aromas derivados de carotenoides durante la maduración de jitomate saladette 7705. Cada valor es la media de tres repeticiones ± error estándar. Valores seguidos por la misma letra no son diferentes de acuerdo a la comparación múltiple de Tukey (a=0,05).
Fig. 2. Levels of aroma volatiles derived from carotenoids during ripening of tomato saladette '7705'. Values are the mean of three replicates ± standard error. Values followed by the same letter are not significantly different according to the Tukey's multiple comparison (ß=0.05).

En este trabajo se puede observar en general una correlación entre los niveles de los compuestos volátiles del aroma y los de sus carotenoides precursores. Los niveles más bajos se observaron en el estado verde y se incrementaron conforme avanzó la maduración (Fig. 1 y Fig. 2). Los niveles de los compuestos volátiles pueden variar por la disponibilidad de los sustratos o por cambios en la actividad de las enzimas dioxigenasas que los producen. Sin embargo, Simkin et al. (2004) reportaron que las enzimas LeCCD que generan estos compuestos volátiles están presentes durante todas las etapas de maduración de frutos de jitomate variedad 'M82'. Por otra parte, resultados de genética comparativa apoyan la correlación entre los niveles de los sustratos carotenoides y los compuestos volátiles del aroma derivados de ellos (Lewinsohn et al., 2005). En este sentido, se ha encontrado también un incremento proporcional entre los niveles de los precursores licopeno y ß-caroteno en jitomates maduros y los compuestos volátiles correspondientes (6-metil-5-hepten-2-ona, geranilacetona, ß-ionona y ß-damascenona) (Tieman et al., 2006; Mathieu et al., 2009; Vogel et al., 2010; Klee y Giovannoni, 2011).
Los niveles de los cuatro compuestos volátiles estudiados en este trabajo son relevantes por su impacto en el aroma, aun cuando sus valores son menores a los de otros compuestos volátiles como el hexanal en esta misma variedad (Díaz de León et al., 2009). Estos resultados son consistentes con los reportados en la literatura en jitomate fresco. Varios estudios informan que las concentraciones de 6-metil-5-hepten-2-ona, ß-ionona, ß-damascenona y geranilacetona son bajas en comparación a aquellas de otros compuestos volátiles presentes en el aroma de estos frutos (Baldwin et al., 2000).
CONCLUSIÓN
Los atributos de calidad medidos (color, firmeza, sólidos solubles totales y acidez titulable) indicaron que la maduración de los frutos empleados en el presente estudio procedió normalmente.
El desarrollo del aroma de jitomate fresco maduro ocurre en las últimas etapas de maduración debido a la acumulación de compuestos volátiles de impacto como 6-metil-5-hepten-2-ona, ß-damascenona, ß-ionona y geranilacetona. El aumento en los compuestos volátiles se correlacionó con el incremento en sus precursores licopeno y ß-caroteno. Estos últimos, además de dar su color rojo característico al fruto, contribuyen al aumento en la capacidad antioxidante en las últimas etapas de maduración.
AGRADECIMIENTOS
La presente investigación se desarrolló gracias al apoyo de la UAM, del Programa PROMEP de Apoyo a la incorporación de Exbecarios-2009 y de la RED PROMEP de Cuerpos Académicos Ciencia y Tecnología Pre y Postcosecha. Se agradece a Conacyt por la beca 224665 otorgada a Omar López Vidal para estudios del Doctorado en Biología Experimental.
REFERENCIAS
1. Abushita, A.E., H.A. Daood y H. Biacs (1997). Determination of antioxidant vitamins in tomatoes. Food Chemistry 60:207-212. [ Links ]
2. Baldwin, E.A., M.O. Nisperos-Carriedo, R. Baker y J.W. Scott (1991). Quantitative analysis of flavor parameters in six Florida Tomato Cultivars (Lycopersicon esculentumMill.). Journal Agricultural Food Chemistry 39: 1135-1140. [ Links ]
3. Baldwin, E.A., J.W. Scott, C.K. Shewmaker y W. Schuch (2000). Flavor trivia and tomato aroma: Biochemistry and possible mechanisms for control of important aroma components. HortScience 35:1013-1021. [ Links ]
4. Beecher, G.R. (1997). Nutrient content of tomatoes and tomatoes products. Proceedings of the Society for Experimental Biology and Medicine 218: 98-100. [ Links ]
5. Bramley, P.M. (2002). Regulation of carotenoid formation during tomato fruit ripening and development. Journal of Experimental Botany 53: 2107-2108. [ Links ]
6. Brand-Williams, W., M.E. Cuvelier y C. Berset (1995). Use of a free radical method to evaluate antioxidant activity. Lebensmittel-Wissenschaft Technologie-Food Science and Technology 28: 25-30. [ Links ]
7. Brennan, T. y C. Frenkel (1977). Involvement of hydrogen peroxide in the regulation of senescence in pear. Plant Physiology 59: 411-416. [ Links ]
8. Bruhn, C.M., N. Fedman, C. Garlitz, J. Harwood, E. Ivas, M. Marshall, A. Riley, D. Turber y E. Williamson (1991). Consumer perception of quality: apricots, cantaloupes, peaches, pears, strawberries, and tomatoes. Journal of Food Quality 14: 187-195. [ Links ]
9. Cantwell, M. (2012). Mature fruit vegetables. Tomato quality attributes. UC Davis. http://www.tomato.org/food/color.html [ Links ]
10. Dalal, K.L., D.K. Salunkhe, A.A. Boe y L.E. Olson (1965). Certain physiological and biochemical changes in the developing tomato fruit. Journal Food Science 30: 504-508. [ Links ]
11. Díaz de León-Sánchez, F., C. Pelayo-Zaldívar, F. Rivera-Cabrera, M. Ponce-Valadez, X. Ávila-Alejandre, F.J. Fernández, H.B. Escalona- Buendía y L.J. Pérez-Flores (2009). Effect of refrigerated storage on aroma and alcohol dehydrogenase activity in tomato fruit. Postharvest Biology and Technology 54: 93-100. [ Links ]
12. Giovannucci, E. (2005). Tomato products, lycopene, and prostate cancer: a review of the epidemiological literature. The Journal of Nutrition 135: 2030S-2031S. [ Links ]
13. Jiménez, A., G. Creissen, B. Kular y J. Firmin (2002). Changes in oxidative process and components of antioxidant system during tomato fruit ripening. Planta 214: 751-758. [ Links ]
14. Kader, A.A. (2003). A Perspective on Postharvest Horticulture (1978-2003). HortScience 38:1004-1008. [ Links ]
15. Kader, A. A. (2008). Perspective flavor quality of fruits and vegetables. Journal of the Science of Food and Agriculture 88: 1863-1868. [ Links ]
16. Klee, H. J. (2010). Improving the favor of the fresh fruits: genomic, biochemistry and biotechnology. New Phytologist 187: 54-56. [ Links ]
17. Klee, H.J y J.J. Giovvanoni (2011). Genetics and control of tomato fruit ripening and quality attributes. The Annual Review of Genetics 45: 41-59. [ Links ]
18. La Vecchia, C. (1997). Mediterranean epidemiological evidence on tomatoes and the prevention of digestive tract cancer. Proceedings of the Society for Experimental Biology and Medicine 218: 125-128. [ Links ]
19. Lewinnsohn, E., Y. Sitrit, E. Bar, Y. Azulay, A. Meir, D. Zamir y Y. Tadmor (2005). Carotenoid pigmentation affects the volatile composition of tomato and watermelon fruits, as revealed by comparative genetic analyses. Journal of Agricultural and Food Chemistry 53: 3142-3143. [ Links ]
20. Liu, C., M.M. Jahangir y T. Ying (2012). Alleviation of chilling injury in postharvest tomato fruit by preconditioning with ultraviolet irradiation. Journal Science Food Agriculture 92: 3016-3022. [ Links ]
21. Mahattanatawee, K.J., A. Manthey, G. Luzio, S.T. Talcott, K. Goodner y E.A. Baldwin (2006). Total antioxidant activity and fiber content of select Florida-grown tropical fruits. Agricultural Food Chemistry 54: 7355-7363. [ Links ]
22. Mathieu, S., V. Dal Cin, Z. Fei, H. Li, P. Bliss, M.G. Taylor, H.J. Klee y D.M. Tieman (2009). Flavour compounds in tomato fruits: identification of loci and potential pathways affecting volatile composition. Journal of Experimental Botany 40: 325-337. [ Links ]
23. Nguyen, L.M. y S.J. Schwartz (1999). Lycopene: Chemical and biological properties. Food Technology 53: 38-45. [ Links ]
24. Organización de las Naciones Unidas para la Agricultura y Alimentación (FAO), FAOSTAT (2011). Top de producción mundial de tomate 2011. En: http://faostat.fao.org/site/339/default.aspx [ Links ]
25. Periago, M.J., I. Martínez-Valverde, G. Ros, C. Martínez y G. López (2001). Propiedades químicas, biológicas y valor nutritivo del licopeno. Anales de Veterinaria 17: 51-66. [ Links ]
26. Rinalducci, S., L. Murgiano y L. Zolla (2008). Redox proteomics: basic principles and future perspectives for the detection of protein oxidation in plants. Journal of Experimental Botany 59: 3781-3801. [ Links ]
27. Rogiers, G.N., Y. Suzy, K. Mohan y K. Richard (1998). Maturation and ripening of fruit of Amelanchier alnifolia Nutt. are accompanied by increasing oxidative stress. Annals of Botany 81: 203-211. [ Links ]
28. Ronen, G., M. Cohen, D. Zamir y J. Hirschberg (1999). Regulation of carotenoid biosynthesis during tomato fruit development. The Plant Journal 17: 341-351. [ Links ]
29. Shao, H., C. Li-Ye, Z. Hua y K. Cong-Min (2008). Primary antioxidant free radical scavenging and redox signaling pathways in higher plant cells. International Journal of Biological Sciences 4: 8-14. [ Links ]
30. Simkin, A., S. Schwartz, M. Auldridge, M. Taylor y H. Klee (2004). The tomato carotenoid cleavage dioxigenase 1 genes contribute to the formation of the flavor volatiles ß-ionone, pseudoionone and geranylacetone. The Plant Journal 40: 882-892. [ Links ]
31. Tieman, M.D., M. Zeigle, G. Schmelz y P. Taylor (2006). Identification of loci affecting flavour volatile emissions in tomato fruits. Journal of Experimental Botany 57: 887-896. [ Links ]
32. Vogel, J.T., D.M. Tieman, Ch. Sims, A.Z. Odabasi, D.G. Clark y H.J. Klee (2010). Carotenoid content impacts flavor acceptability in tomato (Solanum lycopersicum). Journal of the Science of Food and Agriculture 90: 2233-2240. [ Links ]
33. Vranova, E., I. Dirk y V. Breusagem (2002). Signal transduction during oxidative stress. Journal of Experimental Botany 53: 1227-1236. [ Links ]
34. White, J.W. (2002). Recent Advance in fruit development and ripening: an overview. Journal of Experimental Botany 53: 1995-200. [ Links ]
35. Zambrano, J., J. Moyeja y L. Pacheco (1996). Efecto del estado de madurez en la composición y calidad de frutos de tomate. Agronomía Tropical 46: 61-72. [ Links ]
36. Zanfini, A., G. Corbini, C. La Rosa y E. Dreassi (2010). Antioxidant activity of tomato lipophilic extracts and interactions between carotenoids and a-tocopherol in synthetic mixtures. Lebensmittel-Wissenschaft Technologie - Food Science and Technology 43: 67-72.













