Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.83 no.2 Vicente López dic. 2014
ARTÍCULOS ORIGINALES
Variación fenotípica de morfotipos de chile (Capsicum annuum L.) nativo de Oaxaca, México
Phenotype variation of chile morphotypes (Capsicum annuum L.) native to Oaxaca, Mexico
Castellón Martínez E1, JC Carrillo-Rodríguez1, JL Chávez-Servia2, AM Vera-Guzmán2
1 Instituto Tecnológico del Valle de Oaxaca, Ex-Hacienda de Nazareno, Santa Cruz Xoxocotlán, Oaxaca, México, C.P. 71230. Tel. y Fax: (+52-951) 517-0444.
2 Instituto Politécnico Nacional, CIIDIR Unidad Oaxaca, Hornos # 1003 Santa Cruz Xoxocotlan, Oaxaca, México. C.P. 71230, e-mail: jchavezs@ipn.mx; araverag@hotmail.com
Address Correspondence to: J.C. Carrillo Rodriguez, e-mail: jcarrillo_rodriguez@hotmail.com
Recibido / Received 20.I.2013.
Aceptado / Accepted 27.IX.2013.
Resumen. Los agricultores desempeñan una función importante en la selección y preservación de la diversidad local de chiles (Capsicum annuum L.) nativos que se distinguen por su forma de fruto, características de planta y reflejan alta heterogeneidad biogeográfica y cultural. Con el propósito de aportar información sobre la diversidad de variedades locales de chile, se planteó el objetivo de evaluar la variación fenotípica y cambios poscosecha de frutos en seis morfotipos de chile nativo de los Valles Centrales de Oaxaca, México. Se hizo una colecta y caracterización en planta y fruto de 52 muestras agrupadas en seis morfotipos, bajo un diseño de bloques al azar con tres repeticiones, en invernadero. A la cosecha se colectó una muestra de frutos y se evaluó su respuesta poscosecha mediante caracteres físicos. Se determinaron diferencias significativas entre y dentro de morfotipos (Chile de Agua, Nanche, Piquín, Solterito, Tabaquero y Tusta) en altura de planta, diámetro de tallo, tamaño de fruto, peso medio del fruto, número de frutos y rendimiento de frutos por planta. Un patrón semejante se determinó en coordenadas de color L*, a*, b*, índice croma, ángulo hue y pérdida de peso, tanto al momento de la cosecha como nueve días después de almacenamiento a temperatura ambiente. En el análisis discriminante, basado en caracteres morfológicos y de poscosecha, se detectaron diferencias significativas (Lambda de Wilks < 0,01) en las distancias de Mahalanobis entre morfotipos. Por consiguiente, cada morfotipo es una entidad fenotípica diferente.
Palabras clave: Capsicum annuum; Agricultores; Conservación in situ; Variedad local.
Abstract. Farmers' role is important for the selection and conservation of the local diversity of native peppers (Capsicum annuum L.), which are distinguished by pod shape, plant traits, and show high levels of biogeographic and cultural heterogeneity. Our objective was to evaluate the phenotypic variation and postharvest changes of fruits in six morphotypes of native peppers from the Central Valleys of Oaxaca, Mexico. This would contribute information on the diversity of pepper landraces. Collection and characterization of plant and fruits were undertaken for 52 samples grouped into six morphotypes, under a completely randomized block design with three repetitions under greenhouse conditions. At harvest time, pod samples were collected to evaluate their postharvest response using physical parameters. Significant differences (p<0.05) were estimated among and within morphotypes (Chile de Agua, Nanche, Piquin, Solterito, Tabaquero and Tusta) for plant height, stem diameter, fruit size, average fruit weight, fruit number, and pod yield per plant. A similar pattern was determined in the coordinates of color L*, a*, b*, chroma index, hue angle and weight loss, at harvest time and nine days after storage under room temperature. Also, significant differences (Wilks' Lambda < 0.01) were determined by discriminant analysis based on morphological and postharvest traits, for the Mahalanobis' distances among morphotypes. Therefore, each morphotype is a different phenotypic unit.
Keywords: Capsicum annuum; Farmers; In situ conservation; Landrace.
INTRODUCCIÓN
México es el centro de origen, domesticación y diversificación de Capsicum annuum L., como así lo evidencian los restos arqueológicos encontrados en las cuevas de Ocampo de la Sierra de Tamaulipas (7000-5000 a.C.), Coxcatlán en el Valle de Tehuacán (6000-4000 a.C.), y Silvia y Guilá Naquitz en Oaxaca (600-1521 d.C.), una evolución que continúa hasta nuestros días (MacNeish, 1964; Smith, 1967; Bushnell, 1976; Pickersgill, 1971; Eshbaugh, 1980; Loaiza-Figueroa et al., 1989; Perry y Flannery, 2007; Aguilar-Meléndez et al., 2009).
En las estadísticas de producción 2011 de chile (C. annuum L.) en México se reportaron más de 20 tipos diferentes de formas de frutos. Entre ellos se destacan por sus nombres locales (con más de mil hectáreas sembradas): Jalapeño, Ancho, Mirasol, Poblano, Serrano, Chilaca, Guajillo, Tabaquero, Colorado, Pasilla, Puya, de Árbol o Cola de Rata, Costeño y Piquín, entre otros (SIAP, 2011). Generalmente, los agricultores siembran variedades nativas. En el país se distribuyen más de 100 morfotipos de chile silvestres y cultivados, que se consumen y demandan los mercados de las comunidades urbanas y rurales. Sin embargo, se ha determinado además una alta variabilidad genética entre y dentro de tipos (Pozo et al., 1992; Loaiza-Figueroa et al., 1989; Corona-Torres et al., 2000; Latournerie et al., 2002; Hernández-Verdugo et al., 2001; Votova et al., 2005; Hernández et al., 2008; Alonso et al., 2008; Aguilar-Meléndez et al., 2009; Aguilar-Rincón et al., 2010; Nuez et al., 2003). Las divergencias genéticas entre morfotipos de chile están también asociadas a diferencias en su composición química; por ejemplo, en contenido de capsaicinoides, favonoides, carotenoides, polifenoles y otros compuestos (Cazáres-Sánchez et al., 2005; Moran-Bañuelos et al., 2008; Vera-Guzmán et al., 2011).
Las características físicas y químicas diferenciales de fruto entre morfotipos de chile hacen posible que se consuma de forma variada tanto en fresco como en seco. Particularmente, la cocina mexicana explota esas diferencias en los platillos, que se traduce en variaciones en consistencia física del fruto, aroma y sabor, entre otros aspectos (Cazáres-Sanchez et al., 2005; Vera-Guzmán et al., 2011). En las formas cultivadas y semidomesticadas de chile, los agricultores modifican las características de fruto a través de sus practicas de manejo y selección (Portis et al., 2004; Votova et al., 2005; Kraft et al., 2010; Toledo-Aguilar et al., 2011). Las poblaciones silvestres de chile cambian incluso por presiones de selección natural (Votova et al., 2002; Tewksbury et al., 2008). Además, esos atributos deseables y de calidad de frutos son alterados durante la poscosecha, ya sea por manejo o por características propias de los frutos (Krajayklang et al., 2000; Smith et al., 2006; Vázquez et al., 2010; Salinas et al., 2010). El objetivo de este trabajo fue evaluar la variación fenotípica y cambios poscosecha de frutos en seis morfotipos de chile (Capsicum annuum L.) nativo de los Valles Centrales de Oaxaca, México.
MATERIALES Y MÉTODOS
Material vegetal. Se caracterizaron 52 poblaciones de chile de los morfotipos Chile de Agua', Tabiche', Tusta', `Piquín', Solterito' y Nanche', nombres locales asignados en los Valles Centrales de Oaxaca, México, a las variantes de formas de frutos más conocidos. El tamaño de las muestras colectadas varió de acuerdo a la disponibilidad que tenían los agricultores donantes o las plantas disponibles en solares y traspatios, desde 2 kg de fruto en los morfotipos de frutos grandes (De Agua' y Tabiche') hasta 500 ó 30 g en los de fruto pequeño. Estos últimos son considerados semidomesticados o silvestres (Piquín') porque crecen sin intervención humana y desarrollan sus frutos durante la estación de lluvias, regularmente de mayo a septiembre; son aceptados por sus recolectores. De abril a septiembre de 2012, se hizo una exploración y colecta dirigida en los terrenos de cultivo, traspatios y mercados locales de 32 municipios de los Valles Centrales de Oaxaca. Al menos se tomaron cuatro muestras de frutos de cada morfotipo: De Agua' (8), Tusta' (4), Tabiche' (8), Nanche' (4), Solterito' (14) y Piquín' (14) (Fig. 1, Tabla 1).

Fig. 1. Ubicación geográfica de sitios donde se obtuvieron las colectas de chile desde abril a septiembre de 2012.
Fig. 1. Location of sampling sites of the study pepper accessions, from April to September 2012.
Tabla 1. Listado de muestras poblacionales evaluadas de chiles nativos de los Valles Centrales de Oaxaca, México.
Table 1. Listing of population samples of native peppers from the Central Valleys of Oaxaca, Mexico.


Manejo del experimento y caracterización morfológica. Las semillas germinaron, y las plántulas desarrollaron la quinta hoja verdadera, en sustrato comercial de materia orgánica de musgos naturales de turberas conocido como peat moss®. Posteriormente, se efectuó el trasplante de la colección (52 poblaciones) en invernadero bajo un diseño de bloques completos al azar con tres repeticiones. Se utilizó el invernadero del Instituto Tecnológico del Valle de Oaxaca (ITVO), en la Exhacienda de Nazareno, Santa Cruz Xoxocotlán, Oaxaca. Para favorecer el crecimiento y desarrollo de las plantas, se implementó un sistema de fertilización y riego por goteo con aplicaciones semanales de las fórmulas comerciales de fertilización: 15-30-15+1,0 MgO + Microelementos (MgO 0,5%; S 0,7%; B 2000 ppm; Zn 2000 ppm) y 25-10-10 + Microelementos (S 0,8%; Mg 0,5%; Fe 400 ppm; Zn 200 ppm; Mn 200 ppm; Mo 100 ppm; Cu 100 ppm; B 100 ppm), más aplicaciones semanales de nitrato de calcio cuando inició la fructificación.
Con el propósito de prevenir y controlar enfermedades, se aplicaron Previcur N®, Pentaclor 600 f®, Metacid 400 ts® y sulfato de cobre, debido a la presencia de Phytium spp., Rhizoctonia sonali, Fusarium spp., Oidiopsis sp., Phytophtora sp., y Alternaria sp., entre otras. Para el manejo de poblaciones plaga como Trialeurodes vaporariorum, Tetranichus sp., Epitrix sp. yAphis spp., se aplicó Sultron* 725®, Picus 70 wg®, Lanate® y Thiodan®.
La caracterización morfológica de las poblaciones se realizó en base al color, arrugamiento transversal y forma del fruto, forma del fruto en unión con el pedicelo, forma del ápice, altura de planta a 30, 60 y 90 días después del trasplante, número de ramas primarias y secundarias, largo, ancho, peso y número de lóculos del fruto, y número de frutos por planta. Todos los caracteres fueron evaluados en base a los descriptores para Capsicum del IPGR (1995).
Evaluación poscosecha de frutos. A la cosecha se tomó una muestra de 100 a 500 g de frutos de tres plantas por parcela experimental, y se evalúo el color al corte y nueve días después de almacenamiento a temperatura ambiente promedio (24,7 °C; 34-80% de humedad relativa). El color se registró con ayuda de un colorímetro portátil Mini Scan (MS/B-200S; Hunter Lab®, Reston, Virginia, USA) en lectura en las coordenadas CIE Lab L*, a* y b*, donde; L* indica el grado de brillo o luminosidad [0 (blanco) a 100 (negro)]; a* determina la variación de verde (-) a rojo (+), y b* la variación de azul (-) a amarillo (+). Las lecturas se realizaron en tres puntos diferentes de la parte media de los frutos. Con los valores de L*, a* y b* se calculó el índice croma (C*)= [(a*)2 + (b*)2]1/2 y el ángulo hue (h°) = tan-1 (b*/a*).
El contenido de sólidos solubles se evaluó al momento de la cosecha y nueve días después de la cosecha, en una mezcla de 10 g de frutos molido y 50 mL de agua neutra (pH = 7,0). Las lecturas se hicieron mediante un refractómetro manual (Atago modelo 3T®, Japan) y se expresaron en grado Brix (método 932.14 de la AOAC, 1990). También se determinó el pH mediante un potenciómetro digital (modelo PH 10, Conductronic®).
Análisis estadístico. En los caracteres cuantitativos morfológicos y de poscosecha, se hizo un análisis de varianza (ANOVA) para evaluar las diferencias entre morfotipos y dentro de morfotipos (poblaciones). Cuando se determinaron diferencias significativas (p=0,05) entre estos factores, se procedió a hacer una comparación de medias por el método de Tukey. Posteriormente, con los promedios estandarizados por el valor máximo de cada variable, se realizó un análisis de componentes principales mediante la matriz de varianzas y covarianzas. En el caso de las variables cualitativas, se hizo un análisis de correspondencia múltiple. Finalmente, se hizo un análisis de conglomerados de agrupación jerárquica por el método de la media no ponderada (UPGMA, acrónimo en inglés). Todos los análisis se realizaron mediante el paquete estadístico SAS (1999).
RESULTADOS Y DISCUSIÓN
Variación morfológica entre y dentro de morfotipos. Mesoamérica es una de las regiones más importantes de origen, domesticación y diversificación de varios cultivos como aguacate, cacao, algodón, maíz, calabaza, frijol y chile. Este último sigue su proceso híbrido de domesticación, existen especies de uso y manejo común por los agricultores en sus terrenos de cultivo o huerto y variantes silvestres, "salen solas, mencionan los usuarios-consumidores", sin manejo del hombre (Pickersgill, 1971, 2007). En este trabajo, los resultados indican que existen al menos seis principales grupos de diversidad fenotípica en los Valles Centrales de Oaxaca con divergencias significativas (p<0,05) entre ellos. Se obtuvieron diferencias estadísticamente significativas (p=0,05 y p=0,01) entre y dentro de los morfotipos evaluados en todas las variables, excepto dentro de colectas para el número de frutos por planta (Tabla 2). Los coeficientes de variación fueron de 14,5 a 24,9%.
Tabla 2. Cuadrados medios del análisis de varianza de las variables morfológicas evaluadas en seis morfotipos de chile nativo de los Valles Centrales de Oaxaca.
Table 2. Mean squares from the analyses of variance of morphological variables evaluated on six morphotypes of native pepper from the Central Valleys of Oaxaca.

ddt: Días después del trasplante; ns: no significativo a p>0,05; *significativo a p=0,05; ** significativo a p=0,01. CV: coeficiente de variación.
ddt: Days after transplanting; ns: not significant at p>0.05; *significant at p=0.05; ** significant at p=0.01. CV: variation coefficient.
Entre morfotipos se presentaron diferencias importantes en la velocidad de crecimiento de la planta. En altura de planta a 30, 60 y 120 días después del trasplante, los patrones fueron los siguientes; las variantes cultivadas de Chile de Agua y Tusta fueron de crecimiento lento, de crecimiento intermedio Tabaquero y Solterito, y de rápido crecimiento Nanche y Piquín. Estos últimos sobresalieron estadísticamente en altura, y son variantes de las formas silvestres. En diámetro de tallo sobresalió estadísticamente Nanche (> 1 cm), y en extremo opuesto Chile de Agua, con menor grado de desarrollo del tallo (0,61 cm). La descripción de largo y ancho de fruto fueron determinantes en la diferenciación de morfotipos; el que sobresalió estadísticamente por el mayor tamaño fue Chile de Agua, le siguieron Tabaquero y Solterito, y los más pequeños fueron Tusta, Nanche y Piquín. En peso de frutos por planta y peso medio de frutos, sobresalió Chile de Agua seguido del Tabaquero y Solterito, y de manera opuesta los menores pesos de frutos correspondieron a Tusta, Nanche y Piquín, aunque tuvieron una mayor producción de frutos por planta (Tabla 3). Semejantes patrones describieron Latournerie et al. (2002) en Yucatán, y Castañón-Nájera et al. (2008) en Tabasco, México. Esto indica que en cada microregión Mesoamericana las comunidades humanas aprovechan tanto las formas cultivadas como las formas silvestres y probablemente segregantes (introgresiones) que se forman con el cruzamiento natural de ambas (Jarvis y Hodgkin, 1999).
Tabla 3. Valores promedio de la variación morfológica en seis morfotipos de chile nativo.
Table 3. Average values of the morphological variation in six morphotypes of native pepper.

ddt: Días después del trasplante. En columna, medias con la misma letra no diferen significativamente (Tukey, p<0,05).
ddt: Days after transplanting. Within each column, means followed by the same letter do not differ significantly (Tukey, p<0.05).
La variación dentro de morfotipos fue notable. Nanche se mostró como el más estable en los caracteres vegetativos y reproductivos; le siguió Piquín, que sólo presentó diferencias entre poblaciones en rendimiento por planta con variaciones de 1,0 a 31,3 g (Tabla 4). Esto sugiere que deben realizarse trabajos con mayor número de muestras, tal como lo probó Hernández et al. (2008) en chile Piquín del Noreste de México.
Tabla 4. Variación morfológica dentro de morfotipos de chiles nativos del Valle de Oaxaca.
Table 4. Morphological variation within morphotypes of native peppers from the Oaxaca's Valley


ddt: Días después del trasplante. En columna y dentro de cada morfotipo, medias con la misma letra no difieren significativamente (Tukey, p<0,05).
ddt: Days after transplanting. Within each column and morphotype, means followed by the same letter do not differ significantly (Tukey, p<0.05).
En el morfotipo Chile de Agua, se observaron diferencias entre poblaciones en altura de planta a 30 días del trasplante, longitud y ancho de fruto, rendimiento por planta y densidad del fruto. Esto sugiere la existencia de variabilidad que puede utilizarse en el mejoramiento genético de este tipo. En este sentido, Tabaquero y Solterito presentaron la mayor variabilidad en casi todos los caracteres evaluados. Aunque no son de alto consumo (Castellón-Martínez et al., 2012), pueden utilizarse como fuente de genes para mejorar las variantes locales cultivadas. Tusta resultó de variación intermedia. Las poblaciones fueron semejantes en altura de planta a 60 y 120 días después del trasplante, longitud y ancho de fruto, número de frutos por planta y peso medio de frutos, y difrieron en rendimiento de frutos por planta, diámetro de fruto y altura de planta a 30 días del trasplante (Tabla 4).
En relación a la variación en caracteres cualitativos entre morfotipos, se determinó que la pubescencia del tallo y hojas, cantidad de macollos (brotes basales) producidos, forma del fruto y forma de unión fruto-pedicelo, fueron determinantes en diferenciar los morfotipos y poblaciones dentro de cada tipo, usando el análisis de correspondencia. En la Figura 2 se observa que las poblaciones de Tabaquero, y algunas de Piquín, Tusta y Nanche se asociaron en sentido positivo con la dimensión 2, que estuvo determinada por la mayor pubescencia de tallo y hojas. Las poblaciones de Solterito fueron más dispersas en dicha Figura, indicando mayor divergencia entre ellas. Entre agricultores y consumidores de los Valles Centrales de Oaxaca, se menciona que es relativamente simple diferenciar cada morfotipo de chile solo considerando los caracteres cualitativos de forma de fruto y planta.

Fig. 2. Dispersión de 52 colectas de chile nativo de los Valles Centrales de Oaxaca, basado en las dos primeras dimensiones del análisis de correspondencia.
Fig. 2. Scattering of 52 accessions of native pepper from the Central Valleys of Oaxaca, based on the first two dimensions of the correspondence analysis.
Comportamiento de frutos en poscosecha. En el análisis de varianza combinado se determinaron diferencias significativas (p<0,05) entre tiempos de evaluación de frutos, morfotipos e interacción tiempos-morfotipos; se estimaron diferencias significativas (p<0,05) para todas las variables evaluadas, excepto grados Brix y pH en tiempos de evaluación, y pH para la interacción (tiempo poscosecha x morfotipo) (Tabla 5). Es de resaltar que no se detectaron diferencias significativas entre colectas ni para pH ni grados Brix (Tabla 5). Los coeficientes de variación fueron inferiores a 23%. Es de considerar que, aun en poscosecha se observaron diferencias entre y dentro de los morfotipos, y las divergencias no solo se restringieron a caracteres agromorfológicos.
Tabla 5. Cuadrados medios del análisis de varianza de variables de poscosecha en frutos de seis morfotipos de chile nativo.
Table 5. Mean squares from the analysis of variance of postharvest variables on fruits of six morphotypes of native pepper.

ns: no significativo (p>0,05); *significativo a p=0,05; **significativo a p=0,01.
ns: not significant (p>0.05); * significant at p=0.05; **significant at p=0.01.
Las diferencias significativas en las coordenadas CIE Lab de color a la cosecha y 9 días después hacen indirectamente referencia al proceso de maduración del fruto desde verde a rojo (Tabla 6). La intensidad o luminosidad del color (L*) decrece, y los tonos (a*) de verde a rojo, y de azul a amarillo (b*) se incrementan a los 9 días después de cosechar. Todo esto se refleja consistentemente en los índices asociados con la madurez; hue y croma. El pH y grados Brix se incrementan. En estos morfotipos, Vera-Guzmán et al. (2011) determinaron que la vitamina C, fenoles, flavonoides, carotenoides y capsicinoides se incrementan en concentración a medida que avanza la madurez. Es decir, los compuestos asociados con el sabor, aroma y pungencia fueron más evidentes en estado maduro, y los consumidores asiduos de un tipo lo pudieron diferenciar con relativa facilidad. Las diferencias en compuestos químicos entre morfotipos también fueron reportadas por Cázares-Sánchez et al. (2005) en morfotipos de Yucatán, y por Moran-Bañuelos et al. (2008) en Puebla, México.
Tabla 6. Valores promedio de la respuesta de frutos de seis morfotipos de chile nativo en caracteres de poscosecha.
Table 6. Average values of the response of fruits on six morphotypes of native pepper in postharvest characters.
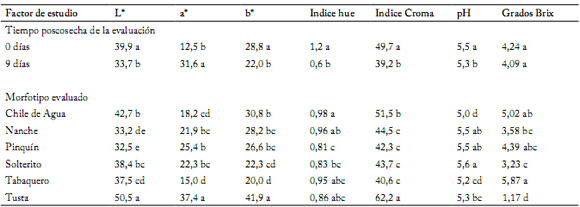
En columna y dentro de cada factor, medias con la misma letra no difieren significativamente (Tukey, p<0,05).
Within each column and factor, means followed by the same letter do not differ significantly (Tukey, p<0.05).
Los morfotipos se pudieron diferenciar con la ayuda de las coordenadas del color e índices hue y croma; Tusta a simple vista presentó frutos amarillos paja con un mancha antocianínica, se diferenció con los mayores valores de L*, a* y b* e índice croma. Chile de Agua fue de color verde claro o verde limón a la vista, presentó tonos intermedios de L*, b* y altoíndice hue. Piquín se diferenció con bajos valores de L*, índices hue (h°) y croma, e intermedios en a* y b*; se distinguió por un color visual de verde intenso a verde limón. Tabaquero mostró frutos de color verde intenso, por lo que sus valor de a* y b* fueron bajos. El Nanche fue verde intermedio, con bajos valores de L* e índice croma. La mayor concentración de grados Brix se observó en Tabaquero, después Chile de Agua y Piquín, y finalmente Tusta (Tabla 6), un patrón semejante al evaluado por Vera-Guzmán et al. (2011) en los mismo tipos.
En la interacción tiempo de poscosecha y morfotipos se notaron diferencias importantes en L* y b* para Chile de Agua y Tusta, no así para los otros tipos. Es decir, en Nanche, Piquín y Solterito los parámetros L* y b* no aportaron elementos para diferenciar los frutos al momento de la cosecha y 9 días después. En contraposición, la coordenada a*, y los índices hue y croma ayudaron a diferenciar colectas dentro del morfotipo a la cosecha y después de nueve días de almacenamiento. Los grados Brix y pH no mostraron diferencias en la interacción tiempos de cosecha y morfotipos, por lo que pueden ser parámetros menos influenciados por el tiempo de almacenamiento (Tabla 7).
Tabla 7. Interacción de la respuesta de los frutos de seis morfotipos de chile nativo, al corte y nueve días de almacenamiento a temperatura ambiente.
Table 7. IInteraction of the fruit response of six morphotypes of native pepper, at harvest and nine days of storage at room temperature.

En columna y dentro de cada morfotipo, medias con la misma letra no difieren significativamente (Tukey, p<0,05).
Within each column and morphotype, means followed by the same letter do not differ significantly (Tukey, p<0.05).
La pérdida de peso durante el almacenamiento fue diferente entre morfotipos. La mayor pérdida se observó en Tusta, y le siguieron Piquín, Tabaquero y Nanche (Fig. 3). Chile de Agua presentó comparativamente la menor pérdida de peso. En promedio se estimó que se perdieron 4,1 g por día en los frutos más grandes, después de nueve días de almacenamiento a temperatura ambiente (24,7 °C, desviación estándar 3,6).

Fig. 3. Patrones de pérdida de humedad en frutos almacenados de seis morfotipos de chile nativo de los Valles Centrales de Oaxaca.
Fig. 3. Patterns of moisture loss on stored fruits of six native pepper morphotypes from the Central Valleys of Oaxaca.
La lambda de Wilks determinó diferencias significativas (p<0,01) en las distancias de Mahalanobis entre morfotipos de chile nativos de los Valle Centrales de Oaxaca (Tabla 8). Las divergencias fenotípicas, morfológicas y de respuesta de poscosecha de los frutos fueron significativas entre morfotipos, tal como reportaron Bautista et al. (2012). En este caso, todos los morfotipos difrieron significativamente, y esas diferencias también determinaron divergencias en (1) composición de frutos, como concluyeron Vera-Guzmán et al. (2011), y (2) genéticas, como lo reportaron Aguilar-Méndez et al. (2009) entre Piquín, Nanche, Tusta y Chile de Agua. Es decir, los agricultores seleccionaron los tipos cultivados y le confirieron diferencias en composición de fruto y genética, y de manera natural los tipos silvestres también se diferenciaron.
Tabla 8. Distancias de Mahalanobis entre siete grupos poblacionales de morfotipos de chile, basadas en caracteres morfológicos y de poscosecha de frutos.
Table 8. Mahalanobis distances among seven population groups of pepper morphotypes, based on morphological and fruit postharvesting traits.

Todas las distancias difieren significativamente de acuerdo con la Lambda de Wilks (F=18,6; gl=70; p=0,01).
All distances differ significantly according to Lambda de Wilks (F=18.6; df=70; p=0.01).
CONCLUSIONES
Los morfotipos de chiles nativos denominados regionalmente como Chile de Agua, Nanche, Piquín, Solterito, Tabaquero y Tusta se diferenciaron fenotípicamente en altura de planta a 30, 60 y 120 días después del trasplante, diámetro del tallo, largo, ancho, peso medio de fruto, número de frutos y rendimiento por planta. Dentro de cada morfotipo se determinaron diferencias significativas semejantes, excepto en número de frutos por planta.
Entre morfotipos, también se determinaron diferencias significativas (p<0,05) en la calidad física poscosecha de frutos, al momento del corte y nueve días de almacenamiento a temperatura ambiente, en relación a las coordenadas de color (L*, a* y b*) e índices hue y croma. Las coordenadas de color a* e índices hue y croma fueron eficientes para evaluar la interacción entre morfotipos y tiempos de almacenamientos. La pérdida promedio de peso por día de almacenamiento fue de 4,1 g/día.
Se determinaron divergencias signifcativas entre morfotipos, de acuerdo con las distancias de Mahalanobis y la Lambda de Wilk (p<0,01), en relación a caracteres de planta, fruto y características físicas de poscosecha. Los morfotipos denominados con nombres regionales están asociados a entidades fenotípicas diferentes.
REFERENCIAS
1. Aguilar-Melendez, A., P.L. Morrell, M.L. Roose y S C. Kim (2009). Genetic diversity and structure in semiwild and domesticated chile (Capsicum annuum; Solanaceae) from Mexico. American Journal of Botany 96: 1190-1202. [ Links ]
2. Aguilar-Rincón, V.H., T. Corona-Torres, P. López-López, L. Latournerie-Moreno, M. Ramírez-Meraz, H. Villalón-Mendoza y J.A. Aguilar-Castillo (2010). Los Chiles de México y su Distribución. SINAREFI, Colegio de Postgraduados, INIFAP, IT-Conkal, UNAL y UAN. Montecillo, Texcoco, Estado de México. 114 p. [ Links ]
3. Alonso, R.A., C Moya, A. Cabrera, P. Ponce, R. Quiroga, M.A. Rosales y J.L. Zuart (2008). Evaluación in situ de la variabilidad genética de los chiles silvestres (Capsicum spp.) en la región frailesca del estado de Chiapas, México. Cultivos Tropicales 29: 49-55. [ Links ]
4. Association of Official Analytical Chemists (AOAC) (1990). Official methods of analysis of the Association of Official Analytical Chemists. Vol. 2, 15th ed. Association of Official Analytical Chemists, Washington DC, USA, pp. 685-1298. [ Links ]
5. Bautista, C.M., J.C. Carrillo R., J.L. Chávez S. y Y. Villegas A. (2012). Diferencias morfológicas entre variantes de chile (Capsicum annuum L.) de Oaxaca, en invernadero. En: 9° convención Mundial de chile, 5 al 7 de Julio de 2012. Comité Nacional de Productores de Chile A.C., Consejo Estatal de Productores de Chile en Zacatecas S.C., Universidad Autónoma de Zacatecas, Fundación Produce Zacatecas, Comité Estatal de Sanidad Vegetal A.C. y Comité Estatal Sistema Producto de Zacatecas A.C. Zacatecas, México, pp. 373- 379. [ Links ]
6. Bushnell, F.B.A. (1976). The beginning and growth of agriculture in Mexico. Phil. Trans. R. Soc. Lond. B 275: 117-128. [ Links ]
7. Cázares-Sánchez, E., P. Ramírez-Vallejo, F. Castillo-González, M. Soto-Hernández, T. Rodríguez-González y J.L. Chávez-Servia (2005). Capsaicinoides y preferencia de uso en diferentes morfotipos de chile (Capsicum annuum L.) del centro-oriente de Yucatán. Agrociencia 39: 627-638. [ Links ]
8. Castañón-Nájera, G., L. Latournerie-Moreno, M. Mendoza-Elos, A. Vargas-López y H. Cárdenas-Morales (2008). Colección y caracterización de chile (Capsicum spp.) en Tabasco, México. Phyton, International Journal of Experimental Botany 77: 189-202. [ Links ]
9. Castellón-Martínez, E., J.L. Chávez-Servia, J.C. Carrillo-Rodríguez y A.M. Vera Guzmán (2012). Preferencias de consumo de chiles (Capsicum annuum L.) nativos en los Valles Centrales de Oaxaca. Revista Fitotecnia Mexicana 35 (Núm. Especial 5): 27-35. [ Links ]
10. Corona-Torres, T., A. García-Velázquez, F. Castillo-González, V. Montero-Tavera y H.S. Azpiroz-Rivero (2000). Caracterización isoenzimática de la diversidad genética de colectas de chile (Capsicum annuum L. y Capsicum chinense Jacq.). Rev. Chapingo Serie Horticultura 6: 5-17. [ Links ]
11. Eshbaugh, W.H. (1980). The taxonomy of the genus Capsicum (Solanaceae). Phytologia 4: 153-166. [ Links ]
12. Hernández-Verdugo, S., R. Luna-Reyes y K. Oyama (2001). Genetic structure and diferentiation of wild and domesticated populations of Capsicum annuum (Solanaceae) from Mexico. Plant Systematics and Evolution 226: 129-142. [ Links ]
13. Hernández V., S., R.G. López, P Sánchez, M. Villarreal, S. Parra, F. Porras y J.L. Corrales (2008). Variación fenotípica entre y dentro de poblaciones silvestres de chile del noroeste de México. Revista Fitotecnia Mexicana 31: 323.330. [ Links ]
14. Internacional Plant Genetic Resources (IPGR) (1995). Descriptores para Capsicum spp. Instituto Internacional de Recursos Fitogenéticos, Centro Asiático para el desarrollo e Investigación Relativo a los Vegetales y Centro Agronómico Tropical de investigación. Roma, Italia. 52 p. [ Links ]
15. Jarvis, D.I. y T. Hodgkin (1999). Wild relatives and crop cultivars: detecting natural introgression and farmer selection of new genetic combinations in agroecosystems. Molecular Ecology 8: 159-173. [ Links ]
16. Kraft, K.H., J.J. Luna-Ruiz y P. Gepts (2010). Different seed selection and conservation practices for fresh market and dried chile farmers in Aguascalientes, Mexico. Economic Botany 64: 319-328. [ Links ]
17. Krajaylandg, M., A. Klieber y P.R. Dry (2000). Colour at harvest and post-harvest behaviour influence paprika and chilli spice quality. Postharvest Biology and Technology 20: 269-278. [ Links ]
18. Latournerie, L., J.L. Chávez, M. Pérez, G. Castañon, S.A. Rodríguez, L.M. Arias y P. Ramírez (2002). Valoración in situ de la diversidad morfológica de chiles (Capsicum annuum L. y Capsicum chínense Jacq.) en Yaxcabá, Yucatán. Revista Fitotecnia Mexicana 25:25-33. [ Links ]
19. Lesur, L. (2006). Manual del Cultivo del Chile. Ed. Trillas. México, D.F. 80 p. [ Links ]
20. Loaiza-Figueroa, F., K. Ritland, J.A. Laborde y S.D. Tanksley (1989). Patterns of genetic variation of the genus Capsicum (Solanaceae) in Mexico. Plant Systematics and Evolution 165: 159-188. [ Links ]
21. MacNeish, R.S. (1964). Ancient Mesoamerican civilization. Science 143: 531-537. [ Links ]
22. Morán-Bañuelos, S.H., V.H. Aguilar-Rincón, T. Corona-Torres, F. Castillo-González, R.M. Soto-Hernández y R. San Miguel-Chávez (2008). Capsaicinoides en chiles nativos de Puebla, México. Agrociencia 42: 807-816. [ Links ]
23. Muñoz, F.I. y B.C. Pinto (1966). Taxonomía y distribución geográfica de los chiles cultivados de México. Folleto Misceláneo No. 15. INIASAG. México. 23 p. [ Links ]
24. Nuez, F.R., G. Ortega y J. Costa (2003). El Cultivo de Pimientos, Chiles y Ajíes. Ed. Mundi-Prensa, México. 607 p. [ Links ]
25. Perry, F. y K. Flannery (2007). Precolumbian use of chili peppers in the Valley of Oaxaca, México. Proceedings of the National Academy of Science of the United States of America 104: 11905-11909. [ Links ]
26. Pickersgill, B. (1971). Relationships between weedy and cultivated forms in some species of chili peppers (Genus Capsicum). Evolution 25: 683-691. [ Links ]
27. Pickersgill, B. (2007). Domestication of plants in the Americas: insights from Mendelian and molecular genetics. Annals of Botany 100: 925-940. [ Links ]
28. Portis, E., A. Acquadro, C. Comino y S. Lanteri (2004). Effect of farmers' seed selection on genetic variation of a landrace population of pepper (Capsicum annuum L.), grown in North-West Italy. Genetic Resources and Crop Evolution 51: 581-590. [ Links ]
29. Pozo, O., S. Montes y E. Redondo (1991). Chile (Capsicum spp.). En: P. Ortega, G. Palomino, F. Castillo, V.A. González, M. Livera (eds.) pp. 217-238. Avances en el Estudio de los Recursos Fitogenéticos de México. Sociedad Mexicana de Fitogenética, A.C. Chapingo, México. [ Links ]
30. Salinas, R.M., E.A. Liévano, F. Ulín-Montejo, J.N. Mercado y D. Petit (2010). Caracterización morfológica y cambios durante la vida postcosecha de cuatro tipos de chile amashito (Capsicum annuum L.) variedad glabriusculum (Dunal) Heiser & Pickersgill. Revista Iberoamericana de Tecnología Postcosecha 11: 92-100. [ Links ]
31. SAS (1999). SAS® Procedures Guide, Version 8. SAS Institute Inc. Cary, NC, USA. 1643 p. [ Links ]
32. Sistema de Información Agroalimentaria y Pesquera (SIAP) (2011). Anuario Estadístico de la Producción Agrícola 2011. Sistema de Información Agroalimentaria y Pesquera de la Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. http://www.siap.gob.mx/index.php?option=com_wrapper&view= wrapper&Itemid=350 (Consultado el 17 de diciembre de 2011). [ Links ]
33. Smith, C.E. (1967). Plant remains. En: D.S. Byers (ed.), pp. 220-255. The prehistory of the Tehuacán Valley. University of Texas Press. Austin, TX, EEUU. [ Links ]
34. Smith, D.L., J.R. Stommel, R.W.M. Fung, C.Y. Wang y B.D. Whitaker (2006). Influence of cultivar and harvest method on postharvest storage quality of pepper (Capsicum annuum L.) fruit. Postharvest Biology and Technology 42: 243-247. [ Links ]
35. Tewksbury, J. J., K.M. Reagan, N.J. Machnicki, T.A. Carlo, D.C. Haak, A.L. Calderón-Peñaloza y D.J. Levey (2008). Evolutionary ecology of pungency in wild chilies. Proceedings of the National Academy of Science of the United States of America 105: 11808-11811. [ Links ]
36. Vera-Guzmán, A.M., J.L. Chávez-Servia, J.C. Carrillo-Rodríguez y M.G. López (2011). Phytochemical evaluation of wild and cultivated pepper (Capsicum annuum L. and C. pubescens Ruiz & Pav.) from Oaxaca, Mexico. Chilean Journal of Agricultural Research 71: 578-585. [ Links ]
37. Vázquez, E., M. Ramírez, H. Mata, R. Ariza y I. Alia (2010). Atributos de calidad y vida de anaquel de frutos de cultivares de chile serrrano en México. Revista Fitotecnia Mexicana 33: 79-82. [ Links ]
38. Votova, E.J., G.P. Nabhan y P.W. Bosland (2002). Genetic diversity and similarity reveled via molecular analysis among and within an in situ population an ex situ accessions of chiltepin (Capsicumannuum var. glabrisculum). Conservation Genetics 3: 123-129. [ Links ]
39. Votova, E.J., J.B. Baral y P.W. Bosland (2005). Genetic diversity of chile (Capsicum annuum var. annuum L.) landraces from Northern New Mexico, Colorado and Mexico. Economic Botany 59: 8-17. [ Links ]














