Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.83 no.2 Vicente López dic. 2014
ARTÍCULOS ORIGINALES
Anatomía foliar y caulinar de tres Salicornieae (Chenopodiaceae) halófilas argentinas
Leaf and stem anatomy of three halophytic Salicornieae (Chenopodiaceae) from Argentina
Pérez Cuadra V y PM Hermann
Lab. de Plantas Vasculares. Dep. de Biología, Bioquímica y Farmacia. Universidad Nacional del Sur. San Juan 670. C.P. 8000. Bahía Blanca, Prov. Buenos Aires. Argentina.
Address Correspondence to: Vanesa Pérez Cuadra, e-mail: vperezcuadra@uns.edu.ar
Recibido / Received 5.VII.2012.
Aceptado / Accepted 21.X.2013.
Resumen. Las especies pertenecientes a las Salicornieae (Chenopodiaceae), llamadas jumes, son ricas en sales, lo que refleja su naturaleza halófila. Se estudió la anatomía de hoja y tallo de Allenrolfea patagonica, Heterostachys olivascens y H. ritteriana. El material colectado en el Salitral de la Vidriera a 30 km de Bahía Blanca (Prov. Buenos Aires), fue fijado, deshidratado, incluido y teñido con técnicas tradicionales de anatomía vegetal. La epidermis abaxial de las hojas en las tres especies presenta células con papilas, mientras que la adaxial generalmente carece de ellas. Los estomas están hundidos en la cara abaxial de las tres especies y en la adaxial de A. patagonica; se encuentran a nivel epidérmico en ambas especies de Heterostachys. La estructura dorsiventral inversa del mesofilo es consecuencia de la posición adpresa de las hojas. Los haces vasculares están inmersos en tejido acuífero. El tallo con crecimiento primario de A. patagonica presenta una corteza delgada y una médula amplia mientras que en los Heterostachys las cortezas son amplias y sus médulas pequeñas. En las tres especies se diferencia máster cambium, que genera una corteza secundaria y una matriz de esclereidas donde se encuentran inmersos los haces vasculares correspondientes al crecimiento secundario. A pesar de variaciones en detalles anatómicos menores se puede corroborar una similar tendencia en la organización en estas Salicornieae.
Palabras clave: Salicornieae; Anatomía vegetativa; Máster cambium; Hojas adpresas; Halófitas.
Abstract. Species belonging to the tribe Salicornieae (Chenopodiaceae), called jumes, are rich in salts, reflecting its halophytic nature. The leaf and stem anatomy of Allenfolfea patagonica, Heterostachys olivascens and H. ritteriana were studied. The material, collected in the Salitral de la Vidriera located 30 km from Bahia Blanca (Buenos Aires, Argentina), was fixed, dehydrated, embedded and stained with traditional techniques for plant anatomy. The foliar abaxial epidermis of the three species had papillate cells, while the adaxial one, usually did not. The stomata were sunken in the abaxial epidermis of the three species, and of the adaxial one of A. patagonica; they occurred at the epidermal level in both species of Heterostachys. The inverse dorsiventral structure of the mesophyll was a result of the appressed position of the leaves. The vascular bundles were embedded in aqueous tissue. The primary stem growth of A. patagonica showed a thin cortex and a wide pith, while in both species of Heterostachys the cortex was large and the pith small. Master cambium diferentiated in all three species; it produces a secondary cortex and a sclereid matrix in which the vascular bundles, produced by secondary growth, are immersed. Although there were minor variations in anatomical details, a similar organization pattern can be corroborated in these Salicornieae.
Keywords: Salicornieae; Vegetative anatomy; Master cambium; Appressed leaves; Halophytes.
INTRODUCCIÓN
Las Chenopodiaceae -actualmente consideradas como Amaranthaceae (Stevens, 2001 onwards)- comprenden alrededor de 102 géneros y unas 1400 especies de amplia distribución mundial, aunque en su mayoría confinadas a áreas xéricas o salitrosas (especialmente las estepas y semidesiertos de Norte y Sud América, Asia Central y Sud África, las costas de los mares Rojo, Caspio y Mediterráneo, y las llanuras salitrosas de Australia) (Giusti, 1967). Dentro de las Dicotiledoneae, las Chenopodiaceae tienen la mayor proporción de géneros de halófilas, con aproximadamente 300 especies; probablemente es la familia donde la tolerancia a la sal está más extendida (Flowers et al., 1986). La mayoría de las especies de esta familia presentan características de tipo xeromórfico que les permiten desarrollarse en ambientes donde los parámetros ecológicos incluyen déficit de agua, radiación solar elevada y cambios bruscos de temperatura (Simon, 1997).
En la Argentina se hallan representados 14 géneros con aproximadamente 121 especies de las cuales 59 son endémicas y 35 introducidas (Múlgura y Marticorena, 2008) y "..., en general, son hierbas o arbustos anuales o perennes, muy raramente pequeños árboles; sus hojas casi siempre son alternas, glabras o pubescentes, a menudo carnosas, sin estípulas. Las ramas son erguidas o decumbentes, si bien en algunas especies subarbustivas -de los géneros Suaeda Forssk. ex Scop., Sarcocornia (Duval-Jouve ex Moss) A.J. Scott, Allenrolfea Kuntze, Heterostachys Ung.-Sternb., etc.- las ramas se extienden sobre el suelo formando manchas de vegetación y sólo las extremidades o las ramitas secundarias se presentan erguidas. Las flores son muy pequeñas, inconspicuas, solitarias o agrupadas en cimas" (Soriano, 1948).
Dentro de esta familia hay especies de gran valor hortícola, como la espinaca (Spinacia oleracea L.), la acelga (Beta vulgaris L. var. cicla L.) y la remolacha (Beta vulgaris L.). Entre otras especies se deben destacar también la quínoa (Chenopodium quinoa Willd.) y la cañihua (Ch. pallidicaule Aellen), que aún hoy se cultivan en pequeñas áreas y fueron empleadas como seudocereales y hortalizas por aborígenes americanos (Giusti, 1984).
Las Chenopodiaceae no han sido ampliamente estudiadas, quizás por ser poco atractivas para muchos colectores y botánicos. A pesar de presentar dificultades taxonómicas, en muchos géneros hay aspectos fascinantes acerca de la diversidad de estrategias adaptativas. Probablemente el género Atriplex sea uno de los más estudiados dentro de la familia, debido a que sus especies pueden emplearse en la rehabilitación de suelos salinos (Plenchette y Duponnois, 2005).
Según Soriano (1944), "establecer límites claros entre Amaranthaceae y Chenopodiaceae es una tarea difícil si bien hay ciertos caracteres que definen con bastante precisión estas dos familias. Por ejemplo, las Amaranthaceae poseen sépalos cartáceos y generalmente coloreados y los estambres soldados en su base formando un disco, en tanto que en las Chenopodiaceae los sépalos son herbáceos o membranosos y los filamentos de los estambres no están soldados o lo están muy brevemente". En la actualidad se considera que la alianza Amaranthaceae y Chenopodiaceae constituye un grupo monofilético (Kadereit et al., 2003; Müller y Borsch, 2005) y son consideradas como una sola familia, las Amaranthaceae (Stevens, 2001). Esto ya era sustentado por estudios de tipo palinológico, los que mostraban que ambas familias forman una unidad morfológica muy homogénea (Cuadrado, 1993). Sin embargo, se mantienen aún las denominaciones por separado cuando se hace referencia a uno de los grupos estrictamente (Stevens, 2001). Es por esto que en el presente trabajo se considerará a las Chenopodiaceae sensu stricto y a las Amaranthaceae sensu stricto para una mayor claridad y debido a que, a pesar de todo, aún se mantiene la controversia en la filogenia de estas dos familias, sin estar totalmente claro el acierto o no de la unión de las mismas.
Fuera de todos los problemas taxonómicos, las Chenopodiaceae son asombrosas por las características anatómicas que presentan -se pudo comprobar la existencia de un cilindro interno de células fotosintéticamente activas localizadas por dentro de la endodermis en tallos de seis Salicornieae (Redondo-Gómez et al., 2005)- así como por los beneficios sorprendentes que pueden prestar: pueden ser utilizadas para el tratamiento de efluentes provenientes de la acuicultura, donde son importantes para disminuir los niveles de nitrógeno y fósforo de las aguas (Brown et al., 1999).
Resulta interesante ensayar la domesticación de las halófitas naturales y utilizarlas como alimento, forraje o cultivos oleaginosos. Se estima que alrededor de 2500-3000 especies se encuentran naturalmente en salitrales. Esto es un enorme potencial como recurso por sí mismo, pero también como un banco de genes del cual se pueden desarrollar cultivos económicamente viables. Para esto, en primer lugar se debe estudiar la anatomía, fisiología y ecología de estas plantas (Khan y Duke, 2001).
El género Allenrolfea contiene tres especies, de las cuales una habita en Norte América [Allenrolfea occidentalis (S. Watson) Kuntze] y las otras dos [Allenrolfea patagonica (Moq.) Kuntze y Allenrolfea vaginata (Griseb.) Kuntze] exclusivamente en nuestro país (Giusti, 1984). Allenrolfea patagonica habita en suelos salados, desde Salta hasta el sur de la provincia de Buenos Aires, mientras que A. vaginata se restringe sólo al noroeste del país (Soriano, 1947).
El género Heterostachys está constituido por dos especies, ambas tratadas en el presente estudio; el área de distribución de H. olivascens (Speg.) Speg. se limita al litoral sur de Buenos Aires y al de Río Negro (Soriano, 1947); H. ritteriana (Moq.) Moq. habita en América Central (México y Haití) y América del Sur (Venezuela y Argentina, donde se la encuentra en los suelos salados desde Salta hasta el norte de Chubut) (Soriano, 1947). En los estudios de Ragonese (1951) dentro de las Salinas Grandes (noroeste de la Prov. de Córdoba, sudeste de la Prov. de La Rioja, sursureste de la Prov. de Catamarca y suroeste de la Prov. de Santiago del Estero) es considerada como una especie pionera, apareciendo en la misma situación en el Salitral de la Vidriera, Prov. de Buenos Aires.
Allenrolfea patagonica, H. ritteriana y H. olivascens son nanofanerófitas y pertenecen a la tribu Salicornieae. Las especies de esta tribu, comúnmente llamadas jumes, están altamente adaptadas a las condiciones salinas, son dominantes en áreas salobres (Kadereit et al., 2005) y son ricas en sales de sodio y potasio, principalmente carbonatos y cloruros, razón por la que se utilizaban para preparar lejías y jabones. Los métodos modernos de obtención de la soda terminaron con esa forma de utilización (Soriano, 1947).
En base a lo señalado, este estudio tiene el objetivo particular de contribuir con la descripción de la anatomía vegetativa de las tres Salicornieae Allenrolfea patagonica (Moq.) Kuntze, Heterostachys olivascens (Speg.) Speg. y H. ritteriana (Moq) Moq. Esto permitirá realizar comparaciones con otras especies ya estudiadas, e interpretar la función de determinadas estructuras anatómicas en relación a adaptaciones morfológicas a su hábitat particular.
MATERIALES Y MÉTODOS
Las especies estudiadas habitan en el Salitral de la Vidriera (Partido de Villarino) (Fig. 1 A), situado aproximadamente a 30 km de la ciudad de Bahía Blanca, Prov. Buenos Aires, Rep. Argentina. El partido de Villarino se encuentra en el sur de la Provincia de Buenos Aires, ocupando un área de 11440 km2; dentro de éste, la región de salitrales está delimitada por los paralelos 38° 35´ y 38° 50´ S, y los meridianos 62° 40´ y 63° 15´ O, con una extensión aproximada de 1580 km2 (Bonorino, 1970).
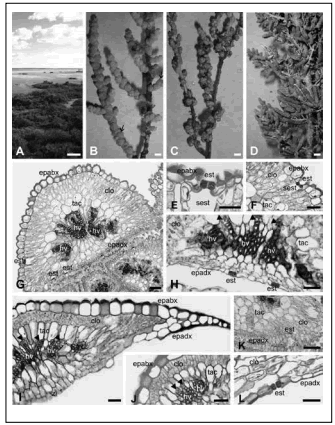
Fig. 1. Ambiente, vista externa de las especies estudiadas y anatomía foliar. A: Vista del Salitral de la Vidriera. B, F, G y K: A. patagonica. C, E, H y L: H. olivascens. D, I-J: H. ritteriana. B-D: Posición de las hojas sobre el tallo. E-F, K-L: Detalle de los estomas. H, J: Haces vasculares y tejido acuífero. Las puntas de fecha marcan el floema. Abreviaturas: clo, clorénquima; epabx, epidermis abaxial; epadx, epidermis adaxial; est, estoma; hv, haces vasculares; sest, cámara subestomática; tac, tejido acuífero; zi, zona inserta en el tallo. Las fechas indican la superficie libre triangular de la hoja. Barras: A, 30 cm; B-D, 1 cm; F-H, I-J, 70 µm; E, K, L, 30 µm.
Fig. 1. Environment, external view of the studied species and leaf anatomy. A: View of Salitral de la Vidriera. B, F, G y K: A. patagonica. C, E, H y L: H. olivascens. D, I-J: H. ritteriana. B-D: Position of the leaves on the stem. E-F, K-L: Stomata detail. H, J: Vascular bundles and aqueous tissue. Arrowheads mark the phloem. Abbreviations: clo, chlorenchyma; epabx, abaxial epidermis; epadx, adaxial epidermis; est, stomata; hv, vascular bundles; sest, substomatal chamber; tac, aqueous tissue; zi, region inserted into the stem. The arrows indicate the triangular free surface of the leaf. Bars: A, 30 cm; B-D, 1 cm; F-H, I-J, 70 µm; E, K, L, 30 µm.
Los muestreos fueron realizados durante noviembre de 2004. Se estudiaron cinco individuos de cada especie en los cuales se analizaron aproximadamente cinco muestras de cada órgano. Para la descripción de la anatomía foliar se utilizaron cortes obtenidos a partir de la parte media de las hojas, en tanto que para la anatomía del tallo los cortes se obtuvieron de la zona media de los entrenudos. Muestras de hojas y tallos fueron fijadas en formol-ácido acético-alcohol, deshidratadas en una serie de concentración creciente de alcohol etílico-alcohol butílico terciario, infiltradas en parafina e incluidas en Paramat (punto de fusión 56 °C). Se realizaron cortes transversales y longitudinales de 10 µm de espesor con micrótomo rotativo. Se tiñeron con safranina-fast green, y se montaron con bálsamo de Canadá.
Todas las observaciones se efectuaron con microscopio óptico compuesto y estereoscópico y se registraron mediante microfotografías. Los ejemplares de herbario de referencia fueron depositados en el herbario del departamento de Biología, Bioquímica y Farmacia (BBB) de la Universidad Nacional del Sur.
RESULTADOS
Las hojas de las tres especies fueron sésiles y adpresas (Fig. 1 B-D). Las hojas de A. patagonica presentaron su parte libre (aproximadamente un tercio de su longitud) de forma triangular (Fig. 1 B). La base de las mismas envolvió al tallo; la parte media de esta base fue muy gruesa pero los extremos que rodearon al tallo en ambas direcciones decrecieron en grosor. Como consecuencia de la posición adpresa de las hojas, la cara adaxial solo expuso aproximadamente un tercio de su superficie, mientras que la cara abaxial estuvo casi completamente expuesta al ambiente (Fig. 1 B). En H. olivascens las partes libres de las hojas estuvieron parcialmente imbricadas entre sí, formando una estructura compacta subesférica (Fig. 1 C), en las ramitas laterales constituida por aproximadamente ocho hojas. Esta posición de las hojas determinó que la cara adaxial prácticamente no expusiera su superficie, mientras que la cara abaxial estuvo en su mayoría expuesta al ambiente. Heterostachys ritteriana presentó una disposición y morfología foliar similar a la descripta para H. olivascens; la diferencia consistió, esencialmente, en que en H. ritteriana el conjunto de hojas (más de 15) formó una estructura más bien cilíndrica y alargada sobre las ramificaciones laterales del tallo (Fig. 1 D).
Anatomía foliar. En corte transversal, las hojas de las tres especies mostraron una epidermis uniestratificada (Fig. 1 E-K, L) con abundante depósito de cutícula en la cara abaxial (Fig. 1 E-F, I-J). La epidermis abaxial estuvo formada por células papilosas grandes con paredes engrosadas principalmente en su cara tangencial externa, siendo las paredes radiales y tangencial interna poco engrosadas (Fig. 1 E-G, I-J). Los estomas fueron hundidos presentando una cámara epiestomática (Fig. 1 E-F). La cámara subestomática fue reducida en A. patagonica (Fig. 1 F) y H. ritteriana y de mayor tamaño en H. olivascens (Fig. 1 E).
A continuación de la epidermis abaxial las tres especies presentaron clorénquima en empalizada (Fig. 1 F-G, I-J) formado por dos a cuatro capas de células rectangulares de longitud variable. Este tejido se extiendió por debajo de la epidermis abaxial formando una banda semicircular hasta alcanzar la epidermis adaxial (Fig. 1 G, I). Inmediatamente por dentro del clorénquima en empalizada se observaron células grandes que constituyeron el tejido acuífero (Fig. 1 F-K). Las células de este tejido fueron alargadas radialmente (Fig. 1 H-J) o más o menos isodiamétricas (Fig. 1 F-G), tuvieron paredes delgadas y variaron en tamaño: fueron generalmente grandes hacia la cara abaxial y más pequeñas hacia la cara adaxial de la hoja (Fig. 1 G). En H. ritteriana las células del tejido acuífero que se ubicaron hacia la cara abaxial (Fig. 1I) fueron considerablemente más grandes que las de A. patagonica y H. olivascens (Fig. 1 H). No se diferenció clorénquima esponjoso en ninguna de las tres especies. Siguiendo el criterio utilizado por Ancibor (1980) se consideró que las hojas de estas especies presentaron una estructura dorsiventral inversa quedando el clorénquima en empalizada hacia la cara abaxial y el parénquima incoloro (tejido acuífero) hacia la adaxial.
En las tres especies se observaron entre siete y nueve haces vasculares dentro del tejido acuífero (Fig. 1 G-I); los haces se reconocieron por los grupos de células floemáticas (Fig. 1 H-J) ya que el tejido xilemático formó una estructura triangular central más bien compacta (Fig. 1 G-J).
En A. patagonica la epidermis adaxial, también uniestratificada, presentó células angostas, altas y papilosas (Fig. 1 K), sobre las cuales se observó una delgada cutícula. En H. olivascens estuvo constituida por células que presentaron diversas morfologías según la región de la hoja en donde se encontraron. Cerca de los márgenes de la hoja fueron similares a las de la cara abaxial, y presentaron abundante depósito de cutícula. Hacia el centro de la cara adaxial tanto el espesor de la cutícula como las papilas disminuyeron en tamaño progresivamente, hasta que finalmente las células comenzaron a hacerse rectangulares y aplanadas tangencialmente en el centro de la hoja perdiendo la cutícula y su forma papilosa (Fig. 1 H, L). En H. ritteriana ocurrió algo similar a lo descripto en la especie anterior pero las células nunca fueron papilosas. En las tres especies, los estomas se encontraron en la superficie de la hoja donde no hay contacto con el tallo, y su ubicación fue semejante a la descripta anteriormente para la cara abaxial. En A. patagonica los estomas también fueron hundidos (Fig. 1 K) como en la cara abaxial, y en ambas especies de Heterostachys se encontraron a igual nivel que las restantes células epidérmicas (Fig. 1 H, L).
No se observó tejido de sostén de tipo colenquimático o esclerenquimático subepidérmico o asociado a los haces a manera de casquetes o vainas. Las hojas fueron anfiestomáticas, No Kranz y de tipo "Corispermoid" (Carolin et al., 1975).
Anatomía caulinar. Los tallos jóvenes de estas especies estuvieron totalmente cubiertos por hojas cuyas bases los abrazaron, quedando éstos completamente protegidos (Fig. 1 B-D),
por lo que no se diferenció una epidermis caulinar.
Un corte transversal del tallo de A. patagonica, a nivel de los primeros entrenudos, reveló dos a tres capas de células ovales, pequeñas, de paredes engrosadas que a modo de corteza, constituyeron la zona más externa del tallo (Fig. 2 A-B). Los haces vasculares, entre nueve y doce, fueron colaterales, se encontraron muy próximos a los tejidos foliares debido a que la corteza es delgada (Fig. 2 A), y estuvieron compuestos por floema y xilema de disposición muy ordenada (Fig. 2 A-B). La médula, grande, estuvo formada por células parenquimáticas de paredes delgadas (Fig. 2 A-B). En las dos especies de Heterostachys, y al mismo nivel que en A. patagonica, se observó una corteza de células grandes con paredes suberinizadas que disminuyó en tamaño hacia la estela (Fig. 2 C). Esta amplia corteza determinó que los tejidos vasculares se encontraran alejados de los tejidos foliares (Fig. 2 C-D). Continuando hacia el centro comenzó a diferenciarse el máster cámbium (Carlquist, 2007) rodeando cuatro o cinco haces vasculares primarios y una médula parenquimática compacta y pequeña (Fig. 2 C-D). En ambas especies de Heterostachys, ya en el cuarto entrenudo, el máster cámbium originó corteza secundaria (formada por células parenquimáticas de paredes suberinizadas) hacia afuera (Fig. 2 D-F), y esclereidas hacia adentro, que rodearon la mitad externa de los haces vasculares primarios, y que posteriormente conformaron una matriz esclerenquimática [(fibrous conjunctive tissue según Carlquist (2007)] (Fig. 2 E-G). Algo más hacia la base, las células de la corteza aumentaron el depósito de suberina y el máster cámbium produjo más esclereidas aumentando la matriz esclerenquimática. En la médula comenzaron a esclerosarse algunas células del tejido parenquimático (Fig. 2 F-G).

Fig. 2. Anatomía caulinar. A-B, I: A. patagonica. C, E, H: H. olivascens. D, F-G, J-K: H. ritteriana. A-C Estructura primaria del tallo. B, Detalle de la estela. D, G, I-K: Tallo maduro. E-F: Detalle de la matriz de esclereidas. H: Esclereidas corticales. A-G, I-K: corte transversal; H: corte longitudinal. Abreviaturas: ce, células de paredes engrosadas; cp, corteza primaria; cs, corteza secundaria; ec, esclereidas corticales; ep, epidermis; hv, haces vasculares; mc, máster cámbium; me, médula; mec, matriz de esclereidas; rcp, restos corteza primaria; rf, restos de tejidos foliares. Barras: A-C, E-F, 20 µm; D, G-K, 50 µm.: A, 30 cm; B-D, 1 cm; F-H, I-J, 70 µm; E, K, L, 30 µm.
Fig. 2. Stem anatomy. A-B, I: A. patagonica. C, E, H: H. olivascens. D, F-G, J-K: H. ritteriana. A-C Primary structure of the stem. B: Detail of the stele. D, G, I-K: Mature stem. E-F: Detail of the sclerenchymatic matrix. H: Cortical sclereids. A-G, I-K: cross section; H: longitudinal section. Abbreviations: ce, cells with thickened walls; cp, primary cortex; cs, secondary cortex; ec, cortical sclereids; ep, epidermis; hv, vascular bundles; mc, master cambium; me, pith; mec, sclerenchymatic matrix; rcp, primary cortez remains; rf, leaf tissue remains. Bars: A-C, E-F, 20 µm; D, G-K, 50 µm.
En secciones basales del tallo de A. patagonica (séptimo entrenudo aproximadamente), se reconocieron nuevamente las capas de células de paredes engrosadas de la corteza primaria, y continuando hacia el centro del tallo el máster cámbium, que, en este estadio, produjo corteza secundaria (formada por células parenquimáticas) hacia afuera y esclereidas, que comenzarán a formar la matriz esclerenquimática hacia adentro (Fig. 2 I). Como consecuencia de la incorporación de nuevo tejido, aumentó el diámetro del tallo y los haces vasculares se hallaron más alejados de los tejidos foliares. El parénquima medular se tornó aerenquimatoso.
Prosiguiendo en sentido basípeto en A. patagonica (noveno entrenudo) y de afuera hacia adentro, se reconocieron restos de tejidos foliares que aún recubrieron al tallo, y una corteza primaria conformada por cuatro o cinco capas de células grandes más o menos isodiamétricas y de paredes suberinizadas (Fig. 2 I). Continuando hacia el centro se observó una capa de esclereidas corticales (Fig. 2 I) y dos a tres capas de corteza secundaria (Fig. 2 I), producida por el máster cámbium (Metcalfe y Chalk, 1957; Carlquist, 2007). Estas células fueron más o menos isodiamétricas, de paredes poco suberinizadas, de menor tamaño que las de la corteza primaria y dispuestas en hileras radiales. Los haces vasculares se encontraron inmersos en la matriz esclerenquimática (Fig. 2 I) cuyas células también se dispusieron en hileras radiales; los haces vasculares secundarios se ubicaron cercanos al máster cámbium (Fig. 2 I) mientras que los primarios rodearon a la médula, de aspecto netamente aerenquimatoso. Los haces vasculares secundarios se originaron a partir del cámbium vascular, a su vez generado como pequeños grupos de células (Carlquist, 2007) en el máster cámbium.
En las especies de Heterostachys el tallo se defolió en las regiones basales (a partir del quinto entrenudo), perdiendo la protección que las hojas le otorgaban, por lo cual aquí se reconoció una epidermis (Fig. 2 G) de células pequeñas con todas sus paredes levemente engrosadas. En la capa interna de la corteza primaria se diferenciaron esclereidas corticales (Fig. 2 G) (más tempranamente en H. ritteriana que en H. olivascens), que separaron a la corteza primaria o de células grandes, de la corteza secundaria o de células menores (Fig. 2 E-G). También en estas especies, el máster cámbium es el que originó, hacia fuera, la corteza secundaria mientras que hacia adentro generó esclereidas que aumentaron el tamaño de la matriz (Fig. 2 G, J-K); estas esclereidas se encontraron en hileras defnidas (Fig. 2 J-K) al igual que en A. patagonica (Fig. 2 I). En la médula aumentó la cantidad de células esclerosadas, a la vez que la misma adquirió un aspecto aerenquimatoso (Fig. 2 G, J). Los haces vasculares secundarios (Fig. 2 J-K) se generaron de la misma forma descripta para A. patagonica.
En las tres especies se encontraron esclereidas corticales (Fig. 2 D-K) entre la corteza primaria y secundaria. Estas esclereidas se diferenciaron antes de que comenzara la actividad del máster cámbium, en grupos de cinco a quince esclereidas formando una o dos capas de células (Fig. 2 D-G, I-K). Más avanzado el crecimiento secundario, se observó que los grupos de esclereidas delimitaron puntos de rotura por donde se fragmentó la corteza primaria (Fig. 2 J-K) debido al aumento de tejidos secundarios.
Se realizaron cortes longitudinales de estos tallos para determinar las características de las esclereidas corticales y de las que forman la matriz en la que se hallan inmersos los haces. Las corticales fueron de longitud variable, en algunos casos cortas y en otros alargadas pero siempre de paredes gruesas (Fig. 2 H). Las que conformaron la matriz fueron similares a las esclereidas de mayor longitud que se encontraron en la corteza, pero, en general, de menor diámetro que las anteriores y paredes más delgadas.
DISCUSIÓN Y CONCLUSIONES
Como se puntualizó en la introducción, las Chenopodiaceae usualmente se encuentran en ambientes donde las condiciones climáticas y ambientales son desfavorables para el crecimiento de otras especies vegetales. La presencia de estas plantas en este tipo de hábitat implica la posesión de características únicas, resultado de la adaptación a los mencionados ambientes y que les permiten, por ejemplo, menores pérdidas de agua, menor incidencia de la radiación, mejor absorción de nutrientes, etc. En determinados casos, son las estructuras morfológicas o anatómicas las que permiten el desarrollo de la estrategia en cuestión, mientras que en otros, la adaptación parece ser netamente fisiológica.
Al explorar el Salitral de la Vidriera se hallaron una gran cantidad de factores de estrés (sequedad en el ambiente y en el suelo, alta radiación solar, alta concentración de sales en el suelo, etc.) que impedirían la implantación o desarrollo de algunas plantas; sin embargo, permitirían la existencia de otras de alguna manera, tales como las aquí estudiadas. A pesar de la pobreza del ambiente de tipo salobre, muchas especies aprovechan sus cualidades diferenciales para desarrollarse en él. Este ambiente está menos habitado por plantas de diversas especies, por lo cual habrá menos competidores, ya que los recursos que se pueden encontrar son muy escasos o difíciles de aprovechar. Es importante recalcar que no hay características comunes anatómicas o fisiológicas definidas para la totalidad de las xerófitas. Cada especie posee adaptaciones propias que contribuyen a mejorar su economía del agua y su respuesta a estreses relacionados a la existencia de ambientes desfavorables debido a sus propias adaptaciones, las que pudieron generarse debido a las variaciones genéticas que poseen (Pyykkö, 1966).
Las tres especies estudiadas presentaron hojas suculentas, "donde las sales se encuentran diluidas en el agua absorbida en exceso; de esta manera la planta puede regular la presión osmótica necesaria para continuar extrayendo agua del suelo salino" (Ruthsatz, 1978).
Allenrolfea patagonica, H. olivascens y H. ritteriana presentaron una reducción de la superficie foliar denominada microfilia, carácter que es considerado de tipo xeromórfico (Ragonese, 1990) y sus hojas fueron adpresas, posición considerada evasiva de la influencia ambiental (Ancibor, 1992); esta disposición de las hojas hace que una de las caras (la adaxial) esté protegida de las fluctuaciones ambientales ya que probablemente se crea una microatmósfera con condiciones más estables en el espacio que resulta entre el tallo y la hoja. La disposición adpresa de las hojas también puede interpretarse como una forma de disminución a la mitad del área foliar expuesta, carácter que es compartido con las plantas en roseta (Ancibor, 1981).
En H. olivascens y H. ritteriana los estomas de la cara adaxial estuvieron a nivel epidérmico mientras que los de la cara abaxial se encontraron hundidos. No sucedió así en A. patagonica, que los tuvo hundidos en ambas caras de la hoja; esto puede deberse a que las hojas de esta especie exponen mayor superficie de la cara adaxial y por ello deben proteger sus estomas, mientras que en las especies de Heterostachys las hojas presentaron una menor superficie adaxial expuesta.
La presencia de gran cantidad de tejido esclerenquimático es una caraterística considerada muy importante como indicador de xeromorfismo en las hojas (Ragonese, 1990). En ninguna de las tres especies se encontró tejido esclerénquimatico en las hojas, faltó por completo cualquier tipo de tejido de sostén subepidérmico o asociado a los haces vasculares. Esto puede relacionarse con el escaso desarrollo de las hojas y el gran desarrollo del tejido acuoso que les otorga turgencia confiriéndoles el sostén necesario y reemplazando en función a los mencionados tejidos.
Las especies aquí estudiadas tuvieron hojas sin estructura Kranz, lo que concuerda con observaciones previas (Carolin et al., 1975; Jacobs, 2001), y resultan de tipo "Corispermoid" (Carolin et al., 1975), ya que no existió una diferenciación entre clorénquima en empalizada y esponjoso y presentaron tejido acuífero en el centro de la hoja donde los haces vasculares se hallaron inmersos. La anatomía de tipo No Kranz está altamente distribuida en las Chenopodiaceae-subfamilias Polycnemoideae, Betoideae, Salicornioideae, Corispermoideae y Sarcobatoideae. Se puede decir que sólo en una subfamilia (Salsoloideae), todos sus representantes poseen anatomía Kranz, y que dentro de las Suedoideae y Chenopodiodeae hay especies con anatomía Kranz y No Kranz (Carolin et al., 1975). Sin embargo, según algunos estudios (Akhani et al., 1997; P´yankov et al., 1997; Voznesenskaya et al., 1999) las especies que presentan anatomía de tipo Kranz se ven favorecidas en ambientes salobres ya que hacen un mejor uso del agua disponible, aprovechan mejor el dióxido de carbono y sobre todo utilizan de manera más eficiente los pocos nutrientes que existen en el suelo. Se puede concluir que las especies aquí estudiadas, no cumplieron con esta regla y que la optimización en la utilización de los recursos estaría dada por otras estrategias.
Algunas de las características foliares descriptas en este estudio para A. patagonica, H. olivascens y H. ritteriana - epidermis uniestratificada papilosa, estructura dorsiventral inversa- son similares a las halladas en Salicornia pulvinata R.E. Fr. (Ancibor, 1980) y en otras especies de la misma tribu. Esto constituye una prueba más del patrón común en la organización tisular en especies estrechamente emparentadas, y habitantes de ambientes de características similares.
Fuera de las Chenopodiaceae, estudios en tres variedades de la especie Nassauvia lagascae (Don) F. Meigen (Compositae) revelan que la microfilia, posesión de estomas protegidos, denso indumento lanoso, entre otras características, son sinónimos de una estructura altamente especializada para la supervivencia en ambientes xerófilos (Ragonese, 1990). Esta combinación de caracteres xeromórficos dista considerablemente de los ya mencionados para las especies aquí estudiadas, exceptuando la microfilia que parece estar muy extendida en diversas familias botánicas. Según Ancibor (1992) gran cantidad de especies pertenecientes a diferentes familias -Nyctaginaceae, Polygonaceae, Solanaceae y Verbenaceae- presentan escaso número de hojas, reducidas a muy reducidas y adpresas e imbricadas en densas rosetas; estas características, en parte, se encontraron en A. patagonica y las dos especies de Heterostachys investigadas en este trabajo, y parecen ser adaptativamente muy valiosas, producto de la convergencia evolutiva.
Los tallos jóvenes de ambas especies de Heterostachys tuvieron una gran cantidad de matriz esclerenquimática. Este tejido les confiere una notable rigidez, y su abundancia está relacionada con la pobreza del suelo (Ancibor, 1982). En este estadio las dos especies de Heterostachys presentaron una anatomía prácticamente idéntica, algo lógico para dos especies de un mismo género que persisten bajo condiciones ambientales similares. El tallo de A. patagonica, en cambio, presentó características completamente diferentes en sus primeros entrenudos que la alejaron, en este estadio, de las dos especies de Heterostachys: ausencia de tejido de sostén, corteza delgada, haces vasculares periféricos, xilema de disposición ordenada.
Habiéndose estudiado los tallos en las tres Salicornieae desde su ápice hasta una distancia de aproximadamente un centímetro o más desde el mismo, pudo observarse que A. patagonica presentó crecimiento secundario más tardío (entre séptimo y noveno entrenudo) que las especies de Heterostachys, donde comenzó más tempranamente (a partir del cuarto entrenudo). A diferencia de lo que ocurrió con el crecimiento primario, las tres especies presentaron el mismo patrón de organización en estadios con crecimiento secundario: corteza primaria, esclereidas corticales, corteza secundaria, máster cámbium, matriz de esclereidas y haces vasculares incluidos en ella. El crecimiento secundario en las especies de Heterostachys se manifestó en los primeros entrenudos, característica que las diferenció de A. patagonica y de otras Chenopodiaceae, donde se registra entre el décimo y duodécimo entrenudo (Balfour, 1965). Este tipo de crecimiento secundario es un carácter compartido por la mayoría de las Chenopodiaceae (Metcalfe y Chalk, 1957).
Algo para destacar es que, en general, cuando en la literatura se describen los cámbiumes sucesivos (anteriormente considerado como crecimiento secundario anómalo) se hace referencia a una diferenciación de xilema y floema diferente de la estudiada en otras especies, donde sólo existe el cámbium vascular y sus derivados (Balfour, 1965; Ancibor, 1980; Fahn y Zimmermann, 1982; D´Ambrogio et al., 2000; Bercu y Bavaru, 2004). En las tres especies aquí estudiadas se encontró máster cámbium y sus derivados (corteza secundaria, cámbium vascular, matriz esclerenquimática); debido a esto se puede afirmar que este tipo de crecimiento se corresponde con el descripto por Carlquist (2007) para otras especies de Caryophyllales.
En este estudio pudo observarse que las tres especies presentaron esclereidas corticales que se ubicaron entre la corteza primaria y secundaria, conformando lo que sería la capa más interna de la corteza primaria. Ellas delimitan zonas por donde se produce la ruptura de la corteza primaria por acción de la presión que ejercen los tejidos secundarios que se generan a partir del máster cambium; éste es el primer registro de una relación entre la posición de las esclereidas corticales y puntos de ruptura de la corteza primaria, que no ha sido reportado anteriormente en ninguna otra especie.
La corteza secundaria fue encontrada en varias especies aunque en ellas no se han observado más de dos capas de células conformándola mientras que en otras especies no se logró identificar (Carlquist, 2007). En las tres especies aquí estudiadas se ha diferenciado una corteza secundaria, formada al menos por tres capas de células, llegando a encontrarse hasta cinco en un grado avanzado del crecimiento secundario. Es posible que en los estudios anteriores no se hayan analizado etapas tardías del crecimiento secundario existiendo la probabilidad de que al incrementarse este crecimiento se produzca un aumento en la cantidad de capas de corteza secundaria, al igual que sucede con la cantidad de xilema secundario.
Fahn y Shchori (1967) y Carlquist (2007) destacaron la importancia de que en las especies que poseen crecimiento secundario "anómalo", los tejidos conductores de los tallos (sobre todo el floema) se encuentren protegidos por tejidos de mayor resistencia. Al parecer, estos tejidos proveen una mayor durabilidad a los tejidos conductores. Esta propiedad se encuentra bien desarrollada en especies altamente adaptadas a condiciones xerófilas, ya que el foema así protegido resiste las condiciones de desecación extrema durante las estaciones desfavorables; las plantas con crecimiento secundario normal no son tan resistentes ya que el floema -que se encuentra en la periferia- es más propenso a colapsar.
Se está avanzando en la determinación de los genes que participan en la adaptación al estrés o en las reacciones de tolerancia al mismo. Se espera que esto provea un conocimiento integrado de las bases bioquímicas y fisiológicas de las respuestas de las plantas (Cushman y Bohnert, 2000). Este punto constituye una vía más de avance no sólo hacia un mejor conocimiento del funcionamiento de los halófitos sino también hacia un camino que muestre el gran potencial de usos que abarcan estas especies.
Sería razonable entonces pensar en la protección del hábitat de las especies halófilas y su estudio exhaustivo, no sólo por la potencialidad de sus usos a futuro sino por el simple valor que posee la biodiversidad en sí misma.
AGRADECIMIENTOS
Este trabajo fue financiado por la Secretaría de Ciencia y Tecnología, Universidad Nacional del Sur (PGI 24/B125). Las autoras agradecen al Dr. Carlos Villamil por la identificación de las especies con las que se realizó este estudio, y a todos aquellos que de alguna forma contribuyeron anónimamente a la realización de este trabajo.
REFERENCIAS
1. Akhani, H., P. Trimborn y H. Ziegler (1997). Photosynthetic pathways in Chenopodiaceae from Africa, Asia and Europe with their ecological, phytogeographycal and taxonomial importance. Plant Systematics and Evolution 206: 187-221. [ Links ]
2. Ancibor, E. (1980). Estudio anatómico de la vegetación de la Puna de Jujuy. II. Anatomía de las plantas en cojín. Boletín de la Sociedad Argentina de Botánica 19: 157-202. [ Links ]
3. Ancibor, E. (1981). Estudio anatómico de la vegetación de la Puna de Jujuy. III. Anatomía de las plantas en roseta. LILLOA 3: 125-136. [ Links ]
4. Ancibor, E. (1982). Estudio anatómico de la vegetación de la Puna de Jujuy. IV. Anatomía de los subarbustos. PHYSIS 41: 107-114. [ Links ]
5. Ancibor, E. (1992). Anatomía ecológica de la vegetación de La Puna de Mendoza. I. Anatomía foliar. Parodiana 7: 63-76. [ Links ]
6. Balfour, E. (1965). Anomalous secondary thickening in Chenopodiaceae, Nyctaginaceae and Amaranthaceae. Phytomorphology 15: 111-122. [ Links ]
7. Bercu, R. y E. Bavaru (2004). Anatomical aspects of Salsola kali subsp. ruthenica (Chenopodiaceae). Phytologia Balcanica 10: 227-232. [ Links ]
8. Bonorino, A.G. (1970). Contribución al conocimiento de las aguas del Partido de Villarino, provincia de Buenos Aires. Actas de la Reunión sobre la Geología de las Sierras Australes Bonaerenses, La Plata, Argentina, pp. 177-191. [ Links ]
9. Brown, J.J., E.P. Glenn, K.M. Fitzsimmons y S.E. Smith (1999). Halophytes for the treatment of saline aquaculture effluent. Aquaculture 175: 255-268. [ Links ]
10. Carlquist, S. (2007). Successive cambia revisited: ontogeny, histology, diversity, and functional significance. Journal of the Torrey Botanical Society 134: 301-332. [ Links ]
11. Carolin, R.C., S.W.L. Jacobs y M. Vesk (1975). Leaf Structure in Chenopodiaceae. Botanisches Jahrbücher für Systematik 95: 226-255. [ Links ]
12. Cuadrado, G.A. (1993). Granos de polen de Chenopodiaceae del Nordeste Argentino, géneros Atriplex, Chenopodium, Holmbergia, Salicornia y Sueda. Boletín de la Sociedad Argentina de Botánica 29: 15-23. [ Links ]
13. Cushman, J.C. y H.J. Bohnert (2000). Genomic approaches to plant stress tolerance. Current Opinion in Plant Biology 3: 117-124. [ Links ]
14. D`ambrogio, A., S. Fernández., E. González, I. Furlan y N. Frayssinet (2000). Estudios morfoanatómicos y citológicos en Atriplex sagittifolia. Boletín de la Sociedad Argentina de Botánica 35: 215-226. [ Links ]
15. Fahn, A. y Y. Shchori (1967). The organization of the secondary conducting tissues in some species of the Chenopodiaceae. Phytomorphology 17: 147-154. [ Links ]
16. Fahn, A. y M.H. Zimmermann (1982). Development of the successive cambia in Atriplex halimus (Chenopodiaceae). Botanical Gazette 143: 353-357. [ Links ]
17. Flowers, T.J., M.A. Hajibagheri y N.J.W. Clipson (1986). Halophytes. The Quarterly Review of Biology 61: 313-337. [ Links ]
18. Giusti, L. (1967). Chenopodiaceae. En: Cabrera, A.L. (ed), pp. 81-127. Flora de la provincia de Buenos Aires, Parte III. Colección Científica del INTA. Buenos Aires, Argentina. 648 p. [ Links ]
19. Giusti, L. (1984). Chenopodiaceae. En: Correa, M.N. (ed), pp. 99-139. Flora Patagónica, Parte IVa. Colección Científica del INTA. Buenos Aires. 373 p. [ Links ]
20. Jacobs, S.W.L. (2001). Rewiew of Leaf Anatomy and Ultrastructure in the Chenopodiaceae (Caryophyllales). Journal of the Torrey Botanical Society 128: 236-253. [ Links ]
21. Kadereit, G., T. Borsch, K. Weising y H. Freitag (2003). Phylogeny of Amaranthaceae and Chenopodiaceae and the evolution of C4 photosynthesis. International Journal of Plant Sciences 164: 959-986. [ Links ]
22. Kadereit, G., D. Gotzek, S. Jacobs y H. Freitag (2005). Origin and age of australian Chenopodiaceae. Organisms, Diversity and Evolution 5: 59-80. [ Links ]
23. Khan, M.A. y N.C. Duke (2001). Halophytes-A resource for the future. Wetlands Ecology and Management 6: 455-456. [ Links ]
24. Metcalfe, C. R. y L. Chalk (1957). Anatomy of the Dicotyledons; leaves, stem and wood in relation to taxonomy with notes on economic uses. Vol. II. Clarendon Press, Oxford. 1500 p. [ Links ]
25. Múlgura, M.E. y A. Marticorena (2008). Chenopodiaceae. En: Zuloaga, F.O., O. Morrone y M.J. Belgrano (eds), pp. 1909-1929. Catálogo de las Plantas Vasculares del Cono Sur. Vol. II. Missouri Botanical Garden Press. Missouri, USA. 3348 p. [ Links ]
26. Müller, K. y T. Borsch (2005). Phylogenetics of Amaranthaceae based on matK/trnK sequence data - Evidence from parsimony, likelihood, and Bayesian analyses. Annals of the Missouri Botanical Garden 92: 66-102. [ Links ]
27. Plenchette, C. y R. Duponnois (2005). Growth response of the saltbush Atriplex nummularia L. to inoculation with the arbuscular mycorrhizal fungus Glomus intraradices. Journal of Arid Environments 61: 535-540. [ Links ]
28. P´yankov, V.I., E.V. Voznesenskaya, A.V. Kondratschuk y C.C. Black Jr. (1997). A comparative anatominal and biochemical analysis in Salsola (Chenopodiaceae) species with and without a Kranz type leaf anatomy: a possible reversion of C4 to C3 photosynthesis. American Journal of Botany 84: 597-606. [ Links ]
29. Pyykkö, M. (1966). The leaf anatomy of East Patagonian xeromorphic plants. Annales Botanici Fennici 3: 453-622. [ Links ]
30. Ragonese, A. (1951). La vegetación de la República Argentina II - Estudio Fitosociológico de las Salinas Grandes. Serie Fitogeográfica. Ministerio de Agricultura y Ganadería. Buenos Aires, Argentina. 234 p. [ Links ]
31. Ragonese, A.M. (1990). Caracteres xeromorfos foliares de Nassauvia lagascae (Compositae). Darwiniana 30: 1-10. [ Links ]
32. Redondo-Gómez, S., C. Wharmby, F.J. Moreno, A. De Cires, J.M. Castillo, T. Luque, A.J. Dhabi y M.E. Figueroa (2005). Presence of internal photosynthetic cylinder surrounding the stele in stems of the tribe Salicornieae (Chenopodiaceae) from SW Iberian Peninsula. Photosynthetica 43: 157-159. [ Links ]
33. Ruthsatz, B. (1978). Las plantas en cojín de los semi-desiertos andinos del Noroeste Argentino. Darwiniana 21: 491-539. [ Links ]
34. Simon, L. (1997). Morphologie, ontogénie et valeur adaptative des surfaces glandulaires mucilagènes dans le genre Chenopodium L. (Chenopodiaceae). Académie des Sciences París, Sciences de la Vie 320: 615-620. [ Links ]
35. Soriano, A. (1944). El Género "Nitrophila" en la Argentina y su posición sistemática. Revista Argentina de Agronomía 11:302-308. [ Links ]
36. Soriano, A. (1947). Las Quenopodiáceas de la Tribu "Salicornieae" en la República Argentina. Revista Argentina de Agronomía 14: 148-172. [ Links ]
37. Soriano, A. (1948). Los géneros de Quenopodiáceas de la flora Argentina. Revista Argentina de Agronomía 15: 1-18. [ Links ]
38. Stevens, P.F. (2001 onwards). Angiosperm Phylogeny Website. Version 8, June 2008. http://www.mobot.org/MOBOT/research/APweb/. Último acceso Junio de 2012. [ Links ]
39. Voznesenskaya, E.V., V.R. Franceschi, V.I. P´yankov y G.E. Edwards (1999). Anatomy, chloroplast structure and compartmentation of enzymes relative to photosynthesis mechanisms in leaves and cotyledons of species in the tribe Salsoleae (Chenopodiaceae). Journal of Experimental Botany 50: 1779-1795. [ Links ]














