Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.84 no.1 Vicente López jun. 2015
ARTÍCULOS ORIGINALES
Arthrobacter agilis UMCV2 acelera el crecimiento de Pinus devoniana
Arthrobacter agilis UMCV2 accelerates growth of Pinus devoniana
Valencia-Cantero E2, I Flores-Cortez2, J Ambriz-Parra1, P López-Albarrán1, C Velázquez-Becerra1
1 Facultad de Ingeniería en Tecnología de la Madera, Universidad Michoacana de San Nicolás de Hidalgo. Edificio D, Ciudad Universitaria. C.P. 58030 Morelia, Michoacán, México.
2 Instituto de Investigaciones Químico Biológicas, Universidad Michoacana de San Nicolás de Hidalgo. Edifcio B5; Ciudad Universitaria. C.P. 58030 Morelia, Michoacán, México.
Address Correspondence to: Crisanto Velázquez-Becerra, e-mail: cvelazquez@umich.mx, Tel: 5.443.3223500 Ext. 3099; Fax: 5.443.3260379.
Recibido / Received 14.III.2014.
Aceptado / Accepted 10.IV.2014.
Resumen. Pinus devoniana es una de las especies de Pinus más distribuida en México y posee una gran importancia económica y ecológica. En este trabajo determinamos el efecto de la inoculación de plantas de P. devoniana en etapas juveniles con la rizobacteria Arthrobacter agilis UMCV2 y su compuesto dimetilhexadecilamina en condiciones de invernáculo. Nuestros resultados mostraron que A. agilis UMCV2 promovió el crecimiento de P. devoniana medido como incremento de la altura, grosor del tallo, peso fresco e incremento en la concentración de clorofila. Bajo nuestras condiciones experimentales, el compuesto bacteriano dimetilhexadecilamina produjo un incremento en la concentración de clorofila. Estos datos muestran la viabilidad del uso de A. agilis para mejorar significativamente la velocidad de crecimiento de P. devoniana en condiciones de vivero.
Palabras clave: Arthrobacter agilis UMCV2; Dimetilhexadecilamina; Pinus devoniana; Rizobacterias promotoras del crecimiento vegetal.
Abstract. Pinus devoniana is one of the most widely distributed species of Pinus in Mexico, and has a relevant economic and ecological importance. In this work, the effect of inoculating juvenile P. devoniana plants with the rhizobacteria Arthrobacter agilis UMCV2, and its dimethylhexadecylamine compound was studied under greenhouse conditions. Our results showed that A. agilis UMCV2 promoted growth of P. devoniana as a result of increases on height and stem diameter, fresh weight and chlorophyll concentrations. Under our experimental conditions, the bacterial dimethylhexadecylamine compound produced an increase in the concentration of chlorophyll. These data show the feasibility of using A. agilis UMCV to significantly enhance the growth rate of P. devoniana at a greenhouse scale.
Keywords: Arthrobacter agilis UMCV2; Dimethylhexadecylamine; Pinus devoniana; PGPRs.
INTRODUCCIÓN
El género Pinus incluye aproximadamente 110 especies y es el género de coníferas más extendido en el hemisferio norte (Eckert, 2006; Liston, 1999), especialmente en México. En México una de las especies que se destacan por su amplia distribución e importancia económica es P. devoniana Lindley, también conocida como P. michoacana Martínez (Perry, 1991). P. devoniana es endémico de México y Guatemala. En México está distribuido en los estados de Nayarit, Jalisco, Colima, Michoacán, Guerrero, Guanajuato, Morelos, Puebla, Hidalgo, Tlaxcala, Oaxaca, Veracruz, Zacatecas, y Chiapas (Perry, 1991; Farjon y Styles, 1997). La madera de P. devoniana se destina a la industria de la celulosa y el aserrío, obteniéndose de ellos diferentes productos de un alto valor económico (Perry, 1991; Flores-Velázquez et al., 2007). Pinus devoniana requiere de un largo periodo de tiempo para poder ser aprovechado, ya que tarda al menos 10 años en alcanzar la talla necesaria para su explotación comercial (Zepeda y Acosta, 2000).
Algunas bacterias que habitan en torno a las raíces de las plantas (rizobacterias) pueden promover el crecimiento de éstas. A dichas bacterias se las denomina rizobacterias promotoras del crecimiento vegetal o PGPR (por sus siglas en idioma Inglés) (Ortíz-Castro et al., 2013). Una estrategia para incrementar la velocidad de crecimiento de P. devoniana y otras especies arbóreas ha sido la utilización de PGPR (Lugtenberg y Kamilova, 2009).
Las PGPR pueden promover el crecimiento mediante mecanismos de biofertilización que incluyen la fijación de nitrógeno (Hassan, 2013), solubilización del fosfato (Ramos et al., 2007) y de hierro (Valencia-Cantero et al., 2007), producción de fitohormonas (Barriuso et al., 2005; Ortíz-Castro et al., 2008), inhibición de actividad fúngica y producción de compuestos orgánicos volátiles que actúan como moléculas señal (Velázquez-Becerra et al., 2011 y 2013).
Las PGPR naturalmente presentes en la rizósfera de plantas han logrado incrementar el crecimiento en el porte arbóreo. Así por ejemplo, la inoculación de Bacillus licheniformis CECT 5106 y B. pumilus CECT 5105 promueven el crecimiento de P. pinea y Quercus ilex induciendo cambios en la comunidad microbiana rizosférica (Probanza et al., 2002; Domenech et al., 2004). La inoculación de especies forestales con PGPR ha sido propuesta como estrategia para mejorar el crecimiento de las plántulas con fines de reforestación (Chanway, 1997). Previamente se había sugerido a Arthrobacter citreus L62, aislada de la rizósfera de Pinus pinaster, como candidata para promover el crecimiento de plántulas de pinos por su capacidad para producir auxinas y sideróforos (Barriuso et al., 2005). Así mismo, Arthrobacter oxydans N74 (aislada de Pseudotsuga menziesii ecotipo Williams Lake) fue capaz de promover el crecimiento de dicho ecotipo, pero falló en promover el crecimiento de Pseudotsuga menziesii ecotipo Chilliwack (Chanway y Holl, 1994).
Por otro lado, el empleo de PGPRs como bioinoculantes no siempre consiguen promover el crecimiento de las plantas (Castellanos et al., 1995). Entre los factores que afectan el éxito de los bioinoculantes está la competencia con bacterias nativas y la predación efectuada por los protozoarios (Castellanos et al., 1995; Jousset et al., 2008). Estudios a nivel de microcosmos han mostrado que generar un disturbio como el calentamiento del suelo, mejora la posibilidad del establecimiento de bacterias inoculadas en nuevos ambientes (Liu et al., 2012).
En nuestro grupo de trabajo hemos mostrado que la rizobacteria Arthrobacter agilis UMCV2 se comporta como PGPR, promoviendo el crecimiento de plantas leguminosas como Phaseolus vulgaris, Medicago sativa y M. truncatula (Valencia-Cantero et al., 2007; Velázquez-Becerra et al., 2011; Orozco-Mosqueda et al., 2013a). Mediante un análisis cromatográfico del perfil de compuestos volátiles se encontró que A. agilis UMCV2 produce dimetilhexadecilamina (DMA16), molécula que por sí sola es capaz de promover el crecimiento de la planta y estimularla para que active sus mecanismos de solubilización y absorción de hierro (Orozco-Mosqueda et al., 2013a). La DMA16 ya se ha reportado en el perfil de compuestos volátiles de otras PGPR como B. subtilis G8 (Liu et al., 2008) y Sinorrhizobium meliloti (Orozco-Mosqueda et al., 2013b).
En el presente trabajo buscamos evaluar el efecto de la inoculación de A. agilis UMCV2 y la adición del compuesto DMA16, sobre el crecimiento de la especie arbórea P. devoniana en etapas tempranas de su desarrollo, en un ambiente de vivero.
MATERIALES Y MÉTODOS
Material Vegetal. Se usaron árboles juveniles de P. devoniana de aproximadamente 12 meses de edad que se obtuvieron de la Comisión Forestal del Estado de Michoacán, México (COFOM).
Cepa Bacteriana. Se empleó la rizobacteria A. agilis UMCV2 (Valencia-Cantero et al., 2007), donada por el laboratorio de Ecología Microbiana del Instituto de Investigaciones Químico-Biológicas de la UMSNH, Morelia Michoacán México.
Influencia de A. agilis UMCV2 y la DMA16 sobre P. devoniana. Los arboles juveniles de P. devoniana previamente crecidos en vivero (COFOM), fueron transportados a nuestro laboratorio. Las raíces se lavaron minuciosamente con agua estéril, y los juveniles fueron resembrados en macetas (un ejemplar por maceta) de 15 cm de diámetro y 25 cm de altura. Cada maceta contuvo una mezcla de sustrato (3 kg): 60% peat moss, 20% agrolita y 20% vermiculita.
Se diseñaron tratamientos en los cuales las plántulas de pinos fueron expuestas a la bacteria UMCV2 y al compuesto DMA16 en condiciones de sustrato estéril y no estéril de acuerdo a la Tabla 1.
Tabla 1. Descripción de los tratamientos empleados en este estudio.
Table 1. Description of treatments used in this study.

Los tratamientos SNE-UMCV2 y SE-UMCV2 fueron inoculados al inicio del experimento con 250 mL de una suspensión que contenía A. agilis UMCV2 (1x109 ufc/mL). La cepa se hace crecer previamente por 5 días en medio Agar Nutritivo (AN) a 25 °C en oscuridad (incubadora microbiológica); posteriormente, se recuperan las células con agua esterilizada (Velázquez-Becerra et al., 2011).
El compuesto dimetilhexadecilamina (DMA16) fue obtenido de la casa comercial Sigma-Aldrich (CAS: 112-69-6). Éste fue aplicado en el sustrato de los tratamientos SNE-DMA16 y SE-DMA16 como agua de riego también desde el inicio del experimento (a una concentración final de 100 μM). Cada 8 días se repitió la aplicación. La esterilización del sustrato para nuestros tratamientos SE-UMCV2 y SE-DMA16 se efectuó en un autoclave a 1,4 kg/cm2 y 120 °C durante 20 min por 3 días consecutivos.
En nuestros tratamientos, cada de 21 días durante 126 días, se calculó el porcentaje de crecimiento de las plántulas de pinos de la siguiente manera: [(Valor final - valor inicial) / valor inicial] x 100. Las mediciones efectuadas en las plántulas fueron: Longitud tallo, grosor de la base del tallo y grosor del tallo a su altura media. Después de 126 días se registraron los pesos frescos de las partes aérea y raíz, además de la concentración de clorofila. La concentración de clorofila en las acículas se determinó siguiendo a Steubing et al. (2002) con mínimas modificaciones: Se (1) trituró una muestra de aproximadamente 1 g de acículas de P. devoniana con nitrógeno líquido, (2) aforó a 5 mL con acetona al 80%, (3) dejó incubar por 12 h y (4) filtró en papel filtro (Whatman No. 4). Se determinó la absorbencia de la muestra en un espectrofotómetro a 664 y 646 nm. La concentración de clorofila se calculó de acuerdo a las fórmulas: Clorofila a = (11.96× A664) - (1.93× A646); Clorofila b = (20.36×A646) -¶ (5.50×A664); Concentración de clorofila total en μg/g = (mL acetona × concentración de clorofilas a+b) / peso de la muestra.
Análisis estadístico. Se usó el paquete estadístico STATISTICA 7.0 de statsoft, aplicando ANOVA y una prueba de mínima diferencia significativa (LSD) de Fisher (significancia de 0,05%).
RESULTADOS
La inoculación de A. agilis UMCV2 en etapas juveniles de Pinus devoniana, o la adición de DMA16, produjo un incremento en el crecimiento de las plántulas. Este incremento fue mayor cuando las plántulas crecieron en sustrato no esterilizado, y se observó principalmente en la longitud del tallo de las plántulas (Fig. 1A). Desde la primera mediación realizada (día 21) las plántulas tratadas mostraron un crecimiento muy superior a las plántulas control. Esta estimulación de crecimiento se mantuvo (aunque de forma menos intensa) durante el resto del tiempo que duró el experimento. Al finalizar el mismo (126 días), las plántulas inoculadas con A. agilis UMCV2, y a las que se agregó DMA16, crecieron en promedio 70 y 62%, respectivamente, respecto a su tamaño inicial, comparado con un 22% de crecimiento que experimentaron las plántulas control. El crecimiento en grosor en la base del tallo fue estimulado solo por inoculación con UMCV2 y fue más discreto (Fig. 1B). A partir del día 63 del experimento, el tratamiento con UMCV2 en el sustrato no esterilizado se separó del resto de los tratamientos, que tuvieron un crecimiento similar al control. Al finalizar el experimento, el tratamiento con UMCV2 en sustrato no esterilizado tuvo un incremento de 53% en el grosor de la base del tallo respecto de su grosor inicial, mientras que crecimiento en grosor en la base del tallo fue de aproximadamente 32% en el resto de los tratamientos.
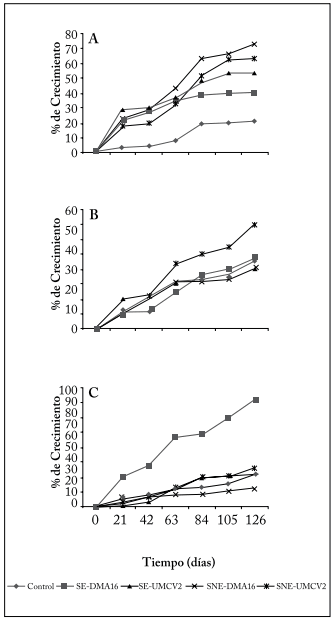
Fig. 1. Incremento (%) del crecimiento del tallo de plántulas de P. devoniana medidos en diferentes fechas respecto al valor inicial. (A) Longitud del tallo; (B) Grosor en la base del tallo; (C) Grosor en la parte media del tallo. Los tratamientos mostrados son Control, sustrato estéril adicionado con DMA16 (SE-DMA16) o inoculado con A. agilis UMCV2 (SE-UMCV2), sustrato no estéril adicionado con DMA16 (SNE-DMA16) o inoculado con A. agilis UMCV2 (SNE-UMCV2).
Fig. 1. Increase (%) of stem growth on seedlings of P. devoniana measured at different dates with respect to the initial value. (A) Stem length; (B) width at the stem base; (C) width at the intermediate portion of the stem. Treatments include Control; sterile substrate with DMA16 (SE-DMA16) or inoculated with A. agilis UMCV2 (SE-UMCV2); non sterile substrate with DMA16 (SNE-DMA16) or inoculated with A. agilis UMCV2 (SNE-UMCV2).
Las plántulas crecidas en sustrato esterilizado adicionadas con DMA16 tuvieron una estimulación del incremento en grosor de la parte media del tallo. Dicho incremento alcanzó un 90% al finalizar el experimento respecto a su grosor inicial. El resto de los tratamientos, incluido el control, tuvieron un incremento de alrededor del 25% (Fig. 1C).
Las plántulas crecidas en sustrato no esterilizado e inoculadas con A. agilis UMCV2 produjeron una biomasa área estadísticamente superior, y tuvieron una clara tendencia de tener una mayor concentración de clorofila, en comparación con los controles no tratados (Figs. 2A y B). Las plantas tratadas con A. agilis UMCV2 en sustrato no esterilizado produjeron raíces de longitud estadísticamente similar a las plantas control, pero con una diferencia estadísticamente superior en el peso fresco (Figs. 2C y D).
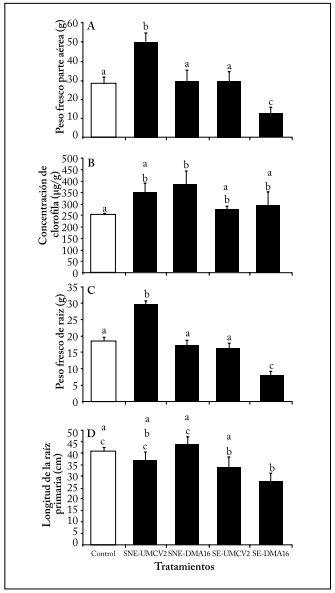
Fig. 2. Efecto de la inoculación con A. agilis UMCV2 y la dimetilhexadecilamina (DMA16) sobre P. devoniana. Panel A: Peso fresco de la parte aérea (g); B: Concentración de clorofila (µg/g); C: Peso fresco de la raíz (g); D: Longitud de la raíz (cm). Los tratamientos mostrados son Control, sustrato estéril adicionado con DMA16 (SE-DMA16) o inoculado con A. agilis UMCV2 (SE-UMCV2), sustrato no estéril adicionado con DMA16 (SNE-DMA16) o inoculado con A. agilis UMCV2 (SNE-UMCV2). Las barras con la misma letra son estadísticamente similares.
Fig. 2. Effect of inoculation with A. agilis UMCV2 and dimethylhexadecylamine (DMA16) on P. devoniana. A: Fresh weight of the aerial part (g); B: Chlorophyll concentration (µg/g); C: Root fresh weight (g); D: Root length (cm). Treatments are Control, sterile substrate with DMA16 (SE-DMA16) or inoculated with A. agilis UMCV2 (SE-UMCV2), non-sterile substrate with DMA16 (SNE-DMA16) or inoculated with A. agilis UMCV2 (SNE-UMCV2). Histograms followed by the same letter are statistically similar.
Las plántulas crecidas en sustrato esterilizado y adicionadas con DMA16 fueron inhibidas respecto a la producción de biomasa. Dichas plántulas produjeron 50% menos de biomasa aérea, y 58% menos de biomasa de raíz (estadísticamente menor), y raíces 35% más cortas que los controles no tratados (también estadísticamente inferiores al control) (Figs. 2A, 2C y 2D). La concentración de clorofila no fue afectada (p>0,05) (Fig. 2B).
Las plantas tratadas con A. agilis UMCV2 en sustrato esterilizado y con DMA16 en sustrato no esterilizado no mostraron diferencias significativas con respecto al control. La excepción correspondió a la concentración de clorofila que fue incrementada por el tratamiento con DMA16 en sustrato esterilizado (Fig. 2B).
DISCUSIÓN
En el presente trabajo se mostró que la inoculación de plántulas juveniles de P. devoniana con la PGPR A. agilis UMCV2, aislada de la rizósfera de Zea mays (Valencia-Cantero et al., 2007), incrementó el crecimiento de las plántulas. Se probaron dos condiciones de inoculación, plántulas crecidas en sustrato no esterilizado y en sustrato esterilizado. Este último tratamiento fue incluido bajo la hipótesis de que al eliminar a las poblaciones bacterianas nativas en torno a la raíz de P. devoniana, darían una ventaja competitiva a la bacteria A. agilis para su implantación en la raíz del pino; como resultado, se incrementarían los efectos de la bacteria sobre la plántula. Sin embargo, la esterilización del sustrato, lejos de mejorar el crecimiento de la plántula, lo limitó; los mayores efectos de la bacteria se dieron en sustrato sin esterilizar. Es posible que: i) al ser esterilizado el sustrato se hayan producido compuestos tóxicos, y ii) en el sustrato existieran otros microorganismos capaces de promover el crecimiento del pino que fueron eliminados con el procedimiento de esterilización.
Es conocido que algunos microorganismos promueven la movilización de N, P, K o Fe, y frecuentemente no son los mismos microorganismos los que movilizan los distintos nutrimentos (Ortíz-Castro et al., 2013). De cualquier forma, este trabajo mostró que A. agilis no requirió de la eliminación o de la atenuación de la flora bacteriana nativa de las raíces de P. devoniana para poder ejercer un efecto promotor en el crecimiento del pino, que fue muy notable [70% más de acumulación de biomasa; más del doble de elongación de la parte aérea respecto a las plántulas control (Figs. 1 y 2)].
La inoculación de A. agilis también produjo una tendencia al incremento en la concentración de clorofila en plántulas crecidas en sustrato no esterilizado (Fig. 2B). Desde que la concentración de clorofila es un parámetro indicativo del nivel nutricional de hierro, es posible que la presencia de A. agilis UMCV2 mejore la nutrición por hierro de las plántulas de P. devoniana, como sucede en M. truncatula (Orozco-Mosqueda et al., 2013a).
Las plántulas en sustrato no esterilizado adicionadas con DMA16 tuvieron un crecimiento más rápido e incrementaron la concentración de clorofila en comparación con el control no tratado. Sin embargo, cuando la DMA16 se adicionó a plántulas crecidas en sustrato esterilizado, el efecto fue negativo en todos los parámetros medidos, excepto la concentración de clorofila. Previamente se había mostrado in vitro que concentraciones superiores a 16 μM de DMA16 en el medio de cultivo producían inhibición en el crecimiento vegetal de plántulas de M. sativa (Velázquez Becerra et al., 2011), pero concentraciones de 100 μM no producían daños en los foliolos de Fragaria ananassa (fresa) también in vitro (Velázquez-Becerra et al., 2013). Sin embargo, no había ningún antecedente de plantas crecidas en suelo.
El presente trabajo mostró que una concentración relativamente alta de DMA16 (100 μM) suministrada a los pinos en el agua de riego una vez por semana, produjo una mejoría en la concentración de clorofila, sin tener efectos adversos en otras variables, sólo si el sustrato tenía su microfora nativa. Es probable que la microfora nativa degrade la DMA16 evitando que se acumule hasta concentraciones inhibitorias. Futuros trabajos deben determinar una forma más apropiada para suministrar DMA16 (dosis, frecuencias y vehículos) de tal manera que produzca un efecto promotor del crecimiento en pinos.
Este trabajo mostró que la inoculación de la rizobacteria A. agilis UMCV2 promovió el crecimiento de plántulas juveniles de P. devoniana cultivadas en invernáculo y sustrato no esterilizado. Los mecanismos por los cuales se ejerce esta promoción del crecimiento no están todavía establecidos. Sin embargo, el compuesto bacteriano DMA16 fue capaz de promover el incremento de la concentración de clorofila en pinos crecidos en sustrato no esterilizado, aunque su aplicación fue perjudicial en pinos crecidos en sustrato esterilizado. De esta forma, la inoculación de P. devoniana con A. agilis UMCV2 se presenta como una alternativa para acelerar el crecimiento de dicha especie de pino en condiciones de vivero.
AGRADECIMIENTOS
Gracias al Consejo Nacional de Ciencia y Tecnología (México) por el apoyo en este trabajo (proyecto "Segundo Periodo de la Convocatoria 2011 del Programa de Apoyos Complementarios para la Consolidación Institucional de Grupos de Investigación"). Gracias al Ing. Cuauhtémoc Ramírez Romero Dirección General de la COFOM y al Dr. Rafael Salgado Garciglia del Laboratorio de Biotecnología Vegetal de la UMSNH.
REFERENCIAS
1. Barriuso, J., M.T. Pereyra, J.A. Lucas-García, M. Megías, F.J. Gutiérrez-Mañero y B. Ramos (2005). Screening for putative PGPR to improve establishment of the symbiosis Lactarius deliciosus-Pinus sp. Microbial Ecology 50: 82-89. [ Links ]
2. Castellanos, J.Z., J.J. Peña-Cabriales y I. Rojas-Martínez (1995). Análisis retrospectivo del uso de inoculantes con cepas élite en frijol (Phaseolus vulgaris L.) en México. Turrialba 45: 89-99. [ Links ]
3. Chanway, C.P. (1997). Inoculation of tree roots with plant growth promoting soil bacteria: an emerging technology for reforestation. Forest Science 43: 99-112. [ Links ]
4. Chanway, C.P. y F.B. Holl (1994). Ecological growth response specificity of two Douglas-fir ecotypes inoculated with coexistent beneficial rhizosphere bacteria. Canadian Journal of Botany 72: 582-586. [ Links ]
5. COFOM.michoacan.gob.mx/ Comisión Forestal del Estado de Michoacán, Calle Justo Mendoza #11, Cuauhtémoc, Morelia, Michoacán de Ocampo, México. [ Links ]
6. Domenech, J., B. Ramos-Solano, A. Probanza, J.A. Lucas-García, J.J. Colón y F.J. Gutiérrez-Mañero (2004). Bacillus spp. and Pisolithus tinctorius effects on Quercus ilex ssp. ballota: a study on tree growth, rhizosphere community structure and mycorrhizal infection. Forest Ecology and Management 194: 293-303. [ Links ]
7. Eckert, A.J. y B.D. Hall (2006). Phylogeny, historical biogeography, and patterns of diversification for Pinus (Pinaceae): Phylogenetic tests of fossil-based hypotheses. Molecular Phylogenetics and Evolution 40: 166-182. [ Links ]
8. Farjon, A. y B.T. Styles (1997). Pinus (Pinaceae). Flora Neotropica. Monograph 75. New York Botanical Garden. New York. USA. 309 p. [ Links ]
9. Flores-Velázquez, R., E. Serrano-Gálvez, V.H. Palacio-Muñoz y G. Chapela (2007). Análisis de la industria de la madera aserrada en México. Madera y Bosques 13: 47-59. [ Links ]
10. Hassan, S.H.T. (2013). Effect of biofertilization by using three Azotobacter isolates and two levels of mineral nitrogen fertilizer on Jerusalem artichoke (Helianthus tuberosus L.) growth, yield and some chemical constituents. Journal of American Science 9: 437-446. [ Links ]
11. Jousset, A., S. Scheu y M. Bonkowski (2008). Secondary metabolite production facilitates establishment of rhizobacteria by reducing both protozoan predation and the competitive effects of indigenous bacteria. Functional Ecology 22: 714-719. [ Links ]
12. Liston, A., W.A. Robinson, D. Piñero y E.R. Alvarez-Buylla (1999). Phylogenetics of Pinus (Pinaceae) based on nuclear ribosomal DNA internal transcribed spacer region sequences. Molecular Phylogenetics and Evolution 11: 95-109. [ Links ]
13. Liu, M., L. Bjørnlund, R. Rønn, S. Christensen y F. Ekelund (2012). Disturbance promotes non-indigenous bacterial invasion in soil microcosms: analysis of the roles of resource availability and community structure. PloS one 7: e45306. [ Links ]
14. Liu, W., W. Mu, B. Zhu y F. Liu (2008). Antifungal activity and components of VOC produced by Bacillus subtilis G8. Current Research in Bacteriology 1: 28-34. [ Links ]
15. Lugtenberg, B. y F. Kamilova (2009). Plant-growth-promoting rhizobacteria, Annual Review of Microbiology 63: 541-556. [ Links ]
16. Orozco-Mosqueda, M.C., C. Velázquez-Becerra, L.I. Macías-Rodríguez, G. Santoyo, I. Flores-Cortez, R. Alfaro-Cuevas y E. Valencia-Cantero (2013a). Arthrobacter agilis UMCV2 induces iron acquisition in Medicago truncatula (strategy I plant) in vitro via dimethylhexadecylamine emission. Plant and Soil 362: 51-66. [ Links ]
17. Orozco-Mosqueda, M.C., L.I. Macías-Rodríguez, G. Santoyo, I. Flores-Cortez, R. Farías-Rodríguez y E. Valencia-Cantero (2013b). Medicago truncatula increases its iron uptake mechanisms in response to volatile organic compounds produced by Sinorhizobium meliloti. Folia Microbiologica 58: 579-585. [ Links ]
18. Ortíz-Castro, R., E. Valencia-Cantero y J. López-Bucio (2008). Plant growth promotion by Bacillus megaterium involves cytokinin signaling. Plant Signaling and Behavior 3: 263-265. [ Links ]
19. Ortíz-Castro, R., E. Valencia-Cantero y J. López-Bucio (2013). The beneficial role of rhizosphere microorganisms in plant health and productivity: improving root development and nutrient acquisition. Acta Horticulturae 1009: 241-250. [ Links ]
20. Perry, J.P. (1991). The pines of Mexico and Central America. Timber press. Portland, Oregon. USA. 231p. [ Links ]
21. Probanza, A., J.A. Lucas-García, M. Ruiz-Palomino, B. Ramos y F.J. Gutiérrez-Mañero (2002). Pinus pinea L. seedling growth and bacterial rhizosphere structure after inoculation with PGPR Bacillus (B. licheniformis CECT 5106 and B. pumilus CECT 5105). Applied Soil Ecology 20: 75-84. [ Links ]
22. Ramos, B., J. Barriuso-Maicas, J.A. Lucas-García, T. Pereyra de la Iglesia, A. Daza y F.J. Gutiérrez-Mañero (2007). Phosphate-solubilizing microorganisms in the rhizosphere of Pinus pinaster and in the mycosphere of associated Lactarius deliciosus. First International Meeting on Microbial Phosphate Solubilization Developments. Plant and Soil Sciences 102: 261-264. [ Links ]
23. Steubing, L., Godoy R. y M. Alberdi (2002). Métodos de ecología vegetal. Primera Edición. Editorial Universitaria Universitaria S. A. Santiago de Chile. pp: 243-261 [ Links ]
24. Valencia-Cantero, E., E. Hernández-Calderón, C. Velázquez-Becerra, J. López-Meza, R. Alfaro-Cuevas y J. López-Bucio (2007). Role of dissimilatory fermentative iron-reducing bacteria in Fe uptake by common bean (Phaseolus vulgaris L.) plants grown in alkaline soil. Plant and Soil 291: 263-273. [ Links ]
25. Velázquez-Becerra, C., L.I. Macías-Rodríguez, J. López-Bucio, I. Flores-Cortez, G. Santoyo, C. Hernández-Soberano y E. Valencia-Cantero (2013). The rhizobacterium Arthrobacter agilis produces dimethylhexadecylamine, a compound that inhibits growth of phytopathogenic fungi in vitro. Protoplasma 250: 1251-1262. [ Links ]
26. Velázquez-Becerra, C., L.I. Macías-Rodríguez, J. López-Bucio, J. Altamirano-Hernández, I. Flores-Cortez y E. Valencia-Cantero (2011). A volatile organic compound isolated from Arthrobacter agilis modulates growth of Medicago sativa in vitro. Plant and Soil 339: 329-340. [ Links ]
27. Zepeda, B.E.M. y M.M. Acosta (2000). Incremento y rendimiento maderable de Pinus montezumae L amb. en San Juan Tetla Puebla. Madera y Bosques 6: 15-27. [ Links ]














