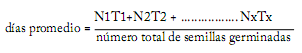Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.84 no.1 Vicente López jun. 2015
ARTÍCULOS ORIGINALES
Evaluación de la viabilidad y germinación de tempisque [Sideroxylon capiri (A.DC.) Pittier Sapotaceae]
Evaluation of the viability and germination of tempisque [Sideroxylon capiri (A.DC.) Pittier Sapotaceae]
Lazos-Monterrosa FA, C Orantes-García, O Farrera-Sarmiento, AG Verdugo-Valdez, MS Sánchez-Cortés, LE Ruíz-Meza
Instituto de Ciencias Biológicas, Universidad de Ciencias y Artes de Chiapas, Libramiento Norte Poniente Nº. 1150, Colonia Lajas Maciel, C.P. 29039, Chiapas, México.
Address Correspondence to: Dra. Carolina Orantes García, e-mail: c_orantes@hotmail.com carolina.orantes@unicach.mx
Recibido / Received 10.VI.2014.
Aceptado / Accepted 17.VIII.2014.
Resumen. El tempisque (Sideroxylon capiri) es un árbol nativo de México usado por la población campesina para la construcción de viviendas, postes y cercos vivos, como combustible (leña) y también con fines forrajeros y ornamentales, entre otros. En México y otros países centroamericanos es considerado como una especie amenazada. En este contexto y con la finalidad de contribuir a su preservación y manejo sustentable, se consideró relevante determinar la proporción de semillas viables, la pérdida de viabilidad debido al periodo de almacenamiento y el proceso germinativo mediante la aplicación de tratamientos pregerminativos. El estudio encontró que las semillas recién colectadas presentaron 100% de viabilidad, la cual disminuyó hasta 0% después de 5 meses de almacenamiento. El tratamiento con remojo en agua durante 24 h a temperatura ambiente (25 °C) obtuvo 55% de germinación final, mientras que con el testigo (sin ningún tratamiento previo) se alcanzó un 39%. El remojo en peróxido de hidrógeno (H2O2) y la escarificación mecánica (papel lija) fueron los tratamientos con menor porcentaje final de germinación (33 y 23%, respectivamente). De acuerdo con la germinación acumulada se encontraron diferencias significativas entre los tratamientos (p≤0,01). Se observó que se puede acelerar el tiempo de emergencia de las semillas con la exposición previa de 24 h en agua a temperatura ambiente.
Palabras clave: Tempisque; Sideroxylon capiri; Sapotaceae; Germinación; Semilla.
Abstract. The tempisque (Sideroxylon capiri) is a tree native to Mexico used by the rural population for housing construction, poles and hedges, as fuel (wood) and also for fodder and ornamental purposes, among others. It is considered an endangered species. In order to contribute to its preservation and sustainable management, it was considered important to determine the proportion of viable seeds, the loss of viability due to storage period and the germination process by applying pregerminative treatments. We found that freshly collected seeds showed 100% viability, which decreased to 0% after 5 months of storage. According to the cumulative germination significant differences between treatments (p≤0.01) were found. It was observed that seeds can accelerate their time of germination with the previous exposure of 24 h in water at room temperature. The soaking treatment in water for 24 h at room temperature obtained final germination of 55%, while with the control 39% was reached. Soaking in hydrogen peroxide and scarification were the treatments with lower germination percentage (33 and 23%, respectively). To get a higher percentage of germinated seeds in a short time, it is necessary to give a soaking treatment in water for 24 h before sowing.
Keywords: Tempisque; Sideroxylon capiri; Sapotaceae; Germination; Seed.
INTRODUCCIÓN
El tempisque (Sideroxylon capiri) es un árbol de hasta 40 m, se distribuye desde México hasta Panamá (García y Di Stefano, 2005), principalmente entre los 0 y 900 m.s.n.m., en climas secos a húmedos con temperaturas entre 22 y 30 °C; es componente importante de los bosques tropicales caducifolios y semi-caducifolios (Jiménez, 1999). Los frutos son carnosos, elipsoides a globosos y contienen una sola semilla de 1,5 a 2,5 cm de largo, globosa a elipsoide, con testa café claro dura y lisa (Newman, 2008). Este árbol es utilizado en Latinoamérica para la construcción de cercos y viviendas, en actividades ceremoniales religiosas, artesanales y como forraje para el ganado. Además es consumido por la fauna silvestre como son los murciélagos, los monos y los venados (García y Di Stefano, 2005; Díaz et al., 2011).
En México, el uso de la flora local es muy importante para las comunidades campesinas; sin embargo, en muchas ocasiones las plantas se obtienen directamente de los bosques, selvas y vegetación secundaria, sin que exista un manejo o cultivo de las especies. Este es el caso del tempisque (Sideroxylon capiri), que además presenta algunos problemas que impiden su propagación, como es su bajo índice de germinación, el cual es inferior al 30%. Esta situación se debe a que posee semillas recalcitrantes, lo que disminuye el índice de viabilidad (García y Di Stefano, 2005). Todas las semillas difieren en su tolerancia a la desecación que sigue tras su diseminación. Según este parámetro, las semillas se pueden clasificar en ortodoxas, recalcitrantes e intermedias. Las semillas ortodoxas toleran una deshidratación hasta de 5% en el contenido de humedad; por su parte, las semillas que toleran la deshidratación entre 10% y 12,5% de contenido de humedad se consideran intermedias, y las que toleran la deshidratación entre 15% y 50% de humedad se denominan recalcitrantes (Farrant et al., 1993; Farnsworth, 2000). Las semillas recalcitrantes se caracterizan por una rápida pérdida de viabilidad, lo que implica limitaciones graves para el almacenamiento de la semilla con fines de propagación (Magnitskiy y Plaza, 2007).
Es importante mencionar que este taxón aún no ha sido evaluado ni incluido en la Lista Roja de la UICN (Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales), pero se encuentra en el Catálogo de Vida (UICN, 2013). En México, según la Norma Ecológica NOM-059-SEMARNAT-2010, se encuentra categorizado como una especie amenazada (Diario Oficial de la Federación, 2010).
Para la conservación y aprovechamiento forestal del tempisque, es relevante conocer las etapas fundamentales para su supervivencia (García y Di Stefano, 2005). Dada la importancia ecológica y económica, así como la escasez de conocimiento que existe sobre S. capiri, se realizó el presente trabajo de investigación con el objetivo de determinar el efecto del almacenamiento en la viabilidad, así como la evaluación de tratamientos pregerminativos en el proceso germinativo de las semillas.
MATERIALES Y MÉTODOS
La investigación se llevó a cabo en el Banco de Germoplasma Vegetal del Instituto de Ciencias Biológicas de la Universidad de Ciencias y Artes de Chiapas, México, en el período de enero a julio de 2010. Los frutos (Fig. 1) fueron colectados en el predio denominado Rancho "El Sabino" municipio de Villaflores, Chiapas (16° 13' 58" N, 93° 16' 07" O, 600 m.s.n.m.). Se colectaron frutos de cinco árboles, ubicados en un cuadrante de una hectárea, seleccionando únicamente los frutos que no estuvieran rotos, vanos, manchados y sin rastros de ataque de insectos (orificios y larvas). Los frutos se despulparon para obtener las semillas, que posteriormente fueron almacenadas en bolsas de papel estraza, en una alacena de madera libre de humedad y con una temperatura ambiente promedio de 25 °C.

Fig. 1. Frutos de Sideroxylon capiri de forma elipsoidal-globoso, color verde; de maduros se vuelven amarillo; se encuentran en grandes cantidades formando racimos.
Fig. 1. Fruits of Sideroxylon capiri ellipsoidal-globose, green; they become yellow when mature; they are in large numbers forming clusters.
Prueba de viabilidad. El propósito de esta prueba fue comparar la viabilidad (capacidad de vida) de las semillas después de 0, 1, 2, 3, 4 y 5 meses de almacenamiento. Para realizar la prueba se formaron seis grupos de semillas, uno por cada periodo de almacenamiento. Cada grupo fue tratado como se describe a continuación: se humedecieron tres lotes con 100 semillas durante 24 h para facilitar un corte longitudinal en la testa y exponer el embrión a la solución de tinción (0,5% cloruro 2, 3,5 trifenil-2H tetrazolio). Las semillas fueron colocadas en cajas Petri y se envolvieron con papel aluminio para limitar su exposición a la luz. La incubación se realizó en un ambiente libre de humedad y luz, a temperatura ambiente (25 °C) durante 24 h (International Seed Testing Association, 2005). Cada semilla se diseccionó y los embriones se observaron con un microscopio estereoscópico marca Carl Zeizz®, para contar el número de semillas totalmente teñidas. Un estudio reciente permite clasificar los materiales vegetales en metabólicamente activos (viables); dormantes (viables) y muertos (Busso et al., 2015). Los datos correspondientes al número de semillas viables (según la International Seed Testing Association, 2005) fueron transformados a arcoseno raíz cuadrada para realizar un análisis de varianza (ANOVA) con el apoyo del paquete estadístico SPSS v.20 (SAS, 2011), de acuerdo a un diseño completamente aleatorizado (Montgomery, 2002).
Pruebas de germinación. Al día siguiente después de la colecta, las semillas se sometieron a tres tratamientos pregerminativos para su valoración, a su vez fue considerado un grupo testigo sin tratamiento para su germinación (Kester et al., 2001):
Escarificación mecánica. Consistió en desgastar la testa de la semilla de forma manual con una lija para madera de grano fino, cuidando de no dañar el tejido interno.
Escarificación química. Las semillas se sumergieron en disolución de peróxido de hidrógeno (H2O2) al 3% de concentración durante 10 min, después se enjuagaron con agua para eliminar el exceso de H2O2.
Hidratación (remojo en agua). Las semillas se colocaron en un vaso de precipitado con 300 mL de agua a temperatura ambiente (25 °C) durante un periodo de 24 h.
Después de los tratamientos, las semillas fueron sembradas en charolas de unicel para forestales tipo Koper block® 77/125 mL, llenas con sustrato de agrolita + tierra negra (1:2) a una profundidad de tres veces el diámetro de las semillas. Se les aplicó riego con agua a capacidad de campo cada tercer día. El período de observación fue de 90 días, con registros cada cinco días. Se consideraron germinadas las semillas cuando presentaron emergencia sobre el sustrato (Kester et al., 2001). Se evaluó el porcentaje de germinación final (%G) para determinar el efecto de los tratamientos en la capacidad germinativa (proporción de semillas capaces de germinar en condiciones óptimas o en una condición determinada) (Bewley y Black, 1994). También fue calculado el tiempo promedio de germinación, el cual se refiere al tiempo que las semillas necesitan para germinar y la germinación acumulada (GA) que muestra la forma en que se incrementa la germinación y el tiempo (días) de inicio de la germinación, como sigue (González y Orozco, 1996; International Seed Testing Association, 2005):
donde N valúa el número de semillas que germinaron dentro de intervalos consecutivos de tiempo; los valores de T son los tiempos transcurridos entre el inicio de la prueba y el final de un intervalo específico de medición.
Análisis estadístico. Se empleó un diseño completamente aleatorio; para ello fue considerado un total de 360 semillas distribuidas en tres repeticiones de 30 semillas por cada tratamiento pregerminativo incluyendo el testigo (4 x 3 x 30). Para evaluar el efecto de los tratamientos en la respuesta germinativa, los datos fueron transformados a arcoseno raíz cuadrada y se sometieron a un análisis de variancia (ANOVA) empleando el paquete estadístico SPSS v.20 (SAS, 2011).
RESULTADOS
Sin almacenamiento, la viabilidad de las semillas de tempisque fue de 100%. Se encontraron diferencias significativas (p≤0,01) entre los tiempos de almacenamiento, lo cual confirma que el período de almacenamiento provocó una disminución en la viabilidad de las semillas, observándose al final del período de cinco meses 0% de viabilidad (Fig. 2).

Fig. 2. Viabilidad de las semillas de tempisque (Sideroxylon capiri) durante un periodo de almacenamiento de cinco meses a temperatura ambiente (25 °C). Los puntos/líneas muestran las medias.
Fig. 2. Viability of tempisque (Sideroxylon capiri) seeds for a period of five months storage at room temperature (25 °C). The points and lines show the means.
Por otra parte, el tratamiento pregerminativo que presentó mayor porcentaje final de germinación fue el de remojo en agua con un 55%, y el más bajo correspondió al tratamiento de escarificación (23%) (Tabla 1).
Tabla 1. Porcentaje final de germinación, desviación estándar y prueba de Tukey (p≤0,05) de los tratamiento aplicados a las semillas de tempisque (Sideroxylon capiri) evaluadas durante 90 días.
Table 1. Final percentage germination, standard deviation and Tukey test (p≤0.05) of treatments applied to tempisque (Sideroxylon capiri) seeds evaluated for 90 days.

N: número de muestras.
%G: porcentaje final de germinación.
σ: desviación típica.
Medias con diferentes letras, difieren estadísticamente (Tukey, p≤0,05).
El análisis de varianza de la germinación acumulada mostró diferencias significativas entre los tratamientos (p≤0,01) (Fig. 3). El tratamiento de remojo en agua durante 24 h promovió que las semillas germinaran más rápido (40 días en promedio después de la siembra), seguido por el tratamiento de escarificación (53 días), en comparación con el testigo (55 días). En cuanto al tratamiento con H2O2 tuvo un tiempo de germinación más prolongado (57 días).

Fig. 3. Germinación acumulada de las semillas de Sideroxylon capiri. Los datos corresponden a promedio y las barras a error estándar. Cada punto representa la media de germinación.
Fig. 3. Cumulative germination of Sideroxylon capiri seeds. Data are mean and standard error bars. Each point represents the mean of germination.
DISCUSIÓN
La viabilidad de las semillas presentó un decaimiento de hasta 0% en cinco meses de almacenamiento. Según García y Di Stefano (2005), el envejecimiento de las semillas de esta especie es muy rápido debido a que son recalcitrantes, y las semillas de este tipo deben mantener un contenido de humedad relativamente alto para mantener su viabilidad (Leprince et al., 1993; Bewley y Black, 1994; Kainer et al., 1999; Kermode y Finch-Savage, 2002; Magnitskiy y Plaza, 2007). Para Floriano (2004), la sensibilidad a la deshidratación y a temperaturas bajas prolongadas implica limitaciones graves para el almacenamiento comercial a largo plazo de las semillas recalcitrantes, ya que la habilidad para germinar de estas semillas depende del grado de tolerancia a la pérdida de agua, al tiempo y las condiciones de almacenamiento (Berjak y Pammenter, 2004). Por su parte, Kester et al. (2001) mencionan que es de suma importancia conocer la viabilidad de las semillas para determinar el periodo de tiempo en el que conservan su capacidad para germinar y así lograr una propagación exitosa. Este aspecto es necesario de tomarse en cuenta al momento de colectar las semillas, junto con las condiciones ambientales y de manejo en la localidad de estudio.
La capacidad germinativa puede ser acelerada por la aplicación de tratamientos pregerminativos; esto se observó al haber obtenido un (1) 55% de germinación en el tratamiento de remojo en agua por 24 h en 40 días, mientras que en la prueba testigo se obtuvo un 39% en 55 días, (2) 33% en remojo en H2O2 a los 57 días, y (3) 23% con escarificación mecánica en 53 días. En un estudio de germinación del tempisque, Di Stefano y García (2000) evaluaron en cámaras de germinación el efecto de varias temperaturas (15, 20, 26, 30, 35 y 40 °C), encontrando que los mayores porcentajes de germinación de las semillas de tempisque, de entre 40 y 60%, se obtuvieron a 30 y 35 °C luego de un mes, y los menores a 15 y 40 °C (<25%). Por su parte, Molina et al. (1996) demostraron que se puede lograr entre 40 a 60% de germinación final en la especie de tempisque si las semillas son remojadas en agua caliente por 1 min.
El tratamiento de inmersión de las semillas en H2O2 al 3% obtuvo mayor porcentaje de germinación (33%) en comparación con la escarificación mecánica que fue de 23%. Este aspecto coincide con los hallazgos de Liyunga et al. (2006), Salisbury y Ross (2000) y Cabello et al. (1998), quienes señalan que el H2O2 aumenta la germinación debido a que ablanda la cubierta, permitiendo que el agua y el oxígeno entren con mayor facilidad.
Se concluye que las semillas de tempisque (S. capiri) son recalcitrantes, reducen significativamente su viabilidad en el período de cinco meses de almacenamiento en condiciones ambientales, y para realizar una propagación más eficiente en cuanto a mayor velocidad y porcentaje de germinación, es necesario remojar a las semillas en agua durante 24 h a temperatura ambiente (25 °C).
Es importante señalar que la realización de estudios básicos que permiten obtener información sobre la propagación de especies amenazadas como el tempisque, representa una etapa fundamental que contribuye al conocimiento de especies nativas, lo que permitirá definir estrategias apropiadas para la reforestación de áreas en las que las poblaciones han disminuido o desaparecido, y en donde también se tomen en cuenta las condiciones ambientales y de manejo locales. También es necesario impulsar y consolidar el desarrollo y la gestión de técnicas y estrategias que permitan el uso sostenible del recurso vegetal. Finalmente, se debe reconocer que una técnica recientemente publicada permite una mejor clasificación de los tejidos vegetales en: metabólicamente activos (viables); dormantes (viables, manteniendo aún la capacidad de producir material vegetal dadas las condiciones apropiadas) y muertas (Busso et al., 2015).
REFERENCIAS
1. Berjak, P. y N. Pammenter (2004). Recalcitrant seeds. En: Benech-Arnold, R. y Sánchez R. (eds), pp. 305-345. Handbook of seed physiology. Food Products Press, New York. [ Links ]
2. Bewley, J. y M. Black (1994). Seeds, physiology of development and germination. Plenum Press, New York. 445 p. [ Links ]
3. Busso, C.A., Y. Torres, L. Ithurrart y L.H. Richards (2015). The TTC-technique might not appropriately test the physiological stage of plant tissues. Russian Journal of Plant Physiology 62: 551-556. [ Links ]
4. Cabello, M., T. Ruiz y J. Devesa (1998). Ensayos de germinación en endemismos Ibéricos. Acta Botánica Malacitana 23: 59-69. [ Links ]
5. Diario Oficial de la Federación (2010). Norma Oficial Mexicana NOM-059-SEMARNAT-2010 Protección ambiental-especies nativas de México de flora y fauna silvestres - categorías de riesgo y especificaciones para su inclusión, exclusión o cambio - lista de especies en riesgo. México. 78 p. [ Links ]
6. Díaz, M., O. Farrera y M. Isidro (2011). Estudio etnobotánico de los principales mercados de Tuxtla Gutiérrez, Chiapas, México. Revista de ciencias Lacandonia de la Universidad de Ciencias y Artes de Chiapas 5(2):21-42. [ Links ]
7. Di Stefano, J. y E. García (2000). Germinación y desarrollo radicular de tempisque (Sideroxylon capiri) a diferentes temperaturas. Nota científica. Revista Agronomía Costarricense 24: 93-97. [ Links ]
8. Farnsworth, E. (2000). The ecology and physiology of viviparous and recalcitrant seeds. Annual Review of Ecology Systematics 31:107-138. [ Links ]
9. Farrant, J.M., N.W. Pammenter y P. Berjak (1993). Seed development in relation to desiccation tolerance: a comparison between desiccation sensitive (recalcitrant) seeds of Avicennia marina and desiccation tolerant types. Seed Science Research 3:1-13. [ Links ]
10. Floriano, E. (2004). Armazenamento de sementes florestais. ANORGS, Santa Rosa. 10 p. [ Links ]
11. García, E. y J. Di Stefano (2005). Fenología de árbol Sideroxylon capiri (Sapotaceae) en el Bosque Seco Tropical de Costa Rica. Revista Biología Tropical 53 (1-2): 5-14. [ Links ]
12. González, Z. y S. Orozco (1996). Métodos de análisis de datos en la germinación de semillas, un ejemplo: Manfreda Brachystachya. Boletín de la Sociedad Botánica de México 58: 15-30. [ Links ]
13. International Seed Testing Association (2005). International rules for seed testing. Rules. Zurich, Suiza. 300 p. [ Links ]
14. Jiménez, Q. (1999). Árboles maderables en peligro de extinción en Costa Rica. Instituto Nacional de Biodiversidad, San José, Costa Rica. 187 p. [ Links ]
15. Kainer, K., M. Duryeaa, M., Malavasi, E. Rodríguez, Da Silva y J. Harrison (1999). Moist storage of Brazil nut seeds for improved germination and nursery management. Forest Ecology and Management 116: 207-217. [ Links ]
16. Kermode, A.R. y W.E Finch-Savage (2002). Desiccation sensitivity in orthodox and recalcitrant seeds in relation to development. En: Black, M. and Pritchard H.W. (eds), pp. 149-184. Desiccation and survival in plants. Drying without dying. Wallingford: CABI Publishing. New York, USA. 416 p. [ Links ]
17. Kester, D.E., T. Fred, Jr. Davies, H.T. Hartmann y R.L. Geneve (2001). Plant propagation: principles and practices. Prentice Hall PTR. 880 p. [ Links ]
18. Leprince, O., G. Hendry y B. McKersie (1993). The mechanism of desiccation tolerance in developing seeds. Seed Science Research 3: 231-246. [ Links ]
19. Liyunga, K., P. Matakala, R. Chintu, C. Joao, G. Fernando, G. Sileshi, F. Akinnifesi y O. Ajayi (2006). Agroforestry options manual: a trainers' guide s.l.: World Agroforestry Centre ICRAF. 39 p. [ Links ]
20. Magnitskiy, V.S. y G.A. Plaza (2007). Fisiología de semillas recalcitrantes de árboles tropicales. Agronomía colombiana 25(1): 96-103. [ Links ]
21. Molina M., G. Brenes y D. Morales (1996). Descripción y viverización de 14 especies forestales nativas del bosque seco tropical. Vol 1. Editorial Esfera Grecia, Costa Rica. 91 p. [ Links ]
22. Montgomery, D. (2002). Diseño y análisis de experimentos. Segunda edición, Limusa, S.A. de C.V. México D.F. 686 p. [ Links ]
23. Newman, M.F. (2008). Flora del valle de Tehuacán-Cuicatlán. Sapotaceae Juss. Universidad Autónoma de México, fascículo 57: 1-20. [ Links ]
24. Salisbury, F. y C. Ross (2000). Fisiología de las plantas. Tercera edición, Paraninfo Tomson Learning, España, 988 p. [ Links ]
25. SAS (2011). SPSS v. 20 Statistics and graphics guide. Statistical discovery software. Institute Cary. N.C. [ Links ]
26. UICN (2013). Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales. Lista Roja de Especies Amenazadas. Versión 2013.2. www.iucnredlist.org [ Links ]