Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.84 no.1 Vicente López jun. 2015
ARTÍCULOS ORIGINALES
Características anatómicas y químicas del tegumento seminal de Medicago sativa L. (alfalfa) cv. Baralfa 85 y su asociación con la dormición
Anatomical and chemical characteristics of the seed coat of Medicago sativa L. (alfalfa) cv. Baralfa 85 seeds and their association with seed dormancy
Galussi AA1, JA Argüello2, MM Cerana2, M Maximino3, ME Moya1
1 Facultad de Ciencias Agropecuarias, Universidad Nacional de Entre Ríos, Argentina.
2 Facultad de Ciencias Agropecuarias, Universidad Nacional de Córdoba, Argentina.
3 Facultad Ingeniería Química, Universidad Nacional del Litoral, Argentina.
Address Correspondence to: Alberto A. Galussi, Facultad de Ciencias Agropecuarias UNER, Oro Verde, Ruta Prov. Nº11, km 10,5 (3101) Paraná, Entre Ríos, Argentina, e-mail: agalussi@arnet.com.ar; cultivar@fca.uner.edu.ar
Recibido / Received 11.IV.2013.
Aceptado / Accepted 7.V.2014.
Resumen. Las semillas de Medicago sativa L. pueden presentar dormición impuesta por la cubierta seminal, lo cual ocasiona variadas cantidades de semillas duras. Estas semillas no germinan ya que no se hidratan por un impedimento en sus cubiertas seminales a la entrada de agua. El objetivo de este trabajo fue analizar las características anatómicas y químicas de la testa de alfalfa en función de los niveles de permeabilidad al agua. Se caracterizaron semillas del cv. Baralfa 85 (cosechas 2004 y 2006), realizándose estudios anatómicos y determinaciones de sustancias estructurales, polifenoles, taninos y cutina presentes en las testas de semillas de diferentes niveles de permeabilidad al agua. Se encontró que las características anatómicas de la cubierta seminal y las proporciones de los distintos componentes determinan el nivel de permeabilidad del tegumento, aspecto que se asocia con la profundidad de la dormición de las semillas. Anatómicamente, el incremento del grosor de la testa se asocia con el menor nivel de permeabilidad al agua de la misma. Esto se atribuye a la variación en el grosor de la cutícula, longitud de las macroesclereidas y grosor de la pared celular, presencia y desarrollo de las osteoesclereidas. Desde el punto de vista fisiológico y químico, el mecanismo de dormición física por la testa, se explica por la mayor cantidad de componentes con características que repelen el agua y son cementantes, tales como polifenoles, ligninas, taninos condensados y sustancias pécticas y menor proporción de celulosa y hemicelulosa.
Palabras clave: Semillas duras; Permeabilidad; Testa; Macroesclereidas; Lignina.
Abstract. Seeds of alfalfa (Medicago sativa L.) can exhibit seedcoat imposed dormancy, which produces hard seeds within a seed lot. These seeds do not germinate because they do not imbibe water due to a barrier to water entry in the seed coat. The aim of this work was to analyze the anatomical and chemical characteristics of the testa of alfalfa seeds with respect to water permeability levels. The anatomy of seeds of the cv. Baralfa 85 was studied and structural substances, polyphenols, tannins and cutin present in the testa of seeds of different water permeability levels were determined. The anatomical characteristics of the seed coat and the proportions of components were found to determine the permeability level of the seed coat, an aspect that is associated with the physical seed dormancy level. Anatomically, increased thickness of the testa was associated with a lower permeability level. The difference may be attributed to the variation in cuticle thickness, length of macrosclereids and thickness of the cell wall, and presence and development of osteosclereids. From the physiological and chemical points of view, the mechanism of physical dormancy of the testa is explained by a greater amount of components that repel water and cement the cell wall, such as polyphenols, lignins, condensed tannins, pectic substances, and a lower proportion of cellulose and hemicellulose.
Keywords: Hard seeds; Permeability; Testa; Macrosclereids; Lignin.
INTRODUCCIÓN
La cubierta de la semilla es la defensa primaria contra el medio ambiente. Un tegumento duro protege la semilla de la tensión mecánica, de los microorganismos, y cambios en temperatura y humedad (Yassen et al., 1994). En lotes de alfalfa se citan variadas cantidades de semillas duras, entre 22% a 37% (Fairey y Lefkovitch, 1991), hasta 50% (Zimmermann et al., 1992) con 90% de embriones viables en las muestras (Zimmermann et al., 1998). En condiciones naturales del cultivo, no todas las semillas que se forman están estrictamente sometidas a las mismas condiciones ambientales ni se ven afectadas con igual intensidad por factores que provocan la dormición física o el tegumento duro (Aitken, 1939; Yause y Ota, 1958; Donnelly, 1970; Quinlivan, 1971; Kowithayakorn y Hill, 1982). Ya a la cosecha, la población de semillas puede presentar semillas duras (Côme y Courbineau, 1992; Fairey et al., 1996; Porquedu et al., 1996; Pérez-García, 2008). Según la ISTA Rules for Seed Testing (2003, 2007), "semillas duras" se denominan a aquéllas cuyas cubiertas son impermeables al agua y no logran germinar porque sus embriones no pueden imbibirse. Esta característica de las semillas es típica en numerosas especies de ciertas familias (Convolvulaceae, Chenopodiaceae, Fabaceae, Liliaceae, Malvaceae, Solanaceae: Nikolaeva, 1980; Popinigis, 1985; Besnier Romero, 1989; Baskin y Baskin, 2004; ISTA, 2007). En Fabaceae, las semillas duras se hallan citadas para numerosas especies forrajeras (Zimmermann et al., 1998; Pérez-García, 2008; Zeng et al., 2005). En cuanto a la exomorfología en la semilla de leguminosa, la testa presenta el hilo, micrópila y lens (Esau, 1987). El tegumento seminal en leguminosas responde, en general, a un patrón común de organización. En la superficie, se halla la epidermis uniseriada, constituida por macroesclereidas; en la región del hilo, aparecen dos capas en empalizada. Debajo de la epidermis, se sitúa la hipodermis, constituida por una sola fila de células esclerenquimáticas (osteoesclereidas). Luego, se dispone el parénquima lagunoso, formado por varias capas de células aplanadas. Le continúa la capa de aleurona y el endosperma y luego el embrión (Bewley y Black, 1986; Esau, 1987; Besnier Romero, 1989). En algunas semillas, se menciona la presencia de tegmen (Marcos-Filho, 2005). No hay variaciones entre la anatomía del tegumento de semillas duras y no duras (Nikolaeva, 1980; Martens et al., 1995). Zeng et al. (2005) citan diferencias en el grosor (cutícula y capa externa) y en el perfil del tegumento (tamaño y arreglo celular más o menos compacto) en semillas duras de leguminosas anuales del género Medicago y Trifolium. En variedades de Glycine max se hallaron diferencias en la porosidad y en la línea clara (Harris, 1987), y en el contenido de lignina (Alvarez et al., 1997; Capeleti et al., 2005). Se cree que la línea clara, al igual que la cutícula, no juega ningún papel en la impermeabilidad de la testa (Besnier Romero, 1989; Boesewinkel y Bouman, 1982). Las células vegetales presentan pared celular constituida por laminilla media, pared primaria y, en algunos casos, pared secundaria. Estas paredes pueden tener variaciones en el espesor y en los contenidos de celulosa, hemicelulosa, lignina y sustancias pécticas, características que se relacionan con la dormición, dureza y resistencia mecánica (Salisbury y Ross, 1992; Taiz y Zeiger, 1998).
En semillas de alfalfa se encontró diferente permeabilidad al agua en las testas, reflejando diferentes niveles de dormición, lo cual influye en la calidad fisiológica de las semillas (Galussi et al., 2013). Las causas que conciernan con el impedimento a la entrada de agua en semillas de alfalfa no están claramente dilucidadas. Es posible que sean más de una. Un estudio comparativo entre tegumentos de diferente permeabilidad al agua contribuiría a (1) explicar los distintos niveles de dormición y (2) desarrollar técnicas que pueden ser usadas para romper la dormición en lotes de semillas. El objetivo de este trabajo fue analizar las características anatómicas y químicas de la testa de alfalfa en función de diferentes niveles de permeabilidad al agua.
MATERIALES Y MÉTODOS
Material biológico. Se trabajó con semillas de Medicago sativa (alfalfa) cv. Baralfa 85 (cosechas 2004 y 2006) provenientes del área de producción de Mendoza, Argentina. Las semillas se revisaron bajo lupa (10x) observando su pureza y descartándose aquellas con daños físicos visibles.
Análisis morfológicos y anatómicos de la testa por microscopía electrónica de barrido (MEB). Las semillas se seleccionaron por nivel de permeabilidad según la velocidad de hidratación clasificándose en aquellas de rápida, lenta y muy lenta hidratación según Galussi et al. (2013). La semillas que se hidrataron dentro de los primeros 15 minutos fueron descartadas, debido a posibles daños en la cubierta seminal. Las semillas se consideraron de rápida hidratación cuando se hidrataron luego de 2 h de inmersión; de lenta hidratación, cuando lo hicieron luego de 14 h de inmersión, y de muy lenta hidratación [semillas con dormición (semillas duras)] cuando no embebieron agua hasta las 3000 h (125 días), 4200 h (175 días) o 9600 h (400 días) de inmersión. De cada nivel de permeabilidad se analizaron cinco tegumentos por muestra (cosechas 2004 y 2006) por MEB. Se observó y fotografió la testa en vista superficial y lateral con diferentes aumentos. En las microfotografías, se observó y comparó la topografía de la testa y aspecto de la cutícula, y en el corte lateral se identificaron las capas celulares presentes, los tamaños celulares y el grosor de la cutícula. La zona seleccionada para estos estudios fue próxima al punto central (Aniszewski, 2009), y observación del área circundante a dicho punto, y el área de la lens. Además, se observó y comparó la pared celular de las macroesclereidas. Las observaciones de la exomorfología y anatomía del tegumento mediante microscopía electrónica de barrido (MEB) se realizaron en el CRIBABB (Centro Regional de Investigaciones Básicas y Aplicadas de Bahía Blanca) y en el CERIDE (Centro Regional de Investigación y Desarrollo de Santa Fe). En el CRIBABB, las muestras fueron criofracturadas con nitrógeno líquido y luego metalizadas con un Sputter Coater en Plasma de Argón (aproximadamente 200 Å de espesor) (Sorrivas y Morales, 1986). Las microfotografías fueron tomadas con el Microscopio EVO 40 X VP (Cambridge, England, 2003). En el CERIDE, los tegumentos se cortaron con bisturí. Los preparados se adhirieron con cinta doble faz de grafito sobre portamuestras del mismo material y, posteriormente, se recubrieron con grafito mediante evaporación empleando un Evaporador marca VEECO, modelo VE-3000, operado en alto vacío (Mulvey, 1980; Reimer, 1985; Robards y Wilson, 1993). Las testas se examinaron con un microscopio electrónico de barrido, marca JEOL, modelo JSM-35C. La adquisición de imágenes fue realizada en forma digital empleando el sistema SemAfore.
Observación de pared celular de células de macroesclereidas en cortes transversales de tegumentos de alfalfa. El trabajo se realizó en el CRIBABB, los tegumentos se hidrataron por cuatro días. Se preparó la solución fijadora, glutaraldehído al 2,5 % en tampón fosfato de sodio 0,1 M (pH 7,2). Luego, se cortó una pieza de tejido (tegumento) con una hoja de afeitar en trozos de 0,5mm de lado y se colocó inmediatamente por 24 h en la solución fijadora. Posteriormente, se lavaron con el mismo tampón (3 lavados de 45 min). Después, se realizó la segunda fijación con tetróxido de osmio 2% por 2 h y se lavó con agua destilada (2 h). Se deshidrató en serie de concentraciones crecientes de acetona (25%, 50%, 80% y 100% por tres veces) por 45 min cada paso, y se incluyó en resina Spurr (Spurr, 1969). Esto se efectuó en vacío en concentraciones ascendentes de resina (R) - acetona (A) [(2A 1R; 1A 1R; 1A 2R (toda la noche)] y en resina pura, 8 h en estufa a 70 °C toda la noche. Con posterioridad, se infiltró de manera de poder realizar cortes transversales y se realizaron secciones ultrafinas en Ultramicrótomo LKB con cuchilla de diamante. El contraste se realizó con acetato de uranilo, solución saturada en agua, por un minuto y citrato de plomo por un minuto. La observación se llevó a cabo en un microscopio electrónico de barrido marca JEOL 100 CXII a 80 KV (Sorrivas y Morales, 1986). Los promedios (μm) fueron obtenidos a partir de observaciones de nueve células de tres testas por nivel de permeabilidad (cosechas 2004 y 2006), antes mencionado.
Determinación de contenidos de sustancias poliméricas estructurales y pécticas, polifenoles, taninos y cutinas. Los tegumentos fueron seleccionados según el siguiente nivel de permeabilidad al agua: (a) rápida hidratación (permeable): tegumentos de semillas que se hidratan completamente en las primeras 4 h de inmersión en agua. En esta condición, las semillas se presentan completamente hinchadas y manifiestan una rajadura en el tegumento por el aumento de tamaño por la imbibición de agua. Para la colecta de tegumentos, las semillas hidratadas, se colocaron a germinar en papel toalla humedecido, enrollado y puestos en bolsa de nylon, y llevados a cámara de germinación (25 ˚C) ubicando los rollos en un ángulo de 45˚. Posteriormente, a los 5 días se colectaron los tegumentos de las plántulas producidas, y se los colocó en cajas de Petri, dejándolos secar en estufa a 25 °C. Esta tarea se realizó hasta obtener 3 g de tegumentos de semillas de rápida hidratación; (b) muy lenta hidratación (impermeable): aquellos tegumentos de semillas que no se hidrataron luego de 22 h de inmersión en agua o también llamadas semillas duras, según ítem 6.5.2.1.2 ISTA Rules for Seed Testing (2007). Para colectar los tegumentos de semillas duras, a las semillas se les hacía un corte en el tegumento en la zona distal de los cotiledones; luego, se dejaron 4 h hidratándose en agua. Posteriormente, se colocaron a germinar en papel toalla humedecido, enrollado y puestos en bolsa de nylon, y llevados a cámara de germinación (25 ˚C), ubicando los rollos en un ángulo de 45˚. Posteriormente, se colectaron los tegumentos de las plántulas producidas a los 5 días, y se los colocó en cajas de Petri, las que se dejaron secar en estufa (25 ˚C). Con este método se colectaron 3 g de testas de semillas duras de alfalfa (cosecha 2004 y 2006).
La determinación de componentes estructurales de la pared celular en los tegumentos se realizó según los métodos citados en Van Soest (1994): para determinar polifenoles totales se utilizó la técnica de Folin-Denis, y para taninos condensados el método de la vainillina. El método de Van Soest se utilizó para la obtención de porcentaje de pared celular (FND), contenidos celulares (SND) y porcentaje de los componentes celulosa, lignina y cutina (FAD). Las determinaciones se efectuaron en el Instituto de Tecnología Celulósica - Facultad Ingeniería Química -Universidad Nacional del Litoral, Santa Fe, Argentina. Los análisis se realizaron en muestras de tegumentos de 0,5 g, y con 2 repeticiones (aproximadamente 3000 tegumentos) por nivel de permeabilidad, con tegumentos de ambas cosechas. La asociación de los componentes químicos determinados en función de la permeabilidad del tegumento se efectuó a través de un análisis de componentes principales (Di Rienzo et al., 2008).
RESULTADOS
Análisis morfológicos y anatómicos de la testa por microscopía electrónica de barrido (MEB). Las observaciones de la exomorfología y anatomía del tegumento mediante MEB, permitieron encontrar diferencias entre tegumentos según el nivel de permeabilidad al agua de la semilla.
En la observación al MEB de la superficie de la testa de la semilla de alfalfa de rápida hidratación (permeable) (Fig. 1 A, B y C), se distinguieron claramente el hilo (anillo y surco hilar), la micrópila y la lens. Se presentó una delgada capa de cutícula, lo que refeja una superficie rugosa o irregular, causada por los extremos proximales de la superficie de las macroesclereidas. La testa alcanzó un grosor de 30 - 40 μm, presentándose una cutícula delgada (1 - 2 mm) que recubrió toda la superficie irregular en la que se observaron sutiles grietas. Se divisó la presencia de orificios, que no son estrictamente poros en la pared celular de las macroesclereidas, sino una superficie no recubierta de cutina y ceras entre los extremos de las macroesclereidas. Las macroesclereidas fueron células de 20 - 30 μm de largo aproximadamente, dispuestas en empalizada en una sola hilera, no tan compacta, con línea clara visible (Fig. 2). En corte transversal, se observó (Fig. 3) la laminilla media, pared celular y contenido celular. El contorno fue de forma poligonal irregular (5 - 7 lados), cuadrangular, triangular, u aovado. Las diagonales tuvieron diferente longitud según la célula, al igual que el ancho de la pared celular (Tabla 1). Las osteoesclereidas estuvieron o no presentes, alcanzaron hasta 3μm de longitud, y las células parenquimáticas estuvieron presentes.

Fig. 1. Características de la exomorfología de la testa de semilla de M. sativa cv. Baralfa 85 (cosecha 2004) observada con MEB. A, B y C: testa de semilla de rápida hidratación, permeable luego de 2 horas en agua; D, E y F: testa de semilla de muy lenta hidratación, permeable luego de 3000 horas (125 días) en agua.
A y D: Vista de la semilla, (L) Lens, (H) Hilo, (M) Micrópila, MEB ×100 y ×200 (barra: 100 µm); B y E: Vista superficial de la zona hilar, (SH) Surco hilar, (AH) Anillo hilar, MEB ×200 y MEB ×400 (barra: 100µm y 10 µm); C: Vista superficial en zona de la lens con vista de los extremos de las macroesclereidas (SL); (Fs) Fisura sútil, MEB ×3000 (barra: 10 µm); F: Vista superficial en zona de la lens con depósitos de cera, MEB ×3000 (barra: 10 µm).
Fig. 1. Exomorphological characteristics of the testa of M. sativa cv. Baralfa 85 seeds (2004 harvest) observed with SEM. A, B and C: Testa of rapid hydration seed, permeable after 2 hours of water immersion; D, E and F: Testa of very slow hydration seed, permeable after 3000 hours (125 days) of water immersion.
A and D: View of seed, (L) Lens, (H) Hilum, (M) Micropyle, SEM ×100 and ×200 (bar: 100 µm); B and E: Surface view of the hilar region, (Hg) Hilar groove, (Hr) Hilar rim SEM ×200 and SEM ×400 (bar: 100 µm and 10 µm); C: Surface view of the lens area with view of the macrosclereid ends (Sl); (Sf) Subtle fssures SEM ×3000 (bar: 10 µm); F: Surface view of lens area with waxes, SEM ×3000 (bar: 10 µm).
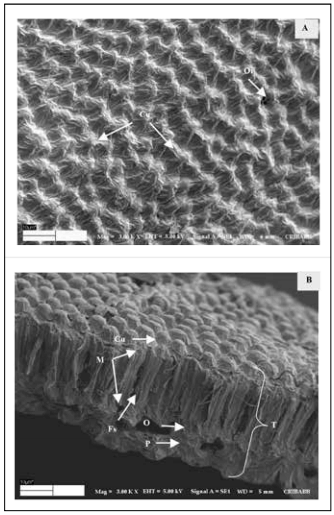
Fig. 2. Testa de semilla de M. sativa cv. Baralfa 85 (cosecha 2004) permeable luego de 2 horas en agua.
A. Superficie de la testa. (Cu) Cutícula, (Or) Orificio. B. Vista tridimensional de la testa. (T) Testa, (Cu) Cutícula y ceras, (M) Macroesclereidas, (O) Osteoesclereidas, (P) Parénquima, (Fs) Fisura sútil entre células. MEB ×3000 (barra: 10 µm).
Fig. 2. Testa of rapid hydration seeds of M. sativa cv. Baralfa 85 (2004 harvest) permeable after 2 hours of water immersion.
A. Surface of testa, (Cu) Cuticle, (Or) Opening. B. Tridimensional view of testa, (T) Testa, (Cu) Cuticle and waxes, (M) Macrosclereids, (O) Osteosclereids, (P) Parenchyma, (Fs) Subtle separation between cells. SEM ×3000 (bar: 10 µm).
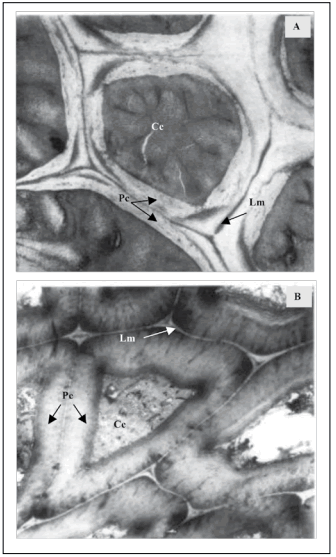
Fig. 3. Macroesclereidas de testa de semillas M. sativa cv. Baralfa 85 (A y B: cosecha 2004 y 2006) de rápida hidratación, permeable luego de 2 horas de inmersión en agua.
(Pc) Pared celular, (Lm) Laminilla media, (Cc) Contenido celular. Transcorte MEB ×6700.
Fig. 3. Macrosclereids of testa of rapid hydration seeds of M. sativa cv. Baralfa 85 (A and B: 2004 and 2006 harvest) permeable after 2 hours of water immersion.
(Pc) Cell wall, (Lm) Middle lamella, (Cc) Cell content. Cross section SEM ×6700.
Tabla 1. Dimensiones de macroesclereidas en testa con diferente permeabilidad de semillas de M. sativa cv. Baralfa 85.
Table 1. Dimensions of macrosclereids in testa of seeds of M. sativa cv. Baralfa 85 with different permeability levels.
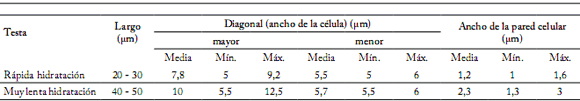
Los valores de la media (μm) responden a las observaciones de 9 células correspondientes a 3 tegumentos de cada nivel de permeabilidad (cosechas 2004 y 2006), Rápida hidratación (testa de semilla permeable luego de 2 horas de inmersión en agua), Muy lenta hidratación (testa de semilla permeable luego de 3000, 4200 y 9600 horas de inmersión en agua); (Mín.) valor mínimo; (Máx.) valor máximo.
Mean values (μm) were obtained from observations of 9 cells corresponding to 3 testas per permeability level (2004 and 2006 harvests), Rapid hydration (testa of seed permeable after 2 hours of water immersion), Very slow hydration (testa of seed permeable after 3000, 4200 and 9600 hours of water immersion), (Min) minimum value, (Max) maximum value.
En tegumentos de semillas de lenta hidratación (Fig. 4), se halló mayor similitud con las características observadas en los tegumentos de semillas de rápida hidratación. El análisis de las microfotografías permitió visualizar una cutícula levemente más gruesa que en la superficie de la testa de semillas de rápida hidratación, y las macroesclereidas (en empalizada) tuvieron ciertas separaciones entre ellas; esto permitiría la entrada de agua, semejante a lo que sucede en las semillas de rápida hidratación. La forma y dimensiones (longitud), y la pared celular de las macroesclereidas observadas fueron similares a las de la testas de rápida hidratación. En el corte transversal se observó contenido celular, y una tendencia a ser más anchas que en la testa de semillas de rápida hidratación (diagonal mayor y menor de mayor longitud). Las osteoesclereidas estuvieron presentes, aunque no bien desarrolladas (o en forma aislada), y las células parenquimáticas siempre estuvieron presentes.
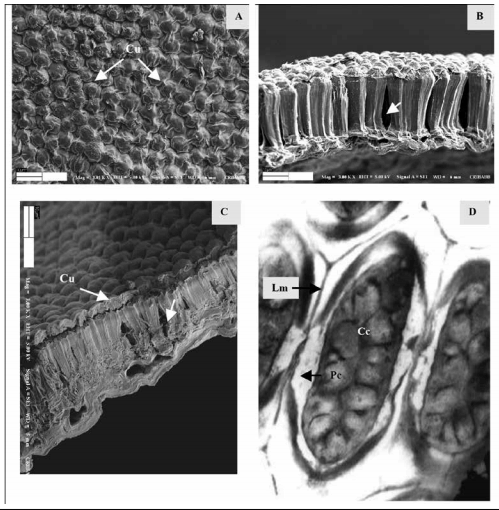
Fig. 4. Testa de semilla de M. sativa cv. Baralfa 85 (cosecha 2004) de lenta hidratación, permeable luego de 14 horas de inmersión en agua. A: Superficie de la testa, (Cu) Cutícula, MEB ×3000; B y C: Transcorte de la testa señalando (Fs) Fisuras sútiles entre macroesclereidas MEB ×3000 (barra: 10 µm); D: Macroesclereida, (Pc) Pared celular, (Lm) Laminilla media, (Cc) Contenido celular, transcorte MEB ×6700.
Fig. 4. Testa of slow hydration seeds of M. sativa cv. Baralfa 85 (2004 harvest) permeable after 14 hours of water immersion. A: Surface of testa, (Cu) Cuticle, SEM ×3000; B and C: Cross section of testa indicating (Fs) subtle separation between macrosclereids SEM×3000 (bar: 10 µm); D: Macrosclereid, (Pc) Cell wall, (Lm) Middle lamella, (Cc) Cell content, cross section SEM ×6700.
La observación al MEB de la testa de la semilla con dormición (semilla dura) permitió visualizar las zonas de lens, hilo y micrópila (Fig. 1 D, E y F). Se puso en evidencia una gruesa capa de cutícula sobre el tegumento, por lo cual no se manifestaron los extremos de las macroesclereidas. En el hilo y la fisura hilar se presentó cierta cerosidad, pero no estuvieron completamente cubiertos. En la Fig. 5, se visualiza la testa en corte transversal a la altura de la lens, área principal de entrada de agua en semillas sin y con dormición (Galussi et al. 2013). Se presentó una sola capa de macroesclereidas en empalizada y, por debajo, las osteoesclereidas, y luego un parénquima esponjoso.

Fig. 5. Testa de semilla de M. sativa cv. Baralfa 85 (cosecha 2004) permeable luego de 3000 horas (125 días) en agua en corte transversal. (L) Señala la zona de la lens a distintos aumentos, (T) Testa, (M) Macroesclereidas, (O) Osteoesclereidas, (P) Parénquima esponjoso. A: ×171 (barra: 100 µm); B: ×1500 (barra: 20 µm; C: ×2750 (barra: 10 µm).
Fig. 5. Cross section of testa of very slow hydration seeds of M. sativa cv. Baralfa 85 (2004 harvest) permeable after 3000 hours (125 days) of water immersion.
(L) Indicates the lens area at different magnifications by SEM. (T) Testa, (M) Macrosclereids, (O) Osteosclereids, (P) Spongy parenchyma. A:×171 (bar: 100 µm), B: ×1500 (bar: 20 µm); C: ×2750 (bar: 10 µm).
En las semillas duras (Fig. 6) se encontró una testa con un grosor de 60 - 70 μm, con una cutícula gruesa (5 - 6 μm). Esto reflejó una superficie poco rugosa sin dejar de manifiesto los contornos proximales de las macroesclereidas en la superficie. Las macroesclereidas fueron más largas y grandes que las mencionadas en semillas de tegumentos permeables, y en empalizada muy compacta, con una longitud aproximada de 40 - 50 μm, con la línea clara presente; fueron células con lumen muy pequeño (sin contenido celular observable). Presentaron el contorno en forma poligonal irregular (5 - 7 lados) o cuadrangular (no se encontraron triangulares ni aovadas), con una pared celular de diferente grosor (tabla 1) según la célula (Fig. 7 y 8). Las osteoesclereidas estuvieron siempre presentes en los tegumentos de las semillas duras, abundantes, bien conformadas externamente, grandes y muy visibles, y también estuvieron presentes las células parenquimáticas.

Fig. 6. Testa de semilla de M. sativa cv. Baralfa 85 (cosecha 2006) de muy lenta hidratación, permeable luego de 3000 horas (125 días) de inmersión en agua.
A: Superficie de la testa (Cu) Cutícula; B y C: Transcorte de dos testas (Cu) Cutícula, (M) Macroesclereida, (O) Osteoesclereida, (P) Parénquima. A y C: MEB ×3000, B: ×2500 (barra: 10 µm).
Fig. 6. Testa of very slow hydration seed of M. sativa cv. Baralfa 85 (2006 harvest) permeable after 3000 hours (125days) of water immersion.
A: Surface of testa, (Cu) Cuticle; B and C: Cross section of two testas, (Cu) Cuticle, (M) Macrosclereids, (O) Osteosclereids, (P) Parenchyma. A and C: SEM ×3000; B: ×2500 (bar: 10 µm).
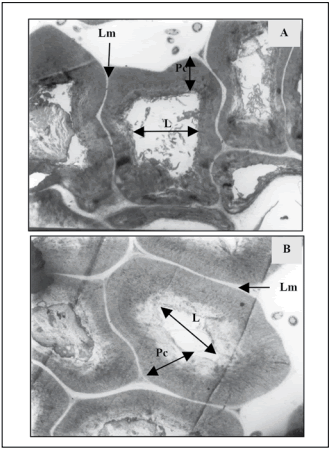
Fig. 7. Macroesclereidas de testa de M. sativa cv. Baralfa 85 (A y B: cosecha 2004 y 2006) de muy lenta hidratación, permeable luego de 4.200 horas (175 días) de inmersión en agua.
Transcorte: A. Transcorte: MEB ×6700; B. MEB ×6700, Lm: Laminilla media; Pc: Pared celular; L: Lumen.
Fig. 7. Macroesclereids of testa of very slow hydration seed of M. sativa cv. Baralfa 85 (A and B: 2004 and 2006 harvest) permeable after 4200 hours (175 days) of water immersion.
Cross section: A. SEM ×6700, B. ×6700, (Lm) Middle lamella, (Pc) Cell wall, (L) Lumen.
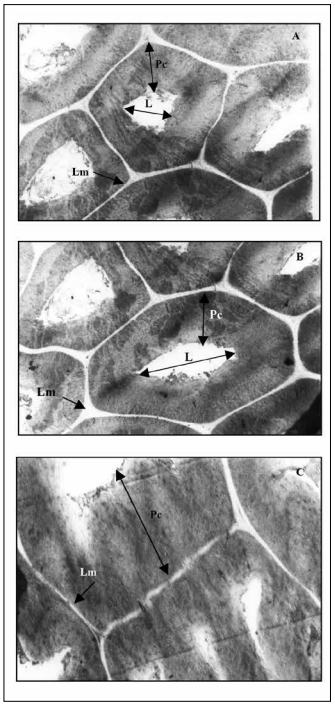
Fig. 8. Macroesclereidas de testa de semilla M. sativa cv. Baralfa 85 (cosecha 2006) de muy lenta hidratación permeable luego de 9.600 horas (400 días) de inmersión en agua.
Transcorte: A. MEB ×6700; B. MEB ×6700, C. MEB ×10000, (Lm) Laminilla media; (Pc) Pared celular; (L) Lumen.
Fig. 8. Macroesclereids of testas of very slow hydration seed of M. sativa cv. Baralfa 85 (2006 harvest) permeable after 9600 hours (400 days) of water immersion.
Cross section: A. SEM ×6700, B. SEM ×6700, C. SEM ×10000, (Lm) Middle lamella, (Pc) Cell wall, (L) Lumen.
Contenidos de sustancias poliméricas estructurales y pécticas, polifenoles, taninos y cutina. Los resultados obtenidos son promedios de aproximadamente 3000 tegumentos para cada nivel de permeabilidad, por lo cual puede haber variabilidad entre testas. No obstante, en las cantidades promedio halladas, se observaron distintos valores entre tegumentos de semillas de rápida hidratación (permeables) y los de semillas de muy lenta hidratación (semillas duras). Los componentes hallados en los tegumentos de cada nivel de permeabilidad variaron en las proporciones, y no por presencia o ausencia de alguno de ellos. De acuerdo a los resultados (Tabla 2), ligninas, polifenoles totales, taninos condensados y contenido celular (sustancias pécticas) se presentaron en mayor cantidad en los tegumentos de semillas duras; en los tegumentos de semillas de rápida hidratación se destacó una mayor cantidad de celulosa y hemicelulosa. El análisis estadístico de componentes principales (sustancias estructurales determinadas en las testas) asoció y correlacionó los tegumentos de semillas duras con la presencia de (1) componentes de características cementantes e impermeables al agua (en mayores proporciones) (Fig. 9; por ejemplo ligninas, taninos condensados y sustancias pécticas) y (2) la menor cantidad de componentes hidrófilos como celulosa y hemicelulosa.
Tabla 2. Determinación de componentes orgánicos (%) en materia seca de tegumentos de diferente permeabilidad de semillas de M. sativa cv. Baralfa 85, cosecha 2004/2006.
Table 2. Determination of organic compounds (%) in dry weight of different permeability testas of M. sativa cv. Baralfa 85 seeds, 2004/2006 harvests.

(Pt) Polifenoles totales; (Tc) Taninos condensados; (Cc) Contenido celular: glucosa, fructosa, sacarosa, galactosa, almidón y fructosanos (protoplastos y sustancias pécticas); (Pc) Pared Celular: (Hc) hemicelulosa, gomas, mucílagos, (C) celulosa, (L) lignina, (Cu) cutina; (FAD) Fibra ácido detergente: celulosa, lignina, cutina y sílice. Obs.: Macroesclereidas y osteoesclereidas de tegumentos duros tienen lumen (no hay contenido celular).
(Pt) Total polyphenols; (Tc) Condensed tannins; (Cc) Cell content: glucose, fructose, sucrose, galactose, starch and fructosan (protoplasts and pectic substances), (Pc) Cell wall, (Hc) hemicellulose, gums, mucilages, (C) cellulose, (L) lignin, (Cu) cutin; (FAD) Acid Detergent Fiber: cellulose, lignin, cutin and silica. Notice that macrosclereids and osteosclereids of testa of very slow hydration seeds have lumen (no cell content).
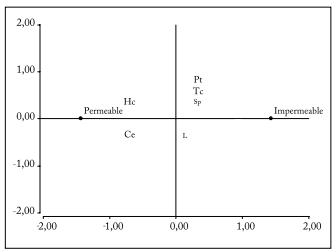
Fig. 9. Componentes de los tegumentos seminales de M. sativa cv. Baralfa 85 (cosechas 2004 y 2006) asociados a las condiciones de permeabilidad (sin dormición física) o impermeabilidad (con dormición física).
(Pt) Polifenoles totales; (Tc) Taninos condensados; (Sp) Sustancias pécticas; (L) Lignina; (Ce) Celulosa; (Hc) Hemicelulosa.
Fig. 9. Components of seed-coat of seeds of M. sativa cv. Baralfa 85 (2004 and 2006 harvests) associated with permeability (non-dormant seed) or impermeability (dormant seed) conditions.
(Pt) Total polyphenols; (Tc) Condensed tannins; (Sp) Pectic substances; (L) Lignin; (Ce) Cellulose, (Hc) Hemicellulose.
DISCUSIÓN
Al comparar los tipos de tegumentos de las semillas de alfalfa se observaron variaciones en el grosor de la cutícula, la longitud de las macroesclereidas y de las osteoesclereidas. Con respecto al grosor de la testa se observa una gradualidad en función del nivel de permeabilidad, de 30 - 40 mm y con cutícula delgada (1 - 2 μm) en testas de semillas de rápida hidratación, a 60 - 70 μm y con cutícula gruesa (5 - 6 μm) en testas de semillas de muy lenta hidratación y con dormición (semillas duras). En cuanto al espesor de la pared celular en macroesclereidas, en general una pared primaria típica tiene 1 - 3 μm y la pared secundaria puede tener 4 μm de espesor o más (Salisbury y Ross, 1992; Taiz y Zeiger, 1998). En este trabajo, las macroeslereidas presentaron espesores aproximados de pared celular de 1,6 μm en testas de semillas de rápida hidratación y de 3 μm en testas de semillas duras. Esto indica la presencia de una pared celular de mayor espesor en macroesclereidas de testas de semillas con dormición (Tabla 1). La presencia de osteoesclereidas bien conformadas y abundantes es característica de los tegumentos de semillas duras de mayor nivel de dormición. Estos aspectos coinciden con las comunicaciones sobre extrema longevidad en las semillas, las cuales conciernen principalmente a taxas con células malpighianas (macroesclereidas) u osteoesclereidas en las Fabaceae y Malvaceae (Mc Kee et al., 1977; Boesewinkel y Bouman, 1982; Bewley y Black, 1986; Martens et al., 1995).
La topografía observada en el tegumento de semilla de rápida hidratación es semejante a lo mencionado por Ma et al. (2004) en la superficie del tegumento de soja. En la testa de semillas de rápida hidratación, se halló la presencia de orificios y de una empalizada de macroesclereidas menos compacta, con sutiles separaciones entre células y grietas en la superficie, características que favorecen la entrada de agua (Fig. 3). Esto coincide con Baskin y Baskin (2000), que asumen que la ruptura de esta dormición presente en las semillas (exceptuando la escarificación mecánica) se debe a la formación de una apertura en la estructura anatómica especializada de la cubierta seminal (o del fruto) a través de la cual entra el agua y se hidrata el embrión. Cabe señalar por lo observado, que son orificios y no estrictamente poros, como citan Perissé y Planchuelo (2004), al estudiar el tegumento en relación a la entrada de agua en semillas de Lupinus sp. En especies de Trifolium, Medicago y Melilotus, Spurny (1972) observó el engrosamiento de la pared celular en el extremo de las macroesclereidas. Los hallazgos en este trabajo, indican que el mecanismo de dormición física en semillas de alfalfa se explica, anatómicamente, por la sumatoria de efectos dados por: mayor espesor de la cutícula, mayor longitud y ancho de macroesclereidas, con una disposición más o menos compacta, y osteoesclereidas en mayor cantidad y más desarrolladas.
En cuanto a los componentes estructurales, una pared primaria típica puede contener entre 9% - 25% de celulosa, 25% - 50% de hemicelulosa y entre 10% - 35% de sustancias pécticas, y alrededor de 10% de proteínas. La pared secundaria se compone de 41% - 45% de celulosa, 30% de hemicelulosa y, en algunos casos, entre 22% - 28% de lignina. Cuando una célula forma una pared secundaria deja de alargarse, la lignina, a medida que se va generando, se deposita primero en la laminilla media (formada por sustancias pécticas), después en la pared primaria existente y, por último, en la pared secundaria (Salisbury y Ross, 1992; Taiz y Zeiger, 1998). Los valores de celulosa (Tabla 2) hallados en los tegumentos de alfalfa, 45,8% (tegumentos de semillas de rápida hidratación) y 39,9% (tegumentos de semillas duras), se aproximan a los mencionados para pared secundaria de células vegetales, que se encuentra en las células esclerenquímaticas; de hemicelulosa se encontró menor cantidad que la mencionada por dichos autores. Ambos componentes, celulosa y hemicelulosa, son de características hidrófilas y fueron hallados en menor cantidad en las testas de semillas con dormición física (semillas duras). Otro componente estructural hallado fue la lignina, la cual se sitúa en las paredes dándole rigidez a la pared celular y el carácter de impermeabilidad al agua (Whetten y Sederof, 1995, Ferrer Amorós, 1997; Capeleti et al., 2005). La lignina fue hallada en mayor cantidad en los tegumentos de semillas duras que en los tegumentos de semillas de rápida hidratación (Tabla 2). Esau (1987) menciona que el endurecimiento del tegumento seminal en leguminosas se da por la formación de paredes secundarias muy lignificadas en las macroesclereidas alargadas y la presencia de osteoesclereidas. La lignina está en estrecha asociación con la celulosa y algunos otros carbohidratos y es de difícil separación. El 7,7% de lignina, hallado en tegumentos de semillas duras, es un contenido relativamente alto si se considera que el tallo de cereales tiene un 3,9% y la paja del trigo un 8,9% de lignina. Para la alfalfa en estado de hoja y preforación, se citan valores de lignina de 3,34% y 7%, respectivamente (Faner, 2007). En Atriplex cordobensis, se hallaron en las brácteas de la unidad de dispersión, capas de células epidérmicas y subepidérmicas con acumulación de lignina, elemento que fue asociado a la impermeabilidad al agua (Argüello et al., 1999). En soja, Baciu-Miclaus (1970) consideraron que la base de las macroesclereidas sería la barrera de impermeabilidad dado el elevado nivel de lingificación hallado, al igual que en el extremo de las células columnares; además, a esto se sumaría la presencia de grandes cantidades de ceras en la base de macroesclereidas, y en y entre las paredes celulares.
La mayor cantidad de polifenoles totales de los tegumentos de semillas duras (tabla 2) responde a que, particularmente, las semillas acumulan importantes cantidades de fenoles en sus cubiertas que actúan como un filtro para que el oxígeno no llegue al embrión, inhibiendo su germinación (Bewley y Black, 1986). Se menciona al estrés hídrico y a las altas temperaturas durante el llenado de la semilla como causantes de la producción de semillas duras (Nikolaeva, 1980; Besnier Romero, 1989). Dichas condiciones ambientales favorecen la actividad de la enzima fenilalanina amonioliasa (PAL), la cual sintetizará mayor cantidad de polifenoles. Se producen fitoalexinas (mayoritariamente polifenoles) que evitan la predisposición de la semilla a infecciones fúngicas o bacterianas y la protegen de la radiación UV. Además, entre los mecanismos adaptativos que contribuyen a resistencia se encuentra el reforzamiento de la pared celular mediante la síntesis de la glicoproteína extensina, y de ligninas y taninos (Ferrer Amorós, 1997; Paniagua, 2004). Estos últimos compuestos orgánicos se ven asociados a las semillas con dormición física en alfalfa. Se podría suponer que la mayor producción de polifenoles es un mecanismo adaptativo de resistencia a dicho estrés ambiental en la planta madre.
Otra sustancia ergástica determinada en los tegumentos fue el tanino. La concentración en especies forrajeras es muy variable: 0,01% a 10% de la materia seca (Faner, 2007). Dicho componente está distribuido ampliamente en el cuerpo vegetal, ningún tejido carece de este grupo heterogéneo de derivados fenólicos (Esau, 1987). Tienen la propiedad de desnaturalizar las proteínas, con lo cual son altamente astringentes. En este trabajo, los taninos condensados son otros compuestos encontrados como más abundantes (0,63%) en tegumentos de semillas duras, que en los tegumentos de semillas de rápida hidratación (0,48%) (Tabla 2). Si se tiene en cuenta la propiedad de precipitar proteínas que presentan los taninos, es posible pensar que estos compuestos serían capaces de actuar como disuasivos de la alimentación y como defensa frente a predadores.
En cuanto a -contenido celular- determinado en la testa, comprende diversas sustancias (Tabla 2), entre éstas, las sustancias pécticas. Al observarse en las microfotografías que las macroesclereidas de tegumentos duros tienen lumen (no hay contenido celular) al igual que en las osteoesclereidas, es de suponer que la cantidad determinada de esta fracción (25,3%), en gran medida, responde a las pectinas de la gruesa laminilla media de las macroesclereidas. Dichas sustancias (pectinas) tienen alta capacidad hidrófila, y pueden unirse con cationes de Ca y Mg formando enlaces entre grupos carboxílicos y cadenas de polisacáridos adyacentes con lo cual se estructura una masa molecular compleja que se comporta como un gel semirígido (las pectinas limitan la porosidad de la pared). Actúan como cementantes (Sandoval et al., 2005) y en células más viejas se lignifican (Esau, 1987). La lignificación, característica asociada en alfalfa a testas de semillas duras, aparentemente tiene dos funciones principales: es cementante y mantiene juntas las fibras de celulosa, y, por la dureza que da a la pared, previene a la célula de daños físicos y químicos (Sandoval et al., 2005).
Las ceras se asocian a un impedimento al ingreso de agua ya que aumentan el ángulo de contacto y diminuyen la superficie de contacto, por lo que humedece menos el tegumento e influye en la velocidad de la entrada del agua (Ferrer Amorós, 1997). Si bien en las microfotografías se observa la presencia de una gruesa cutícula, el método de extracción no logró detectar mayor cantidad de ésta en los tegumentos de semillas duras respecto de los tegumentos permeables de semillas de rápida hidratación. Cabe la posibilidad de la presencia de otros tipos de ceras no detectadas por el método.
Los estudios efectuados aseveran lo dicho por otros investigadores respecto de que, una población se compone de semillas que son morfológicamente distintas y, al mismo tiempo, presentan diferentes intensidades de dormición (Nikolaeva, 1980; Moreira de Carvalho y Nakagawa, 1988; Côme y Courbineau, 1992; Galussi et al., 2003). Según la presente investigación, desde el punto de vista anatómico se pone en evidencia una gradualidad en el grosor de la testa en función del nivel de permeabilidad al agua; mayor grosor de la testa indica mayor dormición física. La diferencia resulta de la variación hallada en el grosor de la cutícula, la longitud de las macroesclereidas y espesor de la pared celular, presencia y desarrollo de las osteoesclereidas. Desde el punto de vista fisiológico y químico, el mecanismo de dormición física por la testa se explica por la mayor cantidad de componentes con características que repelen el agua y son cementantes, tales como polifenoles, ligninas, taninos condensados y sustancias pécticas, y menor proporción de celulosa y hemicelulosa. Las características anatómicas del tegumento y proporciones de los componentes hallados, pone en evidencia los niveles de permeabilidad del tegumento, aspecto que se asocia a la profundidad de la dormición.
AGRADECIMIENTOS
Este trabajo es parte del proyecto de Investigación y Desarrollo nº 2100 subvencionado por la Universidad Nacional de Entre Ríos.
REFERENCIAS
1. Aitken, Y. (1939). The problem of hard seeds in subterranean clover. Proceedings of the Royal Society of Victoria 51: 187-213. [ Links ]
2. Alvarez, P.J.C., F.C Krzyzanowski, J.M.G. Mandarino y J.B. Franca Neto (1997). Relationship between soybean seed coat lignin content and resistance to mechanical damage. Seed Science and Technology 25: 209-214. [ Links ]
3. Aniszewski, T. (2009). Phaseolus lunatus testa topography and biometrics of crushed cells. Seed Science and Technology 37: 121-131. [ Links ]
4. Argüello, J.A., L. Seisdedos, M.V. Cid y M.T. Aiazzi (1999). Morphophisiological aspects of dormancy in the dispersal of Atriplex cordobensis. Phyton International Journal of Experimental Botany 65: 35-41. [ Links ]
5. Baciu-Miclaus, D. (1970). Contribution to the study of hard seed and coat structure properties of soybean. Proceeding International Seed Testing Association 35: 599-617. [ Links ]
6. Baskin, J.M. y C.C. Baskin (2000). Taxonomy, ecology, and evolution of physical dormancy in seeds. Plant Species Biology 15: 139-152. [ Links ]
7. Baskin, J.M. y C.C. Baskin (2004). A classification system for seed dormancy. Seed Science Research 14: 1-6. [ Links ]
8. Besnier Romero, F. (1989). Semillas Biología y Tecnología. (Ed. Mundiprensa), Madrid. 637 p. [ Links ]
9. Bewly, J. y M. Black (1986). Seeds. Physiology of Development and Germination. (Ed. Pleum Press), vol 2, pp. 182. New York. [ Links ]
10. Boesewinkel, F.D. y F. Bouman (1982). The seed: Structure. En: B.M. Johri (Ed.) pp. 567-608. Experimental Embryology of Vascular Plants. Springer, Berlin. [ Links ]
11. Capeleti, I., M.L. Ferrarese, F. Krzyzanowski y F. Ferrarese (2005). A new procedure for quantification of lignin in soybean (Glycine max (L.) Merrill) seed coat and their relationship with the resistence to mechanical damage. Seed Science and Technology 33: 511-515. [ Links ]
12. Côme, D. y F. Courbineau (1992). Environmental control of seed dormancy and germination. En: Fu Jiarui and Khan A.A. (Eds.) pp. 277-298. Advances in the Science and Technology of Seeds. Science Press, Beijing, New York. [ Links ]
13. Di Rienzo, J.A., F. Casanoves, M.G. Balzarini, L. Gonzalez, M. Tablada y C.W. Robledo (2008). InfoStat versión 2008 Grupo InfoStat, FCA, Universidad Nacional de Córdoba, (Ed. Brujas), Córdoba, Argentina. 356 p. [ Links ]
14. Donnelly, E.D. (1970). Persistence of hard seed in Vicia lines derived from interespecific hybridization. Crop Science 10: 661-662. [ Links ]
15. Esau, K. (1987). Anatomía de las plantas con semillas (Ed. Hemisferio Sur). Buenos Aires, Argentina. 512 p. [ Links ]
16. Fairey, D.F. y L.P. Lefkovitch (1991). Hard seed content of alfalfa grow in Canada. Canadian Journal of Plant Science 71: 437-444. [ Links ]
17. Fairey, D.F., L.P. Lefkovitch y N.A. Fairey (1996). The relationship between fall dormancy and germoplasm source in North American alfalfa cultivars. Canadian Journal of Plant Science 76: 429-433. [ Links ]
18. Faner, C. (2007). La pastura de alfalfa como fuente de alimentación para cerdos en crecimiento y terminación Boletín AACP 01.10.07. www.produccion-animal.com.ar/produccion_porcina/72-alfalfa.pdf (2009). [ Links ]
19. Ferrer Amorós, J. (1997). Las células de los tejidos vegetales. Ed. Vedrá, S.L., Barcelona, España. 392 p. [ Links ]
20. Galussi, A.A., J.A. Argüello, M.E. Moya, F.D. Zuriaga y L.R. Zimmermann (2013). Seed dormancy mechanism as a factor influencing seed physiological quality in alfalfa (Medicago sativa L.) cv. Baralfa 85. Seed Science and Technology 41: 50-59. [ Links ]
21. Harris, W.H. (1987). Comparative ultraestructure of developing seed coats of "hard-seed" and "soft-seeded" varieties of soybeans, Glycine max (L.) Merr. Botanical Gazette 148: 324-331. [ Links ]
22. ISTA International Seed Testing Association (2003). International Rules for Seed Testing. Zurich, Switzerland. [ Links ]
23. ISTA International Seed Testing Association (2007). International Rules for Seed Testing. Seed Science and Technology, Bassersdorf, CH-Switzerland. [ Links ]
24. Kowithayakorn, L. y M.J. Hill (1982). A study of lucerne seed development and some aspects of hard seed content. Seed Science and Technology 10: 179-186. [ Links ]
25. Ma, F., E. Cholewa, T. Mohamed, C.A. Peterson y M. Gijzen (2004). Cracks in the palisade cuticle of soybean seed coats correlate with their permeability to water. Annals of Botany 94: 213-228. [ Links ]
26. Marbach, I. y A.M. Mayer (1974). Permeability of seed coats to water as related to drying conditions and metabolism of phenolics. Plant Physiology 54: 817-820. [ Links ]
27. Marcos Filho, J. (2005). Fisiología de sementes de plantas cultivadas. Vol. 12, Ed. Fundação de Estudos Agrários Luis de Queiroz, Piracicaba, SP, Brasil. 495 p. [ Links ]
28. Martens, H., H.B. Jakobsen y O.B. Lyshede (1995). Development of the strofiole in seeds of white clover (Trifolium repens L.). Seed Science Research 5: 171-176. [ Links ]
29. Mc Kee, G.W., R.A. Pfeiffer y N.N. Mosheninn (1977). Seed coat impermeability to water. Agronomy Journal 69: 53-58. [ Links ]
30. Moreira de Carvalho, N. y J. Nakagawa (1988). Semillas. Ciencia, Tecnología y Producción. Ed. Hemisferio Sur, R.O. del Uruguay, 406 p. [ Links ]
31. Mulvey, T. (1980). Electron microscopy and analysis. Ed. Institute of Physics, Gran Bretaña, 492 p. [ Links ]
32. Nikolaeva, M.G. (1980). Factors controlling the seed dormancy pattern. En: Elsevier/North-Holland Biomedical Press (Eds.), pp. 51-74. The physiology and biochemistry of seed dormancy and germination. Amsterdam, The Netherlands. [ Links ]
33. Paniagua, R. (2004). Citología e Histología Vegetal y Animal. 3ª Edición. Ed. McGrw-Hill-Interamericana de España, S.A.U., pp. 779-814, Madrid, España. [ Links ]
34. Pérez-García, F. (2008). Effect of cryopreservation, gibberellic acid and mechanical scarifcation on the seed germination of eight endemic species from the Canary Islands. Seed Science and Technology 36: 237-242. [ Links ]
35. Perissé, P. y A.M. Planchuelo (2004). Seed coat morphology of Lupinus albus L. and Lupinus angustifolius L. in relation to water uptake. Seed Science and Technology 32: 69-77. [ Links ]
36. Popinigis, F. (1985). Fisiologia da Semente [Seed physiolgy], Ed. Pax, 289 pp: DF, Brasília. [ Links ]
37. Porquedu, C., A. Loi y P.S. Cocks (1996). Hardseededness and pattern of seed breakdown in Sardinian populations of Medicago polymorpha under field conditions. Journal Agronomy Science 126: 161-168. [ Links ]
38. Quinlivan, B.J. (1971). Seed coat impermeability in legumes. The Journal of the Australian Institute of Agricultural Science 37: 283-295. [ Links ]
39. Reimer, L. (1985). Scanning electron microscopy. Physics of image formation and microanalysis. Ed. Springer, Berlín, Alemania. 457 p. [ Links ]
40. Robards, A.W. y A.J. Wilson (1993). Procedures in electron microscopy. Eds. Robards W. and Wilson, J. Chichester, England, 700 p. [ Links ]
41. Salisbury, F.B. y C.W. Ross (1992). Fisiología de las plantas. Células: agua, soluciones y superficies. Ed. Tomson, Spain Paraninfo S.A., Madrid, España, 305 p. [ Links ]
42. Sandoval Z., E. (2005). Técnicas aplicadas al estudio de la anatomía vegetal. Universidad Nacional Autónoma de México. Cuadernos, pp: 38, 51, DF, México. [ Links ]
43. Sorrivas, V. de Lozano y A. Morales (1986). Introducción a la Microscopía Electrónica. Ed. CRIBABB, Bahía Blanca, Argentina, 220 p. [ Links ]
44. Spurny, M. (1972). The imbibition processs. pp. 367-389. En: W. Heydecker (Ed.). Seed Ecology Proceedings Nineteenth Easter School in Agricultural Science, University of Nottingham, Butteworths, London, Cited in Rolston, M.P. (1978). The Botanical Review 44: 365-396. [ Links ]
45. Spurr, A.M. (1969). A low-viscosity epoxi embedding medium for electron microscopy. Journal of Ultrastructure Research 26: 31-43. [ Links ]
46. Taiz, L. y E. Zeiger (1998). Plant physiology. 2ª ed. Sinauer Associates, Inc. Massachusetts. 792 p. [ Links ]
47. Van Soest, P.J. (1994). Nutritional Ecology of the Ruminant. Ed.Cornell University Press. Ithaca, NY, USA. 476 p. [ Links ]
48. Whetten, R. y R. Sederoff (1995). Lignin biosynthesis. The Plant Cell 7: 1001-1013. [ Links ]
49. Yassen, M.Y., S.A. Barringer, W.E. Splittstoesser y S. Constanza (1994). The role of seed coat in seed viability. The Botanical Review 60: 426-439. [ Links ]
50. Yause T. y K. Ota (1958). Studies on the hard seed of milk vetch (Astragalus sinicus (L.). Crop Science Society. Japan Proceeding 27: 289-292. [ Links ]
51. Zeng, L.W., P.S. Cocks, S.G. Kailis y J. Kuo (2005). Structure of the seed coat and its relationship to seed softening in Mediterranean annual legumes. Seed Science and Technology 33: 351-362. [ Links ]
52. Zimmermann, L.R., A.A. Galussi y A.H.M. Martinelli (1992). Hard seed viability in alfalfa (Medicago sativa L.). XXIII International Seed Testing Congress, Buenos Aires, Argentina, pp. 48. [ Links ]
53. Zimmermann, L.R., A.A. Galussi, A.H.M. Martinelli, A.P. Fernández, A.H. García, J.R. Pitter, A.R. Zecchin y D.I. Dechanzi (1998). Hard seed viability in Medicago sativa L., Lotus corniculatus L., Trifolium repens L., T. pratense L. and Melilotus alba Med. Seed Science and Technology 26: 271-273. [ Links ]














