Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) vol.85 no.1 Vicente López jun. 2016
ARTÍCULOS ORIGINALES
Calidad fitoquímica de tomate Saladette producido con sustratos orgánicos bajo condiciones de invernadero
Phytochemical quality of tomato Saladette produced with organic substrates under greenhouse conditions
González B ML1, M Fortis H1, P Preciado R1, MA Segura C1, E Salazar Sosa1, JL García H2, JR Esparza R3
1 Instituto Tecnológico de Torreón. Carretera Torreón-San Pedro Km. 75 Ejido Ana. Torreón, Coahuila, 27170, México.
2 Facultad de Agricultura y Zootecnia, Unidad Gómez Palacio, Universidad Juárez del Estado de Durango. Ejido Venecia. Gómez Palacio, Dgo., México.
3 Facultad de Ciencias Químicas Unidad Gómez Palacio, Universidad Juárez del Estado de Durango. Av. Artículo 123 S/N. Fracc. Filadelfia C.P. 35010. Gómez Palacio, Durango., México.
Address correspondence to: Dr. Juan Ramón Esparza-Rivera; Teléfono 52-871-7158810, e-mail: jresparza02001@yahoo.com
Received 27.II.2015.
Accepted 13.VII.2015.
Resumen. El objetivo del presente estudio fue evaluar la producción y calidad fitoquímica de frutos de tomate producidos en diferentes sustratos orgánicos bajo condiciones de invernadero. Los tratamientos aplicados (sustratos orgánicos) fueron: T1 (80% Arena + 20% Vermicompost; T2 (90% Arena + 10% Compost); T3 Testigo con Solución Steiner (80% Arena + 20% Perlita); T4 (80% Arena + 5% Suelo + 15% Vermicompost); T5 (85% Arena + 15% Estiércol Solarizado), y T6 (80% Arena + 5% Suelo + 15% Estiércol Solarizado). Se utilizó un diseño experimental completamente al azar, con cuatro repeticiones de tratamientos. Las variables evaluadas fueron rendimiento, contenido relativo de clorofila en hojas (unidades SPAD), contenido fenólico total, contenido de licopeno, y capacidad antioxidante. Los resultados obtenidos mostraron diferencia significativa (P≤0,05) para el rendimiento, contenidos de clorofila y fenólico, y capacidad antioxidante. Los resultados de rendimiento mostraron que el Tratamiento con solución Steiner obtuvo un rendimiento de 8,75 kg/m2, mientras que el Tratamiento 4 obtuvo un rendimiento estadísticamente igual (8,70 kg/m2, P>0,05). Por otra parte, la capacidad antioxidante del tomate producido fue de 142,28-276,57 µmol Trolox/g ms, y el contenido fenólico fue de 16,4-28,9 mg equiv. de Ac. gálico/100 g de fruto fresco. Asimismo, el contenido de licopeno en el tomate producido con los sustratos orgánicos fue de 2,05-2,77 mg/100 g de tomate fresco, mientras que el fruto producido bajo fertilización química (Solución Steiner) fue de 2,93 mg/100 g de tomate fresco. Los resultados obtenidos indican que los sustratos orgánicos evaluados pueden ser utilizados para la producción de tomate con alta calidad fitoquímica.
Palabras clave: Solanum lycopersicum Mil.; Sustratos orgánicos; Fenólicos; Antioxidantes; Licopeno.
Abstract. The aim of the current study was to evaluate yield and phytochemical quality of tomato fruits produced using organic substrates under greenhouse conditions. The applied treatments (organic substrates) were: T1 (80% River sand + 20% Vermicompost; T2 (90% River sand + 10% Compost); T3 Steiner Solution (80% River sand + 20% Perlite); T4 (80% River sand + 5% Soil + 15% Vermicompost); T5 (85% River sand + 15% Treated manure), and T6 (80% River sand + 5% Soil + 15% Treated manure). We used a totally randomized experimental design, with four replicate treatments. Evaluated variables were: yield, relative content of leaf chlorophyll (SPAD units), total phenolic content, lycopene content and antioxidant capacity. Results showed significant differences in yield, leaf chlorophyll and phenolic contents, and antioxidant capacity. The Steiner solution treatment (8.75 kg/m2) and Treatment 4 (8.70 kg/m2, P>0.05) showed a similar yield. On the other hand, the antioxidant capacity of the tomato produced was 142.28- 276.57 µmol Trolox/g dw, and the phenolic content was 16.4-28.9 mg equiv. of gallic acid / 100 g of fresh fruit. Besides, the lycopene content of the fruit produced in the organic substrates was 2.05-2.77 mg/100 g of fresh fruit. Meanwhile, the tomato produced under chemical fertilization (Steiner solution) was 2.93 mg/100 g of fresh product. The results showed that the organic substrates could be used for producing tomato with a high phytochemical quality.
Keywords: Solanum lycopersicum Mil.; Organic substrates; Phenolics; Antioxidants; Lycopene.
INTRODUCCIÓN
El tomate es la hortaliza de mayor consumo en el mundo, con una producción mundial al año que llega a los 130 millones de toneladas (FAO, 2011). Los consumidores en años recientes han incrementado aún más su demanda ya que prefieren tomates con alto contenido fitoquímico y nutritivo (vitaminas, antioxidantes, licopeno, entre otros) (Angelini et al., 2010). En México, el cierre de la producción agrícola en el cultivo de tomate rojo en 2012 fue de 2,8 millones de toneladas, con un rendimiento de 51,38 t/ha (SIAP, 2012). En años recientes la producción de tomate se ha venido realizando en invernadero, ya que disminuye los riesgos de pérdidas por climas adversos, se hace un uso eficiente de los recursos naturales y se han visto incrementos significativos en su producción, tanto en cantidad como en calidad (Espinosa, 2004).
El tomate es un producto utilizado frecuentemente por las familias en el consumo diario ya sea fresco en ensaladas, puré o como condimento. Este consumo ayuda a la prevención de las enfermedades y la conservación de la salud, porque además del aporte de nutrientes y fibra, contiene compuestos fitoquímicos que se destacan por sus propiedades antioxidantes (González et al., 2010; Crespo et al., 2008).
Sin embargo, la producción de alimentos orgánicos en México demanda fuentes nutricionales orgánicas; en la región se han utilizado compost, vermicompost y estiércol solarizado (Márquez et al., 2013; Márquez-Quiroz et al., 2014). El uso de estas fuentes orgánicas de nutrientes conlleva una mejora en las propiedades físicas y químicas de los sustratos, lo cual se refleja en un mejor desarrollo del cultivo.
Por otra parte, el uso de materiales orgánicos previamente tratados como el estiércol solarizado o vermicompost serían una excelente alternativa para la producción de hortalizas orgánicas con mayor contenido fitoquímico (Preciado et al., 2011). Los residuos orgánicos procesados por la lombriz de tierra, frecuentemente denominados vermicompost, son de tamaño fno, con alta porosidad y por ende aireación y drenaje y, a su vez, una alta capacidad de retención de agua. El vermicompost comparado con la materia prima que lo genera, tiene reducidas cantidades de sales solubles, mayor capacidad de intercambio catiónico y un elevado contenido de ácidos húmicos totales (Fortis et al., 2012). De acuerdo a Morales et al. (2009) el pH de un sustrato se prefiere que sea ligeramente ácido (5,5-6,5) y la conductividad eléctrica que no sea mayor de 2 dS/m. Bansal y Kapoor (2000), señalan que utilizar el estiércol bovino a través de Eisenia foetida en la elaboración de abonos orgánicos contribuye a mantener una biodiversidad de organismos y se puede encontrar una buena relación carbono/nitrógeno.
En relación a los alimentos funcionales, estos aportan al organismo determinadas cantidades de vitaminas, grasas, proteínas, hidratos de carbono y otros elementos necesarios. Sin embargo, cuando un alimento funcional ayuda además a la calidad y mantenimiento de la vida y la salud, o a la prevención de enfermedades, entonces se puede llamar Nutracéutico (Pérez-Leonard, 2006). El cultivo de tomate requiere de ciertas condiciones y medios para obtener un aumento en producción. Unos de los principales factores que determinan el éxito son el suelo, los sustratos o los medios de crecimiento. Particularmente, la caracterización de las propiedades físicas y químicas de los sustratos es importante para determinar su potencial productivo y los beneficios esperados en el crecimiento, desarrollo y calidad nutraceutica de los cultivos.
En este sentido, el objetivo del presente trabajo fue evaluar la relación de los diferentes sustratos orgánicos en la producción (rendimiento) y calidad fitoquímica (capacidad antioxidante, fenoles y licopeno) del tomate en condiciones de invernadero, para mejorar el valor nutritivo de los alimentos y proveer beneficios fisiológicos para el control o la prevención de enfermedades de los consumidores.
MATERIALES Y MÉTODOS
Descripción del sitio experimental. El estudio se realizó en el Instituto Tecnológico de Torreón (ITT), Torreón, Coahuila, México, ubicado entre los paralelos 24° 30’ y 27° N, y meridianos 102° 00’ y 104° 40’ O, a una altitud de 1120 msnm, en condiciones de invernadero. La dimensión del invernadero fue de 120 m2, con estructura de acero galvanizado y cubierta de polietileno tratado contra rayos ultra violeta, calibre 720.
Métodos. El tomate evaluado (tipo Saladette variedad Sahel) fue producido durante el ciclo agrícola otoño-invierno en 2012. Las semillas fueron colocadas en bandejas de polietileno de 200 cavidades (una semilla por cavidad), las cuales contenían Peat Moss húmedo (Premier Promix P6X, Quebec, Canadá) como sustrato. El contenedor fue cubierto con una bolsa plástica negra, y se irrigó diariamente con atomizador hasta la germinación de las semillas. El trasplante fue realizado en el mes de septiembre cuando los juveniles tuvieron 10-15 cm de altura y de 3-5 hojas verdaderas. Los juveniles fueron colocados en bolsas de plástico de polietileno calibre 800 color negro de 10 kg de capacidad; se usó un juvenil/maceta; estos fueron distribuidos en doble hilera con una separación de 30 cm a una densidad de población de 4 plantas/m2. El riego de las plantas fue realizado 2 veces al día, con un volumen de 0,500 L/maceta/día desde el trasplante hasta la floración, y luego fue de 1,0 L/maceta/día desde la floración hasta la cosecha. La polinización fue realizada de forma manual diariamente entre las 12:00-14:00 desde la floración hasta el inicio del desarrollo del fruto. Las plantas fueron podadas y guiadas a un tallo, y sosteniéndolo con rafia. Se emplearon productos orgánicos para control de plagas y enfermedades (mosquita blanca y virosis), las cuales incluyeron repelentes orgánicos como aceite vegetal de Neem y extracto de ajo a razón de 5 cm3 por litro de agua.
Tratamientos. Se evaluaron mezclas de sustratos orgánicos de estiércol bovino (solarizado, composteado y vermicomposteado) y un testigo con fertilización química. La solarización del estiércol y la elaboración de la compost fueron elaboradas en el Campo Experimental y en el Lombricario del ITT. Las mezclas fueron realizadas en base a volumen (v:v) T1= (80%A+20%VER); T2= (90%A+10%ES); T3=(80%A+20%P) Testigo Solución Steiner; T4=(80%A+5%S+15%VER); T5= (85%A+15%COM); T6= (80%A+5%S+15%ES), utilizando como material inerte la perlita y arena, la cual fue lavada con una solución de ácido sulfúrico al 1% y esterilizada con una solución de hipoclorito de sodio al 5%. El tratamiento de fertilización química aplicado fue la solución nutritiva inorgánica (Steiner, 1984). Ésta se preparó usando fertilizantes comerciales altamente solubles, se ajustó a un pH de 5,5 con ácido sulfurico (Capulín-Grande et al., 2007), y la conductividad eléctrica (CE) fue de 2,0 dS/m aforando con agua (Oliva-Llaven et al., 2010). Se realizó un análisis químico de los sustratos elaborados al inicio y al final del ciclo del cultivo de tomate para determinar las propiedades químicas de los sustratos (Tabla 1). El diseño experimental fue completamente al azar con seis tratamientos y cinco repeticiones cada uno, dando como resultado 30 unidades experimentales.
Tabla 1. Análisis químico de los sustratos evaluados para producción de tomate en invernadero.
Table 1. Chemical analysis of the evaluated substrates for greenhouse tomato production.
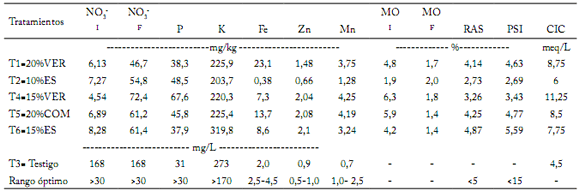
I= Análisis inicial; F= Análisis final de los sustratos evaluados; MO= Materia orgánica; RAS= Relación de absorción de sodio; PSI= porcentaje de sodio intercambiable; CIC= capacidad de intercambio catiónico.
I= Initial Analysis; F= Final analysis of the evaluated substrates; MO= organic matter; RAS= sodium absorption ratio; PSI= percent exchangeable sodium; CIC= cation exchange capacity.
Las variables evaluadas fueron: rendimiento, fruta comercial (peso del fruto, diámetro ecuatorial y polar, cáscara y ancho de la pulpa, y contenido de sólidos solubles), y calidad nutracéutica (contenido fenólico y capacidad antioxidante por el método ABTS+).
Variables evaluadas en planta. Rendimiento (kg/m2): se cosecharon los frutos de tomate considerando su tamaño comercial; se utilizó una balanza analítica marca Shimadzu, considerando el peso de cuatro plantas por tratamiento. Contenido relativo de clorofila (unidades SPAD): se midió con el Medidor Minolta Spad 502 plus.
Variables evaluadas en fruto. Diámetro polar, ecuatorial y de pulpa (cm): Se midió con un vernier manual cada fruto cosechado. Sólidos solubles totales o °Brix (%): se midieron los sólidos solubles de todos los frutos de tomate con un refractómetro marca SperScientific 300001. Se evaluó la calidad nutracéutica (contenido fenólico, capacidad antioxidante por el ABTS + y contenido de licopeno).
Extracto de obtención. Cinco gramos de la muestra (pulpa de tomate fresco) se mezclaron con 10 mL de metanol en un tubo de plástico tapón de rosca, que se colocaron en un agitador (ATR Inc., EU) durante 6 horas (20 rpm) a 5 °C. Los tubos se centrifugaron a 3000 rpm durante 10 min, y el sobrenadante se extrajo para pruebas analíticas.
Contenido de fenólicos totales. El contenido fenólico total se midió usando una modificación del método Folin-Ciocalteau (Esparza Rivera et al., 2006). Se mezclaron 300 µL de muestra y se le agregaron 1080 mL de agua destilada y 120 µL de reactivo Folin-Ciocalteau (Sigma-Aldrich, St. Louis MO, EU), agitando en vórtex durante 10 segundos. Después de 10 minutos se añadieron 0,9 mL de carbonato de sodio (7,5% p/v) agitándose durante 10 segundos. La solución fue dejada en reposo a temperatura ambiente por 30 minutos, y luego fue leída su absorbancia a 765 nm en un espectrofotómetro HACH 4000. El contenido fenólico se calculó mediante una curva patrón usando ácido gálico (Sigma, St. Louis, Missouri, EU) como estándar, y los resultados se reportaron en mg deácido gálico equivalente por g de muestra base seca (mg equiv AG/g BS). Los análisis se realizaron por triplicado.
Capacidad antioxidante equivalente en Trolox (método ABTS+). La capacidad antioxidante equivalente en Trolox se evaluó de acuerdo al método in vitro ABTS+ publicado por Esparza Rivera et al. (2006). Se preparó una solución de ABTS+ con 40 mg de ABTS (Aldrich, St. Louis, Missouri, EU) y 1,5 g de dióxido de manganeso (Fermont, Nuevo León, México) en 15 mL de agua destilada. La mezcla fue agitada vigorosamente y se dejó reposar cubierta durante 20 minutos. Luego, la solución se filtró en papel Whatman 40 (GE Healthcare UK Limited, Little Chalfont, Buckinghamshire, Reino Unido), y la absorbancia se ajustó a 0,700 ± 0,010 a una longitud de onda de 734 nm utilizando solución fosfato buffer 5 mM. Para la determinación de capacidad antioxidante se mezclaron 100 µL de muestra y 1 mL de solución ABTS+, y después de 60 y 90 segundos de reacción se leyó la absorbancia de la muestra a 734 nm. Se preparó una curva estándar con Trolox (Aldrich, St. Louis, Missouri, EU), y los resultados se reportaron como capacidad antioxidante equivalente en µM equivalente en Trolox por g base seca (µM equiv Trolox/mg BS). Los análisis se realizaron por triplicado.
Contenido de licopeno. Fue determinado usando una modificación del método cromatográfico publicado por Berra (2012), basado en el método citado por Barba et al (2006). Un gramo de tomate fresco fue mezclado con 5 mL de una solución cloroformo: metanol (5:1) en un tubo Falcon. La mezcla muestra-solventes fue agitada en ausencia de luz por 24 horas en un agitador rotatorio a 20 rpm. Luego la fase de cloroformo fue separada, centrifugada a 4000 rpm por 10 minutos, y filtrada en una columna de separación empacada con sulfato de sodio (Sigma) activado. Después el cloroformo fue evaporado del extracto en un rotavapor, y el residuo fue almacenado a -20 °C hasta su reconstitución y análisis. El residuo fue reconstituido en cloroformo grado cromatográfico (Sigma), y filtrado a través de un filtro de membrana (MARCA) de 0,45 µm antes de ser inyectado en un equipo de cromatografía de alta resolución Hewlett Packard (Serie 1200, Palo Alto, Calif., U.S.A.) usando el software Chem Station para CL (Agilent Technologies, Palo Alto, Calif., U.S.A.). El licopeno fue eluido en una columna (MARCA) C18 a un flujo de 0,5 mL/min, usando como fase móvil una mezcla 50:50 de acetonitrilo (Sigma) y metanol (Sigma) al 70%, ambos solventes grado cromatográfco. El efluente fue monitoreado a 472 nm en un detector de arreglo de diodos. Los resultados fueron obtenidos usando una curva estándar para licopeno (Sigma), y reportados como mg de licopeno por g de tomate fresco. Los análisis fueron realizados por duplicado.
Análisis estadístico. Se realizaron Análisis de varianza (ANOVA) (F≤0,05) utilizando el programa estadístico Statistical Analysis System (SAS, 1998), y la prueba de Separación de Medias se realizó con una prueba de Tukey (p≤0,05).
RESULTADOS Y DISCUSIÓN
Rendimiento de tomate. El rendimiento fue afectado por el tipo de sustrato utilizado (P<0,05). Estos resultados coinciden con los publicados por Márquez-Hernández et al. (2013) y Márquez-Quiroz et al. (2014) quienes reportan que debido a diferente composición de nutrientes en los materiales orgánicos se tienen distintos niveles de rendimiento en la producción de tomate. Asimismo, los tratamientos mostraron diferencias significativas (P≤0,05) entre ellos, con una media de 0,6-2,2 kg/planta, y 2,49-8,75 kg/m2 (Fig. 1). Por otra parte, se obtuvo un rendimiento similar en el sustrato 4 compuesto por 80% Arena + 20% Vermicompost, en comparación con el testigo Solución Steiner (P>0,05). Estos resultados concuerdan con los publicados por Márquez-Hernández et al. (2012), Herencia et al. (2007) y Moreno et al. (2005) al comparar fertilizaciones orgánicas e inorgánicas. Es posible que la composición nutricional de los sustratos obtenidos de la combinación de medios inertes y vermicompost al 15% v/v, satisfagan los requerimientos de los cultivos de tomate saladette.
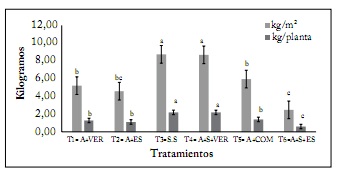
Fig. 1. Rendimiento en el cultivo de tomate producido con sustratos orgánicos en invernadero. Letras distintas dentro de cada columna indican diferencias estadísticamente significativas (Tukey P≤0,05).
Fig. 1. Yield in tomato crop produced with organic substrates in the greenhouse. Different letters within each column indicate statistically significant differences (Tukey P≤0.05).
Estos resultados son menores a los obtenidos por Ortega et al. (2010), quienes reportan rendimientos de tomate en sustratos orgánicos de 10,9-25,0 kg/m2. Por otro lado Zarate (2007) reporta valores de 5,83 kg/planta y 35 kg/m2. Los menores rendimientos obtenidos en el presente trabajo con fertilización orgánica pudieron deberse a la alta CE en los sustratos siendo mayor de 4 dS/m (Tabla 2).
Tabla 2. Determinación de pH y Conductividad Eléctrica de los sustratos evaluados para la producción de tomate al inicio y al final del ciclo del cultivo.
Table 2. Determination of pH and Electrical Conductivity of the evaluated substrates for tomato production at the beginning and end of the crop cycle.
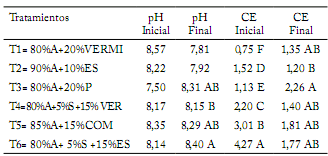
pH= Potencial de Hidrógeno; CE= Conductividad eléctrica.
pH= Potential Hydrogen; EC= electrical conductivity.
Por otra parte se ha reportado en la literatura que es factible obtener rendimientos similares a los obtenidos en el presente trabajo con la aplicación de la fertilización inorgánica óptima (Solución Steiner) mediante la aplicación de algunas fuentes nutritivas orgánicas.
Asimismo, Márquez et al. (2005) reportaron rendimientos similares en tomate producido bajo fertilización inorgánica y el obtenido en un sustrato de arena y vermicompost (50:50% v:v). Los resultados implican que la combinación de vermicompost y material inerte para la constitución de un sustrato contribuyen a la obtención de rendimientos similares a los obtenidos en la producción de tomate usando fertilización inorgánica. Sin embargo la proporción vermicompost- material inerte afecta el rendimiento, ya que se han obtenido distintos resultados dependiendo del porcentaje de vermicompost utilizado.
Rodríguez et al. (2007) reportaron que la aplicación de fertilizantes de algunas fuentes inorgánicas no resulta en la obtención de rendimientos similares a los obtenidos con la aplicación de la Solución Steiner. Con respecto a esto, Márquez et al. (2008), que encontraron que mezclas de vermicomposta y biocomposta tuvieron rendimientos 21,03% menores a los obtenidos en el testigo (Fertilización inorgánica) con un rendimiento de 115,78 t/ha.
Por otra parte, Subler et al. (1998) observaron que el mejor desarrollo del cultivo de tomate se obtuvo con proporciones de 10 y 20% de vermicomposta. También Atiyeh et al. (2000) señalaron que al usar más de 20% de composta en el sustrato disminuyó el rendimiento de la planta. En el presente estudio esto explicaría el menor rendimiento obtenido en el tratamiento 1 (80%A+20%Ver). Tuzel et al. (2003) mencionan que los abonos orgánicos son una alternativa para sustituir la fertilización inorgánica.
Contenido relativo de clorofila (SPAD). Los resultados para esta variable mostraron diferencias significativas (P≤0,05) respecto al contenido relativo de clorofla a los 90 ddt con valores de medias entre (42,5- 60,6) unidades SPAD. El tratamiento 3 (Solución Steiner) fue el más alto con un valor de 60,60 unidades SPAD (Fig. 2). El tratamiento 1 (80%A+20%VER) fue el mayor tratamiento orgánico con un valor de 50,60 unidades SPAD.
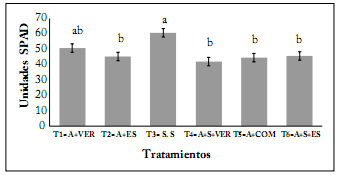
Fig. 2. Contenido relativo de clorofila a los 90 ddt en el cultivo de tomate producido con sustratos orgánicos en invernadero. Letras distintas dentro de cada columna indican diferencias estadísticamente significativas (Tukey P≤0,05).
Fig. 2. Relative chlorophyll content at 90 DAT on tomato crops produced with organic substrates in the greenhouse. Different letters within each column indicate statistically significant differences (Tukey P≤0.05).
En el caso de la solución Steiner, altas cantidades de N se han relacionado con incrementos en la fotosíntesis en varios estudios (Siddiqui et al., 2010). Dado que estos valores de N están directamente relacionados con aumentos en la actividad fotosintética, los tratamientos orgánicos podrían ser una opción viable para ser utilizados como fuente de nutrientes para tomate en invernadero, cuando se busca disminuir el uso de fertilizantes convencionales (Preciado et al., 2011). Asimismo, De la Cruz-Lázaro et al. (2010) encontraron en hojas de tomate, usando fertilización con solución Steiner (100%), valores de SPAD de 57,33 a los 40 ddt y de 53,80 a los 70 ddt, y en sustratos de tezontle más vermicompost los valores fueron de 45,33-37,75, respectivamente.
Calidad. Para el caso de la comparación de medias (P≤0,05) no existió diferencia significativa entre las variables diámetro polar (4,8-5,9 cm), ecuatorial (4,1-4,7 cm), y espesor de pulpa (0,48-0,64 cm) (Tabla 3). Márquez y Cano (2004) reportan menor °Brix en tomate cuando se cultiva en medios inertes, con respecto al uso de sustratos orgánicos.
Tabla 3. Diámetro polar, ecuatorial, pulpa y sólidos solubles de los frutos de tomate evaluados.
Table 3. Polar and equatorial diameters, pulp and soluble solids of the evaluated tomato fruits.
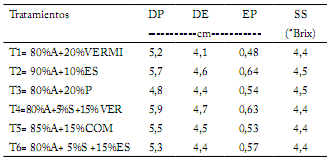
DP= diámetro polar; DE= diámetro ecuatorial; EP= espesor de pulpa;
SS= Sólidos Solubles °Brix.pH= Potential Hydrogen; EC= electrical conductivity.
DP= polar diameter; DE= equatorial diameter; EP= thickness of pulp; SS= ° Brix soluble solids.
En el presente trabajo se obtuvieron valores constantes entre tratamientos en los °Brix (entre 4,4 y 4,5 °Brix). Santiago et al. (1998) señalaron que el tomate para consumo en fresco debe de contener un mínimo de 4,0 °Brix, mientras que Diez (2001) mencionó que el tomate para el procesado industrial debe contar con un contenido de 4,5-5,5 °Brix. Márquez et al. (2013) presentaron valores de 4,61 °Brix en el tratamiento con fertilización orgánica. Gutiérrez et al. (2007) mencionaron que al fertilizar con compost generalmente aumentan los sólidos solubles.
Preciado et al. (2011) señalaron en relación con el tamaño valores de diámetro polar (5,87-6,16 cm), diámetro ecuatorial de (5,39-5,9 cm) y la concentración de sólidos solubles totales (°Brix) del fruto de tomate de (4,1-4,6) para las soluciones nutritivas orgánicas presentaron mayor contenido de sólidos solubles y mayor tamaño de frutos.
La mayor acumulación de sólidos solubles en el fruto podría deberse a una menor absorción y acumulación de agua por los frutos; para superar este problema, los frutos acumulan solutos orgánicos como azúcares simples (glucosa, fructosa y sacarosa) que reducen el potencial osmótico, facilitando así la absorción de agua (Plaut et al., 2004; Goykovic et al., 2007). En el presente estudio, todos los tratamientos evaluados alcanzaron los valores de referencia para el consumo en fresco y para la industria.
Calidad fitoquímica del tomate. El contenido fenólico del fruto producido obtuvo diferencia significativa con valores de 16,4 (T4= 80%A+5%S+15%Ver) a 28,9 (T5=85%A+15%Com), mg equiv. de Ac. Gálico / 100 g en peso fresco. Sin embargo, el tipo de sustrato no tuvo efecto sobre el contenido de licopeno del fruto (P≤0,05) (Tabla 4). Para la Capacidad Antioxidante método ABTS+ se encontró diferencia significativa con valores de 142-236 (µM equiv Trolox / 100 g PF), obteniendo el menor valor en T1 (80%A+ 20%VER) y el mayor valor en T5 (85%A+15%COM) y T6 (80%A+5%S+15%ES), respectivamente. El contenido de licopeno del tomate producido con sustratos orgánicos fue de 2,05 (T6=80%A+5%S+15%ES) a 2,77 (T5=85%A+15%Com) mg / 100 g de tomate fresco. El fruto producido bajo fertilización química (Solución Steiner) fue de 2,93 mg/100 g de tomate fresco.
Tabla 4. Contenido fenólico total y de licopeno, y capacidad antioxidante de tomate producido con diferentes sustratos orgánicos.
Table 4. Total phenolic and lycopene contents and antioxidant capacity of tomato produced with different organic substrates.
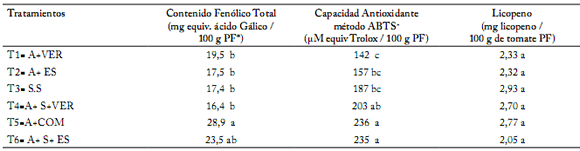
* PF Peso Fresco. Letras distintas dentro de cada columna indican diferencias estadísticamente significativas (Tukey P≤0,05).
* PF Fresh Weight. Different letters within each column indicate statistically significant differences (Tukey P≤0.05).
El contenido fenólico total y la capacidad antioxidante del tomate orgánico fueron afectados por el tipo de sustrato usado. El contenido fenólico del fruto producido en el presente experimento coinciden con los reportados por Zapata et al. (2007), quienes mencionan un contenido fenólico de 17,38 ± 4,40 y 18,97 ± 5.57 mg GAE/100 g tomate fresco en etapa de maduración y comercial. Así mismo Toor et al. (2006) reportan contenidos de fenoles de tomates cultivados en invernadero entre 15,7 y 20,14 mg GAE/100 g tomate fresco.
Los resultados obtenidos en el contenido de licopeno coinciden con los publicados por Adalid et al. (2007), quienes reportan valores similares a los obtenidos en muestras de tomateS. lycopersicon, con 0,66-2,82 mg/100 g de tomate fresco.
La respuesta de las plantas a ambientes estresantes, como en sistemas de producción orgánica, genera mecanismos de defensa incluyendo la producción de antioxidantes (Winter y Davis, 2006). En el presente estudio se utilizaron materiales orgánicos como fuente nutricional, además de que confrieron ciertas propiedades a los sustratos usados debido a los porcentajes aplicados (10 a 20% en base a v/v). Por otra parte, se ha reportado que el contenido de licopeno puede variar de acuerdo con las técnicas de fertilización, tiempo de cosecha y variedad seleccionada (Waliszewski y Blasco, 2010).
Además, es sabido que durante el proceso de maduración del tomate se presentan cambios en el contenido de las clorofilas y carotenoides en los cuales generalmente las clorofilas son degradadas, mientras que se desencadena el proceso de carotenogénesis. Este proceso consiste en el incremento del contenido de carotenoides específicamente, de licopeno, el cual se encuentra directamente relacionado con el grado de madurez del fruto (Solovchenko et al., 2005). Es posible que el aporte nutricional de los tratamientos orgánicos usados fue un factor estresante para la planta en las etapas iniciales de crecimiento, lo cual resultó en la formación del compuesto carotenoide licopeno a un nivel relativamente alto en el fruto.
En el presente estudio se obtuvo el mayor contenido fenólico y capacidad antioxidante en los tratamientos 5 y 6, los cuales resultaron con rendimientos menores a los considerados como aceptables. Una situación a destacar durante el desarrollo del presente estudio fue la presencia de virosis en el cultivo de tomate. Borguini et al. (2009) mencionan que el mayor contenido de compuestos fenólicos en alimentos orgánicos se produce debido a la posible incidencia de plagas y patógenos en el método de cultivo orgánico. Posiblemente esta infección causó un incremento en el contenido fenólico y capacidad antioxidante del fruto en los tratamientos 5 y 6, que resultaron ser los más afectados además de la alta conductividad eléctrica que presentaron.
La calidad fitoquímica, específicamente el contenido de licopeno del tomate fresco producido con las mezclas de materiales orgánicos usadas en el presente estudio resulto igual a la calidad fitoquímica del producto obtenido bajo fertilización tradicional (Solución Steiner). Esto indica la factibilidad de los tratamientos orgánicos por su bajo costo en la implementación de la producción orgánica de tomate.
CONCLUSIONES
El rendimiento de tomate fue estadísticamente similar con la utilización de la solución Steiner (8,75 kg/m2) y la mezcla de arena más tierra y vermicompost (8,70 kg/m2). La utilización de compost (85%A+15%COM) y vermicompost (80%A+5%S+15%VER) en mezclas de sustratos podrían permitir reducir la fertilización química, sin afectar el rendimiento del cultivo de tomate. Esto se considera una mejora en lo que se refiere a fertilización y uso de sustratos en los sistemas de producción bajo invernadero. La calidad Fitoquímica, específicamente contenido de licopeno del tomate fresco producido con las mezclas de materiales orgánicos usadas en el presente estudio, resultó igual a la calidad Fitoquímica del producto obtenido bajo fertilización tradicional (Solución Steiner). Esto indica la factibilidad de utilizar estos tratamientos para la producción orgánica de tomate. Los resultados obtenidos fortalecen el enfoque de que es posible producir orgánicamente en la Comarca Lagunera. Esto es, promoviendo el reciclado del principal residuo orgánico generado en la agroindustria pecuaria (estiércol), a través del proceso de composteo y vermicomposteo. Estos procesos potencialmente podrían optimizar el empleo de recursos naturales no renovables en la producción de cultivos hortícolas en la región.
REFERENCIAS
1. Adalid, A.M., J.M Herrero-Martínez, S. Roselló, A. Maquieira y F. Nuez (2007). Fast determination of prominent carotenoids in tomato fruits by CEC using methacrylate ester-based monolithic columns. Electrophoresis 28: 4120–4127.
2. Angelini, R. (2010). Pomodoro. ART Servizi Editoriali S.p.A., Italia. [ Links ]
3. Atiyeh, R.M., N. Arancon, C.A. Edwards y J.D. Metzger (2000). Influence of earthworm-processed pig manure on the growth and yield of greenhouse tomatoes. Bioresource Technology 75: 175-180. [ Links ]
4. Bansal, S. y K.K. Kapoor (2000). Vermicomposting of crop residue and cattle dung with Eiseniafoetida. Bioresource Technology 73: 95-98. [ Links ]
5. Barba, A.I.O., M. Cámara Hurtado, M.C. Sánchez Mata, V Fernández Ruiz., M. López Saénza de Tejada (2006). Application of a UV-vis detection -HPLC method for a rapid determination of lycopene and b-carotene in vegetables. Food Chemistry 95: 328-336. [ Links ]
6. Berra, W.G (2012). HPLC method optimization and validation for determination of lycopene in tomato (Lycopersicon esculentum, Mill.) Fruits. Science, Technology and Arts Research Journal 1: 14-26 [ Links ]
7. Borguini, R.G. y E.A.F.D Torres (2009). Tomatoes and tomato products as dietary sources of antioxidants. Food Research International, Amsterdam 25: 313-325. [ Links ]
8. Capulín-Grande, J., R. Nuñez-Escobar J. Aguilar-Acuña, M. Estrada-Botello, P. Sánchez-García & J.J. Mateo-Sánchez (2007). Uso de estiércol líquido de bovino acidulado en la producción de pimiento morrón. Revista Chapingo. Serie Horticultura 13: 5-11. [ Links ]
9. Crespo, I., M.V. García-Mediavilla, M. Almar, P. González, M.J. Tuñón, S. Sánchez-Campos y J. González-Gallego (2008). Differential efects of dietary flavonoids on reactive oxygen and nitrogen species generation and changes in antioxidant enzyme expression induced by proinflammatory cytokines in Chang Liver cells. Food and Chemical Toxicology 46: 1555-1569. [ Links ]
10. De la Cruz, E., R. Osorio-Osorio, E. Martínez-Moreno, A.J. Lozano del Río, A. Gómez-Vázquez y R. Sánchez-Hernández (2010). Uso de compostas y vermicompostas para la producción de tomate orgánico en invernadero. Interciencia 35: 363-368. [ Links ]
11. Diez, N.M. (2001). Tipos varietales. El cultivo del tomate. Editorial Mundiprensa. Madrid, España, pp. 93-129. [ Links ]
12. Esparza, R.J.R, M.B. Stone, C. Stushnoff, E. Pilon Smith y P.A. Kendall (2006). Effects of Ascorbic acid applied by two hydrocooling methods on physical and chemical properties of green leaf lettuce stored at 5 °C. Journal of Food Science 71: 270-276. [ Links ]
13. Espinosa, C. (2004). Memorias del IV Simposio Nacional de Horticultura. Invernaderos: Diseño, Manejo y Producción. Torreón, Coah. México. Octubre 13,14 y 15 del 2004. [ Links ]
14. Food Agriculture Organization (FAO) (2011). Los mercados mundiales de frutas y verduras orgánicas. Roma, Italia. 230 p. [ Links ]
15. Fortis Hernández, M., P. Preciado Rangel, J.L. García Hernández, A. Navarro Bravo, J. Antonio González y J.M. Omaña Silvestre (2012). Sustratos orgánicos en la producción de chile pimiento morrón. Revista Mexicana de Ciencias Agrícolas 3: 1203-1216. [ Links ]
16. González, G.J., M.V. García Mediavilla, S. Sánchez Campos y M.J Tuñón (2010). Fruit polyphenols, immunity and inflammmation. British Journal of Nutrition 104: S15-27. [ Links ]
17. Goykovic, V.C. y R. Saavedra (2007). Algunos aspectos de la salinidad en el cultivo de tomate y prácticas agronómicas de su manejo. IDESIA 25: 47-58. [ Links ]
18. Gutiérrez, M.F.A., J. Santiago Borraz, J.A. Montes Molina, C. Carlos Nafate, M. Abud Archila, M.A. Oliva Laven, R. Rincón Rosales y L. Dendooven (2007). Vermicompost as a soil supplement to improve growth, yield and fruit quality of tomato (Lycopersicum esculentum). Bioresource Technology 98: 2781-2786. [ Links ]
19. Herencia, F., P.J.C. Ruiz, S. Melero, G.P.A. García, E. Morillo y C. Maqueda (2007). Comparison between Organic and Mineral Fertilization for Soil Fertility Levels, Crop Macronutrient Concentrations, and Yield. Agronomy Journal 99: 973-983. [ Links ]
20. Márquez, H.C., P. Cano-Ríos, U. Figueroa Viramontes, J.A. Avila Diaz, N Rodríguez-Dimas y J.L. García Hernández (2013). Rendimiento y calidad de tomate con fuentes orgánicas de fertilización en invernadero. FYTON Revista internacional de Botánica Experimental ISSN 0031 9457. 82: 55-61. [ Links ]
21. Márquez, H.C., P. Cano-Ríos y C.V.M. Martínez (2005). Fertilización orgánica para la producción de tomate en invernadero. En: C.A. Leal CH. y J.A Garza G. (eds), pp. 1-11. Memorias del Tercer Simposio Internacional de Producción de Cultivos en invernaderos. Facultad de Agronomía-UANL, Monterrey N.L. México. [ Links ]
22. Márquez Quiroz C., P. Cano-Ríos, A. Moreno Reséndez, U. Figueroa Viramontes, E. Sánchez Chávez, E. De la Cruz Lázaro y V. Robledo Torres (2014). Efecto de la fertilización orgánica sobre el rendimiento y contenido nutricional de tomate saladette en invernadero. ITEA 110: 3-17. [ Links ]
23. Morales Munguía, J.C., M.V. Fernández Ramírez, C. Montiel Cota, y A.B Peralta Beltrán (2009). Evaluación de sustratos orgánicos en la producción de lombricomposta y el desarrollo de lombriz (eiseniafoetida). BIOtecnia 21: 19-26. [ Links ]
24. Moreno, A., M.T. Valdés y T. Zarate (2005). Desarrollo de tomate en sustratos de vermicompost/arena bajo condiciones de invernadero. Agricultura Técnica 65: 26-34. [ Links ]
25. Oliva Llaven, M.Á., L. Rodríguez Hernández, P. Mendoza Nazar, B. Ruiz Sesma, J.D. Álvarez Solís, L. Dendooven y F.A. Gutiérrez Miceli (2010). Optimization of worm-bed leachate for culturing of tomato (Lycopersicon esculentum Mill) inoculated with Glomusfasciculatum and Pseudomonas fluorescens. Electronic Journal of Biotechnology 13: 1-8. [ Links ]
26. Ortega Martínez L.D., J. Sánchez Olarte, J. Ocampo Mendoza, E. Sandoval Castro, B.A. Salcido Ramos y F. Manzo Ramos (2010). Efecto de diferentes sustratos en crecimiento y rendimiento de tomate (Lycopersicum esculentum Mill) bajo condiciones de invernadero. Universidad Autónoma Indígena de México Mochicahui, El Fuerte, Sinaloa. Revista de Sociedad, Cultura y Desarrollo Sustentable Ra Ximhai 6: 339-346. [ Links ]
27. Pérez Leonard, H. (2006). Nutracéuticos: componente emergente para el beneficio de la salud. ICIDCA Instituto Cubano de Investigaciones de los Derivados de la Caña de Azúcar. Cuba 40: 20-28. [ Links ]
28. Plaut, Z., A. Grava, Ch. Yehezkel y E. Matán (2004). How do salinity and water stress affect transport of water assimilates and ions to tomato fruits? Physiologia Plantarum 122: 429-442. [ Links ]
29. Preciado Rangel, P., M. Fortis, J.L. García Hernández, E. Rueda, J.R. Esparza, A. Lara, M.A. Segura y J. Orozco (2011). Evaluación de soluciones nutritivas orgánicas en la producción de tomate en invernadero. Interciencia 36: 689-693. [ Links ]
30. Rodríguez, Dimas N., P. Cano Ríos, E. Favela Chávez, U. Figueroa Viramontes, V. de Paul Álvarez., A. Palomo Gil, C. Márquez Hernández y A. Moreno Reséndez (2007). Vermicomposta como alternativa orgánica en la producción de tomate en invernadero. Revista Chapingo Serie Horticultura 13: 185-192. [ Links ]
31. Santiago, J., M. Mendoza y F. Borrego (1998). Evaluación de tomate (Lycopersicum esculentum, Mill) en invernadero: criterios fenológicos y fisiológicos. Agronomía Mesoamericana 9: 59-65. [ Links ]
32. SAS Statistical Analysis System (2002). SAS software version 9.1. SAS Institute, Inc. Cary, NC, USA. [ Links ]
33. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA) (2010). http://www.siap.gob.mx/, (Consulta: mayo 5, 2010). [ Links ]
34. Servicio de información agroalimentaria y pesquera (SIAP) (2012). Cierre de la producción agrícola por cultivo 2012. Consulta en: http://www.siap.gob.mx/cierre-de-la-produccion-agricola-por-cultivo/ (19/julio/2014). [ Links ]
35. Siddiqui, Masood H., V. Khand, y T.G. Sharma (2010). Measuring the customer perceived service quality for life insurance services: an empirical investigation. International Business Research 3: 171-186. [ Links ]
36. Solovchenko, A.E., O.B. Chivkunova, M.N. Merzlyak y V.A. Gudkovsky (2005). Relationships between chlorophyll and carotenoid pigments during on- and of-tree ripening of apple fruit as revealed non-destructively with refectance spectroscopy. Postharvest Biology and Technology 38: 9-17. [ Links ]
37. Steiner, A.A (1984). The universal nutrient solution. Proc. 6th Int. Cong. on Soilless Culture. ISOSC. Lunteren, Holanda, pp. 633-649. [ Links ]
38. Subler, S., S. Edwards y J. Metzger (1998). Comparing vermicomposts and composts. Biocycle 39: 63-66. [ Links ]
39. Toor R.K, G.P. Savage (2006). Changes in major antioxidant components of tomatoes during post-harvest storage. Food Chemistry 99: 724-727. [ Links ]
40. Tuzel Y., B. Yagmur y M. Gumus (2003). Organic tomato production under greenhouse conditions. Acta Horticulturae 614: 775-780. [ Links ]
41. Waliszewski, K.N. y G. Blasco (2010). Propiedades nutracéuticas del licopeno. Salud Pública Mexicana 52: 254-265. [ Links ]
42. Winter, C.K. y S.F. Davis (2006). Organic Foods. Journal of Food Science 71: 17-124. [ Links ]
43. Zapata, L.M., L. Gerard, C. Davies y M.C. Schvab (2007). Estudio de los componentes antioxidantes y actividad antioxidante en tomates. Universidad Nacional de Entre Ríos, Argentina. Ciencia, Docencia y Tecnología 18: 175-193. [ Links ]
44. Zarate, B. (2007). Producción de tomate (Lycopersicon esculentum Mill.) hidropónico con sustratos, bajo invernadero. Tesis de maestría. C.I.D.I.R. Oaxaca, México. [ Links ]














