Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.21 Posadas jun. 2014
GENÉTICA Y BIOLOGÍA
Selección de condiciones de cultivo óptimas para la secreción de endoglucanasas por cepas de Trichoderma nativas de Misiones
Selection of optimal culture conditions for endoglucanases secretion by native Trichoderma strains from Misiones
María L. Castrillo1,*, Gustavo A. Bich1, Pedro D. Zapata1, Laura L. Villalba1
1 Laboratorio de Biotecnología Molecular (Biotecmol), Instituto de Biotecnología Misiones "Dra. María Ebe Reca" (InBioMis), Universidad Nacional de Misiones. Ruta 12 km 7½. Posadas, Misiones, Argentina.
*E-mail: biotecmol2010@gmail.com
Resumen
Algunas especies de Trichoderma pueden producir grandes cantidades de enzimas hidrolíticas, tales como celulasas, las cuales poseen múltiples aplicaciones industriales y biotecnológicas. El objetivo del presente trabajo fue seleccionar las condiciones de cultivo en medio líquido que favorezcan la secreción de endoglucanasas por cepas del género Trichoderma nativas de la provincia de Misiones. Se llevaron a cabo experimentos utilizando carboximetilcelulosa 0,5% (p/v) como fuente de carbono y medio Mandels como complejo nitrogenado completo y se ensayaron diferentes condiciones de cultivo utilizando como variables el tiempo de incubación, la forma de inóculo y el sistema de control del pH del medio de cultivo. El presente trabajo permitió establecer que la inoculación en forma de suspensión de esporas y el tamponado del medio con buffer succinato de sodio pH 4,8 representan las condiciones de cultivo en medio líquido más adecuadas para la secreción de endoglucanasas por cepas nativas de T. harzianum y T. koningiopsis.
Palabras clave: Trichoderma; Condiciones de cultivo; Celulasas.
Abstract
Some Trichoderma strains produce large amounts of hydrolytic enzymes, such as lendoglucanases,which have many industrial and biotechnological applications. The aim of the present work was to select the culture conditions favouring the secretion of cellulolytic enzymes of Trichoderma native strains from the Province of Misiones. Several experiments were done with carboxymethylcellulose 0.5% (w/v) as carbon source and Mandel's medium containing a complex nitrogen source. Inoculation method, buffer composition and incubation time were selected as independent variables. This work allowed us to establish that the inoculation as spore suspension, and the buffered medium with sodium succinate buffer pH 4.8 represent the most suitable growing conditions in a liquid medium for endoglucanases secretion by native strains of T. harzianum and T. koningiopsis.
Keywords: Trichoderma; Culture conditions; Cellulases.
Introducción
Las especies pertenecientes al género Trichoderma se caracterizan por ser hongos saprófitos, que sobreviven en suelos con diferentes cantidades de materia orgánica, siendo capaces de descomponerla y en determinadas condiciones pueden ser anaerobios facultativos, lo que les permite mostrar una mayor plasticidad ecológica. Se encuentran presentes en todas las latitudes, desde las zonas polares hasta la ecuatorial. Esta distribución tan amplia y su plasticidad ecológica están estrechamente relacionadas con la alta capacidad enzimática que poseen para degradar sustratos, a su metabolismo versátil y a su resistencia a inhibidores microbianos [1]. La capacidad de algunas especies, como T. viride y T. reesei para producir grandes cantidades de enzimas hidrolíticas, tales como celulasas, se aplica comercialmente en áreas tan diversas como en la producción de detergentes, en la industria textil, en la industria de pulpa y papel y en la producción de biocombustibles [2; 3; 4].
Todos los organismos capaces de degradar celulosa cristalina secretan un conjunto de enzimas extracelulares con diferentes especificidades y modo de acción, que intervienen en la hidrólisis de la celulosa. Dicho conjunto se denomina sistema o complejo celulasas [5] y la degradación total de la celulosa requiere la acción sinérgica de los tres componentes enzimáticos de las celulasas [6]. Las celulasas incluyen a las endoglucanasas (EGs) o endo-1,4-β-glucanasas, celobiohi drolasas (CBHs) o exoglucanasas y β-glucosidasas (BGLs). Estas enzimas catalizan la bioconversión de celulosa insoluble a soluble en agua con la subsecuente liberación de glucosa [7]. Las EGs inician el ataque, rompiendo los enlaces β-1,4- glucosídicos en forma aleatoria principalmente en las regiones amorfas del interior de las moléculas de celulosa, produciendo nuevos extremos terminales no reductores. Las CBHs atacan gradualmente las moléculas de celulosa en los extremos terminales no reductores liberando subunidades de celobiosa. Finalmente, las BGLs hidrolizan la celobiosa a glucosa [6].
La biotecnología pretende hacer uso de la biodiversidad del planeta para desarrollar nuevos productos y procesos claves [8], sin embargo para evaluar y seleccionar nuevas cepas microbianas nativas capaces de producir celulasas primeramente es esencial optimizar los parámetros nutricionales y de operación (medios de cultivo, tipos de sustratos, condiciones operativas, pH, temperatura, cofactores, entre otros) que garanticen los máximos rendimientos de enzimas.
Particularmente para determinar cuantitativamente la actividad celulolítica [9], es necesario hacer crecer los microorganismos en un medio de cultivo que contenga una fuente de carbono y de nitrógeno que permitan la secreción extracelular de celulasas. Varios autores consideran a la carboximetilcelulosa (CMC) como una fuente de carbono óptima para la secreción de celulasas [8; 10; 11], y al medio de cultivo Mandels como un complejo nitrogenado completo que induce dicha secreción [12; 13; 14]. Como resultado de estas observaciones algunos métodos han sido propuestos para la detección de la actividad celulolítica en diferentes microorganismos, ya sea cualitativa como cuantitativamente [9; 10; 15; 16; 17; 18]. Actualmente los métodos más empleados y citados son el método cualitativo utilizando un medio selectivo conteniendo CMC, como única fuente de carbono, y revelando la presencia de celulasas mediante el agregado de una solución del colorante azoico rojo Congo [10; 11; 19; 20; 21]; y el método cuantitativo que determina la liberación enzimática de azúcares reductores durante la hidrólisis del CMC, como sustrato, mediante la técnica del ácido dinitrosalicílico (DNS) [9; 22; 23; 24; 25]. Sin embargo, se puede observar en la literatura que existen grandes variaciones entre los diferentes autores en cuanto a la forma de inóculo utilizada, al tiempo de incubación, y a las características del medio, ya sea pH, sistemas buffers, entre otros [12; 11; 14].
Por tanto, el objetivo del presente trabajo fue seleccionar las condiciones de cultivo que favorezcan la secreción de enzimas endoglucanasas en cepas del género Trichoderma nativas de la provincia de Misiones.
Materiales y Métodos
Microorganismos y condiciones de mantenimiento
Se trabajó con dos cepas pertenecientes al género Trichoderma aisladas a partir de suelos en ecosistemas naturales de la provincia de Misiones (Tabla 1).
Tabla 1: Identificación del lugar de procedencia de las cepas evaluadas.

Los cultivos de stock fueron mantenidos a 4 ºC en tubos de 1,5 mL con agar papa dextrosa (PDA) como medio de cultivo.
Composición del medio de cultivo
Los cultivos se prepararon utilizando como fuente de carbono CMC 0,5% (p/v), y como complejo nitrogenado completo el medio Mandels [12].
Se realizaron dos experimentos independientes (experimento Nº 1 y experimento Nº 2) para estandarizar las condiciones de cultivo utilizando como variables el tiempo de incubación, la forma de inóculo y el sistema de control del pH del medio:
Experimento Nº 1: Se prepararon medios de cultivo compuestos por 50 mL de medio Mandels [8] (p/v) + CMC 0,5% (p/v), en frascos Erlenmeyer de 250 mL. El pH del medio fue ajustado a 5 mediante la adición de ácido acético, previo a su esterilización, y fue registrado a lo largo del período de incubación mediante el control de acidez-alcalinidad en líquidos (DF Universal, test paper, colorímetro, pH 1-14). Como forma de inóculo fueron utilizados 5 tacos de micelio joven (10mm) a partir de medio de cultivo sólido PDA con la cepa reactivada 5 días antes. Los cultivos fueron incubados a 29 ºC con luz continua durante 10 días en condiciones estáticas, y cada 3 días se extrajo una alícuota de 1 mL de sobrenadante de cultivo para determinar la cinética de su actividad enzimática. Todos los ensayos fueron realizados por duplicado.
Experimento Nº 2: Se prepararon medios de cultivo compuestos por 50 mL de medio Mandels [8] (p/v) + CMC 0,5% (p/v) + 5 mL de buffer succinato de sodio pH 4,8 100 mM, en frascos erlenmeyer de 250 mL. Para corroborar el mantenimiento de las condiciones ácidas, el pH fue registrado a lo largo del período de incubación mediante el control de acidez-alcalinidad en líquidos (DF Universal, test paper, colorímetro, pH 1-14).La forma de inóculo utilizada fue una suspensión de esporas (107 esporas/mL), la cual se dejó incubar a 29 ºC con luz continua durante 15 días en condiciones estáticas, extrayéndose una alícuota de 1mL de sobrenadante de cultivo cada 2 días para determinar la cinética de su actividad enzimática. Todos los ensayos fueron realizados por duplicado.
La suspensión de esporas fue preparada a partir de cepas cultivadas en medio PDA durante 5 a 7 días a 29 °C con luz continua. Una vez lograda la esporulación, se preparó una suspensión de esporas en una solución de agua destilada estéril con agregado de Tween 80 0,1% (v/v) estéril. El recuento de esporas se realizó con cámara de Neubauer utilizando como base la técnica propuesta por Alves y Farias [26]. El inóculo consistió en 1 mL de esta suspensión de esporas a una concentración de 107 esporas/ mL.
Determinación de la actividad enzimática
La determinación de la actividad enzimática de EGs se realizó en espectrofotómetro Shimadzu UV-3600 a una absorbancia de 540 nm, mediante el empleo de celulosa cristalina al 2% como sustrato del ensayo. La cantidad de azúcares reducidos generados durante el ensayo se estimó mediante el método del ácido DNS, reportado por Miller [9] utilizando glucosa como estandard. La mezcla de reacción fue incubada a 50 °C por 30 min. Una unidad internacional (U/L) de actividad enzimática de EGs fue definida como la cantidad de enzima que libera un μmol de azúcares reductores por min por L.
Análisis estadístico
El análisis de ANOVA seguido por el test de Bonferroni se realizó utilizando Graph Pad Prism versión 6.0 para Windows (Graph Pad Software, San Diego, CA, USA).
Resultados y Discusión
En las condiciones planteadas en el experimento N° 1 (siembra con tacos de 10mm de diámetro) se observó una variable actividad enzimática EGs en el transcurso del tiempo de cultivo para las dos cepas ensayadas en los dos experimentos independientes correspondientes al experimento N° 1 (duplicados), sin mostrar diferencias significativas entre las mismas (p>0,05). Los resultados obtenidos en el experimento N° 1 se muestran en la Figura 1.

Figura 1: Cinética de la secreción de EGs por las cepas NAN-11 (■) y PROF-2 (●) cultivadas en las condiciones del experimento N° 1 (medio Mandels con CMC 0,5% (p/v), pH ajustado mediante la adición de ácido acético e incubación a 29 °C con luz continua) en dos experimentos independientes. Se grafican los valores de actividad enzimática EGs en U/L en función de los días de cultivo.
En este experimento, no fue posible determinar un patrón de secreción en las dos cepas analizadas, ni entre los duplicados del experimento, lo cual podría haber sido posible debido a la forma de inóculo utilizada, que no permite cuantificar exactamente la cantidad del mismo que fue adicionada a cada ensayo. Así mismo, a medida que pasaba el tiempo de cultivo, se observó que el pH iba incrementándose; esta alcalinización del medio podría ser la causa de un cambio en las condiciones aptas para el crecimiento fúngico, hecho que influiría en la secreción de enzimas [27] (Tabla 2).
Tabla 2: Variación del pH con los días de cultivo en las condiciones del experimento N°1.

Por tanto, de los resultados obtenidos del experimento N° 1 se pudo inferir que era necesario ensayar por un lado, otra forma de inóculo, más exacta y comparable, que permita obtener repetitividad del ensayo y esclarecer con certeza el día de máxima actividad enzimática, como podría ser la suspensión de esporas [28]. Por otro lado, era necesario ensayar alguna forma de cultivo que permita mantener el pH del medio en niveles constantes, como podría ser la adición de algún sistema buffer más eficiente para que actúe tamponando el pH de cultivo en condiciones ácidas [27; 29]. Así mismo, sería importante además realizar las extracciones de las alícuotas de sobrenadante de cultivo a intervalos más pequeños para poder observar realmente la dinámica enzimática y llegar a estandarizar el día de máxima secreción para EGs en las cepas estudiadas.
En el experimento N° 2, diseñado en función a los resultados obtenidos en el experimento N° 1, como forma de inóculo se utilizó una suspensión de esporas y un sistema de tamponado basado en el buffer succinato de sodio pH 4,8 100 mM para mantener el cultivo en condiciones ácidas. Este diseño permitió observar valores de actividad enzimática EGs similares entre los duplicados de cada cepa y adecuados entre las diferentes cepas ensayadas. Así mismo, fue posible inferir con este experimento que el primer pico de mayor actividad para EGs se produce al 4to día de cultivo, mostrando diferencias significativas con el resto de los días (p<0,001) (Figura 2). El comportamiento zigzagueante observado para EGs puede ser explicado debido a que esta enzima forma parte del complejo "celulasas" donde actúa de manera sinérgica con las demás enzimas del mismo, para poder hidrolizar completamente los componentes celulolíticos en azúcares simples fermentables [30; 31; 32].
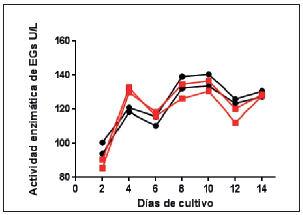
Figura 2: Cinética de la secreción de EGs por las cepas NAN-11 (■) y PROF-2 (●) cultivadas en las condiciones del experimento N°2 (medio Mandels con CMC 0,5% (p/v), pH ajustado mediante buffer succinato de sodio pH 4,8 100 mM e incubación a 29 °C con luz continua) en dos experimentos independientes. Se grafican los valores de actividad enzimática EGs en U/L en función de los días de cultivo.
La adición de buffer succinato de sodio pH 4,8 100 mM al medio de cultivo permitió mantener el pH del medio en condiciones ácidas durante el periodo de incubación correspondiente (Tabla 3).
Tabla 3: Registro de pH en las condiciones del experimento N° 2.

Por tanto, de los resultados obtenidos del experimento N° 2 se pudo concluir que la utilización de una suspensión de esporas como forma de inóculo y el agregado de buffer succinato de sodio pH 4,8 100 mM al medio de cultivo, fueron variantes ventajosas para estandarizar la secreción enzimática de las cepas de Trichoderma analizadas.
La determinación del pico de máxima actividad combinado al menor tiempo de incubación permite que el ensayo de selección (screening) pueda ser realizado de una manera rápida, lográndose obtener resultados fiables en corto tiempo [10; 11; 19; 20; 24]. Por esta razón, y en función de los resultados obtenidos en los experimentos anteriores, se analizó la secreción de EGs de las cepas en estudio a través del tiempo, siguiendo las condiciones del experimento N°2.
Los resultados obtenidos (Figura 3) indican que el día de mayor actividad enzimática para EGs corresponde al 4to día de cultivo; por tal motivo posteriormente se decidió ensayar y determinar las mismas condiciones hasta el 5to día de cultivo.

Figura 3: Cinética enzimática EGs por las cepas NAN-11 (■) y PROF-2 (●) cultivadas en las condiciones del experimento 2 (medio Mandels con CMC 0,5% (p/v) y pH ajustado mediante buffer succinato de sodio pH 4,8 100 mM e incubación a 29°C con luz continua). Se muestra el promedio de dos experimentos independientes. Se grafican los valores de actividad enzimática media de EGs en U/L en función de los días de cultivo. Las barras verticales continuas corresponden al desvió estándar entre los valores.
El presente trabajo permitió establecer que la inoculación en forma de suspensión de esporas y el tamponado del medio con buffer succinato de sodio pH 4,8 representan las condiciones de cultivo en medio líquido más adecuadas para la secreción de EGs por cepas de T. harzianum y T. koningiopsis.
1. Infante, D.; Martinez, B.; González, N. y Reyes, Y. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Rev. Prot. Vegetal. 24: 14-21, 2009. [ Links ]
2. Griffin, D. Fungal physiology. 2nd Edition John Wiley y Sons, New York. 1994. [ Links ]
3. Kubicek-Pranz, E. Nutrition, cellular structure and basic metabolic pathways in Trichoderma and Gliocladium. En: Kubicek C.P. y Harman G.E. (Eds). Trichoderma and Gliocladium: Basic Biology, Taxonomy and Genetics. Taylor y Francis, London, p. 95-119, 1998. [ Links ]
4. Schuster, A. y Schmoll, M. Biology and biotechnology of Trichoderma. Appl. Microbiol. Biotechnol. 87: 787-799, 2010. [ Links ]
5. Macarron Larumbe, R. Purificación y caracterización de endoglucanasa III de Trichoderma ressei (Tesis doctoral). Departamento de Bioquímica y Biología molecular. Facultad de Ciencias Biológicas. Universidad Complutense de Madrid. P. 203, 1992. [ Links ]
6. Vilches Paz, L. Determinación de la actividad de endoglucanasas de cepas fúngicas nativas de las provincias de Huaylas y Huaraz (Tesis de grado). Departamento Microbiología y Parasitología. Facultad Ciencias Biológicas. Universidad Nacional Mayor San Marcos. p.153, 2002. [ Links ]
7. Jahangeer, S.; Khan, N.; Jahangeer, S.; Sohail, M.; Shahzad, S.; Ahmad, A. y Khan, S. A. Screening and characterization of fungal cellulases isolated from the native environmental sourse. Pakistan J. Bot. 37: 739-748, 2005. [ Links ]
8. Venegas, J. y Suárez, D. Screening para el aislamiento y caracterización de microorganismos y enzimas potencialmente útiles para la degradación de celulosas y hemicelulosas. Rev. Colomb. Biotecnología. 6: 58-71, 2004. [ Links ]
9. Miller, G. Use of Dinitrosalicylic Acid Reagent for Determination of Reducing Sugar. Anal. Chem. 31: 426-428, 1959. [ Links ]
10. Sazci, A.; Radford, A. y Erenlerr, K. Detection of cellulolytic fungi by using Congo red as an indicator: a comparative study with the dinitrosalicyclic acid reagent method. J. Appl. Bacteriol. 61: 559-562, 1986. [ Links ]
11. Doolotkeldieva, T. y Bobusheva, S. Screening of Wild-Type Fungal Isolates for Cellulolytic Activity. Microbiol. Insights. 4: 1-10, 2011. [ Links ]
12. Mandels, M. y Reese, E.T. Induction of cellulase in Trichoderma viride as influenced by carbon source and metals. J. Bacteriol. 73: 269-278, 1957. [ Links ]
13. Mandels, M. Microbial sources of cellulose. Biotechnol. Bioeng. Symp. 5: 81-105, 1975. [ Links ]
14. Guerra, G.; Casado, M.R.L.G.; Arguelles, J.; Sanchez, M.I.; Manzano, A.M. y Guzman T. Cellulase production with sugarcane straw by Trichoderma viride on solid bed. Sugar Technol. 8: 30-35, 2006. [ Links ]
15. Mandels, M.; Andreotti, R. y Roche, C. Measurement of saccharifying cellulase. Biotechnol. Bioeng Symp. 6: 21-33, 1976. [ Links ]
16. Hankin, L. y Anagnostakis, S. Solid media containing Carboxy methyl cellulose to detect cellulase activity of Microorganisms. J. Gen. Microbiol. 98: 109-115, 1977. [ Links ]
17. Smith, R. Rapid tube test for detecting fungal cellulase production. Appl. Environ. Microbiol. 33: 980-981, 1977. [ Links ]
18. Mahasneh, A.M. y Stewart, D.J.A. Medium for detecting B-(1-3) glucanase activity in Bacteria. J. Appl. Microbiol. 3: 457-458, 1980. [ Links ]
19. Magnelli, P.; Martinez, A. y Mercuri, O. Método simple para determinar actividad celulolítica en hongos. Rev. Argent. Microbiol. 29: 210-214, 1997. [ Links ]
20. Yoon, J. y Kim, Y. Degradation of crystalline cellulose by the brown-rot basidiomycete Fomitopsis palustris. J. Microbiol. 43: 487-492, 2005. [ Links ]
21. Kasana, R.C.; Salwan, R.; Dhar, H.; Dutt, S. y Gulati, A. A rapid and easy method for detection of microbial cellulases on agar plates using Gram's iodine. Curr. Microbiol. 57: 503-507, 2008. [ Links ]
22. Wood T. Preparation of crystalline, amorphous and dyed cellulase substrate. Methods Enzymol. 160: 19- 45, 1988. [ Links ]
23. Andersen, N.; Johansen, K.; Michelsen, M.; Stenby, E.; Krogh, K. y Olsson, M. Hydrolysis of cellulose using mono-component enzymes shows synergy during hydrolysis of phosphoric acid swollen cellulose (PASC), but competition on Avicel. Enzym. Microb. Technol. 42: 362- 370, 2008. [ Links ]
24. Dashtban, M.; Maki, M.; Leung, K.; Canquan, M. y Wensheng, Q. Cellulase activities in biomass conversion: measurement methods and comparison. Crit. Rev. Biotechnol. 30: 302-309, 2010. [ Links ]
25. Jurick, W.M.; Vico, I.; Whitaker, B.D.; Gaskins, V.L. y Janisiewicz, W.J. Application of the 2-Cyanocetamide Method for Spectrophotometric Assay of Cellulase Enzyme Activity. Plant Pathol. J. 11: 38-42, 2012. [ Links ]
26. Alves, R. y Faria, M. Pequeno manual sobre fungos entomopatogenicos. Empresa Brasileira de Pesquisa Agropecuária. Embrapa Cerrados Ministério da Agricultura, Pecuária e Abastecimento. 2010. [ Links ]
27. Ferreira, S.M.P.; Duarte, A.P.; Queiroz, J.A. y Domingues, F.C. Influence of buffer systems on Trichoderma reesei Rut C-30 morphology and cellulase production. Electronic J. Biotechnol. 12: 1-9, 2009. [ Links ]
28. Domingues, F.; Queiroz, J.; Cabral, J. y Fonseca, L. The influence of culture conditions on mycelial structure and cellulose production by Trichoderma reesei Rut C-30. Enzym. Microb. Technol. 26: 394- 401, 2000. [ Links ]
29. Dhiman, S.; Sharma, J. y Battan, B. Industrial applications and future prospects of microbial xylanases: a review. BioRes. 3: 1377-1402, 2008. [ Links ]
30. Montenecourt, B. y Eveleigh, O. Production and characterization of high yielding cellulose mutants from Trichoderma reesei. TAPPI J. 28: 101-108, 1979. [ Links ]
31. Gómez, F. Métodos secuenciales de pretratamiento químico y enzimático de residuos agrícolas para la producción de metano (Tesis de grado). Instituto Potosino de Investigación Científica y Tecnológica. San Luis de Potosí, México. p. 78, 2008. [ Links ]
32. Sanchez, C. Lignocellulosic residues: biodegradation and bioconversion by fungi. Biotechnol. Adv. 27: 185- 194, 2009. [ Links ]
Recibido: 20/06/2013
Aprobado: 28/11/2013














