Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.27 Posadas jun. 2017
INGENIERÍA, TECNOLOGÍA E INFORMÁTICA
Desarrollo de un prototipo sensor de biomasa basado en algoritmos de procesamiento de imagen
Development of a biomass sensor prototype based in image processing algorithms
Carolina S. Díaz1,*, Jorge H. Barón2
1 CONICET. Facultad de Ingeniería. Universidad Nacional de Cuyo. Centro Universitario Edifico 6, M5502KAF, Mendoza. Argentina.
2 Facultad de Ingeniería. Universidad Nacional de Cuyo. Centro Universitario Edifico 6, M5502KAF, Mendoza. Argentina.
* E-mail: carodiazb78@gmail.com
Resumen
Este trabajo muestra las evaluaciones iniciales para el desarrollo de un prototipo de sensor portátil de biomasa, basado en el procesamiento de imágenes digitales. Fundamentado en la variación del color que se observa durante el desarrollo del cultivo de microalgas. Esta diferenciación del color se debe principalmente a la variación en la composición del cultivo, a medida que las microalgas van creciendo y capturando la energía solar, esto se relaciona directamente con el crecimiento y la producción de biomasa microalgal. La variación del color es evaluada usando tres colores (rojo, verde y azul), utilizando un algoritmo basado en el modelo de color RGB. Este algoritmo busca extraer las variables que determinan las características del cultivo. Lo que permite fundamentar las bases y el desarrollo de un prototipo de sensor de biomasa que permita estimar la producción de biomasa y las distintas fases de cultivo basado en visión.
Palabras clave: Microalgas; Procesamiento de Imágenes; Modelo RGB; Biomasa.
Abstract
The initial concerns of a new biomass prototype portable sensor, using digital image processing are shown in this paper. It is based on the color variation that is observed during the cultivation of the microalgae culture. This color differentiation is mainly due to the variation in the composition of the culture, as microalgae grow and capture solar energy; this is directly related to the growth and production of microalgae biomass. The color variation is evaluated using three primary colors (red, green and blue) using an algorithm based on the RGB model. This algorithm seeks to extract the variables which determine the characteristics of the culture. This allows establishing the basis and the development of a biomass sensor prototype that allows estimating the production of biomass and the different phases of culture based on vision.
Keywords: Microalgae; Image Processing; RGB model; Biomass.
Introducción
Dentro de este equipo de trabajo una de la línea de investigación prioritaria que se viene desarrollando es el cultivo de microalagas en condiciones no estériles para cultivos abiertos, donde la variable principal que determina la productividad del proceso es la biomasa [1]. En el mercado actual existen sensores que permiten medir esta variable, pero en su mayoría están pensados para características de biorreactores cerrados, con todas sus variables externas e internas controladas y dentro de un rango específico, que además son de alto valor económico y en su mayoría no son portables [2].
Con este objetivo global en mente se analizaron las distintas alternativas para el desarrollo inicial del sensor que entregara una medida cualitativa del cultivo en forma rápida y eficaz, y el estado del mismo, crecimiento, decrecimiento, punto óptimo de la curva, momento de repique o de inicio de cultivo continuo. Basándonos en el color que es una de las características principales que otorga información del estado del cultivo, se buscó mediante procesamiento de imágenes cuantificar con una medida esta característica, establecer una relación con la fase de crecimiento y etapa del cultivo. Las microalgas y particularmente la chlorella sp, son organismos que capturan eficientemente la luz solar, al ocurrir esto la composición, principalmente de clorofila, va cambiando y el cultivo se torna de un color verde más intenso. Como ya es bien sabido la eficiencia fotosintética está relacionada con el crecimiento celular y la biomasa microalgal obtenida como se fundamenta en las referencias bibliográficas [3]; [4]; [5]; [6] entre otros.
En este trabajo se presenta un método basado en el procesamiento de imágenes para extraer un valor en relación a la intensidad de los tres colores primarios presentes en cada muestra para un cultivo de chlorella sp. Esta especie de microalga es conocida para la producción de biodiesel dado su alto coeficiente fotosintético y acumulación de lípidos [7]. La variación del color ha sido estudiada e investigada previamente [8]; [9] debido a la variación en la composición bioquímica del cultivo [10], esta variación se puede medir utilizando colorimetría [11], [12], [13].
Metodología
La metodología usada es la extracción de muestras fotográficas en las diferentes fases de cultivos para aislarla de las condiciones lumínicas externas e internas se construye un dispositivo tipo cámara oscura [14]. El método consiste en una caja oscura de dimensiones 35cmx20cmx20cm, pintado su interior de color negro para evitar reflejos, se coloca una fuente constante de 12 Volts para alimentar la fuente de luz incandescente de 60Watts con, con un circuito estabilizador de tensión. Se coloca además un filtro para que la luz sea homogénea y difusa. Las muestras se colocan en un vaso de precipitado de marca BT®GC-I7, se colocan en envases idénticos todas las muestras para que tengan las mismas características de vidrio, grosor y por lo tanto de imagen reflejada. La cámara utilizada es una cámara digital Cannon Power Shot 610® de 14,7 Mpixels, está es colocada dentro de la cámara oscura a una distancia focal de 0,28 cm de la muestra (Figura 1).

Figura 1: Esquema del dispositivo desarrollado.
Luego de varias pruebas las condiciones seleccionadas para tomar la imagen de cada muestra son las siguientes: Modo P: Programable, ISO = 400, Punto Focal = 2,8 mm, Tiempo de Exposición = 1/50 segundos, AF modo evolutiva continuo, Flash apagado. Se realizan pruebas con las imágenes teniendo en cuenta los distintos modelos de color. Para este prototipo luego de ensayos se utiliza el modelo RGB que se basa se en las componentes de los tres colores primarios ROJO, VERDE y AZUL para formar cada color. La imagen RGB se representa como un grupo de tres matrices para el software de procesamiento de imagen utilizado MATLAB®, cada matriz representa un plano con las componentes para cada color RED, GREEN y BLUE. En este modelo de color cada pixel de la imagen es representado por una composición aditiva de los tres colores primarios rojo, verde y azul, el número de colores que puede representar cada pixel está determinado por el número de bits usados para representar cada elemento RGB. En este caso se usan 8 bits por cada color primario esto se denomina el tipo de dato unit8. Teniendo en cuenta la representación de una imagen en MATLAB® [11], son tres planos, uno para cada color primario, según el esquema mostrado a continuación en de la Figura 2.

Figura 2: Representación de una imagen RGB en MATLAB®.
Se procesan las imágenes siguiendo el diagrama de flujo del algoritmo desarrollado mostrado en el siguiente esquema para imágenes en RGB (Figura 3).

Figura 3: Diagrama de flujo procesamiento imagen.
Se lee la imagen obtenida para cada muestra, la imagen del tipo RGB es representada cada plano RED GREEN y BLUE por una matriz de mxn elementos para este caso es el tamaño de la región de interés o ROI se define de 150x75 pixeles. Se separan los tres planos y se trabaja con el plano GREEN una vez que la imagen ha sido homogeneizada. A este plano se le aplican filtros morfológicos y de mediana que entrega como resultado una matriz de valores. Luego procesando esta matriz se obtiene un valor que será proporcional a la biomasa obtenida.
Resultados y Discusión
Se realizaron pruebas experimentales con muestras diluidas de un inoculo cultivado de Chlorrella sp a lo largo de 12 días, partió con el 20% Inoculo, 10% BBM (Bold Basal Medium), 70% Agua. Se tomaron 5 muestras diluidas 1/5, 2/5, 3/5, 4/5, 5/5, más una con agua pura para establecer como referencia. Las imágenes procesadas se muestran en la Figura 4 y los resultados obtenidos para cada muestra se observan en la Tabla 1.

Figura 4: Imágenes tomadas para las diferentes muestras.
Tabla 1: Tabla de resultados
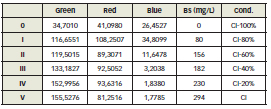
Los valores mostrados de biomasa en la Tabla 1 son obtenidos mediante centrifugado, secado y pesado de las muestras. Graficando los resultados se muestran las siguientes líneas de tendencias en las Figuras 5 y 6 para este ensayo:

Figura 5: Grafica Biomasa vs RED, GREEN y BLUE.
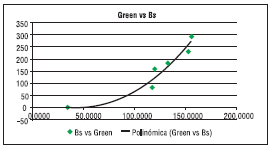
Figura 6: Gráfica valor GREEN vs biomasa.
Según la ecuación obtenida y teniendo en cuenta los valores de GREEN y biomasa que, como se observa, tienen un alto coeficiente de relación cercano a uno, de donde se infiere que lo componente de mayor peso para el desarrollo del algoritmo es la variable GREEN. Se desarrolla ensayo cultivando chlorella durante 24 días en condiciones no estériles en frascos de volumen final 4 litros. Se parte de una concentración inicial de 20% inóculo, 10% BBM, 70% agua. Fotoperiodos de iluminación 12 hs. – 12 hs., inyección de CO2 a demanda según variación de pH. Los resultados obtenidos se muestran en la Tabla 3.
Tabla 2: Ensayo curva de crecimiento.

Se grafican los resultados obtenidos y se muestran en las figuras 6 y 7. Como se puede observar la relación entre la biomasa contenida en el cultivo y el valor GREEN se mantiene directamente proporcional hasta el día diez de cultivo, a partir de ahí el algoritmo utilizará las componentes de los valores RED y BLUE haciendo un análisis multivariable basado en el historial de ensayos del grupo para estimar el valor aproximado de biomasa. Se puede observar que cuando los valores GREEN, RED y BLUE convergen a un valor bajo menor de 50, se considera que el cultivo ha entrado en fase de decrecimiento y muerte. Observando los valores de RGB el algoritmo permite estimar en qué fase de la curva de crecimiento está el cultivo, exponencial, lineal o de decrecimiento y muerte. Lo que permite tomar decisiones de repique o cosecha en el momento óptimo.
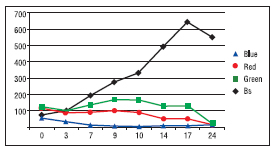
Figura 7: Biomasa y valores RGB en función de días de cultivo.

Figura 8: Valores RGB en función de días de cultivo.
Conclusiones
En las pruebas realizadas, observando las gráficas y los resultados obtenidos, se puede establecer la relación entre el color y la biomasa contenida en el cultivo. Esto permite definir y actuar según las fases principales de crecimiento de las microalgas, debido a la variación de las características del cultivo a medida que van desarrollándose. Los resultados alcanzados en las primeras pruebas experimentales muestran una relación directa: entre el valor obtenido al procesar la imagen y la biomasa contenida en el cultivo, comparada con el procedimiento de peso seco. El espectro de colores en las distintas fases de desarrollo del cultivo se puede diferenciar detectar y cuantificar. Los valores de RED GREEN y BLUE, como se observa en la Figura 5 y 6, convergen a cero cuando las microalgas alcanzan su máximo valor de saturación, brillo e intensidad de color y comienza la fase de muerte. En las fases de crecimiento exponencial el valor de GREEN aumenta proporcionalmente. Determinar estos puntos para cada cultivo es de alta importancia, ya que permite trabajar en la zona de máximo rendimiento, evitando la fase de muerte para obtener mayor productividad. Este desarrollo resulta muy atractivo para implementar en la industria del biodiesel, dado su bajo coste económico, portabilidad, y que permite obtener una característica cualitativa del cultivo en sus diferentes fases, proporcionando mayor rentabilidad a todo el proceso.
1. Rodolfi, L.; Zittelli, G.; Bassi, N.; Padovani, G.; Biondi, N.; Bonini, G.; Tredici, M. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor. Biotechnoogy Bioengeniering. Volume 102, pp. 100–112. 2009
2. Havlik, I.; Linder, P.; Scheper, T.; Reardon, K. On-line monitoring of large cultivations of microalgae and cyanobacteria. Trends of Biothecnology. Volume 31, Issue 7, pp 406–414, Elsevier 2014.
3. MacIntyre, HL.; Kana, TM.; Anning, T.; Geider, RJ. Photoaccclimation of photosynthesis irradiance response curves and photosynthetic pigment in microalgae and cyanobacteria. Journal of Phycology. Volume 38 Issue 1, pp. 17-38. 2002. [ Links ]
4. Silva, J.; Santos R.; Serodio J.; Melo R. Light response curves for Gelidium sesquipedale from different depths, determined by two methods: O2 evolution and chlorophyll fluorescence. Journal of Applied Phycology. Volume 10, Issue 3, pp 295-301, Springer Editoral 1998. [ Links ]
5. Masojidek, J.; Torzillo, G.; Kopecky, J.; Koblizek, M.; Nidiaci, L.; Komenda, J.; Lukavska, A.; Sacchi, A. Changes in chlorophyll fluoresence quenching and pigment composition in the green alga Chlorococcum s. grown under nitrogen deficience and salinity stress. Journal of Applied Phycology Volume 12, pp 417-426. Springter Editorial 2000. [ Links ]
6. Tremblin, G.; Cannuel, R.; Mouget, JL.; Rech, M. Change in light quality due to a blue-green pigment, marennine, released in oyster-ponds: effect on growth and photosynthesis in two diatoms, Haslea ostrearia and Skeletonema costatum. Journal of Applied Phycology. Volume 12, Issue 6, pp 557-566. Springer 2000. [ Links ]
7. Y. Chisti. Biodiesel from microalgae. Biotechnol. Adv., Volume 25, pp. 294–306.2007.
8. Chia-Hung, Su.; Chun-Chong, Fu.; Yet-Chung, Chang; Giridhar, R. Nair; Jun-Liang, Ye; Ming, Chu y Wen-Teng, Wu. Simultaneous estimation of chlorophyll a and lipid contents in microalgae by three-color analysis. Biotechnology and BioengineeringVolume 99, Issue 4, pages 1034– 1039, 1 March 2008.
9. Carvalho, JCM; Fransisco, FR.; Almeida, KA.; Sato, S.; Converti, A. Cultivation of Arthrospira (spirulina) platensis (Cyanophyceae) by fed-batch addition of ammonium chloride at exponentially increasing feeding rates. Journal of Phycology. Volume 40, pp 587-597. Springer 2004. [ Links ]
10. Lopez, MCGM.; Sanchez, ED.; Lopez, JLC.; Fernandez, FGA.; Sevilla, JMF.; Rivas, J.; Guerrero, MG.; Grima, EM. Comparative analysis of the outdoor culture of Haematococous pluvialis in a tubular and bubble column photobioreacttors. Journal of Biotechnology. Volume 123, pp. 329-342. Elsevier 2006. [ Links ]
11. Mohammad, H.; Hyun-Joon, La.; Jae-Yon, Lee; Dae-Hyun, Cho; Sang-Yoon, Shin; Woo-Jin, Kim; Hee-Mock, Oh. Biomass quantification by digital image processing and RGB color analysis. Journal of Applied Phycology. Volume 27, Issue 1, pp 205-209. Springer 2014. [ Links ]
12. Kumar, K.; Sirasale, A.; Das, D. Use of image analysis tool for the development of light distribution pattern inside the photobioreactor for the algal cultivation. Bioresour. Technol., Volume 143, pp. 88–9. Elsevier 2013.
13. Murphy, TE.; Macon, K.; Berberoglu, H. Rapid algal culture diagnostics for open ponds using multispectral image analysis. Biotechnology Progress Volume 30, Issue 1, pp. 233-24, American Institute of Chemical Engineers 2014. [ Links ]
14. Miguel V. Córdoba-Matson, Joaquín Gutiérrez, Miguel Ángel Porta-Gándara. "Evaluation of Isochrysis galbana (clone T-ISO) cell numbers by digital image analysis of color intensity". Journal of Applied Phycology. Volume 22, Issue 4, pp. 427-434, Springer 2010. [ Links ]
Recibido: 06/10/2016.
Aprobado: 20/03/2016.














