Introducción
Numerosos procesos industriales demandan energía térmica en el rango de 80-240ºC [1]. En Sharma et al. (2017) [2], se recopiló información sobre el desarrollo de sistemas de calefacción de procesos industriales mediante energía solar. Países como India, China, Estados Unidos, Alemania, emplean sistemas de energía térmica en industrias agropecuarios, alimenticias, textil, entre otras [3]. Estos sistemas no son tenidos en cuenta en la industria minera ya que se requieren elevadas temperaturas de procesamiento [3].
Argentina es uno de los pocos países que dispone de variados yacimientos de boratos: los denominados “duros” (tincal, colemanita, hidroboracita), así como boratos contenidos en la costra de los salares (ulexita) o disueltos en la salmuera impregnante. Es la tercera exportadora mundial de productos del boro.
El procesamiento de los boratos depende de las propiedades y de la pureza deseada en el producto final. En sentido creciente de valor los principales productos del boro son: mineral sin procesar, concentrados, calcinados, fritas, refinados y BAVA (Boratos de Alto Valor Agregado). Dado el elevado contenido de agua de hidratación de los boratos, la calcinación se muestra como una interesante alternativa para elevar la ley (contenido en B2O3) de minerales o de sus concentrados.
La calcinación consiste en una descomposición térmica del borato, que elimina su agua de hidratación incrementando apreciablemente el contenido de B2O3. Es un proceso que se realiza a relativamente baja temperatura [4]. Los tratamientos pirometalúrgicos de calcinación y de anhidración poseen además una importante ventaja adicional: disminuye el costo de transporte, ítem de suma importancia para los boratos, cuyos yacimientos están generalmente ubicados lejos de los puertos y muy lejos de los mercados, afectando fuertemente la competitividad del sector.
En el caso de la colemanita (borato de calcio), su calcinación ocurre de manera violenta: decrepita, disminuyendo notoriamente su tamaño de partícula hasta tamaño de polvo; simultáneamente también ocurre una disminución de su peso específico, desde 2,4 a 1,9 [5].
La descomposición térmica ocurre alrededor de los 300-450ºC [5, 6, 7]. Como la ganga permanece inalterada tanto en tamaño como en peso específico, ocurre un incremento en la diferencia de esas propiedades que mejora las condiciones de concentración respecto de la carga sin calcinar. Celik y Cakal [5] y Şenol-Arslan et al. [8] estudiaron cómo varían las propiedades físicas con el tratamiento térmico de muestras de colemanita provenientes de diversos yacimientos de Turquía. Can et al. [9] realizaron la calcinación de colemanita empleando un horno de microondas doméstico. Encontraron que el método es ventajoso en cuanto al tiempo de procesamiento (10 minutos para alcanzar 450ºC) y por una reducción de 100ºC en la temperatura de transición de la colemanita a colemanita amorfa.
En Argentina, los yacimientos de boratos se localizan en la región de la Puna, a más de 3000 metros sobre el nivel del mar. Esta región se caracteriza por tener condiciones climáticas extremas, altos gradientes térmicos entre el día y la noche, sol diáfano y escasas precipitaciones durante el año. La probabilidad de días soleados en el invierno es de 85%.
La irradiación (o insolación) es la cantidad de radiación global recibida en un punto geográfico durante un tiempo determinado y sobre una superficie conocida (kWh/m2) y la irradiancia es la magnitud utilizada para describir la potencia incidente sobre unidad de superficie de todo tipo de radiación electromagnética (W/m2). En la región la irradiación varía desde 5,5 a 7,5 kWh/m2 en enero, mientras que en junio lo hace entre 4,5 y 5,5 kWh/m2; en los mismos meses la heliofanía varía, en promedio, entre 8-9 horas [10]. En Salta, en días soleados la irradiancia es de 900 W/m2 [11].
No existen antecedentes en nuestro país del uso de energía no convencional en procesos pirometalúrgicos, sin embargo las condiciones climáticas en la Puna hacen suponer que es factible el uso de la energía solar para llevar a cabo procesos térmicos de relativamente baja temperatura, como en el beneficio de los boratos. En este trabajo se analiza la factibilidad de realizar la calcinación de colemanita (borato de calcio) empleando un concentrador parabólico solar.
Materiales y Métodos
Para la calcinación se empleó un concentrador solar parabólico de 172 cm de diámetro y profundidad de foco (distancia focal) de 40 cm, con un ángulo de inclinación de 30º.
Las muestras de colemanita empleadas tenían 35,58% B2O3,19,09 %CaO y el 45,33% restante corresponde a insolubles tales como sílice. La colemanita pura contiene 50,81% B2O3 por lo que las muestras empleadas tenían una pureza del 70%. Las muestras de tamaño entre 8-10 M (2,38-2mm) y se calcinaron entre 60 y 120 minutos. Durante el proceso de deshidratación las partículas decrepitan reduciéndose su tamaño, en consecuencia luego de los ensayos las partículas tenían un tamaño <20M (<0,84 mm). Las muestras se pesaron antes y después de cada ensayo para determinar la pérdida de peso. Se registró la temperatura a cada instante de tiempo mediante dos termocuplas ubicadas a dos alturas diferentes separadas 7 mm. Se realizaron además ensayos para determinar el avance de la reacción en función del tiempo. Para ello se emplearon muestras cuya masa se informa en la Tabla 2 y se repitieron los mismos a distintos tiempos entre 3 minutos y una hora. Se analizó el contenido de B2O3 antes y después de la calcinación mediante análisis químico por titulación con Na(OH) [4].
Para determinar la energía radiante incidente en la muestra (qri) se realizaron ensayos de vaporización de agua. Para ello se colocó en el foco del concentrador un recipiente con agua a vaporizar. Los ensayos se realizaron empleando recipientes de vidrio, hierro fundido y acero ya que qri depende de las propiedades ópticas del material que recibe la radiación.
La temperatura se registró a distintos tiempos. Los ensayos se realizaron a las 9 de la mañana y tuvieron una duración de una hora. En todos los ensayos el concentrador se ubicó de cara al Este, se considera que en una hora no hay variación en el ángulo de incidencia de la radiación sobre el recipiente portamuestra ya que la pantalla se ajustaba en cada instante de tiempo manualmente para mantener el foco centrado.
El calor útil se define, como la diferencia entre el calor interceptado por el portamuestra y las pérdidas por radiación y convección, de acuerdo a la ecuación 1.
Para determinar el calor interceptado (Qri) se vaporizó una cierta cantidad de agua contenida en distintos recipientes: de vidrio (diámetro 18 cm), de acero inoxidable (diámetro 10 cm) y de hierro fundido (diámetro 24 cm). Como se conoce la cantidad de agua evaporada y el calor latente de vaporización a presión atmosférica, el calor incidente se calculó con la ecuación 5.
Siendo t el tiempo de exposición expresado en horas.
Resultados y Discusión
En la Tabla 1 se presentan los resultados de flujo de calor y densidad de flujo de calor interceptado así como también los parámetros del concentrador solar. La relación qri/Ib es una medida de cuánto concentra el equipo la radiación solar.
El calor interceptado depende de las propiedades del recipiente, en la Tabla 1 se observa que tanto el cristalizador de vidrio como el recipiente de hierro fundido tienen densidad de calor interceptado cercano a 7600 kcal/h m2. Los ensayos empleando el mismo recipiente de acero inoxidable se llevaron a cabo en distintos días por lo que los valores de la densidad de calor incidente (qri) varían entre ensayos. Comparándolo con los demás recipientes, el de acero inoxidable tiene una densidad mayor, alcanzando valores promedio de 13.000 kcal/h m2. La diferencia se debe a las pérdidas por radiación y convección en cada caso, según se observa en la ecuación 1. Por este motivo los ensayos de calcinación de colemanita se llevaron a cabo empleando los recipientes de acero inoxidable.
En la Figuras 1a y 1b se observa la variación de temperatura superior e inferior, medidas con dos termocuplas separadas 7 mm. La termocupla superior se ubicó debajo de una capa de 3 mm de mineral. Las figuras corresponden a los Ensayos 1 y 3 respectivamente (ver Tabla 2). En ambos ensayos se alcanza la temperatura necesaria para producir la decrepitación de la colemanita. La diferencia de temperaturas entre las termocuplas ((T), considerando la distancia entre ellas (7 mm), indicaría una baja transmisión de calor en el sentido vertical, por lo que se podría asumir el fenómeno como un proceso superficial que no se propaga hacia el interior de la muestra. El descenso brusco de las temperaturas en la Figura 1a se debió a la presencia de nubosidad.
Se observa que en ensayos desarrollados en condiciones operativas similares, se alcanzan temperaturas muy diferentes. Esto es debido a que las condiciones ambientales no se mantienen constantes, y a que el movimiento de la pantalla para mantener el foco centrado se realizó manualmente.

Figura 1: a. Evolución de la temperatura durante la calcinación (Ensayo 1). Figura 1b. Evolución de la temperatura durante la calcinación (Ensayo 3).
En Tabla 2 se muestran los resultados de tres ensayos de calcinación realizados en tiempos suficientemente largos tal que se supone que se alcanza el máximo avance posible de la reacción para las condiciones operativas empleadas.
La ley de B2O3 creció de 35,58% en la alimentación a un 44,3-46,6 % en la fracción <20M con un grado de avance entre 50-67 %. La fracción >20M aumenta levemente el contenido de B2O3 pero es una fracción que además de ganga, también posee colemanita sin reaccionar. En el Ensayo 1 las temperaturas alcanzadas durante el tiempo de reacción máximo ensayado (120 minutos) ≈ 600ºC son del orden de las temperaturas alcanzadas en los hornos tradicionales. Esta temperatura, aún cuando se mantuvo durante aproximadamente 60 minutos no fue suficiente para alcanzar la conversión deseada. Por otro lado, la colemanita comienza a fundir a 1.015ºC por lo que no ocurrieron reacciones secundarias durante el ensayo. A pesar de haber permanecido tiempo suficiente no se alcanzan valores de conversión muy elevados. Esto demuestra que la reacción ocurre en la superficie expuesta a la radiación y que el mineral sin reaccionar de las capas inferiores ofrece una alta resistencia a la transferencia de calor, lo mismo se aprecia con la diferencia de temperaturas entre las termocuplas ubicadas a una distancia de 7 mm entre sí.
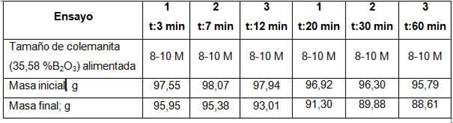
Se realizaron también seis calcinaciones para analizar la influencia del tiempo a 3, 7, 10, 20, 30 y 60 minutos. En la Tabla 3 se muestran las masas iniciales y finales mientras que en la Figura 2 muestra la influencia del tiempo sobre la pérdida de peso, el grado de avance y la recuperación de B2O3 en la fracción fina (<20M).
Los resultados obtenidos son comparables con aquellos que se muestran en la Tabla 1. La máxima velocidad de cambio de las tres variables estudiadas ocurre durante los primeros 10 minutos de calcinación. Esto también demuestra la dificultad en la transferencia de calor hacia el interior de la muestra.
Conclusiones
Es factible calcinar colemanita empleando un concentrador solar. Dependiendo de las condiciones climáticas se obtuvo una conversión entre 45-72%. El calentamiento ocurre en la superficie y la temperatura no se transmite fácilmente hacia el seno del lecho mineral. La irradiancia media anual de la Puna es más que suficiente para alcanzar las temperaturas de decrepitación de la colemanita; ésto, sumado a que la mayoría de las empresas borateras realizan la calcinación en plantas cercanas a los yacimientos hace que el proceso de calcinación pueda llevarse a cabo durante todo el año. El proceso será discontinuo y se recomienda trabajar durante las 9 horas de heliofanía de la región.
Para mejorar la transferencia, y en consecuencia la conversión, se debe diseñar un sistema un sistema dinámico que permita que la totalidad de las partículas se encuentren expuestas a la radiación. Los resultados alientan a continuar con la investigación orientada al diseño de un reactor experimental a escala banco-piloto que permita la obtención de índices metalúrgicos de interés industrial.