Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Salud colectiva
versión On-line ISSN 1851-8265
Salud colect. vol.11 no.1 Lanús mar. 2015
ARTÍCULOS
El uso de placebo en ensayos clínicos de fase III en Brasil
The use of placebos in phase III clinical trials in Brazil
Rubenich, Gustavo Butzge1; Heck, Stephanie Tomasi2; Hellmann, Fernando3; Schlemper Junior, Bruno Rodolfo4
1Estudiante de Medicina, Universidade do Oeste de Santa Catarina, Brasil. gustavorubenich@hotmail.com
2Estudiante de Medicina, Universidade do Oeste de Santa Catarina, Brasil. tefiheck@hotmail.com
3Naturólogo. Magíster en Salud Pública. Profesor, Universidade do Sul de Santa Catarina, Brasil. hellmann.fernando@gmail.com
4Médico. Doctor en Medicina. Profesor, Universidade do Oeste de Santa Catarina, Brasil. schlemper.junior@gmail.com
Recibido: 1 de octubre de 2014
Aprobado: 16 de diciembre de 2014
RESUMEN
El Consejo Federal de Medicina de Brasil (CFM) –órgano normativo y fiscalizador del ejercicio ético de la medicina– prohibió, en 2008, la participación de médicos brasileños en investigaciones que utilizaran placebo para enfermedades con tratamiento eficaz y efectivo, en contraposición a la Declaración de Helsinki, que permite su uso en condiciones metodológicamente justificadas. Con el objetivo de verificar si la normativa ética del CFM modificó el uso de placebo en ensayos clínicos de fase III en Brasil, se analizaron varias características de sus registros en el ClinicalTrials.gov, en los períodos de 2003 a 2007 y de 2009 a 2013. Se concluye que: a) la normativa promulgada por el CFM en 2008 fue ineficaz y prevaleció la posición adoptada por la Declaración de Helsinki; b) el patrocinio de ensayos con placebo por parte de la industria farmacéutica multinacional fue significativo; c) predominaron las investigaciones de fármacos para enfermedades crónicas, y fueron poco significativas para las enfermedades postergadas, de importancia para Brasil.
PALABRAS CLAVES Ética en Investigación; Ética Médica; Ensayo Clínico; Placebos; Declaración de Helsinki.
ABSTRACT
In 2008, Brazil’s Federal Council of Medicine [Conselho Federal de Medicina] (CFM) – regulatory and supervisory agency on the ethical practice of medicine – banned the participation of Brazilian doctors in studies using placebos for diseases with efficient and effective treatment. This position differs with the Helsinki Declaration, which allows the use of placebos in methodologically justified conditions. To ascertain whether the CMF’s ethical regulation modified the use of placebos in phase III clinical trials in Brazil, characteristics of the records in ClinicalTrials.gov were researched in the periods from 2003 to 2007 and from 2009 to 2013. The conclusions reached were: a) the regulations issued by the CFM in 2008 were ineffective and the position adopted by the Helsinki Declaration prevails; b) there was significant sponsorship by the multinational pharmaceutical industry of trials with placebos; c) the research was predominantly on new drugs for chronic diseases, with little study done of the neglected diseases which are of great importance to Brazil.
KEY WORDS Ethics, Research; Ethics, Medical; Clinical Trial; Placebos; Helsinki Declaration.
INTRODUCCIÓN
La utilización de placebo en terapia, si bien se remonta a muchos siglos atrás, cuando era usado por médicos y vendedores de medicinas, se mantuvo en los debates sobre la ética médica hasta la actualidad (1-3). A su vez, la utilización de placebo como comparador en investigaciones clínicas se inició luego de la Segunda Guerra Mundial (4). Aunque la inmoralidad de las investigaciones médicas sea anterior a los horrores de los campos de concentración nazis (5), el Tribunal Militar Internacional y el juicio a los principales criminales de guerra fueron los que dieron origen, en 1947, al primer conjunto de principios éticos internacionales para investigaciones con humanos, conocido como Código de Núremberg. En ese mismo año renacía la Asociación Médica Mundial (AMM), con el objetivo de compartir los problemas comunes de los médicos alrededor del mundo y recuperar la imagen de la medicina. En consecuencia, en 1954, en la 8a. Asamblea General, en Roma, la AMM adoptaba la “Resolution on human experimentation and the principles for those in research and experimentation”, documento precursor de la Declaración de Helsinki (6). Si bien el tema era debatido en aquella época, ninguno de estos dos documentos abordó el tema del uso de placebo en investigaciones médicas. Incluso en la 1ª Declaración de Helsinki de 1964 y en su primera revisión de 1975, el término placebo continuaba ausente, aunque en esta revisión se adoptó el término best current para el diagnóstico y los métodos de tratamiento como comparador en los estudios, que aseguraba el mejor tratamiento a todos los participantes de una investigación. Por lo tanto, si bien en esta época aún no se explicitaba el término placebo, quedaba sobrentendido que cuando existiese tratamiento conocido de la enfermedad en estudio, el uso de una substancia o un procedimiento inerte como comparador en el grupo control sería considerado una falta ética. A mediados de la década de 1970, por primera vez, Sissela Bok advierte sobre el uso engañoso del placebo en tratamientos médicos y ensayos clínicos, en los que muchas veces no se informaba al paciente sobre su uso (7). Según esta autora, además de causar riesgos no previstos usualmente, el uso de placebo contribuía a comprometer el prestigio de la institución y la pérdida de confianza en el equipo médico. A partir de esta época, por lo tanto, la discusión sobre el uso de placebo se hizo más intensa, frecuente y con nuevos parámetros de evaluación. Ya a fines de la década de 1980 e inicios de la siguiente, las denuncias de estudios con uso de placebo para enfermedades con tratamiento existente se publicaban en revistas científicas de gran prestigio (8,9), lo que llevó a la AMM a aprobar una modificación en la Declaración de Helsinki, en 1996, reafirmando que el uso de placebo solo sería ético cuando no existiese tratamiento conocido.
En octubre de 2000, la 52a Asamblea General de la AMM, realizada en Edimburgo, Escocia, adoptó la 5ª revisión de la Declaración de Helsinki que afirmaba que el uso de placebo en el grupo control era ético solo en los casos en los que no existieran intervenciones comprobadas. El texto aprobado en esa ocasión generó controversias en todo el mundo, hasta el punto de que, en 2002, la AMM intentó aclarar las dudas sobre el uso de placebo, como puede leerse en el párrafo 29 de aquella revisión. Fue entonces, en la 53a Asamblea General realizada en Washington, que se amplió el uso de placebo en el grupo control de los ensayos clínicos, permitiéndose su uso incluso para enfermedades con tratamiento reconocido, en situaciones en las que existieran razones científicamente válidas o cuando no implicaran riesgos serios o daños irreversibles para los pacientes. Sin embargo, la publicación de la nota aclaratoria, en vez de esclarecer, aumentó las controversias sobre el uso de placebo (10).
De esta forma, el tema más polémico de la Declaración de Helsinki, por sus implicancias éticas, metodológicas, científicas y económicas, continúa siendo el uso de placebo en ensayos clínicos multicéntricos, especialmente aquellos realizados en países en desarrollo de recursos extremadamente limitados.
En relación con el debate sobre el uso de placebo en investigaciones clínicas, Brasil, a través del Consejo Federal de Medicina, de la Comisión Nacional de Ética en Investigación, del Consejo Nacional de Salud y de la Sociedad Brasileña de Bioética, se ha destacado en el escenario internacional por sus innumerables actuaciones en defensa de la ética en los estudios clínicos, desde la perspectiva de la seguridad de los participantes y del uso de placebo exclusivamente en los estudios de enfermedades que no tengan tratamiento reconocido (11,12). En este escenario, el año 2008 fue importante en esta discusión, por tres razones: primero, por la realización de la 59ª Asamblea General de la AMM, en Seúl, en la que se aprobó la mayor flexibilización de la Declaración de Helsinki, incluida en el artículo 32 (13). En segundo lugar, en función de esta modificación, que puede haber llevado a una reducción de la protección de los participantes y a un mayor beneficio de los patrocinadores (14), el Consejo Federal de Medicina, inmediatamente finalizada la reunión de Seúl, aprobó la Resolución CFM 1885/2008 que, categóricamente, prohíbe a los médicos brasileños cualquier vínculo con investigaciones que usen placebo en estudios con medicamentos eficaces y efectivos (15). En tercer lugar, aún en 2008, el Consejo Nacional de Salud de Brasil (CNS), órgano máximo de deliberación en el área de salud humana, instado por la Comisión Nacional de Ética en Investigación (CONEP, por su sigla en portugués), aprobó una norma ética sobre el control del uso de placebo (Resolución CNS 404/2008) que restringía su uso a las situaciones en las que no existieran métodos probados de profilaxis, diagnóstico o tratamiento (16). Completando y reforzando esta orientación, el CFM mantuvo, en el nuevo Código de Ética Médica (17), aprobado en 2009, en el capítulo que trata de la Enseñanza e Investigación Médica (Art. 106), el mismo tenor de la Resolución CFM 1885/2008.
Por lo tanto, el objetivo del presente estudio es conocer la frecuencia real del uso de placebo en los ensayos clínicos de fase III realizados en Brasil, tomando como punto de corte el año 2008, e identificando algunas de sus características, como el papel de Brasil en los ensayos clínicos, sus principales patrocinadores, las enfermedades más investigadas, su uso en enfermedades con tratamiento conocido (diabetes tipo 1 y 2 e hipertensión) y la inserción de la palabra placebo en los títulos de los ensayos registrados en el ClinicalTrials.gov.
METODOLOGÍA
La investigación se realizó entre enero y marzo de 2014, sobre los ensayos clínicos incluidos en el sitio web ClinicalTrials.gov y registrados entre el 1 de enero de 2003 y el 31 de diciembre de 2007 y entre el 1 de enero de 2009 y el 31 de diciembre de 2013. Se buscó comparar los ensayos clínicos de drogas realizados en los cinco años previos y posteriores a 2008, momento en el que se aprobó la Resolución CFM 1858/2008 y la Declaración de Helsinki de 2008, haciendo el relevamiento de los datos a través de la lectura de los títulos oficiales y la metodología de los proyectos registrados en los períodos referidos.
El ClinicalTrials.gov es un recurso en línea, abierto a todas las personas, con información sobre estudios clínicos para testear la eficacia de drogas experimentales en una gran variedad de enfermedades. El sitio, creado como resultado de la Ley de Modernización de la Food and Drug Administration (FDA) de 1997, fue puesto a disposición del público en febrero de 2000 y es mantenido y actualizado por la National Library of Medicine (NLM) dependiente de los National Institutes of Health (NIH) (18).
De esta forma, en una primera etapa, con el propósito de determinar el número total anual de ensayos clínicos con drogas, en la opción Advanced search se utilizaron los siguientes campos de búsqueda y descriptores:
ADVANCED SEARCH:
Search terms: “Drug”
Recruitment: “All studies”; “Exclude Unknown Status”
Study Results: “All studies”
Study Type: “Interventional Studies”
TARGETED SEARCH:
Interventions: “Drug”
LOCATIONS:
Country 1: “Brazil”
ADDITIONAL CRITERIA:
Gender: “All Studies”
Age Group: “Child”; “Adult”; “Senior”
Phase: “Phase 3”
Funder Type: “NHI”; “Other US Federal Agency”; “Industry”; All others (Individual, University, Organization,...)
First Received: From 01/01/2003 to 12/31/2003
Este mismo procedimiento fue repetido para todos los años estudiados.
En la segunda etapa, con el objetivo de determinar el número de ensayos que utilizaron placebo, se cambió la palabra drug por placebo en el campo de búsqueda Interventions; y para las diferentes variables de los estudios se introdujo, por ejemplo, el nombre de la enfermedad tomado de la Clasificación Internacional de Enfermedades de la Organización Mundial de la Salud (OMS) en el campo de búsqueda Conditions dentro de TARGETED SEARCH. Para identificar a los patrocinadores de los ensayos, en el ítem Funder Type, se seleccionaron separadamente las opciones “Industry”; “NHI”; “Other US Federal Agency”; “All others (Individual, University, Organization,...)”, a los que se incorporaron institutos de investigación, hospitales y fundaciones, tanto brasileños y extranjeros como públicos y privados.
Con el objetivo de verificar la frecuencia del uso de placebo en estudios de fase III de enfermedades con innumerables alternativas terapéuticas, se adoptaron los mismos procedimientos en el ClinicalTrials.gov para el relevamiento de los ensayos en diabetes tipo 2 y en hipertensión (hypertension) y se realizó una búsqueda el 12 de octubre de 2014 con y sin el término placebo en el campo Interventions. Finalmente, para identificar si los ensayos con placebo registrados en el ClinicalTrials.gov en los diez años referidos consignaban esa información en el título resumido y en el título oficial (Official Title), el 10 de enero de 2014 se realizó una lectura detallada de los diseños metodológicos (study design) del grupo de pacientes tratados y del grupo control (placebo) y se comparó con los dos tipos de títulos de los ensayos. El título resumido es elegido por el grupo de investigación, el cual puede ser omitido si los investigadores así lo desean, mientras que el título oficial es obligatorio, debe ser detallado y debe incluir el nombre de la intervención, la condición a ser estudiada y el resultado (19). Actualmente, el ClinicalTrials.gov, además de reunir estudios de los 50 estados pertenecientes a EE.UU., concentra también información sobre los ensayos clínicos realizados en más de 180 países.
Para el análisis estadístico se utilizó el test exacto de Fisher.
RESULTADOS
En los períodos considerados se produjo un aumento en el número de ensayos (Cuadro 1), pasando de 392 en los cinco años previos a 2008 a 615 en el quinquenio posterior. También se observa que, del total de 1.007 ensayos clínicos registrados en los 10 años considerados, el placebo fue utilizado en 438 (43,5%). No hubo diferencias estadísticas entre las proporciones de los test clínicos que utilizaron placebo y los que no lo utilizaron en relación con el período anterior y posterior a 2008 (p=0,696), considerando todos los tipos de patrocinadores.
| Cuadro 1. Ensayos clínicos de fase III de intervención con droga, realizados en Brasil con y sin uso de placebo, registrados en ClinicalTrials.gov de 2003 a 2007 y de 2009 a 2013. |
 |
| Fuente: Elaboración propia. aAños posteriores a la implementación de la Resolución CFM 1885/2008 y de la revisión de la Declaración de Helsinki, Seúl, 2008. |
Al seleccionar solo los estudios patrocinados exclusivamente por la industria farmacéutica (Cuadro 2), se mantiene la misma proporción de ensayos anteriores y posteriores a 2008 con uso de placebo (p=0,944). Sin embargo, en los ensayos financiados por otros organismos (universidades brasileñas y extranjeras, National Institutes of Health de EE.UU. y otros nacionales), se produce un significativo aumento en el período analizado, pasando de 16,1% (5/31) en los años previos a 2008, a 43,1% (44/102) en los cinco años posteriores (p=0,006). Incluso, tal como se observa en el Cuadro 2, la industria farmacéutica financió el 92,1% (361/392) de los ensayos entre 2003 y 2007 y el 83,4% (513/615) en el siguiente período de 5 años, llegando al 86,8% (874/1.007) en los 10 años del relevamiento.
| Cuadro 2. Patrocinadores de los ensayos clínicos de fase III de intervención con droga, realizados en Brasil con uso de placebo, registrados en ClinicalTrials.gov de 2003 a 2007 y de 2009 a 2013. |
 |
| Fuente: Elaboración propia. aNational Institutes of Health (NIH) de EE.UU., otras agencias federales estadounidenses, individuales, universidades, laboratorios brasileños, Organizaciones, etc. bAños posteriores a la implementación de la Resolución CFM 1885/2008 y de la revisión de la Declaración de Helsinki, Seúl, 2008. |
Al identificar a los patrocinadores, se constata que siete industrias farmacéuticas financiaron el 47% (206/438) de los estudios con placebo en Brasil: Sanofi-Aventis, 37 ensayos; Hoffmann-La Roche, 35; Novartis, 32; Bristol-Myers Squibb, 29; Eli Lilly, 28; AstraZeneca, 24; y Janssen, 21 ensayos (Figura 1).
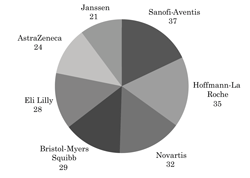 |
| Figura 1. Industrias farmacéuticas patrocinadoras del 47% (206/438) de los ensayos clínicos de fase III de intervención con droga y con uso de placebo, realizados en Brasil y registrados en ClinicalTrials.gov de 2003 a 2007 y de 2009 a 2013. |
| Fuente: Elaboración propia. |
En cuanto a las enfermedades investigadas con uso de placebo (Cuadro 3), el mayor porcentaje corresponde a las neoplasias, con el 23,1% de los 438 ensayos, seguidas por las enfermedades del sistema circulatorio (12,8%), las endócrinas, nutricionales y metabólicas (12,3%) y ciertos desórdenes que involucran al sistema inmune (11,0%), restando para ciertas enfermedades infecciosas y parasitarias menos del 10% de los ensayos clínicos.
| Cuadro 3. Enfermedades investigadas en los ensayos clínicos de fase III de intervención con droga, realizados en Brasil con uso de placebo, registrados en ClinicalTrials.gov de 2003 a 2007 y de 2009 a 2013. |
 |
| Fuente: Elaboración propia. aDesignación según Clasificación Internacional de Enfermedades 2010 de la Organización Mundial de la Salud (OMS). bDespués de la implementación de la Resolución CFM 1885/2008 y de la revisión de la Declaración de Helsinki, Seúl, 2008. |
En relación con los ensayos de fase III sobre diabetes tipo 2, realizados entre 2003 y 2013, y financiados por cualquier tipo de patrocinador, se constató la presencia de placebo en 49 (52,7%) de los 93 registros encontrados en el ClinicalTrails.gov y, de este total, 92 (98,9%) fueron financiados por la industria farmacéutica. Al confrontar la prevalencia del uso de placebo en diabetes tipo 2 de los cinco años previos con los cinco años posteriores a 2008, excluyendo el año 2008, se verificó un aumento importante, aunque no significativo en el último quinquenio, pasando del 44,5% (20/45) al 64,2% (25/39) (p=0,05645). A su vez, en el relevamiento sobre hipertensión, en el período de 2003 a 2013, en ensayos de fase III, 15 (41,7%) ensayos de un total de 36 fueron con placebo, y 31 (86,1%) de ese total fueron patrocinados por las multinacionales farmacéuticas. En la estratificación comparativa anterior (2003-2007) y posterior (2009-2013) a 2008, los porcentajes fueron del 40,0% (6/15) y del 31,2% (5/16), respectivamente, cuya diferencia no tiene significancia estadística (p=0,4467).
Cabe mencionar que, en la presente investigación, el uso de placebo en el grupo control puede haber sido utilizado como complemento de alguna otra droga, activa o no, o como droga única (pura) en el grupo control de una droga experimental.
Con relación a la presencia de la palabra placebo en el título oficial de los ensayos con placebo, de los 438 analizados el 25 de enero de 2014, la palabra placebo estaba presente en 290 (66,2%), por lo tanto, cerca de un tercio no informaba que se trataba de un estudio controlado con placebo. Sobre el título resumido, de los 391 registrados, 342 (88,5%) no exhibían el término placebo.
DISCUSIÓN
Se produjo un aumento significativo del número de ensayos clínicos de fase III con reclutamiento en Brasil, registrados en el ClinicalTrials.gov en los períodos considerados, pasando de 392 antes de 2008 a 615 con posterioridad a este año (Cuadro 1). Acerca de tal aumento, entre 2003 y 2005, este número se quintuplicó y pasó de 22 a 110. Este crecimiento puede originarse en que, a partir de 2005, el International Committee of Medical Journal Editors (ICMJE) (20) comenzó a exigir que solo se aceptaran artículos que tuvieran los resultados de los ensayos registrados en una plataforma pública. Aunque se haya producido un aumento significativo en el mencionado año en virtud de esta exigencia (21), los datos de ese año, en Brasil, vienen al encuentro de un crecimiento en el número de proyectos analizados por la Agencia Nacional de Vigilancia Sanitaria (ANVISA), la cual había aprobado 198 ensayos clínicos, de los cuales 107 estudios (54%) eran de fase III (22). O sea, incluso si se considerara una posible limitación en el registro de los ensayos clínicos antes de 2008, se podría decir que en el período estudiado el aumento de ensayos en Brasil es real.
En comparación con otros países de América del Sur, Brasil es líder, como se constata en los registros actuales del ClinicalTrials.gov. Así, en el mapa que se visualiza en esta plataforma y que sintetiza los números de todos los tipos de estudios clínicos (de intervención y observacionales) registrados en el mundo a lo largo de los años de su funcionamiento, consta que de los 6.050 realizados en esta región hasta el día 12 de octubre de 2014, 4.115 se realizaron en Brasil, y 1.808 en Argentina. Este número registrado en Brasil es similar al referido para todo el continente africano (4.121) (23). Brasil ocupa el decimoquinto lugar en el mundo desde 1990 en la realización de ensayos clínicos (24), estimándose que, solo en los últimos diez años, más de 100 mil voluntarios participaron de estudios clínicos (25). Esto permite estimar un promedio aproximado de 100 participantes por ensayo, si se consideran los 1.007 ensayos registrados en el presente estudio en 10 años. Parte de esa realidad se debe a la creciente globalización de los ensayos clínicos en el panorama mundial, en la búsqueda de reclutamiento de participantes para los estudios (26), los cuales pueden traer consigo implicancias éticas (27). Entre las debilidades de las investigaciones clínicas en contextos de vulnerabilidad social, se destaca la instrumentalización de los participantes de los ensayos derivada de las necesidades de las industrias farmacéuticas, que tienden a desplazarse hacia países de medianos y bajos ingresos, tal como ocurre en el panorama brasileño (28). Los países en desarrollo entraron en la ruta de las inversiones de las empresas farmacéuticas, dado que la reducción de costos es uno de los principales estímulos que impulsan a ampliar su presencia en países periféricos (29). Este fenómeno tiene su origen en la reducción de los ensayos en los países desarrollados por la demora en la ejecución por parte de los responsables en los centros académicos y la posterior utilización de las contract-research organizations (CRO) para acelerar el desarrollo de las investigaciones clínicas (30). En consecuencia, se ha producido un aumento progresivo de la investigación clínica en Brasil y una mayor participación de la industria farmacéutica multinacional (31). En el presente estudio, se comprobó que la participación extranjera en los ensayos clínicos realizados en Brasil fue del orden del 86,8% (874/1.007) en los 10 años del relevamiento y que el 47% (206/438) de estas investigaciones clínicas realizadas con placebo en Brasil fueron patrocinadas por apenas siete empresas (Figura 1), de las cuales cinco (Sanofi-Aventis, Hoffmann-La Roche, Novartis, Eli Lilly y AstraZeneca) son integrantes del grupo de la big pharma, que reúne las diez compañías de mayor presupuesto mundial en 2014 (32). Otros estudios mencionan resultados similares, con índices del 75% y del 80% de los ensayos clínicos en Brasil, financiados por la industria farmacéutica (24,33), siendo que el segundo porcentaje proviene de la Agencia Nacional de Vigilancia Sanitaria. Los referidos números muestran el incremento de los ensayos clínicos por drogas en Brasil patrocinados por empresas extranjeras y se contraponen frontalmente a las visiones acerca de que la prohibición impuesta por el Consejo Federal de Medicina al uso no ético de placebo habría reducido las investigaciones en el país (34).
De este modo, se percibe que la investigación de drogas en Brasil es multicéntrica, internacional y liderada por las casas matrices de las empresas y, por lo tanto, con baja interferencia de los profesionales de los países en desarrollo, los cuales se dedican a ejecutar y a monitorear la generación de los datos, según un diseño metodológico preestablecido (24), aunque los profesionales brasileños tengan alta capacitación para la realización de ensayos de fase III, razonable para ensayos de fases II y IV y bajísima para las investigaciones de fase I (35).
A propósito de las enfermedades investigadas en los ensayos clínicos en Brasil con uso de placebo en los diez años analizados, las neoplasias fueron las más investigadas, con el 23,1% de los 438 ensayos, con una presencia creciente en el mundo y la búsqueda incesante de los laboratorios para el descubrimiento de drogas activas. Las demás enfermedades más investigadas también son de comportamiento clínico prolongado, como algunas relacionadas al sistema circulatorio, las endócrinas, nutricionales y metabólicas y ciertos desórdenes que involucran al sistema inmune. Sin embargo, esta es tan solo una parte de las necesidades brasileñas, dado que el país aún sufre de endemias de gran importancia en su cuadro nosológico, destacándose: la malaria, el dengue, la enfermedad de Chagas, la leishmaniasis, la esquistosomiasis, la lepra, las hepatitis virales, entre otras (36). Históricamente, las empresas farmacéuticas han realizado poca investigación de nuevos fármacos para las enfermedades postergadas porque son enfermedades que afectan, especialmente, a personas de muy bajos ingresos por lo que la inversión no es de interés de las empresas farmacéuticas. Un ejemplo de esto es que, desde 1975 a 1999, entre 1.393 medicamentos, se comercializaron solo 16 nuevas drogas para enfermedades tropicales y tuberculosis (37). En la presente investigación, con relación a Brasil, el tratamiento para las enfermedades postergadas, de gran interés para el país, fue poco estudiado, con menos del 10% de las investigaciones de intervención con drogas (Cuadro 3).
Los resultados de este estudio muestran que la investigación de fármacos está dominada por un pequeño número de grandes empresas multinacionales y que sus investigaciones obedecen más a las leyes de mercado que a las prioridades médicas o necesidades sociales del lugar en donde se realizan (38). Por esta razón, dado que el desarrollo de drogas para las enfermedades postergadas no será realizado por la industria farmacéutica, debería ser incentivado por los organismos públicos de la región (39). Este interés económico por drogas de uso continuo ha llevado a las industrias prácticamente a abandonar la investigación de medicamentos para uso en enfermedades agudas, cuyo ejemplo más contundente y dramático es el de la identificación de nuevos antibióticos, relegada a un plano secundario, a pesar del serio y creciente problema de resistencia bacteriana, que causa víctimas en todo el mundo en números alarmantes y abre la perspectiva siniestra de amenazas del bioterrorismo y pérdidas económicas irreparables (40).
En cuanto al uso de placebo en estudios clínicos, la historia más reciente sobre ética en investigación revela las contradicciones respecto al uso engañoso de placebo en tratamientos médicos y ensayos clínicos, muchas veces sin que el paciente fuese informado de su uso pues, además de causar riesgos no previstos usualmente, compromete el prestigio de la institución y la pérdida de confianza en el equipo médico (7). Resulta increíble que, transcurrido casi medio siglo, el tema del placebo continúe generando tantas discusiones y controversias, permitiendo imaginar la existencia de fuerzas poderosas capaces de presionar por interminables años para intentar justificar lo injustificable respecto al uso de placebo de forma cotidiana en ensayos clínicos de enfermedades con tratamiento conocido.
Claramente, existen opiniones favorables de los ensayos controlados con placebo en las enfermedades con tratamiento conocido (41) y otras que se oponen a esta conducta (9,12). Los primeros argumentan que el uso de placebo reduce el número de participantes en los ensayos, es más rápido y más barato para los patrocinadores y que se justifica, desde el punto de vista metodológico, para evaluar mejor la eficacia y la seguridad. Algunos de los que justifican el uso de placebo, por razones metodológicas y científicas, entienden que no es ético testear una nueva droga en enfermedades en las cuales existe un tratamiento efectivo comprobado (42). A su vez, los que critican esta conducta señalan cuestiones éticas fundamentales, como el derecho al mejor tratamiento disponible, teniendo en cuenta que, en los ensayos controlados, la indeterminación clínica (clinical equipoise) deja de existir, dado que el placebo no trata enfermedades y, por consiguiente, cuando se pierde la indeterminación clínica, el estudio es éticamente frágil (10). Es incuestionable que, en esos ensayos, hay una reducción de la protección por el uso de placebo, el cual sustituye una droga activa que podría ser administrada a los participantes del grupo control en enfermedades con tratamiento reconocido.
En el presente estudio, los resultados encontrados muestran el exceso del uso de placebo, tanto antes como después de 2008, año en que fue promulgada la nueva normativa ética por el CFM. Esto se puede apreciar en el 43,5% (438) del total de los 1.007 ensayos clínicos registrados en los 10 años en la plataforma ClinicalTrials.gov, sin que hayan sido detectadas diferencias significativas entre los dos períodos analizados. Cabe señalar que no fue posible encontrar en la bibliografía otros estudios que hayan utilizado una metodología similar a la de la presente investigación. No obstante, un relevamiento bibliográfico sobre psoriasis detectó el uso de placebo en el 38,5% de los ensayos de intervención con droga, con una frecuencia mucho mayor en los estudios financiados por la industria farmacéutica que en aquellos financiados por otros patrocinadores (43). Tales valores pueden ser producto del elevado número de ensayos controlados con placebo realizados por la industria farmacéutica a lo largo de los años, de manera independiente de cualquier norma ética nacional o internacional y, generalmente, con el respaldo de la agencia estadounidense de control y aprobación de drogas.
No obstante, el dato sorprendente aportado por este estudio es el aumento significativo del uso de placebo luego de 2008, comparativamente al período anterior, en los ensayos patrocinados por sectores no industriales, como las universidades y los organismos públicos (p=0,006). Una posible explicación puede ser la flexibilización proporcionada por las últimas revisiones de la Declaración de Helsinki, en contraposición a la Resolución CFM 1885/2008, que restringe su utilización a las enfermedades sin tratamiento conocido. Complementando las observaciones del presente estudio, llama la atención el excesivo uso de placebo en las investigaciones de diabetes tipo 2 y de hipertensión, enfermedades crónicas para las cuales se esperaba una reducción en la frecuencia, teniendo en cuenta la existencia de múltiples drogas disponibles para sus tratamientos. En los ensayos de fase III para diabetes tipo 2, el uso de placebo en casi el 53% de las investigaciones clínicas en el período estudiado es éticamente injustificable. Es importante también considerar que los elevados porcentajes del uso de placebo en los cinco años anteriores y cinco posteriores a 2008, en diabetes tipo 2, expresan que se trata de una metodología empleada de forma permanente por la industria farmacéutica y que no encuentra respaldo ético en ninguna norma nacional. A su vez, el porcentaje más elevado con posterioridad a 2008, a pesar de no haber una significancia estadística en el último quinquenio, representa un aumento importante que debe ser considerado y puede estar relacionado al aumento de la permisividad de la revisión de la Declaración de Helsinki de 2008. ¿Cómo se justifica que, en más de la mitad de esas intervenciones con drogas en diabetes tipo 2, el grupo control reciba placebo existiendo tantas alternativas de tratamiento sabidamente eficaces? Situación igualmente sorprendente y exagerada se produjo con los ensayos de hipertensión, pues 4 de cada 10 contenían placebo como control, con una frecuencia igualmente elevada al comparar los años previos y posteriores a 2008, lo que demuestra que esta metodología también es de uso constante a lo largo de los años, como se detectó con la diabetes tipo 2. Tales ensayos en hipertensión, controlados con placebo, se consideran no éticos, sobre todo porque su duración es prolongada, razón por la cual no es aconsejable el uso de placebo por los riesgos que implican para los participantes, como recomienda la FDA en EE.UU. (44). Los datos sobre los ensayos de diabetes e hipertensión ilustran la desatención a las normas éticas nacionales ya que, al admitir que los protocolos de esas empresas están elaborados en el exterior y que más del 90,0% de estos ensayos están patrocinados por empresas farmacéuticas multinacionales, cabe a los médicos brasileños la decisión de no integrar los equipos locales en ensayos cuyas características son repudiadas por la entidad médica nacional y latinoamericana y por los organismos brasileños de bioética y del sistema de Comités de Ética en Investigación y la Comisión Nacional de Ética en Investigación. Un estudio sobre ensayos clínicos con placebo en Brasil concluyó que, aunque la mayoría de ellos respete las normas éticas nacionales, es necesario un mayor rigor en el empleo de grupo control con placebo en la protección a los participantes de la investigación (45).
En función de esos abusos éticos, se propuso para América Latina (46): a) total rechazo del uso de placebo en los ensayos clínicos, en cualquier tipo de estudio; b) abandono de la Declaración de Helsinki; c) creación de un documento ético específico del continente latinoamericano volcado a su realidad regional.
Estas diferentes opiniones resultan más evidentes cuando se comparan los ensayos controlados con placebo en los países desarrollados y en desarrollo. En estos últimos, el denominado doble estándar es enérgicamente rechazado (47,48); sin embargo, hay quienes conciben que su empleo en países de bajos recursos económicos o en comunidades de escasa atención a la salud y de infraestructura médica precaria es éticamente justificable (49). A su vez, el llamado “efecto placebo” resulta un misterio como causante de beneficios, tal como alega la industria farmacéutica, teniendo en cuenta que un efecto positivo puede significar una mejora espontánea o ser producto del poder de sugestión del participante (39).
Por lo tanto, ¿cómo se justifica que en más de 50% de los referidos ensayos en diabetes tipo 2 y en aproximadamente el 40% de los test clínicos para hipertensión realizados en Brasil, el grupo control reciba placebo existiendo tantas drogas sabidamente eficaces para las dos enfermedades?
Resulta extraño que en Brasil, que tiene un sistema de control ético con doble valoración para los ensayos clínicos con cooperación y financiamiento extranjeros –por un comité local y otro nacional– se hayan aprobado tantos estudios no éticos para diabetes e hipertensión, en los cuales el placebo haya sido usado en el grupo control. En ensayos clínicos sobre cáncer presentados en el Congreso de la Sociedad Americana de Clínica Oncológica, el 65% de los 26 estudios no tenían autorización de las agencias éticas (39) y, por otro lado, la mitad de los estudios que constan en el ClinicalTrials.gov nunca fueron publicados (50). Otro dato relevante es que, en 2005, se realizaron algunos ensayos clínicos en Brasil sin la autorización ética correspondiente (31). Pese a esta información, resulta difícil imaginar que esto pueda suceder en Brasil con relación a tantos estudios sobre diabetes tipo 2 e hipertensión, o quizá responda a fallas de los Comités de Ética en Investigación y en la Comisión Nacional de Ética en Investigación en Seres Humanos de forma sistemática. A su vez, la reconocida falta de control y seguimiento de los ensayos clínicos por parte del sistema ético brasileño precisa ser revisada para que situaciones como estas no se transformen en una constante. Independientemente de la respuesta a estas dudas, es importante reflexionar sobre la participación de los equipos que actúan en estos ensayos, sobre todo de los médicos-investigadores, teniendo en cuenta que la acción médica infringe el principio hipocrático primum non nocere, o la no maleficencia y cuyos participantes son denominados huérfanos terapéuticos (51). Se admite que factores relacionados a serios conflictos de intereses serían capaces de llevar a los médicos brasileños a participar de los mencionados estudios y a dejar de lado la Resolución CFM 1885/2008, su Código de Ética Médica y el principio bioético de la beneficencia por un interés secundario. Esa actitud invierte la relación histórica entre el médico y el paciente, en la cual el médico satisface las necesidades del paciente, pero en la que el médico investigador puede estar motivado por otros intereses, como la búsqueda de prestigio científico, la participación en el gerenciamiento de los recursos financieros del proyecto de investigación y el aumento de su producción científica (52). La posibilidad de que los médicos induzcan a sus pacientes vulnerables a participar de los ensayos, motivados por su alta remuneración en la conducción de los ensayos también es citada en la bibliografía (53). En esta misma línea, los autores de la clásica obra Principles of Biomedical Ethics enfatizan que los roles dobles de científico-investigador y de médico-clínico van en diferentes direcciones y conllevan obligaciones y conflictos de intereses (54). Incluso señalan que la investigación en seres humanos, a pesar de ser importante para la sociedad, es también moralmente peligrosa, pues se expone a los individuos a algún grado de riesgo en beneficio de la ciencia, destacando que: “no se puede hacer uso del placebo en el caso de que existan evidencias de algún tratamiento adecuado” (54 p.492). Esto parece demonstrar la existencia de un problema ético intrínseco a la investigación clínica en el país, teniendo en cuenta las normativas contrarias al uso de placebo en ensayos clínicos cuando existen intervenciones comprobadas.
Cabe resaltar que, además de las normas prohibitivas del Consejo Federal de Medicina, el gobierno brasileño, por intermedio del Consejo Nacional de Salud, en 2008, también se opuso a las modificaciones en la Declaración de Helsinki que permitían liberar investigaciones con placebo cuando contaran con tratamientos comprobados, razón por la cual emitió la Resolución CNS 404/2008 (16). La Resolución CNS 466/12 no ratifica la Declaración de Helsinki de 2008, sino que acepta solo la Declaración aprobada en 2000 en Edimburgo, Escocia (55). De la misma forma, la Sociedad Brasileña de Bioética (SBB) se opuso al uso de placebo en ensayos clínicos para intervenciones con tratamiento ya existente (56).
En América Latina existe un fuerte movimiento en contra del uso indiscriminado de placebo en ensayos clínicos, liderado por la Confederación Médica Latinoamericana y del Caribe (CONFEMEL) (57), organización que congrega a las entidades análogas de los países de la región, la cual se ha posicionado de forma vehemente en esta cuestión. La primera manifestación pública fue, en 2012, con la Declaración de Bogotá (58) sobre investigación médica en seres humanos, en el marco de su XV Asamblea General Ordinaria cuando afirmó que: a) no admite el uso de placebo en enfermedades con medicación eficaz; b) se opone a los artículos 32 y 33 de la Declaración de Helsinki por contrariar los principios y valores de la profesión médica; c) las poblaciones pobres y vulnerables de la región deben tener los mismos niveles de seguridad que en los ensayos realizados en los países desarrollados. La CONFEMEL aprobó, en noviembre de 2013, la Declaración de Pachuca (59), con severas y duras críticas a la revisión de la Declaración de Helsinki de 2013, realizada en Brasil. El documento propone que los gobiernos no permitan ensayos con el sesgo ético de la utilización de placebo en estudios para enfermedades con tratamiento conocido, y recomienda denunciar tal situación en todos los niveles del Poder Ejecutivo para impedir su aplicación en el territorio. Esto parece reflejar la fuerte indignación de los órganos fiscalizadores de la práctica médica en América Latina y el Caribe sobre la flexibilización del uso de placebo introducida en la Declaración de Helsinki de 2013.
El uso de placebo en algunos tipos de investigaciones clínicas, en el caso del Brasil en particular, puede estar vinculado a otros intereses que no son precisamente la protección de los sujetos de investigación, dado que se esperaba una reducción de estas investigaciones consideradas críticas desde el punto de vista ético. Por el contrario, incluso con posterioridad a la Resolución CFM 1885/2008, la conducta médica parece haber sido insensible a las orientaciones sobre las restricciones a la utilización de placebo en estos ensayos clínicos, lo que puede ser considerado un grave incumplimiento ético. La necesidad de reconocimiento de los riesgos de los participantes en estos ensayos parece haber sido substituida por las necesidades mercadológicas de producción de medicamentos.
En cuanto a las bases de datos más utilizadas para el registro de los ensayos clínicos, el ClinicalTrials.gov, era señalado como la única base de registros existente que cumplía los criterios adoptados por el International Committee of Medical Journal Editors (19), aunque actualmente, se acepten otros registros en plataformas internacionales. A su vez, dos estudios realizados sobre el ClinicalTrials.gov (60,61) y uno realizado sobre la International Clinical Trials Registry Platform (ICTRP) de la Organización Mundial de la Salud (62) concluyeron que tienen grandes limitaciones como, por ejemplo, la elevada prevalencia de ensayos clínicos con metodologías descriptas de forma insuficiente, lo que se condice con lo encontrado en la presente investigación respecto de las dificultades para la identificación adecuada del tipo de intervención del grupo control, lo que puede constituirse en una limitación a ser considerada. Se destaca que los tres estudios internacionales referidos, a pesar de abordar las intervenciones realizadas en los ensayos, extrañamente no incluyeron ninguna evaluación sobre el empleo de placebo, lo que parece demostrar la prevalencia del interés técnico-científico sobre los aspectos éticos más relevantes y más debatidos en la temática de los ensayos con drogas. Frente a tales deficiencias de los registros, se alerta sobre el hecho de que diferentes estudios podrán obtener distintos resultados, razón por la cual se sugieren revisiones de las plataformas internacionales (61-63).
Algunas de las críticas al ClinicalTrials.gov observadas en el presente estudio que podrían ser ampliadas:
- Ensayos multicéntricos que no especifican el número de participantes por país, aunque informen el número total a nivel mundial.
- Significativo porcentaje de ensayos registrados con omisión voluntaria, por parte de los investigadores –es una responsabilidad que les compete a ellos– de la palabra placebo en el título resumido.
- De igual importancia, aunque con menor frecuencia, la ausencia de la palabra placebo en el título oficial. En la identificación de la característica del estudio, si es o no un estudio controlado con placebo, se torna relevante dado que enmascara y esconde al gran público el uso de esta droga inerte.
- Diseños metodológicos poco claros, principalmente, con relación al grupo control y al uso de droga activa y/o placebo, lo que dificulta identificar la intervención real a ser realizada.
En conclusión, la norma ética promulgada por el Consejo Federal de Medicina, en 2008, no alteró en nada el perfil general de los ensayos con uso de placebo en el período analizado, considerando todos los patrocinadores entre los que se destaca la masiva participación de la industria farmacéutica multinacional. En los estudios financiados por estas empresas, la presencia de placebo en el grupo control se mantuvo en niveles elevados y estables a lo largo de los diez años observados. Cabe destacar que estos protocolos se elaboran fuera del país, sin interferencia de los médicos brasileños y, por lo tanto, no dependen de la legislación ética nacional. A su vez, es sorprendente el resultado de los ensayos financiados por otras instituciones, brasileñas y extranjeras (excepto las industrias farmacéuticas multinacionales) y para los cuales el aumento significativo del uso de placebo luego de la promulgación de la norma prohibitiva del Consejo Federal de Medicina, en 2008, no encuentra explicación plausible. Los elevados índices de uso de placebo en ensayos sobre enfermedades con tratamiento efectivo y eficaz, como la diabetes tipo 2 y la hipertensión, es una situación considerada grave para un país con doble aprobación de los estudios multicéntricos. Las enfermedades crónicas fueron las más investigadas, probablemente, porque exigen un tratamiento continuo, lo que despierta el interés económico de la big pharma y restringe las investigaciones de drogas para enfermedades postergadas. Por lo tanto, se concluye que la norma promulgada en 2008 por el Consejo Federal de Medicina fue ineficaz, sobre todo para los médicos brasileños que participaron o elaboraron protocolos clínicos en los períodos considerados y que infringieron las normas éticas.
Cabe señalar que las plataformas de registros clínicos deben ser entendidas como un bien público, así como los datos derivados de esos estudios, lo que reafirma la importancia del aumento de la transparencia de tales bases, la calificación de las evaluaciones de los protocolos de investigación, como también la necesidad de control de las investigaciones clínicas por parte del sistema ético brasileño, a fin de ampliar los mecanismos de seguridad de los participantes en los ensayos clínicos.
CONFLICTO DE INTERESES
Los autores declaran no tener compromisos con las fuentes de financiamiento, o cualquier otro tipo de vínculo que pueda ser entendido como conflicto de intereses.
AGRADECIMIENTOS
Al profesor Dr. Gerson Azulim Muller por el análisis estadístico del presente trabajo. A la Universidade do Oeste de Santa Catarina por la concesión de la Beca de Iniciación de Investigación a uno de los autores (No. 08/UNOESC-R 2013).
1. Beecher HK. The powerful placebo. JAMA. 1955;159(17):1602-1606. [ Links ]
2. Shapiro AK. A contribution to a history of the placebo effect. Systems Research and Behavioral Science. 1960;5(2):109-135. [ Links ]
3. Marcus DM. Clinical and ethical aspects of placebos in clinical practice. JAMA Internal Medicine. 2013;173(8):711-712. [ Links ]
4. Pignarre P. O que é o medicamento?: Um objeto estranho entre ciência, mercado e sociedade. São Paulo: Editora 34; 1999. [ Links ]
5. Lederer SE. Subjected to science: human experimentation in America before the Second World War. Baltimore: Johns Hopkins University Press; 1995. [ Links ]
6. Human D, Fluss SS. The World Medical Association’s Declaration of Helsinki: Historical and contemporary perspectives [Internet]. 2001 [citado 18 set 2014]. Disponible en: http://www.wma.net/en/20activities/10ethics/10helsinki/draft_historical_contemporary_perspectives.pdf.
7. Bok S. The ethics of giving placebos. Scientific American. 1974;231(5):17-23. [ Links ]
8. Angell M. Ethical imperialism?: Ethics in international collaborative clinical research. New England Journal of Medicine. 1988;319(16):1081-1083. [ Links ]
9. Rothman KJ, Michels KB. The continuing unethical use of placebo controls. New England Journal of Medicine. 1994;331(6):394-398. [ Links ]
10. Malik AY, Ghafoor F. International collaborative trials, placebo controls and the Declaration of Helsinki: need for clarification in paragraph 32. Indian Journal of Medical Ethics. 2012;9(1):13-17. [ Links ]
11. Schlemper Junior BR. Historia del control ético de la investigación en seres humanos en Brasil. Boletín Fármacos [Internet]. 2008;11(5):9-10 [citado 20 ago 2014). Disponible en: http://www.saludyfarmacos.org/wp-content/files//nov08.pdf. [ Links ]
12. Schlemper Junior BR, Hellmann F. Controvérsias em tempos de mudanças na Declaração de Helsinque e a experiência brasileira em Ética em Pesquisa. En: Caponi S, Verdi M, Brzozowski FS, Hellmann F, organizadores. Medicalização da vida: ética, saúde pública e indústria farmacêutica. 2a ed. Curitiba: Editora Prismas; 2013. [ Links ]
13. Associação Médica Mundial (AMM). Declaração de Helsinki VI [Internet]. [citado 12 mar 2014]. Disponible en: http://www.wma.net/es/30publications/10policies/b3/17c_es.pdf.
14. Garrafa V, Lorenzo C. Helsinque 2008: redução de proteção e maximização de interesses privados. Revista da Associação Médica Brasileira. 2009;55(5):497-520. [ Links ]
15. Conselho Federal de Medicina (CFM). Resolução Nº 1885, de 23 de outubro de 2008 [Internet]. 2008 [citado 20 ago 2014]. Disponible en: http://www.portalmedico.org.br/resolucoes/CFM/2008/1885_2008.htm. [ Links ]
16. Brasil, Ministério da Saúde, Conselho Nacional de Saúde (CNS). Resolução Nº 404, de 1º de agosto de 2008 [Internet]. 2008 [citado 25 ago 2014]. Disponible en: http://bvsms.saude.gov.br/bvs/saudelegis/cns/2008/res0404_01_08_2008.html. [ Links ]
17. Conselho Federal de Medicina. Resolução Nº 1931, de 17 de setembro de 2009 [Internet]. 2009 [citado 20 mar 2014]. Disponible en: http://www.portalmedico.org.br/resolucoes/CFM/2009/1931_2009.pdf. [ Links ]
18. National Institutes of Health. About this site [Internet]. 2014 [citado 25 ago 2014]. Disponible en: https://www.clinicaltrials.gov/ct2/about-site. [ Links ]
19. De Angelis C, Drazen JM, Frizelle FA, Haug C, et al. Is this clinical trial fully registered? — A statement from the International Committee of Medical Journal Editors. New England Journal of Medicine. 2005;352(23):2436-2438.
20. International Committee of Medical Journal Editors (ICMJE). Update on trials registration [Internet]. 2004 [citado 15 oct 2014]. Disponible en: http://www.icmje.org/news-and-editorials/trial_reg_oct2004.html. [ Links ]
21. Laine C, Horton R, DeAngelis CD, Godlee F, et al. Update on Trials Registration: Clinical Trial Registration: Looking Back and Moving Ahead [Internet]. International Committee of Medical Journal Editors (ICMJE); 2007 [citado 27 sep 2014]. Disponible en: http://www.icmje.org/news-and-editorials/clincial_trial_reg_jun2007.html. [ Links ]
22. Scariot M, Pereira M. Ensaios clínicos aprovados pela Agência Nacional de Vigilância Sanitária. Brasília Médica [Internet]. 2011;48(3) [citado 9 sep 2014]. Disponible en: http://www.ambr.org.br/ensaios-clinicos-aprovados-pela-agencia-nacional-de-vigilancia-sanitaria/. [ Links ]
23. National Institutes of Health. Map of all studies in ClinicalTrials.gov [Internet]. 2014 [citado 20 sep 2014]. Disponible en: https://clinicaltrials.gov/ct2/search/map. [ Links ]
24. Gomes RP, Pimentel VP, Landim AB, Pieroni JP. Ensaios clínicos no Brasil: competitividade internacional e desafios. BNDES Setorial Complexo Industrial da Saúde [Internet]. 2012 [citado 9 set 2014];36:45-84. Disponible en: http://www.bndes.gov.br/SiteBNDES/export/sites/default/bndes_pt/Galerias/Arquivos/conhecimento/bnset/set3602.pdf.
25. Zucchetti C, Morrone FB. Perfil da pesquisa clínica no Brasil. Revista do Hospital das Clínicas de Porto Alegre. 2012;32(3):340-347. [ Links ]
26. Shah S. Cazadores de cuerpos: la experimentación farmacéutica con los pobres del mundo. Madrid: 451 Editores; 2009. [ Links ]
27. Petryna A. When experiments travel: Clinical trials and the global search for human subjects. Princeton: Princeton University Press; 2009. [ Links ]
28. Petryna A. Experimentalidade: Ciência, capital e poder no mundo dos ensaios clínicos. Horizontes Antropológicos. 2011;17(35):127-160. [ Links ]
29. Associação da Indústria Farmacêutica de Pesquisa (Interfarma). Guia Interfarma [Internet]. 2014 [citado 16 sep 2014]. Disponible en: http://www.interfarma.org.br/biblioteca.php?publicacao=&categoria=G. [ Links ]
30. Bodenheimer T. Uneasy alliance: Clinical investigators and the pharmaceutical industry. New England Journal of Medicine. 2000;342(20):1539-1544. [ Links ]
31. Freitas CBD, Schlemper Junior BR. Progress and challenges of clinical research with new medications in Brazil. En: Homedes N, Ugalde A, organizadores. Clinical trials in Latin America: Where ethics and business clash. London: Springer; 2014. [ Links ]
32. Statista. 2014 ranking of the global top 10 biotech and pharmaceutical companies based on revenue (in billion U.S. dollars) [Internet]. 2014 [citado 18 sep 2014]. Disponible en: http://www.statista.com/statistics/272717/top-global-biotech-and-pharmaceutical-companies-based-on-revenue/. [ Links ]
33. Zucchetti C, Morrone FB. Perfil da pesquisa clínica no Brasil. Revista do Hospital das Clínicas de Porto Alegre. 2012;32(3):340-347. [ Links ]
34. Sousa MSA, Franco MAG, Massud Filho J. A nova declaração de Helsinque e o uso de placebo em estudos clínicos no Brasil: a polêmica continua. Revista Médica (São Paulo). 2012;91(3):178-188. [ Links ]
35. Quental C, Salles Filho S. Ensaios clínicos: capacitação nacional para avaliação de medicamentos e vacinas. Revista Brasileira de Epidemiologia. 2006;9(4):408-424. [ Links ]
36. Zago MA. A pesquisa clínica no Brasil. Ciência & Saúde Coletiva. 2004;9(2):363-374. [ Links ]
37. Trouiller P, Olliaro P, Torreele E, Orbinski J, Laing R, Ford N. Drug development for neglected diseases: a deficient market and a public-health policy failure. The Lancet. 2002;359(9324):2188-2194. [ Links ]
38. Moreno RP. La investigación de la industria farmacéutica: ¿condicionada por los intereses del mercado? Acta Bioethica. 2011;17(2):237-246. [ Links ]
39. Ugalde A, Homedes N. Four words regarding clinical trials: science/profit, risks/benefits. Salud Colectiva. 2011;17(2):135-148. [ Links ]
40. Spellberg B, Martin B, Guidos RJ, Boucher HW, Bradley JS, Eisenstein BI, Gerding D, Lynfield R, Reller LB, Rex J, Schwartz D, Septimus E, Tenover FC, Gilbert DN. Combating antimicrobial resistance: policy recommendations to save lives. Clinical Infectious Disease. 2011;52(Suppl 5):S397-S428. [ Links ]
41. Temple R, Ellenberg SS. Placebo-controlled trials and active-control trials in the evaluation of new treatments. Part 1: Ethical and scientific issues. Annals of Internal Medicine. 2000;133(6):455-463. [ Links ]
42. Miller FG, Brod H. What makes placebo-controlled trials unethical? The American Journal of Bioethics. 2002;2(2):3-9. [ Links ]
43. Katz KA, Karlawish JH, Chiang DS, Bognet RA, Propert KJ, Margolis DJ. Prevalence and factors associated with use of placebo control groups in randomized controlled trials in psoriasis: A cross-sectional study. Jounal of the American Academy of Dermatology. 2006;5(5):814-822. [ Links ]
44. Scott D, Halpern BS, Jason HT, Karlawish MD. Placebo-controlled trials are unethical in clinical hypertension research. Archives of Internal Medicine. 2000;160(20):3167-3168. [ Links ]
45. Jordão CE, Mêdola PR, Luciane LC, Rosalen PL. Uso de placebo em experimentos clínicos envolvendo seres humanos no Brasil. Revista de Direito Sanitário. 2008;9(2):31-46. [ Links ]
46. Kottow M. De Helsinki a Fortaleza: una Declaración desangrada. Revista Bioética. 2014;22(1):28-33. [ Links ]
47. Lurie P, Wolfe SM. Unethical trials of interventions to reduce perinatal transmission of the human immunodeficiency virus in developing countries. New England Journal of Medicine. 1997;337(12):853-856. [ Links ]
48. Angell M. The ethics of clinical research in the Third World. [Editorials]. New England Journal of Medicine. 1997;337(12):847-849. [ Links ]
49. Macklin R. Double standard in multinational research. En: Porto D, Schlemper Junior BR, Martins GZ, Dutra T, Hellmann F. Bioética: saúde, pesquisa, educação. Brasília: CFM, SBB; 2014. [ Links ]
50. Mayor S. Half of drug trials with results on ClinicalTrials.gov are not published in journals. BMJ. 2013;347:f7219. [ Links ]
51. Kottow M. El uso de placebos en estudios clínicos y comunitarios: consideraciones éticas. Cuadernos Médico Sociales (Chile). 2009;4(2):94-100. [ Links ]
52. Cabral MML, Schindler HC, Abath FGC. Regulamentações, conflitos e ética da pesquisa médica em países em desenvolvimento. Revista de Saúde Pública. 2006;40(3):521-527. [ Links ]
53. Verástegui Avilés E, Valdez-Martínez E. Regulación y ética de los ensayos clínicos en México. En: Homedes N, Ugalde A, coordinadores. Ética y ensayos clínicos en América Latina. Buenos Aires: Lugar Editorial; 2012. [ Links ]
54. Beauchamp TL, Childress JF. Princípios de ética biomédica. São Paulo: Edições Loyola; 2002. [ Links ]
55. Brasil, Ministério da Saúde, Conselho Nacional de Saúde. Resolução CNS Nº 466, de 12 de dezembro de 2012 [Internet]. 2012 [citado 10 sep 2014]. Disponible en: http://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf. [ Links ]
56. Sociedade Brasileira de Bioética. Moção a respeito da Declaração de Helsinque, de 26 de setembro de 2013 [Internet]. 2013 [citado 10 sep 2014]. Disponible en: http://www.sbbioetica.org.br/noticia/mocao-da-sbb-a-respeito-da-revisao-da-declaracao-de-helsinque-2013/. [ Links ]
57. Confederación Médica Latinoamericana y del Caribe (CONFEMEL). [Internet]. 2014 [citado 18 jul 2014]. Disponible en: www.confemel.com/. [ Links ]
58. Confederación Médica Latinoamericana y del Caribe (CONFEMEL). Declaración de Bogotá sobre investigación médica en seres humanos [Internet]. 2012 [citado 18 jul 2014]. Disponible en: http://www.confemel.com/asambleas/xvaao/declaracion_bogota.pdf. [ Links ]
59. Confederación Médica Latinoamericana y del Caribe (CONFEMEL). Declaración de Pachuca 2013 [Internet]. 2013 [citado 18 jun 2014]. Disponible en: http://www.confemel.com/asambleas/xviaao/declaracion_helsinki.pdf. [ Links ]
60. Califf RM, Zarin DA, Kramer JM, Sherman RE, Aberle LH, Tasneem A. Characteristics of clinical trials registered in ClinicalTrials.gov, 2007-2010. JAMA. 2012;307(17):1838-1847. [ Links ]
61. Zarin DA, Tse T, Ide NC. Trial registration at ClinicalTrials.gov between May and October 2005. New England Journal of Medicine. 2005;353(26):2779-2787. [ Links ]
62. Viergever RF, Ghersi D. The quality of registration of clinical trials. Plos ONE. 2011;6(2):1-8. [ Links ]
63. Homedes N, Ugalde A. La globalización de la investigación clínica en América Latina. En: Homedes N, Ugalde A, coordinadores. Ética y ensayos clínicos en América Latina. Buenos Aires: Lugar Editorial; 2012. [ Links ]














