INTRODUCCIÓN
El precio exorbitante de muchos tratamientos novedosos lleva a preguntarse si los países de bajos y medianos ingresos podrán acceder a ellos1. El asunto se vuelve aún más perturbador si consideramos que un número creciente de ensayos pivotales[a] se realizan en países en los cuales los pacientes se reclutan y se retienen más fácilmente2,3, lo que agiliza la finalización de los ensayos clínicos. Los ensayos más breves permiten a la industria farmacéutica acelerar la aprobación de la comercialización de las nuevas entidades moleculares (NEM) y maximizar los beneficios que acumulan durante su periodo de exclusividad en el mercado4. La incapacidad de reclutar suficientes participantes en países de altos ingresos5 y las pocas trabas regulatorias en países de bajos y medianos ingresos refuerzan esta tendencia.
Se han examinado muy poco las consecuencias que la ejecución de ensayos clínicos tiene para la disponibilidad y el uso seguro y apropiado de medicamentos, y para los presupuestos de salud privados y públicos de los países anfitriones. Las declaraciones éticas internacionales requieren que las NEM aprobadas estén disponibles para las poblaciones en las que fueron probadas6. Las agencias reguladoras latinoamericanas basan sus decisiones de comercialización en las acciones realizadas por sus pares en "países de alta vigilancia" (EE.UU., Japón, Australia, países seleccionados de Europa, y la Agencia Europea de Medicamentos).
Adicionalmente, pacientes y grupos de pacientes en América Latina han utilizado el sistema judicial para ejercer su derecho constitucional a la salud, incluyendo el acceso a productos farmacéuticos nuevos y costosos. Vargas-Pélaez et al.7 realizaron un estudio de revisión sobre artículos científicos que abordaran la judicialización para el acceso a medicamentos y servicios de salud. Identificaron 65 artículos, de los cuales el 80% involucraba a un país latinoamericano (el 68% a Brasil, el 9% a Colombia y el 3% a Argentina). Los autores latinoamericanos citados en su estudio mencionan que, en algunos casos, las cortes tomaron decisiones sin considerar la evidencia sobre la eficacia y seguridad del medicamento o la idoneidad del tratamiento para un paciente en particular, posiblemente poniendo al demandante en riesgo de padecer efectos adversos y de utilizar de forma inapropiada el medicamento. Aún más, algunos autores aseguran que la industria farmacéutica se interesó por promocionar el acceso a los medicamentos a través de la justicia porque de ese modo podrían lograr la inclusión en los formularios públicos de los medicamentos más caros que solo tienen utilidad para un número reducido de pacientes, lo que aumenta innecesariamente el gasto de medicamentos de los servicios públicos de salud.
En otras palabras, las condiciones jurídicas, éticas y regulatorias actuales han facilitado que algunas NEM estén disponibles en los países donde fueron probadas, por lo que son estos países los que tienen que cubrir sus costos, más allá del perfil de seguridad que presenten y de que ofrezcan o no alguna ventaja sobre los tratamientos más económicos ya existentes. Aunque la magnitud del impacto financiero es diferente en cada país, y en parte depende de los precios de venta de las NEM en cada lugar, la cobertura pública de estas NEM nuevas y costosas tensionará los presupuestos públicos de medicamentos.
Las consecuencias de realizar los ensayos clínicos en países de menores ingresos y tercerizar así la investigación han quedado por fuera del radar de los investigadores, posiblemente porque se presupone que las agencias reguladoras de "países de alta vigilancia sanitaria" solo permiten la comercialización de productos que son seguros y eficaces y, en términos ideales, lo que está disponible para los residentes de países de altos ingresos debería estar disponible también para los residentes de países menos prósperos, especialmente si estos últimos contribuyeron al desarrollo de los medicamentos.
Con base en la información de precios y valores de las NEM aprobadas por la US Food and Drug Adminsitration (FDA) en 2011 y 2012 y que fueron testeadas en América Latina, este artículo analiza algunas de las consecuencias sanitarias, financieras y éticas de la tercerización de ensayos clínicos a países de la región[b].
El artículo explora las siguientes preguntas: 1) ¿Las NEM aprobadas por la FDA en 2011 y 2012 están disponibles en los países en los que se realizaron los ensayos pivotales? 2) Si las NEM están registradas ¿están disponibles a precios accesibles? 3) ¿Estas NEM añaden valor terapéutico a los tratamientos existentes, según se informa en los boletines independientes de medicamentos? Se discuten, además, las implicancias de la realización de ensayos clínicos para los mercados farmacéuticos nacionales y para los latinoamericanos que participan en los ensayos clínicos teniendo en cuenta el contexto regulatorio y ético, y la judicialización del acceso a los medicamentos.
METODOLOGÍA
Se realizó un estudio transversal. Se obtuvo el listado de las NEM aprobadas por la FDA en 2011 y 2012 a través de sus publicaciones11,12. Si bien gadobutrol (Gadovist(r)) fue aprobado durante el periodo de estudio, fue excluido de este trabajo por tratarse de un líquido de contraste utilizado en radiología y no de un tratamiento farmacológico. Las revisiones médicas de la FDA, incluidas en el historial de aprobación de estas NEM, mencionan los países en los cuales fueron realizados los ensayos. En el caso de que esta información no estuviera disponible en las revisiones médicas, se obtuvo de los patrocinadores de los ensayos. Los historiales de aprobación de los medicamentos se encuentran disponibles en el portal Drugs@FDA13.
Situación regulatoria y de comercialización de las nuevas entidades moleculares
Para conocer la situación regulatoria de las NEM de cada país, buscamos en los registros farmacéuticos, cuya información varía según cada país. Brasil, Chile y Colombia mantienen un registro de medicamentos aprobados; Argentina tiene un registro de productos comercializados; México publica un listado de los productos aprobados por periodo y Perú cataloga productos disponibles en farmacias. En la Tabla 1 se muestra una lista de las páginas web consultadas. Para los países sin registros o con listados incompletos (Costa Rica, Ecuador, Panamá, Perú, Uruguay), nos comunicamos con las agencias reguladoras. Todos los intentos de comunicación con las entidades reguladoras de República Dominicana y Venezuela fracasaron. A partir de la información de las páginas web de las compañías farmacéuticas, contactamos a sus sedes centrales en EE.UU. para recolectar información sobre el estado de comercialización de sus productos en los países seleccionados.
Tabla 1 Bases de datos consultadas para obtener el estado de registro de los medicamentos probados y el precio de los productos farmacéuticos, según país e institución.

Fuente - Elaboración propia a partir de datos de Argentina14,15; Brasil16,17; Colombia18,19,20; Chile21,22; México23,24 y Perú25,26.
El precio de las nuevas entidades moleculares
En América Latina, alrededor del 78% de los medicamentos se pagan en forma particular en farmacias27. Ya que los productos de interés no fueron incluidos en la base de datos de precios de medicamentos de la World Health Organization y Health Action International (WHO-HAI), obtuvimos el precio de la dosis unitaria de cada producto de los observatorios de cada país, que informan el precio máximo al consumidor (Brasil, México) o los precios de consumo observados (Argentina, Chile, Colombia, Ecuador, Perú) (Tabla 1).
Los precios al consumidor en Costa Rica -país en el que no hay un observatorio de precios- y de los productos argentinos no monitoreados por el observatorio fueron provistos por expertos en farmacología quienes los obtuvieron a través de distribuidores locales. Se calcularon las cantidades necesarias para completar un ciclo o un año de tratamiento utilizando las etiquetas aprobadas por la FDA. Se recolectó la información de precio entre el 25 de agosto y el 20 de septiembre de 2014.
Medición de accesibilidad económica
Se midió la riqueza a través de: 1) el salario mínimo mensual en 2014, según declaraciones públicas en los medios; 2) el ingreso mensual per cápita, según la base de datos de Producto Bruto Interno (PBI) per cápita del Banco Mundial28; 3) el ingreso mensual familiar disponible neto ajustado29 y 4) el patrimonio financiero familiar mensual según la Organización para la Cooperación y el Desarrollo Económicos (OECD)30, disponible solo para 2011 en los casos de Brasil, Chile y México (Tabla 2).
Tabla 2 Salario mínimo mensual, ingreso mensual per cápita, ingreso mensual familiar disponible neto ajustado y patrimonio familiar mensual (en dólares estadounidenses), según país.
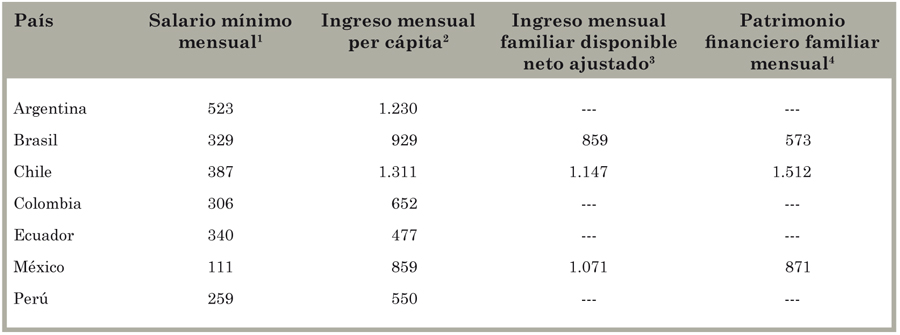
Fuente: Homedes y Ugalde8. --- Dato no disponible a la fecha de realización del estudio. 1El salario mínimo mensual de cada país se obtuvo de declaraciones públicas en los medios. Para Argentina, el salario mínimo mensual corresponde a septiembre de 2014; para Brasil y Chile, julio de 2014; para Colombia, Ecuador y México, enero de 2014; para Perú, junio de 2012. Se convirtieron las monedas locales a dólares según el valor de cambio oficial el 1 de septiembre de 2014. 2El ingreso mensual per cápita proviene de la base de datos del Banco Mundial28, ajustado por los autores al valor de la mediana para el 2013. 3El ingreso mensual familiar disponible neto ajustado corresponde al año 2011, y fue tomado en el año 2014 del índice para una vida mejor de la Organización para la Cooperación y Desarrollo Económicos29. Se define como "la cantidad de dinero que una familia percibe o gana cada año después del pago de impuestos. Representa el dinero del que dispone una familia para gastar en bienes o servicios"30. 4El patrimonio financiero familiar mensual corresponde al año 2011, y fue tomado en el año 2014 del índice para una vida mejor de la Organización para la Cooperación y Desarrollo Económicos29. Se define como "el monto total de los valores financieros que posee una familia, o la suma de todos sus activos financieros menos sus pasivos. El patrimonio financiero toma en cuenta los ahorros, el oro, dinero en efectivo y depósitos, acciones, valores y créditos"30.
Estas medidas presentan varias limitaciones, debido a las múltiples aristas que presentan las dificultades para medir ingresos y patrimonio individuales y familiares utilizando datos agregados:
La distribución de ingresos es muy desigual en la mayoría de los países. Como se puede visualizar en la Tabla 3, el índice de Gini pone en evidencia una gran acumulación de riqueza y muestra que para casi la totalidad de los países, salvo Argentina y Venezuela, el 10% más rico recibe más del 35% del PBI.
Las actividades no-monetarizadas, que son altamente prevalentes en América Latina, solo se pueden estimar. Los giros enviados a través de canales informales en algunos países como México y Ecuador son significativos, pero no se pueden conocer con precisión.
Los ingresos generados a través de actividades ilegales como el contrabando, las drogas o la prostitución no se toman en cuenta cuando se estima el PBI de un país.
Un número importante de jefes y jefas de hogar no cobra mensualmente y tiene dificultades para calcular su ingreso anual. Frecuentemente los trabajadores agrícolas y los que trabajan en el sector informal no perciben el salario mínimo.
Las bases de datos de organizaciones internacionales convierten las monedas locales en dólares en un momento dado, el cual no corresponde con el momento de compra del medicamento, y el tipo de cambio puede variar de forma significativa a lo largo del año. Algunas monedas son relativamente estables, como es el caso de México, o de Ecuador, cuya moneda oficial es el dólar estadounidense; pero otras, por ejemplo el real brasileño, fluctuó en casi un 9% con respecto al dólar, y el peso argentino también ha sufrido depreciaciones severas. Otro problema se relaciona con el valor de la moneda. El valor oficial y el valor real no son siempre equivalentes y, en algunos casos, la diferencia puede ser grande. Durante los años de nuestro análisis, el valor real del peso argentino (en el mercado negro) estaba por encima del oficial en aproximadamente un 40%.
Tabla 3 Índice de Gini y distribución de ingreso familiar entre los deciles más altos y más bajos, según país.

Fuente - Homedes y Ugalde8. 1Los datos corresponden a los siguientes años: Argentina, 2010; Brasil, 2008; Chile, 2009; Colombia, 2010; Costa Rica, 2009; República Dominicana, 2010; Ecuador, 2010; México, 2010; Panamá, 2010; Perú, 2010; Uruguay, 2010; Venezuela, 2006. Según se aclara en la base: "los datos provienen de encuestas a hogares, con los resultados ajustados por tamaño familiar. Los países usan estándares y procedimientos diferentes para recolectar y ajustar la información. Las encuestas sobre ingresos generalmente muestran una distribución más desigual que encuestas sobre consumo. La calidad de las encuestas va mejorando con el tiempo, pero es necesario tener precaución en las comparaciones entre países"31. 2Los datos de la Central Intelligence Agency (CIA)31 corresponden a los siguientes años: Argentina, 2009; Brasil, 2012; Chile, 2009; Colombia, 2010; Costa Rica, 2008; República Dominicana, 2010; Ecuador, 2013; México, 2008; Panamá, 2010; Perú, 2010; Uruguay, 2010; Venezuela, 2011. 3Información del Banco Mundial (BM) disponible para el año 2012 para todos los países, salvo Argentina y Chile que corresponde a 2011. Los datos del Banco Mundial "se basan en datos primarios obtenidos de encuestas de hogares de los organismos de estadística del gobierno y los departamentos de país del Banco Mundial"32. Para más información y especificación, ver la metodología utilizada por el Banco Mundial33.
Por otro lado, podemos señalar problemas relacionados con la definición de los hogares y las estimaciones del número de personas e ingresos. Como bien saben los antropólogos, el concepto de hogar/familia no está tan definido como muchos suelen pensar. Estudios sobre barrios marginales, donde vive un gran número de latinoamericanos, muestran conformaciones familiares variadas. Podemos hablar de familias de sangre, familias por compadrazgo, y hogares de dos o más personas o familias sin relación conviviendo bajo el mismo techo, que comparten algunos gastos y en las que cuesta especificar el aporte de cada una. Hemos observado que, cuando se realiza una encuesta de hogares, los encuestados tienen dificultades para contestar las preguntas sobre el número de personas que viven en el hogar. Hay migrantes que van y vienen y pueden tener dos lugares de residencia sin definir cuál es la primaria. La doble nacionalidad es común, con cantidades significativas en varios países (Argentina, Bolivia, Ecuador y México), por lo que los migrantes pueden no estar incluidos en los censos nacionales. Es difícil para los encuestadores de los censos resolver esta compleja realidad, por ello las cifras oficiales sobre el número de personas por hogar podrían no ser correctas. Estas incertezas influyen en la calidad de los datos disponibles sobre ingreso familiar, proporcionados por organismos nacionales e internacionales. Por su parte, las familias por compadrazgo, son muy comunes en América Latina. Los padrinos y las madrinas pueden no vivir en el hogar pero, de ser necesario, aportan fondos adicionales, lo que podría impactar en los ingresos.
Niëns y Brouwer analizan los desafíos de recolectar información sobre medicamentos e ingresos y de determinar los umbrales de accesibilidad económica34. Niëns et al. sostienen que un umbral del 25% de los gastos totales para la compra de medicamentos los clasificaría como inaccesibles en países como India e Indonesia35. O'Donnell et al. consideran que los gastos en salud que superan el 10% de los ingresos familiares anuales resultan exorbitantes36.
En este estudio, la accesibilidad económica de cada ciclo de tratamiento de un medicamento se establece en relación con el ingreso per cápita o el patrimonio/ingreso familiar mensual, que es equivalente al 8,3% del ingreso anual. El hecho de que el precio calculado resulte desmedido o accesible depende de la situación socioeconómica particular a nivel individual o del hogar. Dadas las grandes desigualdades de la región (Tabla 3), el uso del promedio de ingreso sobreestimará el poder de compra de las personas de los deciles más bajos.
Evaluación del valor terapéutico de las nuevas entidades moleculares
Se consultaron las bases de datos de dos reconocidos boletines independientes de medicamentos -Revue Prescrire de la organización francesa Prescrire, y Worst Pills, Best Pills del Health Research Group de la organización estadounidense Public Citizen- para determinar el valor terapéutico agregado de las NEM con respecto a los tratamientos existentes. Estos informes incorporan información sobre seguridad y Prescrire frecuentemente incluye información de otros boletines. En total, tenemos información de 15 boletines farmacológicos independientes de 11 países. Se utilizó información de Fojo et al.37 para evaluar el valor terapéutico de los nuevos tratamientos de cáncer.
RESULTADOS
Registro y disponibilidad
Los 33 productos incluidos en este estudio se muestran en el Tabla 4. Fue difícil obtener información sobre la comercialización de cada producto de las compañías farmacéuticas. Las sedes centrales de algunas empresas respondieron rápidamente (Vertex, Exelixis, GSK, BMS, Sanofi, AstraZeneca), mientras que otras nos derivaron a sus subsidiarias en América Latina o a las empresas responsables de la comercialización de sus productos por fuera de EE.UU. En varias ocasiones tuvimos que contactar a estas entidades repetidas veces. La precisión de la información provista dependía de la familiaridad del interlocutor con las prácticas y las bases de datos de la empresa. Dos compañías proveyeron información contradictoria, y una nos derivaba con idas y venidas entre la empresa innovadora y la titular de la licencia. Con pocas excepciones (Pfizer Brasil, Colombia y México; Janssen Argentina; Novartis Argentina y Colombia; Takeda-Brasil, y Boehringer-México), las oficinas latinoamericanas se mostraron menos dispuestas a compartir información que los representantes de las sedes centrales en EE.UU. El vicepresidente de una de las empresas escribió: "En respuesta a su pregunta, tenemos la política de restringir la divulgación de información/estrategias de negocio propias en caso de que no exista una relación comercial formal protegida por un acuerdo de confidencialidad" (traducción propia de la comunicación del 5 de septiembre de 2014).
Tabla 4 Productos aprobados por la Food and Drug Administration de EE.UU. en 2011 y 2012, que fueron probados a través de ensayos pivotales en países de América Latina.
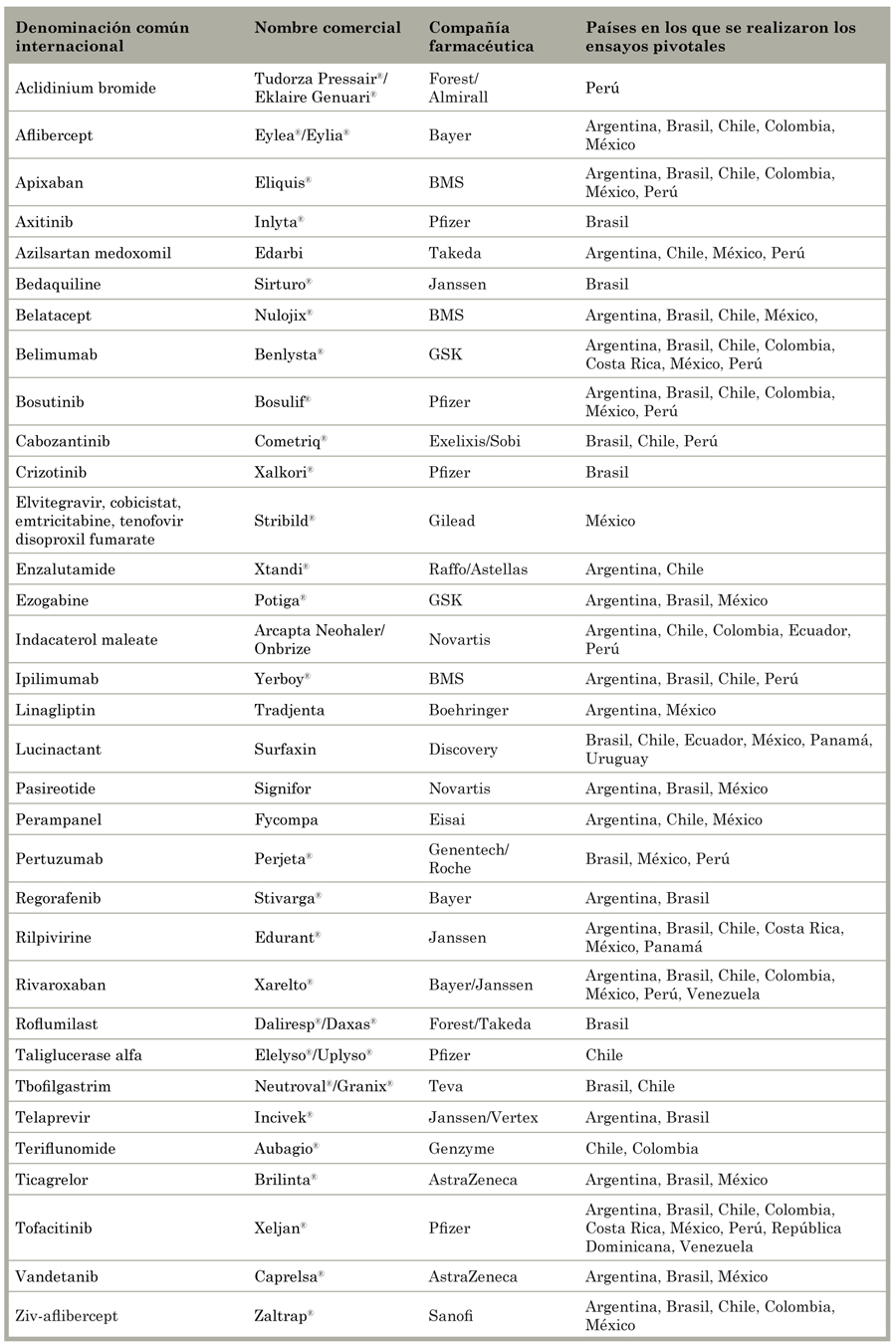
Algunas de las imprecisiones de la industria se pudieron solucionar utilizando información sobre el estado de registro y el precio de los medicamentos. Por ejemplo, se llegó a la conclusión de que bosutinib no estaba comercializado en Argentina y Perú ya que no estaba incluido en la lista de productos comercializados (Argentina) o en el catálogo de productos disponibles en farmacias (Perú), y la información del precio no estaba disponible en ninguno de los dos países. De modo similar, la información del precio indicó que probablemente pertuzumab estuviera disponible en México, rivaroxaban en Colombia y México y ticagrelor en Argentina. En diez casos, fue imposible confirmar el estado de comercialización de las NEM: pasireotide en Brasil; rilpivirine en Argentina, Chile y México; pertuzumab en Perú; teriflunomide en Chile y México; tofacinitib en Costa Rica y Perú; y vandetanib en México.
La combinación de información sobre comercialización y disponibilidad indicó que diez de los 33 productos (30%) no se registraron ni se comercializaron en ninguno de los países en los cuales se habían testeado (aclidium bromide, axitinib, bedaquiline, bosutinib, carbozantinib, elvitegravir-cobicistat-emtricitabine-tenofovir disoproxil fumarate, lucinactant, perampanel, tbofilgastrim, ziv-aflibercept); ocho (25%) se registraron y se comercializaron en todos los países en los que fueron testeados (aflibercept, indacaterol maleate, ipilimumab, linagliptin, regorafenib, roflumilast, taliglucerase alfa, telaprevir); y dos se registraron pero no se comercializaron en ninguno de los países en los que fueron testeados (enzalutamide y ezogabine).
La Tabla 5 presenta el estado de aprobación y comercialización, en septiembre de 2014, de los productos incluidos en el estudio que se registraron y se comercializaron en algunos países pero en otros no (excluyendo las diez NEM que no se registraron en ningún país y las ocho que se comercializaron en todos los países en los que fueron probadas). Si los 33 productos se hubiesen registrado en todos los países en los que fueron probados, deberían haberse completado 121 registros; sin embargo, solo se completaron 67 registros (el 55%). El registro no llevó a la comercialización en al menos ocho casos, y no pudimos determinar el estado de comercialización de siete productos registrados. En total, confirmamos que el 42% de los productos probados se comercializaron en el país en que se realizó el estudio. En dos casos, en que las compañías farmacéuticas afirmaron que un producto estaba disponible, la agencia reguladora decía que no había sido aprobado.
Tabla 5 Estado de registro y comercialización, en septiembre 2014, de algunas de las nuevas entidades moleculares probadas en América Latina y aprobadas por la Food and Drug Administration de EE.UU. en 2011 y 2012, según país1.
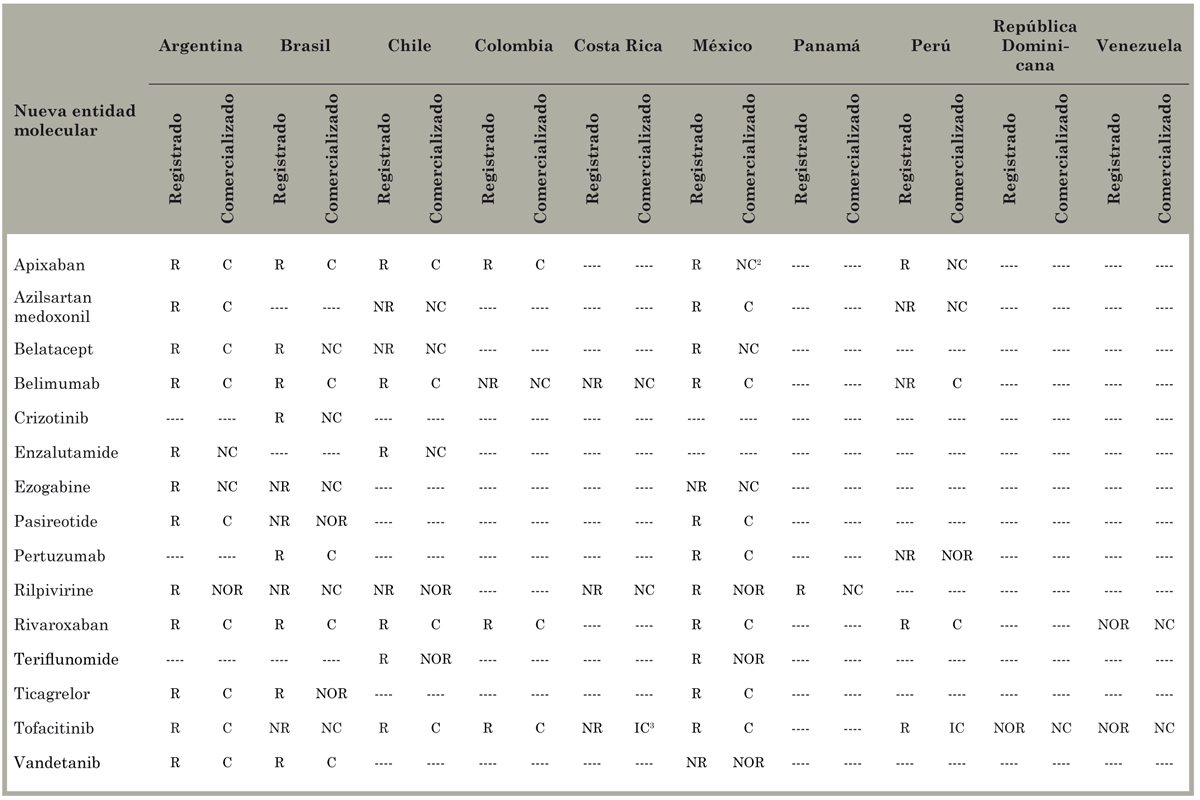
Fuente - Homedes y Ugalde8. R = Registrado; NR = No registrado; C = Comercializado; NC = No comercializado; NOR = No se obtuvo respuesta; IC = Información contradictoria. ---- No se realizaron ensayos clínicos de la nueva entidad molecular en el país. 1Esta tabla no incluye las ocho nuevas entidades moleculares que fueron registradas y comercializadas en todos los países en los que fueron probadas; tampoco incluye las diez que no fueron registradas ni comercializadas en ninguno de los países. 2La empresa BMS afirmó que apixaban no se había comercializado en México pero encontramos información de su precio. Podría ser que solo está disponible para casos especiales. 3La Caja Costarricense de Seguridad Social (CCSS), que ofrece servicios de salud incluyendo medicamentos gratuitos para el 90% de la población de Costa Rica, no lo compró y no está disponible en las principales farmacias.
Precios de las nuevas entidades moleculares en América Latina
En la Tabla 6 se presentan los precios de las 21 NEM comercializadas en América Latina, a excepción de tres, que no estaban disponibles. Los precios varían ampliamente entre países, tanto en términos absolutos como relativos. En Argentina se encontraron los precios absolutos más altos para muchos de los medicamentos del estudio (aflibercept, apixaban, belatacept, ipilimumab, pasireotide, telaprevir, ticagrelor, tofacitinib, vandetanib), siendo a veces el doble del valor del segundo precio más alto (aflibercept, belatacept, tofacitinib). En Brasil se encontraron los precios más bajos para apixaban, belatacept, pertuzumab, rivaroxaban y ticagrelor, pero el precio de belimumab era el doble del precio en Chile. Los precios de belimumab, indacaterol e ipilimumab eran más bajos en Chile; Colombia mostró el precio más bajo para aflibercept y tofacitinib y el más alto para rivaroxaban.
Tabla 6 Precio de los medicamentos comercializados según país donde fueron probados y según cantidad de salarios mensuales necesarios para cubrir un ciclo o un año de tratamiento de acuerdo al precio local (medido como salario mínimo mensual e ingreso mensual per cápita, en dólares estadounidenses). Países seleccionados de América Latina1.
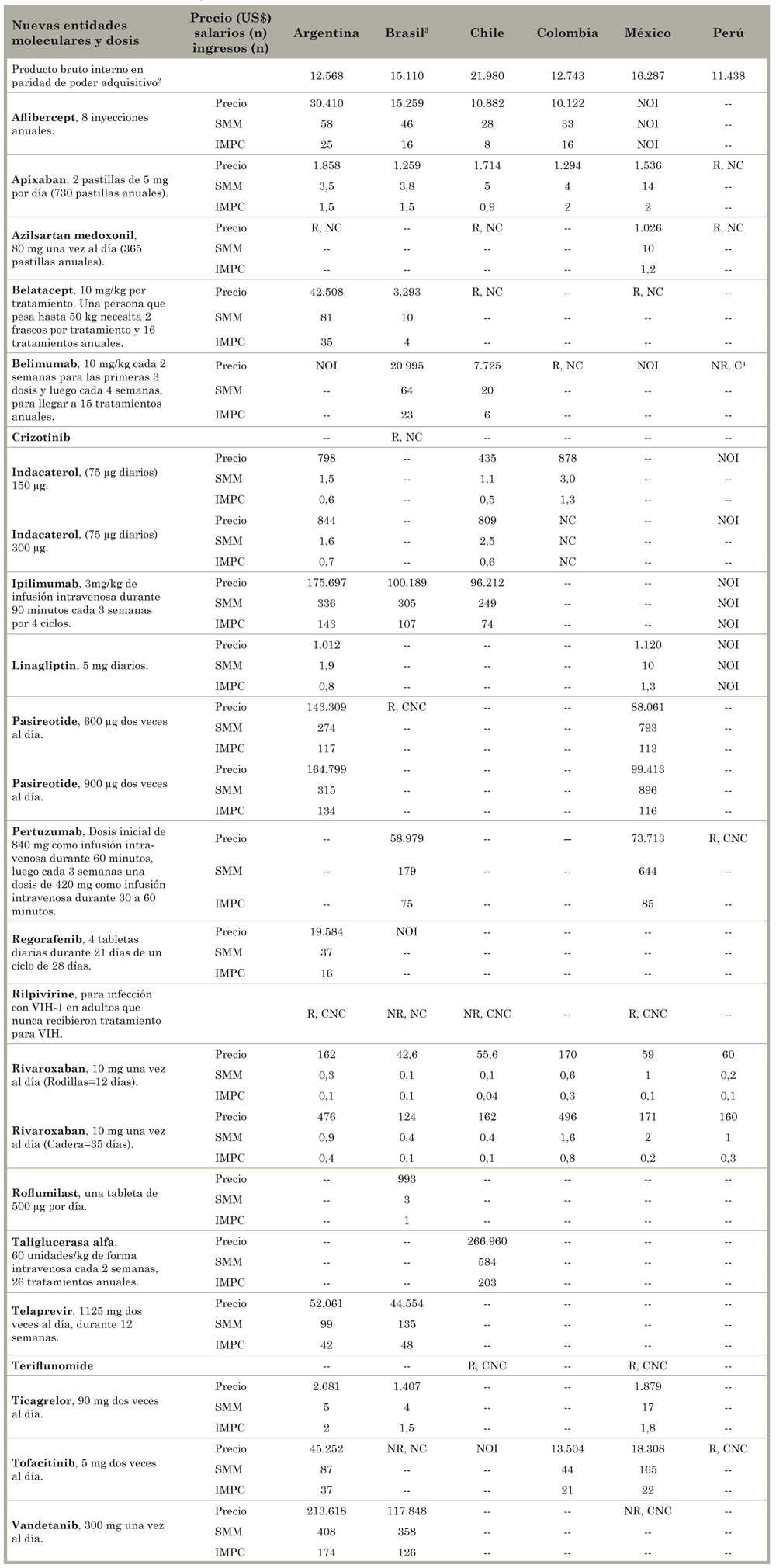
Fuente - Homedes y Ugalde9. SMM = Salario mínimo mensual; IMPC = Ingreso mensual per cápita; R = Registrado: NR = No registrado; C = Comercializado; NC = No comercializado; CNC = Comercialización no confirmada (no se pudo confirmar si el producto estaba disponible en el país); NOI = No se pudo obtener información. 1Los precios son para un ciclo completo de tratamiento o, en casos de enfermedades crónicas, para un año de tratamiento. Se redondearon los datos de salario mínimo mensual e ingreso mensual per cápita por encima de 3 meses. Las celdas sin información (--) indican que no se realizaron ensayos clínicos en el país o el producto no está disponible. En Ecuador, solo había información para indaceterol. Para simplificar la tabla no hemos incluido la información, pero está disponible a través de la autora de correspondencia. 2Información del Banco Mundial tomada en 2014. Toda la información de PBI se informa en paridad de poder adquisitivo, en dólares estadounidenses, con base en la metodología del Atlas utilizado por el Fondo Monetario Internacional y el Banco Mundial. El PBI per cápita de Argentina se basa en datos oficiales informados por el Instituto de Estadísticas y Censos de Argentina que no estima la paridad de poder adquisitivo. El Fondo Monetario Internacional ha pedido que Argentina adopte medidas para mejorar la calidad de datos oficiales de PBI y el índice de precios al consumidor. Para más información ver Banco Mundial38. 3En Brasil, ANVISA publica una lista de precios máximos al consumidor que no incluye impuestos. La tasa de impuestos varía según estado de 0% a 19%. Al precio de ANVISA se le incorporó la tasa máxima de impuestos. 4Disponible según GlaxoSmithKline.
En los países mencionados en la Tabla 6, no encontramos ninguna relación entre precios y PBI per cápita o salario mínimo. En Brasil, el aflibercept cuesta US$15.259 por ciclo de tratamiento; en Argentina, que tiene un PBI un poco más bajo que Brasil, el ciclo de tratamiento del mismo medicamento vale US$30.410. Los brasileros pagan 46 veces el salario mínimo y los argentinos 58 veces, de modo que el tratamiento es inaccesible económicamente en ambos países pero, especialmente, en Argentina. Si comparamos el aflibercept en Colombia y Chile -este último país tiene un PBI bastante más alto que el primero- si bien la droga es algo más económica en Colombia, allí los pacientes tienen que pagar el doble de salarios mínimos que en Chile. En el caso del indacaterol y el rivaroxaban, en Colombia cuestan el doble que en Chile. Muchas otras diferencias significativas pueden visualizarse en la Tabla 6.
La Tabla 7 indica el número de salarios mínimos mensuales (SMM) necesarios para comprar un ciclo de tratamiento o, en el caso de condiciones crónicas, un año de tratamiento. En todos los países, el precio de todos los productos, salvo uno, fue mayor a un SMM. Cinco medicamentos requerían más de uno y hasta cuatro SMM, y seis NEM (39%) costaban entre 100 y 896 SMM. Medido en relación con el ingreso mensual per cápita (IMPC), los argentinos y los chilenos podían comprar tres productos con menos de un IMPC, y los brasileños uno (Tabla 8). Un producto (rivaroxaban) costaba menos que un IMPC en todos los países, pero cuatro productos (dos para el cáncer) valían más de 100 IMPC.
Tabla 7 Número de salarios mínimos mensuales (SMM) necesarios para comprar un ciclo o un año de tratamiento con las nuevas entidades moleculares probadas en América Latina en 2011 y 2012.
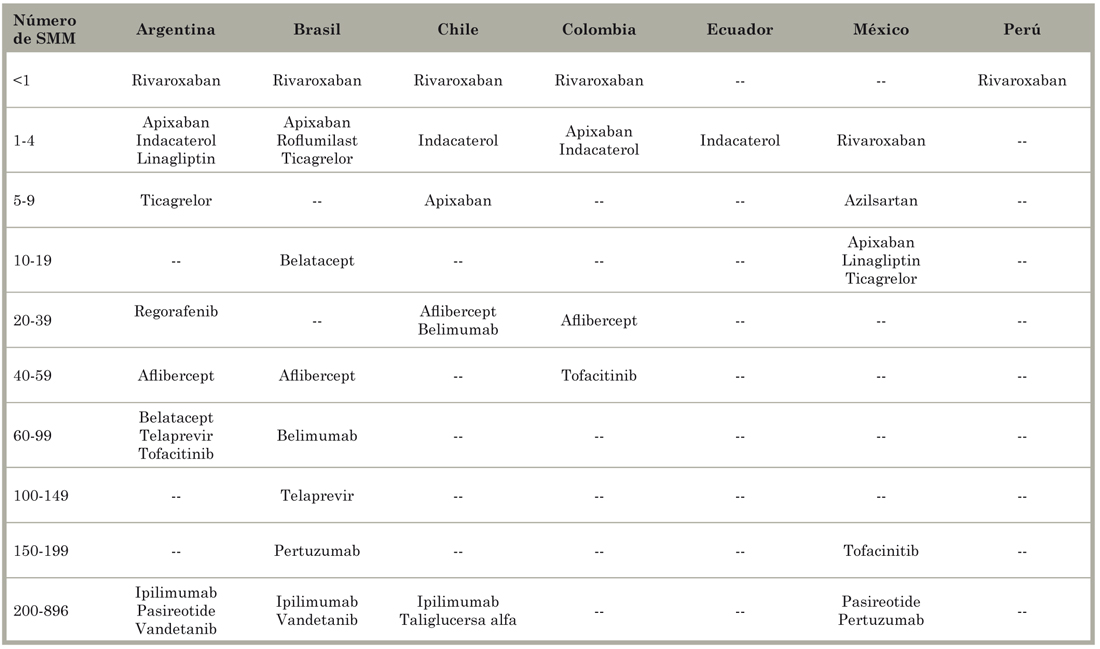
Fuente - Elaboración propia a partir de Homedes y Ugalde9.
Tabla 8 Número de ingresos mensuales per cápita (IMPC) necesarios para comprar nuevas entidades moleculares probadas en países de América Latina en 2011 y 2012.
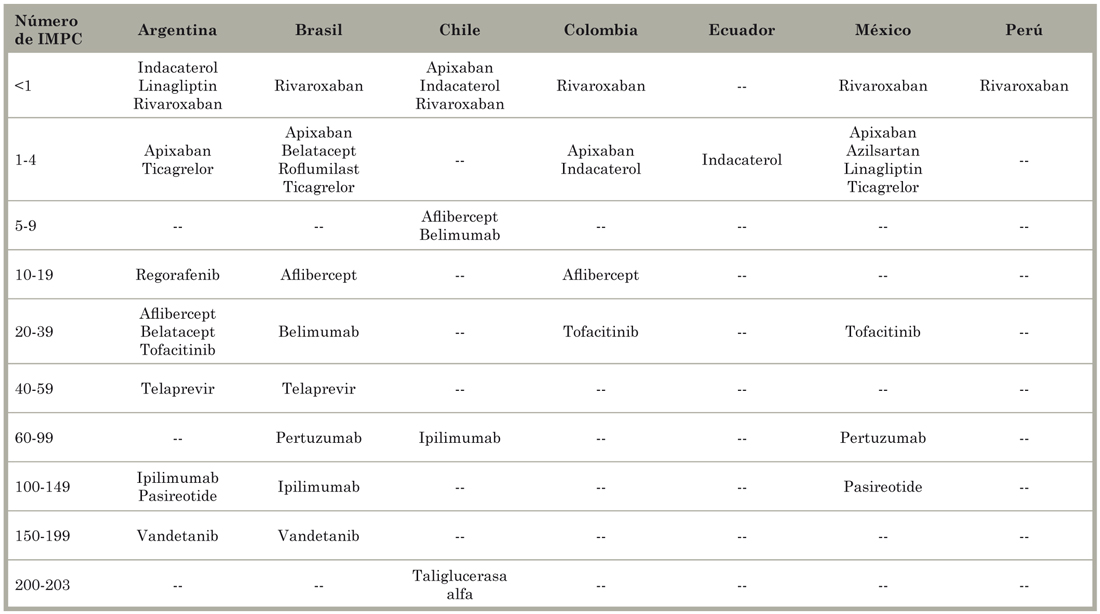
Fuente - Elaboración propia a partir de Homedes y Ugalde9.
Los resultados basados en el ingreso mensual familiar disponible neto ajustado y patrimonio familiar mensual fueron muy similares a los de IMPC. Las comparaciones entre SMM e IMPC en los países latinoamericanos que alojaron el 85% de los ensayos clínicos de la región se muestran en la Tabla 6. La hipótesis de que la gran mayoría de la población no puede acceder a los medicamentos probados en sus países debido a su precio se confirma inequívocamente.
Las ventajas terapéuticas de las nuevas entidades moleculares
Prescrire y Health Research Group evaluaron 26 de las 33 NEM incluidas en el estudio, y determinaron que 21 de las 26 (80%) no ofrecieron ventaja terapéutica sobre los tratamientos existentes y tuvieron efectos secundarios significativos, por lo que aconsejaron no utilizar diez de ellas (Tabla 9). Según estas fuentes y los boletines independientes citados por Prescrire, los restantes cinco productos (crizotinib, enzalutamide, ipilimumab, pasireotide y telaprevir) podrían ofrecer alguna ventaja para algún subconjunto de pacientes, pero la razón costo-beneficio permanece incierta. Solo tres de estos cinco productos estaban disponibles en los países donde fueron testeados.
Tabla 9 Resumen de las evaluaciones realizadas por boletines independientes de medicamentos de las nuevas entidades moleculares probadas en países de América Latina y aprobadas por la Food and Drug Administration de EE.UU. en 2011 y 2012.

Fuente - Homedes y Ugalde9; Pescrire39,40,41; Public Citizen42; Prescrire43,44,45,46,47,48,49,50; Public Citizen51; Prescrire52,53; Public Citizen54; Prescrire55,56,57,58,59,60,61,62,63,64,65,66,67. Nota: Ni Prescrire ni el Health Research Group de Public Citizen habían evaluado azilsartan medoxomil, taliglucerasa alfa, tofacitinib, cabozantinib, ezogabine, lucinactant o tbo-filgrastim.
Ocho de los 33 productos incluidos en nuestro estudio (25%) fueron incorporados en la evaluación de Fojo et al.37. Solo uno (enzalutamide) aumentó la supervivencia significativamente (por 4,8 meses) en pacientes con cáncer de próstata resistente a la castración, cuatro aumentaron el periodo de supervivencia libre de progresión (vandetanib, pertuzumab, carbozantinib, crizotinib), dos NEM no cumplieron con los criterios de la American Society of Clinical Oncology para determinar relevancia clínica (ziv-aflibercept, regorafenib), y los autores tuvieron dudas sobre ipilimumab (Tabla 10).
Tabla 10 Eficacia de tratamientos oncológicos aprobados por la Food and Drug Administration de EE.UU. en 2011 y 2012 y probadas en países de América Latina.
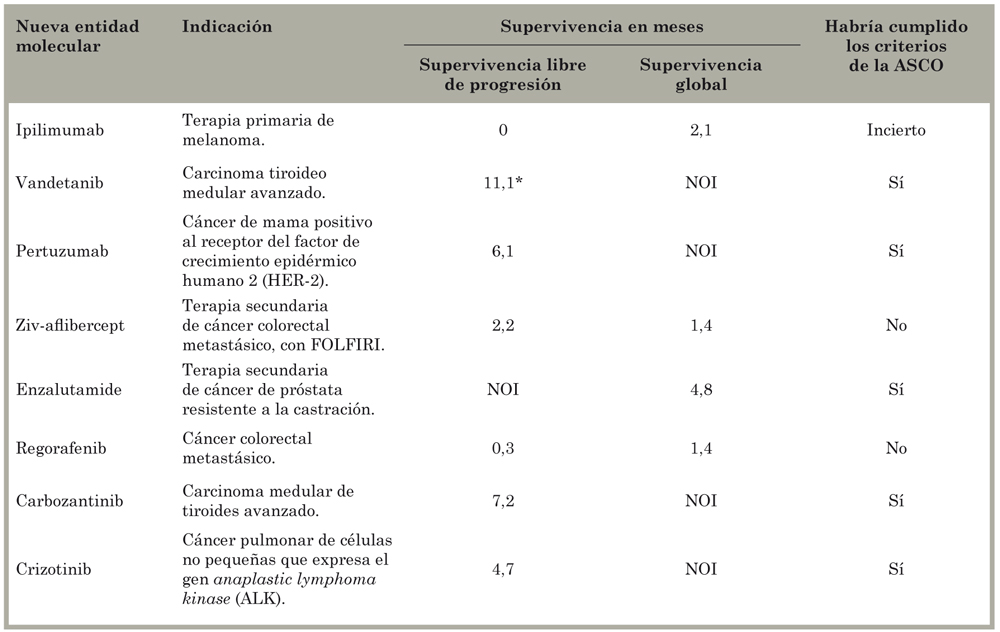
Fuente - Elaboración propia a partir de información de los autores de Fojo et al.37. *Estimado. NOI = No se pudo obtener información. ASCO = American Society of Clinical Oncology.
En contraste con la metodología utilizada por los boletines independientes mencionados anteriormente, Fojo et al.37) evaluaron el valor de cada NEM sin compararlas con otras opciones terapéuticas existentes. Dos NEM calificadas como útiles en su publicación (vandetanib y pertuzumab) fueron cuestionadas por los boletines independientes de medicamentos. Se consideró a vandetanib más peligroso que útil, y se juzgó tener insuficiente información sobre la relación beneficio-riesgo de pertuzumab. Mientras Australian Prescriber y Medical Letter estimaron que parecía aumentar la supervivencia sin empeorar la situación de mujeres positivas al receptor del factor de crecimiento epidérmico humano 2 (HER 2) con metástasis de cáncer de mama, Medical Letter no consideró que se había determinado el efecto en la supervivencia global y otros informaron un aumento de efectos secundarios, con beneficios inciertos e insuficiente información para recomendar su comercialización. Con un precio de más de US$50.000 (pertuzumab) y US$100.000 (vandetanib) por tratamiento en Brasil y de US$200.000 en Argentina (vandetanib), estas NEM no son económicamente accesibles.
DISCUSIÓN
La industria farmacéutica afirma que la implementación de ensayos clínicos en América Latina fortalece la capacidad investigativa en las ciencias biomédicas y constituye una fuente importante de divisas para la región68. Sin embargo, también presenta consecuencias negativas para la sustentabilidad financiera y la seguridad del mercado farmacéutico, así como para el bienestar de los participantes en las investigaciones.
Sustentabilidad y seguridad del mercado farmacéutico
Parece haber poca comunicación entre las unidades de investigación y desarrollo de las empresas farmacéuticas y sus responsables de comercialización de los productos finales. Los ensayos clínicos se tercerizan cuando los países cumplen con ciertos requisitos del patrocinador o de la organización de investigación por contrato que maneja el ensayo como, por ejemplo, la aprobación expeditiva de protocolos, contar con grandes centros urbanos con hospitales de buena calidad y una abundante cantidad de pacientes fáciles de reclutar4. Por otro lado, el registro y la comercialización de productos nuevos son decisiones basadas en las condiciones regulatorias de un país, la presencia de socios empresariales, la voluntad del sistema público de salud de incluir un producto en su listado de medicamentos, el número de pacientes que pueden afrontar el costo del tratamiento y las estimaciones de la rentabilidad del medicamento para la empresa.
Las agencias reguladoras latinoamericanas no rechazan autorizaciones de comercialización cuando el producto ya ha sido comercializado en países de alta vigilancia. El hecho de que la FDA y la Agencia Europea de Medicamentos69,70,71,72,73,74,75,76,77) suelen aprobar NEM sin asegurarse de que sean más eficaces y/o más seguras que los tratamientos existentes78 se traduce en la presencia de los mismos productos en América Latina, más allá de cómo afecten la sustentabilidad financiera y la seguridad de los mercados correspondientes. Asimismo, los lineamientos éticos de Brasil exigen que todos los medicamentos testeados en el país se registren cuando hayan demostrado ser seguros y eficaces. Según la Resolução 446 de 2012 emitida por el Conselho Nacional de Saúde, "en el caso del desarrollo de nuevas drogas, una vez comprobadas su seguridad y eficacia, es obligatorio su registro en Brasil"79. Sin embargo, al parecer ANVISA no está cumpliendo dicha regulación.
Como se ha demostrado, el precio de los productos comercializados es inaccesible para la gran mayoría de la población latinoamericana. Por definición, la inaccesibilidad económica implica que una persona o una familia no puede redistribuir recursos para obtener el producto. Esto también se está convirtiendo en un problema para los países de altos ingresos. Los médicos y las autoridades de salud en EE.UU. y el Reino Unido son reticentes a recetar y pagar medicamentos costosos que ofrecen pocas ventajas en comparación con alternativas más económicas con perfiles de seguridad y eficacia más conocidos80,81,82,83.
Los precios de los medicamentos no se relacionan con los costos de desarrollo de un producto84,85) y nuestros datos indican que los productores de medicamentos no están cumpliendo con las recomendaciones de la OMS de establecer precios según la riqueza del país o un sistema de niveles de precios86. No hemos identificado artículos que aborden los diferenciales de precio entre países limítrofes de América Latina. Es necesario comprender mejor la razón por la cual el mismo medicamento representa una carga económica superior para los argentinos que para los brasileños, mexicanos o para los residentes de otros países latinoamericanos. Para explorar estas diferencias se requerirá un análisis detallado de todos los componentes que influyen en el establecimiento del precio en cada país, incluyendo el precio de venta del productor, los costos de transporte, los impuestos a la importación, el margen de beneficio para los distribuidores y dispensarios y los impuestos a la venta, entre otros. Este análisis quizás demostraría que los gobiernos pueden adoptar políticas para mejorar la accesibilidad económica de las NEM, pero también probablemente pondría en relieve grandes diferencias en el precio de venta del productor, que suele basarse en la evaluación de la industria sobre cuánto está dispuesto a pagar cada país. En los países latinoamericanos, una mayor colaboración entre los responsables de la política farmacéutica y los expertos en modelos alternativos de compra podría llevar a mejores estructuras de precios para la región.
El proceso de judicialización descrito en la introducción puede fomentar que la industria farmacéutica mantenga precios altos, con la consecuencia agravada de exponer a los pacientes a NEM que, según los boletines independientes de medicamentos, no se deberían utilizar. Los pacientes y las asociaciones de pacientes latinoamericanos -con frecuencia apoyados económicamente por las empresas farmacéuticas innovadoras- demandan a sus gobiernos87,88,89,90,91) para obtener acceso a los tratamientos más nuevos, incluso los que no han sido incluidos en los formularios nacionales92,93,94. Los jueces tienden a basar sus decisiones en necesidades individuales en vez de prioridades sociales; si esta tendencia sigue, los programas de salud se verán en condiciones económicas muy difíciles y podrían entrar en bancarrota95,96,97,98,99,100. Sin negar las dificultades, sería útil evaluar el umbral de accesibilidad económica de las NEM para el sector público de salud. Nuestra hipótesis es que la mayor parte de las NEM señaladas en este artículo no son económicamente accesibles para los ministerios de salud o los gobiernos centrales.
El bienestar de los participantes de los ensayos clínicos
Si los 26 productos incluidos en nuestro estudio para los cuales conseguimos información de eficacia y seguridad de fuentes independientes son una muestra representativa de las NEM probadas en América Latina, tenemos que concluir que los modelos actuales de investigación y desarrollo de las NEM tienen fallas. Hay que hacerse dos preguntas: 1) ¿los comités de ética protegieron de forma adecuada a los participantes en los ensayos clínicos, teniendo en cuenta que exponer de forma consciente a los sujetos constituiría una violación del principio ético de beneficencia?; y 2) ¿era necesario realizar los ensayos clínicos en población vulnerable, la cual, teniendo en cuenta los precios indicados, muy probablemente no se verá beneficiada por los nuevos descubrimientos?
El hecho de que un gran número de las NEM no añadieran valor terapéutico a los tratamientos existentes nos lleva a concluir que los pacientes en el brazo experimental del ensayo clínico estaban peores que si no hubiesen participado en el estudio y simplemente hubiesen recibido el tratamiento estándar. De modo similar, los pacientes incluidos en el brazo control, salvo aquellos que recibieron el mejor tratamiento disponible, también corrieron riesgos innecesarios, sobre todo si el ensayo se realizó con control de placebo o de no-inferioridad. Algunos de los riesgos se podrían haber potencialmente evitado si los patrocinadores de los ensayos, las agencias reguladoras y los comités de ética hubiesen realizado un análisis más profundo de los resultados de los estudios preclínicos y de las fases anteriores de los ensayos101,102) y si las NEM siempre se testearan comparándolas con el mejor tratamiento disponible.
Según el artículo 20 de la Declaración de Helsinki, las poblaciones vulnerables no se deberían incluir en ensayos clínicos cuando los productos se pueden testear en poblaciones no vulnerables103. Los sujetos latinoamericanos que participan en los ensayos clínicos suelen tener un bajo nivel socioeconómico y escasa familiaridad con la investigación clínica y el conocimiento médico, por lo que, según algunos autores, se los debería considerar vulnerables104,105,106. Todos los productos incluidos en este estudio, salvo bedaquiline, que se usa en el tratamiento de tuberculosis multiresistente a los medicamentos, se podrían haber testeado en poblaciones no vulnerables.
Otra de las consecuencias adversas de realizar ensayos clínicos patrocinados por la industria que se debería explorar con mayor profundidad es cómo estos desplazan investigaciones que serían más relevantes para la región. Los incentivos ofrecidos a los investigadores principales, que incluyen pero no se limitan a remuneraciones, los alejan del desarrollo de otros productos importantes para la región, como tratamientos para el dengue, la malaria y la leishmaniasis, o de la urgente necesidad de desarrollar genéricos biológicos que podrían salvar vidas y ahorrar dinero107,108.
El cumplimiento de principios éticos y regulaciones
En un sistema de investigación y desarrollo quebrado, con ensayos clínicos innecesarios que no resultan en mejores terapias y que producen NEM inaccesibles económicamente tanto para el sector privado como para el sector púbico, algunos requisitos éticos, jurídicos y regulatorios diseñados para proteger a la población, irónicamente han tenido el efecto opuesto. Permitir la explotación de poblaciones vulnerables también ha tenido consecuencias negativas para la sustentabilidad y seguridad de los mercados farmacéuticos.
La mayoría de los lineamientos éticos, como los del Council for International Organizations of Medical Sciences (CIOMS)6, la Declaración Universal sobre Bioética y Derechos Humanos109 o la Declaración de Helsinki103 afirman que el acceso al tratamiento pos-ensayo tiene que estar asegurado. Según la Pauta 10 de CIOMS, que se refiere a la "Investigación en poblaciones y comunidades con recursos limitados":
Antes de realizar una investigación en una población o comunidad con recursos limitados, el patrocinador y el investigador deben hacer todos los esfuerzos para garantizar que:
la investigación responde a las necesidades de salud y prioridades de la población o comunidad en que se realizará; y
cualquier intervención o producto desarrollado, o conocimiento generado, estará disponible razonablemente para beneficio de aquella población o comunidad.6
El documento incluye también comentarios sobre las pautas. A continuación, reproducimos algunos aspectos claves del contenido del comentario sobre la Pauta 10:
[...] Esto es aplicable especialmente en investigaciones realizadas en países en los cuales los gobiernos carecen de recursos para poner ampliamente a disposición tales productos o beneficios. Aun cuando un producto que será probado en un país particular tenga menor costo que el tratamiento estándar en otros países, el gobierno o los individuos en ese país pueden ser todavía incapaces de asumir su costo. Si el conocimiento obtenido a partir de la investigación en tal país es usado, primariamente, en beneficio de las poblaciones que pueden asumir el costo del producto probado, la investigación puede caracterizarse como explotadora y, por tanto, como no ética. [...] La negociación debiera cubrir la infraestructura de atención de salud requerida para el uso racional y seguro de la intervención, la posibilidad de autorización para su distribución y decisiones respecto a pagos, derechos de patentes, subsidios, tecnología y propiedad intelectual, así como costos de distribución, cuando esta información económica no sea de tipo comercial. [...] En general, si existe una buena razón para creer que es improbable que un producto desarrollado o un conocimiento generado por la investigación esté razonablemente disponible o se aplique para beneficio de la población de un país o comunidad anfitriones propuestos después del término del estudio, no es ético realizar la investigación en tal país o comunidad. (6 [cursivas añadidas]
A su vez, el artículo 15 de la Declaración Universal sobre Bioética y Derechos Humanos, que trata del "Aprovechamiento compartido de los beneficios" de los ensayos clínicos, afirma que "los beneficios resultantes de toda investigación científica y sus aplicaciones deberían compartirse con la sociedad en su conjunto y en el seno de la comunidad internacional, en particular con los países en desarrollo"109. Finalmente, el principio 22 de la Declaración de Helsinki señala que "en los ensayos clínicos, el protocolo también debe describir los arreglos apropiados para las estipulaciones después del ensayo"103.
Sin embargo, en contraste con el comentario sobre la Pauta 10 de CIOMS, ni los patrocinadores, ni las agencias reguladoras, ni cualesquiera de los organismos que aprobaron las declaraciones éticas vinculadas a ensayos clínicos han propuesto acuerdos previos a los ensayos para asegurar que las NEM estén disponibles a precios razonables. Sin dichos mecanismos, los comités de ética y las agencias reguladoras aprueban la implementación de muchos ensayos clínicos que no se deberían autorizar, facilitando la violación del principio de justicia y la explotación de los participantes de los ensayos.
En enero de 2014 se publicó un nuevo "Marco de Consenso para la Colaboración Ética entre Organizaciones de Pacientes, Profesionales de la Salud y la Industria Farmacéutica", cuyo punto 3 dice:
Investigación clínica. La promoción y apoyo del principio que toda investigación en sujetos humanos tiene que tener un propósito científico legítimo, intenciones de mejorar los resultados de salud y realizarse de forma ética...110
Si la industria quiere ser coherente con su propio consenso marco, y con principios éticos universalmente aceptados6,103,109 tendrá que:
Incluir en los protocolos de los ensayos clínicos el precio proyectado de la NEM para que las agencias reguladoras y los comités de ética en investigación puedan tener en cuenta la accesibilidad económica de la NEM antes de autorizar la investigación.
Establecer un mecanismo para garantizar el registro y la disponibilidad de las NEM demostradamente seguras y eficaces en coordinación con las agencias reguladoras de los países en los que testean las NEM.
Reconsiderar sus estrategias de investigación y comercialización para asegurar que las NEM añadan valor terapéutico al arsenal de tratamientos existentes, a un precio accesible.
No patrocinar ensayos clínicos de no-inferioridad, salvo que sean estrictamente necesarios.
Salvo que estas condiciones se cumplan, quizás sería mejor renunciar al cumplimiento del requisito de que las NEM estén disponibles en los países en los que fueron testeadas. Asimismo, dado que las agencias reguladoras de renombre son proclives a aprobar NEM que, según expertos farmacológicos independientes, no se deberían aprobar, las agencias reguladoras latinoamericanos quizá deberían repensar la vinculación entre sus autorizaciones de comercialización y las decisiones tomadas por las agencias reguladoras de alta vigilancia para utilizar, en cambio, la información ofrecida por los boletines independientes de medicamentos. Tomando en cuenta la falta de innovación verdadera, el retraso de la aprobación de las NEM hasta que se hagan disponibles las evaluaciones independientes no será perjudicial para los residentes de América Latina. Se podrían hacer excepciones para las NEM realmente innovadoras.
Limitaciones
Algunas revisiones de las NEM por parte de la FDA no especificaron qué ensayos eran pivotales. Aunque reunimos información de los patrocinadores de los ensayos, podríamos haber incluido ensayos que técnicamente no se consideraron pivotales. No pudimos evitar las mismas limitaciones que encontraron otros autores en el establecimiento de los umbrales de accesibilidad económica. Otros no pueden fácilmente definir lo que un ser humano está dispuesto a sacrificar y los riesgos que está preparado para enfrentar; es una decisión personal que está fuertemente influenciada por valores personales y culturales.
Averiguar los precios de los medicamentos es complejo, y actualmente no hay una metodología estándar. En este momento, más allá de sus deficiencias, los observatorios nacionales probablemente sean las mejores fuentes de información que suelen basarse en la metodología de WHO-HAI. Las variaciones monetarias se suman a la complejidad de comparar información de precios entre países. Averiguamos los precios de los medicamentos en septiembre de 2014, pero los datos utilizados para determinar IMPC son de 2013. En este periodo de tiempo, algunas monedas se devaluaron mientras otras se revalorizaron.
Asimismo, en los países latinoamericanos incluidos en este estudio, los ingresos están muy mal distribuidos (Tabla 3). Si sacáramos los dos deciles más altos, el ingreso per cápita del resto de la población se vería dramáticamente reducido, hasta la mitad en muchos países, por lo que el umbral de accesibilidad económica debería ser más bajo.
La información sobre el registro y la comercialización de las NEM puede tener inexactitudes. Con la utilización de métodos de triangulación identificamos y corregimos algunos errores, pero otros pueden no haber sido detectados.
CONCLUSIONES
Este es el primer estudio que indaga en América Latina los beneficios de los ensayos clínicos no solo para los sujetos de los ensayos sino para los sistemas de salud y la salud de los ciudadanos.
Muchos de los productos testeados no están disponibles o su precio es inaccesible para la gran mayoría de los latinoamericanos, y solo algunos resultaron más eficaces para un grupo selecto de pacientes pero con efectos secundarios significativos. El equilibrio entre los beneficios y las consecuencias negativas económicas y sanitarias de realizar ensayos clínicos en América Latina nos lleva a sugerir que el número de ensayos debería ser drásticamente reducido.
El modelo actual de investigación y desarrollo es muy cuestionado y quizá, hasta que se mejore el modelo, los ensayos clínicos solo se deberían realizar en los países en los que se radican las sedes centrales de las compañías que patrocinan los ensayos. Concluimos que:
Hay una necesidad urgente de determinar la accesibilidad económica de las NEM para el sector público. Dado que los precios de las NEM no se relacionan con los costos de investigación y desarrollo y de producción, la industria cuenta con márgenes amplios para establecer sus precios.
El riesgo que implica obligar a registrar y comercializar productos muy costosos, poniendo en peligro los presupuestos de los ministerios de salud sin mejorar la salud de los pacientes, es una razón para disminuir la implementación de ensayos clínicos en América Latina.
Es necesario fortalecer los comités de ética para que, en su evaluación de los ensayos clínicos, puedan prestar atención significativa a la accesibilidad económica y la pertinencia de la NEM.
Los productos incluidos en este estudio no respondieron a las necesidades terapéuticas de la región, y pueden desviar los recursos científicos que podrían abordar asuntos de mayor relevancia. Mientras los gobiernos dan la bienvenida a las inversiones que acompañan los ensayos provenientes del extranjero, es importante que documenten también sus implicancias.
Las agencias reguladoras de América Latina deberían utilizar la información de expertos y boletines independientes cuando evalúan el pedido de comercialización de las NEM. Se podrían establecer excepciones para las pocas NEM realmente innovadoras.
Es importante descubrir las razones de las diferencias de precio de los medicamentos entre los países de la región.











 text in
text in 



