Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista americana de medicina respiratoria
versión On-line ISSN 1852-236X
Rev. amer. med. respiratoria vol.11 no.4 CABA dic. 2011
ARTÍCULO ESPECIAL
Estadificación mediastinal del carcinoma de pulmón: el aporte de los nuevos métodos endoscópicos
Maria Angélica Saab1, Silvia Quadrelli2, Artemio García2, Gustavo Lyons2, Miguel Blasco2.
1 Centro Oncológico-II Clínica y Policlínica Médica-Sección Neumonología - Clínica Universitaria Hamburgo-Eppendorf. Hamburgo-Alemania
2 Centro Oncología Torácica - Hospital Británico de Buenos Aires
Correspondencia Saab María Angélica Domicilio Postal: Uspallata 2272 Correo electrónico: med.ar@t-online.de Teléfono: 011 43042180 interno 232
Recibido: 28.04.2011
Aceptado: 27.07.2011
Resumen
La estadificación mediastinal en cáncer de pulmón en pacientes potencialmente operables constituye un paso crítico para determinar la estrategia terapéutica. De los métodos de estadificación la mediastinoscopia es el "gold estándar" con una sensibilidad de 80% y baja morbilidad. Sin embargo, no deja de ser un procedimiento quirúrgico. Métodos endoscópicos utilizando ultrasonografía como guía para la punción con aguja fina han emergido como métodos mínimamente invasivos ofreciéndose como alternativa a los métodos quirúrgicos. Con reconocida precisión diagnóstica y sensibilidad, estos métodos van ocupando un lugar en la estadificación mediastinal. Esta revisión aborda principios, aplicaciones clínicas y el papel de esta nueva tecnología en la estadificación del cáncer de pulmón.
Palabras clave: Broncoscopía; Ultrasonografía endobronquial; Cáncer de pulmón; Estadificación mediastinal.
Abstract
Mediastinal staging of lung cancer: the contribution of new endoscopic methods
Mediastinal staging of lung cancer in potentially operable patients is a critical step in determining the therapeutic strategy. Among the methods of staging, mediastinoscopy is the "gold standard" because it combines an 80% sensitivity with a low rate of complications. However it remains a surgical procedure. Methods using endoscopic ultrasound to guide fine needle aspiration emerged as minimally invasive procedures presenting an alternative to surgical methods. Because of their established diagnostic accuracy and sensitivity these methods are occupying a place in the mediastinal staging. This review deals with principles, clinical applications and the role of this new technology in the staging of lung cancer.
Key words: Bronchoscopy; Endobronchial ultrasound; Lung cancer; Mediastinal staging.
En cáncer de pulmón, el estadio de la enfermedad es un factor determinante en la elección de la estrategia terapéutica. La cirugía constituye la opción de tratamiento apropiada en pacientes con enfermedad limitada al pulmón y los ganglios linfáticos hiliares. En pacientes con compromiso de ganglios mediastinales ipsilaterales el beneficio de la cirugía como primera opción terapéutica es cuestionable, mientras que no está en discusión que en pacientes con metástasis en ganglios linfáticos mediastinales contralaterales la cirugía generalmente no está indicada y la quimioterapia, radioterapia o ambas son el tratamiento estándar1. Esto hace crítica una adecuada estadificación a fin de planificar un tratamiento efectivo, optimizar la tasa de supervivencia y limitar al máximo el número de toracotomías inútiles.
Los procedimientos actualmente disponibles para la estadificación mediastinal incluyen procedimientos no invasivos como la tomografía computada de tórax (TC) y la tomografía por emisión de positrones (PET), e invasivos (quirúrgicos y no quirúrgicos).
Los métodos no invasivos son seguros, pero tienen limitada sensibilidad y especificidad. En relación a la utilidad de la TC, un metanálisis2 demostró para este método una sensibilidad de 0.60 (IC 95% 0.58-0.62), especificidad 0.77 (95% IC, 0.75-0.79), y precisión diagnóstica de 0,75 (IC del 95%, 0,74 hasta 0,76). Respecto al PET, otra revisión3 determinó una sensibilidad global de 0,84 (95% IC, 0,78-0,89) y una especificidad de 0,89 (IC del 95% IC 0.83-0.93). En comparación con la TC, los resultados del PET son significativamente mejores, aunque sin alcanzar aún una precisión global que garantice una toma de decisión adecuada. Estas técnicas siguen siendo falibles, y todos los hallazgos radiológicos anormales requieren la confirmación citológica o histológica de malignidad4.
De los métodos invasivos, la mediastinoscopía ha sido tradicionalmente considerada el procedimiento "gold standard" para la estadificación mediastinal en cáncer de pulmón5, 6. Sin embargo, comparada con la certificación mediante toracotomía su sensibilidad global es del 80%7, 8, 9.
La mediastinoscopía cervical estándar (MCS) es un procedimiento realizado en quirófano bajo anestesia general, puede requerir internación (usualmente ambulatoria y duración total no mayor a 45 minutos). Es ideal para evaluar las estaciones ganglionares paratraqueales (2 R, 2L, 4R, 4L), y subcarinal anterior (7), siendo inaccesibles las estaciones subcarinal posterior, paraesogágicos (8), ligamento pulmonar (9), los ganglios subaórticos (5) y paraaóticos (6) según el mapa ganglionar de Mountain y Dresler10. Resulta más invasiva en comparación con las técnicas endoscópicas, tiene un 2% de riesgo de morbilidad y 0,08% de mortalidad (Tabla 1), y la cicatriz resultante puede tener un cierto impacto cosmético poco aceptable para algunos pacientes11.
Tabla 1. Estadificación mediastinal en cáncer de pulmón: Rendimiento de diferentes técnicas diagnósticas
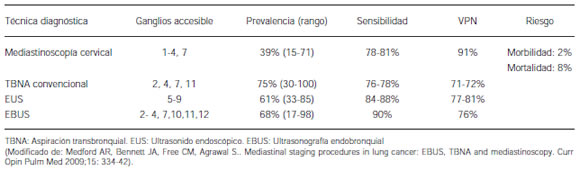
Lemaire y col. informaron con esta técnica una tasa de falsos negativos de metástasis en ganglios linfáticos de 5,5% (56 de 1.019) en pacientes con cáncer sometidos a resección pulmonar. Treinta y dos (57%) de estos se debían a enfermedad metastásica en ganglios normalmente no biopsiados durante la MCS (estaciones 5, 6, 8 o 9)12. La experiencia nacional en mediastinoscopía en manos experimentadas ha mostrado alta sensibilidad (85,7%) y valor predictivo negativo (VPN) (92%)13.
Uno de los mayores condicionantes de su uso en la actualidad es el riesgo de no contar con su utilización como método de estadificación después de la quimioterapia de inducción. Hay evidencia de que los únicos pacientes que se benefician con la cirugía después de la quimioterapia de inducción (neoadyuvancia) son los que han negativizado completamente el mediastino14, 15, 16, 17, haciendo por lo tanto enfáticamente aconsejable la re-estadificación antes de definir la cirugía.
La re-mediastinoscopia es técnicamente más dificultosa debido a presencia de adherencias y cambios fibróticos. Esto implica un rendimiento diagnóstico inferior, siendo la sensibilidad de 29% en el único estudio prospectivo18 y variando de 70 a 73% en dos estudios retrospectivos19, 20.
A pesar de las inequívocas ventajas de la mediastinoscopía y la enfática recomendación de la estadificación mediastinal mediante comprobación histológica, esta técnica está infrautilizada. En EE.UU Little y col. demostró que sólo el 27% de 11.668 pacientes evaluados fueron sometidos a mediastinoscopía preoperatoria, de los cuales sólo el 46% tuvieron evidencia documentada de estudio anatomopatológico de biopsia ganglionar21.
Las desventajas antes mencionadas llevaron a explorar métodos más sencillos que permitan definir la presencia o no de metástasis ganglionares en el mediastino.
Punción aspirativa transbronquial con aguja (TBNA)
A pesar de haber sido descripta hace más de 60 años por el argentino Schieppati22, 23, 24, la TBNA "a ciegas" guiada por imagen estática de TC ha sido poco utilizada en la práctica clínica debido probablemente a su baja sensibilidad en diversos estudios25. Dos recientes revisiones han confirmado que la TBNA es inferior a las técnicas quirúrgicas para la estadificación mediastinal (sensibilidad global 76 a 78% y VPN 71-72%)26, 11 a pesar de haberse realizado en su mayoría en pacientes con ganglios mediastinales prominentes (bulky N2)27, 28, 29. La TBNA puede realizarse en forma ambulatoria, bajo anestesia local, sin presentar morbilidad significativa27, 30. Brinda la posibilidad de diagnóstico y estadificación en un solo procedimiento. Tiene acceso a las estaciones ganglionares 2, 3, 4, 7, 10 y 11, sin embargo al ser un procedimiento "a ciegas" su capacidad de diagnóstico está limitada a la localización y tamaño del ganglio. Asimismo las mayores limitaciones se relacionan con el riesgo de daño del equipamiento y la necesidad de un riguroso entrenamiento, por lo que pocos grupos asistenciales han podido reproducir las cifras de rentabilidad diagnóstica presentes en la literatura.
Ultrasonido endoscópico
Uno de los primeros intentos para mejorar la rentabilidad de la TBNA fue el uso de ultrasonido esofágico (EUS). Este procedimiento consiste básicamente en el uso de una sonda ultrasónica de alta resolución utilizando como vehículo la endoscopía.
Desarrollado en la década de 1980, el EUS se ha convertido en parte integral de la evaluación de tumores malignos gastrointestinales, particularmente en esófago. Por la localización anatómica de éste (posterior y hacia la izquierda de la tráquea), el acceso al mediastino se convirtió en una extensión factible del EUS, haciendo posible su utilización en el diagnóstico y estadificación del cáncer de pulmón31, 32.
El EUS permite la visualización de las estaciones ganglionares mediastinales 7, 8, 9, 5, y la estación 4L. Para la estación 6 la obtención de tejido puede requerir un abordaje transaortal. Sin embargo la visualización completa del mediastino resulta limitada, por su difícil acceso a las estaciones 2R, 3 y 4R33, 34, 35.
El EUS dio paso a una amplia línea de sondas y endoscopios con ultrasonido gracias a los avances tecnológicos en miniaturización y procesamiento de las señales.
Ultrasonido endobronquial
En 1999 comienza a utilizarse el ultrasonido endobronquial (EBUS) de sonda radial, que ya desde los primeros estudios muestra mayor sensibilidad para el diagnóstico de ganglios mediastinales aunque con resultados muy variables36, 37.
EBUS–TBNA obtuvo el sello de EU CE en julio de 2004 y fue aprobada por la "Food and Drug Administration" (FDA) en Marzo de 200638. Desde entonces se ha transformado en una técnica crecientemente estudiada y utilizada en la estadificación del cancer de pulmón, teniendo acceso a las estaciones ganglionares mediastinales e hiliares 2, 3, 4, 7, 10 y 11, siendo usualmente no accesibles a las estaciones 5, 6, 8 y 9. Por esta técnica la TBNA puede realizarse en ganglios ≥ 5 mm en su eje corto.
Aspectos técnicos: El EBUS se basa en el principio del ultrasonido consistente en una serie de ondas mecánicas, longitudinales cuya frecuencia supera la del sonido audible: 20.000 ciclos/ segundo o 20 Kilohercios (20 KHz)39. A su paso a través de los tejidos, y según las leyes ópticas, el haz de ultrasonido puede ser: reflejado, refractado, difractado, dispersado y absorbido. La reflexión y dispersión son imprescindibles en ecografía diagnóstica ya que los ultrasonidos reflejados y parte de los dispersados son los denominados "ECOS".
En la actualidad existen dos formas de EBUS. Cada una utiliza un transductor que produce ondas ultrasónicas y recibe las ondas reflejadas por los tejidos. Un procesador integra las ondas ultrasónicas (o ECOS) para generar la imagen de ultrasonido de dos dimensiones40.
EBUS Sonda Radial
Desde sus inicios las sondas radiales fueron utilizadas para evaluar la estructura de la vía aérea central y determinar la profundidad de invasión tumoral41, extendiéndose posteriormente su utilidad en el diagnóstico de lesiones pulmonares periféricas42.
Hay dos tipos de sondas radiales disponibles. El EBUS con sonda radial 20 MHz (UM-BS20- 26R, Olympus, Tokio, Japón), equipada con un catéter protector provisto en la punta de un balón inflable con agua. Esta sonda se puede insertar a través de un canal de trabajo de 2.8 mm de un fibrobroncoscopio y rotar 360 grados. Permite obtener imágenes detalladas de las estructuras de la pared bronquial y tejido circundantes mediante el método de contacto balón - pared bronquial. El EBUS 20 MHz tiene una resolución de menos de 1 mm y una penetración de 5 cm, lo que permite la identificación de las capas de las vía aérea43, 44. Se describe en el diagnóstico de invasión tumoral de la pared bronquial con estas sondas una sensibilidad general de 66,7%, una especificidad de 100%, y exactitud de 93 a 95%45, 46, 47.
Las sondas son frágiles y deben ser manejadas con mucho cuidado, pudiendo tener una duración de aproximadamente 50 a 75 procedimientos.
Su utilización para muestras de ganglios linfáticos requiere de una toma de muestra secuencial, primero se localiza el órgano diana por medio de EBUS y como segundo paso se realiza la TBNA.
Existe un segundo tipo de sondas, la "minisonda" radial también de 20-MHz con un diámetro externo de 1.7 mm (UM-S20- 20R, Olympus) utilizada para la detección de nódulos periféricos y toma de biopsia. Esta sonda está colocada en un catéter guía el cual se inserta en un canal de trabajo de 2.2 mm de un fibrobroncoscopio. La sonda se avanza hacia la lesión periférica para obtener una imagen EBUS, localizada la lesión se retira la sonda dejando la vaina guía a través de la cual puede introducirse el instrumental para la toma de biopsia o citológica (pinza, aguja, cepillo) Se dispone actualmente de diversas sondas radiales compatibles y no compatibles con catéter guía. Su selección dependerá del objeto que se desea estudiar y su ubicación, ya sea central o periférica (Figura 1).

Figura 1. Diferentes tipos de sondas Radiales para EBUS. A: Sonda con cateter balon UM-BS20-26R; B: Minisonda UM-S20-17S con cateter guía; C: Minisonda UM-S30-25R. Fuente: Olympus Deutschland GmbH.
Estos procedimientos no son realizados en tiempo real y por lo tanto no es posible la visualización de la punción. Para superar este problema, se desarrolló una sonda convexa para ultrasonido endobronquial (CP-EBUS) con capacidad para realizar TBNA en tiempo real (EBUS-TBNA).
EBUS Lineal
También conocido como EBUS de sonda convexa, incorpora un transductor convexo en la punta de un broncoscopio flexible con una frecuencia de 7,5 MHz que permite la exploración paralelamente a la inserción directa del broncoscopio, generando una imagen de 50 grados. Desde 2004 se dispone del broncoscopio flexible (BF-UC160F-OL8, Olympus, Tokyo, Japan) con un canal de trabajo de 2.00 mm, un diámetro externo de 6,7 mm y en la punta de 6,9 mm, resultando más voluminoso que los broncoscopios de uso estándar. El equipo de segunda generación actualmente disponible (BF-UC 180F) posee un diámetro externo de 6,3 mm y en la punta 6,9 mm, con un canal de trabajo de 2,2 mm.
El ángulo de visión del equipo es de 80 grados y la dirección de vista de 35 grados oblicua hacia adelante. El sistema óptico permite obtener imágenes similares a la de los videofibroscopios regulares. Tanto la ecografía y la imagen broncoscópica de luz blanca pueden ser vistas al mismo tiempo. Posee un modo Doppler color que permite diferenciar las estructuras vasculares. Además, la imagen ecográfica puede ser congelada, posibilitando la medición en dos dimensiones de las lesiónes o ganglios linfáticos.
Para la TBNA se utiliza una aguja descartable de calibre 22 (NA-201SX-4022, Olympus) y la actualmente disponible aguja calibre 21(NA- 201SX-4021, Olympus). La aguja está provista de un dispositivo de ajuste para prevenir el daño del canal. Está cubierta por un catéter y equipada con una funda interna que se retira después de pasar la pared bronquial, evitando la contaminación durante la TBNA. Tiene una superficie diseñada que mejora su visualización ecográfica (Figura 2).

Figura 2. Equipo EBUS-TBNA. A: EBUS-TBNA broncoscopio BF-UC180F con canal de trabajo de 2,2 mm y cables de ultrasonido removibles. B: Procesador de Ultrasonido Olympus EU-C60. C: Aguja para EBUS-TBNA. D: Extremo distal del EBUS-TBNA broncoscopio con el transductor de ultrasonido convexo y la aguja TBNA insertada.
Fuente: Olympus Deutschland GMBH
EBUS-TBNA se puede realizarse bajo anestesia local y sedación consciente en forma ambulatoria. Debido al diámetro del EBUS lineal, la inspección completa de las vías respiratorias requiere la realización previa de una broncoscopia flexible estándar. Se recomienda su inserción por medio de la intubación por vía oral.
Las imágenes de ultrasonido se obtienen mediante la colocación de la sonda en contacto directo con la tráquea o la pared bronquial, o después de inflar el balón en la punta del broncoscopio con solución salina. El uso de este balón puede mejorar la calidad de la imagen. Una vez en tráquea se procede a la inspección de las estaciones ganglionares de una manera sistemática según el mapa ganglionar propuesto por la IASLC48. Todos los ganglios deben ser identificados y caracterizados. Las características sonográficas pueden contribuir en la predicción de metástasis49, 50. Se describió como factor predictor independiente de metástasis características del ganglio como la forma redonda, márgenes discontínuos, ecogenicidad heterogénea y signos de necrosis. Sin embargo, se requiere de la confirmación anatomopatológica del material obtenido por punción51.
Para evitar contaminación, la EBUS-TBNA debe ser realizada desde los ganglios N3 seguidos por los N2 y finalmente los ganglios N1.
Aunque previamente se habría sugerido que el máximo rendimiento se alcanzaba con la séptima muestra y que el mismo mejoraba con el uso de análisis rápido in situ (Rapid on-site specimen o ROSE) (71% vs 25%)52, publicaciones más recientes establecen que serían suficientes tres punciones para maximizar el rendimiento diagnóstico53, 54 (Figura 3).

Figura 3. A: Imagen de ultrasonografía endobronquial de un ganglio hiliar derecho con diámetro > 1cm (Estación 10). B: EBUS-TBNA del ganglio linfático hiliar derecho (Estación 10). La aguja de punción es claramente visible en el interior del ganglio. C: Imagen de ultrasonografía endobronquial de un ganglio hiliar derecho con diámetro < 1cm (Estación 11). EBUS-TBNA del ganglio linfático hiliar derecho (Estación 11). La aguja de punción visualizarse en el interior del ganglio.
Fuente: Centro Oncológico-II Clínica y Policlínica Médica-Sección Neumonología- Clínica Universitaria Hamburgo-Eppendorf. Hamburgo Alemania
Utilidad clínica del EBUS
La evidencia publicada sugiere que el EBUS es un método seguro y con alta rentabilidad diagnóstica. Vilmman y col.55 han comunicado que EBUS-TBNA tiene mayor sensibilidad y especificidad que EUS-FNA en la detección de metástasis en ganglios linfáticos.
El estudio prospectivo de mayor escala publicado en cáncer de pulmón se llevó a cabo por el grupo de Herth y col.56 en 2006 con 502 pacientes con adenopatias mediastinales e hiliares. La sensibilidad y el VPN de EBUS-TBNA para la detección de tumores malignos fueron de 94% y 11% respectivamente. Este mismo grupo evaluó posteriormente la utilidad de EBUS-TBNA en la estadificación de pacientes con sospecha de cáncer de pulmón sin agrandamiento de ganglios linfáticos en la TC57, mostrando una sensibilidad de 92.3% y un VPN de 96.3%. Un posterior estudio en pacientes con TC y PET negativos58 determinó un VPN aún mayor (98.9%).
Un metanálisis reciente4 comparó los resultados con varios otros meta-análisis, en los que se utilizaron métodos invasivos o mínimamente invasivos. EBUS-TBNA demostró la mayor sensibilidad 0.93 (95% CI,0.91-0.94) y mayor especificidad 1.00 (95% CI 0.99-1.000). Estos resultados fueron también coincidentes con los resultados de otros estudios bien diseñados. Varela Lema et al59 realizaron una revisión que incluyó dos guías de práctica clínica basadas en la evidencia sobre diagnóstico y estadificación mediastinal del cáncer de pulmón y 14 estudios originales. El diseño fue prospectivo en 12 estudios y retrospectivo en dos, con muestras entre 18 y 502 pacientes. Es notable que la mitad de esos estudios fueran realizados sólo por dos grupos: el de Yasufuku60, 61, 62, 63 y los mencionados del grupo multicéntrico de Herth et al56, 57, 58 (Tabla 2).
Tabla 2. Estadificación mediastinal en cáncer de pulmón: Punción-aspiración transbronquial con aguja guiada por ecografía endobronquial

Los estudios japoneses mostraron una sensibilidad de 94% y VPN de 89.5% evitando mediastinoscopías en 29 de 108 pacientes y toracoscopías o toracotomías en 861. También para este grupo63 la sensibilidad y VPN en pacientes con ganglios de 5 mm sometidos a EBUS-TBNA fue elevada (92% y 90% respectivamente).
Parece claro que la marcada superioridad del EBUS respecto de la TBNA convencional se verifica en los grupos ganglionares de más difícil acceso. En el estudio de Herth y col. el rendimiento de la TBNA convencional en los ganglios subcarinales fue 74% vs 86% para la EBUS-TBNA (diferencia no significativa). En cambio, en los ganglios en posición 2, 3, 4, o de la ventana aortopulmonar el rendimiento de EBUS-TBNA fue significativamente superior (84 vs 58%) (p = 0.001)36.
Algunos autores han comunicado que la sensibilidad de EBUS-TBNA para la evaluación de las metástasis mediastínicas e hiliares parece ser equivalente o incluso superior a la de la mediastinoscopia, demostrando una sensibilidad de la mediastinoscopía en el rango de 72 a 89%26.
El PET puede aumentar la sensibilidad de EBUS-TBNA en la estadificación del cáncer de pulmón. Según datos publicados, el subgrupo de pacientes seleccionados en base a TC o PET positivos tienen una mayor sensibilidad global (0,94, IC 95% 0,93-0,96) que el subgrupo de pacientes sin ningún tipo de selección en base a TC o PET (0,76, IC 95% 0.65-0.85) (p <0,05) mostrando una diferencia estadísticamente significativa en la precisión diagnóstica4.
Avanzando en la utilización de los métodos de ultrasonografía endoscópica, algunos autores64, 65 han sugerido que la combinación EBUS-TBNA y EUS-FNA podrían lograr una estadificación mediastinal mínimamentente invasiva casi completa . Recientemente han sido publicados varios estudios que analizan el efecto combinado de EBUS-TBNA más EUS-FNA. Szlubowzki et al66 realizaron la aspiración con aguja guiada por ultrasonografía combinada (CUS-NA) en 120 pacientes sin ganglios mediastinales aumentados de tamaño (Estadíos I y II). La CUS-NA reveló metastasis mediastinales en 16% de los pacientes. En los 99 patientes con CUS-NA negativo la mediastinoscopía demostró metastasis en el 8%, determinando que para un mediastino normal por imágenes el procedimiento tenía una sensibilidad, especificidad, VPP y VPN de 68%, 98%, 91% y 91% respectivamente. El VPN fue significativamente superior con la CUS-NA que con cualquiera de los dos métodos por separado. De manera similar el grupo de Herth demostró para CUS-NA una sensibilidad del 96% y un VPN de 95%, ambos superiores a los de cada método por separado67. Finalmente un estudio randomizado multicéntrico comparó la estadificación mediastinal quirúrgica por mediastinoscopía con la CUS-NA. El estudio se realizó en 241 pacientes con sospecha de cáncer de pulmón (NSCLC) resecable en quienes la estadificación mediastinal fue indicada basada en los hallazgos de TC y PET. Los pacientes fueron aleatorizados para estadificación por mediastinoscopía o por CUS-NA, seguida de mediastinoscopía en los casos de hallazgo negativo por endosonografía. Se encontró metástasis ganglionares en 35% de los pacientes bajo mediastinoscopía, en 46% de los pacientes estadificados por CUS-NA (p = 0.11) y en 50% de los pacientes sometidos a CUS-NA y posterior mediastinoscopía (P = .02), describiendose una sensibilidad de 79% vs 85% y 94% respectivamente. En el grupo estadificado por CUS-NA (seguido o no por mediastinoscopía) se evitaron más toracotomías innecesarias que en el grupo estadificado sólo por mediastinoscopía (18% vs 7%, p = 0.02)68.
Un aporte reciente de gran importancia ha sido la demostración de que EBUS-TBNA permite recuperar material adecuado para la determinación de mutaciones genéticas. El grupo de Rossell en Barcelona69 demostró que en ganglios > 5mm el análisis genético fue posible en 26 (72.2%) de los 36 pacientes con metástasis ganglionares. Esto implica que en pacientes sin muestras histopatológicas se evitaría un procedimiento quirúrgico (del tumor o de los ganglios) para completar el estudio del tumor.
Limitaciones del EBUS
La mayor limitación de EBUS-TBNA es la imposibilidad de visualizar las estaciones ganglionares 5, 6, 8 y 9. Son limitaciones potenciales la calidad subóptima de la imagen de luz blanca (en EBUS lineal), la posibilidad de resultados falsos negativos, los costosos daños del broncoscopio producidos por la aguja11. Otra dificultad se relaciona con la adquisición de experiencia suficiente en su realización, siendo bastante más compleja que para la endoscopía convencional. Esto hace esencial un entrenamiento adecuado e intenso, siendo esperable que haya cierto retraso en cada centro que comienza a utilizar este método en alcanzar las cifras de rentabilidad de la literatura. Pero, por otro lado, la adquisición de datos en tiempo real hace los resultados menos operador dependiente que los de la TBNA convencional. Esto justifica de alguna manera la extrema variabilidad de la rentabilidad de la TBNA convencional en la literatura (24-89%)36, 70, 71, 72 mientras que el rango de rentabilidad comunicado para EBUS-TBNA es mucho más homogéneo (88-95%)57, 62, 73.
El entrenamiento sistemático en EBUS debería seguir la misma rigurosidad de diseño curricular y evaluación que la formación en broncoscopía general74, 75, TBNA convencional76 y la toracoscopía77. Recientemente el grupo de Johns Hopkins mostró el impacto de un programa de entrenamiento en EBUS. Antes de su inicio los especímenes fueron adecuados en 67% de los procedimientos y el rendimiento diagnóstico fue de 55%, a su finalización de 89% y 82% respectivamente78.
Análisis de costos de la ecografía endobronquial
Hay muy pocos estudios de costo-efectividad disponibles para evaluar el impacto económico del EBUS. Sin embargo, hay evidencia de que la EUS-FNA, una técnica similar, es más costo-efectiva que la estadificación quirúrgica79. Se ha publicado que el EUS redujo los costos en 40% por paciente al disminuir el número de procedimientos de estadificación quirúrgica un 62%80. En cuanto al EBUS, tres estudios recientes demostraron que el mismo evitó el uso de otros procedimientos entre un 30 y 56%81, 82, 83. Calculando específicamente los costos, un estudio británico84 determinó que la incorporación de EBUS- TBNA ahorraría al servicio Nacional de Salud local £32.631 por año (incluyendo costos relacionados a la inversión). En forma similar en los últimos meses un grupo australiano realizó un análisis de costos mostrando que la evaluación inicial con EBUS-TBNA (confirmada por cirugía en los casos negativos) fue la metodología más costo-efectiva en términos económicos85.
Notas de prudencia
La llegada del EBUS al escenario clínico es muy prometedera y anticipa cambiar radicalmente el manejo de los pacientes con cáncer de pulmón potencialmente operable. Sin embargo, debe tenerse en cuenta que a pesar de la ya amplia información disponible, ésta no puede todavía considerarse definitiva.
La falta de confirmación de la totalidad de los resultados utilizando un procedimiento quirúrgico (con excepción de dos estudios publicados por Herth et al)57, 58 y la ausencia de estudios con un adecuado seguimiento de los cambios en el manejo terapéutico de los pacientes, son inconvenientes importantes cuando se trata de llegar a conclusiones definitivas acerca de la verdadera utilidad de la técnica.
Dado que en la práctica clínica los resultados positivos no necesariamente son confirmados con un procedimiento quirúrgico adicional, no existen comunicaciones de especificidad y VPP, asumiendo que estos son del 100%. Asimismo, el haber confirmado la negatividad por procedimientos diferentes (toracoscopía, mediastinoscopía, mediastinotomía o seguimiento clínico), representa un sesgo de verificación.
Por otro lado, entre los estudios hay gran heterogeneidad en el tamaño y tipo de ganglios punzados, el método para la punción y el número de aspiraciones realizadas para obtener las muestras, pudiendo esto también influir en la precisión diagnóstica. De acuerdo con LEE y col.86, los rangos de sensibilidad son 69.8-95.3% cuando el número de aspiraciones se incrementa de 1 a 3, manteniéndose constante con un número mayor. Estos resultados no son constantes y los estudios no siempre comunican el número de aspiraciones. En relación al uso de ROSE, estudios habían mostrado marcada superioridad en la TBNA87, 88, sin embargo un reciente estudio describió este incremento en la rentabilidad solo para la TBNA convencional y no el EBUS-TBNA89. Por esto la influencia de su uso en el EBUS no está bien determinada.
También hay heterogeneidad en los estudios en cuanto a las características del tumor, el tipo de cáncer incluido y la ubicación de la linfadenopatía (N1,N2/N3).
Las poblaciones comunicadas pueden no ser totalmente representativas de la población global de pacientes potencialmente quirúrgicos. Con excepción de pocos estudios57, 58, 86, 90 la prevalencia de ganglios linfáticos malignos fue de 50% y los pacientes reclutados presentaron ganglios linfáticos agrandados, lo cual no representa una población de pacientes típicos. Ha sido descripto que la probabilidad post test para la enfermedad N2 (usando TC y PET) fue de 5% para ganglios entre 10-15 mm y 21% en ganglios de 16 mm, cuando los pacientes tenían FDG-PET negativo 91. La inclusión de pacientes de alto riesgo (en su mayoría con ganglios agrandados en TC) puede llegar a incrementar la sensibilidad y el VPP, y puede que la misma sea menor a la comunicada en la población real de una institución asistencial. Aunque la tasa de falso negativo puede ser el error más sobresaliente en los procedimientos de estadificación, es altamente susceptible a cambios en la probabilidad pretest de enfermedad. Asumiendo que las características del rendimiento de los test permanecen constantes, un incremento en la probabililidad pretest produce una mayor tasa de falsos negativos y disminuye el VPN. En contraste, la sensibilidad es menos directamente dependiente de la probabilidad pretest. Por eso, la comparación de los hallazgos de un estudio de estadificación mediastinal a otro, la sensibilidad puede ser el mejor criterio. Además, es una realidad que el 45% de todos los datos disponibles provienen del grupo de trabajo de Heidelberg liderado por Herth56, 57, 58.
Otro factor adicional es que el EBUS-TBNA requiere una intensa formación práctica en la interpretación de las imágenes ecográficas. Como en toda tecnología de reciente adquisición es esperable que los resultados de centros asistenciales tengan un menor grado de eficacia y mayores efectos adversos que los incluídos en ensayos clínicos de centros académicos específicamente dedicados al método. Finalmente, el costo y la disponibilidad significarán una limitación para su uso durante un tiempo prolongado en muchos sistemas de salud del mundo.
Conclusión
La estadificación del mediastino no puede considerarse adecuada sin la verificación anatomopatológica de la presencia de metástasis. Todos los métodos diagnósticos tienen condicionado su VPN (el más relevante para definir la cirugía) a la prevalencia de la enfermedad (metástasis mediastinales) y por eso la exhaustividad de la búsqueda será diferente en pacientes con bajo riesgo para la presencia de N2 que para pacientes con alto riesgo (N2 visible por imágenes, tumores >3cm, centrales o adenocarcinomas). En este último grupo la confirmación histopatológica de la ausencia de N2 es crítica a fin de evitar toracotomías inútiles.
Sobre la base de la evidencia actual, la TBNA debe considerarse un procedimiento auxiliar de estadificación mediastínica cuando no se cuenta con EBUS en tiempo real, en servicios con experiencia en la técnica y si el paciente presenta adenopatías de gran volumen subcarinales y paratraqueales. En nuestro medio varios endoscopistas aún realizan punción con aguja de Schieppati, de resultados aceptables en este subgrupo de pacientes. Es una alternativa útil de bajo costo, pero requiere un alto nivel de entrenamiento, regularidad en la realización del procedimiento y gran familiaridad con la broncoscopía rígida, por lo cual el número de operadores en condiciones de realizarla es muy bajo. El EBUS representa una opción alternativa mínimamente invasiva a la mediastinoscopía cervical para la estadificación en primera línea del NSCLC cuando están presentes discretos agrandamiento N2-3. Sin embargo, los resultados negativos del EBUS deben ser confirmado por mediastinoscopía. Por lo tanto, es probable que el EUS y el EBUS puedan suplantar a la mediastinoscopia en muchos centros como el método preferido para la estadificación mediastinal. Existen varias razo nes descriptas para esperar esto: en primer lugar, aunque la mediastinoscopía en manos expertas es un método seguro asociado a mínima morbilidad, el EUS y EBUS son procedimientos endoscópicos con un riesgo aún menor no pudiendo negarse su atractivo tanto para el paciente como para el médico. También se puede mencionar la ventaja económica del EUS y EBUS (procedimiento factible de realizarse en una sala de endoscopía bajo sedación y no en sala de operaciones bajo anestesia general). Asimismo los conocimientos técnicos necesarios en mediastinoscopía no están ampliamente disponibles. Esta situación fue demostrada en las conclusiones de Little et al, quienes informaron que la mediastinoscopía se realizó en menos del 30% de los pacientes sometidos a resección. El EUS y EBUS facilita el acceso a ganglios linfáticos que ocacionalmente son inalcanzables por mediastinoscopía, estos incluyen no solo los ganglios hiliares y del mediastino inferior, sino también ganglios sospechosos en pacientes que han sido previamente sometidos a mediastinoscopía, resecciones con disección ganglionar y radioterapia. Por último, y tal vez el motivo más importante, EUS y EBUS son accesibles a médicos no cirujanos92.
En el futuro, el EBUS puede tener un rol (si se confirma en otros estudios) en la estadificación de ganglios menores a un centímetro (o sea CT y PET negativos) y en la re-estadificación después de la quimioterapia de inducción. Sin embargo, actualmente el EBUS no puede ser visto como un reemplazo de la mediastinoscopía cervical. Los últimos datos limitados sugieren que el EBUS puede de hecho llegar a coincidir con la mediastinoscopia cervical en el valor predictivo negativo y tiene inclusive una sensibilidad superior, pero son necesarios más estudios para confirmar estos hallazgos. A nuestro juicio el algoritmo más racional de estudio de un paciente potencialmente quirúrgico es el sugerido por la European Society of Thoracic Surgeoons (Figuras 4 y 5).

Figura 4. Algoritmo propuesto para la estadificación mediastinal en cáncer de pulmón cuando no se dispone de PET.

Figura 5. Algoritmo propuesto para la estadificación mediastinal en cáncer de pulmón cuando se dispone de PET o PET/CT
Dada la amplia disponibilidad de métodos para la estadificación mediastinal, hoy el desafío reside en elegir el método más costo-efectivo para el paciente y el sistema de salud en términos de costo económico, morbilidad y tiempos de demora. Debido a la heterogeneidad de pacientes y a un factor que no puede desmerecerse que es la disparidad en la cobertura de los servicios de salud, cada institución deberá adaptar su algoritmo de estadificación mediastinal a la disponibilidad de recursos y al grado de entrenamiento de su personal. Pero cualquiera sea el método utilizado no hay dudas de que es mandatorio certificar en los grupos de riesgo la presencia o no de metástasis mediastinales ya que la cirugía como único tratamiento no ofrece beneficios a pacientes con N2.
Agradecimientos
Un muy especial agradecimiento al Dr Hans F. E. Klose (Jefe de Servicio de Neumonología del Centro Oncológico-II Clínica y Policlínica Médica- Clínica Universitaria Hamburgo-Eppendorf, Hamburgo- Alemania) y al Dr. Hans Jörg Baumann (Médico del Servicio de Neumonología del Centro Oncológico-II Clínica y Policlínica Médica- Clínica Universitaria Hamburgo-Eppendorf, Hamburgo- Alemania) por la dedicación, conocimiento y colaboración brindada. Así como el valioso aporte a este manuscrito.
Un agradecimiento a Olympus Deutschland GmbH por las imágenes aportadas.
Declaración de conflicto de intereses: Los Dres. María Angélica Saab, Silvia Quadrelli, Gustavo Lyons y Miguel Blasco no tienen conflicto de intereses. El Dr. Artemio García recibe apoyo económico de Olympus Argentina para el desarrollo del Centro de EBUS en el Hospital Británico de Buenos Aires.
1. Miller AB. Epidemiology, prevention, prognostic factors, and natural history of lung cancer. Curr Opin Oncol 1992; 4: 286-91. [ Links ]
2. Dwamena BA, Sonnad SS, Angobaldo JO, et al. Metastases from non-small cell lung cancer: mediastinal staging in the 1990s-meta-analytic comparison of PET and CT. Radiology 1999; 213: 530-6. [ Links ]
3. Toloza EM, Harpole L, McCrory DC. Noninvasive staging of non-small cell lung cancer: a review of the current evidence. Chest 2003; 123: 137-46. [ Links ]
4. Gu P, Zhao YZ, Jiang LY, et al. Endobronchial ultrasound-guided transbronchial needle aspiration for staging of lung cancer: a systematic review and meta-analysis. Eur J Cancer 2009; 45: 1389-96. [ Links ]
5. Silvestri GA, Tanoue LT, Margolis ML, et al. The noninvasive staging of non-small cell lung cancer: The Guidelines. Chest 2003; 123: 147-56. [ Links ]
6. Rusch VW. Mediastinoscopy: an endangered species? J Clin Oncol 2005; 23: 8283-5. [ Links ]
7. De Leyn P, Lardinois D, Van Schil PE, et al. ESTS guidelines for preoperative lymph node staging for non-small cell lung cancer. Eur J Cardiothorac Surg 2007; 32: 1-8. [ Links ]
8. Whitson BA, Groth SS, Maddaus MA. Surgical assessment and intraoperative management of mediastinal lymph nodes in non-small cell lung cancer. Ann Thorac Surg 2007; 84: 1059-65. [ Links ]
9. Yasufuku K, Fujisawa T. Staging and diagnosis of non-small cell lung cancer: invasive modalities. Respirology 2007; 12: 173-83. [ Links ]
10. Mountain CF, Dresler CM, Clifton F. Regional lymph node classification for lung cancer staging. Chest 1997; 111: 1718-23. [ Links ]
11. Detterbeck FC, Jantz MA, Wallace M, et al. Invasive mediastinal staging of lung cancer: ACCP evidence-based clinical practice guidelines (2nd edition). Chest 2007; 132: 202-20. [ Links ]
12. Lemaire A, Nikolic I, Petersen T, et al. Nine-year single center experience with cervical mediastinoscopy: complications and false negative rate. Ann Thorac Surg 2006; 82: 1185-89. [ Links ]
13. Abdala F, Abdala O, Poleri C, et al. Revista Argentina de Medicina respiratoria 2006; 1: 51-3. [ Links ]
14. Bueno R, Richards WG, Swanson SJ, et al. Nodal stage after induction therapy for stage IIIA lung cancer determines patient survival. Ann Thorac Surg 2000; 70: 1826-31. [ Links ]
15. Paul S, Mirza F, Port JL, et al. Survival of patients with clinical stage IIIA non-small cell lung cancer after induction therapy: age, mediastinal downstaging, and extent of pulmonary resection as independent predictors. J Thorac Cardiovasc Surg 2011 Jan; 141: 48-58. [ Links ]
16. Jaklitsch MT, Herndon JE 2nd, DeCamp MM Jr, et al. Nodal downstaging predicts survival following induction chemotherapy for stage IIIA (N2) non-small cell lung cancer in CALGB protocol #8935. J Surg Oncol 2006; 94: 599-606. [ Links ]
17. Lorent N, De Leyn P, Lievens Y, et al. Long-term survival of surgically staged IIIA-N2 non-small-cell lung cancer treated with surgical combined modality approach: analysis of a 7-year prospective experience. Ann Oncol 2004; 15: 1645-53. [ Links ]
18. De Leyn P, Stroobants S, De Wever W, et al. Prospective comparativestudy of integrated positron emission tomography-computed tomography scan compared with remediastinoscopy in the assessment of residual mediastinal lymph node disease after induction chemotherapy for mediastinoscopy-proven stage IIIA-N2 Nonsmall-cell lung cancer: a Leuven Lung Cancer Group Study. J Clin Oncol 2006; 24: 3333-9. [ Links ]
19. Van Schil P, van der Schoot J, Poniewierski J, et al. Remediastinoscopy after neoadjuvant therapy for nonsmall cell lung cancer. Lung Cancer 2002; 37: 281-5. [ Links ]
20. Mateu-Navarro M, Rami-Porta R, Bastus-Piulats R, et al. Remediastinoscopy after induction chemotherapy in nonsmall cell lung cancer. Ann Thorac Surg 2000; 70: 391-5. [ Links ]
21. Little AG, Gay EG, Gaspar LE, Stewart AK. National survey of non-small cell lung cancer in the United States: epidemiology, pathology and patterns of care. Lung Cancer. 2007; 57: 253-60. [ Links ]
22. Schieppati E. Mediastinal lymph node puncture through the tracheal carina. Surg Gynecol Obstet 1958; 107: 243-6. [ Links ]
23. Schieppati E. La punción mediastinal a través del espolón traqueal. Rev Asoc Med Argent 1949; 663: 497-9. [ Links ]
24. Wang KP, Marsh BR, Summer WR, et al. Transbronchial needle aspiration for diagnosis of lung cancer. Chest 1981; 80: 48-50. [ Links ]
25. Holty J-EC, Kuschner WG, Gould MK. Accuracy of transbronchial needle aspiration for mediastinal staging of non-small cell lung cancer: a meta-analysis. Thorax 2005; 60: 949-55. [ Links ]
26. Toloza EM, Harpole L, Detterbeck F. Invasive staging of non-small cell lung cancer: a review of the current evidence. Chest 2003; 123: 157-66. [ Links ]
27. Schenk DA, Bower JH, Bryan CL, et al. Transbronchial needle aspiration staging of bronchogenic carcinoma. Am Rev Respir Dis 1986; 134: 146-8. [ Links ]
28. Shure D, Fedullo PF. The role of transcarinal needle aspiration in the staging of bronchogenic carcinoma. Chest 1984; 86: 693-6. [ Links ]
29. Ratto GB, Mereu C, Motta G. The prognostic significance of preoperativeassessment of mediastinal lymph nodes in patients with lung cancer. Chest 1988; 93: 807-13. [ Links ]
30. Wang KP, Brower R, Haponik EF, et al. Flexible transbronchial needle aspiration for staging of bronchogenic carcinoma. Chest 1983; 84: 571-6. [ Links ]
31. Annema JT, Versteegh MI, Veselic M, et al. Endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of lung cancer and its impact on surgical staging. J Clin Oncol 2005; 23:8357-61. [ Links ]
32. Fritscher-Ravens A, Soehendra N, Schirrow L, et al. Role of transesophageal endosonographyguided fine-needle aspiration in the diagnosis of lung cancer. Chest 2000; 117: 339-45. [ Links ]
33. Silvestri GA, Hoffman BJ, Bhutani MS, et al. Endoscopic ultrasound with fine-needle aspiration in the diagnosis and staging of lung cancer. Ann Thorac Surg 1996; 61: 1441-5. [ Links ]
34. Tournoy GK, Annema JT, Krasnik M, et al. Endoscopic and Endobronchial Ultrasonography According to the Proposed Lymph Node Map Definition in the Seventh Edition of the Tumor, Node, Metastasis Classification for Lung Cancer. J Thorac Oncol 2009; 4: 1576-84. [ Links ]
35. Bolliger CT, Herth FJF, Mayo PH, Miyazawa T, Beamis JF (eds): Clinical Chest Ultrasound: From the ICU to the Bronchoscopy Suite. Prog Respir Res. Basel, Karger, 2009; 37: 166-70. [ Links ]
36. Herth FJ, Becker HD, Ernst A. Conventional vs endobronchial ultrasound guided transbronchial needle aspiration: a randomized trial. Chest 2004; 125: 322-5. [ Links ]
37. Herth FJ, Becker HD, Ernst A. Ultrasound-guided transbronchial needle aspiration: an experience in 242 patients. Chest 2003; 123: 604-7. [ Links ]
38. Comite d' Evaluation et de Diffusion des Innovations Technologiques. Echographie endobronchique linéaire temps réel. Francia, 2006. Recommandation du CEDIT - Ref 05.10/Re2/06. Disponible en: http://www.etsad.fr/etsad/afficher_lien.php?id=1057 [ Links ]
39. Kossoff G. Basic physics and imaging characteristics of ultrasound. World J Surg 2000; 24: 134-42. [ Links ]
40. Sheski FD, Mathur PN. Endobronchial Ultrasound. Chest 2008; 133: 264-70. [ Links ]
41. Kurimoto N, Murayama M, Yoshioka S, Nishisaka T, Inai K, Dohi K. Assessment of usefulness of endobronchial ultrasonography in determination of depth of tracheobronchial tumorinvasion. Chest 1999; 115: 1500-6. [ Links ]
42. Paone G, Nicastri E, Lucantoni G, et al. Endobronchial ultrasound-driven biopsy in the diagnosis of peripheral lung lesions. Chest 2005; 128: 3551-7. [ Links ]
43. Hurter T, Hanrath P. Endobronchial sonography: feasibility and preliminary results. Thorax 1992; 47: 565-7. [ Links ]
44. Steiner RM, Liu JB, Goldberg BB, Cohn JR. The value of ultrasoundguided fiberoptic bronchoscopy. Clin Chest Med 1995; 16: 519-34. [ Links ]
45. Baba M, Sekine Y, Suzuki M, et al. Correlation between endobronchial ultrasonography (EBUS) images and histologic findings in normal and tumor-invaded bronchial wall. Lung Cancer 2002; 35: 65-71. [ Links ]
46. Miyazu Y, Miyazawa T, Kurimoto N, et al. Endobronchial ultrasonography in the assessment of centrally located early-stage lung cancer before photodynamic therapy. Am J Respir Crit Care Med 2002; 165: 832-7. [ Links ]
47. Tanaka F, Muro K, Yamasaki S, et al. Evaluation of tracheo-bronchial wall invasion using transbronchial ultrasonography (TBUS). Eur J Cardiothorac Surg 2000; 17: 570-4. [ Links ]
48. Rusch VW, Asamura H, Watanabe H, et al. The IASLC Lung Cancer Staging Project A Proposal for a New International Lymph Node Map in the Forthcoming Seventh Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2009; 4: 568-77. [ Links ]
49. Lee N, Inoue K, Yamamoto R, Kinoshita H. Patterns of internal echoes in lymph nodes in the diagnosis of lung cancer metastasis . World J Surg 1992; 16: 986-94. [ Links ]
50. Bhutani MS, Hawes RH, Hoffman BJ. A comparison of the accuracy of echo features during endoscopic ultrasound (EUS) and EUS-guided fine-needle aspiration for diagnosis of malignant lymph node invasion. Gastrointest Endosc 1997; 45: 474-9. [ Links ]
51. Fujiwara T, Yasufuku K, Nakajima T, et al. The Utility of Sonographic Features During Endobronchial Ultrasound- Guided Transbronchial Needle Aspiration for Lymph Node Staging in Patients With Lung Cancer A Standard Endobronchial Ultrasound Image Classification System Chest 2010; 138:641-7. [ Links ]
52. Chin R Jr, McCain TW, Lucia MA, et al. Transbronchial Needle Aspiration in Diagnosing and Staging Lung Cancer: How Many Aspirates Are Needed? Am. J. Respir Crit Care Med 2002; 166: 377-8. [ Links ]
53. Seok Lee H, Kook Lee G, Lee HS, et al. Real-time endobronchial ultrasound-guided transbronchial needle aspiration in mediastinal staging of non-small cell lung cancer: how many aspirations per target lymph node station? Chest 2008; 134: 368-74. [ Links ]
54. Diacon AH, Schuurmans MM, Theron J, et al. Transbronchial needle aspirates: how many passes per target site? Eur Respir J 2007; 29: 112-6. [ Links ]
55. Vilmann P, Krasnik M, Larsen SS, et al. Transesophageal endoscopic ultrasound-guided fine-needle aspiration (EUS-FNA) and endobronchial ultrasound-guided transbronchial needle aspiration (EBUS-TBNA) biopsy: a combined approach in the evaluation of mediastinal lesions. Endoscopy 2005; 37: 833-9. [ Links ]
56. Herth FJ, Eberhardt R, Vilmann P, et al. Real-time endobronchial ultrasound guided transbronchial needle aspiration for sampling mediastinal lymph nodes. Thorax 2006; 61: 795-8. [ Links ]
57. Herth FJ, Ernst A, Eberhardt R, et al. Endobronchial ultrasound-guided transbronchial needle aspiration of lymph nodes in the radiologically normal mediastinum. Eur Respir J 2006; 28: 910-4. [ Links ]
58. Herth FJ, Eberhardt R, Krasnik M, Ernst A. Endobronchial ultrasound guided transbronchial needle aspiration of lymph nodes in the radiologically and PET normal mediastinum in patients with lung cancer. Chest 2008; 133: 887-91. [ Links ]
59. Varela-Lema L, Fernandez Villar A, Ruano-Ravina A. Effectiveness and safety of endobronchial ultrasound-transbronchial needle aspiration: a systematic review. Eur Respir J 2009; 33: 1156-64. [ Links ]
60. Yasufuku K, Chiyo M, Sekine Y, et al. Real-time endobronchial ultrasound-guided transbronchial needle aspiration of mediastinal and hilar lymph nodes. Chest 2004; 126: 122-8. [ Links ]
61. Yasufuku K, Chiyo M, Koh E, et al. Endobronchial ultrasound guided transbronchial needle aspiration for staging of lung cancer. Lung Cancer 2005; 50: 347-54. [ Links ]
62. Yasufuku K, Nakajima T, Motoori K, et al. Comparison of endobronchial ultrasound, positron emission tomography, and CT for lymph node staging of lung cancer. Chest 2006; 130: 710-8. [ Links ]
63. Nakajima T, Yasufuku K, Iyoda A, et al. The evaluation of lymph node metastasis by endobronchial ultrasoundguided transbronchial needle aspiration: crucial for selection of surgical candidates with metastatic lung tumors. Gen Thorac Surg 2007; 134: 1485-90. [ Links ]
64. Sheski FD, Mathur PN. Endobronchial ultrasound. Chest 2008; 133: 264-70. [ Links ]
65. Vilmann P, Puri R. The complete ''medical'' mediastinoscopy (EUS-FNA + EBUS-TBNA). Minerva Med 2007; 98: 331-8. [ Links ]
66. Szlubowski A, Zielinski M, Soja J, et al. A combined approach of endobronchial and endoscopic ultrasound-guided needle aspiration in the radiologically normal mediastinum in non-small-cell lung cancer staging a prospective trial. Eur J Cardiothorac Surg 2010; 37: 1175-9. [ Links ]
67. Herth FJ, Krasnik M, Kahn N, Eberhardt R, Ernst A. Combined endoscopic-endobronchial ultrasound-guided fine-needle aspiration of mediastinal lymph nodes through a single bronchoscope in 150 patients with suspected lung cancer. Chest 2010; 138: 790-4. [ Links ]
68. Annema JT, van Meerbeeck JP, Rintoul RC, et al. Mediastinoscopy vs endosonography for mediastinal nodal staging of lung cancer: a randomized trial. JAMA 2010; 304: 2245-52. [ Links ]
69. Rossell R, Garcia-Olivé I, Monsó E, et al. Endobronchial ultrasound-guided transbronchial needle aspiration for identifying EGFR mutations. Eur Respir J 2010; 35: 391-5. [ Links ]
70. Harrow EM, Oldenburg Jr FA, Lingenfelter MS, Smith Jr AM. Transbronchial needle aspiration in clinical practice. A five-year experience. Chest 1989; 96: 1268-72 [ Links ]
71. Mehta AC, Kavuru MS, Meeker DP, Gephardt GN, Nunez C. Transbronchial needle aspiration for histology specimens. Chest 1989; 96: 1228-32. [ Links ]
72. Szlubowski A, Kuzdzal J, Soja J, et al. Transbronchial needle aspiration as a diagnostic method in lung cancer and non-malignant mediastinal adenopathy. Pneumonol Alergol Pol 2007; 75: 5-12. [ Links ]
73. Krasnik M, Vilmann P, Larsen SS, Jacobsen GK. Preliminary experience with a new method of endoscopic transbronchial real-time ultrasound guided biopsy for diagnosis of mediastinal and hilar lesions. Thorax 2003; 58: 1083-6. [ Links ]
74. Wahidi MM, Silvestri GA, Coakley RD, at al. A prospective multicenter study of competency metrics and educational interventions in the learning of bronchoscopy among new pulmonary fellows. Chest. 2010; 137: 1040-9. [ Links ]
75. Colt HG, Davoudi M, Murgu S, et al. Measuring learning gain during a one-day introductory bronchoscopy course. Surg Endosc 2011; 25: 207-16. [ Links ]
76. Davoudi M, Wahidi MM, Zamanian Rohani N, Colt HG. Comparative effectiveness of low- and high-fidelity bronchoscopy simulation for training in conventional transbronchial needle aspiration and user preferences. Respiration 2010; 80: 327-34. [ Links ]
77. Colt HG, Davoudi M, Quadrelli S, Zamanian Rohani N.Use of competency-based metrics to determine effectiveness of a postgraduate thoracoscopy course. Respiration. 2010; 80: 553-9. [ Links ]
78. Lonny B. Yarmus, Emily Brigham, and David Feller-Kopman The Impact of EBUS vs Conventional TBNA on Adequacy, Diagnostic Yield, and Fellows Training at a Major Academic Center Chest 138:425A; doi:10.1378/chest.11026 [ Links ]
79. Aabakken L, Silvestri GA, Hawes R, Reed CE, Marsi V, Hoffman B. Cost-efficacy of endoscopic ultrasonography with fine-needle aspiration vs. mediastinotomy in patients with lung cancer and suspected mediastinal adenopathy. Endoscopy 1999; 31: 707-11. [ Links ]
80. Kramer H, van Putten JW, Post WJ, et al. Oesophageal endoscopic ultrasound with fine needle aspiration improves and simplifies the staging of lung cancer. Thorax 2004; 59: 596-601. [ Links ]
81. Vincent BD, El-Bayoumi E, Hoffman B, et al. Real-time endobronchial ultrasound-guided transbronchial lymph node aspiration. Ann Thorac Surg 2008; 85: 224-30. [ Links ]
82. Tournoy KG, Rintoul RC, van Meerbeeck JP, et al. EBUS-TBNA for the diagnosis of central parenchymal lung lesions not visible at routine bronchoscopy. Lung Cancer 2009; 63: 45-9. [ Links ]
83. Hsu LH, Ko JS, You DL, et al. Transbronchial needle aspiration accurately diagnoses subcentimetre mediastinal and hilar lymph nodes detected by integrated positron emission tomography and computed tomography. Respirology 2007; 12: 848-55. [ Links ]
84. Callister ME, Gill A, Allott W, Plant PK. Endobronchial ultrasound guided transbronchial needle aspiration of mediastinal lymph nodes for lung cancer staging: a projected cost analysis. Thorax 2008; 63: 384. [ Links ]
85. Steinfort DP, Liew D, Conron M, Hutchinson AF, Irving LB. Cost-benefit of minimally invasive staging of non-small cell lung cancer: a decision tree sensitivity analysis. J Thorac Oncol 2010; 5: 1564-70. [ Links ]
86. Lee HS, Lee GK, Lee HS, et al. Real-time endobronchial ultrasound-guided transbronchial needle aspiration inmediastinal staging of non-small cell lung cancer: how many aspirations per target lymph node station? Chest 2008; 134: 368-74. [ Links ]
87. Diette GB, White P Jr, Terry P, et al. Utility of on-site cytopathology assessment for bronchoscopic evaluation of lung masses and adenopathy. Chest 2000; 117: 1186-90. [ Links ]
88. Chin R Jr, McCain TW, Lucia MA, et al. Transbronchial needle aspiration in diagnosing and staging lung cancer: how many aspirates are needed? Am J Respir Crit Care Med. 2002; 166: 377-81. [ Links ]
89. Labib, Mutaz M., Qureiyeh, et al. Comparison of conventional transbronchial needle aspiration (TBNA) vs endobronchial ultrasound-guided (EBUS) transbronchial needle aspiration with and without rapid onsite evaluation (ROSE) in a single center. Chest 2009; 136: 112. [ Links ]
90. Wallace MB, Pascual JMS, Raimondo M, et al. Minimally invasive endoscopic staging of suspected lung cancer. JAMA 2008; 299: 540-46. [ Links ]
91. Langen AJ, Raijmakers P, Riphagen I, Paul MA, Hoekstra OS. The size of mediastinal lymph nodes and its relation with metastatic involvement: a meta-analysis. Eur J Thorac Surgery 2006; 29: 26-9. [ Links ]
92. Block MI. Transition from mediastinoscopy to endoscopic ultrasound for lung cancer staging. Ann Thorac Surg. 2010; 89: 885-90. [ Links ]














