Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista americana de medicina respiratoria
On-line version ISSN 1852-236X
Rev. amer. med. respiratoria vol.11 no.4 CABA Dec. 2011
ATENEO DE CASO CLÍNICO
CASO: Manejo multidisciplinario del paciente con cáncer de pulmón con probable compromiso mediastinal
Dr. Adrián Gilardoni1, Dra. Iris Boyeras Navarro1, Dr. José Luis López1, Dr. Dario Yassim1, Dra. Carolina Tinetti2, Dra. Teresita Said Nisi3, Dr. Osvaldo Salariato1
1Departamento de Cirugía de Tórax - Área Quirúrgica - Instituto de Oncología Ángel Roffo - Uni;versidad de Buenos Aires
2Departamento de Diagnóstico por Imágenes - Área de Terapia Radiante y Diagnóstico por Imágenes - Instituto de Oncología Ángel Roffo - Universidad de Buenos Aires
3Departamento de Oncología Médica - Instituto de Oncología Ángel Roffo - Universidad de Buenos Aires
Correspondencia Iris Boyeras Navarro Correo electrónico: irisboyeras@yahoo.com.ar
Recibido: 04.11.2011
Aceptado: 26.11.2011
Presentación del caso
Dr. López: Se presenta un paciente masculino de 66 años, tabaquista de 100 paquetes / año, sin an;tecedentes patológicos de relevancia, que trabaja como chofer. Consultó por un cuadro de 3 meses de evolución consistente en dolor torácico derecho de características punzantes que aumentaba con los movimientos respiratorios. El performance status (PS) al ingreso Score de Karnovsky 100%, y ECOG 0.
La radiografía de tórax (Figura 1) muestra opa;cidad nodular de contornos irregulares en lóbulo superior derecho. En la tomografía axial com;putada (TAC) de tórax (Figuras 2 y 3) se visualizan en segmento anterior del lóbulo superior derecho una masa de 6 cm en contacto con el hilio y otra formación de 2,5 cm en el mismo lóbulo, de con;tornos irregulares y cavitada, signos de enfisema y adenomegalia de 10 mm a nivel precarinal.

Figura 1. Radiografía de tórax frente: opacidad nodular de contornos irregulares en lóbulo superior derecho.

Figura 2. TACAR de tórax: en segmento anterior del lóbulo superior derecho una masa de 6 cm. en contacto con el hilio y otra formación de 2,5 cm. de contornos irregulares, cavitada en el mismo lóbulo.
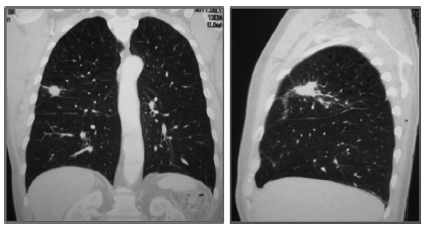
Figura 3. TACAR de tórax: en segmento anterior del lóbulo superior derecho uma masa de 6 cm. en contacto con el hilio y otra formación de 2,5 cm. de contornos irregulares, cavitada en el mismo lóbulo.
Se realizó una punción guiada por TAC cuyo resultado informó carcinoma poco diferenciado de células no pequeñas.
Se realizó una fibrobroncoscopía que evidenció una oclusión concéntrica del ostium bronquial del segmento anterior del lóbulo superior derecho.
En la tomografía por emisión de positrones y fusión con tomografía computada (PET/TC) se evi;denció en el lóbulo superior derecho a nivel para;hiliar una formación sólida hipermetabólica, con un Standardized Uptake Value (SUV) de 14,3, de contornos irregulares, de 48 mm de diámetro, que presenta contacto pleural, y otra imagen nodular hipercaptante (SUV 10) en el mismo lóbulo, en situación posterior. Se observan adenopatías en hilio pulmonar derecho (SUV 4,2) y en mediastino en situación prevascular, retrocavopretraqueal y precarinales (Figura 4).

Figura 4. PET/TC: formación sólida parahiliar derecha hipermetabólica (SUV 14,3), otra imagen nodular hipercaptante (SUV 10) en dicho lóbulo en situación posterior. Adenopatías en hilio pulmo;nar derecho (SUV 4,2) y en mediastino en situación prevascular, retrocavopretraqueal y precarinal.
Los resultados del examen funcional respiratorio se muestran en la Tabla 1.
Tabla 1

Discusión
Dr. Adrián Gilardoni: La discusión se focaliza en varios puntos: determinar las diferencias entre la sexta y la séptima edición del TNM y sus impli;cancias en la conducta terapéutica, la necesidad de confirmar o no histológicamente la presencia de compromiso N2 a través de una mediastinoscopía, establecer cuál sería la conducta terapéutica según este resultado, si los resultados obtenidos hasta el momento habilitarían a realizar neoadyuvan;cia y, de estar indicada la cirugía resectiva, qué extensión tendría la misma. Por último, saber si alguien se inclinaría por un tratamiento definitivo con radio-quimioterapia.
Utilizando la séptima edición del TNM de cáncer de pulmón1, la estadificación clínica del paciente sería T3 por presentar dos nódulos en el mismo lóbulo, N2 por adenomegalias mediasti;nales en TAC y PET TC, M0, estadío clínico IIIA, posible candidato a tratamiento neoadyuvante y posterior cirugía; mientras que en la sexta edición se hubiera clasificado como un T4 N2 MO, un es;tadio IIIB que antes hubiéramos propuesto para tratamiento definitivo con radio-quimioterapia.
Dado que la frecuencia de falsos positivos del PET TC en N2 es del 21%2, creo que es necesario certificar el N2 histológicamente y realizar una mediastinoscopía. Dra. Tinelli, desde el punto de vista de las imágenes, ¿qué nos aportan los hallazgos del PET/TC?
Dra. Tinetti: con respecto a las imágenes ganglionares mediastinales y su relación con el proceso neoproliferativo pulmonar, efectivamente debemos tener en cuenta que el estudio PET-TC presenta una alta sensibilidad pero una baja especificidad relativa, por lo cual el hallazgo de ganglios que muestran incremento de la cap;tación de fluorodesoxiglucosa (FDG) requieren confirmación histológica3. Si analizamos un poco más nuestro caso, vemos que existe una amplia diferencia entre el SUV de los nódulos pulmonares (SUV: 14.3 y 10) y el de los ganglios mediastinales (SUV: 4.2) siendo mucho menor la actividad me;tabólica de estos últimos. Si bien esto podría ser un indicio de que no se vincula directamente al proceso primario (probablemente de origen infla;matorio/infeccioso), debido al pequeño tamaño de éstos, es esperable que el SUV sea menor y por lo tanto no es posible asegurar que no estén vincu;lados con su patología de base, siendo necesario obtener confirmación histológica4.
Dr. Adrián Gilardoni: Así es, y en este caso se decidió realizar una mediastinoscopía, cuyo resultado fue negativo sobre 8 muestras remiti;das a patología. Con estos datos se reestadificó al paciente como T3 N0 M0, estadio IIb. Como consecuencia de estos nuevos datos se plantea la posibilidad de realizar una cirugía de resección pulmonar que en principio consistiría en una lobectomía superior derecha con vaciamiento mediastinal radical. Ahora, si observamos nueva;mente las imágenes debemos prestar atención a la localización yuxtacisural de la masa principal que puede implicar compromiso de otro lóbulo, así como también la cercanía de la arteria pul;monar, todo lo cual puede eventualmente hacer necesaria una neumonectomía. Dra. Boyeras, necesitaríamos saber en este caso si la reserva funcional respiratoria permitiría llevar a cabo esta conducta.
Dra. Iris Boyeras: Bien, a la luz de los datos expuestos se trata de un paciente que presenta como comorbilidad una enfermedad pulmonar obstructiva crónica (EPOC) de grado moderado, si bien siguiendo los criterios clásicos un valor de volumen espiratorio forzado en el primer segundo (VEF1)>2 L se asocia a una mortalidad postoperatoria de < 5%, definiendo el caso como apto para resección que alcance una neumonectomía5, resulta más adecuado utilizar el valor expresado como % del predicho fijándose un va;lor de corte de VEF1 >80% como adecuado para neumonectomía6. En este caso, dado que tanto el VEF1 como la difusión de monóxido de carbono (DLCO) preoperatorios se encuentran por debajo del 80%, conviene complementar los estudios con el cálculo de la función pulmonar postoperatoria predicha (ppo) según la extensión de la resección planeada. Esto implica estimar los valores de función pulmonar remanentes como predictores de riesgo utilizando ecuaciones desarrrolladas en base a diversos métodos que evalúan la cantidad de tejido pulmonar que realmente aporta a la función, como el centellograma de perfusión pul;monar7, o por conteo de segmentos a resecar8. Se ha visto que la presencia de FEV1ppo y DLCOppo < 40%, o de un producto predictivo postoperatorio <1650, es un predictor independiente de compli;caciones cardiopulmonares postoperatorias9, 10. Así podemos ver en la Tabla 2 que al calcular la función pulmonar ppo para lobectomía superior derecha los valores se encuentran por encima del 40% del predicho, indicando que el paciente está apto para la resección hasta esa extensión. Pero al analizar los valores de función ppo para neumonectomía derecha nos encontramos con un valor de VEF1ppo<40% y un Producto predictivo postoperatorio <1650, ambos asociados a mayor morbimortalidad perioperatoria, por lo cual de requerirse neumonectomía sería necesario contar con un test de ejercicio cardiopulmonar para va;lorar el consumo máximo de oxígeno (VO2max). Se acepta que con un valor preoperatorio de VO2max > de 20 ml/kg/min o >75% del predicho la mor;bilidad postoperatoria es < 10% y la mortalidad cercana a 0. El valor en este caso muestra que es apto para neumonectomía (Tabla 3).
Tabla 2

Tabla 3

De todas maneras, por tratarse de un paciente con estos factores de riesgo perioperatorios, se beneficia;ría con un adecuado tratamiento broncodilatador y Rehabilitación Respiratoria previa a la cirugía, si bien esta estrategia solo cuenta como sustento con una serie de trabajos con pequeñas poblaciones de pacientes, los mismos reportaron mejoría en predic;tores de riesgo como el VO2pico11, 12 y podría mejorar el pronóstico postoperatorio y ofrecer un mejor control de los síntomas.
Dr. Osvaldo Salariato: completada la evaluación preoperatoria y estadificación, en este paciente se logró realizar lobectomía superior derecha ya que no había compromiso cisural como se sospe;chó por las imágenes previas y se completó con vaciamiento mediastinal radical, a través de una toracotomía posterolateral derecha.
Algunos autores proponen realizar muestreo ganglionar mediastinal en lugar de realizar el vaciamiento mediastinal sistémico13 y se llegó a la conclusión de que es necesario tener un mapeo de los ganglios del mediastino ya sea a través de un muestreo o de un vaciamiento mediastinal 14, 15, no hallando evidencia de mejora de la sobrevida con uno u otro procedimiento13, 16, 17. En nuestra opinión y experiencia personal, el vaciamiento mediastinal como tal logra recuperar todos los ganglios regionales, que si bien no modifican la sobrevida, proveen una estatificación más exhaus;tiva debido a que la cantidad de ganglios extirpada nunca debe ser menor a 6.
En este paciente en particular se realizó va;ciamiento de los grupos 2r, 4r y 7. La anatomía patológica reveló un carcinoma escamoso modera;damente diferenciado en dos focos, con ausencia de metástasis ganglionares (N0).
Dr. Yassin: En cuanto a la evolución postope;ratoria, el paciente presentó múltiples compli;caciones, entre las que se destacan atelectasia pulmonar derecha que requirió fibrobroncoscopía, fístula a nivel del muñón del bronquio lobar superior, y neumonía asociada a ventilación por Pseudomona y Acinetobacter, por lo que requirió una internación prolongada de 36 días.
Dr. Adrián Gilardoni: ha sido un caso de difícil manejo postoperatorio como podía predecirse por la evaluación previa ya que tenía múltiples factores de riesgo; ahora bien, Dra. Said Nisi, en este contexto ¿qué propuestas de tratamiento adyuvante se podrían ofrecer?
Dra. Teresita Said Nisi: El caso corresponde a un estadio IIB en el contexto de un tabaquista severo, EPOC, con buen PS inicial pero que cursó un post-operatorio con múltiples complicaciones. Con respecto al tratamiento en un estadio IIB sin compromiso ganglionar y con buen PS, se beneficiaria de quimioterapia adyuvante (en tumores > 4 cm, aunque no exista compromiso ganglionar), consistente en 4 ciclos con base en platino.
La recomendación de la quimioterapia adyuvan;te sigue las directrices de la American Society of Clinical Oncology (ASCO)18, se fundamenta en el meta análisis Lung Adjuvant Cisplatin Evaluation (LACE)19, y en tres estudios prospectivos y aleato;rizados20; donde se evidenció mejoría del intervalo libre de enfermedad, reducción del riesgo relativo de recurrencia, reducción del riesgo relativo de muerte, y ventaja en la supervivencia global a los 5 años en favor de la quimioterapia.
En tanto que el impacto de la radioterapia adyuvante se aprecia en los casos con estadio IIIA – N2 (+), por lo cual no se recomendaría en este caso.
Dr. Adrián Gilardoni: Dadas las múltiples complicaciones que el paciente experimentó en el postoperatorio, en este caso se decidió su reeva;luación para determinar la posibilidad de iniciar adyuvancia en la medida que la recuperación de su estado general lo permitiera.
Como conclusión se resalta la importancia del trabajo multidisciplinario en el manejo de este tipo de pacientes con patología neoplásica y comorbilidad respiratoria, la relevancia de la aplicación de la nueva edición del TNM para la adecuada toma de conducta en estos pacientes, así como la renovada trascendencia de la medias;tinoscopía como "gold standard" en la estadifi;cación del mediastino, pese a los significativos aportes del PET/TC.
1. Rami-Porta R, Crowley J, Goldstraw P. The revised TNM staging system for lung cancer. Ann Thorac Cardiovasc Surg 2009; 15: 4-9. [ Links ]
2. De Leyn P, Lardinois D, Van Schil PE, et al. ESTS guide;lines for preoperative lymph node staging for non-small cell lung cancer. European Journal of Cardio-Thoracic Surgery 2007; 32:1-8. [ Links ]
3. Alberts WM. Diagnosis and Management of Lung Cancer Executive Summary. Chest 2007; 132:1S-19S. [ Links ]
4. Lim E, Baldwin D, Beckles M, et al. Guidelines on the radical management of patients with lung cancer. Thorax; 65: 1-27. [ Links ]
5. British Thoracic Society Society of Cardiothoracic Sur;geons of Great Britain Ireland Working P. Guidelines on the selection of patients with lung cancer for surgery. Thorax 2001; 56: 89-108. [ Links ]
6. Colice GL, Shafazand S, Griffin JP, et al. Physiologic Evaluation of the Patient With Lung Cancer Being Consid;ered for Resectional Surgery. Chest 2007; 132:161S-77S. [ Links ]
7. Bolliger CT, Wyser C, Roser H, et al. Lung Scanning and Exercise Testing for the Prediction of Postoperative Performance in Lung Resection Candidates at Increased Risk for Complications. Chest 1995; 108: 341-8. [ Links ]
8. Zeiher BG, Gross TJ, Kern JA, et al. Predicting Postopera;tive Pulmonary Function in Patients Undergoing Lung Resection. Chest 1995; 108: 68-72. [ Links ]
9. Brunelli A, Refai MA, Salati M, et al. Carbon monoxide lung diffusion capacity improves risk stratification in pa;tients without airflow limitation: evidence for systematic measurement before lung resection. European Journal of Cardio-Thoracic Surgery 2006; 29: 567-70. [ Links ]
10. Pierce R, Copland J, Sharpe K. Preoperative risk evalu;ation for lung cancer resection: predicted postoperative product as a predictor of surgical mortality. Am J Respir Crit Care Med 1994; 150: 947-55. [ Links ]
11. Jones L, Peddle C, Eves N. Effects of presurgical exercise training on cardiorespiratory fitness among patients undergoing thoracic surgery for malignant lung lesions. Cancer 2007; 110: 590-8. [ Links ]
12. Bobbio A, Chetta A, Ampollini L. Preoperative pulmonary rehabilitation in patients undergoing lung resection for nonsmall cell lung cancer. Eur J Cardiothorac Surg 2008; 33: 95-8. [ Links ]
13. Darling GE, Allen MS, Decker PA, et al. Randomized trial of mediastinal lymph node sampling versus com;plete lymphadenectomy during pulmonary resection in the patient with N0 or N1 (less than hilar) non small cell carcinoma: Results of the American College of Surgery Oncology Group Z0030 Trial. The Journal of thoracic and cardiovascular surgery; 141: 662-70. [ Links ]
14. Rami-Porta Rn, Wittekind C, Goldstraw P. Complete re;section in lung cancer surgery: proposed definition. Lung cancer (Amsterdam, Netherlands) 2005; 49: 25-33. [ Links ]
15. Wright G, Manser RL, Byrnes G, et al. Surgery for non-small cell lung cancer: systematic review and meta-analysis of randomised controlled trials. Thorax 2006; 61: 597-603. [ Links ]
16. Allen MS, Darling GE, Pechet TTV, et al. Morbidity and Mortality of Major Pulmonary Resections in Patients With Early-Stage Lung Cancer: Initial Results of the Random;ized, Prospective ACOSOG Z0030 Trial. The Annals of Thoracic Surgery 2006; 81: 1013-20. [ Links ]
17. Naruke T, Tsuchiya R, Kondo H, et al. Lymph node sampling in lung cancer: how should it be done? Eur J Cardiothorac Surg 1999; 16: 17-24 [ Links ]
18. Pisters KMW, Evans WK, Azzoli CG, et al. Cancer Care Ontario and American Society of Clinical Oncology Ad;juvant Chemotherapy and Adjuvant Radiation Therapy for Stages I-IIIA Resectable Non Small-Cell Lung Cancer Guideline. Journal of Clinical Oncology 2007; 25: 5506-18. [ Links ]
19. Pignon J-P, Tribodet Hln, Scagliotti GV, et al. Lung Adju;vant Cisplatin Evaluation: A Pooled Analysis by the LACE Collaborative Group. Journal of Clinical Oncology 2008; 26: 3552-9. [ Links ]
20. Arriagada R. Cisplatin-Based Adjuvant Chemotherapy in Patients with Completely Resected Non Small-Cell Lung Cancer. New England Journal of Medicine 2004; 350: 351-60. [ Links ]














