Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista americana de medicina respiratoria
versión On-line ISSN 1852-236X
Rev. am. med. respir. vol.14 no.3 CABA set. 2014
ATENEO DE CASO CLÍNICO
Obstrucción crónica de la vía aérea en un paciente de 18 años
Autores: Sebastian Lamot, Ana María López, Miguel Bergna, Juan Carlos Spina, Josefina Villa, Vanina Martín, Marco Solís, Marcos Hernández, Silvia Quadrelli
Fundación Sanatorio Güemes - Buenos Aires - Argentina
Correspondencia: Sebastian Lamot E-mail: blaslamot@gmail.com
Recibido: 02.08.2014
Aceptado: 04.08.2014
Presentación del caso (Josefina Villa)
Se presenta el caso de un paciente de 18 años de edad con obstrucción crónica al flujo aéreo, que fue derivado a consultorio externo de neumología, para evaluación pre-quirúrgica de neumonectomía.
Nació en 1994, parto natural, edad gestacional: 38 semanas, peso al nacer: 2800gr. A los 4 meses de edad fue hecho el diagnóstico de bronquiolitis sin requerimiento de internación. A los 10 meses de edad sufrió una neumonía con internación y oxigenoterapia. A los dos años presentó múltiples episodios de bronquitis obstructiva. Estuvo en seguimiento en el Hospital Garraham, hasta los 10 años de edad, período durante el cual presentó una atelectasia persistente en lóbulo inferior izquierdo (con fibrobroncoscopía normal) y requirió internaciones cada año por exacerbaciones.
En 1996, un proteinograma por electroforesis mostró un leve aumento de alfa, beta y ?-globulinas y el dosaje de inmunoglobulinas mostro elevación de todas las clases; el valor de IgE fue 500 UI/mL. Un lavado gástrico tuvo tres muestras negativas para BAAR, la PPD negativa y el test del sudor fue de 30meq/l. Un coproparasitológico fue negativo. Durante años recibió corticoides (CCT) inhalados y durante las reagudizaciones CTC sistémicos más broncodilatadores de acción corta.
Una espirometría en 2003 ya mostraba disminución severa del VEF1 (44%) con atrapamiento aéreo (Fig. 1). En 2009, un ecocardiograma doppler mostró hipertensión pulmonar leve.
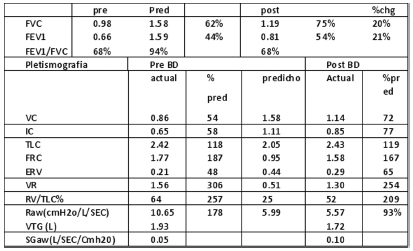
Figura 1. Espirometría año 2003.
En marzo del 2012 presentó neumonía asociada a empiema, cuadro que se repitió al mes requiriendo toracotomía con decorticación pleural izquierda y ventana pleurocutánea.
Cumplió esquema antibiótico con piperacilina/ tazobactam sin rescate de gérmenes en cultivos. Desde entonces persistió con cuadros respiratorios severos de tos y expectoración purulenta acompañados por fiebre, por lo cual se le propuso neumonectomía izquierda.
Un centellograma pulmonar V/Q de ese año mostró ausencia de ventilación y perfusión en pulmón izquierdo con pulmón derecho con distribución normal del radiotrazador.
La espirometría de ese momento se mantenía similar (Fig. 2). En el test de marcha de 6 minutos recorrió 486 mts (64.8 del esperado) con SaO2 inicial 98% y final 95% con Borg 2.
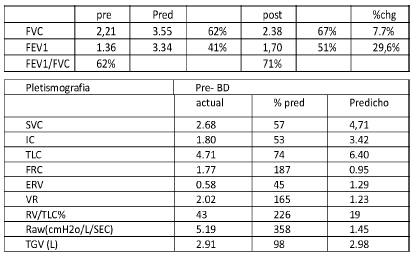
Figura 2. Espirometría año 2012.
Un nuevo proteinograma por electroforesis no mostró cambios. La IgE total fue de 907 UI/mL, la IgE específica para aspergillus fue Clase 0 y el dosaje de alfa 1 antitripsina: 146 mg/dL (83 a 199)
La serología para VIH fue no reactiva.
Se realizó la neumonectomía en otra institución. La anatomía patológica mostró: múltiples bronquiectasias y hemorragia intralveolar. Se observó además fibrosis intersticial con marcado engrosamiento de las paredes vasculares e infiltrado inflamatorio mono y polimorfonuclear. Con técnica de PAS y Ziehl Nielsen no se observaron microorganismos.
El paciente presentó evolución favorable en el post-operatorio y continúa actualmente en seguimiento en consultorios externos sin haber repetido episodios infecciosos ni presentar mayor limitación al ejercicio que antes de la cirugía.
En las Figuras 4 y 5 se muestran las imágenes de las tomografías pre y post operatoria respectivamente. En la Figura 6 se muestran los datos de la espirometría post operatoria.

Figura 4. (TAC de tórax preoperatoria).
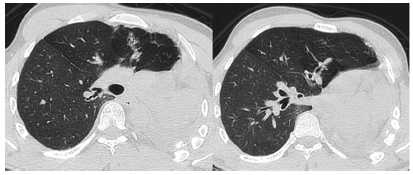
Figura 5. (TAC de tórax post-operatoria).

Figura 6. Espirometría post-neumonectomía
Silvia Quadrelli: Agradeceríamos la descripción de las imágenes por el Dr. Spina.
Juan Carlos Spina: En las imágenes preoperatorias, se observa disminución de volumen del hemitórax izquierdo, desplazamiento del mediastino, colapso del pulmón izquierdo con bronquiectasias cilíndricas y quísticas e hiperinsuflación compensadora del pulmón derecho (neumonocele).
En el hemitórax derecho se observa a nivel apical una bulla y bronquiectasias localizadas en el segmento anterior del lóbulo superior derecho. El lóbulo medio se encuentra hiperaireado.
En el examen post-operatorio persisten aisladas bronquiectasias localizadas en el segmento anterior del lóbulo superior derecho. Los cortes en espiración evidencian atrapamiento aéreo.
Sebastián Lamot: Ante este caso la primera pregunta que a mi juicio se plantea es qué patología llevó a un joven de 17 años a presentar daño pulmonar crónico asociado a elevación persistente de IgE, obstrucción crónica al flujo aéreo e infecciones a repetición.
La patología de inicio en la infancia y que lleva a la obstrucción crónica y severa del flujo aéreo más similar a la este paciente es, según creo, la llamada enfermedad pulmonar obstructiva crónica (EPOC) post-viral.
Los mecanismos involucrados en esta patología son los siguientes: Hay un exceso de producción de IgE específica con la consecuente hiperreactividad bronquial y sibilancias recurrentes; esto produce lesión bronquial y peribronquial que conduce a bronquitis crónica, bronquiectasias o bronquiolitis obliterante. Secundariamente, se produce lesión del intersticio pulmonar. En ocasiones hay atelectasia, neumotórax o neumomediastino y por último, lesión alveolar y del intersticio perialveolar1.
El paciente presentaba episodios de infecciones a repetición asociados a broncoespasmo con espirometría con severa limitación al flujo aéreo con mejoría post-broncodilatores. Este último hecho no es compatible con el daño pulmonar post-viral (que se caracteriza por obstrucción fija), pero cabe citar el antecedente familiar de asma (padre). En la tomografía había áreas de atrapamiento aéreo y zonas de perfusión en mosaico características de esta patología.
Han sido descriptos cuatro criterios diagnósticos2:
El primero es la presencia de bronquiolitis o neumonía severa con requerimiento de internación prolongada (frecuentemente con ventilación mecánica). Este paciente presentó al menos un episodio severo con requerimiento de internación y oxigenoterapia dentro del primer año de vida.
En segundo lugar, la presencia de síndrome de dificultad respiratoria de tipo obstructivo.
En tercer lugar, la presencia de insuficiencia respiratoria hipoxémica persistente hasta después de 30 días del episodio inicial. En este caso hubo hipoxemia, aunque no tenemos documentado si fue persistente.
El último criterio es la presencia de radiografías de tórax patológicas en forma permanente, que sí presenta este paciente.
Según la clasificación de gravedad2, cumplía algunos criterios de compromiso leve (SaO2 >93% aire ambiente, normocapnia, sin sobrecarga hídrica) y otros de severidad moderada (requerimiento de apoyo nutricional, hipertensión pulmonar leve). No presentó en ningún momento criterios de enfermedad severa.
Por otro lado, es importante remarcar que el paciente se realizó la neumonectomía debido a la perdida completa de funcionalidad del pulmón izquierdo y la presencia de infecciones a repetición, varias de ellas severas que causaban importante impacto en la calidad de vida y le impedían el desarrollo de sus actividades. Los hallazgos de la anatomía patológica no detectaron la presencia de fibrosis peribronquial que uno supone encontrar en estos casos, aunque no es infrecuente que la bronquiolitis obliterante no se pueda poner en evidencia en la biopsia3.
Respecto a la evolución y el pronóstico, hay que aclarar que en la mayoría de los pacientes los defectos de perfusión persisten y ocasionalmente mejoran (debido al crecimiento pulmonar, no como un signo de regresión de enfermedad). El pronóstico es incierto y depende de diversos factores, como el tiempo de requerimiento de oxígeno y la gravedad y frecuencia de reinfecciones. Una mayor edad al diagnóstico de la enfermedad y la presencia de atopía con valores de IgE en sangre periférica elevados se describieron como factores predisponentes a un peor pronóstico4.
Para concluir, creo que el paciente presenta un trastorno respiratorio crónico producto de infección viral en los primeros meses de vida. Esto condicionó la aparición de EPOC post-viral con bronquiectasias e infecciones a repetición. Presenta, además, antecedentes de asma en la familia, elevación persistente de IgE e hiperreactividad bronquial que podría ser otro factor agregado responsable de la obstrucción bronquial. No pudimos confirmar en la anatomía patológica la presencia de bronquiolitis obstructiva.
Dado que la neumonectomía removió el origen de las infecciones a repetición, no esperaríamos progresión del daño pulmonar.
Silvia Quadrelli: La neumonectomía nunca es una decisión fácil en patología benigna, especialmente en pacientes jóvenes. Sin embargo, su uso no es tan infrecuente. En una serie de casi 150 pacientes en Egipto, un 8% requirió neumonectomía como tratamiento de las bronquiectasias y si bien tuvieron un 13% de complicaciones en el grupo total, no hubo mortalidad asociada a la cirugía5. El porcentaje aún mayor (11%) y con similares resultados en una enorme serie china (790 pacientes) confirma que recurrir a este procedimiento, si bien indeseado o infrecuente, no es tan excepcional6.
Sin embargo, los resultados de este último estudio son menos optimistas y muestran que un 14% de los pacientes no mejoró o incluso empeoró, demostrando la importancia de la cuidadosa selección de los pacientes. Un estudio turco en niños, en solamente 10 pacientes, sometidos a neumonectomía (por tuberculosis o bronquiectasias) demostró que no hubo mortalidad ni complicaciones de largo plazo7.
Por otra parte, Blyth y col. identificaron tres grupos diferentes en términos de riesgo para una neumonectomía por patología inflamatoria: a) la neumonectomía a través de un empiema (como grupo de alto riesgo), b) la neumonectomía en tuberculosis activa y c) la neumonectomía en niños. Casi el 80% de los empiemas post-neumonectomías ocurrieron en el primer grupo mientras que hubo muy pocas complicaciones en los otros pacientes8.
Estos resultados nos alentaron a incluir la neumonectomía como una opción terapéutica, dada la severidad del último episodio infeccioso y la pobre calidad de vida de este paciente.
Dra. Martín, ¿Cómo juzgó Ud. la capacidad funcional de este paciente antes de la cirugía en vistas a definir el riesgo operatorio?
Vanina Martin: Los últimos de función pulmonar completos de los que disponíamos tenían casi un año, ya que en ese momento no disponíamos de equipamiento para medir volúmenes y DLCO y el paciente estaba recurrentemente enfermo y nunca podía completar sus estudios. Pero la última espirometría al momento de tomar la decisión quirúgica era idéntica a la del último estudio pletismográfico. Debe decirse que todas las guías utilizadas para medir riesgo de resección, se basan en grandes series de pacientes con cáncer y estos pacientes pueden tener diferencias. Los algoritmos más utilizados utilizan el valor de VEF1 post-op (VEF1ppo) para excluir pacientes por riesgo prohibitivo. El riesgo perioperatoria aumenta sustancialmente cuando el VEF1ppo es 40% del predicho o menos y las tasas de mortalidad se eleven a 16-50% y algunos autores comunican mortalidad de hasta 60% si el VEF1ppo es 30% o menos9. Sin embargo, las recomendaciones más recientes son algo menos alarmistas. Concretamente, las guidelines de la European Respiratory Society and European Society of Thoracic Surgeons10 recomiendan el uso de ejercicio en todo paciente con VEF1 <80% y solo excluye de neumonectomía a los pacientes con VEF1 < 35% (Fig. 3) y VO2 < 10ml/kg. Si bien este paciente tenía valores de VEF1 muy bajos (44%), un dato importante (también incluído en las guías) era la falta de perfusión y ventilación en el pulmón a resecar. Con lo cual, el cálculo del VEF1ppo sería prácticamente el mismo que el VEF1 preoperatorio. Lamentablemente, no se obtuvo la autorización de su obra social para un estudio de ejercicio que permitiera medir la VO2 máxima, pero en el equivalente recientemente revitalizado (la subida de escaleras) el paciente fue capaz de subir de 20 m. En la literatura la subida de 22 m o más estuvo asociada a mortalidad menor de 1% aún en pacientes con VEF1ppo menor de 40%. Estos hallazgos nos inclinaron a aceptar la cirugía.
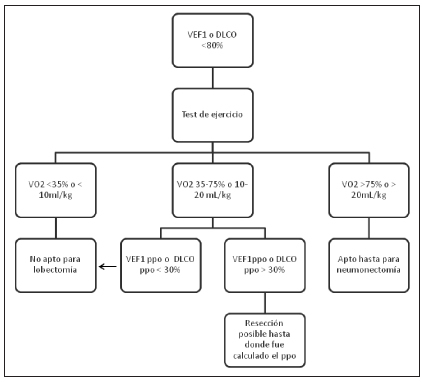
Figura 3. Recomendaciones de la ETS/ERS.
Marco Solís: En realidad, la complicación más frecuente en todas las series de neumonectomía por procesos benignos es el empiema que oscila alrededor del 15-30% según las distintas series. Como fue mencionado, el principal factor de riesgo para esta complicación es el empiema pre-operatorio, que este paciente no presentaba. Otros factores de riesgo son el mal estado nutricional y la infección activa. Por esta razón, es que se enfatizó en mejorar el estado nutricional controlando la dieta y el peso y el tratamiento de la potencial infección. El paciente recibió tratamiento completo como para una infección respiratoria previamente a la cirugía.
Silvia Quadrelli: Nos interesa especialmente la opinión de nuestros invitados expertos en EPOC
Dra. Ana López, ¿cuáles son sus reflexiones sobre este caso?
Ana López: Considerando detalladamente la historia clínica presentada, deberíamos preguntarnos:
- ¿Este paciente tuvo una bronquiolitis obliterante (BO)?
- ¿Fue secundaria una infección por adenovirus?
- ¿Le dejó secuelas? Además, ¿le desencadenó hiper-reactividad bronquial?
- ¿Cuáles fueron las causas de las atelectasias y bronquiectasias?
- ¿Cuál fue el rol de la IgE en todo el proceso y por qué se indicó la neumonectomía?
La causa más frecuente de BO en pediatría es la pos-infecciosa, casi siempre ligada a adenovirus (AV) hasta en 71% de los casos3, especialmente los serotipos 3, 5, 7 y 21 que en algunas series son identificados como un factor de riesgo independiente. En 1984 se describe un nuevo serotipo de AV: 7h que es de mayor virulencia. La doctora Murtagh P. del Hospital de Pediatría Garrahan, hace 34 años describió en nuestro país a la BO post infecciosa, en una serie que incluye un total de 514 pacientes, entre los años 1987 a 2005, que tenían infecciones respiratorias agudas bajas. Entre ellos, se tipificaron adenovirus en 65 pacientes: Ad 7h (58.5%) y otros Ad en el 41.5% (Ad 3x,Ad C, Ad 7i,Ad 11a,Ad 11c y Ad4a ); 14% fallecieron en el episodio inicial y 40% evolucionaron con secuelas1.
Además, 4 al 10% de las neumonías en niños son producidas por Adenovirus y entre 14 al 60% tienen algún grado de secuelas. En la literatura se registra que las distintas áreas geográficas podrían influir en que la infección por adenovirus tenga diferentes evoluciones y prevalencias, ya que éstas difieren entre el hemisferio norte y sur (Chile, Brasil o Argentina)3.
Entonces, ante el interrogante: ¿este paciente desarrolló un BO post infecciosa? tenemos importantes datos a favor: a) clínicos: bronquitis obstructiva recidivante; b) funcionales: patrón obstructivo severo con atrapamiento aéreo y aumento de la resistencia, caída de la conductancia y una mejoría significativa con BD (que no es lo habitual de la BO constrictiva), c) TACAR: a 1 año y 7 meses: atelectasia LII, a los 7 años: atelectasia masiva izquierda, segmentaria LM e hiperinflación compensadora del pulmón derecho, desarrollando a los 18 años atelectasia completa pulmonar. La presencia de perfusión en mosaico es un signo indirecto de BO, (especificidad 99%), bronquiectasias (sensibilidad 80%), engrosamiento bronquial, impactación mucoide y atelectasias.
El centellograma pulmonar evidencia ausencia de la perfusión del pulmón izquierdo, no obstante, sorprende el buen Test de Caminata (6MWT), lo que podría explicarse por una exclusión funcional, no fisiológica de la Ventilación del pulmón izquierdo sin perfusión.
La biopsia quirúrgica en la actualidad, ha sido sustituida por la TACAR, pero puede llegar a ser necesaria en algunos casos, aunque su realización es difícil ya que generalmente estos pacientes son evaluados cursando el episodio agudo, en el que la cirugía aumenta la morbimortalidad. Adicionalmente, como el compromiso es parcheado, si el lugar a biopsiar no está bien seleccionado, el resultado puede ser normal hasta en un 25% de los casos.
La otra pregunta que surge es: ¿desarrolló una BO post-infecciosa, por qué y cuál es el abanico de posibilidades de la evolución?
Las diferentes opciones evolutivas de la BO son las siguientes: puede ser autolimitada y benigna; puede haber una mejoría clínica en el seguimiento en relación al crecimiento pulmonar y reducción en la resistencia de la vía aérea; puede evolucionar con secuelas: (esto es en un bajo porcentaje y más en nuestro medio), puede progresar a insuficiencia respiratoria crónica (una de principales causas en países en desarrollo) y puede llegar requerir trasplante pulmonar. Además tenemos otro dato significativo que son los valores elevados de IgE en sangre periférica.
¿Qué factores de riesgo predisponen a un peor pronóstico de la BO post-infecciosa? Y ¿de qué depende que queden tantas secuelas? Los factores que influyen son la edad (a menor edad peor pronóstico), la infección por adenovirus sumada a la gravedad del episodio inicial, el área geográfica y la atopía con valores elevados de IgE en sangre periférica. Nuestro paciente tenía todas estas variables de mal pronóstico.
La gravedad del episodio puede ser evaluada por un puntaje clínico-radiológico para diagnóstico de BO pos-infecciosa. Hay una serie de criterios (clínicos, infección por AV, TACAR) si el puntaje es de = 7 predice diagnóstico de BO pos-infecciosa con alta precisión (especificidad 100% y sensibilidad 67%). Lo llamativo y quizás desconocido es que la evolución de la BO a mediano y largo plazo varía de acuerdo a las distintas áreas geográficas y que también la severidad está asociada a distintos serotipos3.
La susceptibilidad para desarrollar BO parece estar asociada al origen geográfico. Por ejemplo, se ha detectado mayor incidencia de BO pos-infecciosa en nativos de Nueva Zelanda, Canadá, Alaska y Sudamérica que en poblaciones de Europa y otras regiones de América del norte. Hay mayor incidencia de adenovirus AV 4 y 7, y subgénero B en hemisferio sur predomina el AV 7h que fue descripto como un serotipo de mayor virulencia y según la OMS representa el 20% de todas las infecciones por AV.
Recientes estudios desarrollados en la Argentina, en pacientes con BO pos-infecciosa y en los ancestros nativos americanos (amerindios), señalan que el HLA haplotipo DR8-DQB1*0302, se encuentra aumentado con respecto a un grupo control3, 11.
En Chile se concluye que el compromiso pulmonar severo predispone a desarrollar BO, un estudio retrospectivo (n 45) de niños internados con neumonía por AV, a 5 años seguimiento, comunicó 7 fallecidos, 47.4% pacientes que desarrollaron BO con internación en UTI, ARM y/o Oxigenoterapia, mayor uso de corticoides sistémicos y B2 agonistas12.
Un estudio observacional en Brasil, prospectivo, con seguimiento 3,5 años (n 31), edad media 4,5 años, determinó que cuando se producía bronquiolitis aguda en los primeros 2 años de vida, había un 22,6% de remisión de los síntomas respiratorios, un 67,7% de síntomas persistentes y un 9,7% de fallecidos. En este estudio predispondrían a peor pronóstico la menor edad al comienzo de la enfermedad y la presencia de atopía (aumento de IgE)13.
En España un estudio retrospectivo entre 1994 y 2011, en 22 pacientes, con BO post infecciosa, se realizó un seguimiento de 5 años (n 22, edad media 4,87 años) se encontró que la etiología en el 13% era por AV, 9% por influenza y en 9% por parainfluenza. En la TACAR, había patrón en mosaico en el 100% y bronquiectasias en el 36%14.
En estos pacientes se observaron dos grupos: uno en el que había una mejoría de la función pulmonar (no se sabe bien porque, si se debe al crecimiento pulmonar u otras causas) y en otro grupo se evidenció una tendencia a la estabilidad.
Lo llamativo es que 9 de los 22 pacientes tenían el antecedente de atopía con rinitis alérgica, sensibilización a ácaros o gramíneas, alergia alimentaria y dermatitis atópica.
Como resumen clínico de este caso podemos decir:
Tenemos un paciente con infección viral severa a los 10 meses, con secuelas de tal magnitud, que favorecieron exacerbaciones frecuentes, episodio de neumonía y empiema, que llevaron a la neumonectomía. El agente etiológico probablemente sea un adenovirus por la evolución y presencia de un haplotipo HLA en el hemisferio sur, a lo que se suma la atopía como factor de riesgo, que predispone a peor pronóstico. Estas diferencias en las áreas geográficas dificultan la posibilidad de obtener una vacuna global ya que además hay mutación viral.
¿Cuáles son los diferentes escenarios a considerar cuando nos enfrentamos con pacientes con BO?
Escenarios Clínicos:
1. Como enfermedad primaria: por exposición a polvos minerales o gases irritantes, infección viral, etc.
2. Como parte de una enfermedad intersticial: neumonitis por hipersensibilidad, bronquiolitis respiratoria del fumador (RB-ILD) y enfermedad colágeno-vascular.
3. En el contexto de una enfermedad de la vía aérea de mayor calibre: asma bronquial, fibrosis quística, EPOC o bronquiectasias.
Patrones Anátomos Patológicos:
1. Bronquiolitis celular: infiltrado inflamatorio intraluminal y pared bronquiolar c/ grados de fibrosis.
2. Bronquiolitis infecciosa: Neumonitis por hipersensibilidad. Bronquiolitis folicular Panbronquiolitis.
3. Bronquiolitis respiratoria: relación con tabaquismo, acumulación de Ma pigmentados en los bronquiolos respiratorios y alvéolos. Bronquiolitis respiratoria asociada a enfermedad pulmonar intersticial (BR-ILD) y Neumonía Intersticial descamativa (DIP).
4. Bronquiolitis constrictiva: fibrosis concéntrica entre epitelio bronquiolar y muscularis mucosae, estrechamiento u obliteración de bronquiolos: Idiopática o secundaria a infecciones, medicamentos, enfermedad colágeno-vascular y trasplantes.
5. Bronquiolitis obliterante c/pólipos intraluminales (COP): pólipos de tejido de granulación en el interior de los bronquiolos respiratorios y conductos alveolares asociados a neumonía organizada ya sea idiopática o secundaria a infecciones, medicamentos, enfermedad colágeno-vascular y trasplante.
Patrones Tomográficos
- Patrón de árbol en brote: bronquiectasias.
- Nódulos centrilobulillares: Neumonitis por Hipersensibilidad.
- Perfusión en mosaico: Bronquiolitis constrictiva.
- Vidrio esmerilado y/o consolidación: Neumonía Obliterante Criptogenética (COP).
Dr. Bergna, ¿su diagnóstico coincide con la interpretación de este cuadro como EPOC post-viral?
Miguel Bergna: EPOC post viral es lo que antes llamábamos secuela de infecciones graves del pulmón. El nombre de EPOC tiene que ver con la presencia de un patrón en la espirometría que muestra limitación al flujo aéreo que persiste luego del broncodilatador. Un diagnóstico alternativo a la causa viral sería la neumonía necrotizante con insuficiencia respiratoria aguda, se podría sospechar por la unilateralidad de las lesiones (como muestra el centello VQ el pulmón izquierdo no contribuye en nada a la hematosis y el derecho parece normal). De hecho, como fue señalado, el pulmón derecho está milagrosamente preservado (ya que podría tener secuelas de infecciones previas repetidas).
Creo que si el paciente era o no asmático no lo vamos a poder saber porque tempranamente fue afectado por la neumonía grave. Aunque su respuesta francamente positiva a broncodilatadores habla a favor de eso, podría ser simplemente consecuencia de la infección.
Yo creo que uno puede asumir una causa infecciosa como probable, y las secuelas asumirlas como EPOC, y seguir la evolución del mismo y ver de qué manera se comporta.
Alejandro Shejtman: ¿Cuál es el pronóstico de largo plazo de este paciente? ¿Ustedes consideran que sería candidato al trasplante?
Miguel Bergna: Creo que esto va a depender de cómo evolucione el paciente, si el pulmón remanente repite infecciones y comienza a deteriorar la función pulmonar aún más, es posible que se plantee esta alternativa. No tengo experiencia en qué pasa con estos pacientes a futuro, para nosotros es bastante infrecuente encontrarnos con este grado de secuela y mucho más tener que recurrir a la neumonectomía como tratamiento. En general, luego de la neumonectomía evolucionan bien, pero un porcentaje menor evolucionan mal y sí van a requerir trasplante.
Ana López: En ese sentido, es importante descartar colonización bronquial y si la tiene tratarlo oportunamente, para prevenir el desarrollo de complicaciones más serias. Además de tratarlo como un asmático con toda la medicación posible, y protegerlo con vacunas.
Marcos Hernández: El tema de si tiene o no asma puede ser difícil de resolver y quizás sólo sea semántico. De hecho, hay estudios que han intentado relacionar la infección respiratoria viral subclínica reciente y anterior con la hiper-reactividad medida por histamina. Un estudio de 495 niños y adolescentes de Copenhague midió la respuesta a la histamina, encontrando que estaba presente en 16%, de los cuales sólo un tercio tenía asma clínicamente diagnosticable. Un 10% de todos los sujetos testeados tenía niveles aumentados de los anticuerpos IgM contra parainfluenza, gripe, adenovirus o el virus sincicial respiratorio (RSV), reflejando una infección recientemente adquirida pero no se encontró ninguna asociación entre la hiper-reactividad bronquial y los anticuerpos contra virus respiratorios ni ninguna asociación entre el grado de la sensibilidad bronquial y los anticuerpos virales. Los autores interpretaron que el aumento de la reactividad bronquial en niños y adolescentes asintomáticos, no es causado por infecciones respiratorias virales recientes o anteriores. Sin embargo, los resultados publicados al respecto son controversiales. En el relato de la historia no hay antecedentes familiares de asma ni otras manifestaciones de atopía y no tenía eosinofilia en el esputo. Pero las infecciones bacterianas recurrentes podrían cambiar el perfil del esputo (que por otra parte no siempre muestra eosinofilia en el asma) y la historia familiar no se da en el 100% de los asmáticos. Desde un punto de vista práctico, tiene obstrucción bronquial con respuesta a Bd y parece lógico tratarlo como un asmático15.
Marco Solís: De hecho, una de nuestras primeras preguntas era si podíamos llamar "EPOC" a esta enfermedad con tanto grado de destrucción pulmonar y en un sujeto tan joven. Cuando el estudio cooperativo del Brigham y la Candelaria hablan de EPOC en "jóvenes" hablan de pacientes de menos de 55 años y en el estudio de Celli los pacientes más jóvenes tenían 46 años. No hay dudas de que han sido identificados factores de riesgo en la infancia para el desarrollo del EPOC del adulto. El asma materna o paterna, el asma de la niñez, el tabaquismo materno y las infecciones respiratorias de la niñez están asociados a un FEV más bajo (lo que algunos autores definieron como "factores de desventaja de la niñez"). En un estudio epidemiológico; el 40% de los EPOC tenía uno o más de estos factores de "desventaja de la niñez". Además, estos factores de desventaja están asociados a declinación más rápida del FEV1, por lo cual, parecería que estas personas tienen un riesgo substancialmente creciente de COPD. El interés de esto es poder desarrollar estrategias de prevención. Pero en este caso, la duda en calificarlo como EPOC. A nuestro juicio, en este caso, no se puede hablar de EPOC en el sentido tradicional por la coexistencia de una enfermedad que produce infección recurrente y que se asocia a destrucción pulmonar amplia.
Silvia Quadrelli: Coincido con el Dr. Solís. La explicación lógica a la obstrucción sería la presencia de BO. En la serie publicada por el grupo del Garrahan en el 201016, los pacientes (todos pediátricos) con BO post-infecciosa tenían un VEF1 promedio de 40% con un RV en la pletismografía de más de 340% y un RV/TLC de casi 60%. Como se señaló en las distintas series que este grupo publicó, no había respuesta Bd, por lo cual, coincido en que puede haber otros factores (como la atopía asociada) que justifiquen este hallazgo. Pero aunque no hayamos encontrado la confirmación en la AP (y aún si esta no es la base AP) podemos decir que cumple los criterios del grupo del Garrahan para calificarlo de "EPOC postviral".
Marcos Hernández: De hecho Bandeira y col.17 compararon pacientes con asma de difícil control y con BO y si bien mostraron que los pacientes con BO demostraron un mayor grado de obstrucción y mayor hiperinflación, así como más hallazgos en la TAC de atenuación disminuida, patrón en mosaico y atrapamiento aéreo, las cifras se superponen mucho y ni siquiera los niveles de IgE o la presencia de atopía permiten diferenciar las dos enfermedades. Es interesante que en otros estudios los altos niveles de IgE han mostrado pero pronóstico para la BO. Probablemente porque señalen (quizás en este caso) un verdadero síndrome de superposición. Y en cuanto al diagnóstico de BO post-infecciosa, el diagnóstico no requiere AP y no sabemos si todos los casos descriptos realmente tenían ese hallazgo en la AP. En las series publicadas
el diagnóstico se hace en base a la presentación clínica, particularmente con una historia de bronquiolitis o neumonía por adenovirus, obstrucción fija de la vía aérea y los cambios característicos de la perfusión del mosaico, atenuación vascular, y bronquiectasias centrales en la TAC. Es cierto que con el avanzado grado de destrucción del pulmón más afectado en este paciente, es difícil valorar los hallazgos tomográficos.
Silvia Quadrelli: Los criterios diagnósticos para BO postrasplante fueron claramente definidos, no así para la BO posinfecciosa. El diagnóstico definitivo de BO lo aporta la biopsia de pulmón; su realización presenta alta morbilidad y mortalidad, especialmente en pacientes gravemente enfermos. En este caso, ante un pulmón destruido no tiene mucho valor (supongo) que no se vean hallazgos típicos en la AP del pulmón resecado. La función pulmonar tiene un gran valor debido a su patrón característico, pero este no se encuentra disponible para la mayoría de los neumonólogos pediatras. En el pulmón remanente no se ven claramente hallazgos sugestivos de BO: patrón en mosaico (que implica la combinación de atrapamiento aéreo y oligoemia) ni tampoco dilatación bronquial, engrosamiento de la pared bronquial u opacidades en vidrio esmerilado. Aunque sí se observan alteraciones de la perfusión. Y el funcional post-operatorio (Fig. 6) (además de mostrar que no tuvo disminución de la CV) muestra persistencia del patrón obstructivo. Pero es cierto que esto puede ser síndrome de superposición y que esto sea evidencia de hiperreactividad bronquial.
Marco Solís: En el trabajo de Colom y Teper (del Hospital Gutiérrez)3 los autores validan criterios diagnósticos para evaluar pacientes con enfermedad pulmonar crónica en pediatría y desarrollaron un índice adjudicando puntaje: a) "historia clínica típica" (4 puntos), definida como: paciente previamente sano, con un grave episodio de bronquiolitis que desarrolla hipoxemia crónica (O2 sat<92%), por más de 60 días; b) "historia de infección por adenovirus" (3 puntos), y "TCAR con patrón en mosaico" (4 puntos). Un puntaje =7 predice el diagnóstico de BO posinfecciosa con alta precisión (especificidad 100% y sensibilidad 67%). Se debe enfatizar que un puntaje negativo (<7) no descarta con certeza el diagnóstico de BO. Según datos indirectos (no tuvimos acceso a su historia pediátrica) hay confirmación de la infección por AV y alcanzaría el puntaje. Aunque es raro que no se haya encontrado BO en el pulmón removido.
Silvia Quadrelli: Vale la pena remarcar que gran parte de la literatura a nivel mundial sobre este tema viene de grupos pediátricos argentinos, tanto del Hospital Gutiérrez como del Garrahan. Me gustaría enfatizar la enorme contribución que han hecho los pediatras argentinos al tema de la BO post-infecciosa y las secuelas de las infecciones virales en la infancia en general. En relación a la pregunta del Dr. Schejman, como mencionó el Dr. Bergna, se suele ver a estos pacientes cuando presentan ya compromiso contralateral, es decir muchas veces y es poco frecuente que se plantee la neumonectomía aunque más no fuera por esa razón. Hay una serie pequeña de un grupo francés que tiene alrededor de 22 pacientes sometidos a trasplante unilateral de pulmón con neumonectomia previa; estos tienen una mortalidad más alta que las de trasplante pulmonar habitual y la justificación que los autores dan para esa mayor mortalidad es que el mediastino está traccionado y eso genera alteraciones anatómicas que complican el manejo posoperatorio inicial. Si bien dentro de ese grupo los que presentan bronquiectasias no FQ son los que tienen más baja mortalidad, de presentarse la eventualidad de un transplante, este paciente se incluiría en un grupo de mayor riesgo. Podemos por tanto decir que si bien por ahora resolvimos la parte más grave de nuestro paciente, aún queda mucho por delante y es necesario recordar que es un paciente muy joven con un pulmón único y "en riesgo" y que es importante asegurar la adherencia al seguimiento y prevención de la pérdida de la función pulmonar remanente.
En conclusión, creemos que este paciente tuvo una infección por adenovirus en la infancia y desarrolló lo que en la literatura pediátrica se conoce como "EPOC posviral". La neumonectomía resolvió la infección recurrente pero deberá vigilarse la evolución del pulmón remanente haciendo todos los esfuerzos para preservar la función pulmonar.
1. Castaños C, Aguerre V, González Pena H, et al. Bronquiolitis Obliterante Postinfecciosa. Medicina Infantil 2001; 8: 90-96. [ Links ]
2. Grenoville MA. Secuelas en la infancia de las infecciones respiratorias agudas bajas. Pronap 2003. Módulo 1 [ Links ]
3. Colom AJ, Teper AM. Bronquiolitis obliterante postinfecciosa. Arch Argent Pediatr 2009; 10: 160-7. [ Links ]
4. Zhang L, Irion K, Kozakewich H, et al. Clinical course of post infectious bronchiolitis obliterans. Pediatr Pulmonol. 2000, 29: 341-50. [ Links ]
5. Al-Refaie RE, Amer S, El-Shabrawy M. Surgical treatment of bronchiectasis: a retrospective observational study of 138 patients. J Thorac Dis. 2013, 5: 228-33. [ Links ]
6. Zhang P, Jiang G, Ding J, et al. Surgical treatment of bronchiectasis: a retrospective analysis of 790 patients. Ann Thorac Surg. 2010; 90: 246-50. [ Links ]
7. Kosar A, Orki A, Kiral H, et al. Pneumonectomy in children for destroyed lung: evaluation of 18 cases. Ann ThoracSurg. 2010; 89: 226-31. [ Links ]
8. Blyth DF. Pneumonectomy for inflammatory lung disease. Eur J Cardiothorac Surg. 2000; 18: 429-34.
9. Nakahara K, Ohno K, Hashimoto J, et al. Prediction of postoperative respiratory failure in patients undergoing lung resection for lung cancer. Ann Thorac Surg 1988; 46: 549-52. [ Links ]
10. The European Respiratory Society and European Society of Thoracic Surgeons clinical guidelines for evaluating fitness for radical treatment (surgery and chemoradiotherapy) in patients with lung cancer. European Respiratory Society; European Society of Thoracic Surgeons Joint Task Force on Fitness For Radical Therapy. Eur J Cardiothorac Surg. 2009; 36: 181-4 [ Links ]
11. Teper AM, Marcos CY, Theiler G, Colom AJ, Fainboim L. Association between HLA and the incidence of bronchiolitis obliterans in Argentina. Am J Respir Crit Care Med 2004;169: 382. [ Links ]
12. Jose A. Castro-Rodriguez, Cecilia Daszenies, Marianela Garcia, Rodolfo Meyer, and Ramiro Gonzales. Adenovirus Pneumonia in Infants and Factors for Developing Bronchiolitis Obliterans: A 5-Year Follow-Up. Pediatric Pneumonol 2006; 41: 947-53. [ Links ]
13. Linjie Zhang, Klaus Irion, Harry Kozakewich, Lynne Reid, José J. Camargo Nelson da Silva Porto and Fernando Abreu e Silva .Clinical course of post infectious bronchiolitis obliterans. Pediatric Pulmonology 2000; 29: 341-350. [ Links ]
14. Sardón O, Pérez-Yarzaa EG, Aldasoro A, Corcuera P, Mintegui A et al. Bronquiolitis obliterante. Evolución a medio plazo. An Pediatr (Barc). 2012.doi: 10.1016/j.anpedi.2011.10.012. [ Links ]
15. Backer V1, Ulrik CS, Bach-Mortensen N, Glikmann G, Mordhorst CH. Relationship between viral antibodies and bronchial hyperresponsiveness in 495 unselected children and adolescents. Allergy. 1993 May; 48(4): 240-7. [ Links ]
16. Aguerre V1, Castaños C, Pena HG, Grenoville M, Murtagh P. Postinfectious bronchiolitis obliterans in children: clinical and pulmonary function findings. Pediatr Pulmonol. 2010; 45: 1180-5. [ Links ]
17. Bandeira T1, Negreiro F, Ferreira R, Salgueiro M, Lobo L, Aguiar P, Trindade JC. Clinical, radiological, and physiological differences between obliterative bronchiolitis and problematic severe asthma in adolescents and young adults: the early origins of the overlap syndrome? Pediatr Pulmonol. 2011, 46: 573-80. [ Links ]













