Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista americana de medicina respiratoria
On-line version ISSN 1852-236X
Rev. am. med. respir. vol.14 no.4 CABA Dec. 2014
CASUÍSTICA
Síndrome de obesidad e hipoventilación en terapia intensiva
Reporte de serie de casos de un Hospital de Comunidad
Autores: Eduardo Borsini1, 2, Florencia Ballestero1, Miguel Blasco1, 2, Sebastián Chapela1, Emiliano Descotte1, Florencia Lascar1, Julio Chertcoff1, 2
1Servicio de Terapia Intensiva,
2Servicio de Medicina Respiratoria Hospital Británico de Buenos Aires
Correspondencia: Eduardo Borsini E-mail: borsinieduardo@yahoo.com.ar
Recibido: 25.04.2014
Aceptado: 14.07.2014
Resumen
El Síndrome de Obesidad e Hipoventilación (SOH) incluye hipercapnia, trastornos del sueño y obesidad. Se describen características clínicas y evolución de una serie retrospectiva de pacientes con SOH internados en una Unidad de Terapia Intensiva (UTI) polivalente. Durante 24 meses se identificaron 13 pacientes, 9 hombres (69.23%), media de edad de 58.6 años (SD ± 12.4), IMC medio; 48.5 kg/m2 (SD ± 9.1). Los motivos de internación fueron: fallo respiratorio con hipercapnia en 8 (61.53%), titulación de la VNI en 3 (23.07%) y evento coronario en 2 (15.38%). El tiempo medio de internación en UTI fue de 8.9 días. En 11 casos (84.6%) se realizó una poligrafía respiratoria (PR). Todos tuvieron IAH > 5/hora y en el 90.9% este fue > 30/h. Se utilizó ventilación no invasiva (VNI) en modalidad bilevel (modo S/T) con presiones; IPAP de 23 (SD ± 4.17), EPAP de 12 (SD ± 4.25), frecuencia respiratoria de 18 por minuto (SD ± 1.7). Se realizaron 13 titulaciones con VNI. Cuatro casos (30.77%) requirieron modalidad con volumen asegurado. Con VNI existieron cambios significativos para pH arterial (p = 0.0019), PaO2 (p = 0.0001), PaCO2 (p = 0.0001) y HCO3 (p = 0.008) y la ESS al alta (6.23 ± 2.20) p = 0.0001. Ningún paciente requirió intubación traqueal (IOT) ni se registraron fallecimientos. Todos egresaron con interfases nasobucales e indicación de uso nocturno. En nuestra experiencia la mayoría de las admisiones se debieron a falla respiratoria con hipercapnia y recibieron modalidad bilevel. La PR al lado de la cama del paciente permitió el acceso al diagnóstico y monitoreo de la VNI.
Palabras clave: Obesidad; Hipoventilación; Ventilación no invasiva.
Abstract
Obesity and Hypoventilation Syndrome in an Intensive Care Unit
Obesity Hypoventilation Syndrome (OHS) includes hypercapnia, sleep disturbances and obesity after other causes of hypoventilation have been excluded. We describe clinical features and evolution of a retrospective series of patients with OHS admitted to a polyvalent ICU. During 24 months, 13 patients, 9 males (69.23%) with an average age of 58.6 years old (SD ± 12.4) and a BMI mean of 48.5 kg/m2 (SD ± 9.1) were identified. The reasons for hospitalizations were: respiratory failure with hypercapnia in 8 patients (61.53%), titration of non invasive ventilation (NIV) in 3 (23.07%) and acute coronary event in 2 cases (15.38%). The mean hospitalization time was 8.9 days. We performed a respiratory polygraphy (RP) in 11 cases (84.6%). All patients had AHI >5/hour; in 90.9% the AHI was severely elevated (> 30/h).
We used non invasive ventilation in bilevel modality (S/T mode) in all patients. The pressures used in H2O cm were; IPAP of 23 (SD ± 4.17), EPAP of 12 (SD ± 4.25), respiratory frequency of 18 per minute (SD ± 1.7). We performed 13 titration tests with NIV prior to discharge. Four cases (30.77%) needed presometric modality with insured volume. After NIV, we observed significant changes in arterial pH (p = 0.0019), PaO2 (p = 0.0001), PaCO2 (p = 0.0001), HCO3 (p = 0.008) and the mean of ESS at discharge (6.23 ± 2.20; p = 0.0001). No patient required tracheal intubation and no deaths were observed. All were discharged with NIV devices with oronasal interfaces and night use recommendations. Our findings showed that most hospitalizations were due to respiratory failure with hyipercapnia receiving bilevel modality. The respiratory polygraphy allowed a quickly diagnosis and the NIV monitoring.
Key words: Obesity; Hypoventilation; Non invasive ventilation.
Introducción
La obesidad es una pandemia que afecta fundamentalmente a los países con estilo de vida occidental1-3 y representa un predictor independiente para el desarrollo de diabetes, hipertensión arterial, enfermedad coronaria, síndrome metabólico, apneas del sueño, accidente cerebrovascular e insuficiencia renal4,5. El riesgo de muerte por cualquier causa se incrementa significativamente cuando la obesidad se incrementa de grado moderado a severo tanto en hombres como en mujeres 4,5.
El Síndrome de Obesidad e Hipoventilación (SOH) se refiere al reconocimiento de hipercapnia durante la vigilia (PaCO2 >45 mmHg) en pacientes obesos (IMC > 30 kg/m2), después que otras causas que pueden ocasionar hipoventilación como las enfermedades neuromusculares o de la caja torácica han sido excluidas6-8.
Se postula que el SOH resulta de interacciones complejas entre alteraciones de la mecánica respiratoria, anormalidades del control central de la ventilación, desordenes respiratorios de mecanismo obstructivo durante el sueño (SAHOS) y alteraciones neuro-humorales o endocrinas (resistencia a la leptina e insulina y déficit de progesterona)6. Es frecuente que los pacientes que padecen SOH no sean reconocidos por largos períodos de tiempo hasta que se presenta alguna intercurrencia clínica o quirúrgica o bien hasta que son internados por complicaciones9. El SOH debe distinguirse apropiadamente del denominado síndrome de superposición (overlap) que es la asociación entre SAHOS y enfermedad pulmonar obstructiva crónica (EPOC).
Ha sido recientemente descripto un notable incremento en el número de pacientes que son internados en la UTI por falla respiratoria hipercápnica con o sin diagnóstico previo de SOH relacionados con disfunción sistémica, para el que se ha propuesto el término"SOH maligno"10. Este artículo describe las características clínicas, funcionales, tratamientos indicados y evolución de una serie de pacientes identificados como SOH durante su internación en una UTI polivalente.
Material y métodos
Se realizó una búsqueda retrospectiva de pacientes con falla respiratoria hipercápnica en UTI y revisión de los datos de las historias clínicas a quienes se diagnosticó SOH definido por; IMC >30 kg/m2, PaCO2 >45 mmHg, PaO2 <70 mmHg y trastornos respiratorios del sueño, durante la internación en UTI en el Hospital Británico de Buenos Aires entre noviembre del 2011 y noviembre del 2013. Se excluyeron aquellos con diagnóstico de EPOC, síndrome de overlap, enfermedad músculo esquelética o neuromuscular, enfermedad pulmonar parenquimatosa difusa, embolia pulmonar, hipoventilación relacionada a drogas (opioides o sedantes) o cualquier otra razón conocida para justificar la hipoventilación diurna. Los pacientes solo fueron considerados una única vez en su primera internación.
Los datos clínicos recabados incluyeron: datos antropométricos y demográficos, antecedentes clínicos (insuficiencia renal, HTA, diabetes, enfermedad coronaria, insuficiencia cardíaca), forma de presentación, espirometría del último año según criterios de aceptabilidad y reproducibilidad ATS/ ERS11, 12, días de internación en UTI, gases en sangre a la admisión y al alta, indicadores del estudio de sueño y del tipo y parámetros de las estrategias ventilatorias utilizadas.
Para el estudio de los desórdenes respiratorios del sueño se aceptaron datos basales de polisomnografía (PSG) cuando estuvo disponible, o de poligrafía respiratoria (PR) realizada durante la misma internación, usando registradores de nivel III (American Academy of Sleep Medicine); Embletta (Embla. USA) y Alice PDX (Respironics. USA) dotados de sensado de flujo nasal por cánula, esfuerzo torácico y oximetría de pulso con sensor tipo dedal. Solo se incluyeron lecturas de edición manual según normativas AASM en registros con más de 240 minutos válidos para el análisis (>4 horas)13. Durante los procedimientos de titulación (realizados en una noche diferente al estudio diagnóstico) se establecieron conexiones a los dispositivos terapéuticos de presión positiva no invasivos utilizando equipos Trilogy 202 (Respironics. USA) y S9 Vpap (ResMed. Australia) a fin de obtener datos de fuga, volumen corriente y curvas de presión tiempo. El IAH se definió como el número de eventos respiratorios (apneas e hipopneas) por hora de registro. Se definió IAH de valor patológico cuando éste fue > 5/eventos por hora de registro y se establecieron las siguientes categorías de severidad; leve (IAH entre 5.1 y 14.9 eventos/hora), moderado (IAH entre 15 y 29.9 eventos/hora) y severo (IAH >30 eventos/hora). Se definió como evento de desaturación a la caída de 3% o mayor en relación al valor basal inmediatamente precedente (relativa o absoluta). El índice de desaturaciones (IDO) se calculó dividiendo el número total de eventos de desaturación sobre el tiempo de registro válido en el análisis manual de la PR y el tiempo de saturación debajo de 90% expresado en % del registro con oximetría debajo del valor 90%. Estos indicadores se correlacionaron con datos recogidos sistemáticamente de somnolencia diurna medida mediante la escala de Epworth en su versión vigente con traducción validada al idioma español14. Se constataron además los datos de la ventilación no invasiva (modo ventilatorio y ajustes definitivos del dispositivo al egreso hospitalario), interfases, uso de oxígeno suplementario y del estudio de titulación (PSG o PR) usando el IAH residual y los comentarios del informe.
Todos los pacientes fueron contactados durante el seguimiento a través del consultorio de ventilación no invasiva e insuficiencia respiratoria o por teléfono para conocer su evolución posterior al egreso del hospital.
Análisis
El manejo de la información obtenida de las historias clínicas se realizó en formato de tabla de Excel teniendo precaución de ocultar información que pudiera permitir la identificación de los pacientes o violar la confidencialidad de los datos durante el procesamiento de los mismos. Las variables demográficas se describen usando frecuencias, medianas, medias y sus correspondientes medidas de dispersión. Se calcularon las diferencias y significación estadística utilizando Student Test t para indicadores de gases en sangre entre la muestra basal (admisión) y la gasometría al egreso hospitalario (obtenidas sin oxígeno suplementario, en reposo, sedestación y vigilia a primera hora de la mañana). Se utilizó el programa estadístico Epi Info TM 7.
Resultados
Durante 24 meses fueron identificados 13 pacientes, 9 hombres (69.23%) y 4 mujeres, con una media de edad de 58.6 años (SD ± 12.4). El 84.62% fueron mayores de 50 años. El IMC medio fue de 48.5 kg/m2 (SD ± 9.1). Todos tuvieron una circunferencia de cuello > 40 cm. Se identificó el antecedente de depresión en 4 (30.77%) y uso de benzodiacepinas en 3 (23.8%). En la Tabla 1 se observan los datos demográficos y la prevalencia de las comorbilidades asociadas.
Tabla 1. Datos demográficos y la prevalencia de las comorbilidades asociadas

La función pulmonar evaluada por espirometría computada puso en evidencia defectos de la ventilación sugestivos de restricción (relación FEV1/ FVC > 70 con FVC < 80%) en 12 pacientes (FVC < 80% del predicho) (Tabla 2). Un único paciente tuvo espirometría normal y solo un caso tuvo confirmación de la restricción por pletismografía.
Tabla 2. Función pulmonar evaluada por espirometría computada

Los gases en sangre al ingreso a UTI (mmHg) mostraron (medias y desvío estándar); pH: 7.34 (SD ± 0.056), PaCO2: 56 (SD ± 13.3), PaO2: 63 (SD ± 9.6), HCO3 31.8 (SD ± 5.8).
Los motivos de internación fueron: fallo respiratorio grave con hipercapnia e hipoxemia en 8 pacientes (61.53%), adaptación y titulación de la VNI por falla ventilatoria crónica en 3 (23.07%) y evento coronario agudo (infarto agudo de miocardio) en 2 (15.38%) que requirieron cateterismo cardíaco con angioplastia transluminal coronaria de urgencia y en ambos se registraron disfunción sistólica leve del ventrículo izquierdo (fracción de eyección ecocardiográfica de 35%). Un único paciente (con severa hipoxemia, hipercapnia, excesiva somnolencia diurna y clínica de fallo cardíaco derecho) tuvo datos de hipertensión pulmonar, con presión sistólica de la arteria pulmonar medida por ecocardiograma doppler de 70 mmHg y ecografía doppler venosa de miembros inferiores, TAC helicoidal negativa para enfermedad tromboembólica. El período de internación medio en UTI fue de 8.9 días.
Ningún paciente tenía estudio de sueño previo al ingreso. En 11 casos (84.6%) fue posible disponer de pruebas diagnósticas (PR) realizadas durante la internación a fin de documentar alteraciones respiratorias durante el sueño. Todos los pacientes estudiados tuvieron IAH >5/hora. En 3 pacientes (23.8%) se identificaron períodos de respiración periódica en la PR basal. La Tabla 3 resume los hallazgos de la PR en la propia cama del paciente. La media de la escala de Epworth basal auto administrada fue de 18 puntos (SD ± 3.98).
Tabla 3. Indicadores obtenidos de la poligrafía respiratoria en la cama de la UTI
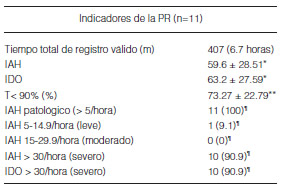
*Número eventos/hora y SD (±)
**% de la noche y SD (±)
Número absoluto y (%)
Se utilizó ventilación no invasiva (VNI) en modalidad bilevel con respaldo de frecuencia respiratoria en todos los pacientes (modo S/T). Las presiones utilizadas en cm H2O (medias y desvío estándar) fueron; IPAP de 23 (SD ± 4.17), EPAP de 12 (SD ± 4.25), frecuencia respiratoria de 18 por minuto (SD ± 1.7).
Se realizaron 13 pruebas de titulación, 11 con PR al lado de la cama (84.62%) y 2 con PSG (15.38%) con VNI previas al alta. El IAH residual medio fue de 9.38/eventos por hora (SD ± 6.8). Cuatro casos (30.77%) requirieron luego de la titulación, modalidad presométrica con volumen asegurado (algoritmo AVAPS con velocidad de ajuste lenta en un cm de H2O por minuto). Los valores medios de AVAPS usados fueron; IPAP máximo: 25.7 cmH2O, IPAP mínimo: 17.5 cmH2O, EPAP: 11.5 cm H2O y volumen corriente promedio asegurado de 580 ml.
Los cambios en el pH arterial evaluados entre la primera evaluación y los valores al egreso mostraron cambios significativos (p= 0.0019). La comparación entre otros indicadores de la gasometría se muestra en la Tabla 4. La media de ESS al alta fue de 6.23 (SD ± 2.20) mostrando una disminución significativa respecto del valor inicial (p= 0.0001). Ningún paciente requirió intubación traqueal (IOT) ni se registraron fallecimientos durante la primera internación. Todos egresaron a domicilio con equipos de VNI con interfases nasobucales e indicación de uso nocturno. En cuatro pacientes se indicó además O2 suplementario en línea adicionado a los equipos de VNI de flujo continuo.
Tabla 4. Gasometría arterial basal y al alta (En vigilia y sin O2 suplementario)

* Presión parcial en milímetros de mercurio
En el seguimiento, un paciente (7.69%) abandonó la VNI y no pudo volver a ser contactado, y dos pacientes fallecieron durante el uso de VNI domiciliaria crónica: uno por neumonía grave con necesidad de IOT/ARM 18 meses posteriores a la indicación de VNI y otro, por evento coronario a los 6 meses del alta. Se registraron 2 re-admisiones hospitalarias (en ambos pacientes que fallecieron). Tres casos fueron intervenidos por el equipo de obesidad y trastornos alimentarios (cirugía bariátrica por técnica de manga gástrica) tras lo cual se pudo suspender la VNI en uno de ellos al disminuir 66 kg de peso. En la actualidad, los 9 pacientes restantes (69.2%) continúan con VNI domiciliaria nocturna.
Discusión
Durante 24 meses, 13 pacientes fueron admitidos en UTI por fallo respiratorio hipercápnico. Solo 3 de estos pacientes (23.07%) fueron internados con sospecha diagnóstica previa de SOH debido a obesidad e hipercapnia, enfatizando que con frecuencia el diagnóstico se establece durante las intercurrencias o complicaciones, ya que el trastorno no es previamente conocido9,10.
Maric y col. en la más extensa serie recientemente publicada de pacientes admitidos a UTI con SOH reconoce el desorden en el 8% de los ingresos utilizando criterios diagnósticos tradicionales10. Nowbar y colaboradores estudiaron 4332 hospitalizaciones consecutivas y consideraron el diagnóstico de SOH en 47 pacientes (1% de la muestra), 19 de los cuales requirieron IOT y ARM9. Kessler y un grupo de investigadores franceses estudiaron 34 SOH en un período de 7 años internados en un servicio de medicina respiratoria15. Ambos trabajos destacan el infradiagnóstico de la entidad y reconocen su impacto en la mortalidad.
La incidencia de SOH en pacientes de terapia intensiva (50% de todos los pacientes hospitalizados con IMC >50 kg/m2) es diferente de la incidencia de la patología en pacientes ambulatorios identificados en centros de medicina del sueño (10-20%) o en la población general (0.3%)16.
Un interesante debate acerca de la forma en la que denominamos el síndrome de hipoventilación y obesidad se ha planteado en la literatura. Esta controversia tiene importancia taxonómica y clínica ya que puede modificar los criterios diagnósticos. La falta de estandarización en el uso de estos criterios puede causar confusión. El IAH elevado se asocia al SOH pero se discute si debe constituir un criterio diagnóstico (existe un 5 a 10% de SOH sin SAHOS) y se ha propuesto reservar el término SOH para aquellos sin SAHOS o bien quienes no corrigen la hipercapnia con el uso de CPAP17-19.
La AASM continúa definiendo al SOH con la presencia de IMC > 30 kg/m2, PaCO2 > 45 mmHg, PaO2 < 70 mmHg y trastornos respiratorios del sueño definidos por IAH elevado. Por ello, aún se exige la PSG como criterio diagnóstico, idealmente si se dispone de capnografía que documente una elevación de la CO2 al final de la espiración = etCO2 > 10 mmHg durante el sueño (respecto del valor basal) o utilizando la saturación de oxígeno nocturna como subrogante (desaturaciones que no se pueden explicar por las apneas del sueño)7, 8.
En nuestra serie, el índice de desaturaciones (media; 63.2 ± 27.59) fue más elevado que el índice de apneas e hipopneas (media; 59.6 ± 28.51). Esto puede deberse a la técnica de cuantificación de las hipopneas mediante PR, ya que por definición los estudios simplificados de diagnóstico subestiman el IAH al no poder identificar los microdespertares y usar como denominador para la construcción de los índices el tiempo de registro y no el tiempo total de sueño. También es posible que los episodios de desaturación representen una medición más global de la función pulmonar y pueden presentar por ello variaciones no debidas a apneas reconocibles en la señal de flujo o presión nasal.
Desde el punto de vista práctico, disponer y obtener un trazado de PSG durante la internación en UTI que disponga de capnografía puede ser difícil en nuestro medio. La PR ha sido validada para el diagnóstico de SAHOS13 y las restricciones sobre su uso en pacientes con condiciones comórbidas han ido disminuyendo al incrementarse la experiencia acumulada que ha determinado un significativo aumento en la evidencia científica disponible. Adicionalmente, el desarrollo de técnicas de exploración no invasivas en los polígrafos respiratorios permiten monitorear variables específicas en la propia cama del paciente durante una o varias noches (volumen corriente, fugas, coordinación de los movimientos durante los eventos de apnea o hipopneas, IAH residual, etc.) y otorgar información útil para el estudio de los trastornos respiratorios de mecanismo no obstructivo. La posibilidad tecnológica de conectar dispositivos registradores de poligrafía con los equipos de VNI (denominada en este contexto poligrafía ventilatoria por algunos autores) permite adquirir información fisiológica del paciente y del equipo de ventilación en la misma interfase visual, a fin de interpretar los eventos que suceden durante la aplicación de las técnicas de ventilación no invasiva (Figuras 1, 2 y 3).

Figura 1. Fragmento de registro de poligrafía en página de 2 minutos con montaje para ventilación no invasiva (presión, flujo, volumen corriente, esfuerzo, oximetría, fase y fuga). Modo: bilevel. EPAP: 5 cm de H2O. IPAP: 12 cm de H2O. FR: 12 por minuto. Se aprecian eventos de hipopneas de mecanismo obstructivo asociadas a desaturaciones. Obsérvese el detalle del desfase de las bandas (oposición de fase) y caída del volumen corriente.

Figura 2. Registro obtenido con ventilación no invasiva en paciente de 50 años con SAHOS e hipoventilación obesidad (PaCO2 basal 56 mmHg e IAH 59/eventos hora. Modo: Presométrico de flujo continuo con ventilación alveolar asegurada. EPAP: 10 mmHg. IPAP mínima 18 mmHg. IPAP máxima 24 mmHg. FR 12 por minuto. Se aprecian eventos respiratorios con caída del volumen corriente y el flujo (presión diferencial) asociados a desaturaciones. El dispositivo incrementa las presiones para intentar compensar la caída de la ventilación.

Figura 3. Superior: Registro obtenido con ventilación no invasiva (0:18 hs) en paciente de 38 años con SAHOS e hipoventilación obesidad (PaCO2 basal 67 mmHg e IAH 73/ eventos hora). Modo: Presométrico de flujo continuo con ventilación alveolar asegurada. EPAP: 5 mmHg. IPAP mínima 10 mmHg. IPAP máxima 18 mmHg. FR 14 por minuto. Se aprecian eventos respiratorios de mecanismo obstructivo (desfase de bandas) asociados a desaturaciones.
Inferior: El fenómeno fue apreciado clínicamente y al elevar la EPAP a 8 cm de H2O (0:52 hs) desaparecen los eventos obstructivos y mejoran la oximetría, el volumen corriente y la coordinación tóraco-abdominal.
Una adecuada interpretación de los fenómenos dependen del tipo de patología que se intenta corregir, del modo de ventilación utilizado (ventilación presométrica o volumétrica), de la interfase elegida y de la coordinación existente entre la bomba ventilatoria y el ventilador mecánico (sincronía paciente-ventilador). Recientemente, una serie de publicaciones sintetizan la experiencia en el análisis sistemático de las anormalidades documentadas mediante PR con VNI de un grupo Europeo (Somno NIV) que describe y propone una clasificación de los eventos durante el monitoreo20, 21.
Once pacientes (84.62%) tuvieron PR en la etapa diagnóstica, y aun teniendo en cuenta la posible subestimación de los indicadores que es posible con PR, todos presentaron IAH elevado en grado patológico, siendo de grado severo el 90.9%. La totalidad de este grupo se titularon por PR durante la aplicación de VNI, estrategia que permitió cambios de modalidad ventilatoria o adición de O2 suplementario en cuatro.
El IAH residual luego de la titulación (9.38 ev/ hora) resultó menor que el basal (59.6 ev/hora) con diferencia estadística significativa (p = 0.0002) y podría deberse a una titulación insuficiente (incluso utilizando PR al lado de la cama) debido a que frecuentemente los ajustes de la VNI se realizaron de manera diferida (y no en tiempo real). Desde el punto de vista clínico, 10 ev/hora representan un grado leve de disturbios respiratorios y tendrían menor impacto en el riesgo cardiovascular.
Maric enfatiza el impacto sistémico del SOH involucrando a múltiples órganos y sistemas que incluyen; falla ventilatoria crónica (con hipercapnia), HTA, hipertrofia ventricular izquierda con disfunción sistólica, sobrecarga del ventrículo derecho (con o sin hipertensión pulmonar), insuficiencia renal crónica y falla hepática no alcohólica por esteatohepatitis. De esta manera, el grupo de Norfolk propone el término Síndrome de Hipoventilación y Obesidad Maligna debido a las asociaciones comórbidas y al comportamiento sistémico10.
La fisiopatología del SOH depende de las complejas relaciones entre la obesidad visceral, el sistema de adipocitoquinas, la resistencia a la insulina, alteraciones en las hormonas gonadales, disfunción hipotalámica, hipoxemia, estrés oxidativo, elevación del tono simpático, hipercitokinemia (estado pro-inflamatorio), déficits vitamínicos, estado de pro-coagulabilidad y disfunción endotelial22. En este sentido, nuestra casuística reúne individuos con alta prevalencia de HTA, diabetes y somnolencia diurna, aunque no realizamos mediciones de marcadores inflamatorios o metabólicos específicos.
Las anormalidades de los test de función pulmonar más constantes en los obesos son la disminución del volumen de reserva espiratoria (VRE) que depende fundamentalmente de la posición (más marcada en el decúbito dorsal) y la caída de la capacidad residual funcional (CRF)19. Un estudio en obesos con FEV1, transferencia de CO normal (DLCO) y sin patología cardiovascular mostró una reducción exponencial de CRF y VRE con incrementos del IMC23. La capacidad pulmonar total (CPT) y el volumen residual (VR) pueden ser normales en obesidad de grado leve a moderada. En grados extremos (obesidad mórbida y super obesidad) se pueden observar caídas marcadas de la CPT por debajo del 50%. Descensos marcados en el peso pueden retornar estos valores a la normalidad24. La CVF es un indicador indirecto de la función pulmonar que es dependiente del esfuerzo de la bomba ventilatoria y no permite definir defectos de la ventilación de tipo restrictivo en presencia de obstrucción. Sin embargo, en esta serie ningún paciente presentaba evidencia de obstrucción (FEV1/FVC ≤ 70) y la FVC se presentó disminuida en el 92.3% de los pacientes, quienes no tenían antecedentes ni evidencia clínica de enfermedad muscular, fibrosis pulmonar o de la caja torácica.
Algunos estudios que han evaluado la performance ventricular por ecocardiografía bidimensional (ECO2D) describen hipertrofia del ventrículo izquierdo (HVI) en más del 70% de los SOH, 60% de disfunción sistólica y 77% de hipertensión pulmonar (HTP)25, 26. Las cardiopatías en pacientes con obesidad severa son complejas debidas a la frecuente existencia de factores de riesgo comunes como la diabetes, HTA, dislipidemias y las apneas del sueño. La HVI se puede presentar de manera independiente en obesos y representa un factor adicional para el desarrollo de eventos de isquemia coronaria27. Tres eventos coronarios se presentaron en nuestros pacientes y en uno de ellos fue causal de muerte.
Un interesante estudio que evaluó 26 pacientes con SOH mediante cateterismo de arteria pulmonar previo a la realización de cirugía bariátrica, encontró valores de HTP en del 88%, con presión capilar elevada (> 18 mmHg) en el 61%28. La hipoxemia y el fallo ventricular diastólico pueden ser responsables de al HTP observada en el SOH29. Encontramos un caso de HTP significativa por ECO2D, aunque no realizamos ecocardiogramas en el resto de los pacientes y no se realizaron cateterismos en nuestra serie.
La disfunción renal es una situación comórbida que se ha reportado que un tercio de los pacientes con SOH10, 30, 31. Es posible que situaciones de riesgo común (diabetes, HTA) puedan incrementar el riesgo de enfermedad renal. En el mismo sentido, la obesidad por sí misma es un factor de riesgo independiente para el desarrollo o la progresión del daño renal30. Nosotros encontramos que todos los pacientes recibían tratamiento por HTA y un 15.38% presentaba insuficiencia renal crónica (dos pacientes que requirieron hemodiálisis y uno de los cuales falleció). Es interesante remarcar que la prevalencia de insuficiencia renal en nuestra serie fue menor a la reportada en la literatura, aunque en dos casos el deterioro durante la internación determinó la necesidad de ingreso al programa de diálisis, sugiriendo el compromiso orgánico del SOH.
Se ha descripto que la VNI puede mejorar el intercambio de gases y mejorar los síntomas clínicos. En nuestra experiencia ha sucedido rápidamente durante la primera internación y los síntomas de somnolencia subjetiva cambiaron significativamente, posiblemente por reducción de la PaCO2, reducción del IAH y mejoría de la fragmentación del sueño. También se ha sugerido el uso inicial de CPAP con o sin el uso suplementario de O2 para el tratamiento de los pacientes con SOH32, 33, con algoritmos que proponen la VNI en casos donde no es posible documentar mejoría con CPAP o bien este no es tolerado. Sin embargo, en Europa el grupo francés ANTADIR propone iniciar VNI en situación aguda o grave (riesgo de IOT/ARM) o bien cuando los valores de PCO2 se encuentran muy elevados34 y en España se reportan series de SOH tratados con VNI35. En este contexto podría indicarse el cambio a CPAP una vez estabilizados los trastornos gasométricos. En nuestros pacientes se utilizó la modalidad bilevel (equipos de flujo continuo) con máscara nasobucal, y se optó por indicar AVAPS cuando no fue posible disminuir o mantener los valores de PaCO2 o cuando los datos de la PR con VNI mostraban episodios de hipoventilación remanentes con bilevel S/T en rango de presiones confortables y sin fuga.
Existen datos que muestran seguridad, eficacia y cumplimiento a largo plazo (un año) con el uso de bilevel domiciliario. Priou, en Francia, comparó la eficiencia y cumplimiento de bilevel domiciliario (77% a 5 años) en pacientes con SOH estables e inestables (internados en UTI). De manera interesante, este trabajo no encontró diferencias en la mortalidad (18.5% a 3 años) entre aquellos tratados desde situación estable en relación a quienes iniciaron VNI luego de una internación por falla respiratoria36.
Por otro lado, Piper y colaboradores en Australia, randomizaron pacientes con SOH estable (media de PaCO2 < 52 mmHg) a recibir CPAP o Bilevel sin hallar diferencias entre ambas modalidades37. No existe evidencia que soporte el uso rutinario de modalidad presométrica con volumen asegurado. Reportes preliminares que compararon bilevel vs. modalidades con volumen promedio asegurado mostraron diferencias solo en la disminución de PaCO2. Jean-Paul Janssens estudio un escaso número de pacientes con SOH en fase estable y mostró que AVAPS puede reducir efectivamente la PaCO2 y mejorar la entrega de volumen corriente sin alterar la arquitectura del sueño38. En la actualidad existen al menos 3 trabajos en ejecución que intentan evaluar la utilidad del modo presométrico no invasivo con volumen objetivo asegurado en SOH cuyos resultados se aguardan con expectativas39.
La PR en la UTI representa un recurso que no está disponible en la gran mayoría de las Unidades de Cuidados Críticos del país, por lo que independientemente de la disponibilidad de PR o PSG de titulación, es necesario enfatizar el tratamiento ventilatorio de estos pacientes, ya que la VNI es una de las herramientas importantes en su manejo.
La disminución del peso es otro importante elemento en el manejo clínico del SOH. Sin embargo una reducción significativa es habitualmente difícil de lograr y mantener. La cirugía bariátrica es una estrategia efectiva debido a que permite disminuciones marcadas del IMC a mediano plazo40. Existe evidencia sustancial que demuestra los efectos de este tipo de tratamientos radicales de la obesidad en el perfil metabólico, la diabetes, el SAHOS, la HTA y la HVI41. Adicionalmente se han documentado sus efectos sobre la función hepática y mediadores inflamatorios42. El reconocimiento temprano del SOH podría permitir el uso de estrategias quirúrgicas para el manejo de la obesidad. En nuestra serie, 3 pacientes obesos mórbidos fueron incluidos en el programa de cirugía bariátrica y recibieron adaptación y titulación de la VNI por falla ventilatoria crónica (23.07%), uno de los cuales ha recibido la indicación de suspender la VNI por mejoría clínica, funcional, polisomnográfica y gasométrica.
Comentarios finales
El SOH es la asociación de obesidad, desordenes respiratorios durante el sueño e hipercapnia, una vez descartadas otras causas evidentes de hipoventilación.
En nuestra experiencia, la mayoría de las admisiones se debieron a falla ventilatoria con somnolencia extrema (síndrome de Pickwick) y fue frecuente la presentación de intercurrencias o complicaciones orgánicas (insuficiencia renal, eventos coronarios, hipertensión pulmonar).
Con frecuencia el trastorno no se conocía hasta que un episodio de falla ventilatoria determinó el ingreso a terapia intensiva. La PR al lado de la cama del paciente permitió el acceso rápido al diagnóstico y el monitoreo de la VNI. Los cambios gasométricos fueron significativos con el uso de bilevel y se utilizaron exclusivamente máscaras nasobucales y O2 suplementario en un tercio de los casos.
La mortalidad de nuestra serie fue del 15.38% a los 18 meses. Un único paciente pudo suspender el tratamiento ventilatorio debido a mejoría documentada luego de la cirugía bariátrica.
Conflictos de interés: EB declara haber recibido financiamiento de la UCA, y traslado y hospedaje de Astra Zeneca y ResMed. SC recibió financiación por beca de la Facultad de Medicina de la UBA. MAB recibió financiamiento para traslado y hospedaje para el Congreso UTI-AAMR. JC declara haber recibido dinero por parte del protocolo de hipertensión pulmonar Acthelion por reclutamiento de pacientes. El resto de los autores declaran no tener conflictos de interés.
1. Flegal KM, Carroll MD, Ogden CL, Curtin LR. Prevalence and trends in obesity among US adults, 1999-2008. JAMA. 2010; 303(3): 235-241. [ Links ]
2. Ministerio de Salud. República Argentina. 1° Encuesta nacional de factores de riesgo 2005 para enfermedades no transmisibles. 2005. Disponible en: http://www.bvs.org.ar/ indicador.htm [ Links ]
3. Ministerio de Salud. República Argentina. 2° Encuesta nacional de factores de riesgo 2009 para enfermedades no transmisibles. Rev. Argent Salud Pública 2011; 2(6): 34-41. [ Links ]
4. Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath CW Jr. Body-mass index and mortality in a prospective cohort of U.S. adults. N Engl J Med. 1999; 341(15): 1097-1105. [ Links ]
5. Flegal KM, Graubard BI, Williamson DF. Cause-specific excess deaths associated with underweight, overweight, and obesity. JAMA. 2007; 298 (17): 2028-2037. [ Links ]
6. Piper AJ, Grunstein RR. Obesity hypoventilation syndrome. Mechanisms and management. Am J Respir Crit Care Med. 2011; 183 (3): 292-298. [ Links ]
7. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force. Sleep. 1999; 22(5): 667-689. [ Links ]
8. Iber C, Ancoli-Israel S, Chesson AL Jr., Quan SF; for the American Academy of Sleep Medicine. The AASM manual for the scoring of sleep and associated events: rules, terminology and technical specifications. 1st ed. Westchester, IL: American Academy of Sleep Medicine, 2007. [ Links ]
9. Nowbar S, Burkart KM, Gonzales R, et al. Obesity-associated hypoventilation in hospitalized patients: prevalence, effects, and outcome. Am J Med. 2004; 116(1): 1-7. [ Links ]
10. Marik P.E, Desai H. Characteristics of Patients With the ‘'Malignant Obesity Hypoventilation Syndrome'' Admitted to an ICU. J Intensive Care Med 2013 28: 124.
11. Brusasco V, Crapo R and Viegi G. ATS/ERS Task Force: Standardization of Lung Function Testing. - Standardisation of spirometry. Eur Respir J 2005; 26: 319-338. [ Links ]
12. Brusasco V, Crapo R and Viegi G. ATS/ERS Task Force: Standardization of Lung Function Testing - Interpretative strategies for lung function tests. Eur Respir J 2005; 26: 948-968. [ Links ]
13. Clinical Guidelines for the Use of Unattended Portable Monitors in the Diagnosis of Obstructive Sleep Apnea in Adult Patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. Journal of Clinical Sleep Medicine, Vol. 3, N° 7, 2007. [ Links ]
14. Chiner E, Arriero JM, Signes-Costa J, Marco J, Fuentes I. Validation of the Spanish version of the Epworth Sleepiness Scale in patients with a sleep apnea síndrome. Arch Bronconeumol. 1999; 35: 422-7. [ Links ]
15. Kessler R, Chaouat A, Schinkewitch P, et al. The obesityhypoventilation syndrome revisited: a prospective study of 34 consecutive cases. Chest. 2001; 120(2): 369-376. [ Links ]
16. Piper AJ, Grunstein R. Obesity Hypoventilation Syndrome. American Journal of Respiratory and Critical Care Medicine, Vol. 183, No. 3 (2011), pp. 292-298 [ Links ]
17. Rabec. C. Obesity Hypoventilation Syndrome. What's in a Name?. Chest 2002; 122;1498. [ Links ]
18. Bandyopadhyay T. Obesity-hypoventilation syndrome: the name game continues. Chest 2004; 125: 352. [ Links ]
19. Rabec C, Lucas Ramos P, Veale D. Complicaciones respiratorias de la obesidad. Arch Bronconeumol. 2011; 47: 252-61. [ Links ]
20. Rabec C, Rodenstein D, Leger P, Rouault S, Perrin C, Gonzalez-Bermejo J; SomnoNIV group. Ventilator modes and settings during non-invasive ventilation: effects on respiratory events and implications for their identification. Thorax. 2011 Feb; 66(2): 170-8. [ Links ]
21. Gonzalez-Bermejo J, Perrin C, Janssens JP, Pepin JL, Mroue G, Léger P, Langevin B, Rouault S, Rabec C, Rodenstein D; SomnoNIV Group. Proposal for a systematic analysis of polygraphy or polysomnography for identifying and scoring abnormal events occurring during non-invasive ventilation. Thorax. 2012 Jun; 67(6): 546-52. [ Links ]
22. Nguyen NT, Magno CP, Lane KT, Hinojosa MW, Lane JSI. Association of hypertension, diabetes, dyslipidemia, and metabolic syndrome with obesity: findings from the National Health an nutrition Examination Survey, 1999 to 2004. J Am Coll Surg. 2008; 207(6): 928-934. [ Links ]
23. Jones RL, Nzekwu MMU. The effects of body mass index lung volumes. Chest 2006; 130: 827-833. [ Links ]
24. Hakala K, Mustajoki P, Aittomäki J, Sovijärvi AR. Effect of weight loss and body position on pulmonary function and gas exchange abnormalities in morbid obesity. Int J Obes Relat Metab Disord 1995; 19: 343-346. [ Links ]
25. Masaidi M, Cuspidi C, Negri F, et al. Left and right ventricular structural changes in obese hypertensives. Blood Press. 2009; 18(1-2): 23-29. [ Links ]
26. Rodrigues SL, Baldo MP, Sa CR, et al. Anthropometric measures of increased central and overall adiposity in association with echocardiographic left ventricular hypertrophy. Hypertens Res. 2010; 33(1): 83-87. [ Links ]
27. Ebinc H, Ebinc FA, Ozkurt ZN, et al. Impact of adiponectin on left ventricular mass index in non-complicated obese subjects. Endocr J. 2008; 55(3): 523-528. [ Links ]
28. Sugerman HJ, Baron PL, Fairman RP, Evans CR, Vetrovec GW. Hemodynamic dysfunction in obesity hypoventilation syndrome and the effects of treatment with surgically induced weight loss. Ann Surg. 1988; 207(5): 604-613. [ Links ]
29. Leung CC, Moondra V, Catherwood E, Andrus BW. Prevalence and risk factors of pulmonary hypertension in patients with elevated pulmonary venous pressure and preserved ejection fraction. Am J Cardiol. 2010; 106(2): 284-286. [ Links ]
30. Hunley TE, Ma LJ, Kon V. Scope and mechanisms of obesityrelated renal disease. Curr Opin Nephrol Hypertens. 2010; 19(3): 227-234. [ Links ]
31. Othman M, Kawar B, El Nahas AM. Influence of obesity on progression of non-diabetic chronic kidney disease: a retrospective cohort study. Nephron Clin Pract. 2009; 113: 16-23. [ Links ]
32. Mokhlesi B, Tulaimat A. Recent Advances in Obesity Hypoventilation Syndrome. Chest 2007; 132; 1322-1336. [ Links ]
33. Mokhlesi Babak. Obesity Hypoventilation Syndrome: A State-of-the-Art Review. Respir Care 2010; 55(10): 1347- 1362. [ Links ]
34. Veale D, Rabec C, Labaan JP. Respiratory complications of obesity. Breathe. 2008; 4: 211-223. [ Links ]
35. Masa JF, Celli BR, Riesco JA, Hernández M, Sánchez De Cos J, Disdier C. The obesity hypoventilation syndrome can be treated with noninvasive mechanical ventilation. Chest. 2001; 119(4): 1102-1107. [ Links ]
36. Priou P, Hamel JF, Person C, Meslier N, Racineux JL, Urban T, Gagnadoux F. Long-term outcome of noninvasive positive pressure ventilation for obesity hypoventilation syndrome. Chest. 2010 Jul; 138(1): 84-90. [ Links ]
37. Piper AJ, Wang D, Yee BJ, Barnes DJ, Grunstein RR. Randomised trial of CPAP vs bilevel support in the treatment of obesity hypoventilation syndrome without severe nocturnal desaturation. Thorax. 2008 May; 63(5): 395-401. [ Links ]
38. Janssens JP, Metzger M, Sforza E.Impact of volume targeting on efficacy of bi-level non-invasive ventilation and sleep in obesity-hypoventilation. Respir Med. 2009 Feb; 103(2): 165-72. [ Links ]
39. U.S. National Institutes of Health [Internet]. https//clinicaltrials.gov/ [ Links ]
40. Sjostrom L, Narbro K, Sjostrom CD, et al. Effects of bariatric surgery on mortality in Swedish obese subjects. N Engl J Med. 2007; 357(8): 741-752. [ Links ]
41. Rubino F, Kaplan LM, Schauer PR, Cummings DE; Diabetes Surgery Summit Delegates. The Diabetes Surgery Summit consensus conference: recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes mellitus. Ann Surg. 2010; 251(3): 399-405. [ Links ]
42. Dixon JB, Bhathal PS, O'Brien PE. Nonalcoholic fatty liver disease: predictors of nonalcoholic steatohepatitis and liver fibrosis in the severely obese. Gastroenterology. 2001; 121(1): 91-100. [ Links ]














