Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista americana de medicina respiratoria
On-line version ISSN 1852-236X
Rev. am. med. respir. vol.16 no.1 CABA Mar. 2016
CASUÍSTICA
Hemorragia alveolar difusa. Diez años de experiencia
Autores: Gladys Noemí Kahl1, María Laura Orazi1, Eduardo Luis De Vito1,2, Claudia Liliana Dubra1, Graciela Noemí Svetliza1, Juan Arturo Precerutti1
1 Sección Neumonología, Servicio de Clínica Médica del Hospital Italiano de Buenos Aires, Argentina
2 Instituto de Investigaciones Médicas Alfredo Lanari, UBA
Correspondencia: Gladys N. Kahl Domicilio postal: Perón 4190, (C1199ABB), Buenos Aires, Argentina Fax: (011) 49590200 int. 8487 E-mail: gladys.kahl@hospitalitaliano.org.ar
Recibido: 14.04.2015
Aceptado: 01.12.2015
Resumen
Introducción: Las manifestaciones registradas de la hemorragia alveolar difusa (HAD) están influenciadas por las características de los pacientes y la experiencia de los centros de referencias donde son asistidos.
Objetivos: Describir los hallazgos clínicos y de laboratorio, las etiologías y los factores de riesgo de mortalidad en pacientes con HAD.
Métodos: Análisis retrospectivo de los informes de flbrobroncoscopias en pacientes con diagnóstico de HAD (período 2003-2013), según etiologías inmunológicas y no inmunológicas.
Resultados: Se identiflcaron 20 pacientes que presentaron los signos clínicos y patológicos de HAD sobre un total de 6839 flbrobroncoscopias (0,3%). La edad mediana fue 57 años (rango 20-88). Los signos más frecuentes de presentación fueron disnea e inflltrados radiológicos pulmonares en el 100% de los casos y anemia en el 95%. La clásica tríada semiológica (inflltrados radiológicos pulmonares, anemia y hemoptisis) de la HAD se encontró solo en 4 casos, 20%. La etiologías no inmunológicas fueron las más frecuentes (15 casos, 75%), especialmente infecciosas, oncohematológicas y cardiovasculares. La mediana de estadía hospitalaria fue de 17.5 días (rango 2-90 días). Doce pacientes fueron tratados en la UTI. La letalidad fue 60% (12/20 pacientes). Los principales riesgos de muerte fueron pacientes inmunocomprometidos (OR 27.50; IC 95%: 1.99 - 378.00, p = 0.013), necesidad de asistencia respiratoria mecánica (OR 18.00; IC 95%: 1.49-216.00, p = 0.023) y estadía en UTI (OR 7.50; IC 95%: 0.92-61.00, p = 0.049). La mortalidad a los 14 días de internación en el grupo no inmunológico fue superior a la del grupo inmunológico (p = 0.007) pero la mortalidad global no fue diferente (p = 0.066).
Conclusiones: En nuestra serie, los principales signos clínicos fueron disnea, anemia e inflltrados pulmonares; pero la tríada clásica fue de rara observación. En todos nuestros pacientes fue posible adscribir la HAD a una etiología deflnida. Las principales etiologías fueron no inmunológicas. La estadía en UTI y la necesidad de ARM se asociaron a mayor riesgo de mortalidad. La mortalidad a mediano plazo no fue diferente entre ambos grupos.
Palabras clave: Hemorragia alveolar difusa; Fibrobroncoscopía
Diffuse Alveolar Hemorrhage. Ten Year Experience
Abstract
Introduction: The registered manifestations of Diffuse Alveolar Hemorrhage (DAH) are influenced by the characteristics of the patients and the experience of the referral centers where they were assisted.
Objectives: To describe clinical and laboratory findings, etiologies and risk factors for mortality of patients with DAH.
Methods: A retrospective analysis of fibrobronchoscopy reports in patients with DAH diagnosis was carried out for the period 2003-2013, according to to immunological and non-immunological etiologies.
Results: Twenty patients with clinical and pathologic signs of DAH were identified, mean age 57 years old (range 20-88). The most common signs of presentation were dyspnea and radiologic pulmonary infiltrates (100%), and anemia (95%). The classical clinical semiology of three signs (radiologic pulmonary infiltrates, anemia and hemoptisis) was present only in 4 cases (20%). The most frequent etiologies were no immunological (75%), especially infectious, oncohematologic and cardiovascular etiologies. The median hospital stay was 17.5 days (range 2-90 days). Twelve patients were admitted into the Intensive Care Unit. Case fatality was 60% (12/20 patients). The main risk factors for death were immunocompromised patients (OR 27.50; IC 95%: 1.99-378.00, p = 0.013), need for prescription of mechanical ventilation (OR was 18.00; IC 95%: 1.49-216.00, p = 0.023) and intensive care unit admission (OR 7.50 (IC 95%: 0.92-61.00, p = 0.049). Mortality at 14 days in the group not immunological was lower (p=0.007) but the overall mortality was not different (p=0.066).
Conclusion: The main clinical manifestation was dyspnea, anemia and pulmonary infiltrates, while the classic triad was infrequent. In all the cases it was possible to attribute the DAH to a defined etiology. The main etiologies were no immunological. The stay in the intensive care unit, the necessity for mechanical ventilation and immunological etiologies were associated with a higher risk of mortality. The medium-term mortality was not different between the two groups.
Key words: Diffuse alveolar hemorrhage; Fibrobronchoscopy.
Introducción
La hemorragia alveolar difusa (HAD) es una manifestación inicial o aparece en la evolución de diversas condiciones inmunológicas y no inmunológicas. La mortalidad varía según las series y la causa subyacente entre el 20 y 100%1. Esta condición fue descripta por primera vez por Virchow y Rokitansky en el siglo XIX2-4. Ellos reportaron un paciente con hemosiderosis pulmonar idiopática y otro con poliangeítis microscópica respectivamente.
Desde entonces, se ha publicado un número importante de series de casos que describen entidades nosológicas definidas que cursan con HAD5-8. Sin embargo, esto contrasta con la escasa cantidad de reportes que consideran a la HAD como centro del análisis3, 9, 10.
Se han propuesto diversas clasificaciones de HAD que contemplan aspectos clínicos11, etiopatogénicos3, histopatológicos3, 4 y la competencia inmunológica12. Si bien el comportamiento general de la HAD está bien caracterizado, las etiologías, la forma de presentación, la evolución y la mortalidad están influenciadas no sólo por las características de los pacientes sino también por los centros de referencias donde fueron asistidos.
Nuestros objetivos fueron describir las características clínicas y de laboratorio, las etiologías y los factores de riesgo de mortalidad de los casos de HAD admitidos en nuestro hospital durante un período de 10 años.
Materiales y métodos
Se efectuó un análisis retrospectivo de todas las fibrobroncoscopias (FBC) en el periodo comprendido entre octubre 2003 y septiembre de 2013 con el objeto de identificar pacientes con HAD. Sobre un total de 6839 FBC, 20 tuvieron el diagnóstico de HAD (0.3%). Esos pacientes reunían los criterios clínicos y anatomopatológicos de HAD aceptados10. De acuerdo a los mismos, se consideraron casos de HAD a los pacientes que cumplieran con los siguientes criterios:
– Cuadro clínico: disnea, tos (con o sin esputo hemoptoico) y/o fiebre durante la última semana previa al ingreso hospitalario.
– Infiltrados alveolares difusos bilaterales en estudios radiográficos.
– Anemia (hemoglobina menor de 12 gr/dl en hombres y 11 gr/dl en mujeres).
– Exclusión de otros diagnósticos que explicaran el cuadro pulmonar y la demostración de macrófagos con hemosiderina en lavado broncoalveolar (> 20%) y/o biopsia pulmonar compatible con HAD.
Se definió inmunocomprometido a todo paciente que recibía 20 mg/día de prednisona o su equivalente durante por lo menos un mes, infección por HIV, enfermedad oncohematológica, trasplante de órgano sólido o médula ósea, uso de drogas inmunosupresoras, quimioterapia o radioterapia12. El diagnóstico de etiología inmunológica se basó en los hallazgos clínicos, estudios radiológicos y datos de laboratorio disponibles.
Análisis estadístico
El análisis estadístico se efectuó mediante estadística descriptiva y comparativa y según distribución normal o no; curva de Kaplan-Meyer/Log-Rank analysis para mortalidad y análisis comparativo de sobrevida para las causas inmunológicas y no inmunológicas.
Con el objeto de estudiar factores pronósticos de mortalidad se utilizó análisis univariado. Se consideraron las siguientes variables: sexo, edad mayor de 60 años, días de internación en la Unidad de Terapia Intensiva (UTI), necesidad de asistencia respiratoria mecánica (ARM), días de internación, valores de hemoglobina, urea y creatinina plasmática, requerimiento de diálisis, competencia inmune y etiologías (inmunológicas y no inmunológicas). Según la variable, se utilizó el test de chi cuadrado para comparar variables dicotómicas, y el test de Wilcoxon para variables continuas.
Resultados
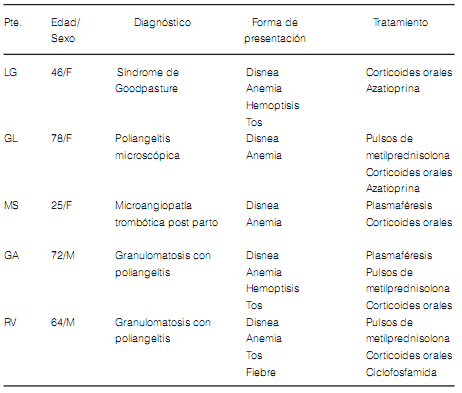
Las características generales de los pacientes al momento del ingreso se muestran en la Tabla 1. La triada clásica de presentación3 (hemoptisis – anemia e infiltrados pulmonares) se encontró en cuatro casos. Todos los pacientes estaban cursando el primer evento de HAD, excepto un paciente que se encontraba en su tercer episodio y se le efectuó una biopsia pulmonar por toracoscopía que aportó el diagnóstico de síndrome de Goodpasture.
TABLA 1. Características generales de los pacientes al ingreso

La caracterización de los pacientes de acuerdo a las causas inmunológicas y no inmunológicas9 se observa en la Tabla 2. Las causas infecciosas (n 4) fueron aspergilosis, citomegalovirus, herpes simple y acinetobacter baumanii; las etiologías oncohematológicas (n 4) correspondieron a leucemia linfática aguda (n 3) y a leucemia mieloide crónica (n 1); mientras que las causas cardiovasculares (n 3) fueron secundarias a insuficiencia cardíaca congestiva (n 2) y estenosis mitral (n 1). Las discrasias sanguíneas (n 1) correspondieron a una coagulopatía por insuficiencia hepática. Cuatro de las cinco condiciones inmunológicas fueron diagnosticadas en el momento de la HAD. La Tabla 3 detalla algunas de las características de los pacientes del grupo de causas inmunológicas.
TABLA 2. Caracterización de los pacientes con HAD de acuerdo a sus etiologías

*PP = post parto
TABLA 3. Características clínicas de los pacientes con HAD de etiologías inmunológicas
La mediana de seguimiento de la muestra estudiada fue de 307 días. La mediana de estadía hospitalaria (n 20) fue de 17.5 días (rango 2-90 días). Cinco de los 20 pacientes requirieron tratamiento dialítico agudo. Doce pacientes (60%) requirieron internación en UTI, 11 de ellos debieron ser asistidos con ARM. Los 12 pacientes internados en UTI tuvieron una mediana de estadía de 7.5 días (rango 1-45 días).
Se registró un total de 12 fallecimientos. De los cuales, dentro de los 14 días hubo cuatro muertes en el grupo de causas no inmunológicas y ninguna en el grupo de causas inmunológicas (Figura 1).
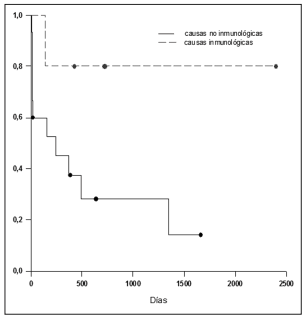
Figura 1. Curva de Kaplan-Meyer comparativa para las HAD de causas inmunológicas (n 5) no inmunológicas (n 15). A los 14 días de internación, la mortalidad fue mayor en el grupo no inmunológico (p = 0.007). Sin embargo, la mortalidad considerando todo el período de seguimiento no alcanzó significación estadística entre ambos grupos (p = 0.066).
En cuanto al riesgo de mortalidad, no se observaron diferencias estadísticamente significativas en lo que respecta a sexo, edad, creatininemia, uremia o requerimiento de diálisis. El requerimiento de internación en UTI demostró un OR para mortalidad de 7.50 (IC 95%: 0.92-61.00, p = 0.049). El riesgo de mortalidad fue mayor en quienes recibieron ARM (OR 18.00; IC 95%: 1.49-216.00, p = 0.023), así como en pacientes inmunocomprometidos (OR 27.50; IC 95%: 1.99-378.00, p = 0.013).
La mortalidad global para ambos grupos no fue diferente p = 0.066. Considerando los primeros 14 días de internación, la mortalidad en el grupo no inmunológico fue superior (p= 0.007). De hecho, a los 14 días todos los pacientes con HAD de causa inmunológica habían sobrevivido (Figura 1). En el grupo no inmunológico, la probabilidad de que ocurra el evento (en éste caso muerte) a los 14 días, era de 0.733 y descendía a 0.281 a los 493 días. Todos éstos datos deben ser tomados con precaución dado el n bajo. Debido a esto no fue objetivo del presente trabajo analizar de forma multivariada el riesgo de mortalidad.
Discusión
La intención de la presente serie de casos fue conocer y mostrar las características de una condición poco frecuente. Esto implica determinadas limitaciones debido al bajo número de pacientes, a la selección no aleatoria y a cierta dificultad para obtener datos completos de las historias clínicas en forma retrospectiva. Asimismo, no fue posible efectuar análisis multivariado debido al bajo número de casos. En el análisis de los resultados tuvimos en cuenta estas limitaciones, de manera que los mismos deben ser interpretados con precaución. Sin embargo, representa la experiencia de nuestra institución durante un periodo de 10 años.
En nuestra serie de casos la forma más frecuente de presentación clínica fue disnea, anemia e infiltrados pulmonares, estos últimos estuvieron presentes en todos nuestros pacientes. La clásica combinación de hemoptisis, anemia e infiltrados pulmonares fue infrecuente, fundamentalmente por la baja ocurrencia de hemoptisis. Estos resultados coinciden con los reportados en otras series2, 13.
La etiología más frecuentemente hallada fue de naturaleza no inmunológica. Estos hallazgos coinciden con lo reportado por otros autores que han enfocado el análisis desde las causas de HAD1, 9, 14 y difiere de otros reportes en enfermedades específicas que tenían HAD asociada a una entidad nosológica definida13, 15-17. La etiología no inmunológica tuvo predominio de causas infecciosas y oncohematológicas. Esto difiere de otras series en las que la principal causa no inmunológica fue insuficiencia cardíaca congestiva y relacionada a drogas18.
En todos nuestros pacientes fue posible adscribir la HAD a una etiología definida. Otras series han reportado entre un 14-35% de casos donde no fue posible establecer un diagnóstico etiológico12, 18. Este hecho ha sido adjudicado a que algunos pacientes ingresaron en mal estado general y no fue posible efectuar los procedimientos diagnósticos indicados18. Otras series consideraron HAD idiopática cuando la búsqueda de sus causas arrojó resultados negativos12. Se estima que alrededor de un 14% de las HAD son idiopáticas, sin embargo algunas de ellas previamente reportadas como idiopáticas pueden ser diagnosticadas en el curso clínico posterior12. Es posible que la combinación de un adecuado protocolo diagnóstico de HAD, aplicado a pacientes cuya condición clínica permita implementarlo, pueda reducir el porcentaje de etiologías no aclaradas. La ausencia de diagnóstico es una condición que desde el punto de vista clínico debe ser considerada transitoria y requiere una cuidadosa observación clínica posterior al evento.
Diversas series han reportado un mayor riesgo de mortalidad asociada a sexo, edad, comorbilidad cardiovascular, valores de creatinina o requerimiento de diálisis1, 12. No hemos logrado confirmar estos hallazgos en nuestra serie de casos. Como era de esperar, los pacientes que ingresaron a UTI y además requirieron ARM, mostraron una tendencia a mayor mortalidad, estos datos son coincidentes con los de otras series reportadas1, 18.
En los casos de HAD asociada a vasculitis se ha reportado una mortalidad mayor19. En nuestra serie el bajo número de pacientes con vasculitis no permite extraer conclusiones al respecto. En la revisión de Sang-Man Jin la mayoría de los pacientes con HAD que se presentaron con insuficiencia respiratoria no tenían enfermedades del tejido conectivo de base. Las enfermedades malignas fueron un hallazgo frecuente en estos pacientes y la evolución no fue diferente entre los pacientes con o sin enfermedades de tejido conectivo20.
En un primer momento la mortalidad en el grupo no inmunológico fue mayor, pero a largo plazo no fue diferente de la del grupo inmunológico. Hasta nuestro conocimiento no disponemos de datos confiables en la literatura como para poder comparar nuestros hallazgos.
Conclusiones
Nuestra serie es la de un hospital polivalente de alta complejidad y estuvo basada en el registro retrospectivo de las FBC realizadas durante los últimos 10 años. La principal manifestación clínica fue disnea, anemia e infiltrados pulmonares; pero la tríada clásica fue de rara observación. La principal etiología fue no inmunológica. La estadía en terapia intensiva, la necesidad de ARM y las etiologías inmunológicas se asociaron a mayor riesgo de mortalidad. En un primer momento la mortalidad en el grupo no inmunológico fue mayor, pero a largo plazo no fue diferente de la del grupo inmunológico. Dado su carácter retrospectivo estos hallazgos deben ser tomados con precaución.
Conflictos de interés: Los autores declaran no tener conflictos de intereses relacionados con el tema de esta publicación.
Bibliografía
1. Prost N, Parrot A, Picard C et al. Diffuse alveolar haemorrhage: factors associated with in-hospital and long-term mortality. ERJ 2010; 35: 1303-1311. [ Links ]
2. Collard HR, Marvin IS. Diffuse alveolar hemorrhage. Clin Chest Med 2004; 25: 583-592. [ Links ]
3. Travis WD, Colby TV, Lombard C, Carpenter HA. A clinicopathologic study of 34 cases of diffuse pulmonary hemorrhage with lung biopsy confirmation. Am J Surg Pathol 1990; 14: 1112-1125. [ Links ]
4. Gomez-Román J. Hemorragias alveolares difusas pulmonares. Arch bronconeumol 2008; 44: 428-436. [ Links ]
5. Hruskova Z, Casian AL, Konopasek P et al. Long-term outcome of severe alveolar haemorrhage in ANCA-associated vasculitis: a retrospective cohort study. Scand J Rheumatol 2013; 42: 211-214. [ Links ]
6. Levy JB, Turner AN, Rees AJ, Pusey CD. Long-term outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med 2001; 134: 1033-1042. [ Links ]
7. Lazor R, Bigay-Game L, Cottin V et al. Alveolar hemorrhage in anti-basement membrane antibody disease: a series of 28 cases. Medicine (Baltimore) 2007; 86: 181-193. [ Links ]
8. Quadrelli SA, Alvarez C, Arce SC et al. Pulmonary involvement of systemic lupus erythematosus: analysis of 90 necropsies. Lupus 2009; 12: 1053-1060. [ Links ]
9. Picard C, Cadranel J, Porcher R et al. Alveolar haemorrhage in the immunocompetent host: a scale for early diagnosis of an immune cause. Respiration 2010; 80: 313-320. [ Links ]
10. De Lassence A, Fleury-Feith J, Escudier E, Beaune J, Bernaudin J, Cordonnier C. Alveolar hemorrhage diagnostic criteria and results in 194 immunocompromised hosts. Am J Respir Crit Care Med 1995; 151: 157-163. [ Links ]
11. Primack S, Miller R, Müller N. Diffuse pulmonary Hemorrhage: clinical, pathologic, and imaging features AJR 1995; 295-300. [ Links ]
12. de Prost N, Parrot A, Cuquemelle E et al. Diffuse alveolar hemorrhage in immunocompetent patient: etiologies and prognosis revisited. Respiratory Medicine 2012; 106: 1021-1032. [ Links ]
13. Buendía-Roldán I, Navarro C, Rojas-Serrano J. Hemorragia alveolar difusa: causas y desenlaces en un instituto de tercer nivel. Reumatol Clin 2010; 6: 196-198. [ Links ]
14. Lin Y, Zheng W, Tian X et al. Antineutrophil cytoplasmic antibody-associated vasculitis complicated with diffuse alveolar hemorrhage: a study of 12 cases. J Clin Rheumatol 2009; 15: 341-344. [ Links ]
15. Cordier J, Valeyre D, Guillevin L, Loire R, Brechot JM. Pulmonary Wegener's granulomatosis. A clinical and imaging study of 77 cases. Chest 1990; 97: 906-912. [ Links ]
16. Lauque D, Cadranel J, Lazor R et al. Microscopic polyangiitis with alveolar hemorrhage. A study of 29 cases and review of the literature. Medicina (Baltimore) 2000; 79: 222-233. [ Links ]
17. Kwok S, Moon S, Ju J et al. Diffuse alveolar hemorrhage in systemic lupus erythematosus: risk factors and clinical outcome: results from affiliated hospitals of Catholic University of Korea. Lupus 2011; 20: 102-107 [ Links ]
18. Rabe C, Appenrodt B, Hoff C et al. Severe respiratory failure due to diffuse alveolar hemorrhage: clinical characteristics and outcome of intensive care. J Crit Care 2010; 25: 230- 232. [ Links ]
19. Semple D, Keogh J, Forni L, Venn R. Clinical review: Vasculitis on the intensive care unit–part 2: Treatment and prognosis. Crit Care 2005; 9: 193-197.
20. Sang-Man J, Jae-Joon Y, Chul-Gyu Y et al. Aetiologies and outcomes of diffuse alveolar haemorrhage presenting as acute respiratory failure of uncertain cause. Respirology 2009; 14, 290-294. [ Links ]














