Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.1 no.2 Ciudad Autónoma de Buenos Aires jun. 2006
CONSENSO
Recomendaciones para el uso de everolimus en pacientes con trasplante cardíaco
Resultados de las Jornadas Latinoamericanas de Consenso
Edimar Alcides Bocchi1, Luis Ahualli2, Marcos Amuchastegui3, Fernando Boullon4, Beatriz Ceruti5, Roberto Colque6, Darío Fernández7, Alfredo Fiorelli1, Pastor Olaya8, Norberto Vulcano9, Sergio V. Perrone10
1INCOR, San Pablo, Brasil.
2Hospital Argerich, Buenos Aires, Argentina.
3Hospital Privado de Córdoba, Córdoba, Argentina.
4Hospital Francés, Buenos Aires, Argentina.
5ICI, Montevideo, Uruguay.
6Hospital Italiano, Córdoba, Argentina.
7Clínica Cardiovascular Santa María, Medellín, Colombia.
8Fundación Valle de Lili, Cali, Colombia.
9Hospital Italiano, Buenos Aires, Argentina.
10Instituto FLENI, Buenos Aires, Argentina.
Trabajo recibido: 2/5/2006
Trabajo aprobado: 22/5/2006
Resumen: Aún cuando los resultados obtenidos en el área de trasplante cardíaco han evolucionado favorablemente durante losúltimos años, existen necesidades médicas pendientes cuya resolución beneficiará a los pacientes en el futuro. Algunos de los problemas por resolver son: la vasculopatía del injerto, la insuficiencia renal crónica, la infección por citomegalovirus (CMV) y el rechazo agudo con compromiso hemodinámico. El everolimus es una nueva opción en la terapia inmunosupresora adyuvante; se trata de un fármaco inhibidor del mTOR, que básicamente ofrece un perfil farmacocinético diferente del de su predecesor: el sirolimus.
Asimismo, el everolimus es el único fármaco adyuvante con el que se ha comprobado una mayor eficacia en la profilaxis del rechazo agudo, al menos en episodios de grado 3 A de la ISHLT (International Society of Heart and Lung Transplantation) (p<0,001), en la prevención de la vasculopatía del injerto (p<0,01) y en la incidencia de infección por CMV (p<0,01). Dado que la vasculopatía del injerto es el principal factor de riesgo de mortalidad después del primer año del trasplante y que el rechazo agudo y la infección por CMV desempeñan un papel fundamental en su desarrollo, estos hallazgos sugieren que el everolimus desempeñaría un papel importante como parte de la terapia primaria de inmunosupresión en los receptores de trasplante cardíaco.
En junio de 2005, se celebraron en Bariloche (Argentina) las Jornadas Latinoamericanas de Consenso sobre el uso de everolimus en el trasplante cardíaco. Allí se reunieron destacados profesionales de la región para evaluar los datos disponibles y establecer, sobre la base de éstos y de su propia experiencia, lineamientos para el uso del everolimus en la práctica diaria.
Introducción
A principios de la década del 80, el trasplante cardíaco se estableció como un procedimiento para el tratamiento de la insuficiencia cardíaca refractaria, con una aplicación muy difundida en virtud de los avances logrados en el tratamiento de los trasplantes y, principalmente, en la terapia inmunosupresora. No obstante, las complicaciones postoperatorias, los episodios de rechazo, los diagnósticos de enfermedad vascular coronaria del injerto, los efectos colaterales de las medicaciones inmunosupresoras, las infecciones y las neoplasias continúan observándose con frecuencia en el seguimiento temprano y tardío del trasplante cardíaco. La enfermedad vascular del injerto es la principal1.
Se han investigado nuevos agentes inmunosupresores con el objetivo de evitar o reducir estas complicaciones2. Los inhibidores de la calcineurina (CNi) y los inhibidores de la biosíntesis de purinas no resultaron efectivos en la prevención del engrosamiento de la túnica íntima inmediatamente después del trasplante cardíaco. Cuando se comparó el mofetil micofenolato (MMF) con la azatioprina, no se observó que el primero redujera la incidencia de la enfermedad vascular del injerto al año de seguimiento, excepto en el área del lumen3. Por otra parte, tampoco se observaron diferencias significativas entre el mofetil micofenolato y la azatioprina en las mediciones angiográficas coronarias cuantitativas de la vasculopatía coronaria por trasplante en el seguimiento prolongado4.
El everolimus es un nuevo agente macrólido inmunosupresor desarrollado para evitar el rechazo agudo y crónico en los receptores de trasplantes. Esta medicación bloquea la función de una proteína reguladora clave: la FRAP (proteína asociada a rapamicina FKBP 12), también conocida como mTOR, cuyo mecanismo de acción es la inhibición de la proliferación celular estimulada por el factor de crecimiento, lo que lleva a detener el desarrollo del ciclo celular en la fase G15.
A menudo, los médicos deben enfrentar el desafío de aplicar en el ámbito clínico los resultados de investigaciones obtenidas con nuevas medicaciones inmunosupresoras. Sería muy útil contar con lineamientos para el uso del everolimus y así poder respaldar las decisiones de los médicos en la atención clínica respecto de la profilaxis del rechazo y de la prevención de eventos y efectos colaterales después del trasplante cardíaco, a fin de lograr un equilibrio adecuado entre eficacia y seguridad.
En junio de 2005, se celebraron en Bariloche (Argentina) las Jornadas Latinoamericanas de Consenso sobre el uso del: "Everolimus en el trasplante cardíaco". Allí se reunieron destacados especialistas en trasplante cardíaco de Uruguay, Colombia, Brasil y Argentina. En estas Jornadas se elaboraron recomendaciones para el uso del everolimus después del trasplante cardíaco, sobre la base de resultados del ensayo pivotal y de la experiencia clínica a fin de obtener mejores resultados en la práctica clínica diaria.
Perfil farmacodinámico del everolimus
El everolimus es un inhibidor de la señal de proliferación y se sabe que ejerce su efecto inmunosupresor mediante el bloqueo de la proliferación de células hematopoyéticas (células T y B) y células no hematopoyéticas (células del músculo liso vascular) impulsado por la interleuquina (IL)-2 y la IL-15 al inhibir la activación de la quinasa p70S65.
La administración de everolimus asociado con ciclosporina A (CsA) y metilprednisolona redujo significativamente la proliferación de las células T6. En los trasplantes en ratas, se observó actividad sinérgica entre el everolimus y la CsA7, el FTY 7208 y el mofetil micofenolato (MMF)9. No se ha demostrado antagonismo entre el everolimus y el tacrolimus10.
En estudios preclínicos, el everolimus evitó:
a.- El rechazo crónico en un modelo de trasplante renal en ratas11.
b.- El desarrollo de rechazo crónico evaluado por el engrosamiento de la túnica íntima en modelos murinos de trasplante de aorta12.
c.- Lesiones obliterantes en un modelo porcino de trasplante alogénico bronquial13.
d.- El rechazo crónico en modelo murino de trasplante de tráquea14.
e.- Inhibió la arteriosclerosis en trasplante de carótida15.
f.- Inhibió la destrucción epitelial y la remodelación de la vía aérea en un modelo porcino de trasplante alogénico de pulmón heterotópico16.
Perfil farmacocinético del everolimus
En los receptores de trasplantes cardíacos a quienes se les administró everolimus 0,75 ó 1,5 mg dos veces al día, los valores de Cmin observados durante un seguimiento de 6 meses fueron superiores a la concentración terapéutica umbral, mientras que los valores de Cmax y el área bajo la curva (AUC) fueron proporcionales a la dosis17.
Cuando se usa everolimus al igual que cuando se utiliza CsA para microemulsión, es conveniente que el paciente lo haga siempre de la misma manera con respecto a la ingesta del alimento, es decir siempre antes/con/después de la comida, pero siempre de igual modo en relación con la ingesta a fin de evitar fluctuaciones en la exposición al fármaco a lo largo del tiempo18.
Las enzimas 3A4, 3A5 y 2C8 del citocromo P450 (CYP) son las enzimas CYP involucradas en el metabolismo del everolimus en el hígado y la pared intestinal. La administración concomitante de inductores e inhibidores de CYP3A4 puede modificar el perfil farmacocinético del everolimus19 (Tabla 1). En los pacientes con deterioro hepático, es posible observar deterioro del clearance de everolimus20. Los pacientes de origen afroamericano pueden presentar una menor exposición al fármaco, por lo que pueden necesitar la administración de dosis más altas (de hecho, la dosis inicial recomendada para pacientes de origen afroamericano es de 3 mg/día)21.
Tabla 1. Interacción del everolimus con los fármacos que actúan por inhibición o inducción de la CYP3A ó en la glicoproteína P con función transportadora

Indicaciones para la administración del everolimus en pacientes con trasplante cardíaco (Tabla 2)
Tabla 2. Indicación para el uso de everolimus en pacientes con trasplante cardíaco "de novo" o que reciben tratamiento de mantenimiento en combinación con ciclosporina y corticosteroides

En un estudio reciente multicéntrico, prospectivo, aleatorizado, controlado con placebo, doble ciego, con muestra grande22, se comparó everolimus (1,5 y 3 mg/día) con azatioprina respecto de la eficacia, seguridad, tolerabilidad e incidencia de vasculopatía del injerto; se incluyeron pacientes con trasplante cardíaco de novo y se siguieron durante doce meses posttrasplante. Todos los pacientes recibieron CsA para microemulsión y esteroides, en todos los casos las dosis de CsA se ajustaron por el nivel del valle para obtener los niveles sanguíneos en el límite inferior del rango terapéutico, la dosis promedio de CsA fue significativamente más bajas en los pacientes con everolimus (3,5 mg/kg y 3,4 mg/kg) que en los pacientes con azatioprina (4,2 mg/kg). En el grupo que recibió everolimus, el estudio mostró lo siguiente: a.- reducción significativa en la incidencia de episodios de rechazo 3 A (ISHLT); b.-reducción significativa en la proliferación máxima del engrosamiento de la túnica íntima a los 12 meses y en la incidencia de la vasculopatía del injerto.
Hay datos publicados de seguimiento a largo plazo que informan que esta diferencia en la eficacia se mantiene en el tiempo cuando se la evalúa al mes 4823.
También, el everolimus resultó efectivo en el control del rechazo en un informe sobre un caso en el que se utilizó una combinación inmunosupresora con una dosis más baja de CsA, MMF y corticosteroides24.
Para decidir la administración del everolimus como terapia de mantenimiento, deberán evaluarse los datos disponibles de experiencias preclínicas, los mecanismos de acción del fármaco y los resultados de pacientes "de novo". Teniendo en cuenta la información actual, se pueden hacer recomendaciones para el uso de everolimus en los siguientes casos:
-Fracaso de la eficacia con otros adyuvantes.
-Posibilidad de profilaxis secundaria de la vasculopatía del injerto.
-Reemplazo de otros adyuvantes por efectos adversos serios.
-Pacientes con riesgo de nefrotoxicidad o para su prevención.
-Posible actividad en pacientes que presenten neoplasias.
Tolerabilidad
En los análisis de seguridad, la tasa de discontinuación fue superior en el grupo de administración de everolimus. Las razones más comunes para interrumpir la administración de la medicación debido a eventos adversos fueron las siguientes: trastornos renales (debido a la administración de dosis estándar de CsA durante el ensayo pivotal), infecciones, leucopenia, trastornos gastrointestinales, trastornos neurológicos, anemia y trombocitopenia. Los recuentos plaquetarios a los 12 meses fueron inferiores en el grupo de administración de 3,0 mg de everolimus. Los niveles de triglicéridos y de colesterol fueron superiores en ambos grupos de administración de everolimus.
La infección por citomegalovirus fue significativamente menor desde el punto de vista estadístico en aquellos pacientes que recibieron la administración de everolimus en comparación con los que recibieron la administración de MMF al mes 12 (p<0,001). En el grupo de tratamiento con everolimus se observó una menor incidencia de infecciones virales, incluida la causada por el citomegalovirus, y una mayor incidencia de infecciones bacterianas.
Con la administración de everolimus se observó un índice de infección similar o inferior al del mofetil micofenolato en transplantados renales25.
En el estudio de trasplante cardíaco "de novo"22, el tratamiento con everolimus se asoció con un mayor aumento de los niveles de creatinina sérica después de 3 meses; no obstante, dichos niveles se mantuvieron dentro de rangos aceptables. El everolimus puede potenciar los efectos nefrotóxicos de la CsA si se utilizan niveles estándar25,26. Los datos de trasplantes renales con una menor exposición a la CsA demostraron que este efecto está relacionado con la dosis y la exposición a la CsA. Los niveles de testosterona fueron bajos en ambos grupos de administración de everolimus, pero se mantuvieron dentro del rango normal27.
Se informó sobre la reactivación de la infección de Chagas después del trasplante cardíaco con protocolos de inmunosupresión basados en CsA y corticosteroides asociados con azatioprina o MMF. El protocolo con MMF presentó una mayor reactivación que el de azatioprina. Sin embargo, al parecer la reactivación no impacta sobre la sobrevida con posterioridad al trasplante, que resultó más alta en comparación con otras etiologías28-35. No parece haber ninguna razón para contraindicar la administración de everolimus en pacientes con cardiopatía chagásica y trasplante cardíaco. No obstante, aún no se dispone de datos sobre la seguridad del everolimus en la cardiopatía chagásica.
Precauciones al recetar everolimus
El everolimus debe utilizarse con cuidado en pacientes con hiperlipidemia, con deterioro grave de la función hepática y en quienes es necesario indicar la administración de inhibidores/ inductores de CYP3A. El tratamiento hipolipemiante con pravastatina, simvastatina, atorvastatina o fluvastatina es obligatorio36. Al parecer, el everolimus potencia los efectos nefrotóxicos de la CsA. Para limitar este problema, se debe reducir la dosis de CsA, cuando se utiliza en forma concomitante con everolimus37. La combinación del everolimus con dosis reducidas de CsA no estuvo asociada con una mayor incidencia de rechazo agudo comprobado por biopsia37-39.
El everolimus se debe administrar con precaución en pacientes que no pueden tomar medicación por vía oral (la administración se debe hacer por vía nasogástrica). No se recomiendala administración del everolimus sin control regular en pacientes con problemas de tolerabilidad con bloqueadores del mTOR, leucopenia grave o trombocitopenia, tratamiento en curso con inhibidores/inductores de CYP3A4, durante el embarazo, ni en pacientes con problemas de cicatrización en el período inmediatamente posterior a la operación, básicamente con infección bacteriana. Sin embargo, cuando se lo comparó con la azatioprina, no se observó un aumento en las complicaciones en la cicatrización22.
Además de los exámenes de rutina después del trasplante cardíaco, se recomienda el control regular de los niveles de colesterol, triglicéridos, leucocitos, recuento plaquetario, la función renal y los niveles sanguíneos del everolimus y CsA. Deberá considerarse la reducción de la dosis del everolimus o la suspensión de la administración del fármaco si el recuento plaquetario es < 50.000 ó el recuento de glóbulos blancos (WBC) es < 3.000. Se recomienda la biopsia endomiocárdica u otro método para controlar el rechazo dentro de los 7-45 días de haber optado por los protocolos de inmunosupresión con everolimus.
El everolimus no presentó actividad mutagénica o clastogénica, ni tampoco potencial oncogénico. Se están llevando a cabo estudios para evaluar la indicación del everolimus para el tratamiento de la neoplasia. Se informó sobre una mayor incidencia de neoplasias en pacientes con enfermedad de Chagas en comparación con otras etiologías35.
Recomendación de dosis y monitoreo terapéutico de los niveles sanguíneos de everolimus
La administración del everolimus debe iniciarse por vía oral con una dosis de 0,75 mg dos veces al día, lo antes posible después del trasplante, y ajustarse según los resultados de los niveles sanguíneos. En pacientes con deterioro hepático leve/ moderado, la dosis inicial debe reducirse a la mitad de la dosis usual20. Los niveles sanguíneos deben mantenerse entre 3 ng/ ml y 8 ng/ml para cubrir el riesgo de rechazo, realizar profilaxis de la vasculopatía post-trasplante cardíaco, y también por razones de seguridad26.
Los niveles sanguíneos de everolimus deben controlarse 4-6 días después de la administración de la primera dosis, o en cualquier momento en caso de modificar la dosis de la medicación, o en caso de comenzar a administrar/suspender la administración/ modificar la dosis de inductores o inhibidores de CYP3A4. Se deberán realizar controles adicionales en caso de diagnosticar deterioro de la función hepática. Una vez alcanzadas las condiciones de estado estacionario, los controles deberán hacerse cada dos semanas durante los primeros 6 meses, una vez por mes hasta cumplir un año de seguimiento, y cada dos meses de allí en adelante. Se deberá realizar un control adicional al momento del diagnóstico o en caso de sospecha de un evento adverso o episodio de fracaso de la eficacia que pudiera estar relacionado con la medicación, y también en caso de comenzar a administrar/suspender/modificar la dosis de una medicación que interactúe con el CYP3A4. Los métodos analíticos utilizados en la actualidad son los siguientes: HPLC/ MS o FPIA26,40.
Dosis de ciclosporina y monitoreo terapéutico de los niveles sanguíneos durante la administración de everolimus
La evaluación de la dosis recomendable de CsA depende del equilibrio entre el riesgo inmunológico y el perfil de seguridad. Sin embargo, deberá planificarse algún tipo de recomendación orientativa para los niveles sanguíneos de CsA durante la administración del everolimus (Tabla 3). La recomendación para los niveles orientativos de C2 (2 horas después de la dosis de CsA) se está analizando en ensayos clínicos. Hasta la fecha, se han realizado experiencias con otras combinaciones como adyuvantes y las perspectivas son prometedoras41,42.
Tabla 3. Recomendaciones para los niveles orientativos de ciclosporina en sangre en pacientes con trasplante cardíaco que reciben la administración concomitante de everolimus*

Para la CsA, rigen las mismas condiciones de control que para el everolimus. Es decir que se deben efectuar controles en caso de comenzar a administrar/suspender/modificar la dosis de una medicación que interactúe con el CYP3A4 y cuando existan sospechas de que un evento adverso o episodio de fracaso de la eficacia que pueda estar relacionado con la medicación.
Conversión de pacientes al protocolo de inmunosupresión con everolimus
La conversión de protocolos de inmunosupresión al uso de everolimus podrá indicarse (Esquema 1):

Esquema 1. Algoritmo sugerido para introducir la administración de everolimus en pacientes en mantenimiento. CsA: Ciclosporina-A
a.- Cuando se produzca un evento adverso no aceptable y relacionado con el tratamiento adyuvante inmunosupresor en curso.
b.- En caso de fracasos en la eficacia o para evitarlos.
c.- Cuando se presenten problemas de nefrotoxicidad (ya que el everolimus permite la reducción de CNi sin perder eficacia inmunosupresora) o antes, para evitar el deterioro de la función renal (Esquema 2).
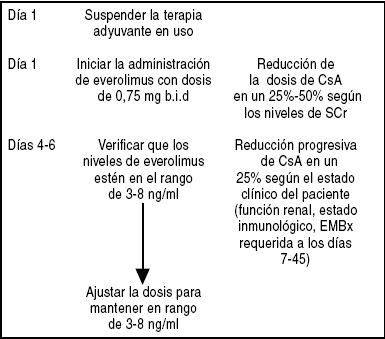
Esquema 2. Algoritmo sugerido para introducir la administración de everolimus en pacientes en mantenimiento con deterioro de la función renal *
*Nota: El deterioro de la función renal requiere la reducción inmediata de la dosis de CNi
CsA: Ciclosporina-A
SCr: Creatinina sérica
EMBx: Biopsia endomiocárdica
Conclusiones y el futuro de la inmunosupresión
Se observa un interés cada vez mayor en los protocolos de inmunosupresión para reducir las complicaciones después de un trasplante cardíaco, como por ejemplo infecciones, rechazo, neoplasias, nefrotoxicidad, hipertensión o vasculopatía coronaria del injerto; para minimizar el uso de medicaciones de baja tolerabilidad, protocolos con ahorro/suspensión de esteroides; o con regímenes con menor exposición o suspensión de los CNi después del período crítico posterior al trasplante43. El everolimus es un nuevo inmunosupresor que redujo el rechazo y la vasculopatía del injerto, de modo que podría ser una opción eficaz.
El RAD B25322 ha sido el único ensayo hasta la fecha que ha demostrado con un modelo doble ciego, aleatorizado y controlado con placebo una reducción en el aumento promedio del engrosamiento máximo de la túnica íntima desde el inicio hasta los 12 meses y en la incidencia de la vasculopatía en los dos grupos de administración del everolimus, con un alto rango de eficacia y seguridad en comparación con la azatioprina. Tomando en cuenta los resultados previamente descriptos, el everolimus podría ser la primera opción como terapia adyuvante para pacientes "de novo" con riesgo de sufrir vasculopatía por trasplante alogénico cardíaco o infección por CMV.
Aún cuando las razones más frecuentes para la suspensión prematura del tratamiento debido a eventos adversos en el ensayo RAD B25322, fueron los trastornos renales, corresponde aclarar que ello se debió a la administración de niveles estándar de CsA. Los expertos creen, fehacientemente, que el uso de everolimus con niveles más bajos de CNi reduce la nefrotoxicidad (Tabla 3).
Durante estas Jornadas de Consenso se elaboraron recomendaciones para la prescripción y el manejo del everolimus con el objeto de mejorar la evolución clínica de pacientes con trasplante cardíaco "de novo" o que reciben tratamiento de mantenimiento. No obstante, en virtud de los datos publicados, es necesario realizar ensayos donde se comparen el everolimus y el mofetil micofenolato. Asimismo, deberá investigarse la asociación entre el CNi junto con el everolimus y el mofetil micofenolato o el sódico en protocolos de inmunosupresión. Cabe agregar que es necesario efectuar ensayos de mayor magnitud y ampliar la experiencia clínica, en especial con grupos de pacientes en América Latina que incluyan sujetos con cardiopatías chagásicas.
1. Taylor DO, Edwards LB, Boucek MM. The Registry of the International Society for Heart and Lung Transplantation: twenty-first official adult heart transplantation report-2004. J Heart Lung Transplant 2004; 23: 796-803. [ Links ]
2. Valantine H, Zuckermann A. From Clinical trials to clinical practice: an overview of Certican® (everolimus) in heart transplantation. J Heart Transplant 2005; 24:S185-S190. [ Links ]
3. Kobashigawa J, Muller L, Renlund D, et al. A randomized active-controlled trial of mycophenolate mofetil in heart transplant recipients. Transplantation 1998; 66:507-15. [ Links ]
4. Eisen HJ, Kobashigawa J, Keogh A, et al. On behalf of the Mycophenolate Mofetil Cardiac Study Investigators. J Heart Lung Transplant 2005; 24:517-525. [ Links ]
5. Chapman TM, Perry CM. Everolimus. Drugs 2004; 64:861-72. [ Links ]
6. Bohler T, Waiser J, Budde K, et al. The in vivo effect of rapamicine derivative. SDZ RAD on lymphocyte proliferation. Transplant Proc 1998; 30:2195-2197. [ Links ]
7. Schuurnan HJ, Cottens S, Fuchs S, et al. SDZ RAD, a new rapamycin derivate: synergism with cyclosporine. Transplantation 1997; 64:32-35. [ Links ]
8. Nikolova Z, Hof A, Baumlin Y, et al. The peripheral lymphocyte count predicts graft survival in DA to Lewis heterotopic heart transplantation treated with FTY720 and SDZ RAD. Transpl Immunol 2000; 8:115-124. [ Links ]
9. Reis A, Megahed M, Reinhard T, et al. Coadministration of the new macrolide immunosuppressive RAD and mycophenolate mofetil in experimental corneal transplantation. Transplantation 2000; 70:1397-1340. [ Links ]
10. Delaney MP, Higgins RM, Morris AG. FK506 and the rapamycin analogue, SDZ RAD do not have antagonistic effects on lymphocytes from renal transplant patients. [abstract]. Am J Transpl 2001;I Suppl I: 301. [ Links ]
11. Viklicky O, Zou H, Muller V, et al. SDZ-RAD prevents manifestations of chronic rejection in rat renal allografts. Transplantation 2000; 69:497-502. [ Links ]
12. Scuurman DJ, Pally C, Weckbecker G, et al. SDZ RAD inhibits cold ischemic-induced vascular remodelling. Transplant Proc 1999; 31:1024-1025. [ Links ]
13. Salminen US, Alho H, Tasknen R, et al. Effects of rapamycin analogue SDZ RAD on obliterative lesions in a porcine heterotopic bronchial allograft model. Transpl Proc 1998; 30:2204-2205. [ Links ]
14. Weckbecker G, Caballero V, Court M, at al. Differential effects of FTY720, RAD, and CsA on signs of chronic rejection in the rat tracheal allograft model. Graft 2002; 5:145-148. [ Links ]
15. Matsumoto Y, Hof A, Baumlin Y, et al. Differential effect of cyclosporin A and SDZ RAD on neointimal formation of carotid allograft in apolipoprotein E-deficient mice. Transplantation 2003; 76:1166-1170. [ Links ]
16. Salminem US, Maasita PK, Taskien Y, et al. Prevention of small airway obliteration in a sine heterotopic lung allograft model. J Heart Lung Transplant 2000;19:193-206. [ Links ]
17. Pirron U, Kovarik JM, Eisen H, et al. Longitudinal pharmacokinetics of a everolimus in de novo heart transplantation patients and its influence on cyclosporine. Transplantation 2002; 74:Suppl:211. [ Links ]
18. Kovarik JM, Hartmann S, Figueiredo J, et al. Effect of food on everolimus absorption: quantification in healthy subjects and a confirmatory screening in patients with renal transplants. Pharmacotherapy 2002; 22:154-159. [ Links ]
19. Jacobsen W, Serkova N, Hausen B, et al. Comparison of in vivo metabolism of the macrolide immunosuppressants sirolimus and RAD. Transpl Proc 2001; 33:514-515. [ Links ]
20. Kovarik JM, Sabia HD, Figueiredo J, et al. Influence of hepatic impairment on everolimus pharmacokinetics: implications for dose adjustment. Clin Pharmacol Ther 2001; 70:423-430. [ Links ]
21. Kovarik JM, Kaplan B, Silva HT, et al. Pharmacokinetics of an everolimus-cyplosporine immunosuppressive regimen over the first 6 months after kidney transplantation. Am J Transplant 2003; 3: 606-613. [ Links ]
22. Eisen HJ, Tuzcu M, Dorent R, et al for the RAD B253 Study Group. Everolimus for the prevention of allograft rejection and vasculopathy in cardiac-transplant recipients. N Engl J Med 2003; 349:847-858. [ Links ]
23. Kobashigawa J, Hare J, Eisen H et al. Everolimus in cardiac transplantation 48 months results. Am J Transpl 2005, Abst 374. [ Links ]
24. Zuckermann A. Clinical experience with Certican© (Everolimus) in maintenance heart transplant patients at the Medical University of Vienna. J Heart Transplant 2005; 24:S206-S209. [ Links ]
25. Vitko S, Margreiter R, Weimar W et al. Everolimus (Certican) 12 months safety and efficacy versus mycophenolate mofetil in de novo renal transplant recipients. Transplantation 2004; 78:1532-1540. [ Links ]
26. Starling RC, Hare JM, Hauptan P, et al. Therapeutic drug monitoring for everolimus in heart transplantation recipients based on exposureeffect modelling. Am J Transplantation 2004; 4:2126-2131. [ Links ]
27. Kramer BK, Neumayer HH, Stahl R, et al RADA2307 Study Group. Graft function, cardiovascular risk factors, and sex hormones in renal transplant recipients on an immunosuppressive regimen of everolimus, reduced dose of cyclosporine, and basiliximab. Transplant Proc 2005;37(3):1601-1604. [ Links ]
28. Urinovsky F, Salomone O, Amuchástegui M et al. Morbimortalidad de los pacientes con miocardiopatía chagásica y trasplante cardíaco. Experiencia inicial. Rev Arg de Cardiología 2003; 71(5):325-331. [ Links ]
29. Bacal F, Silva CP, Bocchi EA, et al. Mychophenolate mofetil increased Chagas´disease reactivation in heart transplanted patients: comparison between two different protocols. Am J Transplant 2005; 5:2017-2021. [ Links ]
30. Bocchi EA, Bellotti G, Mocelin AO, Uip D, Bacal F, Higuchi ML, Amato-Neto V, Fiorelli A, Stolf NA, Jatene AD, Pileggi F. Heart transplantation for chronic Chagas' heart disease Ann Thorac Surg 1996 61(6):1727-1733. [ Links ]
31. Bocchi EA, Bellotti G, Uip D, Kalil J, de Lourdes Higuchi M, Fiorelli A, Stolf N, Jatene A, Pilleggi F. Long-term follow-up after heart transplantation in Chagas' disease. Transplant Proc 1993;25(1 Pt 2):1329-1330. [ Links ]
32. Bocchi EA, Fiorelli A. The paradox of survival results after heart transplantation for cardiomyopathy caused by Trypanosoma cruzi. First Guidelines Group for Heart Transplantation of the Brazilian Society of Cardiology. Ann Thorac Surg 2001; 71(6):1833. [ Links ]
33. Bocchi EA, Fiorelli A et al. The Brazilian experience with heart transplantation: a multicenter report. First Guideline Group for Heart Transplantation of the Brazilian Society of Cardiology. J Heart Lung Transplant 2001; 20(6):6376-45. [ Links ]
34. Bocchi EA, Bellotti G, Bacal F, et al. Heart Transplantation for chronic Chagas heart disease. Ann Thoracic Surg 1996; 61:1727-1733. [ Links ]
35. Bocchi EA, Higuchi ML, Vieira ML, Stolf N, Bellotti G, Fiorelli A, Uip D, Jatene A, Pileggi F. Higher incidence of malignant neoplasms after heart transplantation for treatment of chronic Chagas' heart disease. J Heart Lung Transplant 1998; 17(4):399-405. [ Links ]
36. Kovarik JM, Hartmann S, Huber M et al. Pharmacokinetic and Pharmacodynamic assessment of HMG-CoA reductase inhibitors when coadministered with Everolimus. Journal of Clinical Pharmacology 2002; 42: 222-228. [ Links ]
37. Valantine H. Prevention of Cardiac Allograft Vasculopathy with Certican ® (Everolimus): The Stanford University Experience within the Cetrican phase III Clinical trial. Heart Lung Transplant 2005; 24:S191-195. [ Links ]
38. Vitko S, Tedesco H, Eris J, et al. Everolimus with optimized cyclosporine dosing in renal transplant recipients: 6-month safety and efficacy results of two randomized studies. Am J Transplant 2004; 4:626-35. [ Links ]
39. Lehmkuhl H, Hetzer R. Clinical experience with Certican® (Everolimus) in De Novo Heart Transplant Patients at the Deutsches Herzzentrum Berlin. J Heart Lung Transplant 2005; 24:S201-S203. [ Links ]
40. Boyd J; Arabshahi L; Roberts M; Marbach P. A New FPIA Immunoassay for the Quantitative Determination of Everolimus in Whole Blood. Therapeutic Drug Monitoring 2005; 27(2):213-214. [ Links ]
41. Cantarovich M, Elstein E, de Varennes B, Barkun JS. Clinical benefit of neoral dose monitoring with cyclosporine 2-hr post-dose levels compared with trough levels in stable heart transplantation. Transplantation 1999; 68:1839-1842. [ Links ]
42. Delgado DH, Rao V, Cusimano RJ, et al. Monitoring of cyclosporine 2-hr post-dose and trough levels in heart transplantation. J Heart Lung Transplant 2002; 21:102-103. [ Links ]
43. Eisen H, Ross H. Optimizing the immunosuppressive regimen in heart transplantation. J Heart Transplant 2004; 23 (suppl):S207-213. [ Links ]














