Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Insuficiencia cardíaca
versão On-line ISSN 1852-3862
Insuf. card. vol.1 no.4 Ciudad Autónoma de Buenos Aires dez. 2006
ARTÍCULO ORIGINAL
Restauración ventricular.
Un nuevo concepto diagnóstico y terapéutico en los pacientes con miocardiopatía isquémica
José Cuenca Castillo*, Francisco Estévez Cid*, Alberto Juffé Stein*
* Servicio de Cirugía Cardíaca. Área del Corazón. Complejo Hospitalario Universitario Juan Canalejo (La Coruña). España.
Correspondencia: Dr. José J. Cuenca Castillo.
Servicio de Cirugía Cardíaca.
CHU Juan Canalejo. A Coruña.
e-mail: josecuenca@cardiocrunia.com
Trabajo recibido: 10/8/2006
Trabajo aprobado: 12/9/2006
Summary
Palabras clave: Insuficiencia cardíaca; Remodelado; Insuficiencia mitral; Cirugía.
There is a very important structure/function relationship of the intact ventricles. Postinfarction left ventricular remodeling is characterized by ventricular dilatation and abnormal geometry leading to systolic and diastolic dysfunction. Association of mitral regurgitation with ischemic cardiomyopathy increases the degree of heart failure. In the last years, the concept of ventricular restoration has been introduced. This is a new diagnostic and therapeutic approach for patients in heart failure. MRI studies are of great importance for evaluation, indication and follow up of these patients. The surgical approach to congestive heart failure is therefore a trilogy to deal the vessels, mitral valve, and reduce the ventricle.
Key Words: Heart failure; Remodeling; Mitral regurgitation; Surgery.
La eficiencia del corazón como bomba está íntimamente ligada a la estructura y disposición de sus fibras musculares.
Debemos considerar el proceso de remodelado ventricular, tras un daño miocárdico, como un elemento etiopatogénico de la insuficiencia cardíaca. Dentro de este contexto, el desarrollo de insuficiencia mitral funcional dispara la sintomatología del paciente y empeora su pronóstico. En los últimos años, se ha introducido el concepto de restauración ventricular como una nueva aproximación diagnóstica y terapéutica en el paciente con insuficiencia cardíaca. La resonancia magnética nuclear se ha convertido en la exploración principal para el diagnóstico y seguimiento de estos pacientes. Desde el punto de vista quirúrgico, debemos entender el abordaje de estos pacientes como una trilogía, hay que actuar sobre las arterias coronarias, reparar la válvula mitral si existe una insuficiencia al menos moderada, y realizar una reducción del volumen ventricular.
TABLA DE ABREVIATURAS
TC= Trasplante cardíaco.
IMF= Insuficiencia mitral funcional.
LVESVI = Índice del volumen telesistólico del ventrículo izquierdo.
DCI= Desfibrilador implantable.IC= Insuficiencia cardíaca.
FE= Fracción de eyección.
PCE= Plástica circular endoventricular.
RMN= Resonancia magnética nuclear.
Introducción
Conceptos fisiopatológicos
La morfología y disposición espacial de las fibras miocárdicas le confiere una mayor efectividad a la función contráctil cardíaca. Su orientación oblicua, desde la porción media del ventrículo al ápex, posibilita que para un acortamiento de un 15% de longitud de la fibra miocárdica se produzca una eyección del 60% del volumen ventricular (Fig. 1). Como observamos de forma esquemática, debido al movimiento del ápex sobre la base ventricular durante la sístole, se produce un mecanismo de torsión1,2.
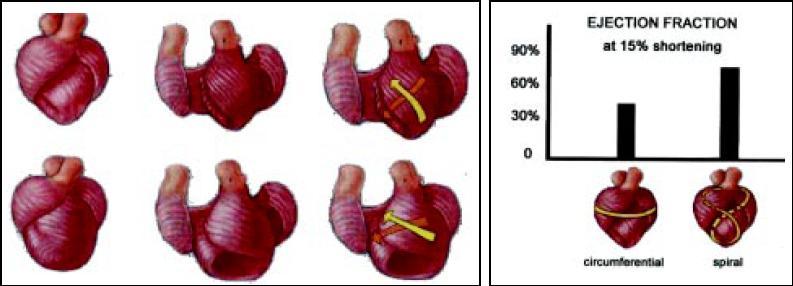
Fig. 1. Representación esquemática de la disposición oblicua de las fibras miocárdicas (espiral) y del mecanismo de torsión posibilitando una mayor eyección ventricular (60%).
Esta configuración geométrica no sólo afecta a la eyección cardíaca, sino que el mecanismo de torsión ventricular también contribuye en gran medida al llenado ventricular de la fase protodiastólica3. Durante esta fase se produce una aspiración de la sangre auricular, que supone entorno al 50-60% del llenado ventricular rápido.
Cualquier enfermedad cardíaca que afecte a la estructura y morfología del corazón, conlleva una alteración en su función. Es bien conocida que la puesta en marcha de mecanismos fisiopatológicos de "compensación" (Fig. 2), tanto anivel cardíaco (remodelado ventricular: hipertrofia concéntrica/ excéntrica, fibrosis, etc.) como a nivel sistémico (activación neurohormonal), a mediano-largo plazo poseen un efecto deletéreo. Una buena parte de las terapias farmacológicas (beta bloqueantes, IECA, etc.) y quirúrgicas (plástica circular endoventricular) están fundamentadas en tratar de contrarrestar dichos mecanismos de compensación a distintos niveles.

Figura 2. Mecanismos neurohormonales de adaptación de falla cardíaca (Tomado de www.portalesmedicos/portalcardio).
El aneurisma del VI es una dilatación sacular, que comprende a todas las capas de la pared libre del mismo, y frecuentemente localizado a nivel antero-lateral y apical. Generalmente, su origen está íntimamente relacionado con un proceso fisiológico de adaptación (remodelado ventricular) frente a una cicatriz de necrosis miocárdica transmural, tras el infarto agudo de miocardio (IAM), que comprende el adelgazamiento y la progresiva dilatación de la misma. Dicha afectación transmural, debe ser diferenciada de cicatrices no transmurales o de zonas que corresponden a fibrosis miocárdica difusa, que producen zonas aquinéticas o disquinéticas pero que no corresponden a una ectasia bien definida de la pared ventricular.
Actualmente, ha disminuido la incidencia de necrosis transmural debido al tratamiento trombolítico y sobre todo a la angioplastia primaria tras el IAM. Estudios de Bogaert3 y asociados con resonancia magnética nuclear (RMN), evidencian que tras la recanalización de la arteria afectada, se produce una necrosis de los 2/3 internos de la pared ventricular, manteniéndose una zona de miocardio epicárdico via-ble. Esta zona previene un extenso remodelado de la zona y la consiguiente formación de un aneurisma (zona disquinética), comportándose angiográficamente como una zona de aquinesia.
Por su similitud fisiopatológica, en la actualidad, se engloban bajo el concepto de área de asinergia (no contráctil) todos los segmentos miocárdicos cuya contractilidad se encuentra por debajo de dos desviaciones estándares de la media, con independencia de que sean aquinéticos o disquinéticos.
Por tanto, el proceso de remodelado de la pared del ventrículo, a nivel de la cicatriz como del miocardio sano, es el responsable de una alteración de la morfología elíptica cardíaca hacia una morfología más esférica, que como hemos visto resta efectividad a la función cardíaca. Por otro lado,la dilatación secundaria de la cavidad ventricular, provoca un aumento de la tensión parietal no aneurismática (Ley de Laplace), que determina un mayor trabajo sistólico y un mayor consumo de oxígeno pudiendo llegar a perder su capacidad contráctil, dilatándose y agravando a su vez el deterioro de la función cardíaca.
La alteración de la morfología ventricular provoca un disbalance entre las fuerzas de tracción y coaptación del aparato subvalvular mitral, dando lugar a una insuficiencia mitral funcional (IMF), asociada o no a dilatación del anillo valvular5 (Fig. 3). Se trata de un tercer mecanismo fisiopatológico que contribuye a una sobrecarga de volumen ventricular, exacerbando el remodelado ventricular.

Figura 3. Tomado de Comin y col5.
El desarrollo de una IMF al menos moderada supone un deterioro clínico en la historia natural del paciente y disminución de la supervivencia6.
Frente al concepto de remodelado ventricular, surge el de restauración ventricular. Se trata de intentar una normalización anatómica y morfológica del miocardio. Además de una adecuada revascularización miocárdica para recuperar zonas viables, se hace necesario actuar sobre los mecanismos que conducen a un ventrículo distendido7,8. De hecho son varios los trabajos que relacionan el índice de volumen telesistólico del ventrículo izquierdo (LVESVI calculado por RMN o ventriculografía) con mayor progresión a insuficiencia cardíaca. White y col.9 muestran que los pacientes tras sufrir un IAM con LVESVI > 60 ml/m2 tienen un mortalidad cinco veces mayor comparado con los que presentan volúmenes normales (< 25 ml/m2). De forma similar, el estudio GUSTO I10 demuestra la importancia del volumen ventricular: entre los pacientes con trombolisis exitosa tras un IAM el 17% tenían dilatación ventricular progresiva (> 40 ml/m2). La mortalidad11 a un año era del 16%, si el LVESVI era de 40-50 ml/m2; el 21% si LVESVI de 50-60 ml/m2 y hasta un 33% de mortalidad si el LVESVI era de 60 ml/m2. En este sentido, se ha observado que tras la realización de una revascularización miocárdica, la mortalidad y los reingresos por ICC es mayor en los pacientes con LVESVI superior a 100 ml/m2. Este parámetro preoperatorio es el único predictor de mejoría de la fracción de eyección tras la revascularizción7,8. En las series de Bolling y col.12,13, trasuna reparación valvular mitral en pacientes con miocardiopatía dilatada, observa en el seguimiento una mortalidad tardía de hasta el 50%, si el índice telesistólico no disminuye significativamente.
La revascularización aislada no cambia el volumen ventricular izquierdo en los ventrículos dilatados (LVESVI > 75 ml/m2), a pesar de la evidencia previa de viabilidad en la zona aquinética (miocardio hibernado), y por tanto no modifica la progresión del paciente hacia la insuficiencia cardíaca14.
Por tanto hemos de entender el concepto de remodelado ventricular como una trilogía15 (Cuadro 1).
Por lo tanto, desde el punto de vista quirúrgico no sólo hemos de actuar restableciendo el flujo coronario, sino que también hemos de corregir la existencia de una insuficiencia mitral (IM), al menos moderada, que contribuye a la sobrecarga volumétrica y distensión ventricular. Actualmente, se han obtenido buenos resultados con el implante de anillos mitrales completos, flexibles y sobrecorrectores16 (una medida menos que el anillo nativo, definido por la distancia intertrigonal), que favorecen las fuerzas de coaptación de los velos mitrales.
Finalmente, la cirugía puede actuar sobre la morfología ventricular con diferentes técnicas. Clásicamente, el tratamiento de elección de los aneurimas ventriculares era farmacológico y se reservaba únicamente el tratamiento quirúrgico, mediante aneurismectomía y cierre con sutura lineal, a pacientes con mala situación clínica y/o cardiopatías asociadas (con malos resultados), siendo realmente el trasplante cardíaco la única alternativa eficaz que modificaba el pronóstico de estos pacientes. Sin embargo, el limitado número de donantes, la presencia de comorbilidades o la edad avanzada, hacen que tan solo un mínimo número de estos pacientes puede realmente llegar a beneficiarse con esta alternativa por lo que han surgido nuevas vías de investigación dirigidas a determinar que pacientes se beneficiarían del tratamiento quirúrgico de su cardiopatía, así como de precisar cual es la técnica más adecuada.
En el caso de los aneurismas ventriculares, la técnica más empleada para actuar sobre el músculo cardíaco y reducir la cavidad ventricular, es la plástica circular endoventricular17,18,19, descrita por Vincent Dor y colaboradores en 1985, que básicamente consiste en la exclusión de la porción aneurismática no contráctil y la reconstrucción del ápex para regenerar la morfología elíptica. Recientemente, ha sufrido modificaciones para el tratamiento de las zonas con infarto no transmural (aquinéticas). Existen otras técnicas como la ventriculectomía lateral parcial izquierda (técnica de Batista20) que suelen emplearse en miocardiopatías dilatadas de origen idiomático o valvular, es decir, en ausencia de necrosis.
Finalmente, en cuanto al cuadro clínico de pacientes tras sufrir IAM con zonas disquinéticas o aquinéticas, la sintomatología más típica comprende desde episodios de insuficiencia cardíaca o angor de difícil tratamiento médico, hasta la aparición de arritmias ventriculares malignas que tienen su origen en la zona perianeurismática.
Objetivo
Evaluar nuestra experiencia frente a este tipo de patología mediante la técnica de Dor, la cual pretende; con la realiza-ción de una sutura circular endoventricular; la recuperación anatómica y geométrica del ventrículo izquierdo (VI), evaluando sus resultados en cuanto a mortalidad precoz y mejoría de la calidad de vida y compararlo con los resultados publicados.
Pacientes y método
Pacientes
Desde Junio de 1994 hasta Abril de 2004 se han intervenido 60 pacientes con aneurismas de VI, 37 (84,09%) varones y 7 (15,9%) mujeres, con una edad media de 64,51 ± 9,43 años (rango entre 46-77). La gran mayoría (55, el 91%) presentaban factores de riesgo cardiovascular, siendo 45% fumadores, 20% diabéticos, 51% con dislipemia, 65% con hipertensión arterial y 15% presentaban insuficiencia renal crónica al menos ligera (creatinina > 1,5 mg/dl). Además eran portadores de sistema de desfibrilación implantado 2 (3,3%) de ellos y otros 2 (3,3%) de sistema de marcapasos. Un gran grupo de pacientes (55, el 91%) presentaba antecedentes de infarto de miocardio, de los cuales 8% no habían sido transmurales, siendo el resto de localización anterosepto-apical 70%, infero-basal 20% y presentando afectación en territorios anterior e inferior 2%. La situación clínica preoperatoria incluía a 12 (20%) pacientes con al menos disnea de pequeños esfuezos (NYHA III-IV), siendo el valor medio de la clasificación NYHA de 1,95 ± 0,90; otros 46 (76%) presentaban angor de esfuerzos (valor medio de escala CCS de 1,86 ± 1,28) y 17 (26,6%) habían tenido algún episodio documentado de arritmias ventriculares malignas. El estudio preoperatorio, además de bioquímica, hemograma y estudio de coagulación, incluyó la realización de un ecocardiograma transtorácico (68,18%) y un estudio hemodinámico invasivo (95,45%), en 8 pacientes con arrítmias ventriculares se realizó un estudio electrofisiológico encaminado a la ablación de las mismas sin éxito. La fracción de eyección preoperatoria media por ecocardiograma transtorácico fue del 38,06% ± 11,27% (rango entre 20-70%) y por ventriculografía izquierda del 35,8% ± 10,45% (rango entre 15-65%). El estudio hemodinámico mostró enfermedad coronaria severa de al menos 1 vaso principal en la totalidad de los pacientes, siendo la media de 2,19 ± 0,83 vasos principales enfermos por paciente; además, 2 (3,3%) presentaban doble lesión valvular aórtica y otros 2 (3,3%) presentaban insuficiencia mitral severa.
La indicación de la cirugía fue la presencia de taquicardias ventriculares sostenidas e intratables en 17 (28,%), angor inestable e ICC en 33 (55 %) e insuficiencia cardíaca en otros 19 (16%) pacientes.
Método
El estudio se compone de 60 pacientes seguidos intervenidos en nuestro centro por aneurisma ventricular izquierdo y con cualquiera de la sintomatología descrita. El estudio se basa en un análisis descriptivo de la población incluida en el mismo, así como la comparación de los grados funcionales medios y la fracción de eyección (ecocardiograma transtorácico) preoperatorios y postoperatorios utilizando para ello la prueba T-Student de muestras relacionadas con un intervalo de confianza del 95%.
Técnica quirúrgica
Todas las intervenciones se realizaron con circulación extracorpórea (CEC), siendo el tiempo total de CEC promedio de 115,37 ± 48,99 minutos (rango entre 54-300), y el tiempo promedio de clampeo aórtico de 88,98 ± 34,49 minutos (rango entre 20-200). Como método de protección miocárdica, en nuestro centro utilizamos cardioplegía hemática fría intermitente por vías anterógrada y retrógrada, ya que creemos que en estos pacientes con baja fracción de eyección es de suma importancia evitar el daño isquémico. En los dos pacientes que presentaban patología de la válvula aórtica asociada fueron sometidos en el mismo procedimiento a cirugía de recambio de la misma, mientras que los dos pacientes que presentaban insuficiencia mitral severa pudo ser reparada la válvula con éxito en ambos casos. Además, 52 pacientes (86%) fueron sometidos a cirugía asociada de revascularización coronaria, realizándose un total de 2,05 ± 1,48 puentes por paciente. Como elección, utilizamos en todos los pacientes la arteria mamaria interna esquelitazada bilateral con técnica (Y o T) de Téctor22.
Descripción de la técnica quirúrgica
Una vez iniciada la CEC e insertado el drenaje del VI (vent), es sencillo delimitar por palpación y visión directa la zona de aneurisma del VI, ya que al ser la zona más adelgazada de la cicatriz se colapsa. Esta maniobra adquiere cada vez una mayor importancia, dado que la menor incidencia de infartos transmurales hace que con la simple inspección visual sea difícil delimitar claramente la zona de disquinesia/ aquinesia. Una vez localizado, se realiza una incisión de 3- 4 cm sobre el mismo paralela a la arteria descendente anterior (Fig. 4A), accediendo al interior en donde se suele encontrar abundante material trombótico. Desde el interior se determina la extensión de la cicatriz endocárdica y se identifica su unión con el miocardio normal a lo largo de toda la circunferencia del aneurisma (Fig. 4B). Si no existe calcificación, la cicatriz septal se diseca hasta su unión con el miocardio sano y posteriormente se reseca, utilizándose como parche para el cierre de la cavidad ventricular (Fig. 5). En los casos de calcificación septal o cuando se trata de un aneurisma inferior con una pequeña cicatriz endocárdica, empleamos un parche de dacrón para este mismo fin. El remodelado elíptico del ventrículo se realiza, creando un nuevo ápex mediante una sutura en bolsa de tabaco con un monofilamento 2/0 ó 3/0, como fue descrita por Fontan y colaboradores21, a lo largo de toda la circunferencia del aneurisma en la unión entre miocardio sano y cicatriz endocárdica (Fig. 4C).
Esta sutura se realiza a suficiente profundidad para evitar que se desgarre cuando se anude manteniendo una tensión suficiente para reducir el cuello del aneurisma y darle una forma oval de aproximadamente 3 cm de diámetro mayor por 2 cm de diámetro menor. El parche de cicatriz endocárdica o material protésico se recortará con esa morfología ydimensiones y será suturado de forma continua con un monofilamento, igualmente, entre la unión de miocardio sano y cicatricial (Fig. 4D), con lo que se produce la exclusión de la porción de miocardio septal, anterior o inferior no contráctil de la cavidad ventricular. Finalmente, los tejidos de la pared miocárdica excluidos son suturados uno sobre otro de forma lineal y reforzados con tiras de teflón para incrementar la hemostasia (Fig. 4D y 4F). Generalmente, esta técnica se acompaña de una revascularización miocárdica extensa que debe incluir la arteria descendente anterior aunque esté completamente ocluida de forma crónica o sea de mala calidad, con el fin de recuperar el miocardio hibernado de las porciones basales del septo y la realización de una plastia mitral, si el paciente presenta una insuficiencia mitral al menos moderada.

Figura 4. Descripción de la técnica quirúrgica.

Figura 5. Ventriculotomía izquierda a nivel del infarto anterior transmural. Se aprecia el límite entre miocardio sano y tejido fibroso cicatricial.
Resultados
Fallecieron un total de 4 pacientes (6,6%), todos en el postoperatorio inmediato y en situación de falla cardíaca refractaria, destacando que sólo fallecieron 3 pacientes (5,3%) de los 56 (93%) que fueron intervenidos en forma electiva, frente a 1 (25%) paciente fallecido entre los 4 (6%) que fueron intervenidos en situación de urgencia.
El tiempo medio de ventilación mecánica fue de 36,2 ± 77,34 (rango entre 3-384) horas por paciente. Si excluimos del grupo, un paciente con 384 horas de intubación que posteriormente falleció, el tiempo medio sería de 21,71 ± 27,63 (rango entre 3-120) horas.
Una gran parte de los pacientes (80%) precisó apoyo inotrópico, si bien la duración del mismo (entre los no fallecidos) se limitó a 2,39 ± 4,17 días por término medio. En 5 pacientes (8,3%) se utilizó la colocación de un balón de contrapulsación intra-aórtico (4 [80%] de ellos electivos y1 [20%] urgente), siendo la duración de la asistencia de 1,75± 0,957 días por término medio. De estos 5 pacientes, falleció 1 (el 20% de los que requirieron balón de contrapulsación). La situación de shock cardiogénico en 2 (3,3%) pacientes requirió la realización de trasplante cardíaco de urgencia, con buena evolución postoperatoria.
La estancia en unidad de cuidados intensivos fue por término medio de 2,98 ± 3,69 (rango entre 1-20) días siendo la estancia postoperatoria total media de 7,55 ± 10,14 (rango entre 3-64) días.
En cuanto a la situación clínica postoperatoria, se realizó una escala de NYHA a los 6 meses de la cirugía, permaneciendo solamente 2 (3,3%) de los 56 pacientes vivos (93%) con disnea para esfuerzos pequeños (NYHA III), y el resto (54; 90%) sin disnea o disnea de esfuerzos importantes (Fig. 6).
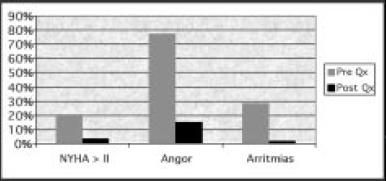
Figura 6. Situación clínica 6 meses postcirugía (p<0,05).
El valor medio de la clasificación NYHA fue de 1,44 ± 0,583, siendo estadísticamente significativo (p=0,002) con respecto al grado NYHA preoperatorio (Fig. 6).
De los 46 pacientes que padecían angor de esfuerzos en el preoperatorio, solamente 8 (13%) continúan con angina para esfuerzos importantes a los 6 meses (Fig. 6), ninguno de ellos presenta angina de esfuerzos moderados, pequeños o de reposo, siendo el valor medio de la escala CCS a los 6 meses de 0,24 ± 0,52 (Fig. 7), encontrándose diferencias estadísticamente significativas (p=0,0002). En cuanto a las arritmias ventriculares malignas (17, el 28%) solamente recidivaron en 1 (5,8%) paciente con aneurisma inferior (Fig. 6), si bien no se había realizado nuevo estudio electrofisiológico, si se habían realizado estudios de Holter en varias ocasiones. Los dos pacientes portadores de sistema de desfibrilación no presentaron datos de taquicardias ventriculares al interrogar los dispositivos.
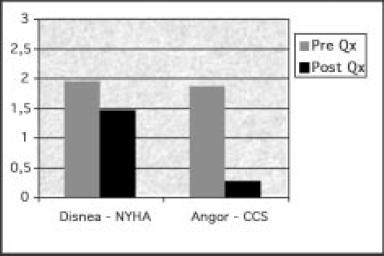
Figura 7. Situación clínica 6 meses postcirugía (p<0,05). Clase NYHA y CCS media pre y postcirugía.
Dentro de las pruebas realizadas a lo largo del seguimiento se realizó un ecocardiograma transtorácico al 25% de los pacientes al primer mes y sexto mes tras la cirugía, la fracción de eyección (FE) media al mes fue de 41,14% ± 10,72% y de 48,5% ± 11,15% a los 6 meses.
Comparando la FE preoperatoria con la de al 1 mes y a los 6 meses, no se obtuvo significación estadística (p 0,245 al mes, p 0,106 a los 6 meses) (Fig. 8).

Figura 8. Fracción de eyección precirugía, al primer y al sexto mes postoperatorio (sin significación estadística).
Discusión
Como hemos comentado, el principio fundamental en la cirugía de restauración ventricular, consiste en la reconstrucción funcional de la cavidad ventricular, con exclusión máxima de las zonas aquinéticas y eliminación del movimiento paradójico, asociando siempre que sea posible la cirugía de revascularevascularización miocárdica y de reparación mitral (IM > 2).
En los resultados publicados en la literatura, la mayoría de los pacientes experimentan una gran mejoría clínica y funcional, aunque en algunos pacientes no se ha podido objetivar una correlación entre esta mejoría y un aumento de la función ventricular. Además, las curvas de supervivencia publicadas son significativamente superiores respecto a las de los pacientes sin tratamiento quirúrgico, especialmente en pacientes con enfermedad coronaria de tres vasos.
Cabe comentar, como referencia, los resultados de un estudio multicéntrico realizado en 13 centros de Europa y Estados Unidos denominado "RESTORE"23 (Reconstructive Endoventricular Surgery returning Torsión Original Radius Elliptical shape to left ventricle) que ha registrado 1.198 pacientes entre 1998 y 2003. En él, se evaluaron los resultados precoces y a 5 años de seguimiento. La edad media de los pacientes era de 63 ± 10 años, todos tenían antecedente de infarto anterior y el 67% de los pacientes presentaban disnea en clase funcional NYHA III-IV. La FE media preoperatoria era de 29,6 ± 10% y el LVESVI 80,4 ± 51,4 ml/m2. En el 95% de los pacientes se realizó revascularización miocárdica asociada, en el 22% reparación mitral y en el 1% sustitución valvular mitral. La mortalidad hospitalaria fue del 5,3% (8,7% en pacientes en los que se añadió reparación/recambio mitral y un 4% en pacientes en los que no se realizó, siendo estadísticamente significativa esta diferencia). Hubo necesidad de implantar balón de contrapulsación en el 8,2%; de asistencia ventricular izquierda en el 0,7% y de ECMO (Extracorporeal membrana oxygenation) en 0,3%. Postoperatoriamente, la FE media pasó a 39 ± 12% (p<0,01 respecto al preoperatorio), lo que supone un incremento de un 10%. El LVESVI postquirúrgico es de 56,6 ± 34,3 ml/m2, tra-duciéndose en un descenso de 23,8 ml/m2 (p<0,01). A 5 años, la supervivencia es del 68,6% ± 2,8%, y el porcentaje de pacientes libres de ingreso hospitalario por falla cardíaca del 78%. Asimismo, el 85% de los pacientes a los cinco años de seguimiento permanecen en clase funcional I-II de la NYHA.
Por análisis de regresión logística, se determinaron los factores de riesgo de mortalidad precoz o tardía tras la cirugía, resultando: edad mayor de 75 años, clase funcional NYHA avanzada (III-IV), FE < de 30% y LVESVI mayor o igual a 80 ml/ m2 (Fig. 9 a 12).
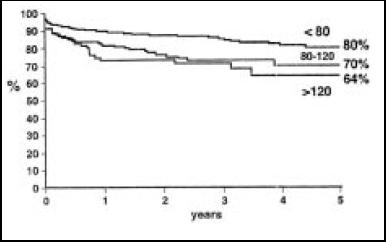
Figura 9. Supervivencia LVSVI preoperatorio23.
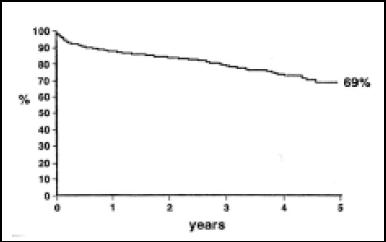
Figura 10. Supervivencia global a 5 años23.
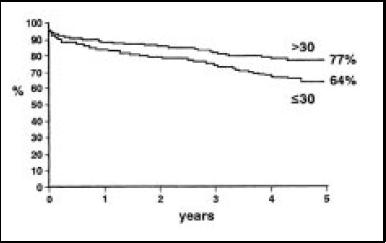
Figura 11. Supervivencia23 y fracción eyección.
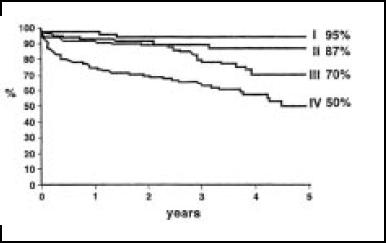
Figura 12. Supervivencia23 y clase funcional NYHA.
En este sentido, cobra importancia la precocidad en la indicación quirúrgica. Ante un daño miocárdico extenso, cualquier técnica de revascularización está condenada al fracaso. En la experiencia de Dor, si el LVESVI es mayor de 120 ml/m2, la supervivencia a 6 años se sitúa entorno al 50% frente a casi el 90% si el LVESVI es menor de 90 ml/m2. De forma similar, Cwajg y colaboradores24 evidencian unos malos resultados quirúrgicos, si el grosor de la pared ventricular izquierda es inferior a 0,6 cm.
Perspectivas de futuro
En cuanto a nuestro estudio, trataremos de cuantificar mediante RMN el LVESVI postquirúrgico con el fin de compararlo con los previos de cada paciente y obtener una valoración de la reducción del volumen ventricular en un amplio número de pacientes. No obstante, como hemos comentado, este índice es un marcador pronóstico de gran importancia. Otro objetivo, en el que estamos trabajando, es el de realizar un seguimiento a medio-largo plazo para poder contrastarlo con los obtenidos en la literatura al respecto.
Cabe mencionar, por su importante repercusión, que estamos a la espera de los resultados del STICH trial25 (Surgical Treatment for Ischemic Heart Failure), que randomiza pacientes con cardiopatía isquémica hacia tratamiento médico, cirugía coronaria aislada o cirugía coronaria más restauración ventricular.
Este estudio permitirá conocer si la cirugía coronaria aumenta la supervivencia en pacientes con coronariopatía y falla cardíaca y si hay un beneficio claro de las terapias de restauración miocárdica (Fig. 13).
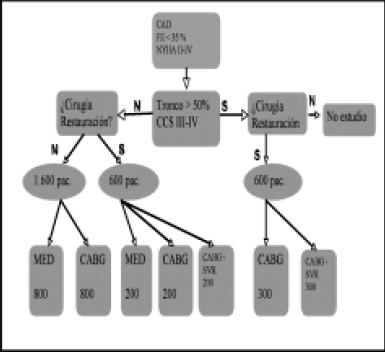
Figura 13. Diseño del STICH trial.
Conclusiones
Consideramos que la plástica circular endoventricular (PCE) es una alternativa quirúrgica adecuada para pacientes en grado funcional NYHA III-IV que no sean candidatos a trasplante cardíaco, ya que se produce una baja mortalidad en pacientes que se intervienen de forma electiva (6,6%), siendo la cirugía de urgencia o la necesidad de asistencia con balón intraaórtico variables que aumentan la mortalidad.
Aunque en nuestro estudio no resulta un aumento significativo de la función sistólica ventricular izquierda, sí se obtienen diferencias significativas en cuanto a mejoría de grado funcional y la disminución de angor y por lo tanto se consigue mejorar la calidad de vida de estos pacientes.
El hecho de que la PCE actúe, no sólo sobre el aneurisma sino también, sobre el tejido perianeurismático, contribuye a la desaparición de las arritmias ventriculares.
Finalmente, consideramos que esta técnica de restauración ventricular es segura y efectiva en el tratamiento de los pa-cientes con aneurismas de VI, tras un infarto de miocardio fundamentalmente de localización anterior.
Los resultados precoces y a corto plazo de las grandes series- grupo RESTORE- (fundamentalmente en cuanto a mortalidad y mejoría de calidad de vida -clase funcional NYHA-), son en general bastante similares a los obtenidos por nuestro grupo; excepto en cuanto a la mejoría significativa de la FE postoperatoria, quizás por el escaso número de pacientes de nuestra casuística, así como por el menor período de seguimiento de sólo 6 meses. También, existen diferencias poblacionales importantes en cuanto al grado funcional NYHA avanzado (IIIIV): 20% en nuestra serie frente al 67% en el grupo RESTORE.
Por otra parte, llama la atención el diferente porcentaje de actuaciones quirúrgicas sobre la válvula mitral (22% en el grupo RESTORE vs 3,3% de nuestra serie). En parte puede explicarse por la intensa actividad del programa de trasplante cardíaco de finales de los años 90, en los que muchos pacientes con FE disminuida, ventrículo dilatado (muy frecuentemente asociado a insuficiencia mitral moderada/severa) y clase funcional avanzada, eran candidatos para trasplante cardíaco.
1. Torrent-Guasp F. Mecánica de los segmentos descendente y ascendente de la banda miocárdica ventricular. Rev Esp Cardiol 2001;54:1091-1102. [ Links ]
2. Shapiro EP, Rademakers FE. Importance of oblique fiber orientation for left ventricular wall deformation. Technol Health Care 1997;5:21-28. [ Links ]
3. Bogaert J, Maes A, Van der Werf F, Bosmans H, Herregods MC, Nuyts J, et al. Functional recovery of subepicardial myocardial tissue in transmural myocardial infarction after successful reperfusion: an important contribution to the improvement of regional and global left ventricular function. Circulation 1999;99:36-43. [ Links ]
4. Lorenz CH, Pastorek JS, Bundy JM. Delineation of normal human left ventricular twist throughout systole by tagged cine magnetic resonance imaging. Journal of Cardiovascular Magnetic Resonance 2000;2(2):97-108. [ Links ]
5. Comin J, Manito N, Roca J, Castells E, Esplugas E. Insuficiencia mitral functional. Fisiopatología e impacto del tratamiento médico y de las técnicas quirúrgicas de reducción ventricular izquierda. Rev Esp Cardiol 1999;52:512-520. [ Links ]
6. Konno T, Sabbah HN, Rosman HJ, Alam M, Jafris S, Stein PD et al. Left ventricular shape is the primary determinant of functional mitral regurgitation in heart failure. Am Coll Cardiol 1992;20:1594-1598. [ Links ]
7. Yamaguchi A, Ino T, Adachi H, et al. Left ventricular end-systolic volume index in patients with ischemic cardiomyopathy predicts postoperative ventricular function. Ann thorac Surg 1995;60:1059-62. [ Links ]
8. Yamaguchi A, Ino T, Adachi H, et al. Left ventricular volume predicts postoperative course in patients with ischemic cardiomyopathy. Ann thorac Surg 1998;65:434-438. [ Links ]
9. White HD, Norris RM, Brown MA, Brandt PW, Whitlock RM, Wild CJ. Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation 1987;76:44-51. [ Links ]
10. Migrino RQ, Young JB, Ellis SG, White HD, Lundergan CF, Miller DP, et al. End-systolic volume index at 90 to 180 minutes into reperfusion therapy for acute myocardial infarction is a strong predictor of early and late mortality. The Global Utilization of Streptokinase and t- PA for Occluded Coronary Arteries (GUSTO)-I Angiographic Investigators. Circulation 1997;96:116-21. [ Links ]
11. Gaudron P, Eilles C, Kugler I, Ertl G. Progresive left ventricular dysfunction and remodelling after myocardial infarction: potencial mechanism and early predictors. Circulation 1993;87:755-63. [ Links ]
12. Bolling SF, Pagani FD, Deeb GM, et al. Intermediate-term outcome of mitral reconstruction in cardiomyopatthy. J Thorac Cardiovasc Surg 1998;115:381-386. [ Links ]
13. Bolling SF. Mitral reconstruction in cardiomyopathy. J Heart Valve Disease 2002;11(suppl1):S26-S32. [ Links ]
14. Vanoverschelde JL, Depre C, Gerber BL, Bogers M, Wijns W, Robert A, et al. Time course of functional recovery after coronary artery bypass graft surgery in patients with chronic left ventricular ischemic dysfunction. Am J Cardiol 2000;85:1432-9. [ Links ]
15. Buckberg G. Congestive heart failure: treat the didease, not the symptom - return to normalcy. J Thorac Cardiovasc Surg 2001;121:628-37. [ Links ]
16. Romano MA, Bolling SF. Update on mitral repair in dilated cardiomyopathy. J Card Surg. 2004 Sep-Oct;19(5):396-400. [ Links ]
17. Dor V. Surgery for left ventricular aneurysm. Curr Opin Cardiol. 1990;5:773-80. [ Links ]
18. Athanasuelas CL, Stanley AWH, Buckberg GD, Dor V, Di Donato M, Blackstone EH, and the RESTORE Group. Surgical anterior ventricular endocardial restoration (SAVER) in the dilated remodeled ventricle following anterior myocardial infarction. J Am Coll Cardiol 2001; 37:1210-1213. [ Links ]
19. Beyersdorf F, Doenst T, Athanasuelas C, Suma H, Buckberg G. The beating open heart rebuilding ventricular geometry during surgical anterior restoration. Semin Thorac Cardiovasc Surg 2001;13:42-51. [ Links ]
20. Batista RJV, Verde J, Nery P, et al. Partial Left ventriculectomy to treta end-stage Herat disease. Ann Thorac Surg 1997;64:634-638. [ Links ]
21. Fontan F. Transplantation of knowledge. J Thorac Cardiovasc Surg 1990;99:387-395. [ Links ]
22. Tector AJ, Amundsen F, Schmahl TM, Kress DC, Downey FX. Total revascularitation with T-graft. Ann Thorac Surg. 1994: 57: 53-59. [ Links ]
23. Athanasuleas C. et al The RESTORE GROUP. Surgical ventricular restoration in the treatment of congestive heart failure due to post-infarction ventricular dilation. J Am Coll Cardiol 2004; 44 (7), 1439-45. [ Links ]
24. Cwajg JM, Cwajg E, Nagueh SF, et al. End-diastolic wall thickness as a predictor of recovery of function in myocardial hybernation. Relation to rest-redistribution Tl-201 tomography and dobutamine stress echocardiography. J Am Coll Cardiol 2000;35:1152-1161. [ Links ]
25. Torsten Doenst et al. To STICH or not to STICH: We know the answer, but do we understand the question? J Thorac Cardiovasc Surg 2005; 129: 246-9. [ Links ]














