Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.2 no.2 Ciudad Autónoma de Buenos Aires abr./jun. 2007
ACTUALIZACIÓN
Asistencia circulatoria mecánica
Parte I
Oscar Mugianesi*
*Médico cardiólogo y terapista del Servicio de Cirugía Cardiovascular. Coordinador del Área de Recuperación de Cirugía Cardiovascular y Trasplantes Intratorácicos. Hospital Italiano de Mendoza. Prov. de Mendoza. Rep. Argentina.
Correspondencia: Dr. Oscar Mugianesi
Ramponi 6293 Barrio Santa Ana
5521 - Mendoza, República Argentina.
Trabajo recibido: 15/12/2006
Trabajo aprobado: 20/03/2007
TABLA DE ABREVIATURAS
IC: Insuficiencia cardíaca.
TxC: Trasplante cardíaco.
ACM: Asistencia circulatoria mecánica.
DAVI: Dispositivo de asistencia ventricular izquierda.
DAV: Dispositivo de asistencia ventricular.
ECMO: Oxigenación con membrana extracorpórea.
CEC: Circulación extracorpórea.
VD: Ventrículo derecho.
VI: Ventrículo izquierdo.
AV: Aurículo-ventricular.
FE: Fracción de eyección.
AI: Aurícula izquierda.
RVP: Resistencia vascular pulmonar.
IAM: Infarto agudo de miocardio.
DABV: Dispositivo de asistencia biventricular.
DAVD: Dispositivo de asistencia ventricular derecha.
CF: Clase funcional.
FR: Función renal.
HTP: Hipertensión pulmonar.
CAT: Corazón artifificial total.
DFDVI: Diámetro de fin de diástole del ventrículo izquierdo.
VMC = Volumen minuto cardíaco.
TA = Tensión arterial.
ON = Oxido nítrico.
ET1 = Endotelina.
AP = Arteria pulmonar.
PCP = Presión capilar pulmonar.
RPT = Resistencia periférica total.
UW = Unidades wod.
ACT = Tiempo de coagulación activado.
BCIP = Balón de contrapulsación intrapulmonar.
RHA = Ruidos hidroaéreos.
HAD = Hormona antidiurética.
SRIS = Síndrome de respuesta inflamatoria sistémica.
rpm = Revoluciones por minuto.
AD = Aurícula derecha.
NPS = Nitropusiato de sodio.
TAM = Tensión arterial media.
GC = Gasto cardíaco.
ARM = Asistencia respiratoria mecánica.
ECG = electrocardiograma.
DAVP = Dispositivo de asistencia ventricular paracorpóreo.
Ac = Anticuerpos.
ACV = Accidente cerebrovascular
TCI = Termo Cardiosystems implantable
VE = Vented electric model
FMO = Falla multiorgánica.
Introducción
La insuficiencia cardíaca (IC) es una entidad que se expande en la población con una pobre sobrevida y calidad de vida a pesar del tratamiento médico, determinando un incremento en el número de pacientes en lista de espera para trasplante cardíaco (TxC). Esta necesidad apremiante sumada a una disminución en el número de donantes (aproximadamente 2300/año), ha hecho que la asistencia circulatoria mecánica (ACM) sea aceptada como una opción terapéutica, debiendo determinar si vamos a emplear dispositivos de flujo pulsátil o continuo, soporte univentricular, biventricular o terapia de reemplazo y si vamos a hacer puente hacia la recuperación ventricular, hacia el TxC o terapia de destino.
El primer puente al TxC con un dispositivo de asistencia ventricular izquierda (DAVI) se hizo hace más de 21 años. El avance tecnológico en los últimos 15 años ha permitido desarrollar diversos dispositivos que varían en tamaño, calidad de soporte, mecanismo de funcionamiento y ubicación; de modo que si contamos con diferentes dispositivos, podremos recomendar para ser empleado por corto tiempo un sistema relativamente simple de ubicación extracorpóreo como la bomba centrífuga, la oxigenación con membrana extracorpórea (ECMO) o Abiomed 5000, que permiten superar la situación de crisis y estabilizar hemodinámicamente al paciente permitiendo retirar el sistema de soporte cuando la función miocárdica se ha restablecido.
Si esto no es posible y no hay contraindicación para el TxC, el paciente puede beneficiarse con un dispositivo de ACM más complejo que le sirva como puente al trasplante. Así, el Thoratec DAV y Medos HIA-DAV son sistemas de ubicación paracorpóreo que se pueden emplear preferentemente para soporte por tiempo moderado.
Un 80% de los casos se mantienen libres de complicaciones a los 4 meses y la sobrevida de los pacientes trasplantados es del 58% a los 5 años.
Finalmente, el Novacor DAVI y HeartMate son dispositivos parcialmente implantables usados para asistencia ventricular por tiempo prolongado en pacientes que no requieren asistencia biventricular.
La ventaja de los sistemas implantables es que permiten dar de alta al paciente con el soporte, siendo la sobrevida con el HeartMate como terapia de destino del 90% a los 30 días y 60% al año.
Asimismo, han surgido dispositivos con flujo axial, confiables, fáciles para implantar y remover, como el Jarvik 2000 que optimiza la hemodinamia del paciente, funcionando sinérgicamente con el ventrículo nativo incrementando el gasto cardíaco (GC), disminuyendo la presión capilar pulmonar (PCP) y la resistencia periférica total (RPT), pudiendo llegar a suspender las drogas inotrópicas constituyendo una alternativa terapéutica al TxC.
El mejor conocimiento acerca del manejo de estos dispositivos, así como de la selección de candidatos y el momento de implantarlos, hace que las indicaciones de la ACM sean precisas dentro del grupo de pacientes que presentan una IC severa de cualquier etiología, permitiendo manejar situaciones de extrema gravedad y urgencia como un paro cardíaco, infarto agudo de miocardio (IAM) con shock cardiogénico, sobredosis de drogas, miocarditis aguda, falla cardíaca postoperatoria y fallo agudo del ventrículo derecho (VD) postrasplante.
Recientemente, la miniaturización de las fuentes de poder y los controladores de los dispositivos para asistencia del ventrículo izquierdo (VI) han posibilitado que sean más confortables para el paciente, permitiendo aumentar las indicaciones para su empleo por tiempo prologado en pacientes ambulatorios.
El advenimiento de las distintas alternativas de ACM, como parte del arsenal terapéutico con que contamos para el tratamiento de la IC terminal, ha permitido mejorar la sobrevida, capacidad funcional y la calidad de vida de estos pacientes, comparados con aquellos que sólo reciben tratamiento médico óptimo; si bien, desde el punto de vista costo/beneficio no serían eficaces1-4,14,39-41,51,77,78,81,89,93,99,102,112,131,134,141,166,208.
Indicaciones
Los dispositivos de asistencia ventricular (DAV) se deben emplear precozmente en pacientes con deterioro hemodinámico sin respuesta al tratamiento médico completo para facilitar la recuperación miocárdica, descomprimiendo el ventrículo distendido y antes de que la falla multiorgánica (FMO) sea irreversible. Aun en aquellos centros que no hacen TxC, para poder manejar al paciente adecuadamente y derivarlo a centros de mayor complejidad para ser trasplantados o asistidos hasta que se recupere el miocardio afectado, constituyendo una alternativa terapéutica útil como puente al TxC, como puente a la recuperación ventricular o como terapia de destino7,14,40,51,95-99,108,131,134,141,148,151,153.
En EEUU, sólo están autorizados el Thoratec, el Novacor y el HeartMate, existiendo muchos otros en diferente estados de experimentación, como el Cardio West CAT, el Abio Cor, el Lion Heart, el DeBakey y el HeartMate II, de los cuales se sabe muy poco.
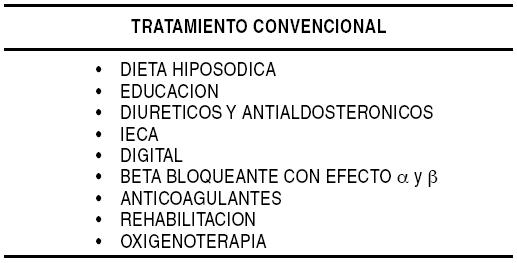
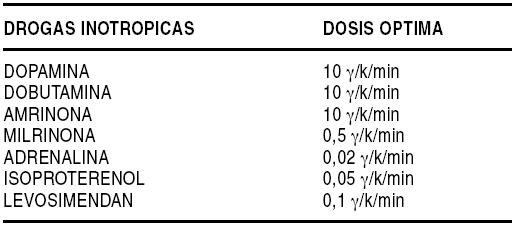
El empleo de la ACM aumenta la chance de sobrevida, permitiendo estabilizar pacientes con severo deterioro de la reserva funcional miocárdica o shock cardiogénico postinfarto, como así también, aquellos pacientes postrasplante con disfunción del injerto o sometidos a cirugía cardíaca para corregir una cardiopatía isquémica, una valvulopatía o una cardiopatía congénita, pero que luego no pueden ser separados de la circulación extracorpórea (CEC) o bien presentan una severa falla cardíaca o cardiopulmonar y no responden al tratamiento convencional instaurado (Gráfico 1), a pesar de tener optimizadas la pre y postcarga (Gráfico 2). Son pacientes que están recibiendo dos o más drogas inotrópicas a dosis óptima (Gráfico 3), reúnen ciertos criterios hemodinámicos (Gráfico 4) y han fracasado otras alternativas terapéuticas como:
Hemofiltración. Permite compensar al paciente con IC, descompensado por sobrecarga de volumen, ya que disminuye la precarga del VD y su dilatación con lo que mejora la función del mismo, la clase funcional (CF) y la función renal (FR)202. Esta mejoría es sostenida y se puede comprobar hasta 30 días post ultrafiltración, por una sostenida reducción de peso de paciente o bien por medio de un eco-Doppler cardíaco que muestra una disminución de la presión de fin de diástole ventricular izquierda (PFDVI), del volumen de la aurícula izquierda (AI), de la presión pulmonar sistólica y diastólica y una mejoría importante en el volumen sistólico y regurgitación mitral.
Resincronizador. Util en pacientes con IC CF III-IV que se acompaña de bloqueo aurículo-ventricular (AV) de primer grado, bloqueo completo de rama izquierda, QRS > de 130 mseg y ecocardiograma que nos permite evidenciar asincronía de la contracción ventricular.
Desfibrilador implantable. Util para el control de arritmias ventriculares en pacientes con miocardiopatía isquémica, hipertrófica o chagásica. Junto con el resincronizador, ya sea asociado o no, sirve como puente al TxC, pues reduce el número de eventos (muerte súbita o requerimiento de DAV) comparado con el tratamiento médico solo, permitiendo que los pacientes lleguen al mismo en mejores condiciones, e incluso en algunos casos se logra una mejoría de la CF de tal magnitud que permite sacar al paciente de la lista de espera203.
Restauración ventricular. Es un procedimiento quirúrgico que se emplea en pacientes con miocardiopatía dilatada idiopática con una fracción de eyección (FE) > del 20%. Este procedimiento se basa en remodelar el VI, sacando las zonas aquinéticas204.
Los potenciales candidatos a recibir ACM pueden ser agrupados en:
1- Pacientes con insuficiencia cardíaca severa
Pacientes con IC en CF III-IV de cualquier etiología, los cuales tienen una alta mortalidad a los 5 años a pesar del tratamiento médico, siendo el TxC la alternativa de elección; aunque alrededor de un 20% de los candidatos a TxC mueren en lista de espera por la falta de donación de órganos. Además el TxC tiene ciertas limitaciones1-5,9,11,13,14,29,38-40,50,78,98,108,112,141,155,161,162,208.
Cuando estos pacientes se descompensan y se tornan refractarios al tratamiento, los DAVI como puente al TxC constituyen un avance que permite incrementar temporariamente el flujo sanguíneo a los distintos órganos de la economía, permitiendo al paciente esperar hasta que se disponga de un donante.
Al comienzo, sólo se podía asistir al paciente por unos meses, siendo el primer corazón artificial que se implantó el Jarvik 7, en 1982, con poco éxito; ya que el paciente tuvo mala calidad de vida y muchas complicaciones.
El desarrollo tecnológico ha permitido en la actualidad contar con dispositivos totalmente implantables, que poseen una batería interna recargable desde el exterior y que le permite al paciente deambular y retirarse a su domicilio.
En efecto, la reducción en el número de donantes y el rápido avance tecnológico explica por qué un número cada vez mayor de pacientes requerirá soporte con un DAVI para sobrevivir, cuando se deteriore su estado clínico y mientras se encuentra en lista de espera.
La pregunta que surge es: ¿estos pacientes deberán ser trasplantados?
Y de ser así: ¿con qué prioridad y cuándo?
Por otro lado, si no se deben trasplantar: ¿cuál sería la alternativa?
La sobrevida de los pacientes que reciben un DAVI cuando son trasplantados es tan buena como la de aquellos con un TxC convencional. Un pequeño número de pacientes (5-20%) con miocardiopatía dilatada puede mostrar una mejoría suficiente de la función ventricular como para permitir retirar el DAVI.
Los pacientes con DAVI implantable como terapia de destino tienen una sobrevida superior a la de aquellos con tratamiento médico y semejante a los trasplantados, favorecido por una menor incidencia de arritmias y fenómenos tromboembólicos a pesar de no emplear anticoagulantes.
Los resultados tempranos sugieren que los pequeños dispositivos de flujo continuo (Impeller pump) están asociados a menor índice de infección y fallo del dispositivo, pero presentan más fenómenos de tromboembolismo y hemorragia.
2- Pacientes sometidos a cirugía cardíaca
Aproximadamente un 1% de los pacientes sometidos a cirugía a corazón abierto para revascularización coronaria, reemplazo valvular o corrección de una cardiopatía congénita, no pueden ser separados de la CEC a pesar de estar totalmente revascularizados o de tener corregida la causa que determinó la cirugía, o de presentar una adecuada pre y post carga, o un adecuado soporte inotrópico, o el medio interno corregido y estar asistidos con balón de contrapulsación intra aórtico1,2,5,12-15,29,30,35-40,84,141.
En estos pacientes sería de primera elección para iniciar el soporte circulatorio mecánico el empleo del ECMO, tomando la sangre desde la AI para controlar así la distensión del VI y el edema agudo pulmonar si lo hubiera y una vez que el VD haya recuperado su función, se podrá proceder a retirar el ECMO; el cual no se puede emplear por tiempo prolongado, debido a la alta incidencia de complicaciones. Si se considera necesario continuar asistiendo al paciente por la disfunción del VI, sería razonable pasarlo a un DAVI como puente al TxC o hasta que recupera la hemodinamia, pero ya con menor riesgo de desarrollar fallo agudo del VD y/o requerir asistencia biventricular.
3- Pacientes sometidos a trasplante cardíaco
Los pacientes sometidos a TxC y que presentan fallo primario del ingerto y/o disfunción severa del VD, habiendo fracasado las medidas clásicas para reducir la resistencia vascular pulmonar (RVP) y mejorar las condiciones hemodinámicas y el flujo sanguíneo pulmonar, se verán beneficiados por el empleo de DAV1,12-14,27,28,33,35,83,141,142,211.
La falla aguda y refractaria del VD es poco frecuente y tiene alta mortalidad, obteniendo mejor sobrevida con menos complicaciones si los pacientes son asistidos con un dispositivo de asistencia ventricular derecha (DAVD) que con ECMO.
El factor de riesgo más importante para su aparición es la hipertensión pulmonar (HTP) del receptor. Su incidencia es del 2-3% después de un TxC.
Un alto porcentaje de pacientes puede ser separado de la asistencia, otros mueren por FMO y otros deben ser retrasplantados, pero con una alta mortalidad.
4- Pacientes con infarto agudo de miocardio
Los pacientes que sufren un IAM pueden evolucionar con un rápido deterioro hemodinámico y síndrome de bajo volumen minuto (SBVM) y/o shock cardiogénico, con una alta mortalidad con tratamiento médico1,2,6-10,13,151-153,184. En estos pacientes, es útil el empleo de ACM con un DAVI cuando el cuadro es debido a una falla del VI, logrando una sobrevida del 54%, pero si la falla es biventricular se deberán asistir ambos ventrículos (DABV) para estabilizar al paciente y si fuera necesario esperar hasta el TxC, con una sobrevida del 71% el primer y segundo año postrasplante y del 54% a los 5 años.
Los pacientes con IAM y comunicación interventricular que fueron asistidos con un DAVI y sometidos a cirugía reparadora, sufrieron ruptura del septum, en otros sectores produciéndose un importante shunt de derecha a izquierda con hipoxia severa y daño neurológico.
El advenimiento de sistemas de soporte permanente puede obviar la necesidad de TxC.
5- Pacientes que presentan arritmias refractarias al tratamiento durante la CEC
Ya sean por miocardiopatía dilatada, hipertrófica o chagásica, o bien aquellos pacientes que padecen una arritmia ventricular sostenida (taquicardia/fibrilación ventricular) durante la CEC y que no responden al tratamiento con antiarrítmicos, encuentran en la ACM una posibilidad que permite retirarlos de la CEC, o bien puede servir como puente para colocar un cardiodesfibrilador implantable o someterlo a TxC81,88,154,158. Debemos tener presente que en los pacientes con arritmia conviene emplear asistencia biventricular, la cual si bien no previene las arritmias, evita la muerte del paciente y simplifica su manejo, pues continúa soportándolo y manteniéndolo con vida a pesar de estar con una fibrilación ventricular o en asistolia.
Objetivo
En líneas generales con la ACM se pretende mejorar la calidad de vida, la capacidad funcional y la sobrevida del paciente que presenta una IC terminal CF IV, manteniendo los siguientes parámetros vitales1-3,13,29,55,56,63,115,121,131,166:
- Un índice cardíaco ≥ 2,2 L/min/m2.
- Presión de AI entre 10-15 mm Hg.
- Presión arterial media ≥ de 75 mm Hg.
- Un soporte inotrópico reducido o suspendido para disminuir el consumo de oxígeno miocárdico.
Criterios de exclusión para la ACM
Los criterios de exclusión para someter a un paciente a ACM son:
- Enfermedad vascular periférica severa.
- Enfermedad cerebrovascular sintomática.
- Cáncer con metástasis.
- Enfermedad hepática severa.
- Alteraciones de la coagulación.
- Infecciones severas y resistentes.
- Insuficiencia renal con uremia > de 100 mg% y/o creatininemia > de 5 mg%.
Si no es candidato a trasplante: este criterio ya ha sido desestimado puesto que hay algunos dispositivos de asistencia (DAV) que se pueden usar como asistencia crónica o permanente.
Métodos empleados
La ACM se puede hacer con bombas centrífugas, de flujo axial o neumáticas, las cuales pueden ser implantables, como el Novacor, HeartMate I VE o paracorpóreas35,38-40,75,77-80,112,132.
Además, puede servir como soporte o como reemplazo ventricular y según el número de ventrículos asistidos puede ser uni o biventricular. Si se intercala un oxigenador de membrana se hace oxigenación con membrana extracorpórea (ECMO).
A su vez contamos con dispositivos para hacer:
Soporte de la circulación sistémica
Balón de contrapulsación.
DAVI (left ventricular assist device) que asiste al VI, drenando sangre de la aurícula o el VI y la retorna a la aorta.
Un correcto llenado y funcionamiento del VD son esenciales para mantener un adecuado flujo del DAVI, lo que asegura una buena sobrevida y recuperación del paciente, la cual puede verse afectada por trastornos de conducción como un bloqueo AV completo que requerirá de la colocación de un marcapasos132.
Soporte de la circulación pulmonar
DAVD (right ventricular assist device) que asiste al VD, drenando sangre de la aurícula o el VD y la retorna a la arteria pulmonar (AP).
Soporte biventricular o asistencia circulatoria total81,88,162
CAT (total artificial heart) que apoya ambas circulaciones.
Si bien no está bien establecido cuándo debemos emplear DAVI o DABV, podemos concluir que esta última se debe emplear siempre que el paciente sea un buen candidato para TxC, basándonos en los requerimientos hemodinámicos del mismo e indicándola cuando presentan una severa falla biventricular y/o arritmias cardíacas potencialmente letales, ya que aunque no previene las arritmias, sí evita la muerte del paciente y simplifica su manejo, pues continua soportándolo y manteniéndolo con vida a pesar de estar con una fibrilación ventricular o en asistolia.
Fuera de estas situaciones la asistencia univentricular tiene la misma sobrevida que la biventricular (Figura 1).
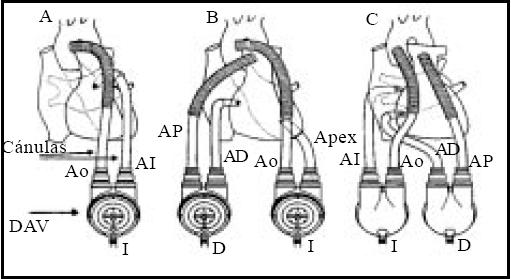
Figura 1. Dispositivo de Asistencia Ventricular (DAV).
Conducta
Una vez alcanzado el soporte circulatorio óptimo, empleando alguno de los dispositivos de ACM, trataremos de reducir o discontinuar los inotrópicos para disminuir el consumo de oxígeno miocárdico.
En efecto, las catecolaminas y los inhibidores de la fosfodiesterasa, aumentan el nivel del AMPc y la entrada de Ca++ al intracelular, ocacionando, frecuentemente, taquicardia u otras arritmias, aumento del consumo de oxígeno, taquifilaxia y daño miocítico directo, por lo cual es importante restringir su uso en estos pacientes; ya que si bien pueden contribuir a su compensacion, podrían ocacionar más daño miocárdico y agravar la miocardiopatía previa, aumentando los índices de reinternación.
Alternativas evolutivas del paciente en ACM
Una vez puesto el paciente en ACM, puede evolucionar de acuerdo a tres alternativas:
1- Recuperación de la función ventricular
Un bajo porcentaje de pacientes (1-2% de los casos) recupera la función ventricular, especialmente cuando son portadores de una miocardiopatía dilatada idiopática, presentan una FE > del 40%, un diámetro de fin de diástole del ventrículo izquierdo (DFDVI) < de 55 mm y/o indicación de resincronizador1-5,13,21,22,41,42,78,80,98,101,104,107,110-114,141.
Los pacientes con mayores posibilidades de recuperación son los que tienen menos fibrosis miocárdica.
El soporte circulatorio se deberá mantener hasta que el paciente recupere la función ventricular (promedio 1 mes), la cual se evaluará cada 48 hs, siendo el ecocardiograma transesofágico el mejor método. Cuando consideramos que se ha recuperado, deberemos asegurarnos que podrá mantener esa función antes de plantearnos retirar el dispositivo, utilizándose dos protocolos. Uno consiste en reducir la frecuencia del dispositivo, determinando un aumento transitorio de la carga ventricular por las variaciones que produce el dispositivo latido a latido; y otro, el más empleado, consiste en reducir el volumen que eyecta el dispositivo, determinando un incremento de la carga de volumen y presión del VI. Empleando este protocolo el weaning (retirada del dispositivo) se iniciará reduciendo gradualmente el flujo, a razón de un 25% cada 6 hs, monitorizando estrechamente el GC, las presiones de llenado y la tensión arterial (TA), agregando o incrementando el soporte inotrópico si fuera necesario. Una vez alcanzado un flujo de soporte de 1 L/min, si el paciente se mantiene estable durante 12 hs, se podrá remover el sistema de asistencia mecánica empleado.
La arritmia ventricular no es un predictor de sobrevida en el paciente que espera una recuperación miocárdica, siendo la sobrevida de los mismos a los 5 años del 80%. De estos pacientes, el 65% tienen una mejoría sostenida y el 35% restante presentan recurrencias de fallo de bomba y muchos de estos últimos son sometidos a TxC.
Los mecanismos por los que la asistencia circulatoria permite obtener este resultado son variados:
a- Descarga el ventrículo asistido con lo que reduce la presión de fin de diástole, lo que constituye el factor más importante para preservar la función miocárdica.
b- Reduce la carga y el trabajo ventricular al disminuir la tensión de la pared, con lo que disminuye el requerimiento metabólico del miocardio, reduciendo el consumo de oxígeno y por lo tanto el flujo sanguíneo requerido (pero no aumenta la perfusión miocárdica), mejorando la contractilidad y la función miocárdica.
c- Mejora el metabolismo mitocondrial a nivel miocítico.
d- Mejora el metabolismo endotelial aumentando el nivel de óxido nítrico (ON) y reduciendo el nivel de endotelina 1 (ET 1).
e- Permite que el septum interventricular se desplace hacia la izquierda, aumentando la compliance diastólica del VD. En efecto, cuando se coloca un DAVI para descargar un VI dañado el septum interventricular se desplaza hacia la izquierda, alterándose la geometría y perfomance del VD de modo que cada 10 mm Hg que cae la presión dentro del VI respecto del VD resulta en un 2% de reducción de la dimensión del VI y 2% de incremento en el VD.
f- Si la RVP es normal, al disminuir la PFDVI, disminuye la presión de la AI, y de la AP, disminuyendo la postcarga del VD.
g- Disminuye el factor natriurético atrial y cerebral originados en los miocitos, células endoteliales y fibroblastos, a nivel auricular el primero y a nivel ventricular el segundo, al dilatarse dichas cavidades.
h-Mejora el consumo máximo de oxígeno (VO2 máx.), favoreciendo la recuperación funcional de los órganos afectados.
i- Reduce la producción de fibrosis miocárdica mientras dura la asistencia.
j- Mejora la actividad del sistema nervioso simpático a nivel miocárdico.
k- Regenera fibra miocárdica (miocardio resucitado), si bien la recuperación no seria definitiva y el miocardio se vuelve a deteriorar.
Todos estos efectos jugarían un rol importante para frenar y revertir el remodelamiento del VI.
2- Bridge para tomar una decisión terapéutica
La asistencia mecánica en algunos casos (2-3%) permite que pacientes con SBVM de cualquier etiología puedan sobrevivir más y mejor, manteniendo un aceptable funcionamiento del resto de sus órganos, permitiéndonos ganar tiempo para1,2,13,15,27,28:
- Pensar en otra alternativa terapéutica (evaluar la evolución del tratamiento convencional, hacer hemofiltración, resincronización o cirugía).
- Hacer un puente para recuperar la hemodinamia.
- Hacer un puente al trasplante, esperando que aparezca un donante.
- Hacer un puente hacia la asistencia mecánica crónica como tratamiento definitivo.
Estas formas agudas de ACM se pueden mantener desde unas horas con ECMO hasta 1 semana con una bomba centrífuga.
3- Bridge para trasplante
La ACM permite en muchos casos (80-90%) que los pacientes con SBVM de cualquier etiología puedan sobrevivir, manteniendo un aceptable funcionamiento del resto de sus órganos, mientras se recupera la función miocárdica y pensamos en una alternativa terapéutica o bien aparece un donante1-4,6,7,13,21,22,40,42,45,46,98,119,121,135,140,141,168,169. Permitiéndonos mejorar la sobrevida de estos pacientes antes y después del trasplante, comparados con aquellos que reciben una infusión continua de catecolaminas, equiparándose a la de aquellos con IC compensada, ya que la asistencia mecánica permite mejorar la CF, llevándola a una CF I-II de la NYHA (New York Heart Association), reducir el soporte inotrópico e incluso suspenderlo, reducir la PCP y la RPT mejorando la perfusión y función de órganos vitales, especialmente hígado y riñón afectados por el hipoflujo, mejorar la masa muscular y el estado nutricional haciendo al paciente menos susceptible a las infecciones.
Asimismo la ACM con dispositivos de soporte del VI (DAVI) constituye una alternativa eficaz con un riesgo aceptable para tratar la HTP severa, con rango de 4,4 a 6,5 unidades wod (UW) que se observa en pacientes con IC terminal y que determina mayor morbi-mortalidad en el TxC ortotópico.
Además la ACM permite, en algunos casos, que el paciente pueda estar fuera del área crítica y aún del hospital reduciendo la frecuencia de internación, sus complicaciones y sus costos.
Este tipo de asistencia mecánica ventricular se puede mantener desde 1 semana hasta 1 mes.
4- Tratamiento crónico o terapia de destino
Cada vez es mayor el número de pacientes con IC terminal por miocardiopatía dilatada y/o isquémica (5-10%) que son incluidos en un programa de ACM crónica prolongada como tratamiento definitivo, debido al reducido número de donantes y al incremento de los dispositivos de asistencia destinados a esta terapia1-4,9,13,21,22,40-43,46,53,55,78,91,95,98,102,120,122,124,129,134,169,205,208,209.
Este tipo de asistencia se mantiene por más de 1 mes y en muchos casos ha superado el año de duración, con una sobrevida del 85% al año, 75% a los 2 años, 65% a los 3 años y 55% a los 4 años; siendo superior en pacientes con soporte implantable que paracorpóreo y en los centros que más dispositivos colocan.
El avance en el empleo del DAVI como terapia de destino ha determinado la necesidad de mejorar la selección de pacientes que van a ser sometidos a este tratamiento para obtener mejores resultados, teniendo en cuenta que la desnutrición, la edad, trombocitopenia y requerimiento de otros procedimientos en el momento del implante del dispositivo, aumentan la mortalidad al año.
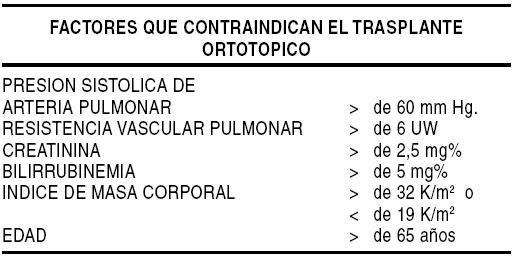
Está especialmente indicado en pacientes > de 65 años que no son aptos para trasplante o tienen alguna contraindicación relativa para TxC ortotópico (Gráfico 5). Asimismo aquellos pacientes con IC terminal e HTP severa que no responden al tratamiento médico y por lo tanto no son candidatos para TxC ortotópico, se han visto beneficiados con el empleo de un DAVI (HeartMate, Novacor, Jarvik 2000, AbioCor CAT) que descargue en forma crónica el VI, más si tienen asociado a lo anterior una elevada presión de la AI, lo que puede revertir la RVP elevada permitiendo el TxC ortotópico (3-11 meses post asistencia). Estos pacientes pueden permanecer, en muchos casos, en su domicilio hasta el trasplante.
En este grupo de pacientes, se debe hacer soporte psiquiátrico y entrenar al paciente y la familia en el manejo del sistema y en la detección precoz de las complicaciones y síntomas por mal funcionamiento ya que puede ser necesario reemplazar la bomba por mal funcionamiento de la misma o por haber llegado al final de su vida útil. Esto le otorga mayor independencia al enfermo que es derivado a su domicilio.
Muchos de estos pacientes logran cierto grado de recuperación durante los primeros 8 meses, siendo máximo durante los 4 primeros. Recuperan fundamentalmente la FR con disminución de la creatinina y mejoran el VO2 máximo.
Los pacientes que mejoran pueden pasar al grupo de bridge para trasplante si son aptos o bien, permanecer junto a los que no mejoran, en terapia permanente.
Complicaciones de la ACM
Su incidencia es menor en los centros más experimentados125. Los pacientes diabéticos tienen mayor riesgo de mortalidad después de implantar un DAVI130.
Las complicaciones mas frecuentes son:
1- Hemorragia. Es una complicación muy frecuente (22-35%), ya sea por problemas de técnica quirúrgica, incorrecto cierre de las cánulas, uso de anticoagulantes o desarrollo de coagulopatias4,6,7,9,11,89,93,102,121,128,137. El papel de la activación plaquetaria no está bien conocido.
Requieren reoperación en un 25% de los casos, por lo tanto el centro debe contar con un equipo quirúrgico stand by.
2- Infección. Sigue siendo la principal causa de muerte en pacientes con miocardiopatía terminal sometidos a ACM, alcanzando una frecuencia mayor del 40%; si bien, una mejor selección de pacientes para recibir un dispositivo de asistencia ventricular, sumado a un mejor manejo de los pacientes y a una mayor durabilidad y mejor diseño de los sistemas, ha determinado una disminución en la frecuencia de infecciones relacionadas con el dispositivo4,7,9,11,13,86,89,92,102,121,137,197,198. La incidencia es similar con cualquier tipo de dispositivo de ACM, tanto en asistencia univentricular como total. Sin embargo cuando se emplean sistemas paracorpóreos o parcialmente implantables que requieren líneas de funcionamiento transcutáneas, las infecciones asociadas al dispositivo son comunes y severas, incrementándose su frecuencia con la duración de la asistencia; pero no contraindican el TxC.
Los gérmenes más frecuentes en pacientes ambulatorios son el Stafilococcus Aureus y el Streptococcus Viridans.
En los pacientes sometidos a ACM se ha descrito un déficit en la inmunidad celular e hipogamma globulinemia (< de 700 mg%), que favorecería la mayor incidencia de infección tanto en el:
- Pretrasplante, pudiendo asentar a nivel torácico, abdominal, bolsillo de las cánulas o flebitis.
- Postrasplante, producida por citomegalovirus.
La infección en el trayecto de las líneas de funcionamiento suele ser de bajo riesgo y raramente progresa a mediastinitis.
Las medidas adoptadas para prevenir la infección son el uso profiláctico de antibióticos y antifúngicos, mantenimiento de las cánulas bien adheridas a la piel, lavado de los sitios donde hay cánulas percutáneas con solución fisiológica y reemplazo de las gammaglobulinas.
3- Fenómenos tromboembólicos. En la IC y en la ACM aumentan los factores procoagulantes, favoreciendo la producción de eventos embólicos a nivel sistémico o cerebral, debido a la formación de trombos dentro de los dispositivos o alrededor de las cánulas y válvulas protésicas, situación que se agrava por la activación plaquetaria y la alteración de las propiedades mecánicas de las células sanguíneas determinadas por la asistencia mecánica. Esto se trata de evitar o prevenir mejorando los dispositivos de asistencia así como la superficie interna del DAV4,9,19,31,32,55,102,128,133,185,195.
Sin embargo, el riesgo real disminuye anticoagulando al paciente con:
- Heparina: en dosis de 2-5 U/kg/h, comenzando entre los días 1-3 del postoperatorio, cuando los tubos de drenaje dan menos de 30 cc/h durante 4 hs, manteniendo el tiempo de coagulación activado (ACT) en 180-200 segundos.
- Aspirina: en dosis de 50mg/día, entre los días 1-3 del postoperatorio si el recuento de plaquetas es ≥ 50.000-70.000 y el debito por los tubos de drenaje es < de 30 cc/h durante 4 hs, aumentando a 325 mg/día de aspirina o 75 mg de clopidogrel, con plaquetas ≥ 250.000/día.
Si no puede ingerir por VO podemos emplear tirofiban EV ajustando la dosis según el peso.
- Warfarina: se emplea para reemplazar la heparina, comenzando entre los días 7-14 del postoperatorio, en dosis de 2 mg/día, una vez que el paciente ha recuperado la función hepática y renal.
Se debe hacer control de coagulación con determinación de KPTT, protrombina (RIN 1,5-2) y recuento de plaquetas.
4- Embolia gaseosa.
5- Trastornos neurológicos. Se producen en el 7-28% de los casos.
Un efecto colateral indeseable producido por el empleo de un DAVI es el síndrome de hiperperfusión cerebral, el cual tiene alta mortalidad8,89,93,102,121,137,212. Fue descrito en pacientes con hipoperfusión cerebral crónica en quienes se restableció la normal circulación cerebral después de una endarterectomía carotídea. El mismo efecto se produce después de implantar un DAVI, si se emplea de entrada un CO > del 50% del basal en lugar de ajustarlo lenta y progresivamente tratando de no superar el 50 % del valor inicial, ya que sino se superaría la capacidad de autorregulación del flujo cerebral, produciéndose dentro de los 30 días trastornos transitorios o definitivos, caracterizados por alteración de la conciencia que puede llegar al coma, déficits neurológicos de origen central, los cuales pueden retrogradar si se reduce el CO del DAVI.
6- Fallo hepático. Se presenta en el 11-20% de los casos. La hiperbilirrubinemia es una complicación frecuente del DAVI y está relacionada con un mala perfusión del hígado por un bajo GC en las primeras 24 horas post implante89,93,102,136. Es máxima a los 3-7 días.
7- Falla multiorgánica102,176.
8- Falla de ventrículo derecho. En un 15-25% de los casos, el empleo de DAVI se puede complicar con la aparición de una claudicación aguda del VD o agravamiento de una alteración previa7,9,10-14,48,49,89,93,102,163-165. Esto se debe a que la asistencia del VI produce un aumento de la precarga del VD al aumentar el retorno venoso, un aumento de la postcarga y del volumen del VD; especialmente, si la RVP se encuentra elevada y aumentamos la presión en la AP y una disminución de la contractilidad del VD al disminuir el desplazamiento septal sistólico hacia la derecha durante el vaciado del VI.
Si embargo, la falla aguda refractaria del VD es poco frecuente, actuando como factores de riesgo para su aparición: la isquemia severa del VD, la HTP y un balance intraventricular alterado como sucede en pacientes con DAVI. Su incidencia es del 0,04-0,1% en pacientes postpericardiotomía, del 2-3% después de un TxC o tromboembolismo de pulmón y de casi un 25% en pacientes que requieren un DAVI. Por ello, es primordial después del implante prevenir o detectar precozmente la falla del VD, así como las infecciones y disfunción del sistema de soporte.
El desarrollo de una falla del VD en pacientes sometidos a DAVI les confiere una significativa morbi-mortalidad, ya que las medidas de soporte, generalmente, se inician tarde o finalizan precozmente. Por lo tanto en estos pacientes, se debe iniciar precozmente un tratamiento intensivo con inotrópicos, vasodilatadores pulmonares (incluyendo la inhalación de ON) y balón de contrapulsación intrapulmonar (BCIP), tendientes a disminuir la resistencia pulmonar y mejorar las condiciones hemodinámicas y el flujo sanguíneo pulmonar. De estos pacientes, un 7-15% no responde al tratamiento convencional y requiere del implante de un dispositivo de asistencia del VD (DAVD) en forma precoz (antes de 24 horas de producida la falla del VD) o tardía (después de transcurridas las 24 horas). La sobrevida de estos pacientes fue evaluada al año, a los 5 y 10 años postrasplante, si bien fue mayor en el grupo que no requirió DAVD, siendo la diferencia no estadísticamente significativa.
9- Arritmia. Después de colocar un DAVI hay un incremento significativo en la aparición de taquicardia ventricular monomorfa, pero no aumenta la incidencia de taquicardia ventricular polimorfa y fibrilación ventricular, no constituyendo un predictor de sobrevida en aquellos pacientes en los que esperamos una recuperación ventricular87,104,107.
10- Obstrucción de la entrada (inflow) de la bomba. Esta entidad se produce por coágulos que se forman en la punta de la cánula.
Dispositivos para la asistencia mecánica
En la actualidad contamos con una importante variedad de dispositivos para asistir al paciente:
1- Balón de contrapulsación intra-aórtico (BCIA).
2- Asistencia mecánica ventricular: bombas de flujo continuo y bombas de flujo pulsátil.
Balón de contrapulsación intra-aórtico
La ACM debe comenzar por los dispositivos más simples, progresando hacia los más complejos, según la respuesta del paciente16,17.
El BCIA es el método de soporte circulatorio temporario más empleado en la actualidad.
Se puede insertar por punción a través de la arteria femoral, quirúrgicamente, en la misma arteria o bien en la arteria ilíaca, subclavia, axilar o por vía transtorácica a través de la aorta ascendente, siendo menor la incidencia de complicaciones vasculares e infección de heridas en este último caso que sise inserta a través de la arteria femoral o ilíaca.
La punta del balón debe quedar posicionada a 3 cm por debajo de la arteria subclavia izquierda, entre el 2do y 3er espacio intercostal izquierdo, controlada por radioscopía o radiografía de tórax.
Tener en cuenta que para obtener contrapulsación, previamente debe haber pulsación o sea que el corazón debe estar latiendo.
Fisiología
El balón de contrapulsación intra-aórtico ejerce su efecto porque al inflarse durante la diástole (contrapulsación) permite aumentar la presión diastólica en la aorta, aumentando así el flujo coronario, siempre que la coronaria no esté obstruida o su lesión no sea crítica. También, permite aumentar el flujo cerebral, reducir la RPT y la postcarga ventricular izquierda, ya que al desinflarse bruscamente antes de que inicie la sístole, deja un espacio vacío en la aorta que permite que la sangre sea eyectada por el VI ante una menor resistencia.
Todos estos efectos descriptos permiten aumentar el GC un 20-40% del valor basal y disminuir el trabajo del VI, ya que disminuye la impedancia aórtica y la tensión de la pared del VI en sístole (postcarga); determinando una disminución del consumo de oxígeno miocárdico.
Indicaciones
Se pueden dividir en:
A- Prequirúrgicas (20% de los casos) en pacientes con:
- Shock cardiogénico.
- Insuficiencia mitral aguda.
- Ruptura del septum interventricular o músculo papilar post-IAM.
- Edema agudo de pulmón.
- IC e isquemia refractaria en paciente con tratamiento completo.
- En forma profiláctica en pacientes con angina inestable y tratamiento completo, previo a ser sometidos a cateterismo, angioplastia o cirugía.
- En forma profiláctica en paciente de alto riesgo para la cirugía de revascularización coronaria.
- Como puente al TxC.
El uso del balón, como el de todo dispositivo de ACM, debe ser precoz para obtener buen resultado en la miocardiopatía isquémica o de cualquier etiología.
B- Quirúrgicas (60% de los casos) en aquellos pacientes que no se pueden separar de la bomba de CEC: a pesar de estar recibiendo tratamiento completo con catecolaminas, tener una adecuada pre y postcarga, haber corregido el medio interno y la afección que determino la cirugía.
C- Postquirúrgicas (20% de los casos) en pacientes que presentan SBVM en el postoperatorio, a pesar de haber optimizado la pre y postcarga y las dosis de catecolaminas. Se produce en el 15% de los pacientes sometidos a CEC, y de éstos el 90% responde bien a las drogas y/o balón de contrapulsación.
Contraindicaciones
Son contraindicaciones absolutas: los pacientes con insuficiencia aórtica, disección de aorta, pacientes que padecen una severa enfermedad aórtica (enfermedad de Marfán, enfermedad quística de la media), pacientes irrecuperables que no pueden ser candidatos a TxC o que tienen incapacidad de generar presiones intraventriculares espontáneas.
Son contraindicaciones relativas: la enfermedad vascular periférica, prótesis valvular aórtica, arritmia supraventricular de alta respuesta ventricular, enfermedad terminal, diátesis hemorrágica o trombocitopenia severa.
Sincronización
El balón se debe sincronizar para que se infle durante la diástole, al producirse el cierre de la válvula aórtica y se desinfle antes del inicio de la sístole y se produzca la apertura de dicha válvula. La sincronización se puede hacer con:
- El electrocardiograma (ECG): inflando al medio de la onda T (fin de la sístole ventricular) y desinflando en el inicio del QRS (fin de la diástole ventricular).
- Onda de presión: permite inflar sobre la onda dícrota (inicio de la diástole ventricular) y desinflar al final de la diástole ventricular.
- Ecocardiograma: que en algunos pacientes, especialmente pediátricos, permite ver simultáneamente la válvula aórtica y el balón, corroborando que esté inflado cuando la válvula aórtica ya se cerró y desinflado antes de que se abra.
Trigger o gatillo
Para disparar el inflado y desinflado del balón se puede emplear:
- El ECG: es el más frecuente, reconociendo el complejo QRS. Si esto no es posible porque tiene un bloqueo de rama izquierda, una fibrilación auricular, extrasístoles supraventriculares o ventriculares frecuentes, se empleará el modo fibrilación auricular o modo pico del ECG, donde el equipo hace un promedio de 5-10 complejos y dispara el inflado, mientras que el desinflado es disparado por el sensado de la onda R.
- Modo marcapaso A o V: se emplea en los pacientes que tienen marcapaso transitorio o definitivo.
- Modo tensión arterial: se emplea cuando no se puede usar el ECG, utilizando la curva de TA.
- Modo internal trigger: es usado cuando no hay latido cardíaco, estando el paciente asistido con bomba centrifuga o de rodillo con flujo continuo.
Frecuencia de inflado
Mientras el paciente requiere asistencia máxima el inflado es 1:1, o sea que cada latido dispara un inflado y desinflado del balón. En la medida que mejora la función ventricular izquierda se va reduciendo progresivamente la frecuencia del inflado a 1:2, o sea que de 2 latidos sólo 1 dispara al balón. Luego si el paciente sigue estable, se reduce a 1:3 - 1:4 ó sea que de cada 3 ó 4 latidos sólo 1 es asistido por el inflado del balón.
Controles
Mientras el paciente está asistido con el BCIA se deben realizar una serie de controles que tienen por finalidad diagnosticar precozmente las complicaciones, las cuales se presentan en un 10% de los casos y están dadas por:
- Disección de aorta torácica o abdominal: se traduce por dolor interescapular o abdominal seguido de mayor deterioro hemodinámico.
- Lesión medular isquémica: se traduce por déficit motor de miembros inferiores (paraplejia).
- Infección: se traduce por temperatura, leucocitosis y cultivos positivos. Hacer control con hemogramas y retrocultivos semanales.
- Ruptura del balón: se caracteriza porque viene sangre por el tubo del balón, lo cual obliga a retirarlo de inmediato.
- Oclusión de la arteria subclavia izquierda por el balón cuando está muy introducido: se traduce por falta de pulso radial izquierdo, dolor y frialdad del miembro superior correspondiente.
- Oclusión u obstrucción de la arteria femoral por donde se introduce el balón: se traduce por disminución de la temperatura y dolor del miembro inferior correspondiente. Controlar pulso, temperatura y hacer Doppler vascular.
- Oclusión de arteria renal: ya sea por desplazamiento del balón o trombosis de la misma. Se traduce por oliguria.
- Infarto intestino-mesentérico: se traduce por dolor y/o distensión abdominal y pérdida de ruidos hidroaéreos (RHA).
Desconexión
Se inicia una vez que el paciente está hemodinámicamente estable con un apoyo inotrópico mínimo, reduciendo la frecuencia del inflado de 1:1 a 1:4, retirando el balón cuando el paciente se mantiene estable por más de 6 horas con una frecuencia del inflado de 1:3 ó menor. Se desconecta con éxito en el 73-88% de los casos.
Mortalidad
La mortalidad de los pacientes asistidos con BCIA es del 50% al mes, producto de embolias múltiples, accidente cerebrovascular o perforación de aorta.
El Cardio DAV129 es un balón de contrapulsación crónicamente implantado en la aorta torácica descendente (Figuras 2.1 y 2.2).
1. Pavie A, Leprince P, Bonnet N, Leger P, Gandjbakhch I. What's new in mechanical circulatory assistance: from clinical indications to material. Arch Mal Coeur Vaiss 2006;99(2):164-70. [ Links ]
2. De Rose JJ Jr., Umana JP, Argenziano M, et al. Implantable left ventricular assist devices provide an excellent outpatient bridge to transplantation and recovery. J Am Coll Cardiol 1997;30(7):1773-7. [ Links ]
3. Park SJ, Tector A, Piccioni W, et al. Left ventricular assist devices as destination therapy: a new look at survival. J Thorac Cardiovasc Surg 2005;129(1):9-17. [ Links ]
4. Birks EJ, Yacoub MH, Banner NR, Khaghani A. The role of bridge to transplantation: should LDAV patients be transplanted? Curr Opin Cardiol 2004;19(2):148-53. [ Links ]
5. Ishino K, Alexi-Meskishvili V, Weng Y, et al. Mechanical circulatory support for post cardiotomy cardiogenic shock in infants. Asaio J 1996;42(5):M735-8. [ Links ]
6. Tatou E, Gomez MC, Leneuf P, et al. Cardiogenic shock complicating extensive infarction with ventricular septal defect. Circulatory assistance and heart transplantation. Arch Mal Coeur Vaiss 2001;94(3):236-40. [ Links ]
7. Hendry PJ, Masters RG, Mussivand TV, et al. Circulatory support for cardiogenic shock due to acute myocardial infarction: a Canadian experience. Can J Cardiol 1999;15(10):1090-4. [ Links ]
8. Kshettry VR, Salerno CT, Bank AJ. Risk of left ventricular assist device as a bridge to heart transplant following postinfarction ventricular septal rupture. J Card Surg 1997;12(2):93-7. [ Links ]
9. Oz MC, Argenziano M, Catanese KA, et al. Bridge experience with long-term implantable left ventricular assist devices. Are they an alternative to transplantation? Circulation 1997;95(7):1844-52. [ Links ]
10. Morgan JA, John R, Lee BJ, Oz MC, Naka Y. Is severe right ventricular failure in left ventricular assist device recipients a risk factor for unsuccessful bridging to transplant and post-transplant mortality. Ann Thorac Surg 2004;77(3):859-63. [ Links ]
11. Dang NC, Topkara VK, Mercando M, et al. Right heart failure after left ventricular assist device implantation in patients with chronic congestive heart failure. J Heart Lung Transplant 2006;25(1):1-6. [ Links ]
12. Kaul TK, Fields BL. Postoperative acute refractory right ventricular failure: incidence, pathogenesis, management and prognosis. Cardiovasc Surg 2000;8(1):1-9. [ Links ]
13. Klodell CT, Staples ED, Aranda JM, Jr., et al. Managing the post-left ventricular assist device patient. Congest Heart Fail 2006;12(1):41-5. [ Links ]
14. Schmid C, Radovancevic B. When should we consider right ventricular support? Thorac Cardiovasc Surg 2002;50(4):204-7. [ Links ]
15. Chen YS, Ko WJ, Lin FY, et al. Preliminary result of an algorithm to select proper ventricular assist devices for high-risk patients with extracorporeal membrane oxygenation support. J Heart Lung Transplant 2001;20(8):850-7. [ Links ]
16. Macoviak J, Stephenson LW, Edmunds LH, Jr., Harken A, MacVaugh H, 3rd. The intraaortic baloon pump: an analysis of five years' experience. Ann Thorac Surg 1980;29(5):451-8. [ Links ]
17. Jafarey AM, Amanullah M, Khan SA, Hasan SB. The use of intra aortic baloon pump in patients undergoing coronary artery bypass grafting at the Aga Khan University Hospital, Karachi. J Pak Med Assoc 2000;50(1):3-7. [ Links ]
18. Von Segesser LK. Cardiopulmonary support and extracorporeal membrane oxygenation for cardiac assist. Ann Thorac Surg 1999;68(2):672-7. [ Links ]
19. Takami Y, Yamane S, Makinouchi K, Glueck J, Nose Y. Mechanical white blood cell damage in rotary blood pumps. Artif Organs 1997;21(2):138-42. [ Links ]
20. Duncan JM, Frazier OH, Radovancevic B, Velebit V. Implantation techniques for the Hemopump. Ann Thorac Surg 1989;48(5):733-5. [ Links ]
21. Siess T, Reul H, Rau G. Concept, realization, and first in vitro testing of an intraarterial microaxial blood pump. Artif Organs 1995;19(7):644-52. [ Links ]
22. Frazier OH, Myers TJ, Westaby S, Gregoric ID. Clinical experience with an implantable, intracardiac, continuous flow circulatory support device: physiologic implications and their relationship to patient selection. Ann Thorac Surg 2004;77(1):133-42. [ Links ]
23. Zink M, ObePCPalder PJ, Gombotz H. Successful temporary left ventricular assistance with the hemopump assist device during acute myocardial infarction after complex mitral valve surgery. Intensive Care Med 2000;26(11):1710. [ Links ]
24. Peterzen B, Lonn U, Babic A, Granfeldt H, Casimir-Ahn H, Rutberg H. Postoperative management of patients with Hemopump support after coronary artery bypass grafting. Ann Thorac Surg 1996; 62(2): 495-500. [ Links ]
25. Mihaljevic T, Leskosek B, von Segesser LK, Tonz M, Turina M. Hemodynamic properties of the hemopump. Helv Chir Acta 1994;60(6):1159-62. [ Links ]
26. Takahama T, Kanai F, Hiraishi M, Onishi K, Yamazaki Z, Suma K, Asano K, Kazama M. Long-term non heparinized left heart bypass (LHB): centrifugal pump or roller pump. Trans Am Soc Artif Intern Organs 1985;31:372-6. [ Links ]
27. Dembitsky WP, Daily PO, Raney AA, Moores WY, Joyo CI. Temporary extracorporeal support of the right ventricle. J Thorac Cardiovasc Surg 1986;91(4):518-25. [ Links ]
28. Gaines WE. Perioperative right heart failure: treatment. Cardiovasc Clin 1987;17(2):231-8. [ Links ]
29. Park SB, Liebler GA, Burkholder JA, et al. Mechanical support of the failing heart. Ann Thorac Surg 1986;42(6):627-31. [ Links ]
30. O'Neill MJ, Jr., Chrostowski AM, Harrison LH, Jr. A rapid method for determining the need for mechanical support of the right ventricle. Ann Thorac Surg 1988;46(1):106-7. [ Links ]
31. Mesana T, Monties JR, Blin D, Goudard A, Mouly-Bandini A, Cornen A. Thromboembolytic complications during circulatory assistance with a centrifugal pump in patients with valvular prostheses. ASAIO Trans 1990;36(3):M525-8. [ Links ]
32. Andersen KS, Nygreen EL, Grong K, Leirvaag B, Holmsen H. Comparison of the centrifugal and roller pump in elective coronary artery bypass surgery-a prospective, randomized study with special emphasis upon platelet activation. Scand Cardiovasc J 2003;37(6):356-62. [ Links ]
33. Reiss N, El-Banayosy A, Mirow N, Minami K, Korfer R. Implantation of the Biomedicus centrifugal pump in post-transplant right heart failure. J Cardiovasc Surg (Torino) 2000;41(5):691-4. [ Links ]
34. Nance JR, Sistino JJ. Heparin-coated adult ECMO vs. ventricular assist devices: a decision analysis modeling approach. J Extra Corpor Technol 2006;38(1):33-7. [ Links ]
35. Hazekamp MG. Mechanical circulatory support after paediatric cardiac surgery. Ned Tijdschr Geneeskd 2006;150(8):413-4. [ Links ]
36. Gow KW, Wulkan ML, Heiss KF, et al. Extracorporeal membrane oxygenation for support of children after hematopoietic stem cell transplantation: the Extracorporeal Life Support Organization experience. J Pediatr Surg 2006;41(4):662-7. [ Links ]
37. Chou NK, Chi NH, Ko WJ, Yu HY, Huang SC, Wang SS, Lin FY, Chu SH, Chen YS. Extracorporeal membrane oxygenation for perioperative cardiac allograft failure. Asaio J. 2006;52(1):100-3. [ Links ]
38. Motomura T, Maeda T, Kawahito S, et al. Extracorporeal membrane oxygenator compatible with centrifugal blood pumps. Artif Organs 2002;26(11):952-8. [ Links ]
39. Steines D, Westphal D, Gobel C, Reul H, Rau G. Platelet function and hemolysis in centrifugal pumps: in vitro investigations. Int J Artif Organs 1999;22(8):559-65. [ Links ]
40. Westaby S, Banning AP, Jarvik R, et al. First permanent implant of the Jarvik 2000 Heart. Lancet 2000;356(9233):900-3. [ Links ]
41. Westaby S, Katsumata T, Houel R, et al. Jarvik 2000 Heart: potential for bridge to myocyte recovery. Circulation 1998;98(15):1568-74. [ Links ]
42. Frazier OH, Myers TJ, Gregoric ID, et al. Initial clinical experience with the Jarvik 2000 implantable axial-flow left ventricular assist system. Circulation 2002;105(24):2855-60. [ Links ]
43. Westaby S, Banning AP, Saito S, et al. Circulatory support for longterm treatment of heart failure: experience with an intraventricular continuous flow pump. Circulation 2002;105(22):2588-91. [ Links ]
44. Westaby S, Frazier OH, Pigott DW, Saito S, Jarvik RK. Implant technique for the Jarvik 2000 Heart. Ann Thorac Surg 2002;73(4):1337-40. [ Links ]
45. Frazier OH, Myers TJ, Jarvik RK, et al. Research and development of an implantable, axial-flow left ventricular assist device: the Jarvik 2000 Heart. Ann Thorac Surg 2001;71(3 Suppl):S125-32; discussion S44-6. [ Links ]
46. Martin J, Siegenthaler MP, Friesewinkel O, et al. Implantable left ventricular assist device for treatment of pulmonary hypertension in candidates for orthotopic heart transplantation-a preliminary study. Eur J Cardiothorac Surg 2004;25(6):971-7. [ Links ]
47. Kindo M, Radovancevic B, Gregoric ID, et al. Biventricular support with the Jarvik 2000 ventricular assist device in a calf model of pulmonary hypertension. Asaio J 2004;50(5):444-50. [ Links ]
48. Song, X.; Throckmorton, A. L.; Untaroiu, A.; Patel, S.; Allaire, P. E.; Wood, H. G.; Olsen, D. B. Axial flow blood pumps. Asaio J 2.003; 49(4): 355-64 [ Links ]
49. Radovancevic B, Gregoric ID, Tamez D, et al. Biventricular support with the Jarvik 2000 axial flow pump: a feasibility study. Asaio J 2003;49(5):604-7. [ Links ]
50. Copeland JG, Arabia FA, Tsau PH, et al. Total artificial hearts: bridge to transplantation. Cardiol Clin 2003;21(1):101-13. [ Links ]
51. Zareba KM. The artificial heart- past, present, and future. Med Sci Monit 2002;8(3):RA72-7. [ Links ]
52. Hoshi H, Shinshi T, Takatani S. Third-generation blood pumps with mechanical noncontact magnetic bearings. Artif Organs 2006;30(5):324-38. [ Links ]
53. Schmid C, Tjan TD, Etz C, et al. First clinical experience with the Incor left ventricular assist device. J Heart Lung Transplant 2005;24(9):1188-94. [ Links ]
54. Driessen JJ, Dhaese H, Fransen G, et al. Pulsatile compared with nonpulsatile perfusion using a centrifugal pump for cardiopulmonary bypass during coronary artery bypass grafting. Effects on systemic haemodynamics, oxygenation, and inflammatory response parameters. Perfusion 1995;10(1):3-12. [ Links ]
55. La Francesca S, Smith R, Gregoric ID, et al. Replacement of a malfunctioning HeartMate II left ventricular assist device in a 14-year-old after a sudden fall. J Heart Lung Transplant 2006;25(7):862-4. [ Links ]
56. Delgado, R.; Bergheim, M. HeartMate II left ventricular assist device: a new device for advanced heart failure. Expert Rev Med Devices. 2005;2(5):529-32. [ Links ]
57. Amir O, Bracey AW, Smart FW, Delgado RM, 3rd, Shah N, Kar B. A successful anticoagulation protocol for the first HeartMate II implantation in the United States. Tex Heart Inst J 2005;32(3):399-401. [ Links ]
58. Frazier OH, Delgado RM 3rd, Kar B, Patel V, Gregoric ID, Myers TJ. First clinical use of the redesigned HeartMate II left ventricular assist system in the United States: a case report. Tex Heart Inst J 2004;31(2):157-9. [ Links ]
59. Ramondo A, Napodano M, Tarantini G, et al. High-risk percutaneous coronary intervention using the intracardiac microaxial pump 'Impella recover'. J Cardiovasc Med (Hagerstown) 2006;7(2):149-52. [ Links ]
60. Minden HH, Lehmann H, Meyhofer J, Butter C. Transradial unprotected left main coronary stenting supported by percutaneous Impella((R)) Recover LP 2.5 assist device. Clin Res Cardiol 2006;95(5):301-6. [ Links ]
61. LaRocca GM, Shimbo D, Rodriguez CJ, et al. The Impella Recover LP 5.0 left ventricular assist device: a bridge to coronary artery bypass grafting and cardiac transplantation. J Am Soc Echocardiogr 2006;19(4):468 e5-7. [ Links ]
62. Henriques JP, Remmelink M, Baan J Jr., et al. Safety and feasibility of elective high-risk percutaneous coronary intervention procedures with left ventricular support of the Impella Recover LP 2.5. Am J Cardiol 2006;97(7):990-2. [ Links ]
63. Garatti A, Colombo T, Russo C, et al. Left ventricular mechanical support with the Impella Recover left direct microaxial blood pump: a single-center experience. Artif Organs 2006;30(7):523-8. [ Links ]
64. Valgimigli M, Steendijk P, Sianos G, OndePCPater E, Serruys PW. Left ventricular unloading and concomitant total cardiac output increase by the use of percutaneous Impella Recover LP 2.5 assist device during high-risk coronary intervention. Catheter Cardiovasc Interv 2005;65(2):263-7. [ Links ]
65. Strauch JT, Franke UF, Breuer M, et al. Technical feasibility of Impella Recover 100 microaxial left ventricular assist device placement after biologic aortic valve replacement (21 mm) for postcardiotomy failure. J Thorac Cardiovasc Surg 2005;130(6):1715-6. [ Links ]
66. Garatti A, Colombo T, Russo C, et al. Different applications for left ventricular mechanical support with the Impella Recover 100 microaxial blood pump. J Heart Lung Transplant 2005;24(4):481-5. [ Links ]
67. Catena E, Barosi A, Milazzo F, et al. Three-dimensional echocardiographic assessment of a patient supported by intravascular blood pump Impella recover 100. Echocardiography 2005;22(8):682-5. [ Links ]
68. Strecker T, Fischlein T, Pfeiffer S. Impella Recover 100: successful perioperative support for off pump coronary artery bypass grafting surgery in a patient with end-stage ischemic cardiomyopathy. J Cardiovasc Surg (Torino) 2004;45(4):381-4. [ Links ]
69. Pavie A, Leger P, Regan M, et al. Clinical experience with a total artificial heart as a bridge for transplantation: the pitie experience. J Card Surg 1995;10(5):552-8. [ Links ]
70. Siegenthaler MP, Brehm K, Strecker T, et al. The Impella Recover microaxial left ventricular assist device reduces mortality for postcardiotomy failure: a three-center experience. J Thorac Cardiovasc Surg 2004;127(3):812-22. [ Links ]
71. Jurmann MJ, Siniawski H, Erb M, Drews T, Hetzer R. Initial experience with miniature axial flow ventricular assist devices for postcardiotomy heart failure. Ann Thorac Surg 2004;77(5):1642-7. [ Links ]
72. Garatti A, Colombo T, Russo C, et al. Impella recover 100 microaxial left ventricular assist device: the Niguarda experience. Transplant Proc 2004;36(3):623-6. [ Links ]
73. Catena E, Milazzo F, Pittella G, et al. Echocardiographic approach in a new left ventricular assist device: Impella Recover 100. J Am Soc Echocardiogr 2004;17(5):470-3. [ Links ]
74. Catena E, Milazzo F, Merli M, et al. Echocardiographic evaluation of patients receiving a new left ventricular assist device: the Impella recover 100. Eur J Echocardiogr 2004;5(6):430-7. [ Links ]
75. Santise G, Petrou M, Pepper JR, Dreyfus G, Khaghani A, Birks EJ. Levitronix as a short-term salvage treatment for primary graft failure after heart transplantation. J Heart Lung Transplant 2006;25(5):495-8. [ Links ]
76. De Robertis F, Birks EJ, Rogers P, Dreyfus G, Pepper JR, Khaghani A. Clinical performance with the Levitronix Centrimag short-term ventricular assist device. J Heart Lung Transplant 2006;25(2):181-6. [ Links ]
77. Takatani S, Matsuda H, Hanatani A, et al. Mechanical circulatory support devices (MCSD) in Japan: current status and future directions. J Artif Organs 2005;8(1):13-27. [ Links ]
78. Nojiri C. Left ventricular assist system with a magnetically levitated impeller technology. Nippon Geka Gakkai Zasshi 2002;103(9):607-10. [ Links ]
79. Pagani FD, Lynch W, Swaniker F, et al. Extracorporeal life support to left ventricular assist device bridge to heart transplant: A strategy to optimize survival and resource utilization. Circulation 1999;100(19 Suppl):II206-10. [ Links ]
80. Farrar DJ, Chow E, Wood JR, Hill JD. Anatomic interaction between the right and left ventricles during univentricular and biventricular circulatory support. ASAIO Trans 1988;34(3):235-40. [ Links ]
81. Farrar DJ, Hill JD, Gray LA, Jr., Galbraith TA, Chow E, Hershon JJ. Successful biventricular circulatory support as a bridge to cardiac transplantation during prolonged ventricular fibrillation and asystole. Circulation 1989;80(5 Pt 2):III147-51. [ Links ]
82. Hill JD. Bridging to cardiac transplantation. Ann Thorac Surg 1989;47(1):167-71. [ Links ]
83. Farrar DJ, Lawson JH, Litwak P, CedePCPall G. Thoratec DAV system as a bridge to heart transplantation. J Heart Transplant 1990;9(4):415-22; discussion 22-3. [ Links ]
84. Ott RA, Mills TC, Eugene J, Gazzaniga AB. Clinical choices for circulatory assist devices. ASAIO Trans 1990;36(4):792-8. [ Links ]
85. Ley SJ. The Thoratec ventricular assist device: nursing guidelines. AACN Clin Issues Crit Care Nurs 1991;2(3):529-44. [ Links ]
86. McBride LR, Swartz MT, Reedy JE, Miller LW, Pennington DG. Device related infections in patients supported with mechanical circulatory support devices for greater than 30 days. ASAIO Trans 1991;37(3):M258-9. [ Links ]
87. Moroney DA, Swartz MT, Reedy JE, Lohmann DP, McBride LR, Pennington DG. Importance of ventricular arrhythmias in recovery patients with ventricular assist devices. ASAIO Trans 1991;37(3):M516-7. [ Links ]
88. Pennington DG, Reedy JE, Swartz MT, et al. Univentricular versus biventricular assist device support. J Heart Lung Transplant 1991;10(2):258-63. [ Links ]
89. Weitkemper HH, El-Banayosy A, Arusoglu L, Sarnowski P, Korfer R. Mechanical circulatory support: reality and dreams experience of a single center. J Extra Corpor Technol 2004;36(2):169-73. [ Links ]
90. Baran DA, Gass AL, Galin ID, et al. Lack of sensitization and equivalent post-transplant outcomes with the Novacor left ventricular assist device. J Heart Lung Transplant 2005;24(11):1886-90. [ Links ]
91. Bunzel B, Laederach-Hofmann K, Wieselthaler GM, Roethy W, Drees G. Posttraumatic stress disorder after implantation of a mechanical assist device followed by heart transplantation: evaluation of patients and partners. Transplant Proc 2005;37(2):1365-8. [ Links ]
92. Holman WL, Pamboukian SV, Blood M, Tallaj JA, McGiffin DC, Kirklin JK. Managing device infections: are we progressing or is infection an insurmountable obstacle? Asaio J 2005;51(4):452-5. [ Links ]
93. Joyce DL, Southard RE, Torre-Amione G, Noon GP, Land GA, Loebe M. Impact of left ventricular assist device (LDAV)-mediated humoral sensitization on post-transplant outcomes. J Heart Lung Transplant 2005;24(12):2054-9. [ Links ]
94. Kettner J, Pirk J, Netuka I, et al. [Mechanical cardiac support-the first use in Czech Republic].Cas Lek Cesk 2005;144(1):38-42; Discussion. [ Links ]
95. Long JW, Kfoury AG, Slaughter MS, et al. Long-term destination therapy with the HeartMate XVE left ventricular assist device: improved outcomes since the REMATCH study. Congest Heart Fail 2005;11(3):133-8. [ Links ]
96. Minami K, Knyphausen E, Suzuki R, et al. Mechanical ventricular circulatory support in children; Bad Oeynhausen experience. Ann Thorac Cardiovasc Surg 2005;11(5):307-12. [ Links ]
97. Morris RJ, Pochettino A, O'Hara M, Gardner TJ, Acker MA. Emergent mechanical support in the community: improvement with early transplant center referral. J Heart Lung Transplant 2005;24(6):764-8. [ Links ]
98. Patel SM, Throckmorton AL, Untaroiu A, Allaire PE, Wood HG, Olsen DB. The status of failure and reliability testing of artificial blood pumps. Asaio J 2005;51(4):440-51. [ Links ]
99. Reinhartz O, Hill JD, Al-Khaldi A, Pelletier MP, Robbins RC, Farrar DJ. Thoratec ventricular assist devices in pediatric patients: update on clinical results. Asaio J 2005;51(5):501-3. [ Links ]
100.Riemer RK, Amir G, Reichenbach SH, Reinhartz O. Mechanical support of total cavopulmonary connection with an axial flow pump. J Thorac Cardiovasc Surg. 2005;130(2):351-4. [ Links ]
101.Sharma MS, Webber SA, Gandhi SK, Morell VO, Winowich S, Buchanan JR, Kormos RL. Pulsatile paracorporeal assist devices in children and adolescents with biventricular failure. Asaio J. 2005;51(5):490-4. [ Links ]
102.Shinn JA. Implantable left ventricular assist devices. J Cardiovasc Nurs 2005;20(5 Suppl):S22-30. [ Links ]
103.Suri RM, Daly RC, Dearani JA, McGregor CG. Successful use of Thoratec biventricular support in a small child awaiting cardiac transplantation. Ann Thorac Surg 2005;80(5):1920-2. [ Links ]
104.Thompson LO, Skrabal CA, Loebe M, et al. Plasma neurohormone levels correlate with left ventricular functional and morphological improvement in LDAV patients. J Surg Res 2005;123(1):25-32. [ Links ]
105.Tsukui H, Teuteberg JJ, Murali S, et al. Biventricular assist device utilization for patients with morbid congestive heart failure: a justifiable strategy. Circulation 2005;112(9 Suppl):I65-72. [ Links ]
106.Weiss WJ. Pulsatile pediatric ventricular assist devices. Asaio J 2005;51(5):540-5. [ Links ]
107.Ziv O, Dizon J, Thosani A, Naka Y, Magnano AR, Garan H. Effects of left ventricular assist device therapy on ventricular arrhythmias. J Am Coll Cardiol 2005;45(9):1428-34. [ Links ]
108.Arabia FA, Tsau PH, Smith RG, et al. Pediatric bridge to heart transplantation: application of the Berlin Heart, Medos and Thoratec ventricular assist devices. J Heart Lung Transplant 2006;25(1):16-21. [ Links ]
109.Hill JD, Reinhartz O. Clinical outcomes in pediatric patients implanted with Thoratec ventricular assist device. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2006;115-22. [ Links ]
110.Kirklin JK, Holman WL. Mechanical circulatory support therapy as a bridge to transplant or recovery (new advances). Curr Opin Cardiol 2006;21(2):120-6. [ Links ]
111.Letsou GV, Sdringola S, Gregoric ID, et al. Myocardial perfusion as assessed by positron emission tomography during long-term mechanical circulatory support. Congest Heart Fail 2006;12(2):69-74. [ Links ]
112.Reiss N, El-Banayosy A, Arusoglu L, Blanz U, Bairaktaris A, Koerfer R. Acute fulminant myocarditis in children and adolescents: the role of mechanical circulatory assist. Asaio J 2006;52(2):211-4. [ Links ]
113.Samuels LE, Holmes EC, Hagan K, Gopalan R, Droogan C, Ferdinand F. The Thoratec Implantable Ventricular Assist Device (DAVI): Initial Clinical Experience. Heart Surg Forum 2006;9(4):E690-2. [ Links ]
114.Slaughter MS, Sobieski MA, Koenig SC, Pappas PS, Tatooles AJ, Silver MA. Left ventricular assist device weaning: hemodynamic response and relationship to stroke volume and rate reduction protocols. Asaio J 2006;52(3):228-33. [ Links ]
115.Zimpfer D, Wieselthaler G, Czerny M, et al. Neurocognitive function in patients with ventricular assist devices: a comparison of pulsatile and continuous blood flow devices. Asaio J 2006;52(1):24-7. [ Links ]
116.Starnes VA, Oyer PE, Portner PM, et al. Isolated left ventricular assist as bridge to cardiac transplantation. J Thorac Cardiovasc Surg 1988;96(1):62-71. [ Links ]
117.Frattini PL, Wachter C, Hung TC, Kormos RL, Griffith BP, Borovetz HS. Erythrocyte deformability in patients on left ventricular assist systems. ASAIO Trans 1989;35(3):733-5. [ Links ]
118.Hung TC, Butter DB, Kormos RL, et al. Characteristics of blood rheology in patients during Novacor left ventricular assist system support. ASAIO Trans 1989;35(3):611-3. [ Links ]
119.Reedy JE, Ruzevich SA, Swartz MT, Termuhlen DF, Pennington DG. Nursing care of a patient requiring prolonged mechanical circulatory support. Prog Cardiovasc Nurs 1989;4(1):1-9. [ Links ]
120.Al-Khaldi A, Ergina P, DeVarennes B, Lachappelle K, Cecere R. Left ventricular unloading in a patient with end-stage cardiomyopathy and medically unresponsive pulmonary hypertension. Artif Organs 2004;28(2):158-60. [ Links ]
121.Haddad M, Hendry PJ, Masters RG, et al. Ventricular assist devices as a bridge to cardiac transplantation: the Ottawa experience. Artif Organs 2004;28(2):136-41. [ Links ]
122.Jurmann MJ, Weng Y, Drews T, Pasic M, Hennig E, Hetzer R. Permanent mechanical circulatory support in patients of advanced age. Eur J Cardiothorac Surg 2004;25(4):610-8. [ Links ]
123.Kumpati GS, Cook DJ, Blackstone EH, et al. HLA sensitization in ventricular assist device recipients: does type of device make a difference? J Thorac Cardiovasc Surg 2004;127(6):1800-7. [ Links ]
124.Martin J, Siegenthaler MP, Friesewinkel O, Fader T, van de Loo A, Trummer G, Berchtold-Herz M, Beyersdorf F. Implantable left ventricular assist device for treatment of pulmonary hypertension in candidates for orthotopic heart transplantation-a preliminary study. Eur J Cardiothorac Surg 2004;25(6):971-7. [ Links ]
125.Matsumiya G, Miyamoto Y, Fukushima N, Monta O, Sawa Y, Matsuda H. Intraabdominal placement of a Novacor ventricular assist system by using an expanded polytetrafluoroethylene pouch. Ann Thorac Surg 2004;77(5):1851-3. [ Links ]
126.Mussivand T, Hetzer R, Vitali E, et al. Clinical results with an ePTFE inflow conduit for mechanical circulatory support. J Heart Lung Transplant 2004;23(12):1366-70. [ Links ]
127.Pasque MK, Hanselman T, Shelton K, Hedges R, Keohe-Huck B. Operative strategies to reduce complications in Novacor left ventricular assist device placement. J Card Surg 2004;19(4):329-35. [ Links ]
128.Potapov EV, Ignatenko S, Nasseri BA, et al. Clinical significance of PlA polymorphism of platelet GP IIb/IIIa receptors during long-term DAV support. Ann Thorac Surg 2004;77(3):869-74; discussion 74. [ Links ]
129.Raman J, Jeevanadam V. Destination therapy with ventricular assist devices. Cardiology 2004;101(1-3):104-10. [ Links ]
130.Butler J, Howser R, Portner PM, Pierson RN, 3rd. Diabetes and outcomes after left ventricular assist device placement. J Card Fail 2005;11(7):510-5. [ Links ]
131.Clegg AJ, Scott DA, Loveman E, et al. The clinical and cost-effectiveness of left ventricular assist devices for end-stage heart failure: a systematic review and economic evaluation. Health Technol Assess 2005;9(45):1-148. [ Links ]
132.Collart F, Dieuzaide P, Kerbaul F, Mouly-Bandini A, Mesana TG. Complete atrioventricular block decreases left ventricular assist device flow rate. Ann Thorac Surg 2005;80(2):716-7. [ Links ]
133.Dewald O, Schmitz C, Diem H, et al. Platelet activation markers in patients with heart assist device. Artif Organs 2005;29(4):292-9. [ Links ]
134.Faggian G, Santini F, Franchi G, Portner PM, Mazzucco A. Insights from continued use of a Novacor Left Ventricular Assist System for a period of 6 years. J Heart Lung Transplant 2005;24(9):1444. [ Links ]
135.Fernandez FG, Jaramillo A, Ewald G, et al. Blood transfusions decrease the incidence of acute rejection in cardiac allograft recipients. J Heart Lung Transplant 2005;24(7 Suppl):S255-61. [ Links ]
136.Fujita Y, Fujino Y, Matsumiya G, et al. Postoperative hyperbilirubinemia after implantation of left ventricular assist device is associated with poor postoperative liver perfusion. J Artif Organs 2005;8(1):28-33. [ Links ]
137.Kalya AV, Tector AJ, Crouch JD, et al. Comparison of Novacor and HeartMate vented electric left ventricular assist devices in a single institution. J Heart Lung Transplant 2005;24(11):1973-5. [ Links ]
138.Thohan V, Stetson SJ, Nagueh SF, et al. Cellular and hemodynamics responses of failing myocardium to continuous flow mechanical circulatory support using the DeBakey-Noon left ventricular assist device: a comparative analysis with pulsatile-type devices. J Heart Lung Transplant 2005;24(5):566-75. [ Links ]
139.Robin J, Tronc F, Curtil A, et al. [Left ventricular assistance by postoperative mechanical devices in neonates]. Arch Mal Coeur Vaiss 1997;90(5):661-5. [ Links ]
140.Champsaur G, Ninet J, Vigneron M, Cochet P, Neidecker J, Boissonnat P. Use of the Abiomed BVS System 5000 as a bridge to cardiac transplantation. J Thorac Cardiovasc Surg 1990;100(1):122-8. [ Links ]
141.Estanove S, Bastien O, Flamens C. [Mechanical circulation assistance. Changes in techniques and concepts. Implication of anesthesia/resuscitation on patient management. Retrospective study on 159 cases. Bull Acad Natl Med 2002;186(7):1221-35; discussion 36. [ Links ]
142.Girard C, Bastien O, Clerc J, et al. Right ventricular assistance using a centrifugal pump after heart transplantation. Ann Fr Anesth Reanim 1990;9(1):79-82. [ Links ]
143.Ninet J, Vigneron M, Cochet P, Neidecker J, d'Agrosa MC, Bastien O, de Riberolles C, Champsaur G. Assisted circulation by external heterotopic prosthesis as a bridge to heart transplantation. Arch Mal Coeur Vaiss. 1990;83(10):1571-7. [ Links ]
144.Goldstein DJ. Worldwide experience with the MicroMed DeBakey Ventricular Assist Device as a bridge to transplantation. Circulation 2003;108 Suppl 1:II272-7. [ Links ]
145.Sezai A, Shiono M, Nakata K, et al. The possibility of a veno-arterial bypass system using the Abiomed BVS 5000. Artif Organs 2006;30(1):74-7. [ Links ]
146.Anderson MB, Plate JM, Krause TJ, Scholz PM. Peripheral arterial cannulation for Abiomed BVS 5000 left ventricular assist device support. J Heart Lung Transplant 2005;24(9):1445. [ Links ]
147.Samuels L, Entwistle J, Holmes E, et al. Clinical use of the abiomed BVS 5000 as a pulsatile extracorporeal membrane oxygenation unit. Asaio J 2004;50(3):234-6. [ Links ]
148.Potapov EV, Merkle F, Guttel A, et al. Transcontinental transport of a patient with an AbioMed BVS 5000 DABV. Ann Thorac Surg 2004;77(4):1428-30. [ Links ]
149.Morgan JA, Stewart AS, Lee BJ, Oz MC, Naka Y. Role of the Abiomed BVS 5000 device for short-term support and bridge to transplantation. Asaio J 2004;50(4):360-3. [ Links ]
150.Samuels LE, Entwistle JC, 3rd, Holmes EC, Parris T, Wechsler AS. Mechanical support of the unrepaired postinfarction ventricular septal defect with the Abiomed BVS 5000 ventricular assist device. J Thorac Cardiovasc Surg 2003;126(6):2100-1. [ Links ]
151.Potapov EV, Weng Y, Hausmann H, Kopitz M, Pasic M, Hetzer R. New approach in treatment of acute cardiogenic shock requiring mechanical circulatory support. Ann Thorac Surg 2003;76(6):2112-4. [ Links ]
152.Entwistle JW, 3rd, Bolno PB, Holmes E, Samuels L E. Improved survival with ventricular assist device support in cardiogenic shock after myocardial infarction. Heart Surg Forum 2003;6(5):316-9. [ Links ]
153.Castells E, Calbet JM, Saura E, et al. Acute myocardial infarction with cardiogenic shock: treatment with mechanical circulatory assistance and heart transplantation. Transplant Proc 2003;35(5):1940-1. [ Links ]
154.Fasseas P, Kutalek SP, Samuels FL, Holmes EC, Samuels LE. Ventricular assist device support for management of sustained ventricular arrhythmias. Tex Heart Inst J 2002;29(1):33-6. [ Links ]
155.Samuels LE, Holmes EC, Thomas MP, et al. Management of acute cardiac failure with mechanical assist: experience with the ABIOMED BVS 5000. Ann Thorac Surg 2001;71(3 Suppl):S67-72; discussion S82-5. [ Links ]
156.Abraham W, Wasler A, Cabuay B, Khanal S, Bartus K, Zile MR, Konstam MA. Cardiology, Henry Ford Heart & Vascular Institute, Detroit, MI; Medicine, University of Iowa, Iowa City, IA; Internal Medicine, University Hospital Saarland, Homberg, Germany; Cardiology, John Paul II Hospital, Krakow, Poland; Cardiology, Medical University of South Carolina, Charleston, SC; Cardiovascular Medicine, The Ohio State University. Clinical results with the Orqis® medical cancion® CRS™ therapy. 25th annual meeting and scientific sessions abstracts view International Society for Heart and Lung transplantation. April 2005. [ Links ]
157.LaPietra A, Grossi EA, Galloway AC, Colvin SB, Ribakove GH. Beating-heart coronary artery bypass grafting for left ventricular failure assisted by the Abiomed BVS 5000. J Card Surg 2001;16(2):170-2. [ Links ]
158.Thomas NJ, Harvey AT. Bridge to recovery with the Abiomed BVS-5000 device in a patient with intractable ventricular tachycardia. J Thorac Cardiovasc Surg 1999;117(4):831-2. [ Links ]
159.Lachat M, Jaggy C, Leskosek B, et al. Optimized performance of the Abiomed BVS 5000: adjustment of the pump height based on Doppler control of the flow pattern. Perfusion 1999;14(1):59-67. [ Links ]
160.Sato M, Katayama Y, Higuchi S, Kosako Y, Ohtsubo S, Itoh T. Initial clinical experiences of the ABIOMED BVS SYSTEM 5000 in Japan. Jpn J Thorac Cardiovasc Surg 1998;46(2):236-42. [ Links ]
161.Sato M, Higuchi S, Kosako Y, Katayama Y, Ohtsubo S, Itoh T. A case of fulminant myocarditis treated by ABIOMED BVS 5000 biventricular support. Kyobu Geka 1998;51(6):451-6. [ Links ]
162.Marelli D, Laks H, Amsel B, et al. Temporary mechanical support with the BVS 5000 assist device during treatment of acute myocarditis. J Card Surg 1997;12(1):55-9. [ Links ]
163.Chen JM, Levin HR, Rose EA, et al. Experience with right ventricular assist devices for perioperative right-sided circulatory failure. Ann Thorac Surg 1996;61(1):305-10; discussion 11-3. [ Links ]
164.Chen JM, Levin HR, Catanese KA, et al. Use of a pulsatile right ventricular assist device and continuous arteriovenous hemodialysis in a 57-year-old man with a pulsatile left ventricular assist device. J Heart Lung Transplant 1995;14(1 Pt 1):186-91. [ Links ]
165.Kaltenbock F, Gombotz H, Tscheliessnigg KH, Matzer C, Winkler G, Auer T. Right ventricular assist device (DAVD) in septic, fulminating pulmonary artery embolism. Anaesthesist 1993;42(11):807-10. [ Links ]
166.Minami K, el-Banayosy A, Posival H, et al. Improvement of survival rate in patients with cardiogenic shock by using nonpulsatile and pulsatile ventricular assist device. Int J Artif Organs 1992;15(12):715-21. [ Links ]
167.Potapov, E. V.; Loebe, M.; Nasseri, B. A.; Sinawski, H.; Koster, A.; Kuppe, H.; Noon, G. P.; DeBakey, M. E.; Hetzer, R. Pulsatile flow in patients with a novel nonpulsatile implantable ventricular assist device. Circulation 2000; 102 (19 Suppl 3): III183-7 [ Links ]
168.Nastala CJ. Bridge to cardiac transplantation: current practice. Crit Care Nurs Q 1995;18(1):65-76. [ Links ]
169.Potapov EV, Loebe M, Nasseri BA, et al. Pulsatile flow in patients with a novel nonpulsatile implantable ventricular assist device. Circulation 2000;102(19 Suppl 3):III183-7. [ Links ]
170.Copeland JG, Pavie A, Duveau D, et al. Bridge to transplantation with the CardioWest total artificial heart: the international experience 1993 to 1995. J Heart Lung Transplant 1996;15(1 Pt 1):94-9. [ Links ]
171.Arabia FA, Copeland JG, Smith RG, et al. International experience with the CardioWest total artificial heart as a bridge to heart transplantation. Eur J Cardiothorac Surg 1997;11 Suppl:S5-10. [ Links ]
172.Pavie A, Duveau D, Baron O, et al. CardioWest, a complete artificial heart, the French experience. Chirurgie 1997;121(9-10):685-9. [ Links ]
173.Arabia FA, Copeland JG, Smith RG, et al. Infections with the Cardio-West total artificial heart. Asaio J 1998;44(5):M336-9. [ Links ]
174.Copeland JG. Current status and future directions for a total artificial heart with a past. Artif Organs 1998;22(11):998-1001. [ Links ]
175.Copeland JG 3rd, Arabia FA, Banchy ME, et al. The CardioWest total artificial heart bridge to transplantation: 1993 to 1996 national trial. Ann Thorac Surg 1998;66(5):1662-9. [ Links ]
176.Leprince P, Pavie A, Leger P, et al. The cardiowest total artificial heart: experience of 29 cases. Arch Mal Coeur Vaiss 1998;91(4):397-404. [ Links ]
177.Tsau PH, Arabia FA, Toporoff B, Paramesh V, Sethi GK, Copeland JG. Positive panel reactive antibody titers in patients bridged to transplantation with a mechanical assist device: risk factors and treatment. Asaio J 1998;44(5):M634-7. [ Links ]
178.Arabia FA, Copeland JG, Pavie A, Smith RG. Implantation technique for the CardioWest total artificial heart. Ann Thorac Surg 1999;68(2):698-704. [ Links ]
179.Arabia FA, Copeland JG, Smith RG, et al. CardioWest total artificial heart: a retrospective controlled study. Artif Organs 1999;23(2):204-7. [ Links ]
180.Copeland JG, Arabia FA, Smith RG, Sethi GK, Nolan PE, Banchy ME. Arizona experience with CardioWest Total Artificial Heart bridge to transplantation. Ann Thorac Surg 1999;68(2):756-60. [ Links ]
181.Copeland JG. Mechanical assist device; my choice: the CardioWest total artificial heart. Transplant Proc 2000;32(7):1523-4. [ Links ]
182.Copeland JG, Smith RG, Arabia FA, Nolan PE, Banchy ME. The CardioWest total artificial heart as a bridge to transplantation. Semin Thorac Cardiovasc Surg 2000;12(3):238-42. [ Links ]
183.Arabia FA. Update on the total artificial heart. J Card Surg 2001;16(3):222-7. [ Links ]
184.Arusoglu L, Reiss N, Morshuis M, Korfer R, El-Banayosy A. Implantation of CardioWest total artificial heart in irreversible acute myocardial infarction shock-new hope for patients with infaust prognosis. Z Kardiol 2003;92(11):916-24. [ Links ]
185.Copeland JG, Arabia FA, Tsau PH, Nolan PE, McClellan D, Smith RG, Slepian MJ. Total artificial hearts: bridge to transplantation. Cardiol Clin. 2003,21(1):101-13. [ Links ]
186.Leprince P, Bonnet N, Rama A, Leger P, Bors V, Levasseur JP, Szefner J, Vaissier E, Pavie A, Gandjbakhch I. Bridge to transplantation with the Jarvik-7 (CardioWest) total artificial heart: a single-center 15-year experience. J Heart Lung Transplant. 2003;22(12):1296-303. [ Links ]
187.Samuels LE, Dowling R. Total artificial heart: destination therapy. Cardiol Clin 2003;21(1):115-8. [ Links ]
188.Copeland JG, Smith RG, Arabia FA, Nolan PE, McClellan D, Tsau PH, Sethi GK, Bose RK, Banchy ME, Covington DL, Slepian MJ. Total artificial heart bridge to transplantation: a 9-year experience with 62 patients. J Heart Lung Transplant 2004;23(7): 823-31. [ Links ]
189.El-Banayosy A, Arusoglu L, Morshuis M, Kizner L, Tenderich G, Sarnowski P, Milting H, Koerfer R. CardioWest total artificial heart: Bad Oeynhausen experience. Ann Thorac Surg. 2005;80(2):548-52. [ Links ]
190.Leprince P, Bonnet N, Varnous S, et al. Patients with a body surface area less than 1.7 m2 have a good outcome with the CardioWest Total Artificial Heart. J Heart Lung Transplant 2005;24(10):1501-5. [ Links ]
191.Hetzer R, Potapov EV, Stiller B, Weng Y, Hubler M, Lemmer J, Alexi- Meskishvili V, Redlin M, Merkle F, Kaufmann F, Hennig E. Improvement in survival after mechanical circulatory support with pneumatic pulsatile ventricular assist devices in pediatric patients. Ann Thorac Surg.2006;82(3):917-24; discussion 924-5. [ Links ]
192.Potapov EV, Hetzer R. Pediatric Berlin heart excor. Ann Thorac Cardiovasc Surg 2006;12(2):155. [ Links ]
193.Hetzer R, Alexi-Meskishvili V, Weng Y, et al. Mechanical cardiac support in the young with the Berlin Heart EXCOR pulsatile ventricular assist device: 15 years' experience. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2006:99-108 [ Links ]
194.Dunnington GH Jr., Sleasman J, Alkhaldi A, Pelletier MP, Reitz BA, Robbins RC. Successful bridge to transplant using the Berlin Heart left ventricular assist device in a 3-month-old infant. Ann Thorac Surg 2006;81(3):1116-8. [ Links ]
195.Etz C, Welp H, Rothenburger M, et al. Analysis of platelet function during left ventricular support with the Incor and Excor system. Heart Surg Forum 2004;7(5):E423-7. [ Links ]
196.Schmid C, Scheld HH, Tjan TD. Biapical cannulation for biventricular support with the pneumatically driven Excor system. Asaio J 2005;51(1):126-7. [ Links ]
197.Burns GL. Infections associated with implanted blood pumps. Journal: Int J Artif Organs1993;16(11):771-6. [ Links ]
198.McBride LR, Swartz MT, Reedy JE, Miller LW, Pennington DG. Device related infections in patients supported with mechanical circulatory support devices for greater than 30 days. Journal: ASAIO Tran1991;37(3):M258-93. [ Links ]
199.Frazier OH, Duncan M, Radovancevic B, Wilansky S, Texas Heart Institute. Clinical implantation of the "Heartmate" ventricular assist device. Videorecording . Houston, Tex.: The Institute; 1990. [ Links ]
200.Sander Jensen KM, Aldershvile J, Boesgaard S, et al. Circulatory support with the mechanical heart, "HeartMate". Ugeskr Laeger 2000;162(26):3717-22. [ Links ]
201.Phillips WS, Burton NA, Macmanus Q, Lefrak EA. Surgical complications in bridging to transplantation: the Thermo Cardiosystems LDAV. Ann Thorac Surg 1992;53(3):482-5; discussion 5-6. [ Links ]
202.Saltzberg MT, Neumann A, Costanzo MR, Abstract [270] Acute Short Term Ultrafiltration Produces Sustained Hemodynamic Benefits in Acutely Decompensated Heart Failure Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
203.Bedi MS, Gujral V, Kormos R, Murali S. Cardiovascular Institute, University of Pittsburgh, Pittsburgh, PA Posters [271] Cardiac Resynchronization Therapy in end Stage Heart Failure Patients listed for Cardiac Transplant. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
204.Willians JA, Patel ND, Nwakama LU, Conte JV, Abstract (35) Surgical Ventricular Restoration versus Cardiac Transplantation: Hospital Charges, Outcomes, and Survival Analyses of Two Surgical Options for Ischemic Cardionyopathy. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
205.Healy AH, Kfoury AG, Nelson DM, Horne BD, Smith HK, KePCPin BA, Wecker R, Nelson KM, Renlund DG, Long JW, UCAT Artificial Heart Program, LDS Hospital, Salt Lake City, UT). Oral Sessions (102) Predictors of Long-Term Survival in Destination Therapy Left Ventricular Assist Device Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
206.El-Banayosy A, Koerfer R, Hetzer R, Wieselthaler G, Pavie A. Department of Thoracic and Cardiovascular Surgery, Heart and Diabetes Center NPCP, Bad Oeynhausen, Germany; German Heart Center Berlin, Berlin, Germany; University of Vienna, Vienna, Austria; Pitie Salpetriere Hospital, Paris, France, Posters [293] Initial Results of a European Multicenter Clinical Trial with the DuraHeart® Mag-Lev Centrifugal Left Ventricular Assist Device. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
207.John R, Liao K, Lietz K, Colvin-Adams MM, Boyle AJ, Miller LW, Joyce LD, Cardiothoracic and Cardiovasular Division, University of Minnesota, Minneapolis, MN. Posters [304] Use of the Levitronix CentriMag Ventricular Assist Device (DAV) for the Treatment of Refractory Cardiogenic Shock in Patients with End-Stage Heart Failure. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
208.El-Banayosy A, Arusoglu L, Kizner L, Morshuis M, Sarnowski P, Cobaugh D, Koerfer R, Department of Throacic and Cardiovascular Surgery, Heart and Diabetes Center NPCP, Bad Oeynhausen, Germany, Oral Session [104] Long-Term Out-of-Hospital Experience in Mechanical Circulatory Support Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
209.Lietz K, Long J, Kfoury AG, Slaughter MS, Silver MA, Milano CA, Rogers J, Miller LW. Cardiovascular Division, University of Minnesota, Minneapolis, MN; Divisions of Cardiology and Cardiothoracic Surgery, LDS Hospital, Salt Lake City, UT; Divisions of Cardiology and Cardiothoracic Surgery, Advocate Christ Medical Center, Oak Lawn, IL; Divisions of Cardiology and Cardiothoracic Surgery, Duke University Medical Center, Durham NC, Plenary Session (251) The Impact of Patient Selection on Long-Term Outcomes of Left-Ventricular Assist Device Implantation as Destination Therapy for End-Stage Heart Failure. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
210.Delgado RM, Radovancevic B, Radovancevic R, Rodriguez G, Frazier OH. Center for Cardiac Support, Texas Heart Institute, Houston, Oral Session. [228] Effects of Left Ventricular Assist Devices with Different Flow Characteristics on Vasopressin Levels. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
211.Toyoda Y, McCurry KR, Hattler BG, Zenati MA, Tsukui H, Boujoukos AJ, Kormos RL. Cardiothoracic Surgery, University of Pittsburgh Medical Center, Pittsburgh, PA; Critical Care Medicine, University of Pittsburgh Medical Center, Pittsburgh, PA. Oral Session (232) Right Ventricular Assist Device Is Better Than Extracorporeal Membrane Oxygenation for Isolated Right Ventricular Failure Following Heart Transplantation. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
212.Lietz K, Brown K, John R, Anderson D, Joyce L, Miller LW. Cardiovascular Division, University of Minnesota, Minneapolis, MN; Division of Neurology, University of Minnesota, Minneapolis, MN; Division of Cardiothoracic Surgery, University of Minnesota, Minneapolis, Oral Session. (233) The Effects of Hyperperfusion on Postoperative Neurologic Dysfunction in Recipients of Left-Ventricular Assist Device. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]