Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.2 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2007
ACTUALIZACIÓN
Asistencia circulatoria mecánica
Parte II
Oscar Mugianesi*
*Médico cardiólogo y terapista del Servicio de Cirugía Cardiovascular. Coordinador del Área de Recuperación de Cirugía Cardiovascular y Trasplantes Intratorácicos. Hospital Italiano de Mendoza. Prov. de Mendoza. Rep. Argentina.
Correspondencia: Dr. Oscar Mugianesi
Ramponi 6293 Barrio Santa Ana
5521 - Mendoza, República Argentina.
Trabajo recibido: 15/12/2006
Trabajo aprobado: 20/03/2007
TABLA DE ABREVIATURAS
IC: Insuficiencia cardíaca.
TxC: Trasplante cardíaco.
ACM: Asistencia circulatoria mecánica.
DAVI: Dispositivo de asistencia ventricular izquierda.
DAV: Dispositivo de asistencia ventricular.
ECMO: Oxigenación con membrana extracorpórea.
CEC: Circulación extracorpórea.
VD: Ventrículo derecho.
VI: Ventrículo izquierdo.
AV: Aurículo-ventricular.
FE: Fracción de eyección.
AI: Aurícula izquierda.
RVP: Resistencia vascular pulmonar.
IAM: Infarto agudo de miocardio.
DABV: Dispositivo de asistencia biventricular.
DAVD: Dispositivo de asistencia ventricular derecha.
CF: Clase funcional.
FR: Función renal.
HTP: Hipertensión pulmonar.
CAT: Corazón artifificial total.
DFDVI: Diámetro de fin de diástole del ventrículo izquierdo.
VMC = Volumen minuto cardíaco.
TA = Tensión arterial.
ON = Oxido nítrico.
ET1 = Endotelina.
AP = Arteria pulmonar.
PCP = Presión capilar pulmonar.
RPT = Resistencia periférica total.
UW = Unidades wod.
ACT = Tiempo de coagulación activado.
BCIP = Balón de contrapulsación intrapulmonar.
RHA = Ruidos hidroaéreos.
HAD = Hormona antidiurética.
SRIS = Síndrome de respuesta inflamatoria sistémica.
rpm = Revoluciones por minuto.
AD = Aurícula derecha.
NPS = Nitropusiato de sodio.
TAM = Tensión arterial media.
GC = Gasto cardíaco.
ARM = Asistencia respiratoria mecánica.
ECG = electrocardiograma.
DAVP = Dispositivo de asistencia ventricular paracorpóreo.
Ac = Anticuerpos.
ACV = Accidente cerebrovascular
TCI = Termo Cardiosystems implantable
VE = Vented electric model
FMO = Falla multiorgánica.
Asistencia mecánica ventricular
A- Bombas de flujo continuo
Si a pesar de haber instaurado un tratamiento médico óptimo y haber colocado el balón de contrapulsación intraaórtico, el paciente no se compensa; podemos emplear otros dispositivos de ayuda ventricular que nos permitirán soportar, ayudar o sustituir un corazón gravemente enfermo97,210.
La ACM debe ser precoz en todo paciente que no responde al tratamiento convencional ya que para recuperarse debe contar con una reserva funcional suficiente y no esperar a que llegue a un estadío terminal e irrecuperable.
Las bombas de flujo continuo a diferencia de las pulsátiles no requieren de cámaras ni válvulas.
Se ha comprobado que el empleo de dispositivos de flujo continuo (Jarvik 2000, HeartMate II) sería beneficioso sobre los pulsátiles (HeartMate I), pues permitiría a los pacientes mantener un nivel de hormona antidiurética (HAD) más elevado, lo que le permitiría lograr una mayor presión arterial y tener menor mortalidad.
1.- Bomba de rodillo
El sistema de soporte cardiopulmonar utilizando la bomba de rodillo ofrece un flujo continuo. Recordemos que manteniendo una presión de perfusión de 70 mm Hg. no se necesita pulsatilidad para lograr una adecuada oxigenación tisular18,19,27,28,32,34,39,43,118. La canulación del paciente puede ser quirúrgica (en la vena cava superior y la aorta) o por punción a nivel inguinal colocando una cánula venosa que se lleva hasta la vena cava inferior o aurícula derecha (AD) y una cánula arterial que se lleva hasta la arteria ilíaca o aorta abdominal.
Con este tipo de asistencia, algunos pacientes han sobrevivido más de 48 hs, aunque se aconseja no mantenerla más de 6 hs, ya que el uso prolongado de este sistema produce hemólisis, activación leucocitaria que podría desencadenar o agravar un síndrome de respuesta inflamatoria inespecífica sistémica (SIRS), agregación plaquetaria que favorece la aparición de trombosis en el postoperatorio, desnaturalización de las proteínas plasmáticas y mayor edema tisular, debido a la salida de líquido intracapilar hacia el intersticio.
Este dispositivo de asistencia es útil en pacientes con shock cardiogénico, especialmente si requieren corrección quirúrgica, o bien como puente hacia otro sistema de soporte circulatorio mecánico tal como un DAVI o ECMO, el cual emplea cánulas de mayor diámetro para reducir la hemólisis e intercala un oxigenador especial para disminuir la pérdida de plasma en el circuito y hacer oxigenación extracorpórea (ECMO), enviando la sangre desde las cavidades derechas a la aorta, pasando previamente por el oxigenador realizando un by pass al pulmón. Dichos oxigenadores pueden estar recubiertos con heparina para reducir el riesgo de trombos (Figura 3).
2.- Bomba centrífuga (Biomedicus, Medos, Saint Jude y Sarns)26-34,38,39,112,139,142
La bomba centrífuga genera un flujo de sangre continuo que, si bien tiene un efecto deletéreo sobre los elementos formes de la misma, es menor que el ocasionado por la bomba roller.
Consta de una consola externa con el motor y sus comandos, que hace rotar un cabezal de 0 a 6.000 revoluciones por minuto (rpm), generando un flujo que puede alcanzar hasta los 10 latidos/minuto (lat/min), pero que no guarda relación directa con la velocidad de rotación.
Este sistema permite enviar la sangre desde la AI o el VI a la aorta, o bien desde la AD o el VD a la AP, según se desee realizar el soporte mecánico al VI, al VD o a ambos, teniendo en cuenta que las variaciones en la precarga de la centrífuga (expresada por la presión venosa central y la presión wedge) y las variaciones en la postcarga (expresada por la tensión arterial media y la RPT), se acompañan de cambios en el flujo de la misma, siendo el volumen eyectado directamente proporcional a la precarga e inversamente proporcional a la postcarga. Por lo tanto, si se desea mantener un flujo de 3,5-4 L/min, se deberá mantener adecuada precarga y una tensión arterial media entre 50-60 mm Hg con la ayuda de nitroprusiato de sodio (NPS), ya que si la tensión arterial media es de 90 mm Hg el flujo cae a 2,5 L/min. También en este circuito, se puede intercalar un oxigenador y hacer ECMO.
Algunos optan por anticoagular al paciente con heparina EV para mantener el KPTT en 1,5-2 veces el valor normal. Otros prefieren no anticoagular mientras se mantenga un flujo mayor a 2 L/min y hacer sólo profilaxis, manteniendo un ACT > de 150 segundos para evitar la formación de coágulos alrededor de las cánulas. Finalmente, si el GC que se maneja con la centrifuga es < de 500 se anticoagula, manteniendo un ACT > de 400 segundos.
Este sistema tiene la ventaja de ser de bajo costo, fácil colocación y manejo, requiriendo sólo una anticoagulación reducida, pudiendo además intercalar un oxigenador de membrana recubierto con heparina y hacer ECMO, si fuera necesario por disfunción pulmonar aunque ya requeriría estricto control durante las 24 horas, pero nos permitirá evaluar al paciente y su posibilidad de recuperación antes de emplear dispositivos de ACM más costosos.
La desventaja es que sólo puede dar soporte por corto plazo (hasta 4 días), aunque en algunos casos se ha usado hasta 30 días.
Es útil para ser usado como puente hacia la recuperación ventricular de aquellos pacientes que no se pueden separar de la bomba de CEC, lo que constituye su empleo más frecuente, ya sea después de una cirugía de revascularización coronaria, reemplazo valvular, corrección de cardiopatía congénita en pacientes pediátricos, o TxC que desarrolla un fallo severo del VD potencialmente reversible.
Los pacientes pueden ser separados del soporte hasta en el 70% de los casos, otros mueren por FMO y otros deberán ser trasplantados o retrasplantados, lo que también conlleva una elevada mortalidad.
También, se ha empleado como puente (bridge) para la recuperación de la función de un ventrículo dañado y como bridge al TxC.
Como complicaciones se han descrito: hemólisis, coagulopatía, fenómenos tromboembólicos, insuficiencia renal, insuficiencia respiratoria, arritmias, falla ventricular, infecciones ya que las cánulas salen sin protección de la piel favoreciendo la mediastinitis y la sepsis. Además, cuando se empleó por tiempo prolongado (> de 5 días y hasta 25 días) en pacientes con prótesis valvular aórtica, se ha visto la aparición de trombosis a nivel de la prótesis, seguida de fenómenos tromboembólicos coronarios que determinaron la muerte (Figura 4).
3- Hemopump19-25,48,54
Es una microbomba intraarterial de alta velocidad, montada sobre un catéter abierto en ambos extremos e impulsada por un cable conectado a un motor electromagnético paracorpóreo que la hace girar entre 17.000-48.000 rpm con lo que descarga el VI, aspirando sangre desde dicha cavidad para luego bombearla hacia la aorta con un flujo axial continuo, unidireccional, no pulsátil e independiente del ritmo cardíaco.
Como otros DAVI de flujo axial continuo (MicroMed, De-Bakey, Jarvik 2000, HeartMate II, Streamliner, Impella, Berlin Incor, Valvo pump y el IVAP), la hemopump se ha usado para tratar pacientes con falla severa del VI (clase III-IV de la NYHA), pudiendo ser usado como puente al TxC, como terapia de destino y también en aquellos con disfunción ventricular postcardiotomía, periparto, post-IAM y trasplantados cardíacos con falla del implante o rechazo agudo.
El flujo varía en relación inversa a la postcarga, pudiendo alcanzar un GC de 3,5-5 L/min, aún con el corazón sin latir y con una hemólisis mínima.
En estos pacientes, al igual que en todos aquellos en los que se hace soporte del VI, las catecolaminas se deberán reducir lentamente para tratar de prevenir la falla del VD.
El dispositivo se introduce, en forma percutánea, por la arteria femoral hasta llegar al VI, siendo la cánula de entrada al mismo fabricada con silicona, de unos 20 cm de largo y 7 mm de diámetro, con un bisel radio opaco que facilita y permite controlar la entrada a través de la válvula aórtica. No se ha evidenciado regurgitación a través de dicha válvula, ni reducción del flujo coronario.
Se debe anticoagular con heparina EV para mantener el KPTT en 1,5 -2 veces el valor normal.
Presenta las siguientes contraindicaciones: estenosis o insuficiencia aórtica, disfunción de válvula aórtica mecánica, aneurisma disecante de aorta, defectos septales auriculares o ventriculares, enfermedad aortoilíaca severa, resistencia vascular sistémica elevada, falla del VD o biventricular.
Y presenta las siguientes complicaciones: eyección de la
cánula desde el VI, falla del VD, fractura del cable conductor, hemólisis leve a moderada cuando se superan las 27.000 rpm, trombocitopenia que retorna a lo normal después de 10 días de retirada la hemopump, tromboembolismo por el desprendimiento de trombos intramurales, infecciones, isquemia del miembro inferior por donde se realizó su colocación, injuria vascular y valvular y, también, arritmias (Figura 5).
4- Jarvik 200022,35,39-49,87,120,124,129,131
Es una bomba electromagnética intraventricular de flujo axial continuo que pertenece a la segunda generación de sistemas de soporte circulatorio. A diferencia de la primera generación de dispositivos para asistencia del VI que fueron desarrollados en los años 70 y diseñados para reemplazar al VI, ya que lo descargaban totalmente capturando todo el volumen minuto cardíaco, este sistema se diseño para asistir al VI, descargándolo sólo parcialmente para normalizar el volumen minuto cardíaco y logrando un aumento de la función del corazón nativo crónicamente enfermo por un tiempo prolongado, permitiendo mejorar la sobrevida y la calidad de vida con pocos efectos adversos.
Se implanta en el ápex del VI por toracotomía lateral izquierda, con by pass parcial, suturado al miocardio por un extremo y por el otro descarga en la aorta descendente.
La fuente de poder suele ser portable, accediendo por una línea a través de la pared abdominal o ubicarse detrás de la aurícula sobre una base de titanio.
El dispositivo mide 5,5 cm de largo y 2,5 cm de diámetro. Cuenta con una cámara que tiene una capacidad de 25 ml y un sistema impelente que gira a una velocidad de 1500-2000 rpm y da un flujo de hasta 10 L/min, optimizando la hemodinamia del paciente y funcionando sinérgicamente con el ventrículo nativo. Y así, incrementa el GC, disminuye la PCP y la RPT, pudiendo llegar a permitir la suspensión de las drogas inotrópicas.
Presenta un bajo índice de infección, ya que está encapsulado en el miocardio, y también, un bajo nivel trombogénico, ya que recibe toda la sangre directamente desde la válvula mitral sin necesitar tubos de entrada ni válvulas.
Permite asistir al paciente por tiempo prolongado, siendoútil como puente para la recuperación ventricular izquierda, constituyendo además una estrategia emergente en el tratamiento de la IC terminal, como terapia de destino o como puente al TxC. También, es una alternativa útil para tratar aquellos pacientes en los que no se puede realizar un TxC ortotópico por presentan RVP elevada, ya que se ha logrado mejorar el GC y reducir la RVP a valores casi normales después de 3-6 meses de tratamiento, permitiendo hacer el TxC ortotópico con bajo riesgo y buen resultado.
Se debe monitorizar la coagulación en forma rigurosa y realizar un ecocardiograma transesofágico periódicamente para valorar la función ventricular.
Es conveniente tener el equipo quirúrgico stand by, ya el 25% de los pacientes se reopera por sangrado o taponamiento cardíaco.
Este dispositivo se haya contraindicado si texiste falla biventricular o del VD, si bien se ha desarrollado un Jarvik 2000 que permite hacer asistencia biventricular en forma segura y efectiva en pacientes con HTP severa, disfunción del VD y en aquellos con un ventrículo fibrilado, dando un volumen minuto (o sea un output device) de 3-11 litros por minuto.
Las complicaciones son arritmias, infecciones, hemólisis, fenómenos tromboembólicos que se previenen anticoagulando con warfarina, fallo del VD teniendo en cuenta que el Jarvik 2000 es un DAVI que se puede usar como DAVD, implantándolo en la AD por la misma vía (Figura 6).
5- HeartMate II2,45,47,48,55-58,95,100,120,124
Es un DAVI de flujo axial continuo, pequeño y fácil de implantar que puede detectar y corregir automáticamente la descarga excesiva del VI. Es de simple diseño con una cámara confeccionada en titanio con una superficie interna lisa para reducir los fenómenos tromboembólicos.
Se implanta por esternotomía mediana y actúa por un suave movimiento de rotación, pudiendo alcanzar un flujo de hasta 10 L/min. Su peso es de 400 g, por lo tanto no se percibe, siendo útil en pacientes jóvenes y pequeños. Se alimenta con baterías que son transportadas por el paciente y cuenta con un back up electrónico de seguridad.
Este dispositivo nos permite asistir al paciente para restaurar su hemodinamia, mejorando la sobrevida y pudiendo recuperar la función de otros órganos como el hígado y el riñón. Ello mejora la clase funcional hasta tal punto que en algunos casos podremos retirar el soporte; mientras que en otros, podremos asistir al paciente por un tiempo más prolongado, permitiéndole volver a su domicilio y realizar tareas habituales, lo que en un 60% de los casos se logra entre los días 17 al 68 del postoperatorio y por un tiempo que variable de 2 a 460 días constituyendo un método seguro que permite mejorar la calidad de vida de los pacientes que esperan un TxC.
Este dispositivo totalmente implantable, al igual que el Jarvik 2000 y Novacor, constituye una alternativa útil para tratar pacientes a los que no se les puede realizar un TxC ortotópico por presentar una RVP elevada, habiendo logrado mejorar el GC y reducir la RVP a valores casi normales después de 3-6 meses de tratamiento, lo que permite hacer el TxC ortotópico con bajo riesgo y buenos resultados. También, constituyen una opción de tratamiento permanente o terapia de destino para aquellos pacientes que no son candidatos a TxC.
Estos dispositivos tienen bajo índice de infección por poseer líneas de conducción finas y flexibles, bajo índice de trombosis y hemólisis por las características de la superficie de la bomba, que es biocompatible.
Las complicaciones más frecuentes del DAVI son la hemorragia y el tromboembolismo, debiendo anticoagular al paciente por prevención (Figura 7).
Las bombas de tercera generación para ACM52, son todas de flujo axial continuo y cuentan con un sistema de levitación electromagnético que puede categorizarse en tres tipos:
1- El motor que hace funcionar al sistema impelente, levitado electromagnéticamente, es externo. Su ejemplo es la bomba DuraHeart. La desventaja de esta categoría es que usa un motor mecánico.
2- El motor hace funcionar el sistema impelente directamente, ya que la bomba se encuentra dentro del rotor del motor y el campo magnético que genera es lo que la hace girar, mientras otro sistema electromagnético la mantiene levitada. El mejor ejemplo es el Berlin Heart INCOR.
3- El sistema impelente funciona sin requerir motor ni soporte ya que un campo electromagnético levita y hace girar la bomba. Por lo tanto, no hay fricción ni generación de calor por lo que el trauma de los elementos formes de la sangre, el riesgo de hemólisis y la formación de trombos es mínimo, manteniéndose con un KPTT de 1,5/2,5. Este ejemplo corresponde al sistema Levitronix Centrimag del Impella Recover.
6- DuraHeart48,51,52,78,84,85,206
Es un DAVI implantable que tiene un sistema de rotación eletromagnético que mantiene en suspensión el rotor, asegurando una mínima fricción y producción de calor. Evita el contacto entre los componentes en movimiento y la cámara de sangre, reduciendo las posibilidades de hemólisis.
Ha sido diseñado para asistencia ventricular prolongada.
Rota a 1.200-2.600 rpm, dando un flujo de 2 a 8 L/min. El peso de la bomba es de 540 gramos, y el de la fuente de energía y el controlador 700 gramos cada uno (Figura 8 y 9).
7- Berlin Heart Incor35,47,48,50-53,84,108
Es una bomba implantable diseñada para asistir al VI (DAVI - LVAD=left ventricular assist device) por tiempo prolongado.
Tiene la ventaja de ser pequeña y liviana (pesa unos 200 gramos), tener bajo consumo de energía, ser de simple colocación, implantándose en la punta del VI y la aorta ascendente, y producir escasa hemólisis por su suave mecanismo de acción.
Se ha empleado por tiempo variable de días a años, sirviendo en algunos pacientes de puente al TxC, a la recuperación ventricular o como terapia de destino.
Tiene bajo índice de infección. Se han visto fenómenos de sangrado tardío, episodios de isquemia cerebral transitorios y tromboembólicos.
Las causas de muerte durante la asistencia, fueron principalmente el FMO (o sea que mantener un flujo adecuado no asegura que no se presente esta complicación, más aún si el síndrome de respuesta inflamatoria sistémica -SRIS- ya está avanzado), el accidente cerebrovascular y el fallo de VD.
8- Impella Recover LP 2,5 - 5,0 y 10,047,48,51,52,59-68,70-76,207
Es una bomba centrífuga, miniaturizada, electromagnética e intravascular que genera un flujo axial, siendo útil para asistir al VI, VD o ambos (DAVI / DAVD-right ventricular assist device / DABV - biventricular assist device) por corto tiempo.
El equipo para soportar el VD pesa 17 gramos, y puede dar un flujo de hasta 6 L/min. Se conecta desde la AD a la pulmonar, permitiéndole al VD descansar y recuperarse. Es útil en pacientes con reducción severa de la función del VD postcirugía de by pass aorto-coronario, TxC o de otra causa. El dispositivo para soportar al VI pesa 8 gramos y puede dar un flujo de hasta 5 L/min.
Es un dispositivo de bajo costo y fácil de implantar ya que no requiere CEC. Se coloca por vía percutánea y en el caso de asistir al VI se introduce a través de la aorta ascendente, penetrando al VI a través de la válvula aórtica, para que lo descargue drenando la sangre por medio de un graft vascular en la aorta ascendente, con un flujo continuo de 3-5 L/min a 30.000 rpm, permitiendo incrementar el volumen minuto cardíaco en ± 1,4 L/min.
Es útil para asistir pacientes por corto tiempo, sirviendo por ejemplo como puente para ser usada precozmente en pacientes con fallo multiorgánico, por ser un método efectivo, seguro y poco costoso. Se utiliza como puente para recuperar al paciente para ser evaluado para TxC o intentar, si fuera necesario, hacer un soporte más prolongado y costoso.
También, se puede emplear como puente para recuperación ventricular en pacientes con shock cardiogénico o reducción severa de la función del VI y síndrome de bajo volumen minuto cardíaco postcardiotomía que no puede separarse de la CEC o post reemplazo de válvula aórtica con prótesis biológica, o que padece de miocarditis, IAM. Puede asociarse al balón de contrapulsación intraaórtica para transformar el flujo continuo en pulsátil.
También, es útil como puente al TxC o en caso de disfunción temprana del graft, empleándose como puente a la recuperación o al retrasplante. Se ha utilizado soporte biventricular en pacientes trasplantados con disfunción del graft. Se puede emplear como puente hasta decidir qué es lo más conveniente para el paciente y también como soporte en individuos de alto riesgo que van a ser sometidos a cirugía de revascularización coronaria o angioplastia (donde hasta ahora sólo se empleaba el balón de contrapulsación intraaórtico) o bien para ACM prolongada.
El ecocardiograma bi y tridimensional es útil antes, durante y después del implante, permitiéndonos descartar alteraciones anatómicas que contraindiquen su uso. Además permite monitorizar el posicionamiento del dispositivo intracavitario y detectar un mal funcionamiento del mismo y controlar al paciente para evaluar la carga del VI, lo cual es necesario para optimizar la función de la bomba.
La sobrevida promedio es del 50%, fundamentalmente en pacientes con un volumen minuto cardíaco residual de 1 L/min o más.
El soporte con este sistema se ha mantenido hasta un máximo de 14 días, si bien algunos lo han prolongado hasta 60 días.
No induce ni aumenta insuficiencia aórtica y tendría bajo índice de complicaciones como hemólisis y trombocitopenia. Requiere escasa o ninguna anticoagulación sistémica.
La causa más importante de muerte es la sepsis (Figura 10).
9- Micromed DeBaky48,122,131,138,144,167
Es un DAVI implantable de flujo axial continuo de segunda generación que emplea una pequeña bomba con la tecnología del impeller. Su peso es de 93 gramos.
Es útil para asistir paciente con fallo cardíaco terminal o shock cardiogénico que no se pueden compensar, a pesar de recibir un tratamiento adecuado con catecolaminas y balón de contrapulsación o bien que no pueden ser destetados de los mismos pudiendo servir como puente al TxC, a la recuperación ventricular o terapia de destino.
Tiene las ventajas de ser silencioso, tener bajo índice de infección y de falla del dispositivo. En cuanto a la incidencia de trombosis de la bomba y fenómenos de tromboembolismo se pueden reducir con el uso de elementos revestidos con heparina.
10- LionHeart122,130,141
Es también un DAVI de segunda generación y flujo axial continuo, con la tecnología del Impeller y una durabilidad de 2-3 años. Este dispositivo es el único totalmente implantable o sea que no requiere de líneas percutáneas que son la principal fuente de infección, por lo tanto tienen menor incidencia de infección que los otros dispositivos, pudiendo asentar la misma a nivel de la herida quirúrgica del implante o producirse durante el cambio de baterías.
Es útil en pacientes con fallo cardíaco terminal o shock cardiogénico que no se compensan a pesar del tratamiento con catecolaminas y balón de contrapulsación o bien no pueden ser destetados de los mismos y no son candidatos a TxC, ya sea por la edad (mayores de 60-65 años) u otra condición patológica, viéndose beneficiados en su sobrevida y calidad de vida con el empleo de este dispositivo de soporte como terapia definitiva.
11- Orqis Medical Cancion CRS156
Es un novedoso sistema de asistencia que consta de un circuito percutáneo de bajo flujo que asegura un aumento continuo del flujo aórtico,m permitiendo mejorar el GC, reducir la presión wedge (presión de enclavamiento o presión capilar pulmonar) y los diámetros auriculares y ventriculares a las 24-72 horas postimplante, manteniendo un flujo de 1,2 - 1,5 L/minuto.
Es útil en pacientes con fallo cardíaco agudo que después de 24 horas de evolución presentan un bajo GC (IC) y/o creatinina elevada a pesar del tratamiento instituido con inotrópicos y diuréticos.
La bomba toma la sangre por una cánula colocada es la arteria femoral y la vuelca en la aorta terminal a través de un pigtail colocado por vía percutánea, o en la arteria axilar a través de un graft colocado en ella.
El tiempo promedio de utilización del procedimiento fue de 72 horas.
12- ECMO1,5,15,18,34-38,79,96
Es el procedimiento de primera elección para soportar neonatos, pacientes pediátricos y pacientes jovenes recuperables. En efecto, en estos grupos de pacientes, muchos autores prefieren hacer un rescate inicial empleando ECMO, mientras hacen una correcta evaluación de los mismos, ya que se ha visto que tienen la misma sobrevida que si emplearan otros dispositivos de DAVI. Sólo si estos pacientes logran mejorar su hemodinamia, la función de sus órganos y son aptos para TxC, serán soportados con otro DAVI como puente al TxC, teniendo en cuenta que los dispositivos pediátricos no son implantables.
El ECMO permite hacer soporte circulatorio y respiratorio al mismo tiempo, pero tiene la desventaja de que sólo puede ser usado por algunas semanas, debido a la alta incidencia de hemólisis, mientras que los modernos sistemas neumáticos de asistencia ventricular (Medos, Berlin Incor, Thoratec) pueden usarse durante meses, siendo razonable pasar al paciente a uno de ellos si se desea mantener como puente al TxC o hasta que se recupere la función ventricular.
La técnica consiste en canular al paciente a nivel veno-arterial, ya sea central (AD y aorta descendente) o periférico (vena femoral común y arteria femoral) o veno-venoso.
Se conecta a una bomba de flujo continuo y se intercala un oxigenador, teniendo en cuenta que cuando se emplea un oxigenador de membrana siliconado se debe emplear una bomba roller ya que tienen alta resistencia para flujos elevados de sangre, siendo mayor la posibilidad de hemólisis.
Se han estudiado oxigenadores de fibra hueca que tienen baja resistencia al flujo y permiten emplear bombas centrífugas, lo que asegura menos hemólisis y un adecuado intercambio gaseoso con un flujo de 3 L/min.
Se anticoagula con heparina comenzando después de resuelto el sangrado, para mantener un tiempo de coagulación activado (ACT) de 180-220 seg.
El flujo de la bomba se aumenta progresivamente hasta que se logra bloquear la oxigenación pulmonar, manteniendo una saturación de oxígeno en sangre arterial de 80-90% y teniendo en cuenta que el filtro se debe cambiar cuando no se obtenga un adecuado intercambio gaseoso. Está indicado cuando a pesar de una adecuada asistencia respiratoria mecánica (ARM), tenemos:
- Shunt > del 30%, lo que equivale a una saturacion de oxígeno en sangre arterial menor del 95% con una FIO2 de 1.
- Presón parcial de anhidrido carbónico en sangre arterial > de 44 mm Hg.
- Compliance pulmonar < de 40 ml/cm de agua.
Esta técnica se emplea en:
- Niños con síndrome de membrana hialina o IC severa, que no responden al tratamiento convencional.
- Niños y adultos con síndrome de distress respiratorio de cualquier etiología.
- Pacientes con Tx pulmonar o cardiopulmonar que sufren una disfunción severa del graft pulmonar.
Los principales factores de riesgo para mortalidad son el desarrollo de insuficiencia renal o FMO.
Las causas más frecuentes de muerte son la FMO y la necrosis intestinal.
El weaning, o separación del ECMO, se planifica cuando el paciente comienza a recuperarse de la patología de base que determinó su colocación, bajando lentamente el flujo de la bomba y comprobando que el paciente puede mantener un adecuado GC, gases en sangre y oxigenación tisular.
Controles
Se deben monitorizar estrechamente:
- VMC.
- Precarga y postcarga.
- Gases en sangre arterial y venosa (saturación de oxígeno en sangre venosa central - SvcO2 > de 70% lo que indica buena oxigenacion tisular).
- Anión Gap.
- Nivel de lacticidemia.
- Glucemia.
- Coagulación.
B- Bombas de flujo pulsátil
Los sistemas pulsátiles empleados durante los últimos 20 años son de gran tamaño y tienen mayor incidencia de complicaciones tromboembólicas, mayor incidencia de infección y menor durabilidad que los de flujo continuo, por lo cual en los últimos 2 años se ha trabajado más con bombas rotativas de tamaño reducido y flujo axial que son más durables y resistentes a la infección, aunque requerirían mayor anticoagulación por la tendencia a la trombosis de la bomba, surgiendo los DAVI de segunda y tercera generación útiles como puente al TxC y terapia de destino19,54,84,110,115-118,134,138.
Sin embargo, estudios realizados han demostrado que el flujo pulsátil, a diferencia del continuo, se acompaña de una disminución en la activación de la cascada renina-angiotensina-aldosterona, o bien de un mayor clearance, lo que lo haría de elección en estos pacientes donde el nivel elevado de renina es considerado perjudicial para la recuperación del VI. Además, el flujo pulsátil produciría menor activación leucocitaria y respuesta inflamatoria, menos shunt y menos edema tisular.
Si bien, el flujo pulsátil descarga mejor al VI y reduce mejor sus diámetros, ambas formas de soporte permiten normalizar marcadores celulares de disfunción ventricular, como el factor alfa de necrosis tumoral miocárdico (FNT alfa) y el BNP.
Ambos sistemas, pulsátil y continuo, producen también una mejoría neurocognitiva equivalente.
Aproximadamente, un 1% de los pacientes sometidos a cirugía a corazón abierto no se pueden separar de la CEC y alrededor de un 20% de los candidatos a TxC mueren en lista de espera. Los 5 sistemas neumáticos y pulsátiles más importantes, que permiten dar una solución a este problema son Thoratec, Novacor, Thermetics, Symbion y Abiomed, y ninguno es óptimo para todos los pacientes, por lo que es conveniente conocer sus características para seleccionar el mejor en cada caso.
1- Thoratec5-7,49,50,77,81-85,92,94,96,99,101,103,105,106,108-113,121,139
Es un dispositivo de asistencia uni o biventricular paracorpóreo, que cuenta con una consola neumática para hacerlo funcionar y dos ventrículos de poliuretano con válvulas mecánicas, con una capacidad de 65 cm3/latido, dando un volumen minuto máximo de 7,5 L/min.
El dispositivo se conecta por un lado a la AI o VI y/o AD o VD y por el otro a la arteria aorta y/o pulmonar, habiéndose comprobado que cuando se cánula el VI en lugar de la AI en el modo lleno/vaciado, se obtiene una mejor perfomance traducida por un mejor flujo del dispositivo con baja precarga, menor presión de vacum y menor duración sistólica.
Puede funcionar de tres modos:
- Manual: es asincrónico, se caracteriza por tener una frecuencia fija predeterminada por el operador y un volumen variable.
- Sincronizado con el electrocardiograma (ECG) que equivale al contrapulsador.
- Vaciado gatillado por llenado: eyectando el volumen completo una vez que se llenó el ventrículo. Es el más empleado. Tiene una frecuencia variable que depende del volumen de llenado.
Indicaciones
Este dispositivo se ha empleado en pacientes postcardiotomía en los que no se pudo hacer el weaning de la CEC, en pacientes postrasplante con fallo del graft, pacientes con IAM, miocarditis aguda severa y también como bridge en candidatos a cirugía reparadora o TxC.
También se ha usado en niños con IC terminal, como puente hacia la recuperación ventricular o al TxC. Al igual que el HeartMate II, se ha empleado en postoperatorio de cirugía de Fontan con anastomosis cava pulmonar total cuando se complica con síndrome de bajo volumen minuto cardíaco, conectándolo desde la cava superior e inferior a la AP.
Su utilización le permite al paciente prevenir o recuperarse de la FMO.
Tiene bajo índice de tromboembolismo e infección.
El paciente puede ser asistido durante días o años aún teniendo el ventrículo fibrilado.
Cuando se usan los dos módulos, asistencia biventricular, el rendimiento del VD siempre deberá ser menor que el del VI para no ocasionar un edema agudo de pulmón.
Anticoagulación
Se puede emplear:
1- Dextrán 40 a razón de 50 cm3/h durante 36 hs.
2- Heparina a razón de 400-1000 U/h durante 7 días.
3- Warfarina, cuando la asistencia dura semanas o meses.
El sistema paracorpóreo (DAVP) descrito precedió el desarrollo de un Thoratec implantable (DAVI) cuyas cámaras son de titanio recubiertas y permite hacer soporte uni o biventricular. La bomba de sangre es compatible con el TLC II lo que permite externar al paciente si cumple con los requisitos necesarios (Figuras 11.1 y 11.2).
2- Novacor45,49,50,74,79,82,84,90,92-99,101,109-131,134-138,177
Es un dispositivo pulsátil para asistencia ventricular izquierda, alimentado eléctricamente, que cuenta con una bomba totalmente implantable unida a la punta del VI por un lado y a la aorta ascendente o descendente por el otro. La bomba o ventrículo, se coloca en el cuadrante superior externo del abdomen conectándola a una consola externa de control que le da al paciente mayor autonomía. Otras veces, es colocada en forma intraabdominal dentro de un saco de politetra-fluoroetileno para evitar el contacto con las vísceras. Esto reduciría la frecuencia de sangrado e infecciones a nivel del bolsillo que contiene la bomba en la pared abdominal.
La cáscara del ventrículo es de poliuretano y sus válvulas de tejido pericárdico.
Hay dos modelos, el N100 que eyecta 70 cm3/latido y el N 120 que da 90 cm3/latido. Puede eyectar hasta 10 L/min, aunque el índice cardíaco (sinónimo de output device) usado es de 2,4-3,4 L/min.
Se debe evaluar muy bien el estado del VD antes de indicarlo, ya que de su buen estado depende que el VI mecánico tenga una adecuada precarga y que la asistencia no se complique con una falla del VD.
Puede funcionar, al igual que el dispositivo anterior, de tres modos:
- Con frecuencia fija (asincrónico con el latido natural).
- Sincrónico con el ECG como un contrapulsador.
- Vaciado completo gatillado por el llenado de la cámara.
Este último modo, en contrapulsación sincrónica y automática es el más utilizado, haciendo que se llene durante la sístole ventricular y se vacíe durante la diástole.
Indicaciones
Este dispositivo es útil en pacientes entre los 15-65 años de edad con superficie corporal entre 1,5-2,5 m2.
Se ha usado principalmente como puente al TxC para estabilizar la hemodinamia del paciente y evitar el deterioro de sus órganos, pero también se ha empleado en pacientes con IC refractaria al tratamiento.
Permite hacer una asistencia prolongada, cuya duración puede ir de 1 día a 6 años, con una sobrevida al año del 52%, comparada con el 25% que se obtiene con tratamiento médico.
Estudiando el cross match de los pacientes que lo emplean como puente al TxC con la técnica de anticuerpos contra panel, se ha comprobado que la ACM no sensibiliza al receptor, si bien a veces se ha observado la aparición de anticuerpos (Ac) que aumentan rápidamente al comienzo, pero luego decrecen, siendo la sobrevida postrasplante similar al grupo de pacientes que no recibió ACM. Asimismo también, se ha comprobado en algunos estudios, que los pacientes trasplantados que reciben transfusiones tienen menor incidencia de rechazo agudo del graft.
Contraindicaciones
- Enfermedad parenquimatosa pulmonar o HTP > de 6 UW.
- Falla ventricular derecha primaria o secundaria a enfermedad pulmonar.
- Insuficiencia renal o hepática irreversible.
- Válvula aórtica protésica.
- Discrasia sanguínea que pueda ocasionar hemorragia incontrolable.
- Cáncer con metástasis.
- Enfermedad vascular periférica sintomática.
- Enfermedad cerebrovascular sintomática.
Complicaciones
Se pueden presentar las siguientes complicaciones: infección, hemorragia, taponamiento cardíaco, accidente cerebrovascular (ACV) y FMO.
Tiene bajo índice de hemólisis y tromboembolismo, pero se ha comprobado que produce cambios en la forma de los glóbulos rojos, tornándolos más rígidos, afectando la microcirculación y aumentando la viscosidad sanguínea.
El empleo de un conducto de alimentación de politetra-fluoroetileno en lugar de poliéster, en pacientes asistidos con Novacor ha reducido significadamente la incidencia de ACV embólico (10% vs 23%).
Es el sistema que tiene menor incidencia de reparación y reemplazo, en pacientes que requieren asistencia prolongada (Figura 12).
3- HeartMate I9,49,50,55,56,121,129,131,137,199-201
Termo Cardiosystems (TCI) HeartMate vented electric (VE).
Es un DAVI que consta de una cámara de titanio recubierta con poliuretano, tiene válvulas biológicas y su superficie es rugosa, permitiendo desarrollar con el tiempo una pseudoíntima que disminuye el riesgo de trombosis y evita el uso de anticoagulantes.
Tiene una capacidad de 80 cm3/latido y la eyección máxima es de 10 L/min.
Al igual que el anterior es totalmente implantable, colocándolo en paralelo al corazón del receptor por toracotomía mediana, pudiendo funcionar accionado por:
- Aire: que es enviado desde una consola externa. Se usa cuando es empleado por un corto tiempo.
- Electricidad: por medio de un motor colocado dentro de la bomba y alimentado por baterías por vía percutánea. Se usa cuando es utilizado por tiempo prolongado.
La bomba puede funcionar en forma automática, acoplado al ECG, o por llenado (permitiendo adaptarse al ejercicio, fiebre, estrés).
Este sistema permite una asistencia prolongada, siendo el único sistema aprobado para terapia de destino. Los fenómenos de sangrado, infección y tromboembolismo son poco frecuentes y en algunas instituciones han tenido menor incidencia que con el Novacor. Se han visto con poca frecuencia complicaciones tales como mediastinitis, peritonitis asociada con el dispositivo, perforación de colon, hernia diafragmática postrasplante y requerimiento de reoperación para cambiar el equipo por desperfectos (Figura 13).
4- Jarvik7-Symbion CAT-CardioWest7,49,51,69,79,82,84,97,163,164,169-190
Constituye el mismo dispositivo que nació con el nombre de Jarvik 7 y evolucionó con los años a Symbion CAT y finalmente a CardioWest.
Es un dispositivo neumático, pulsátil y ortotópico que reemplaza totalmente a ambos ventrículos enfermos, efectuando una ventriculectomía bilateral, a diferencia de los otros sistemas, que sólo asisten a los ventrículos, pero no los reemplazan.
Permite hacer una asistencia circulatoria biventricular, siendo manejado por una consola externa.
Es de simple diseño, con válvulas de entrada y salida a los ventrículos más grandes que la de otros dispositivos lo que permite alcanzar un VMC de 6-8 L/min, aun con los ventrículos fibrilados, reduciendo las presiones de llenado y mejorando la perfusión tisular, lo que lleva a una rápida recuperación del paciente.
El CardioWest fue diseñado y probado como un corazón artificial permanente y el primer dispositivo utilizado como terapia de destino, aunque actualmente se emplea especialmente como puente al TxC.
Se debe usar en pacientes con una superficie corporal mínima de 1,5-1,7 m2, siendo útil como puente al TxC en quienes presentan fallo biventricular y para rescatar pacientes con IC severa, especialmente, con claudicación del VD y RVP elevada o edema agudo de pulmón y disfunción renal o hepática secundaria al bajo GC. También es útil en aquellos pacientes que presentan severo daño miocárdico ya sea postinfarto, por rechazo del implante cardíaco, enfermedad de válvula nativa o mecánica y en pacientes con arritmias intratables.
La incidencia de fenómenos tromboembólicos, ACV e infección no varía respecto de otros dispositivos como el Thoratec o Novacor. Las complicaciones por sangrado pueden alcanzar un 17% con alto requerimiento de transfusiones y reoperaciones pero no se han producido muertes por sangrado.
El avance tecnológico ha permitido la miniaturización y facilitado la portación de este sistema de soporte, pudiendo enviar a los pacientes a su domicilio con el Cardiowest CAT, permitiendo considerar su empleo por tiempo prolongado como terapia de destino.
Las complicaciones más frecuentes son el sangrado, la infección (mediastinitis) y el tromboembolismo, el cual se previene con el agregado de anticoagulantes. Sin embargo, comparado con otros dispositivos, la incidencia de infecciones y fenómenos embólicos con secuela neurológica son menos frecuentes.
La mortalidad se debe habitualmente a sepsis, mal funcionamiento del dispositivo y FMO por el deterioro previo al implante. En efecto, el 80% de los pacientes que murieron por FMO tenían al menos 3 criterios de disfunción orgánica antes del implante, definiendo dicha disfunción por la necesidad de asistencia respiratoria mecánica por más de tres días, bilirrubina total y creatinina mayores de 2 mg%, recuento de plaquetas menor de 80.000/cm3, protrombina menor del 50% y alteraciones del sistema nervioso central (Figura 14).
5- AbioCor187
Al igual que el anterior es un dispositivo neumático, pulsátil y ortotópico que reemplaza totalmente ambos ventrículos enfermos. Fue diseñado como terapia de destino, para reemplazar en forma permanente el corazón dañado en aquellos pacientes con severa falla biventricular que no son candidatos para un TxC, permitiéndonos dar el alta domiciliaria de los mismos.
A diferencia de este dispositivo, el CardioWest se emplea en aquellos pacientes que siendo candidatos a trasplante se descompensan, requiriendo de un sistema de ACM como puente al trasplante, permitiéndonos a su vez dar de alta al paciente.
6- Berlin Heart Excor5,94,96-100,103,105,108,122,139,191-196
Es un dispositivo extracorpóreo, neumático y de flujo pulsátil, que tiene la particularidad de ser producido en tamaño pediátrico, siendo útil para asistencia uni o biventricular en niños desde los 3 meses de edad, con 7 Kg de peso, 0,70 m2 de superficie corporal y hasta los 18 años de edad, al igual que el Thoratec (cuyo ventrículo pediátrico tiene una capacidad de 13 cm3), Medos HIA y Biomedicus para asistencia uni o biventricular (con canulación biapical) y el Novacor para asistencia ventricular izquierda.
Se emplea con bombas y cánulas revestidas con heparina y anticoagulando al paciente.
La sobrevida obtenida con los sistemas de asistencia ventricular es mejor que con el ECMO (50% vs 45%), siendo la sobrevida del 70-80% en pacientes con cardiomiopatías y miocarditis, pero sólo del 27% en pacientes con cardiopatía congénita.
Es útil para ser empleado como bridge al TxC, para lograr la recuperación del VI o como terapia de destino. Las principales complicaciones son sangrado, eventos tromboembólicos e infección.
7- Abiomed BVS 5000 (BioCor)51,84,87,120,124,140,143-152,155-162
Es un dispositivo neumático de asistencia ventricular que cuenta con una bomba pulsátil y paracorpórea, manejada automáticamente por volumen que permite asistir el VI, el VD o ambos.
Cuando el paciente está en reposo, se emplea una bomba que tiene dos cámaras, una superior que es un reservorio pasivo que se llena por gravedad desde las aurículas y otra inferior que es la cámara de bombeo o ventrículo, con válvulas de entrada y salida, que al llenarse eyecta la sangre hacia las arterias pudiendo alcanzar un VMC de hasta 6 L/min.
El hecho de ser un dispositivo paracorpóreo nos permite ajustar visualmente el volumen de carga, del cual dependerá el volumen minuto del sistema, alcanzando la precarga óptima con una presión auricular media de alrededor de 5 mm Hg, lo que corresponderá a una precarga de unos 20 mm Hg en el paciente. Si se superan estos valores puede aparecer o agravar se la insuficiencia de las válvulas aurículo-ventriculares.
Cuando el paciente deambula, se deberá emplear otro ventrículo, el cual se carga por vacum.
El peso del ventrículo cuando se permanecer en reposo es de 1,6 Kg, y cuando se deambula es de 300 gramos; además, ambos pueden intercambiarse. El peso de la consola es de 43 Kg.
Este dispositivo se puede usar para hacer ECMO, con la ventaja de que mantiene su flujo pulsátil a pesar del oxigenador, logrando una mejor perfusión renal y periférica. También, es útil para asistir por corto tiempo, ya sea que se espere una recuperación ventricular o bien como puente al TxC, a pacientes con fallo cardíaco agudo, shock cardiogénico post IAM con o sin defecto interventricular o de otra etiología, como por ejemplo: una miocarditis aguda. Se ha descrito mayor mortalidad en pacientes postcardiotomía.
Además, algunos pacientes con shock cardiogénico post IAM, fueron sometidos a cirugía de revascularización coronaria una vez puestos en DAVI y con el corazón latiendo.
La complicación más frecuente es el tromboembolismo, originado en la aurícula, el ventrículo o el sitio donde se implanto la cánula (Figura 15 y 16) (Algoritmo 1).
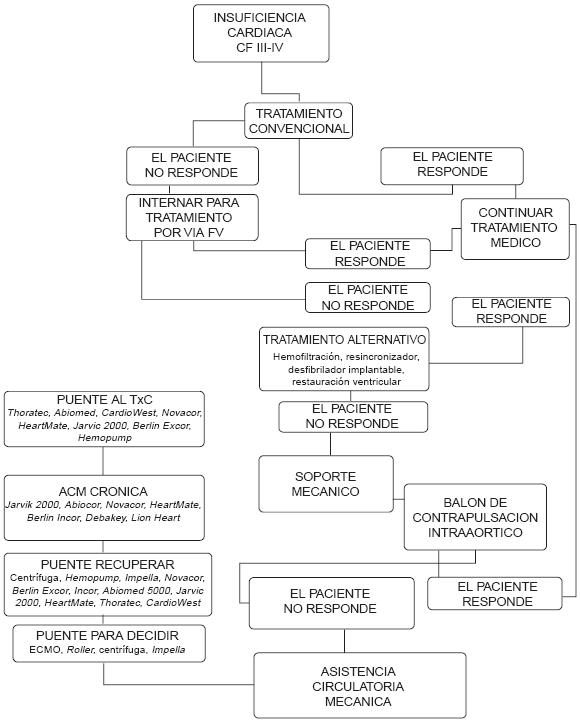
Algoritmo 1. Terapéutica de la insuficiencia cardíaca Clase Funcional (CF) III-IV.
1. Pavie A, Leprince P, Bonnet N, Leger P, Gandjbakhch I. What's new in mechanical circulatory assistance: from clinical indications to material. Arch Mal Coeur Vaiss 2006;99(2):164-70. [ Links ]
2. De Rose JJ Jr., Umana JP, Argenziano M, et al. Implantable left ventricular assist devices provide an excellent outpatient bridge to transplantation and recovery. J Am Coll Cardiol 1997;30(7):1773-7. [ Links ]
3. Park SJ, Tector A, Piccioni W, et al. Left ventricular assist devices as destination therapy: a new look at survival. J Thorac Cardiovasc Surg 2005;129(1):9-17. [ Links ]
4. Birks EJ, Yacoub MH, Banner NR, Khaghani A. The role of bridge to transplantation: should LDAV patients be transplanted? Curr Opin Cardiol 2004;19(2):148-53. [ Links ]
5. Ishino K, Alexi-Meskishvili V, Weng Y, et al. Mechanical circulatory support for post cardiotomy cardiogenic shock in infants. Asaio J 1996;42(5):M735-8. [ Links ]
6. Tatou E, Gomez MC, Leneuf P, et al. Cardiogenic shock complicating extensive infarction with ventricular septal defect. Circulatory assistance and heart transplantation. Arch Mal Coeur Vaiss 2001;94(3):236-40. [ Links ]
7. Hendry PJ, Masters RG, Mussivand TV, et al. Circulatory support for cardiogenic shock due to acute myocardial infarction: a Canadian experience. Can J Cardiol 1999;15(10):1090-4. [ Links ]
8. Kshettry VR, Salerno CT, Bank AJ. Risk of left ventricular assist device as a bridge to heart transplant following postinfarction ventricular septal rupture. J Card Surg 1997;12(2):93-7. [ Links ]
9. Oz MC, Argenziano M, Catanese KA, et al. Bridge experience with long-term implantable left ventricular assist devices. Are they an alternative to transplantation? Circulation 1997;95(7):1844-52. [ Links ]
10. Morgan JA, John R, Lee BJ, Oz MC, Naka Y. Is severe right ventricular failure in left ventricular assist device recipients a risk factor for unsuccessful bridging to transplant and post-transplant mortality. Ann Thorac Surg 2004;77(3):859-63. [ Links ]
11. Dang NC, Topkara VK, Mercando M, et al. Right heart failure after left ventricular assist device implantation in patients with chronic congestive heart failure. J Heart Lung Transplant 2006;25(1):1-6. [ Links ]
12. Kaul TK, Fields BL. Postoperative acute refractory right ventricular failure: incidence, pathogenesis, management and prognosis. Cardiovasc Surg 2000;8(1):1-9. [ Links ]
13. Klodell CT, Staples ED, Aranda JM, Jr., et al. Managing the post-left ventricular assist device patient. Congest Heart Fail 2006;12(1):41-5. [ Links ]
14. Schmid C, Radovancevic B. When should we consider right ventricular support? Thorac Cardiovasc Surg 2002;50(4):204-7. [ Links ]
15. Chen YS, Ko WJ, Lin FY, et al. Preliminary result of an algorithm to select proper ventricular assist devices for high-risk patients with extracorporeal membrane oxygenation support. J Heart Lung Transplant 2001;20(8):850-7. [ Links ]
16. Macoviak J, Stephenson LW, Edmunds LH, Jr., Harken A, MacVaugh H, 3rd. The intraaortic baloon pump: an analysis of five years' experience. Ann Thorac Surg 1980;29(5):451-8. [ Links ]
17. Jafarey AM, Amanullah M, Khan SA, Hasan SB. The use of intra aortic baloon pump in patients undergoing coronary artery bypass grafting at the Aga Khan University Hospital, Karachi. J Pak Med Assoc 2000;50(1):3-7. [ Links ]
18. Von Segesser LK. Cardiopulmonary support and extracorporeal membrane oxygenation for cardiac assist. Ann Thorac Surg 1999;68(2):672-7. [ Links ]
19. Takami Y, Yamane S, Makinouchi K, Glueck J, Nose Y. Mechanical white blood cell damage in rotary blood pumps. Artif Organs 1997;21(2):138-42. [ Links ]
20. Duncan JM, Frazier OH, Radovancevic B, Velebit V. Implantation techniques for the Hemopump. Ann Thorac Surg 1989;48(5):733-5. [ Links ]
21. Siess T, Reul H, Rau G. Concept, realization, and first in vitro testing of an intraarterial microaxial blood pump. Artif Organs 1995;19(7):644-52. [ Links ]
22. Frazier OH, Myers TJ, Westaby S, Gregoric ID. Clinical experience with an implantable, intracardiac, continuous flow circulatory support device: physiologic implications and their relationship to patient selection. Ann Thorac Surg 2004;77(1):133-42. [ Links ]
23. Zink M, ObePCPalder PJ, Gombotz H. Successful temporary left ventricular assistance with the hemopump assist device during acute myocardial infarction after complex mitral valve surgery. Intensive Care Med 2000;26(11):1710. [ Links ]
24. Peterzen B, Lonn U, Babic A, Granfeldt H, Casimir-Ahn H, Rutberg H. Postoperative management of patients with Hemopump support after coronary artery bypass grafting. Ann Thorac Surg 1996; 62(2): 495-500. [ Links ]
25. Mihaljevic T, Leskosek B, von Segesser LK, Tonz M, Turina M. Hemodynamic properties of the hemopump. Helv Chir Acta 1994;60(6):1159-62. [ Links ]
26. Takahama T, Kanai F, Hiraishi M, Onishi K, Yamazaki Z, Suma K, Asano K, Kazama M. Long-term non heparinized left heart bypass (LHB): centrifugal pump or roller pump. Trans Am Soc Artif Intern Organs 1985;31:372-6. [ Links ]
27. Dembitsky WP, Daily PO, Raney AA, Moores WY, Joyo CI. Temporary extracorporeal support of the right ventricle. J Thorac Cardiovasc Surg 1986;91(4):518-25. [ Links ]
28. Gaines WE. Perioperative right heart failure: treatment. Cardiovasc Clin 1987;17(2):231-8. [ Links ]
29. Park SB, Liebler GA, Burkholder JA, et al. Mechanical support of the failing heart. Ann Thorac Surg 1986;42(6):627-31. [ Links ]
30. O'Neill MJ, Jr., Chrostowski AM, Harrison LH, Jr. A rapid method for determining the need for mechanical support of the right ventricle. Ann Thorac Surg 1988;46(1):106-7. [ Links ]
31. Mesana T, Monties JR, Blin D, Goudard A, Mouly-Bandini A, Cornen A. Thromboembolytic complications during circulatory assistance with a centrifugal pump in patients with valvular prostheses. ASAIO Trans 1990;36(3):M525-8. [ Links ]
32. Andersen KS, Nygreen EL, Grong K, Leirvaag B, Holmsen H. Comparison of the centrifugal and roller pump in elective coronary artery bypass surgery-a prospective, randomized study with special emphasis upon platelet activation. Scand Cardiovasc J 2003;37(6):356-62. [ Links ]
33. Reiss N, El-Banayosy A, Mirow N, Minami K, Korfer R. Implantation of the Biomedicus centrifugal pump in post-transplant right heart failure. J Cardiovasc Surg (Torino) 2000;41(5):691-4. [ Links ]
34. Nance JR, Sistino JJ. Heparin-coated adult ECMO vs. ventricular assist devices: a decision analysis modeling approach. J Extra Corpor Technol 2006;38(1):33-7. [ Links ]
35. Hazekamp MG. Mechanical circulatory support after paediatric cardiac surgery. Ned Tijdschr Geneeskd 2006;150(8):413-4. [ Links ]
36. Gow KW, Wulkan ML, Heiss KF, et al. Extracorporeal membrane oxygenation for support of children after hematopoietic stem cell transplantation: the Extracorporeal Life Support Organization experience. J Pediatr Surg 2006;41(4):662-7. [ Links ]
37. Chou NK, Chi NH, Ko WJ, Yu HY, Huang SC, Wang SS, Lin FY, Chu SH, Chen YS. Extracorporeal membrane oxygenation for perioperative cardiac allograft failure. Asaio J. 2006;52(1):100-3. [ Links ]
38. Motomura T, Maeda T, Kawahito S, et al. Extracorporeal membrane oxygenator compatible with centrifugal blood pumps. Artif Organs 2002;26(11):952-8. [ Links ]
39. Steines D, Westphal D, Gobel C, Reul H, Rau G. Platelet function and hemolysis in centrifugal pumps: in vitro investigations. Int J Artif Organs 1999;22(8):559-65. [ Links ]
40. Westaby S, Banning AP, Jarvik R, et al. First permanent implant of the Jarvik 2000 Heart. Lancet 2000;356(9233):900-3. [ Links ]
41. Westaby S, Katsumata T, Houel R, et al. Jarvik 2000 Heart: potential for bridge to myocyte recovery. Circulation 1998;98(15):1568-74. [ Links ]
42. Frazier OH, Myers TJ, Gregoric ID, et al. Initial clinical experience with the Jarvik 2000 implantable axial-flow left ventricular assist system. Circulation 2002;105(24):2855-60. [ Links ]
43. Westaby S, Banning AP, Saito S, et al. Circulatory support for longterm treatment of heart failure: experience with an intraventricular continuous flow pump. Circulation 2002;105(22):2588-91. [ Links ]
44. Westaby S, Frazier OH, Pigott DW, Saito S, Jarvik RK. Implant technique for the Jarvik 2000 Heart. Ann Thorac Surg 2002;73(4):1337-40. [ Links ]
45. Frazier OH, Myers TJ, Jarvik RK, et al. Research and development of an implantable, axial-flow left ventricular assist device: the Jarvik 2000 Heart. Ann Thorac Surg 2001;71(3 Suppl):S125-32; discussion S44-6. [ Links ]
46. Martin J, Siegenthaler MP, Friesewinkel O, et al. Implantable left ventricular assist device for treatment of pulmonary hypertension in candidates for orthotopic heart transplantation-a preliminary study. Eur J Cardiothorac Surg 2004;25(6):971-7. [ Links ]
47. Kindo M, Radovancevic B, Gregoric ID, et al. Biventricular support with the Jarvik 2000 ventricular assist device in a calf model of pulmonary hypertension. Asaio J 2004;50(5):444-50. [ Links ]
48. Song, X.; Throckmorton, A. L.; Untaroiu, A.; Patel, S.; Allaire, P. E.; Wood, H. G.; Olsen, D. B. Axial flow blood pumps. Asaio J 2.003; 49(4): 355-64 [ Links ]
49. Radovancevic B, Gregoric ID, Tamez D, et al. Biventricular support with the Jarvik 2000 axial flow pump: a feasibility study. Asaio J 2003;49(5):604-7. [ Links ]
50. Copeland JG, Arabia FA, Tsau PH, et al. Total artificial hearts: bridge to transplantation. Cardiol Clin 2003;21(1):101-13. [ Links ]
51. Zareba KM. The artificial heart- past, present, and future. Med Sci Monit 2002;8(3):RA72-7. [ Links ]
52. Hoshi H, Shinshi T, Takatani S. Third-generation blood pumps with mechanical noncontact magnetic bearings. Artif Organs 2006;30(5):324-38. [ Links ]
53. Schmid C, Tjan TD, Etz C, et al. First clinical experience with the Incor left ventricular assist device. J Heart Lung Transplant 2005;24(9):1188-94. [ Links ]
54. Driessen JJ, Dhaese H, Fransen G, et al. Pulsatile compared with nonpulsatile perfusion using a centrifugal pump for cardiopulmonary bypass during coronary artery bypass grafting. Effects on systemic haemodynamics, oxygenation, and inflammatory response parameters. Perfusion 1995;10(1):3-12. [ Links ]
55. La Francesca S, Smith R, Gregoric ID, et al. Replacement of a malfunctioning HeartMate II left ventricular assist device in a 14-year-old after a sudden fall. J Heart Lung Transplant 2006;25(7):862-4. [ Links ]
56. Delgado, R.; Bergheim, M. HeartMate II left ventricular assist device: a new device for advanced heart failure. Expert Rev Med Devices. 2005;2(5):529-32. [ Links ]
57. Amir O, Bracey AW, Smart FW, Delgado RM, 3rd, Shah N, Kar B. A successful anticoagulation protocol for the first HeartMate II implantation in the United States. Tex Heart Inst J 2005;32(3):399-401. [ Links ]
58. Frazier OH, Delgado RM 3rd, Kar B, Patel V, Gregoric ID, Myers TJ. First clinical use of the redesigned HeartMate II left ventricular assist system in the United States: a case report. Tex Heart Inst J 2004;31(2):157-9. [ Links ]
59. Ramondo A, Napodano M, Tarantini G, et al. High-risk percutaneous coronary intervention using the intracardiac microaxial pump 'Impella recover'. J Cardiovasc Med (Hagerstown) 2006;7(2):149-52. [ Links ]
60. Minden HH, Lehmann H, Meyhofer J, Butter C. Transradial unprotected left main coronary stenting supported by percutaneous Impella((R)) Recover LP 2.5 assist device. Clin Res Cardiol 2006;95(5):301-6. [ Links ]
61. LaRocca GM, Shimbo D, Rodriguez CJ, et al. The Impella Recover LP 5.0 left ventricular assist device: a bridge to coronary artery bypass grafting and cardiac transplantation. J Am Soc Echocardiogr 2006;19(4):468 e5-7. [ Links ]
62. Henriques JP, Remmelink M, Baan J Jr., et al. Safety and feasibility of elective high-risk percutaneous coronary intervention procedures with left ventricular support of the Impella Recover LP 2.5. Am J Cardiol 2006;97(7):990-2. [ Links ]
63. Garatti A, Colombo T, Russo C, et al. Left ventricular mechanical support with the Impella Recover left direct microaxial blood pump: a single-center experience. Artif Organs 2006;30(7):523-8. [ Links ]
64. Valgimigli M, Steendijk P, Sianos G, OndePCPater E, Serruys PW. Left ventricular unloading and concomitant total cardiac output increase by the use of percutaneous Impella Recover LP 2.5 assist device during high-risk coronary intervention. Catheter Cardiovasc Interv 2005;65(2):263-7. [ Links ]
65. Strauch JT, Franke UF, Breuer M, et al. Technical feasibility of Impella Recover 100 microaxial left ventricular assist device placement after biologic aortic valve replacement (21 mm) for postcardiotomy failure. J Thorac Cardiovasc Surg 2005;130(6):1715-6. [ Links ]
66. Garatti A, Colombo T, Russo C, et al. Different applications for left ventricular mechanical support with the Impella Recover 100 microaxial blood pump. J Heart Lung Transplant 2005;24(4):481-5. [ Links ]
67. Catena E, Barosi A, Milazzo F, et al. Three-dimensional echocardiographic assessment of a patient supported by intravascular blood pump Impella recover 100. Echocardiography 2005;22(8):682-5. [ Links ]
68. Strecker T, Fischlein T, Pfeiffer S. Impella Recover 100: successful perioperative support for off pump coronary artery bypass grafting surgery in a patient with end-stage ischemic cardiomyopathy. J Cardiovasc Surg (Torino) 2004;45(4):381-4. [ Links ]
69. Pavie A, Leger P, Regan M, et al. Clinical experience with a total artificial heart as a bridge for transplantation: the pitie experience. J Card Surg 1995;10(5):552-8. [ Links ]
70. Siegenthaler MP, Brehm K, Strecker T, et al. The Impella Recover microaxial left ventricular assist device reduces mortality for postcardiotomy failure: a three-center experience. J Thorac Cardiovasc Surg 2004;127(3):812-22. [ Links ]
71. Jurmann MJ, Siniawski H, Erb M, Drews T, Hetzer R. Initial experience with miniature axial flow ventricular assist devices for postcardiotomy heart failure. Ann Thorac Surg 2004;77(5):1642-7. [ Links ]
72. Garatti A, Colombo T, Russo C, et al. Impella recover 100 microaxial left ventricular assist device: the Niguarda experience. Transplant Proc 2004;36(3):623-6. [ Links ]
73. Catena E, Milazzo F, Pittella G, et al. Echocardiographic approach in a new left ventricular assist device: Impella Recover 100. J Am Soc Echocardiogr 2004;17(5):470-3. [ Links ]
74. Catena E, Milazzo F, Merli M, et al. Echocardiographic evaluation of patients receiving a new left ventricular assist device: the Impella recover 100. Eur J Echocardiogr 2004;5(6):430-7. [ Links ]
75. Santise G, Petrou M, Pepper JR, Dreyfus G, Khaghani A, Birks EJ. Levitronix as a short-term salvage treatment for primary graft failure after heart transplantation. J Heart Lung Transplant 2006;25(5):495-8. [ Links ]
76. De Robertis F, Birks EJ, Rogers P, Dreyfus G, Pepper JR, Khaghani A. Clinical performance with the Levitronix Centrimag short-term ventricular assist device. J Heart Lung Transplant 2006;25(2):181-6. [ Links ]
77. Takatani S, Matsuda H, Hanatani A, et al. Mechanical circulatory support devices (MCSD) in Japan: current status and future directions. J Artif Organs 2005;8(1):13-27. [ Links ]
78. Nojiri C. Left ventricular assist system with a magnetically levitated impeller technology. Nippon Geka Gakkai Zasshi 2002;103(9):607-10. [ Links ]
79. Pagani FD, Lynch W, Swaniker F, et al. Extracorporeal life support to left ventricular assist device bridge to heart transplant: A strategy to optimize survival and resource utilization. Circulation 1999;100(19 Suppl):II206-10. [ Links ]
80. Farrar DJ, Chow E, Wood JR, Hill JD. Anatomic interaction between the right and left ventricles during univentricular and biventricular circulatory support. ASAIO Trans 1988;34(3):235-40. [ Links ]
81. Farrar DJ, Hill JD, Gray LA, Jr., Galbraith TA, Chow E, Hershon JJ. Successful biventricular circulatory support as a bridge to cardiac transplantation during prolonged ventricular fibrillation and asystole. Circulation 1989;80(5 Pt 2):III147-51. [ Links ]
82. Hill JD. Bridging to cardiac transplantation. Ann Thorac Surg 1989;47(1):167-71. [ Links ]
83. Farrar DJ, Lawson JH, Litwak P, CedePCPall G. Thoratec DAV system as a bridge to heart transplantation. J Heart Transplant 1990;9(4):415-22; discussion 22-3. [ Links ]
84. Ott RA, Mills TC, Eugene J, Gazzaniga AB. Clinical choices for circulatory assist devices. ASAIO Trans 1990;36(4):792-8. [ Links ]
85. Ley SJ. The Thoratec ventricular assist device: nursing guidelines. AACN Clin Issues Crit Care Nurs 1991;2(3):529-44. [ Links ]
86. McBride LR, Swartz MT, Reedy JE, Miller LW, Pennington DG. Device related infections in patients supported with mechanical circulatory support devices for greater than 30 days. ASAIO Trans 1991;37(3):M258-9. [ Links ]
87. Moroney DA, Swartz MT, Reedy JE, Lohmann DP, McBride LR, Pennington DG. Importance of ventricular arrhythmias in recovery patients with ventricular assist devices. ASAIO Trans 1991;37(3):M516-7. [ Links ]
88. Pennington DG, Reedy JE, Swartz MT, et al. Univentricular versus biventricular assist device support. J Heart Lung Transplant 1991;10(2):258-63. [ Links ]
89. Weitkemper HH, El-Banayosy A, Arusoglu L, Sarnowski P, Korfer R. Mechanical circulatory support: reality and dreams experience of a single center. J Extra Corpor Technol 2004;36(2):169-73. [ Links ]
90. Baran DA, Gass AL, Galin ID, et al. Lack of sensitization and equivalent post-transplant outcomes with the Novacor left ventricular assist device. J Heart Lung Transplant 2005;24(11):1886-90. [ Links ]
91. Bunzel B, Laederach-Hofmann K, Wieselthaler GM, Roethy W, Drees G. Posttraumatic stress disorder after implantation of a mechanical assist device followed by heart transplantation: evaluation of patients and partners. Transplant Proc 2005;37(2):1365-8. [ Links ]
92. Holman WL, Pamboukian SV, Blood M, Tallaj JA, McGiffin DC, Kirklin JK. Managing device infections: are we progressing or is infection an insurmountable obstacle? Asaio J 2005;51(4):452-5. [ Links ]
93. Joyce DL, Southard RE, Torre-Amione G, Noon GP, Land GA, Loebe M. Impact of left ventricular assist device (LDAV)-mediated humoral sensitization on post-transplant outcomes. J Heart Lung Transplant 2005;24(12):2054-9. [ Links ]
94. Kettner J, Pirk J, Netuka I, et al. Mechanical cardiac support-the first use in Czech Republic.Cas Lek Cesk 2005;144(1):38-42; Discussion. [ Links ]
95. Long JW, Kfoury AG, Slaughter MS, et al. Long-term destination therapy with the HeartMate XVE left ventricular assist device: improved outcomes since the REMATCH study. Congest Heart Fail 2005;11(3):133-8. [ Links ]
96. Minami K, Knyphausen E, Suzuki R, et al. Mechanical ventricular circulatory support in children; Bad Oeynhausen experience. Ann Thorac Cardiovasc Surg 2005;11(5):307-12. [ Links ]
97. Morris RJ, Pochettino A, O'Hara M, Gardner TJ, Acker MA. Emergent mechanical support in the community: improvement with early transplant center referral. J Heart Lung Transplant 2005;24(6):764-8. [ Links ]
98. Patel SM, Throckmorton AL, Untaroiu A, Allaire PE, Wood HG, Olsen DB. The status of failure and reliability testing of artificial blood pumps. Asaio J 2005;51(4):440-51. [ Links ]
99. Reinhartz O, Hill JD, Al-Khaldi A, Pelletier MP, Robbins RC, Farrar DJ. Thoratec ventricular assist devices in pediatric patients: update on clinical results. Asaio J 2005;51(5):501-3. [ Links ]
100.Riemer RK, Amir G, Reichenbach SH, Reinhartz O. Mechanical support of total cavopulmonary connection with an axial flow pump. J Thorac Cardiovasc Surg. 2005;130(2):351-4. [ Links ]
101.Sharma MS, Webber SA, Gandhi SK, Morell VO, Winowich S, Buchanan JR, Kormos RL. Pulsatile paracorporeal assist devices in children and adolescents with biventricular failure. Asaio J. 2005;51(5):490-4. [ Links ]
102.Shinn JA. Implantable left ventricular assist devices. J Cardiovasc Nurs 2005;20(5 Suppl):S22-30. [ Links ]
103.Suri RM, Daly RC, Dearani JA, McGregor CG. Successful use of Thoratec biventricular support in a small child awaiting cardiac transplantation. Ann Thorac Surg 2005;80(5):1920-2. [ Links ]
104.Thompson LO, Skrabal CA, Loebe M, et al. Plasma neurohormone levels correlate with left ventricular functional and morphological improvement in LDAV patients. J Surg Res 2005;123(1):25-32. [ Links ]
105.Tsukui H, Teuteberg JJ, Murali S, et al. Biventricular assist device utilization for patients with morbid congestive heart failure: a justifiable strategy. Circulation 2005;112(9 Suppl):I65-72. [ Links ]
106.Weiss WJ. Pulsatile pediatric ventricular assist devices. Asaio J 2005;51(5):540-5. [ Links ]
107.Ziv O, Dizon J, Thosani A, Naka Y, Magnano AR, Garan H. Effects of left ventricular assist device therapy on ventricular arrhythmias. J Am Coll Cardiol 2005;45(9):1428-34. [ Links ]
108.Arabia FA, Tsau PH, Smith RG, et al. Pediatric bridge to heart transplantation: application of the Berlin Heart, Medos and Thoratec ventricular assist devices. J Heart Lung Transplant 2006;25(1):16-21. [ Links ]
109.Hill JD, Reinhartz O. Clinical outcomes in pediatric patients implanted with Thoratec ventricular assist device. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu. 2006;115-22. [ Links ]
110.Kirklin JK, Holman WL. Mechanical circulatory support therapy as a bridge to transplant or recovery (new advances). Curr Opin Cardiol 2006;21(2):120-6. [ Links ]
111.Letsou GV, Sdringola S, Gregoric ID, et al. Myocardial perfusion as assessed by positron emission tomography during long-term mechanical circulatory support. Congest Heart Fail 2006;12(2):69-74. [ Links ]
112.Reiss N, El-Banayosy A, Arusoglu L, Blanz U, Bairaktaris A, Koerfer R. Acute fulminant myocarditis in children and adolescents: the role of mechanical circulatory assist. Asaio J 2006;52(2):211-4. [ Links ]
113.Samuels LE, Holmes EC, Hagan K, Gopalan R, Droogan C, Ferdinand F. The Thoratec Implantable Ventricular Assist Device (DAVI): Initial Clinical Experience. Heart Surg Forum 2006;9(4):E690-2. [ Links ]
114.Slaughter MS, Sobieski MA, Koenig SC, Pappas PS, Tatooles AJ, Silver MA. Left ventricular assist device weaning: hemodynamic response and relationship to stroke volume and rate reduction protocols. Asaio J 2006;52(3):228-33. [ Links ]
115.Zimpfer D, Wieselthaler G, Czerny M, et al. Neurocognitive function in patients with ventricular assist devices: a comparison of pulsatile and continuous blood flow devices. Asaio J 2006;52(1):24-7. [ Links ]
116.Starnes VA, Oyer PE, Portner PM, et al. Isolated left ventricular assist as bridge to cardiac transplantation. J Thorac Cardiovasc Surg 1988;96(1):62-71. [ Links ]
117.Frattini PL, Wachter C, Hung TC, Kormos RL, Griffith BP, Borovetz HS. Erythrocyte deformability in patients on left ventricular assist systems. ASAIO Trans 1989;35(3):733-5. [ Links ]
118.Hung TC, Butter DB, Kormos RL, et al. Characteristics of blood rheology in patients during Novacor left ventricular assist system support. ASAIO Trans 1989;35(3):611-3. [ Links ]
119.Reedy JE, Ruzevich SA, Swartz MT, Termuhlen DF, Pennington DG. Nursing care of a patient requiring prolonged mechanical circulatory support. Prog Cardiovasc Nurs 1989;4(1):1-9. [ Links ]
120.Al-Khaldi A, Ergina P, DeVarennes B, Lachappelle K, Cecere R. Left ventricular unloading in a patient with end-stage cardiomyopathy and medically unresponsive pulmonary hypertension. Artif Organs 2004;28(2):158-60. [ Links ]
121.Haddad M, Hendry PJ, Masters RG, et al. Ventricular assist devices as a bridge to cardiac transplantation: the Ottawa experience. Artif Organs 2004;28(2):136-41. [ Links ]
122.Jurmann MJ, Weng Y, Drews T, Pasic M, Hennig E, Hetzer R. Permanent mechanical circulatory support in patients of advanced age. Eur J Cardiothorac Surg 2004;25(4):610-8. [ Links ]
123.Kumpati GS, Cook DJ, Blackstone EH, et al. HLA sensitization in ventricular assist device recipients: does type of device make a difference? J Thorac Cardiovasc Surg 2004;127(6):1800-7. [ Links ]
124.Martin J, Siegenthaler MP, Friesewinkel O, Fader T, van de Loo A, Trummer G, Berchtold-Herz M, Beyersdorf F. Implantable left ventricular assist device for treatment of pulmonary hypertension in candidates for orthotopic heart transplantation-a preliminary study. Eur J Cardiothorac Surg 2004;25(6):971-7. [ Links ]
125.Matsumiya G, Miyamoto Y, Fukushima N, Monta O, Sawa Y, Matsuda H. Intraabdominal placement of a Novacor ventricular assist system by using an expanded polytetrafluoroethylene pouch. Ann Thorac Surg 2004;77(5):1851-3. [ Links ]
126.Mussivand T, Hetzer R, Vitali E, et al. Clinical results with an ePTFE inflow conduit for mechanical circulatory support. J Heart Lung Transplant 2004;23(12):1366-70. [ Links ]
127.Pasque MK, Hanselman T, Shelton K, Hedges R, Keohe-Huck B. Operative strategies to reduce complications in Novacor left ventricular assist device placement. J Card Surg 2004;19(4):329-35. [ Links ]
128.Potapov EV, Ignatenko S, Nasseri BA, et al. Clinical significance of PlA polymorphism of platelet GP IIb/IIIa receptors during long-term DAV support. Ann Thorac Surg 2004;77(3):869-74; discussion 74. [ Links ]
129.Raman J, Jeevanadam V. Destination therapy with ventricular assist devices. Cardiology 2004;101(1-3):104-10. [ Links ]
130.Butler J, Howser R, Portner PM, Pierson RN, 3rd. Diabetes and outcomes after left ventricular assist device placement. J Card Fail 2005;11(7):510-5. [ Links ]
131.Clegg AJ, Scott DA, Loveman E, et al. The clinical and cost-effectiveness of left ventricular assist devices for end-stage heart failure: a systematic review and economic evaluation. Health Technol Assess 2005;9(45):1-148. [ Links ]
132.Collart F, Dieuzaide P, Kerbaul F, Mouly-Bandini A, Mesana TG. Complete atrioventricular block decreases left ventricular assist device flow rate. Ann Thorac Surg 2005;80(2):716-7. [ Links ]
133.Dewald O, Schmitz C, Diem H, et al. Platelet activation markers in patients with heart assist device. Artif Organs 2005;29(4):292-9. [ Links ]
134.Faggian G, Santini F, Franchi G, Portner PM, Mazzucco A. Insights from continued use of a Novacor Left Ventricular Assist System for a period of 6 years. J Heart Lung Transplant 2005;24(9):1444. [ Links ]
135.Fernandez FG, Jaramillo A, Ewald G, et al. Blood transfusions decrease the incidence of acute rejection in cardiac allograft recipients. J Heart Lung Transplant 2005;24(7 Suppl):S255-61. [ Links ]
136.Fujita Y, Fujino Y, Matsumiya G, et al. Postoperative hyperbilirubinemia after implantation of left ventricular assist device is associated with poor postoperative liver perfusion. J Artif Organs 2005;8(1):28-33. [ Links ]
137.Kalya AV, Tector AJ, Crouch JD, et al. Comparison of Novacor and HeartMate vented electric left ventricular assist devices in a single institution. J Heart Lung Transplant 2005;24(11):1973-5. [ Links ]
138.Thohan V, Stetson SJ, Nagueh SF, et al. Cellular and hemodynamics responses of failing myocardium to continuous flow mechanical circulatory support using the DeBakey-Noon left ventricular assist device: a comparative analysis with pulsatile-type devices. J Heart Lung Transplant 2005;24(5):566-75. [ Links ]
139.Robin J, Tronc F, Curtil A, et al. Left ventricular assistance by postoperative mechanical devices in neonates. Arch Mal Coeur Vaiss 1997;90(5):661-5. [ Links ]
140.Champsaur G, Ninet J, Vigneron M, Cochet P, Neidecker J, Boissonnat P. Use of the Abiomed BVS System 5000 as a bridge to cardiac transplantation. J Thorac Cardiovasc Surg 1990;100(1):122-8. [ Links ]
141.Estanove S, Bastien O, Flamens C. Mechanical circulation assistance. Changes in techniques and concepts. Implication of anesthesia/resuscitation on patient management. Retrospective study on 159 cases. Bull Acad Natl Med 2002;186(7):1221-35; discussion 36. [ Links ]
142.Girard C, Bastien O, Clerc J, et al. Right ventricular assistance using a centrifugal pump after heart transplantation. Ann Fr Anesth Reanim 1990;9(1):79-82. [ Links ]
143.Ninet J, Vigneron M, Cochet P, Neidecker J, d'Agrosa MC, Bastien O,de Riberolles C, Champsaur G. Assisted circulation by external heterotopic prosthesis as a bridge to heart transplantation. Arch Mal Coeur Vaiss. 1990;83(10):1571-7. [ Links ]
144.Goldstein DJ. Worldwide experience with the MicroMed DeBakey Ventricular Assist Device as a bridge to transplantation. Circulation 2003;108 Suppl 1:II272-7. [ Links ]
145.Sezai A, Shiono M, Nakata K, et al. The possibility of a veno-arterial bypass system using the Abiomed BVS 5000. Artif Organs 2006;30(1):74-7. [ Links ]
146.Anderson MB, Plate JM, Krause TJ, Scholz PM. Peripheral arterial cannulation for Abiomed BVS 5000 left ventricular assist device support. J Heart Lung Transplant 2005;24(9):1445. [ Links ]
147.Samuels L, Entwistle J, Holmes E, et al. Clinical use of the abiomed BVS 5000 as a pulsatile extracorporeal membrane oxygenation unit. Asaio J 2004;50(3):234-6. [ Links ]
148.Potapov EV, Merkle F, Guttel A, et al. Transcontinental transport of a patient with an AbioMed BVS 5000 DABV. Ann Thorac Surg 2004;77(4):1428-30. [ Links ]
149.Morgan JA, Stewart AS, Lee BJ, Oz MC, Naka Y. Role of the Abiomed BVS 5000 device for short-term support and bridge to transplantation. Asaio J 2004;50(4):360-3. [ Links ]
150.Samuels LE, Entwistle JC, 3rd, Holmes EC, Parris T, Wechsler AS. Mechanical support of the unrepaired postinfarction ventricular septal defect with the Abiomed BVS 5000 ventricular assist device. J Thorac Cardiovasc Surg 2003;126(6):2100-1. [ Links ]
151.Potapov EV, Weng Y, Hausmann H, Kopitz M, Pasic M, Hetzer R. New approach in treatment of acute cardiogenic shock requiring mechanical circulatory support. Ann Thorac Surg 2003;76(6):2112-4. [ Links ]
152.Entwistle JW, 3rd, Bolno PB, Holmes E, Samuels L E. Improved survival with ventricular assist device support in cardiogenic shock after myocardial infarction. Heart Surg Forum 2003;6(5):316-9. [ Links ]
153.Castells E, Calbet JM, Saura E, et al. Acute myocardial infarction with cardiogenic shock: treatment with mechanical circulatory assistance and heart transplantation. Transplant Proc 2003;35(5):1940-1. [ Links ]
154.Fasseas P, Kutalek SP, Samuels FL, Holmes EC, Samuels LE. Ventricular assist device support for management of sustained ventricular arrhythmias. Tex Heart Inst J 2002;29(1):33-6. [ Links ]
155. Samuels LE, Holmes EC, Thomas MP, et al. Management of acute cardiac failure with mechanical assist: experience with the ABIOMED BVS 5000. Ann Thorac Surg 2001;71(3 Suppl):S67-72; discussion S82-5. [ Links ]
156.Abraham W, Wasler A, Cabuay B, Khanal S, Bartus K, Zile MR, Konstam MA. Cardiology, Henry Ford Heart & Vascular Institute, Detroit, MI; Medicine, University of Iowa, Iowa City, IA; Internal Medicine, University Hospital Saarland, Homberg, Germany; Cardiology, John Paul II Hospital, Krakow, Poland; Cardiology, Medical University of South Carolina, Charleston, SC; Cardiovascular Medicine, The Ohio State University. Clinical results with the Orqis® medical cancion® CRS™ therapy. 25th annual meeting and scientific sessions abstracts view International Society for Heart and Lung transplantation. April 2005. [ Links ]
157.LaPietra A, Grossi EA, Galloway AC, Colvin SB, Ribakove GH. Beating- heart coronary artery bypass grafting for left ventricular failure assisted by the Abiomed BVS 5000. J Card Surg 2001;16(2):170-2. [ Links ]
158.Thomas NJ, Harvey AT. Bridge to recovery with the Abiomed BVS- 5000 device in a patient with intractable ventricular tachycardia. J Thorac Cardiovasc Surg 1999;117(4):831-2. [ Links ]
159.Lachat M, Jaggy C, Leskosek B, et al. Optimized performance of the Abiomed BVS 5000: adjustment of the pump height based on Doppler control of the flow pattern. Perfusion 1999;14(1):59-67. [ Links ]
160.Sato M, Katayama Y, Higuchi S, Kosako Y, Ohtsubo S, Itoh T. Initial clinical experiences of the ABIOMED BVS SYSTEM 5000 in Japan. Jpn J Thorac Cardiovasc Surg 1998;46(2):236-42. [ Links ]
161.Sato M, Higuchi S, Kosako Y, Katayama Y, Ohtsubo S, Itoh T. A case of fulminant myocarditis treated by ABIOMED BVS 5000 biventricular support. Kyobu Geka 1998;51(6):451-6. [ Links ]
162.Marelli D, Laks H, Amsel B, et al. Temporary mechanical support with the BVS 5000 assist device during treatment of acute myocarditis. J Card Surg 1997;12(1):55-9. [ Links ]
163.Chen JM, Levin HR, Rose EA, et al. Experience with right ventricular assist devices for perioperative right-sided circulatory failure. Ann Thorac Surg 1996;61(1):305-10; discussion 11-3. [ Links ]
164.Chen JM, Levin HR, Catanese KA, et al. Use of a pulsatile right ventricular assist device and continuous arteriovenous hemodialysis in a 57-year-old man with a pulsatile left ventricular assist device. J Heart Lung Transplant 1995;14(1 Pt 1):186-91. [ Links ]
165.Kaltenbock F, Gombotz H, Tscheliessnigg KH, Matzer C, Winkler G, Auer T. Right ventricular assist device (DAVD) in septic, fulminating pulmonary artery embolism. Anaesthesist 1993;42(11):807-10. [ Links ]
166.Minami K, el-Banayosy A, Posival H, et al. Improvement of survival rate in patients with cardiogenic shock by using nonpulsatile and pulsatile ventricular assist device. Int J Artif Organs 1992;15(12):715-21. [ Links ]
167.Potapov, E. V.; Loebe, M.; Nasseri, B. A.; Sinawski, H.; Koster, A.; Kuppe, H.; Noon, G. P.; DeBakey, M. E.; Hetzer, R. Pulsatile flow in patients with a novel nonpulsatile implantable ventricular assist device. Circulation 2000; 102 (19 Suppl 3): III183-7 [ Links ]
168.Nastala CJ. Bridge to cardiac transplantation: current practice. Crit Care Nurs Q 1995;18(1):65-76. [ Links ]
169.Potapov EV, Loebe M, Nasseri BA, et al. Pulsatile flow in patients with a novel nonpulsatile implantable ventricular assist device. Circulation 2000;102(19 Suppl 3):III183-7. [ Links ]
170.Copeland JG, Pavie A, Duveau D, et al. Bridge to transplantation with the CardioWest total artificial heart: the international experience 1993 to 1995. J Heart Lung Transplant 1996;15(1 Pt 1):94-9. [ Links ]
171.Arabia FA, Copeland JG, Smith RG, et al. International experience with the CardioWest total artificial heart as a bridge to heart transplantation. Eur J Cardiothorac Surg 1997;11 Suppl:S5-10. [ Links ]
172.Pavie A, Duveau D, Baron O, et al. CardioWest, a complete artificial heart, the French experience. Chirurgie 1997;121(9-10):685-9. [ Links ]
173.Arabia FA, Copeland JG, Smith RG, et al. Infections with the Cardio- West total artificial heart. Asaio J 1998;44(5):M336-9. [ Links ]
174.Copeland JG. Current status and future directions for a total artificial heart with a past. Artif Organs 1998;22(11):998-1001. [ Links ]
175.Copeland JG 3rd, Arabia FA, Banchy ME, et al. The CardioWest total artificial heart bridge to transplantation: 1993 to 1996 national trial. Ann Thorac Surg 1998;66(5):1662-9. [ Links ]
176.Leprince P, Pavie A, Leger P, et al. The cardiowest total artificial heart: experience of 29 cases. Arch Mal Coeur Vaiss 1998;91(4):397-404. [ Links ]
177.Tsau PH, Arabia FA, Toporoff B, Paramesh V, Sethi GK, Copeland JG. Positive panel reactive antibody titers in patients bridged to transplantation with a mechanical assist device: risk factors and treatment. Asaio J 1998;44(5):M634-7. [ Links ]
178.Arabia FA, Copeland JG, Pavie A, Smith RG. Implantation technique for the CardioWest total artificial heart. Ann Thorac Surg 1999;68(2):698-704. [ Links ]
179.Arabia FA, Copeland JG, Smith RG, et al. CardioWest total artificial heart: a retrospective controlled study. Artif Organs 1999;23(2):204-7. [ Links ]
180.Copeland JG, Arabia FA, Smith RG, Sethi GK, Nolan PE, Banchy ME. Arizona experience with CardioWest Total Artificial Heart bridge to transplantation. Ann Thorac Surg 1999;68(2):756-60. [ Links ]
181.Copeland JG. Mechanical assist device; my choice: the CardioWest total artificial heart. Transplant Proc 2000;32(7):1523-4. [ Links ]
182.Copeland JG, Smith RG, Arabia FA, Nolan PE, Banchy ME. The CardioWest total artificial heart as a bridge to transplantation. Semin Thorac Cardiovasc Surg 2000;12(3):238-42. [ Links ]
183.Arabia FA. Update on the total artificial heart. J Card Surg 2001;16(3):222-7. [ Links ]
184.Arusoglu L, Reiss N, Morshuis M, Korfer R, El-Banayosy A. Implantation of CardioWest total artificial heart in irreversible acute myocardial infarction shock-new hope for patients with infaust prognosis. Z Kardiol 2003;92(11):916-24. [ Links ]
185.Copeland JG, Arabia FA, Tsau PH, Nolan PE, McClellan D, Smith RG, Slepian MJ. Total artificial hearts: bridge to transplantation. Cardiol Clin. 2003,21(1):101-13. [ Links ]
186.Leprince P, Bonnet N, Rama A, Leger P, Bors V, Levasseur JP, Szefner J, Vaissier E, Pavie A, Gandjbakhch I. Bridge to transplantation with the Jarvik-7 (CardioWest) total artificial heart: a single-center 15-year experience. J Heart Lung Transplant. 2003;22(12):1296-303. [ Links ]
187.Samuels LE, Dowling R. Total artificial heart: destination therapy. Cardiol Clin 2003;21(1):115-8. [ Links ]
188.Copeland JG, Smith RG, Arabia FA, Nolan PE, McClellan D, Tsau PH, Sethi GK, Bose RK, Banchy ME, Covington DL, Slepian MJ. Total artificial heart bridge to transplantation: a 9-year experience with 62 patients. J Heart Lung Transplant 2004;23(7): 823-31. [ Links ]
189.El-Banayosy A, Arusoglu L, Morshuis M, Kizner L, Tenderich G, Sarnowski P, Milting H, Koerfer R. CardioWest total artificial heart: Bad Oeynhausen experience. Ann Thorac Surg. 2005;80(2):548-52. [ Links ]
190.Leprince P, Bonnet N, Varnous S, et al. Patients with a body surface area less than 1.7 m2 have a good outcome with the CardioWest Total Artificial Heart. J Heart Lung Transplant 2005;24(10):1501-5. [ Links ]
191.Hetzer R, Potapov EV, Stiller B, Weng Y, Hubler M, Lemmer J, Alexi- Meskishvili V, Redlin M, Merkle F, Kaufmann F, Hennig E. Improvement in survival after mechanical circulatory support with pneumatic pulsatile ventricular assist devices in pediatric patients. Ann Thorac Surg.2006;82(3):917-24; discussion 924-5. [ Links ]
192.Potapov EV, Hetzer R. Pediatric Berlin heart excor. Ann Thorac Cardiovasc Surg 2006;12(2):155. [ Links ]
193.Hetzer R, Alexi-Meskishvili V, Weng Y, et al. Mechanical cardiac support in the young with the Berlin Heart EXCOR pulsatile ventricular assist device: 15 years' experience. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2006:99-108 [ Links ]
194.Dunnington GH Jr., Sleasman J, Alkhaldi A, Pelletier MP, Reitz BA, Robbins RC. Successful bridge to transplant using the Berlin Heart left ventricular assist device in a 3-month-old infant. Ann Thorac Surg 2006;81(3):1116-8. [ Links ]
195.Etz C, Welp H, Rothenburger M, et al. Analysis of platelet function during left ventricular support with the Incor and Excor system. Heart Surg Forum 2004;7(5):E423-7. [ Links ]
196.Schmid C, Scheld HH, Tjan TD. Biapical cannulation for biventricular support with the pneumatically driven Excor system. Asaio J 2005;51(1):126-7. [ Links ]
197.Burns GL. Infections associated with implanted blood pumps. Journal: Int J Artif Organs1993;16(11):771-6. [ Links ]
198.McBride LR, Swartz MT, Reedy JE, Miller LW, Pennington DG. Device related infections in patients supported with mechanical circulatory support devices for greater than 30 days. Journal: ASAIO Tran1991;37(3):M258-93. [ Links ]
199.Frazier OH, Duncan M, Radovancevic B, Wilansky S, Texas Heart Institute. Clinical implantation of the "Heartmate" ventricular assist device (videorecording /). Houston, Tex.: The Institute; 1990. [ Links ]
200.Sander Jensen KM, Aldershvile J, Boesgaard S, et al. Circulatory support with the mechanical heart, "HeartMate". Ugeskr Laeger 2000;162(26):3717-22. [ Links ]
201.Phillips WS, Burton NA, Macmanus Q, Lefrak EA. Surgical complications in bridging to transplantation: the Thermo Cardiosystems LDAV. Ann Thorac Surg 1992;53(3):482-5; discussion 5-6. [ Links ]
202.Saltzberg MT, Neumann A, Costanzo MR, Abstract (270) Acute Short Term Ultrafiltration Produces Sustained Hemodynamic Benefits in Acutely Decompensated Heart Failure Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
203.Bedi MS, Gujral V, Kormos R, Murali S. Cardiovascular Institute, University of Pittsburgh, Pittsburgh, PA Posters (271) Cardiac Resynchronization Therapy in end Stage Heart Failure Patients listed for Cardiac Transplant. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
204.Willians JA, Patel ND, Nwakama LU, Conte JV, Abstract (35) Surgical Ventricular Restoration versus Cardiac Transplantation: Hospital Charges, Outcomes, and Survival Analyses of Two Surgical Options for Ischemic Cardionyopathy. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Sessions. April 5 - 8. 2006. Madrid. España. [ Links ]
205.Healy AH, Kfoury AG, Nelson DM, Horne BD, Smith HK, KePCPin BA, Wecker R, Nelson KM, Renlund DG, Long JW, UCAT Artificial Heart Program, LDS Hospital, Salt Lake City, UT). Oral Sessions (102) Predictors of Long-Term Survival in Destination Therapy Left Ventricular Assist Device Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
206.El-Banayosy A, Koerfer R, Hetzer R, Wieselthaler G, Pavie A. Department of Thoracic and Cardiovascular Surgery, Heart and Diabetes Center NPCP, Bad Oeynhausen, Germany; German Heart Center Berlin, Berlin, Germany; University of Vienna, Vienna, Austria; Pitie Salpetriere Hospital, Paris, France, Posters (293) Initial Results of a European Multicenter Clinical Trial with the DuraHeart® Mag-Lev Centrifugal Left Ventricular Assist Device. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
207.John R, Liao K, Lietz K, Colvin-Adams MM, Boyle AJ, Miller LW, Joyce LD, Cardiothoracic and Cardiovasular Division, University of Minnesota, Minneapolis, MN. Posters (304) Use of the Levitronix CentriMag Ventricular Assist Device (DAV) for the Treatment of Refractory Cardiogenic Shock in Patients with End-Stage Heart Failure. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
208.El-Banayosy A, Arusoglu L, Kizner L, Morshuis M, Sarnowski P, Cobaugh D, Koerfer R, Department of Throacic and Cardiovascular Surgery, Heart and Diabetes Center NPCP, Bad Oeynhausen, Germany, Oral Session (104) Long-Term Out-of-Hospital Experience in Mechanical Circulatory Support Patients. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
209.Lietz K, Long J, Kfoury AG, Slaughter MS, Silver MA, Milano CA, Rogers J, Miller LW. Cardiovascular Division, University of Minnesota, Minneapolis, MN; Divisions of Cardiology and Cardiothoracic Surgery, LDS Hospital, Salt Lake City, UT; Divisions of Cardiology and Cardiothoracic Surgery, Advocate Christ Medical Center, Oak Lawn, IL; Divisions of Cardiology and Cardiothoracic Surgery, Duke University Medical Center, Durham NC, Plenary Session (251) The Impact of Patient Selection on Long-Term Outcomes of Left-Ventricular Assist Device Implantation as Destination Therapy for End-Stage Heart Failure. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
210.Delgado RM, Radovancevic B, Radovancevic R, Rodriguez G, Frazier OH. Center for Cardiac Support, Texas Heart Institute, Houston, Oral Session. (228) Effects of Left Ventricular Assist Devices with Different Flow Characteristics on Vasopressin Levels. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
211.Toyoda Y, McCurry KR, Hattler BG, Zenati MA, Tsukui H, Boujoukos AJ, Kormos RL. Cardiothoracic Surgery, University of Pittsburgh Medical Center, Pittsburgh, PA; Critical Care Medicine, University of Pittsburgh Medical Center, Pittsburgh, PA. Oral Session (232) Right Ventricular Assist Device Is Better Than Extracorporeal Membrane Oxygenation for Isolated Right Ventricular Failure Following Heart Transplantation. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]
212.Lietz K, Brown K, John R, Anderson D, Joyce L, Miller LW. Cardiovascular Division, University of Minnesota, Minneapolis, MN; Division of Neurology, University of Minnesota, Minneapolis, MN; Division of Cardiothoracic Surgery, University of Minnesota, Minneapolis, Oral Session. (233) The Effects of Hyperperfusion on Postoperative Neurologic Dysfunction in Recipients of Left-Ventricular Assist Device. International Society of Heart and Lung Transplantation. Twenty Sixth Annual Meeting and Scientific Session. April 5 - 8. 2006. Madrid. España. [ Links ]