Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Insuficiencia cardíaca
versão On-line ISSN 1852-3862
Insuf. card. v.3 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2008
ARTÍCULO DE OPINIÓN
¿Deben todos los pacientes con fracción de eyección menor del 30% recibir un desfibrilador implantable?
Roberto Concepción*
* Médico Cardiólogo.Unidad de Insuficiencia Cardíaca. Hospital DIPRECA. Santiago de Chile. Chile.
Correspondencia: Dr. Roberto Concepción.
Servicio de Cardiología. Hospital DIPRECA.
Av. Vital Apoquindo 1200.
Las Condes. Santiago de Chile. Chile.
E-mail: robertoedith2002@yahoo.com
Recibido: 28/11/2007
Aceptado:12/04/2008
La muerte súbita es una grave complicación de los pacientes con insuficiencia cardíaca, la gran mayoría de las veces letal y poco predecible por los métodos diagnósticos convencionales. El uso de los desfibriladores automáticos implantables previene en forma significativa esta complicación en pacientes con arritmias malignas demostrada. Algunos ensayos clínicos han mostrado que el implante de un desfibrilador disminuye la mortalidad en pacientes con disfunción sistólica severa del ventrículo izquierdo, pero sin evidencia de arritmias graves. Esto ha generado un debate en relación a si todos los pacientes con disfunción ventricular sistólica severa deben ser sometidos al implante de estos dispositivos. La presente es una revisión y discusión de los principales trabajos publicados recientemente al respecto y una visión crítica de los distintos escenarios que se han evaluado en ensayos clínicos controlados y observacionales.
Palabras clave: Muerte súbita; Insuficiencia cardíaca; Desfibriladores automáticos implantables; Disfunción ventricular.
Summary
Should every patient with an ejection fraction less than 30% receive an implantable cardioverter-defibrillator?
Sudden death is a serious complication in patients with heart failure. It is mostly lethal and poorly predictable by conventional diagnosis methods. Implantable automatic defibrillators' use prevents significantly this complication in patients with demonstrated malignant arrhythmias. Some clinical trials have shown that the implant of a defibrillator diminishes the mortality in patient with severe systolic left ventricular dysfunction, but without evidence of serious arrhythmias. This has generated a debate in relation to if all patients with severe systolic ventricular dysfunction should be subjected to the implant of these devices. The present is a revision and discussion of the main works published recently in this respect, and also a critical point of view of the different fields that have been evaluated in controlled clinical and observational trials.
Keywords: Suden death; Heart failure; Implantable automatic defibrillators; Ventricular dysfunction.
Resumo
Todos os pacientes com fração de ejeção menor de 30% devem receber um desfibrilador implantável?
A morte súbita é uma grave complicação dos pacientes com insuficiência cardíaca, a grande maioria das vezes letal e pouco predecível pelos métodos de diagnósticos convencionais. O uso dos desfibriladores automáticos implantáveis previnem de forma significativa esta complicação em pacientes com arritmias malignas demonstrada. Alguns ensaios clínicos mostraram que o implante de um desfibrilador diminui a mortalidade em pacientes com disfunção sistólica severa do ventrículo esquerdo, mas sem evidência de arritmias graves. Isto gerou um debate em relação a se todos os pacientes com disfunção ventricular sistólica severa devem ser submetidos ao implante destes dispositivos. O presente é uma revisão e discussão dos principais trabalhos publicados recentemente a respeito e uma visão crítica dos diferentes cenários que se avaliaram em ensaios clínicos controlados e observacionais.
Palavras chave: Morte súbita; Insuficiência cardíaca; Desfibriladores automáticos implantáveis; Disfunção ventricular.
Introducción
La mortalidad cardiovascular ha disminuido en la ultima década en países donde las enfermedades crónicas no transmisibles son la causa número uno de muerte; sin embargo, el numero de pacientes que fallecen por muerte súbita (MS) no se ha modificado y en algunos países se ha incrementado1. En la década del '60, los primeros estudios observacionales con registro continuo de electrocardiograma (ECG) demostraron que la inmensa mayoría de las MS eran por taquicardia ventricular (TV) y fibrilación ventricular (FV). Con el desarrollo de los sistemas ambulatorios de registro electrocardiográfico (Holter de ECG) se documentó que las arritmias ventriculares (sobre todo TV) post infarto agudo al miocardio (IAM) en presencia de disfunción sistólica ventricular izquierda (fracción de eyección -FE- < 30 ó 35%) eran predictores independientes de MS después de un IAM (Fig. 1).

Figura 1. Mortalidad en relación a la fracción de eyección en pacientes con infarto agudo de miocardio. Registros americanos y canadienses.
Objetivo
El objetivo de esta revisión es destacar los principales trabajos que han avalado el uso de desfibriladores automáticos implantables (DAI) en prevención primaria de MS de pacientes con disfunción ventricular izquierda y establecer nuestros puntos de vista respecto a la racionalidad e idoneidad de esta intervención en el contexto de disfunción sistólica severa del ventrículo izquierdo (VI).
Discusión
Como mencionamos en la introducción, estudios observacionales mostraron relación inequívoca entre arritmias ventriculares (TV/FV) disfunción sistólica del VI y MS2,3. Esta información rápidamente derivó en intentar modificar el pronóstico de estos pacientes con la supresión de arritmias ventriculares con fármacos antiarrítmicos. Trabajos realizados para probar la anterior hipótesis fallaron en demostrarlo y por el contrario resultaron estrategias peligrosas en el contexto del IAM.
El ensayo clínico denominado CAST (Cardiac Arritmia Supresión Trial) fue detenido en forma prematura por exceso de mortalidad en la rama de fármacos antiarrítmicos (flecainida/encainida), comparado con placebo4.
Evidencia de la eficacia de los DAI en prevención de muerte súbita arrítmica
Michael Mirowski desarrolló el desfibrilador automático implantable y publicó su primera experiencia en 19805. Hubo que esperar una década para evaluar en forma "randomizada" y controlada la eficacia de este dispositivo. Rápidamente la "anatomía" de los DAI se transformó de un artefacto bastante voluminoso (los primeros DAI se implantaban en el abdomen y con electrodos epicardios) a dispositivos muy similares a los marcapasos de uso rutinario.
Los primeros estudios controlados comparando DAI vs tratamiento con amiodarona (AMD) y otros agentes farmacológicos en la prevención secundaria de la MS en sobrevivientes de un paro cardíaco mostraron la superioridad del DAI6-10.
El paso siguiente fue demostrar que el DAI podía reducir la mortalidad en pacientes con enfermedad coronaria crónica y disfunción ventricular izquierda sin evidencia de TV/FV espontánea, pero inducible en un estudio electrofisiológico (EEF).
El MUSTT (Multicenter Unsustained Tachycardia Trial) y el MADIT (Multicenter Automatic Desfibrillator Implantation Trial) incluyeron pacientes con fracción de eyección (FE) menor al 40% y 35%, respectivamente; considerando que estudios pre y post trombolíticos establecían una clara diferencia entre pacientes con FEVI < 40% y mortalidad arrítmica11. En términos absolutos, la estrategia del implante de DAI en pacientes con disfunción ventricular resultó superior al tratamiento convencional en este grupo de pacientes; sin embargo, subestudios posteriores mostraron que, por ejemplo en el estudio MADIT, el subgrupo de pacientes con FE entre 26% y 35% no tuvo mejora significativa en la mortalidad, comparado el uso de DAI con tratamiento convencional post IAM, beneficiándose en forma significativa sólo los pacientes con FE por debajo del 26%12.
DAI como prevención primaria de MS en disfunción sistólica severa del ventrículo izquierdo
El estudio MADIT II fue diseñado para demostrar la superioridad del DAI vs el tratamiento óptimo de insuficiencia cardíaca (IC) en pacientes coronarios con disfunción sistólica severa.
Este ensayo clínico tuvo dos criterios diferentes de inclusión respecto a trabajos previos: FE < 30% y sin necesidad de un EEF previo a la randomización13.
Es de notar que en todos estos ensayos no era condición tener IC "sintomática" para ser enrolado; sin embargo, dos tercios de los pacientes que entraron al MADIT II tenían clase funcional (CF) según la New York Heart Association (NYHA) II-III, de manera que eran pacientes de alto riesgo no sólo por el "número" (FE del 30%), sino también por la presencia de IC sintomática.
Recientemente, el papel de los DAI en pacientes con IC cuya etiología es no isquémica (básicamente miocardiopatías dilatadas primarias) ha sido estudiado en al menos 3 grandes ensayos clínicos. El estudio CAT (German Cardiomiophathy Trial) enroló 104 pacientes con miocardiopatía no coronaria, CF II-III de la NYHA y FE promedio del 24%, no mostró superioridad el DAI vs tratamiento convencional14. Cabe destacar que en el estudio CAT, el número de pacientes es bajo y la mortalidad del grupo control fue baja, restándole poder estadístico a dicho reporte. El estudio DEFINITE (The Defibrilators In Non-Ischemic Cardiomiophathy Treatment Evaluation) incluyó 458 pacientes con FE < 35% e historia de IC sintomática (CF II-III de la NYHA) y TV espontánea no sostenida. Los pacientes fueron randomizados a DAI o tratamiento óptimo para IC (la mayoría con inhibidores de la enzima conversora de angiotensina -IECA-, beta bloqueantes y diuréticos). A los 2 años de seguimiento, la mortalidad del grupo control fue del 14,1% vs 7,9% para el grupo DAI (no significativo)15.
El trabajo llamado Sudden Cardiac Death in Heart Failure (SCD-HeFT) enroló 2521 pacientes con IC de etiología coronaria y no coronaria en CF II-III de la NYHA y FE promedio del 25%, todos con terapia óptima para IC; además, los pacientes fueron incluidos en una de las siguientes estrategias: placebo, AMD o DAI. La mortalidad a 2 años del grupo control fue del 14% y la mortalidad de pacientes asignados a DAI fue del 23% menor que los pacientes asignados a placebo en un seguimiento a 4 años (p=0,007). Los pacientes de etiología no coronaria, igualmente, se beneficiaron con el DAI. El tratamiento con AMD no consiguió beneficio alguno sobre la mortalidad en los pacientes tratados16 (Figura 2 y Tabla 1).
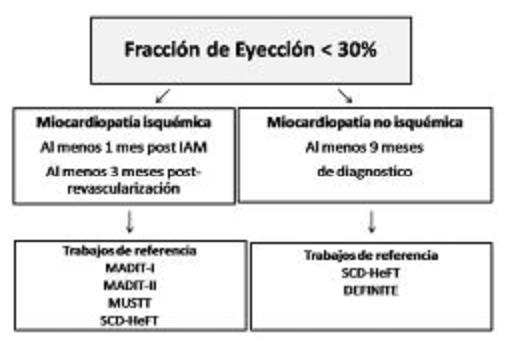
Figura 2. Indicación de desfibrilador automático implantable (DAI) en pacientes con disfunción sistólica severa en EEUU.
FE: fracción de eyección. IAM: infarto agudo de miocardio.
En la ultima década, los DAI han mejorado la sobrevida de pacientes con disfunción ventricular izquierda independiente del beneficio de la inhibición del sistema renina-angiotensina-aldosterona demostrado con IECA, beta bloqueantes y antialdosterónicos, sobre todo los de etiología isquémica y mayormente en pacientes con otros marcadores de MS (TV/FV indudad vista en las poblaciones estudiadas, con criterios definidos de enrolamiento, debemos adoptarlas como guías de tratamiento en nuestra práctica clínica diaria? La respuesta a esta pregunta es hasta el momento controversial.
Mecanismos principales de muerte súbita
El problema es que los mecanismos causales de MS son complejos y múltiples, incluso en un mismo paciente. Por ejemplo, en pacientes con enfermedad coronaria, pero sin evidencia de IAM previo, el mecanismo más común responsable de MS es la fibrilación ventricular desencadenada por un evento isquémico. Muchos de esos pacientes tienen una FE > 40%. En el registro prospectivo Holandés, más del 50% de las MS en pacientes "coronarios" ocurrió con FE > 30% y un 25% incluso con FE > 50%17. Enfermos con IAM tienen múltiples mecanismos que desencadenan TV/FV: reentrada intramiocárdica por una "anisotropía no uniforme", así como otras anormalidades electrofisiológicas creadas por el tejido fibroso formado durante el proceso de cicatrización, estos circuitos de reentrada no requieren isquemia para desencadenar TV/FV. Las hipertrofia miocárdica del tejido no infartado pudiese predisponer a FV18. A ello debemos añadir los cambios neurohormonales que se producen posteriormente a extensos infartos con fenómeno de remodelamiento ventricular que muchos casos derivan en el síndrome de IC19.
Con todo lo anterior, debemos concluir que los mecanismos que eventualmente pudiesen contribuir a la aparición de TV/ FV son múltiples y por tanto no existe un solo test o variable independiente que defina por sí sola el riesgo real de MS, sobre todo en pacientes coronarios.
Limitación de la FE como variable aislada en la predicción de MS
En un reporte del registro prospectivo Maastricht Circulatory Arrest Registry, sólo el 19% de los pacientes con enfermedad coronaria conocida y que experimentaron MS tenían una FE < 30% antes del evento17. Un subestudio de este registro demostró que la FE fue mayor al 30% en el 56% de pacientes con IAM documentado y MS20. La limitación de la FE como marcador de riesgo aislado de MS también fue evaluado en el estudio ATRAMI (European Autonimic Tone and Reflexes After Myocardial Infarction)21. Este estudio incluyó a 1284 pacientes dentro del primer mes post IAM y evaluó múltiples estrategias de estratificación de riesgo para MS (la FE promedio fue del 49%). Después de 21 meses de seguimiento, 49 pacientes murieron, de los cuáles menos de la mitad tenían FE < 30% (evaluada post IAM). Un subestudio del registro ATRAMI trató de definir el rol de la FE como predictor independiente de MS en esa población y se encontró que la FE < 30% aislada no era un predictor de riesgo de MS; sin embargo, cuando una FE < 30% se combinaba con otros factores (TV no sostenida, sensibilidad baro-refleja anormal) sí fue predictor de mortalidad en este ensayo22.
Otra aproximación para examinar la utilidad de la FE como predictor independiente de MS se evaluó en el subestudio del MUSTT. En este análisis, la mortalidad total de pacientes con FE < 30% fue mayor que los pacientes con FE> 30%; sin embargo, los pacientes con FE < 30% sin TV inducible tenían riesgo de muerte similar que pacientes con FE > 30% y TV inducible23. De esta observación podemos inferir que hay subgrupos de pacientes con FE > 30% que se beneficiarían con el implante de un DAI, al igual que los pacientes con FE < 30%.
¿En que momento de la evolución de la IC debemos implantar un DAI?
El estudio clínico denominado Valsartan, Captopril, or Both in Myocardial Infarction Complicated by Heart Failure, Left Ventricular Function, or Both (VALIANT)24 enroló más de 14500 pacientes, comparando los efectos de valsartán con captopril en pacientes con IAM complicados con disfunción ventricular izquierda, IC o ambas, entre 1998 y 2000. El promedio de FE fue del 35%, un tercio de los pacientes tenían IAM previo y aproximadamente tres cuartas parte de los enfermos estaban en CF II-III al momento de la randomización. Durante el tiempo medio de seguimiento (24,7 meses), el 7,3% de los pacientes murió súbitamente o fue rescatado de una MS. El gran cúmulo de mortalidad estuvo en el primer mes post evento y fue disminuyendo en forma significativa a medida que pasaron los meses (tasa de riesgo del primer mes del 1,4% que declino a razón del 0,14 al 0,18% por mes subsiguiente). A pesar de lo anterior, no hay evidencia que implantar un DAI justo en el primer mes del IAM reduce en forma significativa el riesgo de MS post IAM24,25.
El estudio denominado DINAMIT (The Defibrillator in Acute Myocardial Infarction Trial) incluyó pacientes post IAM con FE promedio del 26% y randomizados a recibir un DAI "profiláctico" o tratamiento convencional en los primeros 30 días del IAM (promedio de 18 días), no hubo diferencias significativas en cuanto a la prevención de MS y si una mayor incidencia de IC en el grupo DAI26.
La gran mayoría de los pacientes enrolados en ensayos clínicos de "prevención primaria" de MS y disfunción ventricular izquierda se han incluido al menos 2 años post infarto. Por ejemplo, en el estudio MADIT II, el tiempo promedio de enrolamiento post IAM fue de 81 meses, y en el MUSTT fue de 39 meses.
En un subregistro del estudio MUSTT publicado recientemente, se analizó la mortalidad global y "arrítmica", desarrollando un modelo predictivo de mortalidad que tenía en cuenta no sólo la FE, sino otras variables independientes (TV durante al hospitalización, presencia de bloqueo de rama izquierda u otro trastorno de la conducción intraventricular, uso de digital, edad mayor de 65 años). Teniendo en cuenta este modelo, los pacientes que tenían sólo como factor de riesgo una FE < 30% tenían un riesgo de mortalidad global a los 2 años del 6,2% y de muerte arrítmica del 3,5%. Este riesgo es 3 veces menor que la mortalidad global del grupo control del estudio MADIT II (19,8%), dado que la mayoría de los pacientes enrolados en el MADIT II tenía otros factores de riesgo: dos tercios de los pacientes tenían ICC sintomática (CF II ó más -NYHA-), al menos el 50% de los pacientes tenían bloqueo de rama izquierda u otra alteración de la conducción intraventricular y más de la mitad usaba digital. De manera que, no todos los pacientes con cardiopatía coronaria y FE < 30% tienen el mismo riesgo de morir27.
¿Existe un único test para definir claramente el riesgo de MS en los pacientes con FE < 30%? Desafortunadamente, no tenemos respuesta concreta al respecto; sin embargo, la política hasta el momento seguida por muchos sistemas de salud es tratar de reunir al menos 3 criterios de alto riesgo de MS de los que hemos mencionado anteriormente. Especial interés en el ultimo tiempo ha despertado un método no invasivo que podría al menos tener un valor predictivo negativo adecuado, se trata de la alternancia de la onda T en registros de ECG de alta resolución. Reportes iniciales le dan a este método una especificidad muy alta28-30.
Complicaciones a largo plazo de los DAI
Existen algunos interrogantes y dudas que estudios controlados y observacionales de largo plazo despejarán: calidad de vida post DAI, beneficio a largo plazo (la mayoría de los trabajos tienen tiempo limitado a máximo 2,5 años), la llamada "tormenta del desfibrilador", complicación que no posee métodos en la actualidad para su predicción. Por último, la relación costo/beneficio de esta intervención en la prevención de MS es un tema no menor para los Sistemas de Salud y conjunto de Sociedades Científicas de países sub-desarrollados o en vías de desarrollo a la hora de implementar políticas en la prevención primaria de la MS en pacientes con disfunción ventricular.
Conclusiones
- La FE aislada esta lejos de ser un marcador ideal para basar la indicación de un DAI.
- Múltiples factores interactúan con la FE e influyen en la mortalidad de un paciente con similar grado de disfunción ventricular izquierda.
- Son necesario otros elementos para estratificar el riesgo en pacientes con FE < 30% y no olvidar que debemos también identificar esos mismos factores para pacientes con FE > 30%, pero que tienen riesgo de MS.
1. Zheng Z-J, Croft JB, Giles WH, et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation 2001;104:2158-2163. [ Links ]
2. Valero E, Pesce R. Riesgo de muerte y miocardiopatía dilatada. Rev Insuf Cardíaca 2007;2;4:153-158. [ Links ]
3. Zaim S, Zaim B, Rottman J, et al. Characterization of spontaneous recurrent ventricular arrhythmias detected by electrogram-storing defibrillators in sudden cardiac death survivors with no inducible ventricular arrhythmias at baseline electrophysiologic testing. Am Heart J 1996;132:274-279. [ Links ]
4. Echt DS, Liebson PR, Mitchell LB, et al. Mortality and morbidity in patients receiving encainide, flecainide or placebo. The Cardiac Arrhitmia Suppression trial. N Eng J Med 1991;324:781-788. [ Links ]
5. Mirowski M, Reid P, Mower M. Termination of malignant ventricular arrhytmias with an implanted automatic defibrillator in human beings. N Eng J Med 1980;303:322-324. [ Links ]
6. The Antiarrhytmics Versus Implantable defibrillators (AVID) Investigators. A comparison of antiarrhythmic- drug therapy with implantable defibrillators in patient resuscitated from near-fatal ventricular arrhythmias. N Eng J Med 1997;337:1576-1583. [ Links ]
7. Connolly S, Gent M, Roberts R, et al. Canadian Implantable Defibrillator Study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation 2000;101:1297-1302. [ Links ]
8. Kuck K-H, Cappato R, Siebels J, et al. Randomized comparison of antiarrhythmic drug theraphy with implantable defibrillator in patients resucitated from cardiac arrest: The Cardiac Arrest Study Hamburg (CASH). Circulation 2000;102:748-754. [ Links ]
9. Connolly S, Hallstron AP, Cappato R, et al. Metea-analysis of the implantable cardioverter defibrillator secondary prevention trials. AVID, CASH, and CIDS studies. Antiarrhythmics vs. Implantable defibrillator study. Cardiac Arrest Study Hamburg. Canadian Implantable Defibrillator Study. Eur Heart J 2000;21:2071-2078. [ Links ]
10. Oxilia Estigarribia MA, Dubner S. Cardiodesfibrilador automático implantable en insuficiencia cardíaca. Una puesta al día. Rev Insuf Cardíaca 2006;1;4:179-182. [ Links ]
11. Moss AJ, Hall WJ, Cannon DS et al. Improved survival with an implantable defibrillator in patient with coronary artery disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Eng J Med 1996;335:1933-1940. [ Links ]
12. Buxton AE, Lee KI, Fisher JD, et al. A randomized study of the prevention of sudden death in patient with coronary artery disease. N Eng J Med 1999;341:1882-1890. [ Links ]
13. Moss AJ, Zareba W, Hall WJ, et al. Prophylactic Implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Eng J Med 2002;346:877-883. [ Links ]
14. Bansch D, Antz M, Boczor S, et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: The Cardiomyopathy Trial (CAT). Circulation 2002;105:1453-1458. [ Links ]
15. Kadish A, Dyer A, Daubert J, et al. Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation (DEFINITE) Investigators. Prophylactic defibrillators implantation in patient with non ischemic dilated cardiomyopathy. N Engl J Med 2004;350:2151-2158. [ Links ]
16. Bardy GH, Lee KL, Mark DB, et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HF) Investigators. Amiodarone or an implantable cardioverter-defibrilator for congestive heart failure. N Engl J Med 2005;352:225-237. [ Links ]
17. de Vreede-Swagemakers JJ, Gorgels AP, Dubois-Arbouw WI, et al. Out-of- hospital cardiac arrest in the 1990´ s : a population-based study in the Maastrich area on incidence, characteristic and survival. J Am Coll Cardiol 1997;30:1500-1505. [ Links ]
18. Misier AR, Opthof T, van Hemel NM et al. Dispersion of "refractoriness" in non-infracted myocardium of patients with ventricular tachycardia or ventricular fibrillation after myocardial infarction. Circulation 1995;91:2566-2572. [ Links ]
19. Myerburg RJ, Kessler KM, Castellanos A. et al: Sudden cardiac death: structure, function, and time - dependence of risk. Circulation 1992;85:I1-I10. [ Links ]
20. Gorgels AP, Gijsbers C, de Vreede-Swagemakers JJ, et al. Out-of- hospital cardiac arrest - the relevance of heart failure. The Maastricht Circulatory Arrest Registry. Eur Heart J 2003;24:1204- 1209. [ Links ]
21. Le Rovere MT, Bigger JT Jr, Marcus FI, et al. Baroreflex sensitivity and heart rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonimic Tone an reflexes after Myocardial Infarction) Investigators. Lancet 1998;351:478-484. [ Links ]
22. Le Rovere MT, Pinna GD, Hohnloser SH, et al. Baroreflex sensitivity and heart rate variability in the identification of patient at risk for life threatening arrhytmias: implications for clinical trials. Circulation 2001;103:2072-2077. [ Links ]
23. Buxton AE, Lee KL, Hafley GE, et al. A simple model using the Mustt database can stratify total modality and sudden death risk of coronary diseases patient. J Am Coll Cardiol 2004;43:43:425A. [ Links ]
24. Valiant Investigators. Sudden Death in Patients with myocardial infarction and left Ventricular Dysfunction, Heart Failure or Both. N Eng J Med 2005;352;25:2581-2588. [ Links ]
25. Wilbur D, Zareba W, Hall W, et al. Time dependence of mortality risk and defibrillator benefit after myocardial infarction. Circulation 2004;109:1082-1084. [ Links ]
26. Hohnloser SH, Kuck KH, Dorian P, et al. Prophylactic Use of an Implantable Cardioverter-Defibrillator after Acute Myocardial Infarction (DINAMIT Trial). N Eng J Med 2004;351:2481-2488. [ Links ]
27. Buxton AE, Moss AJ. Should everyone with an ejection fraction less than 30% receive an implantable cardioverter-defibrillator? Circulation 2005;111:2537-2549. [ Links ]
28. Cantillon DJ, Kenneth M, Markowitz SM et al: Predictive value of Microvolt T Wave Alternans in Patients with Left Ventricular Dysfunction. J Am Coll Cardiol 2007;50:166-173. [ Links ]
29. Blomfield DM, Bigger T, Steinman RC et al. Microvolt T- Wave Alternans and the Risk of Death or Sustaines Ventricular Arrhythmias in Patients With Left Ventricular Dysfunction. J Am Coll Cardiol 2006;47:456-463. [ Links ]
30. Chow T, Kereiakes DJ, Bartone Ch, et al. Prognostic Utility of Microvolt T-Wave Alternans in Risk Stratification of Patients with Ischemic Cardiomyopathy. J Am Coll Cardiol 2007;49:50-58. [ Links ]















