Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. v.3 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2008
ARTÍCULO DE REVISIÓN
Miocardio no compactado
Laura Arias*
* Médica cardióloga. Instituto Argentino de Diagnóstico y Tratamiento (IADT). Buenos Aires. Rep. Argentina.
Integrante del Servicio de Ecocardiografía y Ecografía Vascular Periférica de Cardiotest del Sanatorio Las Lomas. San Isidro. Provincia de Buenos Aires. Rep. Argentina.
Correspondencia: Dra. Laura Arias.
Instituto Argentino de Diagnóstico y Tratamiento.
Marcelo T. de Alvear 2346/2400
C1122AAL - Buenos Aires, República Argentina.
Tel: +(54-11) 49639500
E-mail: lauarias@yahoo.com
Recibido: 28/03/2008
Aceptado: 05/06/2008
Palabras clave: Miocardio no compactado; Miocardiopatía; Insuficiencia cardíaca; Trabeculaciones
Introducción
Se trata de una forma muy infrecuente de miocardiopatía congénita, hoy en día, diagnosticada con creciente frecuencia, que se da como resultado de la interrupción en el proceso de compactación endomiocárdica, ocurrido durante la vida intrauterina; esta entidad también es conocida como "miocardiopatía espongiforme"1. Durante la vida intrauterina, las múltiples trabeculaciones y recesos se comunican directamente con la cavidad ventricular. El miocardio no compactado (MNC) se caracteriza por la presencia en la vida adulta de estas trabeculaciones, las cuales a menudo se localizan en segmentos hipertrofiados e hipoquinéticos del ventrículo izquierdo (VI). Por definición el MNC se presenta en ausencia de otras cardiopatías estructurales2.
La heterogeneidad en la forma de presentación y muchas veces la simple ignorancia hacen que no se arribe al diagnóstico de MNC. La finalidad de esta revisión es de alguna manera aclarar los conceptos clínicos, anatomopatológicos, diagnósticos y genéticos más relevantes de esta enfermedad.
Historia
La persistencia de sinusoides en el VI como una anomalía aislada fue descripta por primera vez en una joven de 33 años de edad, en 1984. Esta alteración fue puesta de manifiesto luego de la realización de un ecocardiograma bidimensional3. Para el año 1985, otro grupo reportó el caso de una joven de 21 años de edad cuyo debut se dio a los 15 años con un edema agudo de pulmón4. En este último caso, el ecocardiograma bidimensional mostró una estructura canaliforme asentada sobre un miocardio engrosado e hipoquinético. Ya en los inicios de la década de los 90, se publicó un estudio con ocho casos de MNC en una población pediátrica5 y hacia fines de dicha década la Clínica Mayo reportó 17 casos hallados en 37555 estudios ecocardiográficos realizados6.
Clasificación de las miocardiopatías
Las miocardiopatías constituyen un conjunto extraordinariamente heterogéneo de procesos que sólo tienen en común la afectación del músculo cardíaco y que causan un amplio espectro de formas de disfunción del mismo, por lo tanto se definen como el conjunto de enfermedades miocárdicas que generan deterioro de la función sisto/diastólica del VI. Entre las múltiples clasificaciones que se han realizado de las miocardiopatías, hoy en día se acepta comúnmente la de la World Health Organization/International Society and Federation of Cardiology Task Force (WHO/ISFC). Esta clasificación (Tabla 1) se efectúa según el modelo fisiopatológico o, de ser posible, por los factores etiológicos/patogénicos, dividiéndose en miocardiopatía dilatada (MCD), miocardiopatía hipertrófica (MCH), miocardiopatía restrictiva, displasia arritmogénica de ventrículo derecho y las denominadas miocardiopatías específicas, incluyendo la miocardiopatía isquémica, la valvular, la hipertensiva y todo el conjunto de formas secundarias a una variedad de agentes y causas, entre las que se encuentra la miocarditis7.
La categoría de miocardiopatía no clasificada no es satisfactoria, refleja el desconocimiento que existe sobre algunas entidades como la fibroelastosis, la amiloidosis y algunas miocardiopatías mitocondriales, el MNC sería de acuerdo a la clasificación WHO/ISFC, una miocardiopatía no clasificada.
Epidemiología
Durante el año 2003, fue publicado un trabajo acerca de la incidencia de miocardiopatías en niños, llevada a cabo sobre un total de 467 casos. Las miocardiopatías ubicadas bajo la categoría de "otras" y "no especificada", dentro de las cuales se encontraría el MNC, representaron el 7% del total de los casos, por debajo de la miocardiopatía hipertrófica en primer lugar y en segundo, la MCD8.
En el mismo año, otro estudio en el mismo sentido proveniente de Australia determinó que la incidencia de MNC representaba alrededor del 9,25% de todos los casos de miocardiopatías primarias, ocupando el tercer lugar luego de la MCD y la MCH9.
Estos datos fueron comparables con otra experiencia publicada durante el mismo año, donde la incidencia de MNC representó el 9,5% de las causas de miocardiopatía diagnosticada en niños10. En un estudio realizado sobre una población de 1580 pacientes adultos consecutivos durante 6 meses, sólo 2 de ellos (0,1%) cumplieron todos los criterios para MNC11.
En la mayor serie de pacientes adultos con MNC, la incidencia se encuentra en el orden del 0,014%12. Se trata de una población referida a un centro universitario ecocardiográfico, debido al hallazgo de anomalías ecocardiográficas poco claras, en pacientes asintomáticos, así como también pacientes con síntomas de insuficiencia cardíaca congestiva severa, sin un diagnóstico etiológico. El sesgo de selección que determina una población de pacientes principalmente sintomáticos, no permite que hoy en día se conozca la real prevalencia de esta entidad en la población adulta.
Manifestaciones clínicas
La tríada compuesta por insuficiencia cardíaca, arritmias y eventos cardioembólicos es la principal manifestación observada, tanto en población pediátrica como en adultos con deterioro de la función sistólica del VI5. Pueden observarse diferentes arritmias, desde una fibrilación auricular hasta una taquicardia ventricular sostenida. Oechslin y col.12 publicaron la serie más importante de seguimiento a largo plazo en pacientes adultos con MNC; en la Tabla 2 se detallan las características clínicas y electrocardiográficas de la población de los 34 pacientes incluidos. La presencia de trombos en el VI sólo fue documentada en 3 pacientes, uno de ellos con antecedente de trombosis mesentérica.
Cuando se compara esta serie con las realizadas sobre población pediátrica5, la diferencia más notable radica en la ausencia de distrofia facial y síndrome de Wolff-Parkinson-White (WPW) en la población adulta. Esto último es algo esperable, ya que en un porcentaje elevado de neonatos con síndrome de WPW, la preexcitación desaparece durante el primer año de vida13. Además, está demostrado que la prevalencia de este síndrome guarda una relación inversa con la edad14. La presencia de bloqueos completo de rama fueron más frecuentes en las poblaciones adultas. Otras manifestaciones de importancia como la insuficiencia cardíaca, arritmias ventriculares y eventos embólicos sistémicos fueron comparables entre la población adulta y al menos una de las poblaciones pediátricas estudiadas.
Diagnóstico
A- Procedimientos no invasivos
Ecocardiografía
La ecocardiografía es considerada el método estándar para el diagnóstico de la MNC. Los criterios diagnósticos fueron determinados a principios de esta década2,15 (Tabla 3).
Para la mejor diferenciación visual de la típica estructura miocárdica de dos capas consistentes en una fina banda compacta epicárdica de tejido uniforme y otra capa endocárdica trabeculada con grandes recesos endomiocárdicos, la vista paraesternal en eje corto es la que ofrece mejor definición. La relación en fin de sístole entre la porción no compactada y la compactada debe ser mayor a 2. Estos criterios permiten, hoy en día, diferenciar claramente esta entidad de otras, tales como la MCD y la afectación cardíaca secundaria a la hipertensión arterial16.
El VI se divide en nueve segmentos con la finalidad de describir en forma correcta y precisa la localización de las alteraciones: un segmento apical, 4 segmentos medio ventriculares y 4 segmentos basales (cada uno de ellos dividido en anterior, inferior, septal y lateral.). Los segmentos afectados se encuentran característicamente hipoquinéticos en los pacientes sintomáticos y en aquellos con deterioro de la función sistólica del VI: en contraste, los pacientes asintomáticos estudiados en un screening familiar pueden no presentar dichas alteraciones17.
Un importante diagnóstico diferencial debe ser tenido en cuenta: la presencia de trabeculaciones prominentes como una variante de la normalidad. Por lo general, éstas se presentan en la pared libre del VI o en el septum interventricular18. En un estudio realizado con la finalidad de determinar la incidencia y las características de las variantes normales de la anatomía cardíaca, se encontraron trabeculaciones en 201 pacientes sobre un total estudiado de 1580. En ellos, la relación encontrada entre las porciones no compactada y compactada fue de 1,2±0,4, la localización de las mismas se dio mayormente en el septum interventricular, a diferencia de la localización típica en paredes inferior y lateral observada en el MNC. Sólo 2 pacientes (0,1%) cumplieron con los criterios para MNC11. En casos en los cuales la calidad de la imagen no es del todo óptima, la utilización de contraste puede facilitar el diagnóstico19. La utilización de strain rate o Doppler tisular puede mejorar aun más la calidad de la imagen20 (Figuras 1 y 2).
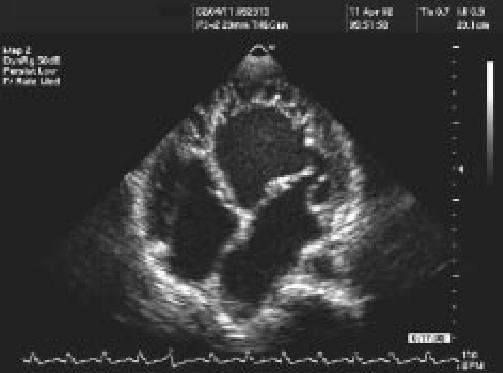
Figura 1. Ecocardiograma bidimensional, vista apical de cuatro cámaras mostrando la típica afectación de la pared lateral del ventrículo izquierdo.
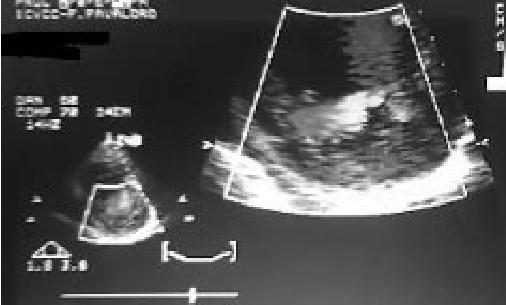
Figura 2. Ecocardiograma Doppler color, vista paraesternal en eje corto a nivel de los músculos papilares, se observa flujo dentro de los recesos intratrabeculares.
El ecocardiograma tridimensional (3D) aumenta el valor diagnóstico y la capacidad para delinear los segmentos endomiocárdicos afectados en pacientes portadores de MNC, colaborando en la realización de un diagnóstico diferencial más confiable21. La capacidad de este método de determinar con exactitud la profundidad de los recesos intratrabeculares, sumada a la localización exacta de los segmentos no compactados, le aporta un enorme valor pronóstico. Desde el momento que se conoce que la sobrevida está directamente relacionada con la extensión del compromiso ventricular, y que dicha extensión puede ser en sí misma un criterio de indicación de trasplante o de cardiodesfibrilador implantable (CDI)12, la caracterización con el ecocardiograma 3D podría ser de gran utilidad21.
Tomografía por emisión de positrones (PET)
A diferencia de la cámara gamma convencional (Single Photon Emission Computed Tomography: SPECT) el PET permite cuantificar un proceso biológico en términos absolutos, con una alta resolución espacial. En el caso de la perfusión, no sólo puede analizar la perfusión relativa, sino que también puede evaluar el flujo coronario en ml/min/gramo de tejido en forma regional, es decir por territorio vascular. Esta cuantificación puede llevarse a cabo tanto en reposo como ante un apremio farmacológico, utilizándose en este método radiotrazadores de vida media muy corta como el 13N-amonio o el RB 18.
Del cociente entre el flujo en estrés y el flujo en reposo se obtiene el cálculo de la reserva de flujo coronario22. En este sentido, fue realizado un estudio del flujo sanguíneo con PET en reposo y durante estrés farmacológico, se hallaron defectos de perfusión miocárdica en el 60% de los segmentos no compactados, el 90% de los segmentos sanos no presentó alteraciones de la microcirculación. El flujo de reserva coronaria se encontró disminuido en el 75% de los segmentos afectados, no encontrándose diferencia estadísticamente significativa entre estos segmentos y los segmentos sanos en términos de reserva de flujo coronario. De esta manera, se determinó que la disminución en la reserva coronaria en pacientes con MNC no es patrimonio único de los segmentos no compactados. Los defectos de perfusión miocárdica fueron propuestos como causa de arritmias y disfunción ventricular23.
Tomografía computada y resonancia magnética nuclear
Existe poca bibliografía a cerca de los hallazgos en la tomografía computada (TC) en pacientes con MNC. Hamamichi y col.24 han publicado una investigación sobre seis pacientes adolescentes a los cuales se les realizó una TC ultrarrápida y una resonancia magnética nuclear (RMN) para diagnosticar la presencia de MNC. Aunque la resolución de imagen de las porciones miocárdicas no compactadas es excelente, éstos no son métodos que estén ampliamente utilizados en el diagnóstico diario de esta patología.
B- Procedimientos invasivos
Angiografía
Los hallazgos típicos del MNC pueden observarse con ventriculografía. Luego de la inyección de contraste, el miocardio afectado puede distinguirse con claridad. De todas formas, la realización de este procedimiento está generalmente dirigida a descartar o confirmar otras patologías concomitantes.
Hallazgos anatomopatológicos
El MNC se caracteriza por la presencia de segmentos hipoquinéticos e hipertróficos que consisten en una capa miocárdica engrosada y no compactada que yace sobre una capa epicárdica delgada y compacta. El endocardio contiene grandes y profundos recesos y trabeculaciones prominentes, como resultado de la detención de la compactación durante la embriogénesis. Esta detención se da habitualmente entre las semanas 5 y 8 de la vida fetal, ya que es en este período cuando el miocardio se compacta y los espacios intratrabeculares se transforman en capilares. La compactación ocurre desde epicardio a endocardio y de ápex a base25,26. No se han definido hallazgos histológicos específicos, más allá del aumento de la fibrosis subendocárdica encontrada en algunos casos. Los recesos se comunican con la cavidad del VI, pero no con la circulación coronaria12.
El MNC es una entidad diferente a la hipertrabeculación del VI27,28. Esta última se define como la presencia de al menos tres trabeculaciones prominentes en el VI, se asocia frecuentemente con problemas extracardíacos. Stollberger y col. asumen que en estos casos la no compactación podría ser secundaria a otro proceso diferente de aquel determinado genéticamente, con lo cual se trataría de una alteración adquirida29.
Diagnóstico diferencial
La diferenciación entre MNC y otras entidades que afectan a VI puede ser dificultosa. Se realizó un estudio ciego, reviendo estudios ecocardiográficos grabado en cintas de vídeo16 a los cuales se les aplicaron los criterios establecidos para el diagnóstico de MNC2 con la finalidad de diferenciar esta entidad de otras tales como MCD, miocardiopatía hipertensiva, cardiopatías valvulares y presencia de trabeculaciones y bandas aberrantes.
Diferenciación entre MNC y MCD y miocardiopatía hipertensiva
Es el diagnóstico diferencial más importante. Se determinó que la estructura clásica de dos capas miocárdicas del MNC, no es patrimonio exclusivo de éste, dicha estructura estuvo presente casi en el 26% de los pacientes con MCD, pero no se mantenía una relación >2 entre las porciones no compactada/compactada16, observándose también en los pacientes con MCH. Ninguno de los pacientes con MCD incluidos en este estudio cumplió con todos los criterios para MNC. En pacientes con miocardiopatías valvulares, también está presente la estructura en dos capas ya descripta, pero las regiones engrosadas se encuentran presente incluso en el septum interventricular, lo cual es completamente diferente a la hallado en el MNC, donde sólo los segmentos afectados se encuentran engrosados y donde el septum es, por lo general, respetado.
El volumen de fin de diástole es mucho menor en pacientes con MNC que en aquellos con MCD. Sólo la disfunción diastólica se encuentra presente en la casi totalidad de estas patologías, por lo cual no debe ser tomada como parámetro para individualizar las entidades.
Criterios para MNC en pacientes valvulares
Se han reportado casos esporádicos de MNC en presencia de estenosis aórtica (EA)30. En base a estos casos, se evaluó si los cambios miocárdicos presentes en valvulopatías tales como EA insuficiencia aórtica e insuficiencia mitral (IM) imitaban lo descripto en el MNC16. Sorpresivamente, no se encontraron diferencias significativas con respecto a la formación de recesos e hipertrabeculación entre pacientes con IM o enfermedad aórtica; de todas formas sólo 2 pacientes con EA (ambos con aorta bicúspide) cumplieron con todos los criterios diagnósti cos para MNC. La real incidencia de MNC en comorbilidad con diferentes valvulopatías no está del todo determinada, aún se desconoce si la coexistencia de ambas aumenta la mortalidad. El espesor del septum interventricular es importante a la hora de realizar el diagnóstico diferencial, ya que en el MNC se encuentra respetado casi en la totalidad de los casos, lo cual no ocurre en miocardiopatías valvulares.
Trabeculaciones hipertróficas y bandas aberrantes
La presencia de bandas aberrantes en corazones normales no es un hallazgo infrecuente (0,5 al 50%)31. Los dos tercios basales del septum interventricular se mantienen generalmente sin afectación. Las porciones comprometidas son generalmente la pared libre y la pared inferior en los segmentos medios y apicales, manteniéndose esto también en el caso de MNC.
Como se reiteró en varias oportunidades, la no compactación no se encuentra presente en las porciones basales. La presencia de más de tres trabeculaciones: hipertrabeculación, puede estar presente en un vasto número de patologías cardíacas como desórdenes neuromusculares y enfermedades valvulares32,33.
Estas observaciones son inespecíficas y pueden incluso constituir una variante de la normalidad.
Como conclusión acerca de la diferenciación de esta entidad, se puede asumir que algunos criterios diagnósticos de MNC pueden estar presentes en otras patologías, pero la combinación de todos ellos es de alta especificidad. En pacientes sin evidencia de enfermedades neuromusculares, la presencia de hipertrabeculación no es un criterio suficientemente sensible. La posibilidad de encontrar la totalidad de los criterios para MNC en otra patología es ≤ 5%.
Pronóstico e historia natural
Durante los seis años de seguimiento que llevaron a cabo Ritter y col.6, ocho de los 17 pacientes murieron, tres de ellos presentaron muerte súbita y dos de ellos habían sido sometidos a trasplante cardíaco. En la serie más numerosa de pacientes con MNC12, en el seguimiento a largo plazo (44±40 meses), el 35% sufrió una muerte súbita, el 12% fue sometido a trasplante cardíaco, el 24% presentó eventos tromboembólicos y el 41% arritmias ventriculares.
Los hallazgos clínicos al momento del diagnóstico en pacientes que finalmente no sobrevivieron, fueron diferentes en aquellos que presentaron mayor sobrevida, como ser mayores diámetros de fin de diástole, clase funcional de la New York Heart Association (NYHA) III/IV, fibrilación auricular crónica y bloqueos de rama12,34. Puede asumirse que la presencia de estos parámetros hablaría de un peor pronóstico. La elevada mortalidad de esta entidad y el carácter familiar de la misma, marcan la indicación de realizar un screening con ecocardiografía en familiares directos.
Genética
El MNC es un desorden genético heterogéneo35 y su diagnóstico es importante no sólo por la elevada mortalidad observada en pacientes sintomáticos, sino porque una vez determinada la existencia de la enfermedad es necesario realizar un screening familiar, dado que están descriptas dos formas: una forma esporádica y una forma familiar.
El MNC neonatal puede encontrarse relacionado con una mutación en el gen G4.5 localizado en el cromosoma X36 asociado con el síndrome de Barth, una enfermedad mitocondrial ligada al sexo que afecta tanto el músculo cardíaco como el esquelético37. El gen G4.5 codifica para una proteína llamada tafacina, no se conoce ninguna otra proteína que posea una secuencia homóloga. Ha sido demostrado que el MNC y otras miocardiopatías dilatadas ligadas al cromosoma X, pueden ser causadas por mutaciones en el gen que codifica para una proteína que compone la línea Z del músculo esquelético y cardíaco38. De todas formas, esta mutación no es la única responsable de esta alteración en la maduración del sistema cardiovascular.
Las formas adultas de MNC son genéticamente diferentes a las mutaciones genéticas ligadas a X presentes en la población pediátrica. Se sugiere una transmisión autosómica dominante39, esto se basa en que prácticamente el 50% de los descendientes de pacientes portadores de MNC heredan la condición.
Opciones terapéuticas
El tratamiento de estos pacientes es similar al de otros con diferentes tipos de miocardiopatías, por lo tanto el tratamiento debe incluir un correcto manejo de la insuficiencia cardíaca, control de las arritmias y anticoagulación oral como prevención de embolias sistémicas en pacientes con deterioro de la función sistólica del VI.
Tanto la implantación de un CDI como la posibilidad de un trasplante cardíaco en pacientes sintomáticos, debe ser considerada tempranamente. La tasa de mortalidad o trasplante cardíaco en seis años de seguimiento fue del 59%6. Hasta el año 2004, sólo 7 pacientes con MNC habían sido sometidos a trasplante cardíaco40. Los pacientes de alto riesgo, aquellos que al momento de presentación muestran hallazgos tales como mayores diámetros de fin de diástole, clase funcional de la NYHA III/IV, fibrilación auricular crónica y bloqueos de rama12 deben recibir las medidas terapéuticas más agresivas.
Cuando el tratamiento estándar para la insuficiencia cardíaca falla, es en última instancia el trasplante cardíaco el tratamiento indicado; esto demuestra que el tratamiento es el punto más débil ligado al conocimiento de esta enfermedad.
1. Freedom RM, Yoo SJ, Perrin D, Taylor G, Petersen S, Anderson RH. The morphological spectrum of ventricular noncompaction. Cardiol Young 2005;15;4:345-364. [ Links ]
2. Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001;86:666-671. [ Links ]
3. Engberding R, Bender F. Identification of a rare congenital anomaly of the myocardium by two-dimensional echocardiography: persistence of isolated myocardial sinusoids. Am J Cardiol 1984;53:1733-1734. [ Links ]
4. Goebel N, Jenni R, Grüntzig AR. Persistent myocardial sinusoids. Rofo 1985;142;6:692-693. [ Links ]
5. Chin TK, Perloff JK, Williams RG, Jue K, Mohrmann R. Isolated noncompaction of left ventricular myocardium. A study of eight cases. Circulation 1990;82;2:507-513. [ Links ]
6. Ritter M, Oeschslin E, et al. Isolated noncompaction in the myocardium in adults. Mayo Clin proc 1997;72:26-31. [ Links ]
7. Richardson P, McKenna WJ, Bristow M, Maisch B, Mautner B, O'Connell J, et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of the Cardiomyopathies. Circulation 1996;93:841-842. [ Links ]
8. Lipshultz SE, Sleeper LA, Towbin JA, Lowe AM, Orav EJ, Cox GF, et al. The incidence of pediatric cardiomyopathy in two regions of the United States. N Engl J Med 2003;348;17:1647-1655. [ Links ]
9. Nuguet AW, Doubney PEF, Chandros P, et al. The epidemiology of childhood cardiomyopathy in Australia. N Engl J Med 2003;348:1639-1646. [ Links ]
10. Pignatelli RH, McMahon CJ, Dreyer WJ, Denfield SW, Price J, Belmont JW, et al. Clinical Characterization of Left Ventricular Noncompaction in Children: A Relatively Common Form of Cardiomyopathy. Circulation 2003;108:2672-2678. [ Links ]
11.Tamborini G, Pepi M, Celeste F, Muratori M, Susini F, Maltagliati A, Veglia F. Incidence and characteristics of left ventricular false tendons and trabeculations in the normal and pathologic heart by second harmonic echocardiography. J Am Soc Echocardiogr 2004:17;367-374. [ Links ]
12. Oechslin EN, Attenhofer Jost EH, Rojas JR, Kaufmann PA, Jenni R. Longterm follow-up of 34 adults with isolated left ventricular noncompaction: a distinct cardiomyopathy with poor prognosis. J Am Coll Cardiol 2000;36:493-500. [ Links ]
13. Swiderki J, Lees MH, Nadas AS. The Wolff-Parkinson-White syndrome in infancy and childhood. Br Heart J 1962;24:561-580. [ Links ]
14. Soria R, Guize L, Chretien JM, Le Heuzey JY, Lavergne T, Desnos M, Hagege A, Guerre Y. The natural history of 270 cases of Wolff-Parkinson-White syndrome in a survey of the general population. Arch Mal Coeur Vaiss 1989;82;3:331-336. [ Links ]
15. Hughes SE, McKenna WJ. New insights into the pathology of inherited cardiomyopathy. Heart 2005;91:257-264. [ Links ]
16. Frischknecht BS, Attenhofer Jost CH, Oechslin EN, et al. Validation of noncompaction criteria in dilated cardiomyopathy, and valvular and hypertensive heart disease. J Am Soc Echocardiogr 2005;18:865-872. [ Links ]
17. Jenni R, Oechslin E. Isolated ventricular non-compaction of the myocardium in adults. Heart 2007;93;11-15. [ Links ]
18. Boyd MT, Seward JB, Tajik AJ, et al. Frequency and location of prominent left ventricular trabeculations at autopsy in 474 normal human hearts: implications for evaluation of mural thrombi by two-dimensional echocardiography. J Am Coll Cardiol 1987;9:323-326. [ Links ]
19. Lowery MH, Martel JA, Zambrano JP, et al. Noncompaction of the ventricular myocardium: the use of contrast-enhanced echocardiography in diagnosis. J Am Soc Echocardiogr 2003;16:94-96. [ Links ]
20. Williams RI, Masani ND, Buchalter MB, et al. Abnormal myocardial strain rate in noncompaction of the left ventricle. J Am Soc Echocardiogr 2003;16:293-296. [ Links ]
21. Bodiwala K, Miller AP, Nanda NC, Patel V, Vengala S, Mehmood F, et al. Live Three-Dimensional Transthoracic Echocardiographic Assessment of Ventricular Noncompaction. Echocardiography: A Jrnl of CV Ultrasound & Allied Tech 2005; 22:611-620. [ Links ]
22. Campisi R, Di Carli MF.Assessment of coronary flow reserve and microcirculation: a clinical perspective. J Nucl Cardiol 2004;11;1:3-11. [ Links ]
23. Jenni R, Wyss CA, Oechslin EN, et al. Isolated ventricular noncompaction is associated with coronary microcirculatory dysfunction. J Am Coll Cardiol 2002;39:450-454. [ Links ]
24. Hamamichi Y, Ichida F, Hashimoto I, et al. Isolated noncompaction of the ventricular myocardium: ultrafast computed tomography and magnetic resonance imaging. Int J Cardiovasc Imaging 2001;17:305-314. [ Links ]
25. Sedmera D, Thomas PS. Trabeculation in the embryonic heart. Bioessays 1996;18:607. [ Links ]
26. Olsen EN, Srivastava D. Molecular pathways controlling heart development. Science 1996;272:671-676. [ Links ]
27. Vatta M, Mohapatra B, Jimenez S, Sanchez X, Bowles N, Bowles KR, et al. Response to correspondence by Dr Stoellberger et al: do cipher gene mutations cause left ventricular noncompaction with subclinical myopathy? J Am Coll Cardiol 2004;44:1139-1140. [ Links ]
28. Thierfelder L, Sasse-Klaasen S, Gerull B, Jenni R, Oechslin E. Response to Dr Finsterer and Dr Stoellberger: heterogeneous myopathic background of left ventricular hypertrabeculation/ noncompaction. Am J Med Genet 2004;131A:222-223. [ Links ]
29. Stollberger C, Finsterer J. Left ventricular hypertrabeculation/noncompaction. J Am Soc Echocardiogr 2004;17:91-100. [ Links ]
30. Sengupta PP, Mohan JC, Arora R. Noncompaction of left ventricular myocardium in the presence of calcific aortic stenosis in an adult. Indian Heart J 2001;53:766-768. [ Links ]
31. Keren A, Billingham ME, Popp RL. Ventricular aberrant bands and hypertrophic trabeculations: a clinical pathological correlation. Am J Cardiovasc Pathol 1988;1:369-378. [ Links ]
32. Finsterer J, Stollberger C, Feichtinger H. Histological appearance of left ventricular hypertrabeculation/noncompaction. Cardiology 2002;98:162-164. [ Links ]
33. Finsterer J, Stollberger C, Wegmann R, Jarius C, Janssen B. Left ventricular hypertrabeculation in myotonic dystrophy type 1. Herz 2001;26:287-290. [ Links ]
34. Ganame J, Ayres NA, Pignatelli RH. Ventrículo izquierdo no compactado: una forma de miocardiopatía recientemente reconocida. Rev Insuf Cardíaca 2006;1;3:125-130. [ Links ]
35. Digilio MC, Marino B, Bevilacqua M, Musolino AM, Giannotti A, Dallapiccola B. Genetic heterogeneity of isolated noncompaction of the left ventricular myocardium. Am J Med Genet 1999;85:90-91. [ Links ]
36. Sasse-Klaassen S, Probst S, Gerull B, Oechslin E, Nuernberg P, Heuser A, et al. A novel gene locus for autosomal dominant left ventricular noncompaction maps to chromosome 11p15. Circulation 2004;109:2720-2723. [ Links ]
37. Ichida F, Tsubata S, Bowles KR, et al. Novel gene mutations in patients with left ventricular noncompaction or Barth syndrome. Circulation 2001;103:1256-1263. [ Links ]
38. Vatta M, Mohapatra B, Jimenez S, et al. Mutations in Cypher/ZASP in patients with dilated cardiomyopathy and left ventricular non-compaction. J Am Coll Cardiol 2003;42:2014-2027. [ Links ]
39. Sasse-Klaassen S, Gerull B, Oechslin E, et al. Isolated noncompaction of the left ventricular myocardium in the adult is an autosomal dominant disorder in the majority of patients. Am J Med Genet 2003;119A:162-167. [ Links ]
40. Stamou SC, Lefrak EA, Athari FC, et al. Heart transplantation in a patient with isolated noncompaction of the left ventricular myocardium. Ann Thorac Surg 2004;77:1806-1808. [ Links ]