Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. v.3 n.3 Ciudad Autónoma de Buenos Aires jul./sep. 2008
ARTÍCULO ORIGINAL
Cardiomyopathy and secondary mitral insufficiency
Surgical possibilities in the end-stage phase
Enio Buffolo, MD*; João Nelson R. Branco, MD**
* Head Professor Cardiovascular Surgery Department. Federal University of São Paulo, Paulista School of Medicine. São Paulo. Brazil.
** Assistant. Cardiovascular Surgery Department. Federal University of São Paulo, Paulista School of Medicine. São Paulo. Brazil.
Correspondence: Enio Buffolo, MD
Rua Borges Lagoa, 1080 - 7º A
Cep. 04038-031 - São Paulo - SP - Brazil
Phone: 0055-11-5574-6611
Fax: 0055-11-5574-6786
E-mail: enio.buffolo@terra.com.br
Received: 04/02/2008
Accepted: 05/15/2008
Background. Secondary mitral insufficiency is a strong risk factor for death in end stage cardiomyopathies. The possible correction of mitral regurgitation is now been accepted as an alternative to cardiac transplantation in a special subset of patients.
We proposed a surgical approach that consists of implantation of a mitral prosthesis smaller than the annulus and preservation and traction of the papillary muscles to reduce sphericity of the left ventricle.
Methods. Between December 1995 and March 2008, 132 cardiomyopathies were operated on including the following etiologies: ischemic (78), idiopathic (49), Chaga's disease (3), viral (1), and postpartum (1).
The patients were analyzed according to clinical criteria, echocardiographic findings and morphology of left ventricle.
Results. All patients were in an end-stage phase, requiring >2 hospital admissions over the past 3 months, despite receiving full medication.
Furthermore, 8 were in intensive care unit receiving intravenous drugs or intra-aortic balloon counterpulsation, and one was in cardiogenic shock. Hospital mortality was 14.4% (19/132) yet midterm follow-up showed a relatively flat late survival curve, with evidence of improved clinical status, better echocardiographic parameters, and reduction ventricular sphericity.
Conclusions. The high early mortality rate is related to other clinical conditions at the time of surgery. However, the resultant flat survival after this early interval offers a promising long-term therapeutic alternative for the treatment of patients in refractory heart failure with cardiomyopathy that is associated to moderate or severe secondary mitral regurgitation.
Keywords: Secondary Mitral Insufficiency; Cardiomyopathy; Mitral Regurgitation; Mitral Prosthesis; Refractary Heart Failure.
Introduction
Heart failure (HF) has a high incidence and prevalence. North American data reports the diagnosis of 400,000 new cases of HF annually. In spite of adequate drug management, the 5-year survival rate for these patients is only 50%. Furthermore, only 40% of patients in functional class (FC) IV (NYHA - New York Heart Association) have a 1 year survival rate. Heart transplantation is now considered the gold standard treatment for patients with congestive heart failure that is refractory to medical treatment. However, due to the small number of donors, indications for this procedure are limited. Moreover, transplantation is not available in patients of elderly age, in the presence of associated disease, or with inadequate socioeconomic environment1-3.
Other surgical procedures have been suggested to benefit a large number of patients and these include cardiomyoplasty4,5, partial left ventriculectomy (PLV)6,7, mitral valve correction8-10, biventricular pacing11, and myocardial revascularization itself12.
However, no consistently effective surgical alternative is available in this cohort of patients, who suffer a poor short-term outcome due to high mortality rates, from advanced dilated cardiomyopathy.
Mitral insufficiency has a dual impact on this population, since it causes severe hemodynamic changes in end-stage dilated cardiomyopathy, and is simultaneously associated with a shorter survival13-15. Mitral insufficiency is a secondary phenomenon, as the valve itself is not diseased. Its significance is emphasized by the acceptance of correction of mitral regurgitation with a method that reduces annular dimension as an alternative to cardiac transplantation in a special subset of patients16. This technical approach has special impact because routine mitral valve exposure involves a conventional procedure that is well recognized by the cardiac surgeon.
Mitral regurgitation appears late in advanced dilated cardiomyopathy, and is due to the interaction of the following factors: segmental alterations in contractility, papillary muscle dysfunction, dilatation of the mitral valve annulus, and particularly, geometric alteration of the ventricular cavity, which changes from an elliptical to a spherical shape15,17. The sphericity index quantifies this geometric form alteration by comparing the transverse ventricular (short) and long axis; an ellipse has a 0.5 ratio (the length is twice the width) and a sphere is 1.0 due to similar transverse and longitudinal dimensions.
The importance of simultaneous correction of mitral incompetence during partial left ventriculectomy is emphasized by our review of the significant functional improvement that follows coordinating these procedures, and similar observations were made by others18. Recognition of this potential benefit, coupled with understanding that mitral valve exposure involves a routine approach that is well recognized by all cardiac surgeons, led us to propose a new surgical approach. The components include implantation of a mitral prosthesis that is smaller than the annulus, combined with a method that restores the elliptical normal architecture of left ventricle (LV) from inside its cavity.
This goal is reached by shortening the longitudinal axis by bringing the stretched papillary muscles toward the annulus, a technique that reduces the sphericity of the left ventricle and creates an elliptical ventricular shape. This report will summarize our experience in 132 consecutive patients with end-stage cardiomyopathy and secondary mitral insufficiency treated by a novel method of mitral valve implantation.
Materials and methods
One hundred and thirty two patients with dilated cardiomyopathy with moderate or severe secondary mitral regurgitation underwent a new surgical procedure between December 1995 and March 2008. This cohort comprised 74 males (56.1%) with ages varying from 25 to 82 years (63±12). Thirty three patients (25%) were more than 70 years of age. Etiological factors include ischemia in 80 patients (60.6%), idiopathic in 47 (35.6%), Chagas disease in 3, viral in 1, and gestational in 1 patient.
A hundred and nine patients were in FC IV (82.6%) and twenty three in FC III (17.4%) despite adequate medication, and each patient required >2 hospital admissions for advanced heart failure symptoms. Eleven of them were in the intensive care unit receiving inotropes or intra-aortic balloon counterpulsation, two required dialysis, and one was in cardiogenic shock. Twenty-nine patients had undergone prior operations including myocardial revascularization, LV aneurysmectomy, partial ventriculectomy, or resynchronization as either isolated or combined procedures.
Inclusion criteria were end-stage cardiac insufficiency, more than two admissions in the last 3 months and moderate/severe mitral insufficiency diagnosed by transesophageal echocardiography.
Exclusion criteria included: organic mitral pathology, associated aortic valve disease, left ventricular aneurysm, or myocardial revascularization with hibernating myocardium. All operative procedures were carried out following the Institutional Review Board's (IRB) approval.
A standard surgical approach was followed including median sternotomy, cannulation of the aorta and both vena cava, and mitral valve exposure via either left longitudinal or transeptal exposure if left atrial size was small. Prosthesis implantation preserved valvular leaflets as well as the subvalvular apparatus.
The anterior leaflet was sectioned in the middle as in the technique described by Miki et al.19, and a Teflon felt with sutures was placed along the free border of the leaflet cusp and then directed toward each commissure to exert traction on the tops of the papillary muscles. In very large LV chambers, a pledgeted mattress suture is passed across the tip of the papillary muscle, and then inserted through the edge of incised anterior leaflet, and then into the annulus.
This traction maneuver shortens the longitudinal axis of the left ventricle by an amount that is equivalent to the distance between the free border of the cusp and its insertion in the atrio ventricular annulus. When this suture is secured, traction is made the base of the papillary muscles, so that the ovoid shape of the left ventricle becomes restored following suture coaptation to the annulus.
The overall surgical objective to this global spatial relationship also includes shrinking the upper ventricular circumference.
Consequently, the base of the heart was thereby narrowed by implanting a small prosthesis that was usually two sizes smaller than the annulus. Biological prostheses were employed in 127/132 patients. Five mechanical valves were used. Annular sizes ranging from 25 to 33 mm including 25 (4), 27 (67), 29 (26), 31 (32), and 33 (3). Additionally, 70% (56/80) of ischemic patients underwent associated procedures including revascularization (25), exclusion fibrotic areas (26), or both (3), and resynchronization (2).
Postoperative hospital discharge follow-up examination evaluated functional classification, pharmacological management, serial echocardiographic evaluation, and morbidity and mortality. The mean follow-up period was 39±18 months. Eleven patients underwent pre and postoperative nuclear magnetic resonance (NMR) examination to evaluate the left ventricular sphericity index, obtained by comparison of the ratio of the transverse/longitudinal axis to generate a width/length relationship.
The Friedman test (multiple comparison tests) was used to compare distributions of pre and postoperative results. The alpha error was established as p=0.01, and the Kaplan-Meier method was used to generate actuarial survival curves.
Results
Hospital mortality (30th day) was 14.4% (19/132), and the primary causes of death were low cardiac output (7), multiple organ failure (4), cerebrovascular accident (2), bronchopneumonia (3), refractory arrhythmias (1), sudden death (1), and mesenteric thrombosis (1). A hundred thirteen patients were discharged from hospital and had a follow-up varying from 1 to 118 months (mean 39±18).
The actuarial survival curve, including hospital mortality, is shown in Figure 1. The predominant mortality decline occurred in the immediate perioperative interval (first 2 months), as a relatively flat late trajectory was observed following hospital discharge indicating a relatively stable in the late course of the survivors.
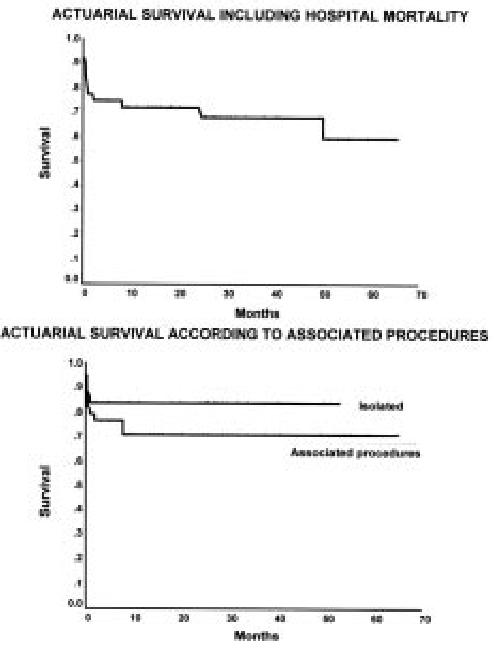
Figure 1. Actuarial survival curve of the first 116 patients showing the mitral drop due to hospital mortality followed by a relatively flat and stable curve.
Substantial reduction in morbidity was also observed, since the postoperative functional class improved significantly. Whereas preoperative evaluation showed that 82.6% were in FC IV and 17,4% in III, late postoperative evaluation demonstrated that 77% were in FC II, 15% in III, and 8 in IV. Within this class IV group, three patients have undergone heart transplantation, and one is on the transplant waiting list.
Functional evaluation was also made by transthoracic echocardiographic measurements, as ejection fraction, stroke volume and left ventricular volumes were measured preoperatively, before hospital discharge, and 6 months postoperatively, as displayed in Figures 2, 3 and 4.
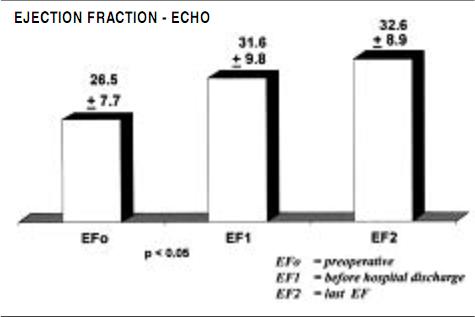
Figure 2. Evolution of the echo ejection fraction valves in period pre operative, pre hospital discharge and 6 months later (mean).
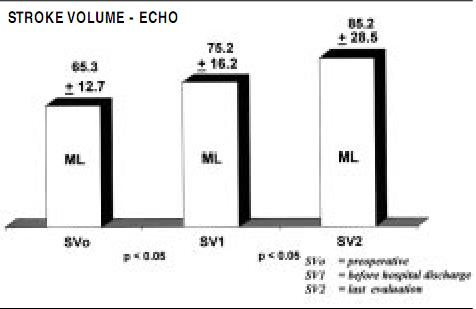
Figure 3. Stroke volume echo showing significant increase due to elimination of the regurgitant volume.

Figure 4. Evolution of the left ventricular volumes (diastolic and systolic volumes) without showing significant reduction.
These functional changes were associated with a striking alteration in ventricular shape, as observed in Figure 5 that compares pre and postoperative echocardiographic analyses in the same patient. Quantification of how restoration affected ventricular sphericity was done in 11 consecutive patients. Figure 6 shows how NMR analysis showed restoration of ventricular shape during mitral implantation and decreased sphericity index to thereby allow development of a more elliptical contour.

Figure 5. Echocardiogram taken before and after implantation of bioprosthesis and papillary muscle implantation. Note the change in shape from spherical chamber (left) to elliptical configuration (right) postoperatively.
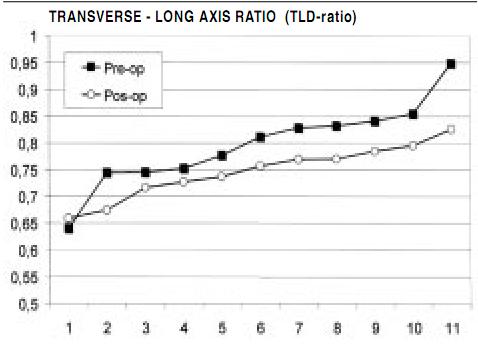
Figure 6. Magnetic resonance values for pre and postoperative sphericity index (relationship between transverse and longitudinal axis) in 11 patients. Note that postoperative indices become more elliptical, as the sphericity index reduces, indicating less sphericity (0.5 = ellipse, 1.0 = sphere).
Discussion
The connections of the papillary muscles to the mitral valve in the normal heart insure the natural elliptical shape, by anchoring the V-shaped chamber through their connections between the chords and the ventricular wall. Conversely, detachment of these connections during mitral valve replacement changes ventricular geometric shape towards a spherical configuration.
The importance of maintaining this normal connection is clear, since techniques of valve replacement in nonfailing hearts are governed by routinely maintaining leaflet, chord, and papillary muscle connections to avoid iatrogenic disruption of ventricular geometric architecture.
Tethering of the valvular apparatus exists during dilation, with disruption of the coaptation capacity of the valve leaflets as a central anatomic feature the stretched ventricle that accompanies dilated cardiomyopathy16. Similar impairment of normal papillary muscle function feature exists whether the underlying disease is remote muscle stretch after a myocardial infarction or intrinsic myocyte damage from idiopathic or inflammatory cardiomyopathy. Both factors were present in the patient population reported, and this novel surgical approach of ventricular restoration via the papillary muscles was instituted because of (a) recognition of the importance of rebuilding this geometric configuration when dealing with valve implantation in dilated failing hearts, and (b) our prior knowledge of the functional benefits that result after adding correction of mitral incompetence during PLV in the treatment of nonischemic cardiomyopathy.
The principals of salvaging the leaflet and chordal apparatus were described in 1988 by Miki et al.19, whereby he made the same V-shaped incision into the anterior leaflet as done in this study. However, the described approach differs since Miki only attached the leaflets and chords to the annulus, whereas the described method in this report sometimes, in much dilated hearts, places a mattress suture through the tip of the papillary muscle in this process. Whereby a more conical chamber is created as this suture was secured.
The principles of this procedure include (a) the commonality of conventional surgical knowledge about how to routinely approach the mitral valve, so that no new exposure method must be learned, and (b) showing how modification of an established method mitral valve implantation can be expanded to employ the traction concept, as the tips of the stretched papillary muscle head are withdrawn into the annulus during valve implantation. This modification of papillary muscle architecture now allows these natural structures to exert a restoration effect on the underlying ventricle by making its shape more elliptical.
The echocardiographic, magnetic resonance imaging (MRI), and clinical data, support the importance of restoring a more normal shape to these failing dilated hearts. Functional support of the improved shape was provided by echo data of a more elliptical contour, improved ejection fraction, reduced end-systolic volume index, and, most importantly, rendering 77% of patients into a NYHA class II category, when their preoperative classification included 83% in NYHA class IV and 17% in class III. Pre and postoperative MRI testing evaluated the sphericity index and quantified a return to the more elliptical shape, the desired geometric configuration from this novel procedure that coordinates ventricular rebuilding with mitral valve implantation.
Two aspects of this 132 patient experience become clear by evaluation of the survival curves. First, there was a 14.4% hospital mortality, and the predominance of deaths occurred within the initial 2-3 month interval. This finding implies that three factors must be considered, including urgent introduction of this procedure in very high-risk patients, failure to address and exclude the nonfunctional area or other associated procedures in 56/80 ischemic patients, as well as addressing a more detailed investigation of the methods of myocardial protection in these very advanced patients. For example, a similar adverse influence of urgent procedures was reported by Suma and coworkers18,20 when a ventricular approach was applied to patient with nonischemic cardiomyopathy.
Furthermore, we considered absence of scar as a contraindication to exclude nonfunctional muscle in ischemic dilated cardiomyopathy. However, trabecular scar may be present21.
The second prognostic factor relates to the relatively flat trajectory of the survival curve following the early loss of high- risk patients. This observation implies that restoration of shape may introduce a geometric configuration that allows a good long-term future, since the expected downward survival trajectory would be otherwise expected if such elliptical form change did not alter the natural course of the disease process.
Mitral valve implantation for secondary mitral regurgitation in dilated ischemic cardiomyopathy has been a procedure with limited effect in dilated ischemic cardiomyopathy. However, prior approaches only addressed the valve22-24. The new method in this report uses the retained papillary muscles as an anchor to rebuild shape during valve replacement, and thereby introduces a ventricular aspect to this commonplace procedure.
The preliminary data implies that this novel look into a valve/ventricular procedure for end-stage cardiomyopathy may merit further consideration in the future. Furthermore, this current application of the traction effect of the papillary muscles may be further expanded to simultaneously narrow the widening that sometimes exists between the bases of the papillary muscles in the dilated chamber. This approach has also the advantage to prevent further dilatation of only mitral valve repair, already reported by others25.
Recently we observed in a late follow-up of two transplanted hearts, that we need to develop a surgical strategy to prevent septal expansion that may occur despite mitral prostheses implantation and remodeling.
Conclusion
Mitral valve prosthesis implantation and left ventricular restoration via the papillary muscles in end-stage cardiomyopathy with significant mitral regurgitation may offer an alternative to heart transplantation.
These early and late findings demonstrate better quality of life, improvement in several echocardiographic parameters of function, and reduction in sphericity of the LV. The hospital mortality rate is increased in these high-risk patients, but the relatively flat trajectory of the late survival curve implies that improved prognosis may be expected in this cohort of patients with end-stage heart disease.
1. Evans RW, Orians CE, Ascher NL. The potential supply of organ donors. An assessment of the efficacy of organ procurement efforts in the United States. J Am Med Assoc 1992;267;2:239-46. [ Links ]
2. Bourassa MG, Gurne O, Bangdiwala SI, Ghali JK, Young JB, Rousseau M, Johnstone DE, Yusuf S. Natural history and patterns of current practice in heart failure. The Studies of Left Ventricular Dysfunction (SOLVD) Investigators. J Am Coll Cardiol 1993;22(4 Suppl. A):14A-9A. [ Links ]
3. Bassie BM, Parker M. Congestive heart failure current controversies in future projects. Am J Cardiol 1990;66:429-30. [ Links ]
4. Carpentier A, Chachques JC, Acar C, Relland J, Mihaileanu S, Bensasson D, Kieffer JP, Guibourt P, Tournay D, Roussin I. Dynamic cardiomyoplasty at seven years. J Thorac Cardiovasc Surg 1993;106;1:42-52. [ Links ]
5. Patel HJ, Lankford EB, Polidori DJ, Pilla JJ, Plappert T, John Sutton MS, Acker MA. Dynamic cardiomyoplasty: its chronic and acute effects on the failing heart. J Thorac Cardiovasc Surg 1997;114;2:169-78. [ Links ]
6. Batista RJ, Santos JL, Takeshita N, Bocchino L, Lima PN, Cunha MA. Partial left ventriculectomy to improve left ventricular function in endstage heart disease. J Card Surg 1996;11;2:96-7. [ Links ]
7. McCarthy PM, Starling RC, Wong J, Scalia GM, Buda T, Vargo RL, Goormastic M, Thomas JD, Smedira NG, Young JB. Early results with partial left ventriculectomy. J Thorac Cardiovasc Surg 1997;114:1-11. [ Links ]
8. Buffolo E, Paula IA, Palma H, Branco JN. A new surgical approach for treating dilated cardiomyopathy with mitral regurgitation. Arq Bras Cardiol 2000;74;2:129-40. [ Links ]
9. Bolling SF, Deeb GM, Brunsting LA, Bach DS. Early outcome of mitral valve reconstruction in patients with end-stage cardiomyopathy. J Thorac Cardiovasc Surg 1995;109;4:676-82. [ Links ]
10. Calafiore AM, Gallina S, Contini M, Iaco A, Barsotti A, Gaeta F, Zimarino M. Surgical treatment of dilated cardiomyopathy with conventional techniques. Eur J Cardiothorac Surg 1999;16(Suppl. 1):S73-8. [ Links ]
11. Alonso C, Leclercq C, Victor F, Mansour H, de Place C, Pavin D, Carre F, Mabo P, Daubert JC. Electrocardiographic predictive factors of long-term clinical improvement with multisite biventricular pacing in advanced heart failure. Am J Cardiol 1999;84;12:1417-21. [ Links ]
12. Dreyfus GD, Duboc D, Blasco A, Vigoni F, Dubois C, Brodaty D, de Lentdecker P, Bachet J, Goudot B, Guilmet D. Myocardial viability assessment in ischemic cardiomyopathy: benefits of coronary revascularization. Ann Thorac Surg 1994;57;6:1402-7. [ Links ]
13. Boltwood CM, Tei C, Wong M, Shah PM. Quantitative echocardiography of the mitral complex in dilated cardiomyopathy: the mechanism of functional mitral regurgitation. Circulation 1987;76:777-85. [ Links ]
14. Kono T, Sabbah HN, Rosman H, Alam M, Jafri S, Goldstein S. Left ventricular shape is the primary determinant of functional mitral regurgitation in heart failure. J Am Coll Cardiol 1992;20;7:1594-8. [ Links ]
15. Romeo F, Pelliccia F, Cianfrocca C, Gallo P, Barilla F, Cristofani R, Reale A. Determinants of end-stage idiopathic dilated cardiomyopathy: a multivariate analysis of 104 patients. Clin Cardiol 1989;12;7:387-92. [ Links ]
16. Bolling SF, Pagani FD, Deeb GM, Bach DS. Intermediate-term outcome of mitral reconstruction in cardiomyopathy. J Thorac Cardiovasc Surg 1998;115;2:381-6. [ Links ]
17. Chandraratna PAN, Aronow WS. Mitral valve ring vs dilated ventricle. Chest 1987;79:2. [ Links ]
18. Suma H, Isomura T, Horii T, Buckberg G, RESTORE Group. Role of site selection for left ventriculoplasty to treat idiopathic dilated cardiomyopathy. Heart Fail Rev 2005;9;4:329-36. [ Links ]
19. Miki S, Kusuhara K, Veda Y. Mitral valve replacement with preservation of chordae tendinae and papillary muscles. Ann Thorac Surg 1998;45:28-34. [ Links ]
20. Isomura T, Suma H, Horii T, Sato T, Kobashi T, Kanemitsu H, Hisatomi K. Mid-term ventricular function after left ventricular restoration in patients with non-ischemic dilated cardiomyopathy. Eur J Cardiothorac Surgery 2000;19:684-689. [ Links ]
21. Athanasuleas CL, Buckberg GD, Stanley AW, Siler W, Dor V, Di Donato M, et al. Surgical ventricular restoration: the RESTORE Group experience. Heart Fail Rev 2004;9;4:287-97. [ Links ]
22. Dahlberg PS, Orszulak TA, Mullany CJ, Daly RC, Enriquez-Sarano M, Schaff HV. Late outcome of mitral valve surgery for patients with coronary artery disease. Ann Thorac Surg 2003;76;5:1487-539. [ Links ]
23. Enriquez-Sarano M, Schaff HV, Frye RL. Mitral regurgitation: what causes the leakage is fundamental to the outcome of valve repair. Circulation 2003;108;3:253-6. [ Links ]
24. Buckberg GD, Menicanti L, de Oliveira SA, Isomura T. Restoring papillary muscle dimensions during restoration in dilated hearts. Interact Cardiovasc Thorac Surg 2005;4:475-477. [ Links ]
25. Glammarco G, Liberi R, Giancani M, Canosa C, Gallina S, Francisco A, Spera G, De Mauro M. Recurrence of functional mitral regurgitation in patients with dilated cardiomyopathy undergoing mitral valve repair: how to predict it? Interactive Cardiovasc and Thorac Surg 2007;6:340-344. [ Links ]














