Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Insuficiencia cardíaca
versão On-line ISSN 1852-3862
Insuf. card. v.3 n.3 Ciudad Autónoma de Buenos Aires jul./set. 2008
RIÑÓN E INSUFICIENCIA CARDÍACA
¿Síndrome cardiorrenal o renocardíaco?
Parte II
Mónica G. Sultán* y José N. L. Osso**
* Médica cardióloga. Consultorios externos de Cardiología. Servicio de Trasplante Cardiopulmonar. Instituto FLENI. Ciudad de Buenos Aires. República Argentina.
** Coordinador Médico. Centro Nefrológico Zárate-Campana. Provincia de Buenos Aires. República Argentina.
Correspondencia: Dr. José N. L. Osso
losso@s5.coopenet.com.ar
Recibido: 02/10/2007
Aceptado:12/05/2008
Palabras clave: Insuficiencia renal; Clearance de creatinina; Hipertensión arterial; Filtrado glomerular; Insuficiencia cardíaca
Introducción
Como ya se ha consignado en la Parte I1 de este artículo, la enfermedad cardiovascular es un gran desafío a resolver cuando coexiste con insuficiencia renal crónica (IRC), ya que el 43,6% de todas las muertes en pacientes que presentan el estadio final de la insuficiencia renal (EFIR) son debidas a causas cardíacas2.
La muerte de causa cardíaca es 10-20 veces más común en pacientes con IRC, que en la población general que no la padece, con una gran prevalencia de hipertrofia ventricular izquierda (HVI) y enfermedad arterial coronaria, 75% y 40% respectivamente3. Por lo tanto, una elevación en la creatinina sérica o una disminución en el clearance de creatinina en pacientes con insuficiencia cardíaca congestiva (ICC) descompensada aguda está asociada a un peor pronóstico con mayor mortalidad cardiovascular, independientemente de otros factores de riesgo. Este incremento de la mortalidad es aún mayor si está acompañado de oliguria, edemas, hiponatremia o refractariedad al tratamiento diurético.
Entre los pacientes con insuficiencia cardíaca (IC), varios son los hallazgos clínicos comunes a los que se desarrollan en la insuficiencia renal (IR): mayor edad, disfunción renal previa, diabetes (DBT) e hipertensión arterial (HTA), y a su vez el decremento de la función renal genera una serie de anormalidades que incluyen cambios en la coagulación, fibrinólisis, disfunción endotelial, anemia, proteinuria, alteración del balance calcio-fósforo, sistema renina angiotensina aldosterona (SRAA), anormalidades lipídicas y arritmias2. La IC, en adición a la IR, sorpresivamente no sólo es frecuente en pacientes con disfunción sistólica, el 37 al 55% tienen fracción de eyección (FE) ≥ al 40%, motivo por el cual no parece estar caracterizada por "bajo gasto cardíaco", ya que una proporción de estos pacientes se presentan hipertensos y en contraste se hallaron signos de empeoramiento de la IR (retención de H2O y Na+) taquipnea, rales, ingurgitación yugular. Estas observaciones sugieren que la fisiopatología de la disfunción renal es mucho más compleja que simplemente en un reducido volumen cardíaco. Factores vasculares, tales como el óxido nítrico, las prostaglandinas, los péptidos natriuréticos y las endotelinas, pueden mediar la perfusión renal, independientemente de la hemodinamia cardíaca. Un disbalance en este sistema causaría, a menudo, mayor deterioro en ambas funciones, mayor disminución del flujo renal, mayor activación del SRAA, reducción del óxido nítrico en el endotelio, activación del sistema nervioso simpático, activación de mediadores inflamatorios; lo cual conduciría a un círculo vicioso.
Desde la más reciente concepción de la inmunología es ya sabido que en la IRC la inflamación juega un importante rol en la patogenia del deterioro cardiovascular, y se la conoce como nuevo factor emergente. Se sabe que existen citoquinas que son citoprotectoras en episodios agudos, pero que aumentan el riesgo cardiovascular en forma crónica. Los adipocitos, por ejemplo, producen una gran cantidad de mediadores que también son producidas por los monocitos como la interleucina-6 (IL-6) y el factor de necrosis tumoral (FNT) alfa, como asimismo, las proteínas específicas de estas células como la leptina y la adiponectina que se correlacionan inversamente con elíndice masa corporal (IMC) y la resistencia insulínica. En este contexto, es sabido que en el sistema cardiovascular hay una sobrerregulación de citoquinas proinflamatorias en situaciones de sobrecarga de presión, isquemia, hipertrofia en ICC y que inicialmente tienen dicha función protectora. Pero de mantenerse esta situación en el tiempo, presentan un efecto deletéreo4. Si a esto se agrega que muchas de estas citoquinas son depuradas a través de la vía renal, es razonable entender por qué el 50% ó más de los pacientes en estadios avanzados de IRC tienen altos niveles de mediadores de micro inflamación5.
Un dato interesante es que el FNT alfa no es producido en el miocardio normal, pero en situaciones de sobrecarga de volumen o de presión del ventrículo izquierdo (VI) se expresa en un aumento del FNT. Además, cuando aumenta la actividad simpática y se produce un aumento crónico del sistema beta adrenérgico se estimula la secreción de FNT alfa y de IL-6 (Figura 16 y Tabla 17).

Figura 1. Base de datos de San Francisco. Enfermedad renal crónica y riesgo de muerte y de eventos cardiovasculares. Adaptado de Go y col.6
La interacción entre la descompensación cardíaca (cualquiera fuere la FE) activaría también, independientemente, el sistema neurohormonal, la respuesta inflamatoria, el sistema nervioso simpático, el sistema inmune, etc., lo cual conduciría a un mayor daño estructural y funcional tanto del corazón como del riñón, fallo renal y cardíaco, o cardiorrenal, mutuamente amplificarían la falla progresiva en ambos órganos. El proceso es complejo y el deterioro de la función renal en pacientes con este síndrome conduce a la resistencia de muchas terapias estándares y a la exacerbación de los síntomas. El propósito de este artículo es establecer los recursos terapéuticos con los que contamos hoy en día para la corrección de estas asociaciones que sustancialmente aumentan el riesgo de muerte, y apoyar el concepto de que este desafío terapéutico debe ser enfrentado desde el punto de vista cardiológico y nefrológico.
Tratamiento
Las guías consensuadas por el American College of Cardiology (ACC) y la American Heart Association (AHA), publicadas en Circulation en el año 2005, han aportado lineamientos adecuados para el tratamiento de la IC y no son objeto de discusión en este trabajo. Nada nuevo se puede decir respecto de la importancia de la dieta hiposódica, mejorar la anemia y de las medidas no farmacológicas.
Respecto del arsenal farmacológico que disponemos podemos ampliar algunos conceptos con el solo fin de mejorar la comprensión de nuestras actitudes médicas cuando indicamos un fármaco en pacientes con insuficiencia cardíaca y renal asociadas.
Para ello, el primer paso es saber cuál es la función renal de cada paciente, sabiendo que el clearance de creatinina informado por el laboratorio, generalmente, sobreestima dicha función y para ello sólo es necesario una simple corrección según la siguiente fórmula:
Esto nos permite establecer que los pacientes con clearance calculados ≤ 60 ml/min deben contar con la evaluación de un nefrólogo, dado que desde ese valor comienzan las complicaciones de la IRC, como la anemia y el hiperparatiroidismo.
Existen fórmulas más exactas pero también más complejas.
Rol de la eritropoyetina
Datos desde cohortes de seguimiento > 5000 pacientes con IRC han demostrado que cerca del 50% de los pacientes, tenía concentración de Hb < 12 g/dl. Adicionalmente, con el progreso de la IRC desde estadios 1 al 3, el riesgo de tener concentración de Hb < 12 g/dl, se incrementa 2 veces8 . La anemia es frecuentemente observada en pacientes con IC y la incidencia parece estar incrementada con el empeoramiento de la misma9. La incidencia se incrementa del 9% en IC clase funcional (CF) I, al 79% en CF IV. Los cambios hemodinámicos compensatorios que resultan de la anemia, por la reducida liberación y utilización del O2, como el aumento de la frecuencia cardíaca (FC) y del volumen minuto (VM), resultan en > isquemia miocárdica, HVI, dilatación del VI e IC10.
Por otra parte en el síndrome cardiorrenal (SCR) severo, no sólo hay un absoluto déficit de eritropoyetina (EPO), sino también disminución de la sensibilidad a la EPO. Esto provocaría una más pronunciada anemia, en presencia de IC. Los receptores EPO están presentes en el corazón, riñón, sistema vascular, en donde su activación resulta en anti-apoptosis, proliferación, posiblemente antioxidación y anti-inflamación. Por lo tanto, la EPO puede mejorar tanto la función renal como la cardíaca11 (Figuras 212, 39 y 4).
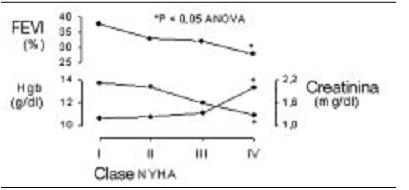
Figura 2. Relación entre la severidad de la anemia, de la insuficiencia renal crónica y de la insuficiencia cardíaca congestiva: análisis retrospectivo de 142 pacientes con insuficiencia cardíaca congestiva. (Adaptado de Silverberg y col.)9
FEVI: Fracción de eyección del ventrículo izquierdo. Hgb: hemoglobina. NYHA: New York Heart Association.

Figura 3. Enfermedad cardiovascular y anemia. (Adaptado de Anand y col.)12

Figura 4. Efectos de la angiotensina II en el transporte lipídico y en la disfunción endotelial.
Rol de los IECA
Los inhibidores de la enzima conversora de la angiotensina (IECA) disminuyen la formación de angiotensina (ANG) II, disminuyendo tanto la resistencia arteriolar como la venosa.
Este efecto de descarga sobre el VI, produce una elevación del volumen minuto, una mejoría sintomática y disminuye un 25% la mortalidad cardiovascular de uno a tres años, debido a un enlentecimiento en la velocidad de progresión de la disfunción cardíaca. Cuando se utiliza un IECA y un diurético de asa, podremos aumentar la concentración de sodio plasmático en pacientes con IC y mejorar la hiponatremia. Este sinergismo suele reflejar la interacción de dos factores que determinan un aumento de la excreción de agua libre: 1) aumento de la oferta de agua al túbulo colector por efecto del diurético de asa y 2) disminución de la reabsorción de agua en el túbulo colector, ya sea tanto por la reducción de la hormona antidiurética (HAD) (debido al aumento del volumen minuto) como, probablemente, a una resistencia a la HAD.
Dado el aumento del VM y del flujo sanguíneo renal se podría asumir que los IECA también aumentarían el filtrado glomerular. Sin embargo, esta respuesta sólo se obtiene del 10 al 25% de los pacientes, mientras que el aumento de la creatinina plasmática es mucho más frecuente. Estas pequeñas disminuciones de la función renal suelen detectarse dentro de la primera semana.
La función renal tiende a mantenerse estable a menos que se presente alguna complicación, como por ejemplo, un nuevo deterioro de la función cardíaca.
El mecanismo por el cual los IECA producen una disminución del filtrado medular en IC es el mismo que presentan algunos pacientes con estenosis arterial renal bilateral: una reducción preferencial de la resistencia arteriolar eferente con la consiguiente disminución de la presión intraglomerular que interfiere con la normal respuesta de autorregulación. Los niveles basales de función renal se suelen lograr mediante la disminución de la dosis de diuréticos que determinará una disminución en la dependencia la ANG II de dicho filtrado glomerular.
Estas disminuciones en el filtrado glomerular pueden ser minimizadas o prevenidas, combinando bajas dosis iniciales de IECA más una disminución transitoria de la dosis de diuréticos. La creatinina y el potasio deben medirse dentro de la primera semana, que es cuando pueden aparecer los cambios hemodinámicos renales o los trastornos de la excreción de potasio.
Los pacientes con IR previa son los que presentan un mayor riesgo de hiperkalemia. La IC avanzada se asocia con disminución de la oferta de sodio y agua a los sectores de secreción de potasio en los túbulos colectores. La adecuada secreción de potasio en estos pacientes depende de un aumento de la secreción de aldosterona, una respuesta que puede ser parcialmente ineficaz debido a una disminución en la producción de ANG II.
Además, los IECA tienen otros efectos beneficiosos como inhibir la proliferación celular, disminuir la apoptosis, inhibir la fibrosis en la vasculatura en general y, especialmente, en el riñón y el corazón. También, tienen un efecto beneficioso sobre el balance fibrinolítico, ya que al inhibir la formación de ANG II (que posee efectos protrombóticos) y a través de la promoción de la acumulación de bradiquinina tendrían un efecto antitrombótico13.
Los estudios de investigación básica y clínicos han demostrado que los IECA previenen la fibrosis miocárdica y mejoran el remodelado ventricular post infarto agudo de miocardio (IAM) y en la ICC14.
El uso de IECA mejora la sintomatología y el rendimiento ergométrico en pacientes con IC de origen no isquémico moderado a intenso. El primer estudio realizado en esta dirección fue el CONSENSUS (Cooperative North Scandinavian Enalapril Study) en pacientes en CF IV de la New York Heart Association (NYHA)15, donde se halló un descenso del 40% de la mortalidad de los tratados frente a placebo. Posteriormente, el estudio SOLVD (Study of Left Ventricular Dysfunction)16 , también con enalapril, realizado en pacientes con IC asintomática con un descenso de la FE superior al 35% logró un descenso menor, pero también significativo de la mortalidad (16%).
Resultados similares ofreció el estudio VHeFT-2 (Veteran Administration Heart Failure Trial)17. Siguiendo la línea de los IECA, los antagonistas de los receptores de la angiotensina (ARA) también han demostrado ser clínicamente capaces de reducir la mortalidad secundaria a ICC de manera igual a aquéllos, como demuestran los estudios ELITE I (Evaluation of Losartan In The Elderly)18, ELITE II19 y RESOLVD (Randomized Evaluation of Strategies of Left Ventricular Dysfunction)20. Este último estudio incluyó una nueva variable en su análisis, un grupo de tratamiento combinado con enalapril y candesartán asociados (n=332), frente al tratamiento con enalapril (n=107) o tratamiento con candesartán aislados (n=327), durante un período de seguimiento de menos de un año. La combinación no fue superior a los fármacos aislados respecto a la mortalidad, pero ofreció una mejoría significativa en el objetivo combinado de mortalidad y hospitalización por IC.
Los pacientes tratados con la combinación presentaban también una mejoría de los volúmenes telesistólico y telediastólico del VI respecto a los otros grupos. Estos cambios se asociaban con un descenso de los niveles plasmáticos de aldosterona, péptido natriurético cerebral y ANG II que no ocurrían en los grupos tratados solamente con enalapril o solamente con candesartán (Tabla 2).
Inhibidores de los receptores AT II (ARA II)
En la ICC, donde las concentraciones de ANG II están aumentadas, el bloqueo de los receptores AT1 a nivel de la vasculatura renal produce un aumento del flujo sanguíneo y del filtrado glomerular, a nivel tubular disminuye la reabsorción tubular de sodio y a nivel de la inervación simpática terminal produce una disminución de la liberación de epinefrina. Todos estos efectos aumentan la capacidad de excreción de sodio21 (Figuras 5, 622 y 723).

Figura 5. Estudios con bloqueantes de los receptores de la angiotensina.

Figura 6. IDNT (Irbesartan in Diabetic Nephropathy Trial): Endpoint primario - Tiempo a la duplicación de la creatinina sérica, estadio final de la enfermedad renal o muerte. (Adaptado de Lewis et al.)22

Figura 7. RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan): Componentes primarios. Duplicación de la creatinina sérica. (Adaptado de Brenner et al.)23
El IDNT (Irbesartan in Diabetic Nephropathy Trial)24 demostró que la amlodipina no era útil para tratar el punto final primario que era la duplicación de la creatininemia, IRC terminal o muerte (Tabla 3 y Figura 8).

Figura 8. Cambios en la angiotensina.
Sin embargo, el primer ensayo clínico de tamaño y duración suficiente diseñado para demostrar que la asociación de IECA y ARA era superior a la administración de IECA aislados en ICC fue el estudio Val-HeFT (Valsartan Heart Failure Trial)25. Este estudio incluyó pacientes con ICC CF II a IV de la NYHA, con una FE < 40% en el ecocardiograma y un volumen telediastólico del VI > 2,9 cm/m2, todos tratados con IECA, que recibieron además valsartán (n=2511) o placebo (n=2499). La duración del seguimiento fue superior a 2 años. No hubo diferencias significativas en la mortalidad entre los grupos, pero sí en el objetivo combinado de mortalidad y morbilidad (RR=0,87; p=0,009), con una reducción del 27,7% en la incidencia de hospitalización. También mejoró la sintomatología de los enfermos y la FE en el grupo tratados con valsartán (e IECA). Detectándose una reducción de los niveles plasmáticos de epinefrina y aldosterona en los pacientes tratados con ARA frente a placebo (Figura 9).

Figura 9. Hospitalización por insuficiencia cardíaca congestiva.
Aunque los resultados del Val-HeFT no demostraron definitivamente la superioridad de la terapia combinada sobre el uso aislado de IECA en pacientes con ICC, ofrecieron perspectivas interesantes en cuanto a la utilidad de asociar ARA a IECA en pacientes con sintomatología importante y hospitalizaciones reiteradas. Los efectos favorables, desde el punto de vista humoral y ecocardiográfico, permitirían esperar que, en un seguimiento más largo, estos efectos analíticos pudieran transformarse en realidades clínicas26.
Sobre la base del estudio Val-HeFT, el valsartán se aprobó para el tratamiento de la IC en pacientes con intolerancia a los IECA.
El JNC 7 (Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure's) también reconoce como indicación a los ARA para la IC con HTA27.
El estudio Saitama (E-Cost)28 demostraba que los pacientes con historia previa de enfermedad cardiovascular tenían mayores riesgos de internaciones por eventos cardiovasculares y era el primer estudio prospectivo en demostrar que el candesartán era efectivo para reducir los eventos en pacientes hipertensos con coexistencia de enfermedad cardiovascular y enfermedad renal crónica, especialmente para la prevención de ICC (Figuras 10, 1128, 1229, 1330 y 1432).

Figura 10. Incidencia de eventos cardiovasculares en pacientes con historia de enfermedad cardiovascular. Candesartán redujo significativamente la incidencia total de eventos cardiovasculares e insuficiencia cardíaca crónica. *p<0,05 vs los grupos tratados convencionalmente.

Figura 11. Incidencia de eventos cardiovasculares en pacientes sin historia de enfermedad cardiovascular. No hubo diferencia significativa en la incidencia de enfermedades cardiovasculares entre ambos grupos28.

Figura 13. La angiotensina II (AII) juega un rol central en el daño de órgano. (Adaptado de Willenheimer et al.)30
AT1 receptor: receptor de la angiotensina. TFG: tasa de filtrado glomerular. IM: infarto de miocardio.

Figura 14. Meta-análisis de estudios con inhibidores de la enzima convertidora de la angiotensina y bloqueantes de los receptores de la angiotensina en personas con nefropatía diabética. (Adaptado de Strippoli et al.)32
Los IECA y los ARA II protegen al riñón y al corazón de manera independiente de sus efectos antihipertensivos.
Esta protección se produce tanto por efectos hemodinámicos (disminución de tensión arterial, disminución de la presión capilar glomerular con dilatación de la arteriola eferente, disminución de proteinuria) como no hemodinámicos (inhibición de la infiltración macrófago/monocito, disminución de la micro inflamación y disminución del stress oxidativo) (Tablas 4 y 5).
Ya existen muchos estudios publicados, tanto en los '80 como en los '90, que han demostrado cómo los IECA reducen el riesgo de muerte y los eventos cardiovasculares después de un IAM, y que mejoran la sobrevida en pacientes con disminución de la función VI. Estos efectos cardioprotectores se evidencian, particularmente, en pacientes internados por ICC, tanto en el estudio RENAAL (Reduction of Endpoints in NIDDM with the Angiotensin II Antagonist Losartan)33 como en el IDNT, utilizando losartán. Estas 2 clases de drogas parecen ofrecer beneficios comparables en cuanto a la evolución cardiovascular, tanto en pacientes con IC como en pacientes post IAM.
También existen muchas demostraciones de los efectos de la aldosterona en la progresión de la fibrosis miocárdica, por lo que se sabe que el uso de espironolactona o eplerenona disminuye la mortalidad en pacientes con IC avanzada.
El efecto renoprotector de los IECA está demostrado tanto en pacientes diabéticos como no diabéticos y en cualquier estadio. Estas drogas además disminuyen el riesgo de pasar de la normoalbuminuria a la microalbuminuria. Tanto los IECA como los ARA II disminuyen la tasa de progresión de la microalbuminuria hacia la proteinuria significativa. Actualmente, existe interés en evaluar si la aldosterona puede estar implicada en la progresión de la IRC, pero independientemente de la inhibición del SRA34.
La disfunción endotelial es el escalón fisiopatológico inicial para la progresión del deterioro vascular que determina tanto la enfermedad cardiovascular como la enfermedad renal crónica. La ANG II juega un rol prioritario en la disfunción endotelial. Por lo tanto, el bloqueo del SRAA con un bloqueante de los receptores y/o un IECA nos ofrece la posibilidad lógica de revertir dicha disfunción, disminuir la microalbuminuria y, en consecuencia, mejorar tanto el pronóstico renal como el cardíaco. Tanto los IECA como los ARA actúan a diferentes niveles del SRA y algunas evidencias recientes muestran sus distintos niveles de acción a nivel endotelial. Además de disminuir la tensión arterial, ya existen estudios suficientes que demuestran que los ARA disminuyen el deterioro de órganos blancos, incluyendo mejoría de la disfunción endotelial, endurecimiento arterial, progresión de la IR en DBT tipo 2, proteinuria e HVI. Del estudio ONTARGET (ONgoing Telmisartan Alone in combination with Ramipril Global Endpoint Trial) se espera saber si la mejoría de la disfunción endotelial también reduce los eventos cardiovasculares y renales en pacientes de alto riesgo y si existen diferencias en la utilización del IECA, el ARA o ambos (doble bloqueo)35.
Resumiendo, los IECA claramente mejoran los síntomas, la morbilidad y la sobrevida en pacientes no urémicos que tienen IC, y en pacientes con IRC36.
Los IECA también demostraron beneficios en aquellos que tenían tanto disfunción sistólica como diastólica37,38, reduciendo la progresión de la enfermedad renal, la proteinuria y la regresión de la HVI. La proteinuria es un reconocido marcador de disfunción endotelial e incrementada permeabilidad vascular y los sujetos con microalbuminuria tienen una alta prevalencia de mortalidad cardiovascular ya que se asocio con HVI y anormal geometría del VI39. Por lo tanto, a los pacientes que desarrollan IR durante la hospitalización por IC descompensada no se les debería suspender la prescripción de IECA, ya que en general, no está asociada al empeoramiento de la función renal, excepto en situaciones clínicas criticas (shock cardiogénico o IR aguda)40. Estos sólo están contraindicados en pacientes que tienen enfermedad renovascular, deshidratados, hiperkalémicos y en algunos pacientes en estadio final de su enfermedad renal. (Figura 15).

Figura 15. Renoprotección con los ARA más allá de la HTA. Esquema hipotético para daño renal diabético. Los bloqueantes de los receptores de la angiotensina, a diferencia de los beta bloqueantes y los bloqueantes de los canales de calcio, poseen todas las propiedades para la renoprotección (encajonada), por ejemplo inhibición del sistema renina-angiotensina, prevención de deposición anormal de hierro en el intersticio, corrección de hipoxia crónica, hydroxil radical scavenging, reducción de las expresiones de la hemo-oxigenasa (HO)-1 y la NADPHoxidasa, mejoría en la infiltración de células inflamatorias, inhibición del inhibidor del activador de plasminógeno tipo 1 (PAI-1), e inhibición de la formación de los productos finales de la glicación. Estos beneficios interrelacionados de los bloqueantes de los receptores de la angiotensina pueden contribuir a la renoprotección, por ejemplo, reducción de la proteinuria y mejoría del daño glomerular y tubulointersticial, independientemente de la disminución de presión arterial. La línea de puntos muestra el efecto inhibitorio.
Rol del Nesiritide
Reciente atención se ha focalizado sobre el tratamiento con pépticos natriuréticos que pareció jugar un rol benéfico mediante la interacción, que se demostró en algunos modelos animales y pequeños estudios clínicos, entre el corazón y el riñón. En pacientes con IC, el nesiritide produce vasodilatación, con la consecuente disminución de la presión de fin de diástole del VI e incremento del índice cardíaco. Estos efectos son acompañados de natriuresis y diuresis; sin embargo, el clearance de creatinina no mejoró con el nesiritide.
En el estudio Vasodilator in the Management of Acute CHF (VMAC), el nesiritide fue comparado con nitroglicerina intravenosa, en cuanto a la mejoría clínica durante 24 hs de infusión en ambos grupos. Durante este período se usaron menos diuréticos en el grupo nesiritide (85% versus 94%)41. Un subsiguiente análisis del comité del VMAC, comparando pacientes con creatinina ≥ a 2 mg/dl, con otro con niveles normales de creatinina sérica, tampoco dilucidó los efectos renales del nesiritide42.
Otro estudio fue realizado por Wang y colaboradores, luego de las conclusiones conflictivas acerca del nesiritide sobre la tasa de filtrado glomerular (GFR), flujo plasmático renal, natriuresis y diuresis. Las conclusiones fueron que "el nesiritide no mejora la función renal en pacientes con IC descompensada.
La función renal empeoró comparado con el basal y esto podría ser referido a la insuficiencia renal, alteraciones hemodinámicas, al balance del sodio, severidad de la IC o dosis de la droga"43. En un meta-análisis de 5 estudios randomizados, Sackner-Bernstein y col., reportaron el incrementado del riesgo de empeorar más la función renal44.
Rol de los antagonistas de los receptores de la arginina vasopresina
Otro modulador neurohormonal que es activado en la IC, es la arginina vasopresina (AVP) que provoca retención de agua, de sodio y congestión.
La AVP es secretada desde la glándula pituitaria, y su efecto está mediado por tres tipos de receptores: V1A, V1B y V2. Este último se encuentra localizado en el túbulo distal y colector. Cuando la AVP se une a los V2 receptores, se incrementan los niveles intracelulares de adenosin monofosfato cíclico, esta molécula actúa como un segundo mensajero en la transferencia de vesículas conteniendo los canales de agua aquaporina-2 e incrementando la trascripción de aquaporina-2. El AVP regulado por la actividad de aquaporina-2, determina la permeabilidad del túbulo colector y esto se asocia con una disminución de la diuresis. En la IC, la secreción de AVP puede incrementarse por la hipotensión arterial o por una virtual disminución del volumen intravascular. El exceso de AVP puede también conducir a la hiponatremia.
Cuanto mayor es el disturbio electrolítico causado por la terapia diurética, la disminución de 3 mEq de sodio sérico en pacientes hospitalizados, está asociada con un 20% de incremento en la mortalidad dentro de los 60 días45. Por otra parte, del análisis del OPTIMIZE-HF (Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure Trial) surgió que su valor, como predictor de peor pronóstico, se mantuvo tanto en pacientes con disfunción sistólica como diastólica46 (Figuras 1 y 16)47.
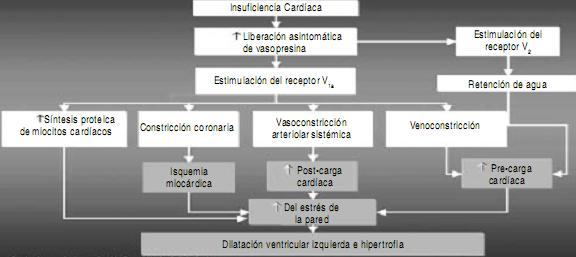
Figura 16. Efectos de la vasopresina en la insuficiencia cardíaca47.
Un incremento del sodio sérico durante la hospitalización de 2 mEq/L o mayor, está asociado con una reducción relativa del 14% de la mortalidad a los 60 días, comparada con aquellos que no tuvieron cambios48.
El tolvaptan (antagonista del receptor V2) ha sido evaluado en la IC descompensada, tanto en pacientes internados y luego del alta hospitalaria. En el corto tiempo por sus propiedades aquaréticas aliviando la congestión, los síntomas, sin excreción significativa de sodio, mientras que a largo plazo, por su antagonismo neurohormonal. El cambio en el peso corporal después de 24 hs de terapia con tolvaptan fue uno de los primarios endpoints del Acute and Chronic Therapeutic Impact of a Vasopressin Antagonist in Congestive Heart Failure (ACTIV in CHF) trial49.
Rol de los diuréticos
Respecto de los diuréticos de asa, uno de los pilares del tratamiento farmacológico en el paciente con sobrecarga de volumen, ellos nos ayudarán a mejorar los síntomas al disminuir la sobrecarga de volumen, pero no debemos olvidar que no mejoran la sobrevida y llevan implícito el riesgo de la muerte por arritmias (especialmente cuando se asocian a diuréticos ahorradores de potasio).
La furosemida es un ácido orgánico que alcanza el líquido tubular por secreción a nivel del túbulo proximal por el transportador de aniones orgánicos.
Estos diuréticos disminuyen la reabsorción de ClNa a nivel del asa gruesa de Henle mediante la inhibición del transportador Na-K-Cl2 presente en la membrana luminal tubular, logrando una franca disminución de la entrada de sodio a la célula tubular. Debido a su alta unión a proteínas, ingresan a la luz tubular por secreción a nivel del túbulo proximal más que por filtración glomerular. El objetivo es lograr disminuir la presión intravascular y permitir la movilización del líquido intersticial (edema) por difusión, lográndose además no disminuir demasiado la presión intravascular. A pesar de la mejoría sintomática y aumento de la tolerancia al ejercicio, la disminución de la presión de llenado cardíaca producida por los diuréticos, generalmente, disminuye el gasto cardíaco50.
Tanto la disminución de flujo sanguíneo renal como la reducción de la actividad de dicho transportador (por aumento de los niveles de aniones orgánicos endógenos) interfieren con la secreción tubular de furosemida en pacientes con alteraciones de la función renal.
De esta manera, a una determinada dosis, la eliminación neta de sodio se mantendrá durante 1 a 2 semanas hasta alcanzar un nuevo estado de equilibrio, en el que la pérdida de sodio será igual a la ingesta y el efecto del diurético es contrarrestado por el resto de los factores que determinan la retención de sodio, como por ejemplo, el sistema renina-angiotensina.
En pacientes con función renal normal, el aumento de diuresis comienza con 10 mg de furosemida con un efecto máximo con dosis de 40 mg por vía intravenosa (IV).
En pacientes con IC, cirrosis avanzada o IR existe una disminución de perfusión renal con consecuente disminución de oferta de droga al riñón, aumento del SRAA y aumento de la actividad retenedora de sodio y en la IR especialmente aniones retenidos y que compiten por la secreción tubular. En IC con función renal normal, la dosis máxima efectiva en general es de 40 mg de furosemida; pero, en presencia de IR, esa dosis se debe duplicar tanto por la vía oral como por la vía IV, ya que la biodisponibilidad cae al 50%. De esta manera en los grados I- II y III de IRC, podemos utilizar 80 mg IV como dosis máxima y en IRC grado IV y V hasta 200 mg de furosemida por vía IV.
La eficacia de estas drogas es dosis dependiente, es decir que no alcanzará su mayor efecto natriurético hasta alcanzar su umbral.
En pacientes severamente comprometidos en los que debemos utilizar la vía IV, es preferible utilizar la infusión continua más que la aplicación en bolos, ya que según la revisión de Cochrane produce menos tinnitus y menor pérdida de la audición.
En pacientes en los que ya no se logra aumentar el efecto con dosis máximas con furosemida por vía oral, se puede rotar ésta a bumetanida o torasemida y además agregar diuréticos para bloquear la reabsorción de sodio a nivel del túbulo distal (doble bloqueo tubular), como los tiazídicos o espironolactona para mejorar la sobrevida como se demostró en el estudio RALES (Randomized Aldactone Evaluation Study), en pacientes con severa alteración de la función cardíaca (promedio FEVI 25%).
De esta manera se logran disminuir los efectos deletéreos de la aldosterona a nivel cardíaco, efecto que no se logra con otros diuréticos de túbulo distal como amiloride51.
En pacientes con edema pulmonar secundario a IAM, la furosemida IV produce una venodilatación transitoria semejante a la producida por la morfina, lográndose una disminución de las presiones de llenado cardíaco y disminución de la congestión pulmonar aun antes del aumento de la diuresis52. Es altamente probable que este efecto se deba al aumento de producción local y renal de prostaglandinas vasodilatadora53-56.
Cuando se utiliza conjuntamente un IECA y un diurético de asa, se logra mejorar la hiponatremia en pacientes en IC que suele57 deberse a un aumento del agua libre por aumento de su llegada al túbulo colector (por disminución de su reabsorción previa) y disminución de la secreción de HAD en el colector (por aumento del VM) y probable resistencia a la HAD.
Ya que está demostrada la mejoría del VM y del flujo plasmático renal, es razonable pensar que los IECA mejorarían el filtrado glomerular, observándose esto sólo en un 20% de los pacientes. Siendo mucho más frecuente encontrar un aumento de la creatininemia58.
Este fenómeno suele ocurrir en la primera semana de tratamiento y luego la función renal tiende a estabilizarse, a menos que se agregue algún factor que complique la función renal como el deterioro de la función cardíaca.
En los pacientes con IC, la disminución del filtrado glomerular se reproduce en aquellos pacientes en los que dicho filtrado depende de altos niveles de ANG II. Es el caso del paciente sometido a altas dosis de diuréticos con consecuente hipovolemia relativa o pacientes con hipotensión relativa (presión arterial media < 75 mm Hg). Es así que esta disminución del filtrado glomerular suele deberse a una disminución de la ANG II intrarrenal por reducción preferencial de la constricción de la arteriola eferente con disminución de la presión intraglomerular (fenómeno que interfiere con la respuesta de autorregulación). La manera de lograr que se vuelva a la función renal de base es disminuir la dosis de diuréticos y de este modo terminar con la dependencia del filtrado glomerular a través de la ANG II. Es por esta razón que los IECA se deben administrar comenzando con bajas dosis59.
De todas maneras, aún con manejos óptimos, la función renal de algunos pacientes es tan ANG II-dependiente que se debe rotar a una combinación de hidralazina + dinitrato de isosorbide (que no disminuye en forma preferencial la presión de la arteriola eferente)60.
En algunas situaciones clínicas, este cambio en el tratamiento puede ser transitorio, permitiéndonos volver al esquema de tratamiento prescripto con anterioridad.
Se conoce que la resistencia a los diuréticos es un factor independiente para muerte por todas las causas, muerte súbita y muerte por falla de bomba61.
En este sentido siempre, se debe evaluar la adherencia a la dieta hiposódica (menos de 100 mEq/día) y el uso de algunas drogas.
La principal causa de resistencia aparente a los diuréticos es la ingesta de drogas antiinflamatorias no esteroideas (AINE), ya que las mismas inhiben la síntesis de prostaglandinas por inhibición de la ciclooxigenasa y contrarrestan el efecto natriurético de los diuréticos.
Rol de los inhibidores de la aldosterona
La utilización de espironolactona lleva implícito el conocimiento de los efectos sobre la kalemia y los efectos endócrinos a lo largo del tiempo, como son la ginecomastia, el dolor mamario, las alteraciones del ciclo menstrual, impotencia sexual y disminución de la libido.
También, se ha utilizado otro antagonista selectivo (no se une a receptores de andrógeno y progesterona) de la aldosterona como es la eplerenona. El estudio EPHESUS (Epleronone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study)62 ha demostrado importantes beneficios en la IC (FEVI promedio 33%), en el IAM entre 3 y 14 días, pero sólo en pacientes con creatininemias menores a 2,5 mg% o con kalemias superiores a 5 mEq/l o reciben otros diuréticos ahorradores de potasio. En él, se destaca que el 87% de los pacientes recibieron un IECA y el 75% un beta bloqueante, permitiendo inferir los beneficios del antagonismo de la aldosterona.
Los efectos deletéreos de la aldosterona a nivel cardíaco son conocidos, ya que la producción cardíaca de aldosterona aumenta en la medida que aumenta el grado de la IC a través de la inducción de la aldosterona sintetasa por estimulación de la angiotensina. También, se sabe que la ANG II activa sobremanera los receptores de mineralocorticoides en las arterias coronarias y en las células del músculo liso vascular arterial aórtico.
Este aumento local de aldosterona puede estimular la producción de enzima convertidora de angiotensina en el sistema renina angiotensina local y de esta manera generar otro círculo vicioso (Figuras 1763,44).

Figura 17. Mecanismos propuestos para daño renal inducido por aldosterona.
Todo esto podría hacer pensar que los pacientes tratados con IECA no necesitarían un severo tratamiento con inhibidores de la aldosterona, que como ya se sabe, la ANG II es el mayor estímulo para la producción de aldosterona. Sin embargo, como se demostró tanto en el estudio RALES como en el estudio EPHESUS, los mayores beneficios se lograron en pacientes tratados con espironolactona, ya que, en este caso, podría pensarse que los pacientes con IC tratados con IECA tienen una mayor concentración plasmática de aldosterona65 y que el estímulo para este aumento de aldosterona es un fenómeno frecuente en pacientes con IC, por la producción de sistemas renina angiotensina tisulares que no dependan de la enzima convertidora o por un aumento de la concentración de potasio plasmático.
Rol de los beta bloqueantes
La importancia pronóstica y el impacto en la IR de los beneficios de los IECA y beta bloqueantes son aún inciertos.
En un estudio de 754 pacientes con IC, fue más prevalente la IR, y esta situación se reportó como un factor pronóstico independiente tanto de disfunción diastólica como sistólica. En el mismo, la reducción en la mortalidad fue semejante en pacientes con y sin IR66.
Rol de los hipolipemiantes
Lamentablemente, hay pocos datos de estudios en la población general sobre el efecto de la disminución de los lípidos en pacientes con IRC.
El Study of Heart and Renal Protection (SHARP) es un estudio de investigación, designado para comparar ezetimibe/simvastatina vs placebo en aproximadamente 9000 pacientes con IRC, entre los cuales hay 6000 en estado pre-diálisis y 3000 sometidos a diálisis67. Fueron excluidos los pacientes con IAM previo, los revascularizados y los trasplantados renales, con un plan de tratamiento por 4 años. El end point primario es determinar el efecto de la reducción del LDL sobre los mayores eventos cardiovasculares, definidos como IAM no fatal o muerte de causa cardíaca, stroke fatal o no fatal, o revascularización. El end point secundario incluirá determinar los efectos de la combinación de estas drogas en la progresión de la IRC. El K/DOQI Work Group68, llamado en general NCEP AT-III (The National Cholesterol Education Program-Adult Treatment Panel) guidelines69, concluye: "En ausencia de datos de estudios randomizados en pacientes con IRC, es razonable asumir que las intervenciones recomendadas por el NCEP ATP-III deben reducir la aterosclerosis en pacientes con enfermedad cardiovascular e IRC asociada". El grupo de trabajo concluye, que de acuerdo a la literatura, la expectativa de riesgo de enfermedad coronaria a 10 años en pacientes con IRC es del 20% (69.222), por lo tanto se justifica que la IRC es considerada un equivalente al riesgo de enfermedad cardiovascular, bajando agresivamente el colesterol. Estas guías se aplican directamente a pacientes con estadio I a IV de IRC y aporta guías especificas sólo para estadio V70 (Figura 4).
Rol de la hemofiltración
A diferencia de los sistemas de diálisis, se puede realizar con 2 vías periféricas de diámetro 20 G. Se pueden eliminar de 100 a 500 ml/hora. Generalmente, se realizan tratamientos de 8 a 9 hs diarias, siendo el volumen extracorpóreo de sólo 40 ml de sangre (Figura 18).

Figura 18. Ultrafiltración. Soluciones para la insuficiencia cardíaca crónica. Muestra de un aparato para realizar hemofiltración que permite extraer agua plasmática y solutos menores a 50.000 daltons.
En el gráfico de la Figura 19 del estudio de Marenzi71 que trató 24 pacientes con IC CF IV con gran sobrecarga de peso y oliguria, se observa la disminución de la presión auricular, de la presión wedge (de enclavamiento de la presión capilar pulmonar) y la mejoría del VM y del volumen de eyección a las 24 hs posteriores al procedimiento.

Figura 19. Ultrafiltración en insuficiencia cardíaca crónica71.
Recientemente, se publicaron los resultados del estudio UNLOAD (The randomized Ultrafiltration vs IV Diuretics for Patients Hospitalized for Acute Decompensated CHF trial) en el que se estudiaron 200 pacientes con ICC (NYHA CF III-IV) tratados con diuréticos y con ultrafiltración venovenosa durante 8 hs. En el mismo, se demostró que el grupo tratado con ultrafiltración presentó un menor número de internaciones por IC (18% contra 32%) y una menor demanda de consulta médicas no programadas (21% contra 44%), dentro de los 3 meses de comenzado el tratamiento.
A pesar de que el método de ultrafiltración o hemofiltración tiene una de sus indicaciones en pacientes con IR y falla hemodinámica severa, en este caso la IR no era severa dada la media de edad (62 años), peso (101 Kg) y creatinina (1,5 mg%) que permiten inferir que la media de filtrado glomerular era al menos superior a 50 ml/min. Debemos destacar que fueron excluidos pacientes con creatininemia > 3 mg%. Los autores destacan que no se realizó un estudio de costos, siendo ésta una de las limitaciones. En Argentina, la hemofiltración veno-venosa es de uso limitado por la disponibilidad y costos. Es de esperarse en los próximos años algún otro estudio que reproduzca estos beneficios y evalúe los costos globales a mediano y largo plazo72.
Conclusiones
En los últimos años, se han acumulado suficientes datos que demuestran que aún las mínimas alteraciones de la función renal son un importante factor de riesgo cardiovascular independiente.
El solo hecho de que los pacientes con alteraciones mayores de la función renal se hayan excluido de la mayoría de los estudios multicéntricos y la demostración que los pacientes con alteraciones renales menores incluidos tenían peor evolución, permitió demostrarlo.
Estos pacientes presentan más frecuentemente diabetes, hipertensión arterial, enfermedad coronaria e IC73. También, está ampliamente demostrado que casi el 50% de las muertes en pacientes con IRC se debe a factores cardiovasculares. Es por eso que tampoco debe sorprender que entre el 30 y 50% de los pacientes con ICC tengan compromiso de la función renal. Esto implica una gran co-dependencia entre el corazón y el riñón; de allí que en los estadios III-IV y V de IRC existe una gran interdependencia entre factores de riesgo cardiovascular tradicionales y no tradicionales (como la anemia, la microalbuminuria y los trastornos del metabolismo fosfocálcico)74.
Los cambios en la medicina actual, con la gran ayuda de la epidemiología clínica, nos dicen que debemos tener en cuenta la relación que existe entre la aparición de los eventos cardiovasculares y la disminución del filtrado glomerular (Figura 20).
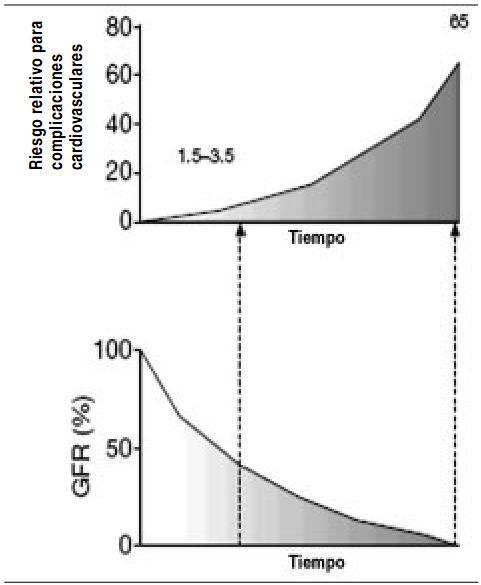
Figura 20. Relación inversa entre función renal y riesgo cardiovascular. Las figuras ilustran el aumento hipotético del riesgo relativo en pacientes con nefropatías progresivas, comparado con la población general. GFR: tasa de filtrado glomerular.
Notaremos la importancia de la detección precoz de la disminución del filtrado glomerular como elemento de prevención y tratamiento precoz de alteraciones cardiovasculares.
Esto está demostrado aún para pequeñas alteraciones de la función renal75 y es posible reducir el riesgo tanto para mortalidad como para internaciones por insuficiencia cardiorrenal, demostrado inicialmente en el estudio HOPE (Heart Outcomes Prevention Evaluation trial)76.
El concepto de que los pacientes con enfermedades cardiovasculares son un grupo de alto riesgo de padecer IRC terminal, obliga a tener un enfoque pragmático para mejorar la identificación y control de estos pacientes77.
Al respecto, destacaremos la alta morbimortalidad que determina la consulta nefrológica tardía, como lo demostraron varios estudios. En estos casos, los pacientes presentaron un mayor nivel de anemia, hipoalbuminemia, interacción riñón-corazón con deterioro severo de las funciones de ambos órganos y mala evolución78-81.
Finalmente, podemos concluir que son los médicos clínicos y cardiólogos los primeros que tendrán la enorme responsabilidad de detectar las pequeñas alteraciones de la función renal y establecer el riesgo aumentado de padecer alteraciones cardiovasculares (incluyendo a la IC y la muerte), no sólo por los factores clásicos sino por los no clásicos, y así poder evitar, junto al nefrólogo, la velocidad de progresión tanto de la patología cardiovascular como de la renal, ofreciendo terapéuticas adecuadas al grado de alteración de ambos órganos.
Asimismo, los nefrólogos deberán realizar la consulta cardiológica precoz en pacientes con IR cualquiera sea su grado.
De allí que, en los pacientes que ya presenten deterioro de ambos órganos, los tratamientos deberán ser lo suficientemente enérgicos para poder evitar las complicaciones del seguro deterioro severo de varios órganos blancos (Figura 21).

Figura 21. Abordaje conjunto cardio-nefrológico.
1. Sultán MG, Osso JNL. ¿Síndrome cardiorrenal o renocardíaco? Un desafío médico. Rev Insuf Cardíaca 2006;1;3:131-135. [ Links ]
2. Mc Cullough PA. Cardiorenal risk: an important clinical insertion. Rev Cardiovasc Med 2002,3:71-76. [ Links ]
3. Foley RN, Parfrey PS, Sarnak MJ. Epidemiology of cardiovascular disease in chronic renal disease. J Am Soc Nephrol 1998;9(supp 12):s16-s23. [ Links ]
4. Zoccali C, Mallamaci F, Tripepi G. Inflammatory proteins as predictors of cardiovascular disease in patients with end-stage renal disease. Nephrol Dial Transplant 2004;19(Suppl)5:V67-72. [ Links ]
5. Schindler R. Causes and therapy of micro-inflammation in renal failure. Nephrol Dial Transplant 2004;19(Suppl 5):V34-40. [ Links ]
6. Go AS, Chertow GM, Fan D, McCulloch CE, Hsu CY. Chronic kidney disease and the risks of death, cardiovascular events and hospitalization. N Engl J Med 2004;351:1296-1305. [ Links ]
7. Zoccali C, Benedetto FA, Mallamaci F, et al. Inflammation is associated with carotid atherosclerosis in dialysis patients. Creed Investigators. Cardiovascular Risk Extended Evaluation in Dialysis Patients. J Hypertens 2000;18:1207-13. [ Links ]
8. McClellan W, Aronoff SL, Bolton WK. The prevalence of anemia in patients with chronic kidney disease. Curr Med Res Opin 2004;20:1501-1510. [ Links ]
9. Silverberg DS, Wexler D, Blum M, Keren G, Sheps D, Leibovitch E, et al. The use of subcutaneous erythropoietin and intravenous iron for the treatment of anaemia of severe, resistant congestive heart failure improve cardiac and renal function and functional cardiac class, and markedly reduce hospitalizations. J Am Coll Cardiol 2000;35;7:1737-44. [ Links ]
10. Foley RN, Parfrey PS, Harnett JD, Kent GM, Murray DC, Barre PE. The impact of anaemia on cardiomyopathy morbidity and mortality in end-stage renal disease. Am J Kidney Dis 1996;28:53-61. [ Links ]
11. Jie KE, Verhaar MC, Cramer MJ, van der Putten K, Gaillard CA, Doevendans PA, et al. Erythropoietin and the cardiorenal syndrome. Am J Physiol Renal 2006,291;5:F932-44. [ Links ]
12. Anand IS, Chandrashekhar Y, Ferrari R, Poole-Wilson, et al. Renal function, haemodynamics and plasma hormones. Brit Heart J 1993;70:357-362. [ Links ]
13. Brown NJ, Agirbasli MA, Williams GH, et al. Effect of activation and inhibition of the renin-angiotensin system on plasma PAI-1. Hypertension 1998;32;6:965-71. [ Links ]
14. Robles NR. Bloqueo combinado del eje renina-angiotensina. Nefrología 2003;13;6:497-503. [ Links ]
15. Swedberg K, Held P, et al. CONSENSUS II Study Group N Engl J M 1992;327:678-84. [ Links ]
16. The SOLVD Investigators. Effect of Enalapril on survival in patients with reduced left ventricular ejection fraction and congestive heart failure. N Engl J M 1991;325:303-10. [ Links ]
17. Cohn JN, Johnson G, Ziesche S, et al. A comparison of enalapril with hidralazine dinitrate isosorbide in the treatment of chronic congestive heart failure. N Engl J Med 1991;325:303-15. [ Links ]
18. Pitt B, Segal R et al. Randomized trial of losartan vs captopril in patients over 65 with heart failure (Evaluation of losartan in the elderly study ELITE I). Lancet 1997;349:747-52. [ Links ]
19. Pitt B, Poole Wilson P, et al. Effect of losartan compared with captopril and mortality in patients with symptomatic heart failure. Randomized trial the losartan heart failure survival study ELITE II. Lancet 2000,355:1582-87. [ Links ]
20. Tsuyuki RT, Yusuf S, Rouleau JL, for the RESOLVD pilot study investigators. Combination neurohormonal blockade with ACE inhibitors, angiotensin II antagonists and beta-blockers in patients with congestive heart failure: design of the Randomised Evaluation of Strategies for Left Ventricular Dysfunction (RESOLVD) Pilot study. Can J Cardiol 1997;13:1166-1174. [ Links ]
21. Di Bona GF, Jones SY, Sawin LL. Angiotensin receptor antagonist improves cardiac reflex control of renal sodium handling in heart failure. Am J Physiol Heart Circ Physiol 1998;274:H636-H641. [ Links ]
22. Lewis EJ, Hunsicker LG, Clarke WR, Berl T, Pohl MA, Lewis JB, Ritz E, Atkins RC, Rohde R, Raz I, for the Collaborative Study Group. Renoprotective Effect of the Angiotensin-Receptor Antagonist Irbesartan in Patients with Nephropathy Due to Type 2 Diabetes. N Engl J Med 2001;345:851-860. [ Links ]
23. Brenner BM, Cooper ME, de Zeeuw D, Keane WF, Mitch WE, Parving HH, Remuzzi G, Snapinn SM, Zhang Z, Shahinfar S, for the RENAAL Study Investigators. Effects of Losartan on Renal and Cardiovascular Outcomes in Patients with Type 2 Diabetes and Nephropathy. N Engl J Med 2001;345:861-869. [ Links ]
24. Rodby RA, Rohde RD, Clarke WR, Hunsicker LG, Anzalone DA, Atkins RC, Ritz E, Lewis EJ, and for the Collaborative Study Group. The Irbesartan Type II Diabetic Nephropathy Trial: study design and baseline patient characteristics. Nephrol Dial Transplant 2000;15:487-497. [ Links ]
25. Robles NR. Bloqueo combinado del eje renina-angiotensina. CIN 2003 3er Congreso de Nefrología por Internet. [ Links ]
26. Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr., Jones DW, Materson BJ, Oparil S, Wright JT Jr., Roccella EJ; and the National High Blood Pressure Education Program Coordinating Committee. Seventh report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure. JAMA 2003;289:2560-2571. [ Links ]
27. Nakamura T, Kanno Y, Takenaka T, Suzuki H. An Angiotensin Receptor Blocker Reduces the Risk of Congestive Heart Failure in Elderly Hypertensive Patients with Renal Insufficiency -Hypertens Res 2005;28;5:415-423. [ Links ]
28. Suzuki H, Kanno Y, Efficacy of Candesartan on Outcome in Saitama Trial (E-COST) Group. Effects of candesartan on cardiovascular outcomes in Japanese hypertensive patients. Hypertens Res 2005;4:307-14. [ Links ]
29. Jalowy A, Schulz R, Heusch G. AT1 receptor blockade in experimental myocardial ischemia/reperfusion. J Am Soc Nephrol 1999;10(Suppl 11):S129-S139. [ Links ]
30. .Willenheimer R, Dahlöf B, Rydberg E. Erhardt L. ATI -receptor blockers in hypertension and heart failure: clinical experience and future directions. Eur Heart J 1999;20:997-1008. [ Links ]
31. Cohn JN, Tognoni G. A randomized trial of the angiotensin receptor blocker Valsartan in chronic heart failure. N Engl J M 2001,345:1667-75. [ Links ]
32. Strippoli GFM, Craig M, Deeks JJ, Schena FP, Craig JC. Effects of angiotensin converting enzyme inhibitors and angiotensin II receptor antagonists on mortality and renal outcomes in diabetic nephropathy: systemic review. BMJ 2004;329:828-831. [ Links ]
33. Berl T, Henrich W. Kidney-Heart Interactions: Epidemiology, Pathogenesis, and Treatment. Clin J Am Soc Nephrol 2006;1:8-18. [ Links ]
34. Ruilope LM, Redón J, Schmieder R. Vasc Health Risk Manag. 2007;3;1:1-9. [ Links ]
35. Mann JFE, Gersteni HC, et al. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of Ramipril: The HOPE randomised trial. Ann Int Med 2001;134:629-636. [ Links ]
36. Murphy SW. Diastolic dysfunction. Curr Opinion Cardiovasc Med 2004;6;1;61-68. [ Links ]
37. Brenner B, Cooper M, et al. Effects of Losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Eng J Med 2001;345:861-869. [ Links ]
38. Watchtell K, Ibsen H, et al. Albuminuria and cardiovascular risk in hypertensive patients with left ventricular hypertrophy: The Life study. Ann Int Med 2003;139:901-906. [ Links ]
39. Bremer BM, Cooper ME et al for RENAAL Study Investigators. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J M 2001;345:861-69. [ Links ]
40. Butler J, Forman DE, et al. Relationship between heart failure treatment and development of worsening renal function among hospitalized patients. Am Heart J 2004;147:331-338. [ Links ]
41. Publication Committee for the VMAC Investigators (Vasodilatation in the management of acute CHF) Intravenous Nesiritide vs. Nitroglycerin for treatment of Decompensated Heart Failure: A randomised controlled trial. JAMA 2002;287:1531-1540. [ Links ]
42. Butler J, Emerman C, et al. VMAC study investigators. The efficacy and safety of B-natriuretic peptide (nesiritide) in patients with renal insufficiency and acutely decompensated congestive heart failure. Nephrol Dial Transplant 2004;19:391-399. [ Links ]
43. Wang DJ, Dowling TC, Meadows D, et al. Nesiritide does not improve renal function in patients with chronic heart failure and worsening serum creatinina. Circulation 2004;110:1620-1625. [ Links ]
44. Sackner-Bernstein JD, Skopicki HA, Aaronson KD. Risk of worsening renal function with nesiritide in patients with acutely decompensated heart failure. Circulation 2005;111:1487-1491. [ Links ]
45. Klein L, O'Connor CM, et al. Lower serum sodium is associated with increased short-term mortality in hospitalized patients with worsening heart failure: results from the outcomes of a prospective trial of intravenous milrione for exacerbations of chronic heart failure (OPTIME-CHF) study. Circulation 2005;111:2454-2460. [ Links ]
46. Gheorghiade M, Stough WG, et al. Serum sodium concentration and mortality in patients admitted with heart failure: an analysis of Optimi- ze-HF. J Card Fail 2005;11(Suppl):Abstract 348. [ Links ]
47. Schrier RW. Role of diminished renal function in cardiovascular mortality: marker or pathogenetic factor? J Am Coll Cardiol 2006;47:1-8. [ Links ]
48. Gheorghiade M, Adams K, O'Connor C, et al. J Improvement in hyponatremia during hospitalization for worsening heart failure is associated with improved outcomes: insights from the acute and chronic therapeutic impact of vasopressin antagonist in chronic heart failure (ACTIV in CHF). Am Coll Cardiol 2005;45(Suppl A):Abstract 1075-148. [ Links ]
49. Gheorghiade M, Gattis WA, O'Connor C, et al. Effects of Tolvaptan, a vasopressin antagonist, in patients hospitalized with worsening heart failure. And the Acute and Chronic Therapeutic Impact of a Vasopressin Antagonist in Congestive Heart Failure (ACTIV in CHF). JAMA 2004,291:1963-1971. [ Links ]
50. Stampfer M, Epstein SE, Beiser GD, Braunwald E. Hemodynamic effects of diuresis at rest and during intense upright exercise in patients with impaired cardiac function. Circulation 1968;37:900. [ Links ]
51. Loon NR, Wilcox CS, Unwin RJ. Mechanism of impaired natriuretic response to furosemide during prolonged therapy. Kidney Int 1989;36:682. [ Links ]
52. Wollam GL, Tarazi RC, Bravo EL, Dustan HP. Diuretic potency of combined hydrochlorothiazide and furosemide therapy in patients with azotemia. Am J Med 1982;72:929-938. [ Links ]
53. Bourland WA, Day DK, Williams HE. The role of the kidney in the early nondiuretic action of furosemide to reduce elevated left atrial pressure in the hypervolemic dog. J Pharmacol Exp Ther 1977;202:221-229. [ Links ]
54. Johnston GD, Hiatt WR, Nies AS, et al. Factors modifying the early nondiuretic vascular effects of furosemide in man: The possible role of renal prostaglandins. Circ Res 1983;53:630-635. [ Links ]
55. Fujimura A, Ebihara A. Role of angiotensin II in renal prostaglandin E production after furosemide administration. Hypertension 1988;11:491-494. [ Links ]
56. Pickkers P, Dormans TP, Russel FG, et al. Direct vascular effects of furosemide in humans. Circulation 1997;96:1847-1852. [ Links ]
57. Oster JR, Materson BJ. Renal and electrolyte complications of congestive heart failure and effects of treatment with angiotensin-converting enzyme inhibitors. Arch Intern Med 1992;152:704-710. [ Links ]
58. Ljungman S, Kjekshus J, Swedberg K. Renal function in severe congestive heart failure during treatment with enalapril (the Cooperative North Scandinavian Enalapril Survival Study -CONSENSUS- trial). Am J Cardiol 1992;70:479-488. [ Links ]
59. Packer M, Lee WH, Medina N, et al. Functional renal insufficiency during long-term therapy with captopril and enalapril in severe chronic heart failure. Ann Intern Med 1987;106:346-354. [ Links ]
60. Packer M, Lee WH, Medina N, Yushak M. Influence of renal function on the hemodynamic and clinical responses to long-term captopril therapy in severe chronic heart failure. Ann Intern Med 1986;104:147-154. [ Links ]
61. Neuberg GW, Miller AB, O'Connor CM, et al. Diuretic resistance predicts mortality in patients with advanced heart failure. Am Heart J 2002;144:31-8. [ Links ]
62. Hostetter TH, Ibrahim HN. Aldosterone in chronic kidney and cardiac disease. J Am Soc Nephrol 2003;14:2395-401. [ Links ]
63. Williams JS, Williams GH. 50th anniversary of aldosterone. J Clin Endocrin Metab 2003;88:2364-2372. [ Links ]
64. Jorde UP, Vittorio T, Katz SD, et al. Elevated plasma aldosterone levels despite complete inhibition of the vascular angiotensin-converting enzyme in chronic heart failure. Circulation 2002;106:1055-1057. [ Links ]
65. McAlister FA, Ezekowitz J, Tonelli M, Armstrong PW. Renal insufficiency and heart failure. Prognostic and therapeutic implications from a prospective cohort study Circulation 2004;109;8:1004-1009. [ Links ]
66. Baigent C, Landry M: Study of Heart and Renal Protection (SHARP). Kidney Int 2003;Suppl S207-S210. [ Links ]
67. Kidney Disease Outcomes Quality Initiative (K/DOQI) Group: K/DOQI clinical practice guidelines for management of dyslipidemias in patients with kidney disease. Am J Kidney Dis 2003;41(Suppl 3):I-IV,S1- S91. [ Links ]
68. Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, Pasternak RC, Smith SC Jr, Stone NJ. Implications of recent clinical trials for the National Cholesterol Education Program Adult treatment Panel III guidelines. Circulation 2004;110:227-239. [ Links ]
69. Pitt B, Remme W et al. Eplerenone a selective aldosterone blocker in patients with left ventricular dysfunction after myocardial infarction. N Engl J M 2003,348;1309-21. [ Links ]
70. Nogueira J, Weir M. The Unique Character of Cardiovascular Disease in Chronic Kidney Disease and Its Implications for Treatment with Lipid-Lowering Drugs. Clin J Am Soc Nephrol 2007;2:766-785. [ Links ]
71. Marenzi G, Lauri G, Grazi M, Assanelli E, Campodonico J, Agostoni P.Circulatory response to fluid overload removal by extracorporeal ultrafiltration in refractory congestive heart failure. J Am Coll Cardiol 2001;38;4:963-968. [ Links ]
72. Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, Jaski BE, Fang JC, et al., for the UNLOAD Trial Investigators-Ultrafiltration Versus Intravenous Diuretics for Patients Hospitalized for Acute Decompensated Heart Failure. J Am Coll Cardiol 2007;49;6:675-683. [ Links ]
73. Pinkau T, Hilgers KF, Veelken R, Mann JFE. How Does Minor Renal Dysfunction Influence Cardiovascular Risk and the Management of Cardiovascular Disease? J Am Soc Nephrol 2004;15:517-523. [ Links ]
74. Chamberlain I, Obialo MD. Cardiorenal Consideration as a Risk Factor for Heart Failure. Am J Cardiol 2007;99;6:S2,S21-S24. [ Links ]
75. Hillege HL, et al. Renal function, neurohormonal activation, and survival in patients with chronic heart failure. Circulation 2000;102:203- 210. [ Links ]
76. Mann JF, Gerstein HC, Pogue J, Bosch J, Yusuf S. Renal insufficiency as a predictor of cardiovascular outcomes and the impact of ramipril: The HOPE randomized trial. Ann Intern Med 2001;134:629-636. [ Links ]
77. McClellan W, Langston RD, Presley R. Medicare Patients with Cardiovascular Disease Have a High Prevalence of Chronic Kidney Disease and a High Rate of Progression to End-Stage Renal Disease. J Am Soc Nephrol 2004;15:1912-1919 [ Links ]
78. Peña JM, y col. La referencia tardía al nefrólogo influye en la morbi-mortalidad de los pacientes en hemodiálisis. Nefrología 2006;26;1:84-97. [ Links ]
79. Muntner P, He J, Loria C, Whelton PK. Renal insufficiency and subsequent death resulting from cardiovascular disease in the united states. J Am Soc Nephrol 2002;13:745-753. [ Links ]
80. Obrador GT, Pereira BJ: Early referral to the nephrologist and timely initiation of renal replacement therapy: a paradigm shift in the management of patients with chronic renal failure. Am J Kidney Dis 1998;31:398-417. [ Links ]
81. Levin A. Consequences of late referral on patient outcomes. Nephrol Dial Transplant 2000;15(Supl. 3):8-13. [ Links ]





















