Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.3 no.4 Ciudad Autónoma de Buenos Aires Oct./Dec. 2008
CIENCIAS BÁSICAS EN INSUFICIENCIA CARDÍACA
Biomecánica de la falla cardíaca
John Bustamante*, Javier Valbuena**
* Médico cardiólogo, PhD, PostPhD, Prótesis y Bioimplantes Cardíacos.
Director Investigador, Grupo de Dinámica Cardiovascular, Universidad Pontificia Bolivariana. Medellín. Colombia.
Miembro Correspondiente Sociedad Argentina de Cardiología (SAC).
Miembro de Número Sociedad Colombiana de Cardiología y Cirugía Cardiovascular (SCC).
** Ingeniero Mecánico. Fellow en el área de Mecánica de Fluidos.
Investigador, Grupo de Dinámica Cardiovascular, Universidad Pontificia Bolivariana. Medellín. Colombia.
Correspondencia: Dres. John Bustamante y Javier Valbuena.
Campus Universitario - Universidad Pontificia Bolivariana.
Cir. 1ª No 70 - 01, Medellín. Colombia.
E-mail: john.bustamante@upb.edu.co
Trabajo recibido: 29/03/2008
Trabajo aceptado: 15/07/2008
Palabras clave: Falla cardíaca; Biomecánica; Bomba de expulsión
Introducción
La falla cardíaca, patología que ha representado un papel de primera línea en la morbimortalidad de la población y con gran impacto en la salud pública, ha sido generadora de innumerables investigaciones y puestas de trabajos de numerosos grupos en todo el mundo, lo que ha derivado no sólo en el conocimiento mismo de la enfermedad, sino más allá, en el conocimiento más minucioso de la funcionalidad cardíaca; además de dar pie simultáneamente al desarrollo de incontables adelantos tecnológicos relacionados con dispositivos de asistencia circulatoria, implantes cardiovasculares, técnicas intervencionistas entre otros.
El complejo fisiológico y patológico inmerso en la falla cardíaca, que interrelaciona aspectos tanto biológicos como físicos, conlleva la necesidad de comprender desde el campo de la cardiología aquellos aspectos físicos expresados en la función y disfunción del sistema cardiocirculatorio, específicamente, los que conciernen a la dinámica de fluidos (flujo sanguíneo) y a la mecánica de sólidos (estructura cardíaca y vasos sanguíneos). Por lo tanto, se justifica integrar al cuerpo médico en el enfoque multidisciplinario de la biomecánica que permita tratar al aparato cardiovascular como sistema de bombeo1.
La biomecánica relaciona el concepto de la mecánica clásica aplicada a los sistemas biológicos, y su estudio se dirige al tratamiento de las propiedades mecánicas tanto de los tejidos, órganos y sistemas fisiológicos en los seres vivos2,3.
Considerando que la falla cardíaca representa la pérdida de capacidad del corazón para bombear eficientemente la sangre a través del organismo sin alcanzar a suplir las demandas metabólicas, es indispensable conocer los principios físicos que rigen el funcionamiento del corazón como bomba y los principios hidrodinámicos que regulan el movimiento de la sangre a través del sistema circulatorio. En otras palabras, es necesario comprender la biomecánica implícita, tanto para discernir la concomitancia de los síntomas reconocidos y específicos de la falla cardíaca, como para seleccionar el tratamiento más idóneo.
De los signos reconocidos de falla cardíaca, la mayoría tiene un componente biomecánico implícito: tanto en el corazón (alteración de la contractilidad, asincronía, problema del llenado ventricular, disfunción valvular, etc.), como en el sistema vascular y la sangre (incremento en la resistencia viscosa, sobrecarga de presión y volumen, alteración del perfil de flujo, etc.); los cuales afectan el desempeño mecánico del corazón como bomba, tanto en la eficiencia con la que expulsa la sangre como en el consumo energético requerido para su operación.
Dentro de este panorama, el dominio de los aspectos biomecánicos de la falla cardíaca será fundamental para evaluar el estado de la disfunción; así como definir el tratamiento individualizado; y en estados avanzados seleccionar la mejor opción de asistencia mecánica. Sobre todo hoy, que la tecnología médica ofrece una serie de dispositivos de asistencia circulatoria como alternativa a la escasez de donantes para acudir al trasplante cardíaco.
Para lograr este propósito, el sistema cardiocirculatorio se divide en tres componentes sinérgicos: el corazón, los vasos sanguíneos y la sangre; en los que se establecen los conceptos físicos para acometer el estudio en los campos de mecánica de sólidos, para el análisis de la estructura de bombeo, y mecánica de fluidos, para el análisis de la circulación, con el fin de entender su función específica y deducir su participación biomecánica dentro del conjunto4.
Este artículo más que tratar la etiopatología de la falla cardíaca busca relacionar aquellos aspectos biomecánicos del sistema de bombeo con las disfunciones que se producen en la operación del sistema cardiocirculatorio, centrando la atención en uno de sus componentes, el corazón, con el ánimo de entender la complejidad fisiológica de la función normal y facilitar la interpretación de las patologías concomitantes.
Complejo cardiocirculatorio
La sangre fluye a través del sistema cardiovascular impulsada por la fuerza que genera el corazón con cada contracción. Desde este punto de vista, se equipara el sistema biológico con un sistema de bombeo mecánico. En ambos casos, el comportamiento del sistema se puede analizar descomponiéndolo en tres partes: el fluido (la sangre) que es el medio de transporte de masa; la red de conductos (vasos sanguíneos), a través de los cuales se desplaza el fluido, y la unidad de bombeo (el corazón), que provee la energía necesaria para impulsar el fluido y vencer las pérdidas de presión.
En cada componente, se debe considerar el comportamiento pasivo (estático), derivado de sus características estructurales y del material del cual está constituido; y el comportamiento activo (dinámico), derivado de las respuestas propias de cada componente y la reacción ante los estímulos de los otros dos subsistemas. El comportamiento pasivo es simple de modelar, aplicando las leyes físicas y las relaciones biológicas que lo rigen, pero el activo no; pues depende de muchas variables para caracterizar la respuesta de las complejas estructuras de cada componente y los efectos derivados de la interacción entre ellos.
El corazón es una estructura de sección elipsoidal, formada por varias capas, las cuales están compuestas por diversos biomateriales, conformando subestructuras que se caracterizan por una respuesta específica ante la aplicación de un esfuerzo. La relación esfuerzo-deformación (stress-strain) de la pared cardíaca depende de las contribuciones relativas de los constituyentes de soporte: elastina y colágeno, y del fenómeno activo dependiente de energía que se relaciona con el músculo cardíaco. Estos elementos de soporte tienen un comportamiento diverso: unos son más elásticos, otros son más viscosos; de esta forma, cuando se unen, brindan a la estructura un comportamiento mixto de tipo viscoelástico.
Debido a esta respuesta viscoelástica compleja, no se dispone de un modelo que evalúe con certeza la conducta del corazón en cada paciente, pero se puede obtener una aproximación a su comportamiento a partir de las reacciones ante los estímulos internos (presión sanguínea y tensión de pared) y externos (tejidos circundantes), aplicando los conceptos de la biomecánica.
El enfoque biomecánico del sistema cardicirculatorio ha permitido, así mismo, plantear diversos modelos numéricos obtenidos por deducción y análisis de sus homólogos hidráulicos, con el fin de realizar simulaciones como alternativa a las restricciones que impone la realización de los complejos estudios en el sistema vivo (sea por dificultad técnica, por el riesgo sobre el paciente o por el alto costo), brindando la posibilidad de evaluar el comportamiento del sistema bajo diferentes condiciones fisiológicas y patológicas; ofreciendo así una visión diferente del sistema cardiocirculatorio y aportando los conceptos necesarios para el aprovechamiento de los diferentes desarrollos tecnológicos en el soporte y la asistencia cardíaca artificial.
Aunque no hay máquina hidráulica que se asemeje al corazón, debido a la singularidad de contener en si mismo, tanto la cámara de bombeo como la fuente de energía para impulsar la sangre; el corazón se puede comparar con una bomba de desplazamiento positivo (BDP) para efectos de analizar su desempeño como bomba: del lado hidráulico, establece la relación entre la capacidad de contracción y la presión intracavitaria generada, y la relación entre la presión de expulsión y el débito cardíaco; mientras que del lado energético, establece la cantidad de energía que consume para expulsar la masa sanguínea a una presión específica.
Biomecánica del corazón como entorno de la falla cardíaca
Las deducciones biomecánicas en el sistema cardiovascular se apoyan en conceptos físicos, que conllevan la interpretación fisiológica del corazón como bomba eyectiva. El comportamiento mecánico del corazón depende en este sentido de: la estructura y geometría de las cámaras cardíacas (morfología, espesor y diámetro), las características de las fibras musculares (capacidad de contracción), el llenado cardíaco y la resistencia al flujo que impone la red vascular.
El análisis del comportamiento del sistema se plantea en términos de variables como: tensión, elasticidad y resistencia del miocardio; densidad y viscosidad de la sangre; presión y velocidad de flujo sanguíneo; volumen expulsado, así como capacitancia y eficiencia cardíaca.
Comportamiento del miocardio
Los biosólidos tienen un comportamiento más complejo que los sólidos inertes: están compuestos por diversos tejidos que se entrecruzan, dispuestos en capas con diferentes estructuras y orientación, y con cada una de esas capas el biosólido adquiere nuevas propiedades mecánicas. Es por esto que no hay una relación lineal entre el esfuerzo y la deformación, como lo establece la ley de Hooke para los sólidos inertes, que en el caso de los biosólidos es válida sólo para pequeños rangos de deformación.
A esto se agrega el fenómeno activo de reclutamiento de fibras que responde ante una tensión determinada, presente en un sistema dinámico como el corazón.
Cuando se le aplica una fuerza a un biosólido (Figura 1), el esfuerzo inducido disminuye con el tiempo, efecto denominado relajación; y si la fuerza se mantiene aplicada induciendo un esfuerzo constante, el biosólido continúa deformándose, efecto denominado fluencia. De otro lado, cuando enfrenta una carga cíclica, la deformación es dependiente del período y de las condiciones de aplicación de la fuerza, acumulando parte de la energía de deformación, que no es disipada durante el proceso de liberación, efecto denominado histéresis3,5. Estos tres fenómenos caracterizan el comportamiento viscoelástico del miocardio, sin considerar el proceso activo de la contracción.

Figura 1. Comportamiento de un biomaterial.
El comportamiento viscoelástico del miocardio es esencial para el llenado y vaciado de la sangre de las cámaras cardíacas: las respuestas elástica y viscosa combinadas de la pared ajustan el bombeo pulsante a las demandas de flujo sanguíneo, ya que intervienen en la regulación de las relaciones esfuerzo-deformación y presión-flujo. En este sentido, las propiedades biomecánicas del miocardio, al variar de una persona a otra, modifican las condiciones de flujo en respuesta a la demanda metabólica en cada paciente.
Aún no se cuenta con un modelo completamente satisfactorio para describir el comportamiento activo del miocardio; sin embargo, éste puede representarse con un modelo mecánico compuesto por un resorte y un amortiguador, donde el resorte representa las características elásticas del tejido, debidas a la elasticidad de las miofibrillas y el tejido conectivo, mientras que el amortiguador representa las características viscosas, debidas al desplazamiento de las moléculas de actina sobre las de miosina.
Los cambios derivados de procesos que conllevan fibrosis y rigidez de la pared ventricular tienen como consecuencia modelos viscoelásticos que distorsionan la respuesta normal esfuerzo-deformación, consumiendo mayor cantidad de energía de un lado, o restringiendo la capacidad de bombeo de otro, según se detalla en el apartado "El corazón como bomba eyectiva".
Tensión de pared ventricular
Es un indicador de la resistencia que se opone al acortamiento de las fibras miocárdicas durante la expulsión y al estiramiento durante el llenado. Dicha tensión depende de: la presión intracavitaria, la geometría y dimensión de la cámara y el espesor de pared. Es importante aclarar que la tensión en la pared no es un indicativo de la capacidad de contracción del corazón, más bien: el valor de tensión durante la fase de expulsión refleja la postcarga ventricular, y el valor durante el llenado refleja la precarga.
La tensión soportada por la pared cardíaca se puede deducir de la relación entre el esfuerzo de la pared de un contenedor con la presión interna de flujo y la deformación que causa sobre el recipiente que lo contiene, descripta en la denominada ley de Laplace, bajo la suposición que la pared tiene una conformación homogénea y que la presión interna se distribuye uniformemente contra ella, para que genere una tensión distribuida.
Según la ley de Laplace (Figura 2), la tensión de la pared (T), varía con los cambios de la presión interna de flujo (Pi) y el radio (R) de la cámara:


Figura 2. Relación tensión-presión en una cámara ventricular.
De forma clínica, se puede calcular la tensión, suponiendo la geometría cardíaca como un elipsoide, con diámetro menor o transversal (d) y diámetro mayor o longitudinal (D), con un espesor de pared (h), en la que la presión intracavitaria (P) genera tensión en dos direcciones: una tensión circunferencial (TC) y una tensión meridional (TM), que se calculan con las expresiones:

Del análisis de estas expresiones, la geometría ventricular llega a ser un factor muy importante en la falla cardíaca, la cual puede determinar en detrimento del comportamiento energético del miocardio. Los cambios de geometría elipsoidal normal a esferoidal, como sucede en la cardiomiopatía dilatada, implican la generación de mayor tensión en la pared, efecto que por sí mismo agrava el estado funcional del corazón, según se detalla en el siguiente apartado.
El corazón como bomba eyectiva
En el corazón, se presenta un fenómeno periódico que incluye una activación eléctrica, seguida por una cadena de eventos mecánicos: en función de la contracción (que implica el acortamiento del músculo) y en función del bombeo (que implica la expulsión sanguínea), fenómeno denominado acoplamiento electromecánico.
Para evaluar el desempeño del corazón, se usa la relación presión-volumen (P-V), estableciendo una analogía entre el ciclo cardíaco y el ciclo de desplazamiento positivo de las bombas mecánica (Figura 3), que consta de cuatro fases:
1- Compresión (tramo C-D). En el caso mecánico, se cierra la válvula de entrada y el émbolo empieza a comprimir el fluido contra el cilindro; mientras que en el corazón se acorta la longitud de las fibras y se aumenta el espesor de la pared, disminuyendo el volumen de la cámara.
2- Descarga (tramo D-A). Se abre la válvula de salida y el fluido es expulsado: en la bomba mecánica a presión constante y en el corazón a presión variable.
3- Descompresión (tramo A-B). Se cierra la válvula de salida y el émbolo empieza a retroceder, produciendo una rápida reducción de la presión. En el corazón ocurre un proceso semejante por relajación de la pared.
4- Llenado (tramo B-C). Se abre la válvula de entrada y se llena la cámara de fluido, a presión constante en el caso mecánico. En el corazón, este proceso se debe a la interacción entre los fenómenos elásticos de la pared y de flujo de retorno sanguíneo.

Figura 3. Ciclo mecánico de desplazamiento positivo.
En este símil, pueden analizarse los trastornos que llevan a un inadecuado suministro de flujo por parte del corazón. El generador del bombeo mecánico equivale al corazón, el caudal que sale de la bomba equivale al débito cardíaco, la inertancia del circuito hidráulico corresponde a la masa sanguínea, la resistencia hidráulica equivale a la resistencia vascular y la capacitancia hidráulica corresponde a la compliance vascular.
Al igual que en el análogo hidráulico, la falla cardiocirculatoria puede ser de dos tipos: una por falla en la fuente de poder (energía), y la otra, debido al incremento de la impedancia del circuito (inertancia, capacitancia y resistencia hidráulica). El corazón tiene un punto de operación límite, hasta el cual es capaz de cubrir las condiciones de operación impuestas por el sistema circulatorio; al sobrepasar dicho punto (por aumento de la impedancia vascular), aunque el corazón funcione adecuadamente, se deterioran las condiciones de operación. Por lo tanto, los incrementos severos de: masa sanguínea circulante (inertancia), depósitos vasculares de sangre (capacitancia), resistencia hidráulica periférica (resistencia), o rigidez de la pared vascular (elastancia), disminuyen el flujo que pasa a través del circuito, tornándolo inadecuado para las necesidades del organismo.
Si la causa de la falla es la reducción de la eficiencia del bombeo cardíaco, debido a: inhabilidad del miocardio para producir suficiente fuerza contráctil, anormalidades estructurales de la bomba o disfunción de la relajación y del llenado ventricular, se denomina falla cardíaca primaria; la cual puede originarse en alteraciones tanto de la función de expulsión (disfunción sistólica) como del llenado ventricular (disfunción diastólica).
Disfunción sistólica-diastólica
En la Figura 4, se presenta el comportamiento de la curva presión-volumen en la falla sistólica y diastólica. La línea punteada representa el ciclo normal. En la falla sistólica, la cámara tiene más volumen al comienzo de la diástole, la presión protodiastólica puede estar aumentada y la fracción de eyección disminuida. En la falla diastólica, el volumen de llenado disminuye, la presión de fin de diástole está aumentada y la fracción de eyección es normal o inferior dependiendo de la precarga6.

Figura 4. Relación presión-volumen en disfunción ventricular. DD: disfunción diastólica. DS: disfunción sistólica
Compliance cardíaca
Una característica importante de la cámara cardíaca es su capacidad de acumular determinado volumen sanguíneo sin provocar aumentos considerables de tensión, concepto denominado capacitancia (C), o también compliance, definida por la relación de los cambios de volumen (DV) que sufre la cámara ante los cambios de presión (DP):

de manera que los valores de capacitancia pequeños significan mayor rigidez de la cámara.
Por el carácter viscoelástico de la pared, la tensión generada por el cambio de volumen disminuye con el tiempo, debido a la relajación; es decir, de acuerdo con la ley de Laplace; mientras el volumen sea el mismo (radio constante), la presión interna también disminuye en el tiempo; de esta manera la tensión parietal se reduce, evitando que la pared acumule esfuerzo de deformación.
Es importante considerar el efecto de relajación de la pared cuando se mide la capacitancia en las cámaras cardíacas, pues la variable presión se debe medir en estado estable, antes y después del cambio de volumen. Por ejemplo, si la presión se mide antes de la relajación, la capacitancia será menor que la obtenida en estado estable; de otro lado, en el caso de que el volumen cambie rápidamente (llenado rápido) la presión varía con la rapidez del cambio de volumen: en este caso la capacitancia se encuentra menor que la obtenida con cambios más lentos.
La disfunción diastólica genera la incapacidad para el llenado adecuado de la cámara ventricular; debido tanto a alteración de las propiedades pasivas (compliance) como de los procesos activos (desactivación dependiente de energía). La alteración de las propiedades pasivas de la pared ventricular puede ser debida a procesos que varían la composición de la pared: la enfermedad coronaria crónica puede llevar a fibrosis miocárdica difusa, mientras que la hipertrofia concéntrica anormal puede generar marcada rigidez de la cámara por exagerado desarrollo muscular. De otro lado, la alteración de los procesos activos (relajación) puede verse en la cardiomiopatía hipertrófica y en la enfermedad coronaria; en la primera, por enlentecimiento de la relajación y en la segunda, por déficit de disposición de oxígeno, que retarda y disminuye el grado de relajación.
La disfunción aparece en un comienzo como un patrón lento de relajación, con poca o ninguna elevación de la presión diastólica. En esta etapa, el llenado ventricular es lento e incompleto, a menos que la presión auricular se incremente. Cuando la disfunción progresa, produce aumento de la presión diastólica ventricular, que puede reflejar sus efectos hemodinámicos hacia la aurícula.
Contractilidad cardíaca
El proceso más relevante del corazón, como órgano de bombeo, es el proceso de contractilidad: acortamiento de las fibras miocárdicas y su relación con la generación de tensión en la pared cardíaca para producir la presión de bombeo.
La contractilidad es afectada por las condiciones de llenado de las cámaras cardíacas. La capacidad del corazón para llenarse y su habilidad para vaciarse pueden interpretarse con la ley de Frank-Starling, la cual establece que: un incremento de la distensión cavitaria previa a la contracción, aumenta el volumen expulsado; debido a que la contracción de la fibra muscular es función de su longitud, en virtud del área de las superficies químicamente activas en los sarcómeros.
La reducción de la capacidad contráctil ventricular conlleva la incapacidad de la pared miocárdica para acortarse contra una carga impuesta, tornándose incompetente para expulsar sangre hacia el sistema vascular. Esta disfunción afecta de manera diferente el trabajo de cada ventrículo: dado que la resistencia de la circulación sistémica es varias veces mayor que la resistencia de la circulación pulmonar, la reducción en la fuerza contráctil se reflejará más en la circulación sistémica.
Las variaciones de contractilidad miocárdica bajo distintas circunstancias y estados fisiológicos, unidas a los fenómenos compensatorios del lecho vascular, hacen difícil detectar las reducciones leves de la contractilidad al comienzo del proceso patológico, y el diagnóstico sólo es posible cuando existen signos obvios de la disfunción avanzada. En este sentido, en los estadios iniciales, la alteración mecánica de la bomba cardíaca produce incapacidad para atender las demandas sólo durante la actividad física y, si la afección es severa, hasta en condiciones de reposo.
Débito cardíaco
La bomba cardíaca opera con el principio de desplazamiento positivo según el cual la expulsión se produce por reducción del volumen de la cámara. En una bomba mecánica de pared rígida, el volumen expulsado (V) en cada ciclo es constante, por lo que el caudal (Q) varía sólo con los cambios de frecuencia de operación (f),

En lugar de ello, en las bombas de pared elástica, como el corazón, el volumen de trabajo puede variar en situaciones fisiológicas y patológicas, por lo que el débito cardíaco (CO) varía con los cambios de frecuencia (HR) y de volumen de expulsión (V(t)):

El débito cardíaco depende de:
1- Precarga: relacionada con el volumen ventricular de fin de diástole.
2- Postcarga: relacionada con la resistencia vascular periférica o presión vascular.
3- Contractilidad: capacidad del miocardio para compensar la pre y postcarga.
Aunque en las bombas mecánicas es poco usual variar la frecuencia de operación, por la ineficiencia derivada de las pérdidas energéticas, y corresponde variar la capacidad de la cámara de bombeo, el corazón utiliza esta variable para ajustar la demanda de sangre, ya que al aumentar la frecuencia cardíaca hasta cierto valor crítico no reduce su eficiencia de operación.
Cuando se genera flujo pulsante por medio de una bomba de desplazamiento positivo con cámara de bombeo flexible7, la cual emula mejor el funcionamiento del corazón, se puede observar que, manteniendo constante la frecuencia de operación, un incremento de viscosidad del fluido (que aumenta la impedancia circulatoria) provoca una reducción del caudal; y esta reducción se compensa con un incremento en la presión de operación del dispositivo de bombeo. En otros términos, una bomba de desplazamiento positivo de pared elástica, a diferencia de una de pared rígida, compensa los aumentos de resistencia hidráulica con disminución del flujo.
De otro lado, cuando en un dispositivo de cámara de bombeo flexible se aumenta la frecuencia de operación, manteniendo constante la viscosidad, se aumenta el caudal, y la presión de pulso tiene una disminución leve.
El corazón también varía el caudal con los cambios de la presión de descarga, la cual depende de los cambios de resistencia vascular. Es decir, los aumentos de resistencia vascular periférica deben ser cubiertos con incrementos de la presión cardíaca (presión de bombeo) para mantener el mismo flujo sanguíneo (débito cardíaco).
En las personas con entrenamiento físico, la respuesta del corazón ante un aumento de requerimientos de flujo es cubierta en su mayor parte por un aumento de la contractilidad, y es complementada con un aumento de la frecuencia cardíaca, pues el miocardio está en capacidad de aumentar la presión que se requiere para cubrir el incremento de resistencia vascular. En cambio, en las personas con poco entrenamiento físico o con falla cardíaca, el miocardio no tiene suficiente potencia para enfrentar los incrementos de presión, entonces recurre a un aumento de frecuencia para aumentar el caudal, que además en algunas oportunidades está acompañado de una leve disminución de la presión por reducir el volumen del ciclo. Esto hace que dicha respuesta sea limitada y reduzca su eficacia al incrementar el esfuerzo del miocardio, dando origen a la disfunción ventricular.
De igual manera, alteraciones de la activación eléctrica cardíaca por disfunción tanto en la generación como en la transmisión de estímulos, puede llevar a que el corazón no logre adaptarse a diferentes situaciones de exigencia de suministro sanguíneo. Bradicardia severa, taquicardia extrema o bloqueo de la conducción del estímulo eléctrico hacia los ventrículos, provocan deficiencia en el bombeo cardíaco. La fibrilación ventricular causa contracción caótica de la pared cardíaca, que lleva a un inapropiado bombeo, convirtiéndose en una disfunción hidrodinámica grave. En la fibrilación auricular, los estímulos conducidos a los ventrículos son bastante irregulares, produciendo variación del tiempo de llenado ventricular, esto junto con la pérdida de contracción efectiva de la aurícula, llevan a una reducción del volumen latido.
Trabajo cardíaco
En la función de bombeo, la pared cardíaca desarrolla dos procesos: actúa como transformador biofísico de energía, convirtiendo la energía química en mecánica; y actúa como bomba, cambiando de forma y contrayéndose para producir la expulsión sanguínea. Esto convierte al corazón en una bomba singular, en la cual la fuente de energía y la unidad de bombeo están integradas.
La energía consumida en el bombeo sanguíneo supone dos clases de trabajo: uno representado en el acortamiento-estiramiento de los elementos viscosos y elásticos de la pared, así como en los procesos metabólicos que el tejido demande, denominado trabajo interno; y otro, representado en la expulsión sanguínea, denominado trabajo externo.
Al igual que en la bomba mecánica de desplazamiento positivo, el trabajo producido para sostener la función de bombeo en el corazón se puede visualizar mediante la curva presión-volumen (Figura 5), en la cual el área contenida por la curva representa el trabajo eyectivo.
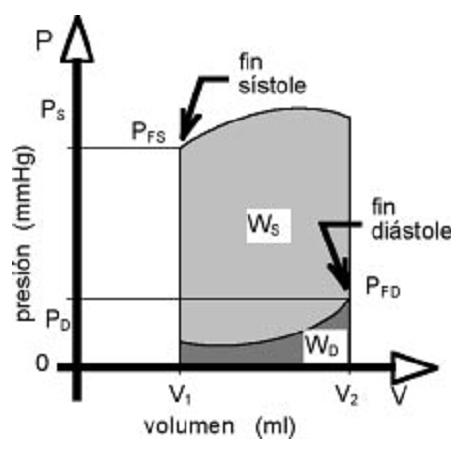
Figura 5. Relación presión-volumen en el ciclo cardíaco.
Trabajo interno. El corazón consume gran parte de la energía en sostener funciones que no contribuyen con el bombeo, pero que son propias de su operación: metabolismo celular, activación electroquímica de las fibras y generación de tensión en la pared, lo que se traduce en el denominado trabajo interno.
En tal sentido, la energía gastada en trabajo interno es significativa cuando el corazón maneja un volumen presistólico alto (aumento de la precarga) o debe enfrentar una gran resistencia hidráulica (aumento de la postcarga) debido al incremento de la tensión de la pared. También aumenta el trabajo interno y consecuentemente el gasto energético con el incremento de la frecuencia cardíaca, ya que el aumento de la velocidad de contracción de las fibras viscoelásticas demanda más potencia.
Mecánicamente el incremento en la esfericidad del ventrículo representa un incremento del trabajo interno por incremento de la tensión, según la ley de Laplace. A su vez, este cambio de la geometría puede llevar a insuficiencia de la válvula de entrada ventricular, provocando una disminución del volumen sistólico debido al reflujo, y deteriorando la hemodinámica aunque no se vea ello representado en la disminución de la fracción de eyección.
Trabajo externo. Es la cantidad de energía consumida en impulsar la sangre, lo que incluye: vencer la inercia de la masa sanguínea, compensar el factor elástico de la red vascular y vencer las pérdidas de flujo producidas por la viscosidad sanguínea.
Físicamente, el trabajo cardíaco (W) es resultado del producto de la presión alcanzada (P) por el volumen sanguíneo (V) en las cámaras durante la contracción.

El trabajo externo realizado por el corazón es transferido a la sangre en forma de energía de presión, la cual se descompone en energía cinética y potencial. Con la energía cinética (Wc), se impulsa la masa sanguínea (m) a una velocidad de expulsión (u), calculada mediante la ecuación:

mientras que con la energía potencial (WP), se mantiene la presión sanguínea (P), se cubren las pérdidas de energía de flujo debidas a la fricción viscosa (Dh1), los cambios hidrostáticos (DZ) y la dilatación vascular (s/Er), según la expresión:

Potencia de la bomba cardíaca
Para evaluar el desempeño del corazón, se debe cuantificar la potencia (Pot), que establece la relación entre el trabajo realizado (dW) durante la expulsión sanguínea y el tiempo en el cual se ejecuta (dt):

De manera clínica, se evalúa con el producto de la presión generada (P) durante la expulsión por el cambio de volumen ventricular (dV) y el tiempo sistólico (dt), según la expresión:

Al igual que sus análogos mecánicos, la operación del corazón se puede analizar considerando tres formas de potencia:
1- Potencia consumida (PC), gastada por el corazón en sus funciones durante cada ciclo, incluye el cubrimiento de los requerimientos metabólicos y la generación de tensión en la pared, que produce la presión de flujo.
2- Potencia mecánica (PM), requerida en la contracción de la pared; (3) Potencia hidráulica (PH), invertida en generar la presión de flujo para transportar la sangre a través de la red vascular.
La potencia hidráulica cardíaca varía con los cambios de resistencia vascular periférica y viscosidad sanguínea. Si alguno de estos factores se torna crónico, podrá causar disfunción ventricular, y en su estadio más avanzado genera la falla congestiva. En otros términos, la variación de potencia es un indicio de falla cardíaca secundaria.
Eficiencia de la bomba cardíaca
Es el rendimiento del corazón en términos del aprovechamiento de la potencia.
De acuerdo con las formas de potencia, se pueden definir físicamente dos clases de eficiencia:
Eficiencia hidráulica (ŒH), relaciona la potencia hidráulica (PH) transmitida al fluido con la potencia mecánica (PM) disponible en la pared:

Mide la capacidad de la bomba para transmitirle presión al fluido. Las bombas mecánicas de desplazamiento positivo alcanzan eficiencias hidráulicas altas, entre el 70 y 90%.
Eficiencia total (ŒT), relaciona la potencia hidráulica (PH) con la potencia consumida (PC),

Como es difícil medir por separado la energía gastada en los diferentes procesos que tienen lugar durante el ciclo cardíaco, sólo es posible definir el desempeño del corazón en términos de su eficiencia total: si durante un período de tiempo representativo (t), equivalente a un latido, se mide el trabajo útil sobre el fluido (WEXT) y la energía consumida (EC), se puede calcular la eficiencia total (ŒT) como:

Por lo tanto, la eficiencia total es un indicador del desempeño integral de la bomba cardíaca, ya que considera la eficiencia hidráulica, la eficiencia mecánica y la energía perdida en calor y gastos metabólicos durante su operación.
La cantidad de energía consumida en cada contracción se puede determinar evaluando el consumo de substratos ricos en fosfatos; sin embargo, no es fácil conocer la cantidad de substratos presente en las células miocárdicas; por tal motivo, se evalúa indirectamente midiendo la cantidad de oxígeno consumido (VO2) por el corazón, que se obtiene con la diferencia arterio-venosa coronaria de oxígeno y el débito cardíaco (CO):

Reducciones en la eficiencia cardíaca son indicios de una disfunción del miocardio, que puede tornarse en una falla cardíaca primaria.
Alteraciones estructurales que afectan la eficiencia hidráulica
Algunas malformaciones del corazón pueden constituirse en causa de falla cardíaca. En esta patología, la fuerza contráctil se encuentra usualmente intacta, al menos en estadios iniciales, pero diferentes partes de la bomba cardíaca presentan anormalidades estructurales y funcionales.
Comunicaciones anormales entre las cavidades y conexiones patológicas de los vasos principales son las más frecuentes condiciones de este grupo. Comunicaciones entre las aurículas o los ventrículos, producen flujo patológico de una cámara a otra, que se dirige de la zona de alta presión a la zona de baja presión. El flujo depende del tamaño del orificio y de la diferencial de presión entre las dos cámaras, de manera que puede ocurrir durante una parte o todo el ciclo cardíaco. En caso de estrechez de los tractos de salida ventricular o de las válvulas, aumenta la postcarga en el ventrículo correspondiente.
La función inadecuada de la bomba cardíaca también es causada por múltiples anomalías en las paredes ventriculares por afecciones miocárdicas, que pueden ser de tipo degenerativas, hipertróficas y anóxicas.
Diferentes miocardiopatías degenerativas acompañadas de fibrosis intersticial pueden ser causa de falla cardíaca primaria.
Se inician como un proceso inflamatorio, en el cual se puede encontrar hipocinesia ventricular, aumento de las presiones ventriculares al final de la diástole y reducción del índice cardíaco. A medida que la enfermedad avanza, sobreviene el proceso degenerativo miocárdico que lleva a un síndrome de dilatación del ventrículo (cardiomiopatía dilatada) causando disfunción sistólica y diastólica combinadas.
La miocardiopatía hipertrófica se caracteriza por un desarrollo exagerado de las fibras musculares (hipertrofia) casi siempre de tipo concéntrico. Con el crecimiento de la pared, las cavidades ventriculares se vuelven pequeñas y rígidas, ocasionando una disfunción diastólica. El hallazgo hemodinámico predominante es un incremento de presión en la aurícula y las venas correspondientes, como consecuencia de la elevada presión del ventrículo en la diástole.
Durante la eyección del ventrículo izquierdo puede presentarse una diferencia de presión entre la cámara y la sección de salida del ventrículo, ocasionada por la contracción hiperdinámica de la parte media del ventrículo, que provoca el desplazamiento del tabique interventricular hacia el cono de salida, en este caso recibe el nombre de cardiomiopatía hipertrófica obstructiva o estenosis subaórtica funcional.
La miocardiopatía anóxica, debido a la disminución del flujo sanguíneo coronario, es una causa frecuente de falla cardíaca primaria. Aunque la disfunción de contracción y relajación de tipo anóxico también se observa en pacientes con cardiomiopatía hipertrófica o estenosis aórtica, aún con coronarias normales.
Es importante señalar, bajo el punto de vista del análisis fisiopatológico, que el ventrículo izquierdo presenta diferencias con respecto al ventrículo derecho en cuanto al suministro y necesidades de oxígeno. El suministro de sangre al ventrículo izquierdo se da casi en su totalidad durante la diástole, a diferencia del derecho donde el flujo, aunque principalmente en diástole, tiene un componente importante durante la sístole. De otro lado, la demanda de oxígeno del ventrículo derecho es menor que la del ventrículo izquierdo, debido a su menor masa y trabajo realizado. Estos dos elementos contribuyen para que el problema isquémico del ventrículo derecho no repercuta de la misma manera que en el ventrículo izquierdo.
En el caso extremo, la interrupción de sangre a través de las coronarias lleva a necrosis de la zona afectada, que es seguida de la pérdida de las funciones de contracción y relajación de la zona comprometida, convirtiéndola en una estructura pasiva que reduce la eficiencia del corazón.
Como la función de las válvulas cardíacas es fijar el sentido del flujo pulsante en una dirección, alteraciones del mecanismo valvular producen disfunciones cardíacas de dos tipos según el daño de la válvula. En la estenosis la alteración del mecanismo valvular provoca alto consumo energético y reducción del flujo en dirección anterógrada, mientras que en la insuficiencia hay reflujo sanguíneo a la cámara anterior (regurgitación), reduciendo en ambas la eficiencia hidráulica8.
En las anteriores circunstancias, sea por mayor volumen o por resistencia al flujo, la lesión implica un incremento del trabajo de bombeo del ventrículo. Cuando la presión ventricular no es adecuada para eyectar la sangre a través del orificio estenótico, el volumen de sangre residual aumenta gradualmente en el ventrículo, dando comienzo a la dilatación de la cámara.
Como el trabajo del ventrículo izquierdo es mayor que el del ventrículo derecho, este tiene una gran reserva funcional que le permite incrementar la presión hasta en cuatro veces su valor normal (la presión ventricular izquierda no se incrementa en más de dos veces), por lo que la dilatación ventricular y la manifestación de falla aparecen sólo en casos avanzados.
Factores extracardíacos
Disfunción cardíaca secundaria. Aquella falla circulatoria relacionada con fenómenos externos al corazón, pero que traen como consecuencia una falla cardíaca, llevan a anormalidades intrínsecas miocárdicas o valvulares semejantes a las que se presentan en las fallas primarias. La mayoría de las veces relacionan un incremento en la resistencia al flujo, aumento de la masa sanguínea circulante, expansión del lecho vascular o impedimentos externos al llenado ventricular, como las afecciones pericárdicas, ya que este tiene una elasticidad limitada.
Sistema vascular. El aumento súbito de presión que genera el corazón con el volumen sanguíneo expulsado en cada contracción, es amortiguado por la viscoelasticidad de la pared arterial aórtica y pulmonar, que reacciona con una amplia dilatación disminuyendo considerablemente la resistencia hidráulica a la expulsión. Esta respuesta viscoelástica tiene como resultado una reducción del trabajo externo y por tanto una disminución de la tensión que debe desarrollar el miocardio durante la sístole. Es por esto que las propiedades mecánicas de la aorta, en mayor medida, y la pulmonar, en menor, tienen un papel protagónico en el acoplamiento funcional entre el corazón y la red vascular, ya que los vasos deben absorber el cambio súbito de presión del bombeo pulsante9.
Así, una reducción del amortiguamiento, como ocurre por aumento de la rigidez causada en los procesos arterioescleróticos, tiene consecuencias sobre la carga ventricular y la tensión parietal.
Relación entre las ondas de pulso y flujo. Con la energía suministrada por el corazón a la sangre, se superponen dos eventos en el árbol vascular: parte de la energía de expulsión se equilibra con la tensión del vaso, convirtiéndose en presión, produciendo la dilatación aórtica y pulmonar; y la energía restante impulsa la columna de sangre, convirtiéndose en velocidad, produciendo el flujo. Con la primera se genera la onda de pulso que se propaga por la pared del vaso mientras que con la segunda se genera la onda de flujo que se propaga por la sangre.
Fluido sanguíneo. El fluido sanguíneo es una solución de células y elementos formes suspendidos en un medio acuoso, el plasma. Por su parte, el plasma está conformado en casi su totalidad por agua, y el resto por proteínas y otras substancias.
La sangre exhibe una reacción viscosa que depende de varios factores, dificultando la interpretación de su comportamiento así como la elaboración de modelos físicos que describan los fenómenos de flujo. Sin embargo, de las observaciones experimentales se han podido fijar unas condiciones bajo las cuales se puede aplicar los conceptos básicos de la mecánica de fluidos para simplificar su tratamiento y facilitar la solución de los modelos.
Comportamiento viscoso. La sangre completa se comporta como un fluido no newtoniano debido a su contenido celular; sin embargo, en la macrocirculación el flujo sanguíneo exhibe un comportamiento que se aproxima al newtoniano, gracias a una propiedad dinámica importante del eritrocito en virtud de la cual adquiere forma hidrodinámica que reduce la perturbación del flujo, denominada flexibilidad eritrocitaria, y que participa en la mecánica de la circulación sanguínea.
Disfunciones debidas al cambio de forma del eritrocito o incremento del hematocrito, aumentan la viscosidad sanguínea, lo que demanda un mayor trabajo externo; afectando la eficiencia de la bomba cardíaca.
Los flujos que se caracterizan por fuerzas inerciales predominantes sobre las fuerzas viscosas, representados con número de Reynolds altos, tienen tendencia a la turbulencia. Es el caso del flujo sanguíneo que se da a través de los vasos mayores y las cámaras del corazón, con grandes áreas de flujo y considerable masa sanguínea. Este tipo de flujo consume mayor cantidad de energía y puede traducirse en un momento dado en una alteración de la eficiencia.
Sobrecarga y remodelación cardíaca. La sobrecarga hemodinámica, ya sea de presión o de volumen, induce una remodelación de las paredes como parte de los mecanismos de adaptación del miocardio, denominada remodelación ventricular, definida por los cambios de masa, tamaño y forma que llevan a una variación de la relación masa-volumen del ventrículo.
Los mecanismos de adaptación del corazón le permiten soportar las sobrecargas de presión o volumen por largo tiempo sin deterioro de la función ventricular, aunque más tarde estos mecanismos serán insuficientes, con la consiguiente alteración de la función. Las sobrecargas de presión implican mayor tensión sistólica del corazón y ello induce fundamentalmente hipertrofia sin dilatación, mientras que las sobrecargas de volumen implican mayor tensión diastólica e inducen dilatación de la cámara.
Sobrecarga de presión. Al igual que en cualquier sistema hidráulico, los incrementos de la resistencia en el sistema cardiovascular imponen una carga adicional de trabajo a la bomba. El aumento de la resistencia por hipertensión arterial, estrechamiento de la salida ventricular o de los grandes vasos, conlleva una sobrecarga al ventrículo. La respuesta inicial ante esta alteración consiste en incrementar la presión generada por la cámara ventricular durante la contracción y prolongar el tiempo de eyección, aumentando el trabajo cardíaco, para lo cual se utiliza la reserva disponible. A medida que evoluciona la disfunción, la sobrecarga de presión induce hipertrofia de la pared ventricular de tipo concéntrica que, a medida que progresa, lleva a un trastorno en la relación masa-pared-funcionalidad, consumiendo más energía de la que dedica al trabajo externo, incrementando las necesidades energéticas del corazón. Durante estados moderados de hipertrofia se observa una proliferación de capilares que llenan las necesidades y demandas de sangre por parte del miocardio; sin embargo, al avanzar la hipertrofia, alcanza un nivel crítico en el cual la suplencia coronaria de oxígeno se torna insuficiente, de manera que la presión de perfusión coronaria se vuelve una variable crítica para suministrar un adecuado flujo al corazón, y cuando la presión disminuye se presenta un fenómeno de anoxia miocárdica.
Simultáneamente con la hipertrofia, se presenta en algunas ocasiones hiperplasia con incremento en el número de fibroblastos y producción de tejido fibroso, con un incremento de la proporción de colágeno en el miocardio. La producción de tejido conectivo es responsable a su vez de la disminución de la distensibilidad de la pared ventricular. También se puede presentar ruptura de la estructura colágena con el consecuente deslizamiento de los miocitos, alterando la unión y relación de las unidades contráctiles, produciendo una contracción ineficaz. Estos dos eventos demandan un mayor trabajo interno, afectando la eficiencia de la bomba cardíaca.
La hipertrofia culmina en falla cardíaca cuando el espesor de la pared no aumenta en proporción a la tensión que sufre, debido en parte a la isquemia miocárdica intermitente, que inhibe la síntesis de proteínas en el miocardio y los procesos dependientes de energía. También sobreviene la falla cuando la distensibilidad ventricular se ve tan afectada que limita el llenado ventricular. Ante la tensión crónica sobreviene la dilatación de las cámaras cardíacas y, según el principio de Laplace, ello incrementará aún más la tensión sobre las paredes. En última instancia, el miocardio se vuelve incapaz de vencer la excesiva carga sobreimpuesta y entra en falla.
Sobrecarga de volumen. En los sistemas hidráulicos, el incremento del volumen de bombeo representa una carga adicional de trabajo a la bomba. Las patologías con alto débito cardíaco por aumento de volumen debido a incremento de la volemia, como en comunicaciones arteriovenosas y enfermedad valvular que represente reflujo a las cámaras ventriculares, generan una sobrecarga al ventrículo correspondiente.
La sobrecarga de volumen sostenida por largo tiempo lleva a la dilatación de la cámara e induce hipertrofia de tipo excéntrica de la pared. Ello conlleva un cambio de geometría (forma y tamaño) del corazón que puede interferir el funcionamiento, sin embargo, puede tener diferente connotación según la causa. Por ejemplo, la insuficiencia mitral, tanto como la aórtica, condiciona una sobrecarga de volumen al ventrículo izquierdo, aunque su comportamiento fisiopatológico es diferente. En la insuficiencia mitral aunque hay un incremento de volumen ventricular diastólico (precarga), la fuga de sangre hacia la aurícula durante la sístole disminuye la resistencia a la eyección, debido a que hay dos orificios de salida. En cambio, en la insuficiencia aórtica, la regurgitación valvular produce igualmente un incremento del volumen diastólico, pero a diferencia del caso anterior, es eyectado por un solo orificio de salida, generando así un mayor trabajo durante la sístole.
Ambas patologías producen dilatación de la cámara pero con diferentes efectos. En el caso de la insuficiencia mitral, sólo en estadios avanzados se presenta incremento de la tensión sistólica (consecuencia de la dilatación progresiva del ventrículo con disminución relativa del espesor de la pared), momento en el cual la tensión se convierte en un estímulo para generar hipertrofia. En esta patología, el estiramiento excesivo de la pared, debido a la dilatación y a una hipertrofia miocárdica inadecuada, puede dañar estructuralmente las miofibrillas, conduciendo a la insuficiencia contráctil. Bajo estas condiciones, reparar la insuficiencia mitral empeoraría la falla porque se incrementa la postcarga, ya que sólo queda un orificio de salida.
En el caso de la insuficiencia aórtica, el incremento temprano de la tensión estimula la hipertrofia, haciendo que esta sea concomitante con la dilatación, protegiendo así al ventrículo del estiramiento de la pared; por lo tanto hay mayor resistencia para que aparezca daño estructural de las miofibrillas evitando la insuficiencia contráctil. Bajo estas condiciones, a diferencia del caso anterior, su pronóstico mejorará al reemplazar la válvula, ya que con ello se disminuye la precarga.
Modelos biomecánicos de falla cardíaca
Para evaluar el comportamiento dinámico normal o patológico del sistema cardiovascular se pueden elaborar modelos obtenidos por comparación con sus homólogos hidráulicos, que pueden ser físicos10-12 o matemáticos13-16. Los modelos físicos son aproximaciones en símiles hidráulicos, mientras que los modelos matemáticos son una representación del sistema real mediante ecuaciones que caracterizan las funciones y elementos de operación.
Aunque es difícil elaborar un modelo completo del sistema cardiovascular, de un lado por las muchas variables que intervienen y de otro por las complejas relaciones entre sus componentes, que llevan a modelos demasiado complejos y difíciles de resolver; de las observaciones experimentales del sistema, se pueden fijar unas condiciones que simplifican el tratamiento de cada subsistema y facilitan la solución de los modelos.
Para la construcción del modelo cardíaco se debe considerar las características de los elementos biomecánicos, como la configuración de redes en las secciones vasculares, el aparato valvular, la viscoelasticidad de los componentes y las propiedades de la sangre; así como, el comportamiento hemodinámico del sistema. El modelo se puede simplificar suponiendo que bajo condiciones fisiológicas la sangre mantiene la densidad constante, por lo tanto se evalúa como un fluido incompresible. De otro lado, en la macrocirculación la sangre se comporta como un fluido con viscosidad uniforme, por lo tanto se puede considerar como fluido newtoniano.
Con estos modelos, se realizan simulaciones brindando la posibilidad de evaluar el comportamiento del sistema bajo diferentes condiciones patológicas; como alternativa a las restricciones que impone la realización de complejos estudios en el sistema vivo, ofreciendo así un nuevo método para evaluar el sistema cardiocirculatorio.
Un caso específico es el análisis del efecto de la modificación de la forma del corazón en la eficiencia, cuando cambia su geometría elíptica normal a una globular o esférica, que tiene desventajas mecánicas significativas: en casos de dilatación sin hipertrofia o con hipertrofia excéntrica la forma del corazón tiende a ser globular, mientras que en la dilatación con hipertrofia concéntrica tiende a ser más elíptica. Existe evidencia clínica que entre corazones de similar espesor y tamaño, los que tienen forma globular están asociados con baja eficiencia para realizar trabajo eyectivo y mayor probabilidad de desarrollar insuficiencia cardíaca, a través de modelos computacionales es posible predecir los cambios en la geometría cardíaca para que un procedimiento quirúrgico de remodelación ventricular tenga mayor eficacia.
Asistencia mecánica de la falla cardíaca
Los pacientes con disfunción cardíaca, para quienes la terapia farmacológica y quirúrgica ya no representaban una opción terapéutica, contaban hasta hace pocos años sólo con la opción del trasplante como única alternativa para su supervivencia, con grandes dificultades de aplicación por la escasez de donantes y del manejo inmunológico del rechazo.
En las últimas décadas, se han introducido numerosas técnicas para la asistencia mecánica de la falla cardíaca terminal, dando origen a diversos dispositivos para suplir la función de la bomba cardíaca. Estos dispositivos se clasifican según su ubicación en soportes extracorpóreos e intracorpóreos, y según su tiempo de aplicación como de corta asistencia hasta soportes prolongados o permanentes, y reciben el nombre de dispositivos de asistencia ventricular (VAD, por su acrónimo en inglés).
Varios de estos equipos representan por su misma portabilidad y versatilidad una posibilidad para que el paciente pueda estar en su casa en lugar de en una unidad hospitalaria, o incluso asistir a su trabajo. El desarrollo tecnológico alcanzado en el campo de la cardiología con estos soportes ha llegado al punto en el que hoy se accede primero la opción de los VAD antes que el trasplante.
Además del soporte circulatorio que ofrecen los dispositivos de asistencia ventricular y su beneficio sistémico, la reducción del trabajo cardíaco que implica su uso debido a la reducción de la postcarga ventricular, la cual asume el VAD, ha demostrado una recuperación de la estructura histológica y por tanto de la función de contracción.
El propósito de la asistencia temporal en un comienzo debe buscar la máxima descarga del trabajo ventricular para disminuir la disfunción; en una fase más avanzada, debe pretender una carga progresiva que evite que la falta de actividad miocárdica conduzca a atrofia y disfunción, e incluso que propicie la recuperación funcional.
El reto tecnológico impuesto por la optimización del mecanismo funcional de los VAD, ha llevado al desarrollo de dispositivos que se centran en dos formas de operación: de flujo pulsátil y de flujo continuo. La comparación de las condiciones biomecánicas de los dos tipos de flujo, pulsante y continuo, puede aportar criterios fundamentales para interpretar los resultados obtenidos de su aplicación hasta hoy y permitir la optimización de los VAD17-19.
Considerando que la función del sistema cardiocirculatorio es prefundir los órganos y transportar los eritrocitos, el flujo pulsante no es sólo la condición natural, sino la adaptación más eficaz para cumplir los dos propósitos con el menor consumo de energía. Durante la sístole, la presión generada por el corazón aumenta la velocidad sanguínea, se concentran los eritrocitos en el núcleo de flujo y se reduce la viscosidad sanguínea para transportarlos de un segmento vascular a otro3; mientras que durante la diástole cesa la presión, se reduce la velocidad y se dispersan los eritrocitos hacia la pared vascular permitiendo la distribución de eritrocitos hacia todas las ramificaciones derivadas.
En contraste, el flujo continuo no es fisiológico y no tiene los beneficios del flujo pulsante: facilitar la distribución de eritrocitos hacia todas las ramificaciones y estimular la pared con el cambio de presión. En un flujo continuo se forma una corriente permanente, con velocidad constante y una capa límite (región de flujo con alta viscosidad) en las cercanías de la pared, la cual aumenta el esfuerzo de flujo, demandando más energía de operación.
Eliminar el estímulo periódico sobre la pared vascular durante tiempos prolongados, altera el estado del sistema vascular, con aumento de la resistencia vascular periférica20. Como la presión es constante, se mantiene dilatado el vaso, agotando su reserva de relajación, entrando en la zona de fluencia, que se reduce con el tiempo por acumulación de deformación, es decir se aumenta la rigidez y tensión del vaso.
Dado que el flujo natural tiene carácter pulsátil, surge el interés por comprender la reacción del organismo ante el flujo continuo de varios modelos de VAD. Las investigaciones en animales muestran que el organismo puede adaptarse al flujo continuo21 y en este sentido un estudio comparando la hemodinámica en pacientes asistidos con flujo pulsante y continuo durante tres meses22 no encontró diferencias significativas. En contraste, otros resultados experimentales muestran que el flujo pulsante, además de ser el fisiológico, propicia la recuperación de los órganos (pulmones, riñones) después de asistir la disfunción circulatoria23.
Además de los mecanismos de bombeo, en los VAD también se viene trabajando en sistemas de control dinámico (redes neuronales y control difuso) que ajusten los mecanismos de operación del dispositivo de acuerdo a la demanda del paciente, es decir para adaptase a las distintas necesidades24,25. Sin embargo, fijar los criterios de control para los dispositivos no ha sido fácil, por la dificultad para duplicar los mecanismos de regulación que tiene el sistema natural.
En el momento, hay una variedad de dispositivos de asistencia en vías de desarrollo y aplicación práctica. Dentro de estos, es posible que las ventajas de los sistemas axiales, tales como el tamaño y el ahorro de energía, aunadas al conocimiento de los efectos del flujo continuo en el organismo, determinen que se generalice su uso en la práctica clínica.
Conclusiones
El enfoque biomecánico del corazón aporta conceptos prácticos con los cuales se puede analizar la funcionalidad del sistema cardiocirculatorio bajo diferentes condiciones tanto fisiológicas como fisiopatológicas; de esta forma, proporciona el conocimiento necesario para el mejor aprovechamiento de los recursos de la tecnología medica, y facilita el diseño y mejoramiento de dispositivos cardiovasculares, así como de distintos accesos terapéuticos.
1. Bustamante J. La evolución de la tecnología cardiovascular a partir de la investigación interdisciplinaria. Sociedad Iberoamericana de Información Científica SIIC, SIICSalud 2007;v.Abril:1-6. [ Links ]
2. Bustamante J. Biomecánica Cardiovascular: Aplicación de una disciplina básica en la cardiología clínica y quirúrgica. Rev Col Cardiol 2000;8;5:233-238. [ Links ]
3. Bustamante J, Valbuena J. Biomecánica Cardiovascular. Medellín: Editorial Universidad Pontificia Bolivariana 1999:1-374. [ Links ]
4. Bustamante J, Valbuena J. Biomecánica cardiocirculatoria: análisis y modelado cardiovascular. Rev Col Cardiol 2003;10;5:229-239. [ Links ]
5. Armentano RL, Fischer EI. Biomecánica arterial. Buenos Aires: Editorial Akadia 1994:1-200. [ Links ]
6. Fischer EI, Chachques JC, Perrone SV, Pichel RH. Insuficiencia cardíaca severa. Buenos Aires. Editorial Akadia 1994:1-203. [ Links ]
7. Bustamante J, Mejía S, Zuleta L, Del Valle C, Chamat J, Valbuena J. Desarrollo de un prototipo de bomba de flujo pulsátil para caracterizar las condiciones hidrodinámicas en un ambiente de circulación extracorpórea. Rev Col Cardiol 2007;14;1:25-32. [ Links ]
8. Bustamante J. Biomecánica valvular cardíaca. En: Enfermedad valvular. 1ª Ed. Montoya M, Escobar C, Jaramillo S. (Eds.), Medellín: Servigráficas Ltda - Publicaciones Congregación Mariana 2004:p.47-71. [ Links ]
9. Bustamante J, Echeverri C, Valbuena J. Evaluación hidromecánica de venas yugulares bovinas frescas y fijadas en glutaraldehído para uso como bioimplante cardiovascular. Rev Col Cardiol 2007;14;4:238-245. [ Links ]
10. Bía D, Bustamante J, Cabrera E, Zócalo Y, Pérez H, Saldias M, Alvarez I, Armentano R. Integrated metodology development for vascular and heart valve prosthesis evaluation in tissue banks. Cardiovascular Sciences Forum 2006;1;1:11-29. [ Links ]
11. Bustamante J, Barros JF, Roldán A, García S. Modelo físico del sistema cardiovascular - DYNASIM. Rev Col Cardiol 2004;11;3:150-156. [ Links ]
12. Bustamante J, Herrera E, Henao F, Pardo H, Madrid L. Desarrollo de un nuevo equipo para la evaluación hidrodinámica de bioprótesis valvulares cardíacas - Simulador Cardiovascular T/II. Rev Col Cardiol 2001;8;9:425-432. [ Links ]
13. Bustamante J, Suárez G, Landaeta R. Nuevos recursos para la investigación en el área de la cardiología: técnicas numérico-matemáticas aplicadas al diseño y desarrollo de dispositivos de uso cardiovascular. Rev Fed Arg Cardiol 2005;34;3:350-357. [ Links ]
14. Bustamante J, Suárez G. Planteamiento del modelo para una bomba de asistencia ventricular cardíaca (Dibac) como fase previa al estudio de la interfase fluido-mecánico del dispositivo. En: Simulación numérica y modelado computacional. 1ª Ed. J. Rojo, M.J. Torres, M. Cerrolaza (Eds.). Caracas: Sociedad Venezolana de Métodos Numéricos 2004: p. BI 1-8. [ Links ]
15. Bustamante J, Valbuena J. Modelización cardiocirculatoria. En: Bioingeniería en Iberoamérica: Avances y Desarrollos. 1ª Ed. Müller-Karger CM, Cerrolaza M. (Eds.). Barcelona: Editorial Zasoram 2003: p. 175-203. [ Links ]
16. Bustamante J, Landaeta R, Suárez G. Técnicas computacionales aplicadas al desarrollo de la cardiología. Gaceta Cardiovascular 2003; No 10:6-7. [ Links ]
17. DeBakey Michael. Miniature implantable axial flow ventricular assist device. Ann Thorac Surg 1999;68:637-640. [ Links ]
18. Potapov E, Loebe M, DeBakey M, et al. Pulsatile flow in patients with a novel nonpulsatile implantable ventricular assist device. Circulation 2000;102:III-183. [ Links ]
19. Kim Y, Chernyshev O, Alexandrov A. Nonpulsatile cerebral perfusion in patient with acute neurological deficits (case report). Stroke 2006;37:1562. [ Links ]
20. Runge T, Grover F, Cohen J et al. Comparison of a steady flow pump to a preload responsive pulsatile pump in left atrial-to-aorta bypass in canines. Artif Organs 1991;15:35-41. [ Links ]
21. De Rose J and Jarvik R. Axial flow pumps; in: Cardiac Assist Devices. Goldstein D. and Oz M. Eds. New York; Ed Futura Publishing 2000:359-374. [ Links ]
22. Haft J, Armstrong W, Pagani F et al. Hemodynamic and exercise performance with pulsatile and continuous-flow left ventricular assist devices. Circulation 2007;116:I8-I15. [ Links ]
23. Mori F, Ivey T, Itoh T, et al. Effect of pulsatile reperfusion on postischemic recovery of myocardial function after global hypothermic cardiac arrest. J Thorac Cardiovasc Surg 1987;93:719-727. [ Links ]
24. Vollkron M, Schima H, Huber L, Benkowski R, Morello G, Wieselthaler G. Development of a suction detection system for axial blood pumps. Artif Organs 2004;28;8:709-16. [ Links ]
25. Schima H, Vollkron M, Huber L, et al. Necessities for patient and device monitoring during the various phases of circulatory support. ISRBP 2003. [ Links ]














