Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Insuficiencia cardíaca
versão On-line ISSN 1852-3862
Insuf. card. v.4 n.3 Ciudad Autónoma de Buenos Aires jul./set. 2009
ARTÍCULO DE REVISIÓN
Manejo contemporáneo de la insuficiencia mitral severa
Valentina M. Bichara, MD*; Héctor I. Michelena, MD**; Yan Topilsky, MD**; Rakesh Suri, MD, PhD***; Maurice Enriquez-Sarano, MD**
* Hospital Centro de Salud. San Miguel de Tucumán. Tucumán. República Argentina.
** División de Enfermedades Cardiovasculares. Clínica Mayo. Rochester. Minnesota. Estados Unidos de Norteamérica.
*** División de Cirugía Cardiovascular. Clínica Mayo. Rochester. Minnesota. Estados Unidos de Norteamérica.
Correspondencia: Héctor I. Michelena, MD
Mayo Clinic 200 First Street SW, Rochester, MN, USA. 55905
Tel: 507-2843687
Fax: 507- 2667929
E-mail: michelena.hector@mayo.edu
Recibido: 02/08/2009
Aceptado: 04/09/2009
Palabras clave: Insuficiencia cardíaca; Insuficiencia de la válvula mitral; Riesgo; Cirugía torácica; Pronóstico
Introducción
La hemodinamia de la insuficiencia mitral (IM) está caracterizada por la reversión del flujo sanguíneo durante la sístole ventricular, desde el ventrículo izquierdo (VI) hacia la aurícula izquierda (AI). La etiología de la IM es predominantemente degenerativa, primaria u orgánica (alteración intrínseca de las valvas en los casos de enfermedad de Barlow, deficiencia fibroelástica, prolapso, ruptura cordal) en países desarrollados y reumática en países en desarrollo. La IM funcional (valvas normales con dilatación del anillo y/o desplazamiento de las valvas [“tethering”]), secundaria a cardiopatía dilatada o enfermedad isquémica del VI continúa en ascenso, debido a la epidemia mundial de la enfermedad coronaria. La IM es la enfermedad valvular más común en los Estados Unidos de Norteamérica, con una frecuencia de IM moderada o severa del 1,7% en la población general, ascendiendo al 6,4% en individuos entre 65-74 años y del 9,3% en > 75 años1. La ecocardiografía Doppler ha resultado ser el modo no invasivo por excelencia para su diagnóstico y para toma de decisiones en su tratamiento. La IM resulta de la disfunción mecánica de la válvula mitral y sus componentes (anillo, valvas, cuerdas tendinosas y músculos papilares) y por lo tanto su corrección definitiva es mecánica también, a través de la cirugía. Pero la válvula mitral no es un ente aislado; está íntimamente relacionada con el VI y es garante de la función de este último, debido a su continuidad a través de las cuerdas tendinosas. Lasúltimas décadas han sido testigo de avances substanciales en el entendimiento de la fisiopatología, historia natural y desarrollo de opciones para el tratamiento mecánico de esta condición. Específicamente, la reparación mitral para IM orgánica y el reemplazo mitral con conservación del aparato subvalvular para válvulas no reparables constituyen la base del tratamiento actual. Procedimientos mecánicos percutáneos menos invasivos están siendo investigados. La historia natural y fisiopatología de la IM ha generado importantes debates y avances en cuanto al “timing” o momento quirúrgico apropiado para la corrección de esta condición. La combinación de una progresión en IM que puede ser pausada, con ausencia de síntomas o sintomatología mínima, y la noción de un posible deterioro irreversible del VI en asintomáticos con fracción de eyección (FE) normal, son el eje de estos debates. Sin embargo, el impacto clínico negativo de factores de riesgo recientemente descritos en la IM severa y de la disfunción del VI no reconocida oportunamente, ha llevado, junto al éxito y baja mortalidad de la reparación de la válvula, al concepto de la cirugía temprana.
La IM es una enfermedad progresiva
La IM es una enfermedad progresiva, con un aumento promedio de 5-8 ml por año del volumen regurgitante (VolR) y de 4-6 mm2 por año del orificio regurgitante efectivo (ORE)2. Los cambios anatómicos son los factores determinantes de la progresión, siendo más rápida en pacientes con prolapso de válvula mitral, en particular nueva ruptura cordal (hasta 20 ml por año), y en los pacientes con dilatación del anillo mitral. Es importante destacar que la progresión no es uniforme: se observa progresión importante en la mitad de los pacientes, pero hasta el 11% presenta regresión espontánea de la IM, relacionado con la mejoría en las condiciones de precarga. La progresión de la IM es causa de remodelado adverso del ventrículo izquierdo con desarrollo de disfunción ventricular2, que puede ocurrir inicialmente con una FE “normal” (>50%) y sin síntomas, y trae consigo un pronóstico inferior al de la población no afectada. Eventualmente, la FE disminuye significativamente y el pronóstico es más reservado.
La inquietante historia natural de la IM severa
Son ampliamente dispares las estimaciones de sobrevida a largo plazo en pacientes con IM que han sido reportadas3,4 (entre el 27-97% a cinco años). En la Mayo Clinic se analizó la historia natural de la IM causada por ruptura cordal5 y observamos que, en comparación con las expectativas de supervivencia de la población general, la mortalidad en IM fue notable (6,3% anual). Una alta morbilidad estuvo presente a los 10 años, con una incidencia de fibrilación auricular (FA) del 30%, y de insuficiencia cardíaca del 63%. Además, a los 10 años, el 90% de los pacientes había fallecido o se le practicó cirugía, lo que significa que la operación es casi inevitable en esta población. Los pacientes en clase funcional (CF) III-IV de la New York Heart Association (NYHA), incluso transitoria, mostraron una elevada mortalidad (34% anual), si no eran operados; pero incluso en aquellos con CF I- II, la mortalidad fue notable (4,1% anual). Los pacientes con FE<60% también muestran un incremento en la mortalidad, comparado con aquellos con FE>60%; pero no pudimos definir ningún grupo de bajo riesgo, a pesar del tratamiento médico adecuado. De tal manera que esperar una reducción de la FE<60% o la aparición de síntomas CF II de la NYHA parece no ser adecuado, ya que el pronóstico empeora aunque se practique cirugía.
La muerte súbita es un evento catastrófico en la IM severa con ruptura cordal, responsable aproximadamente del 25% de las muertes en pacientes bajo tratamiento médico6. Los determinantes de las tasas más altas de muerte súbita son los síntomas graves y la baja FE; sin embargo, la mayoría de las muertes repentinas se produce en pacientes sin síntomas o con mínimos síntomas y FE normal6. La tasa de muerte súbita es del 1,8% por año en general, incluso en pacientes sin factores de riesgo es del 0,8% por año. Estos datos ponen en evidencia el grave pronóstico que implica la IM severa, lo que sugiere que la cirugía debe considerarse en forma temprana en el curso de la enfermedad.
Disfunción ventricular izquierda:
frecuente y poco previsible
Cómo evaluar la función del VI en la IM es objeto de un intenso debate. El incremento del volumen diastólico aumenta la precarga. Durante la sístole ventricular, el volumen regurgitante va hacia la AI; esto sugiere una disminución de la impedancia a la eyección, pero al final la poscarga continúa normal, resultando en una FE que puede permanecer normal por un tiempo considerable. Múltiples métodos de medición de los índices de la función ventricular izquierda han sido sugeridos, sin embargo, la FE y el diámetro de fin de sístole (DFS) del VI son los más prácticos, porque resultan fáciles de cuantificar ecocardiográficamente y conservan poder predictivo, porque representan una aproximación a la contractilidad intrínseca del VI.
Clínicamente, la disfunción ventricular izquierda es indicador de mal pronóstico con tratamiento conservador5 e inclusive en el postoperatorio7. A pesar de no ser común la muerte perioperatoria debido a los progresos de la anestesiología y la protección del miocardio, la disfunción del VI es la causa más frecuente de muerte tardía posoperatoria7. La FE disminuye de manera significativa, inmediatamente después de la corrección quirúrgica de la IM, aproximadamente, un 10%2. Por lo tanto, a pesar de la mejoría sintomática, es frecuente la disfunción ventricular izquierda posoperatoria (FE<50%), sucediendo en cerca de un tercio de los pacientes con IM orgánica operados con éxito. La disfunción ventricular izquierda posoperatoria está asociada a una baja sobrevida2,8, y a una alta incidencia de insuficiencia cardíaca9, y por lo tanto debe procurarse prevenirla.
La FE preoperatoria es el mejor predictor de mortalidad y de insuficiencia cardíaca a largo plazo en pacientes con tratamiento conservador5 y, también, luego de la cirugía7. El DFS también es un factor importante para predecir la FE en el posoperatorio2. Por lo tanto, pacientes con una FE<60% y/o un DFS>40 mm son considerados pacientes con disfunción ventricular izquierda manifiesta, aunque estén asintomáticos y deben recibir cirugía de rescate en ausencia de otras comorbilidades o contraindicaciones10.
Sin embargo, la reducción de la FE del VI no debe ser considerada una contraindicación para la cirugía en pacientes con IM orgánica, porque la mortalidad operatoria no es excesiva, especialmente, si se puede reparar la válvula7. La precisión de la predicción de la FE posoperatoria es inexacta2,8,11, pero el mejor resultado se observa en pacientes con una FE>60%; esta etapa de la enfermedad parece representar la mejor oportunidad para la cirugía. Por lo tanto, el concepto de espera los primeros signos y síntomas de disminución de la FE está asociado a un notable riesgo de “inesperada” disfunción del ventrículo izquierdo2 que puede resultar irreversible y afectar el pronóstico quirúrgico y post-quirúrgico. Las indicaciones actuales para cirugía mitral por IM del American College of Cardiology y la American Heart Association10 están resumidas en la Tabla 1. Estas indicaciones se refieren a una IM severa con un VolR≥60 cc/latido y un ORE≥0,4 cm2, y están dirigidas a patología orgánica/primaria, excepto cuando se especifique una patología isquémica.
Cirugía mitral: avances recientes
Los riesgos y resultados quirúrgicos son consideraciones esenciales en la evaluación del momento quirúrgico. La mortalidad operatoria es de considerable importancia. Sin embargo, para los pacientes con IM orgánica, la mortalidad a disminuido considerablemente12, especialmente con reparación mitral (Figura 1). En la Mayo Clinic de Rochester (MCR) es de alrededor del 1% en pacientes menores de 75 años, a quienes se le realizó reparación o reemplazo valvular7. Por el contrario, la mortalidad operatoria en pacientes mayores de 75 años es aproximadamente del 5% en nuestra institución. Sin embargo, la cirugía mejora la sobrevida del paciente y la normaliza a la esperada en la población general13, de tal manera que la cirugía en patologías orgánicas (usualmente deficiencia fibroelástica en este grupo etáreo) se debe considerar antes que la disfunción del VI suceda, en estos pacientes mayores.

Figura 1. Reparación mitral. Conceptos quirúrgicos básicos. A. Esquema de la resección triangular de la valva posterior con aposición y sutura de los segmentos resultantes. B. Sutura de una banda de 63 mm (standard en la Mayo Clinic) a los trígonos fibrosos del anillo mitral seguido de prueba de integridad con solución salina. Figuras con permiso de la Mayo Clinic.
La disponibilidad de reparación de la válvula es de crucial importancia. Estudios previos sugieren una menor mortalidad operatoria y una mejor sobrevida a largo plazo después de la reparación valvular14,15, pero no estaba claro si esto se debe a una mejor condición preoperatoria de los pacientes sometidos a reparación de la válvula o a la virtud del propio procedimiento. En nuestra experiencia, ajustando las diferencias clínicas entre pacientes que reciben reparación versus sustitución, la reparación de la válvula per se es un predictor independiente de mejores resultados después de la cirugía en IM, con una menor mortalidad operatoria y mayor sobrevida a largo plazo9. Este beneficio se observa asociado, o no, a la cirugía de revascularización miocárdica9. Una de las principales razones para mejorar el resultado es una mejor FE del VI, lo cual se logra después de la reparación de la válvula mitral9. La conservación del aparato subvalvular sin duda juega un papel en la conservación de la FE después de la reparación valvular, como no ocurre después del reemplazo valvular. La mejoría en la sobrevida después de la reparación valvular no está asociada a un menor riesgo de reoperaciones9.
No sólo la disponibilidad de la reparación, sino también, la experiencia del centro que la practica, son fundamentales. Los hospitales que practican más de 140 reparaciones por año se acercan a una mortalidad quirúrgica del 1% versus el 3% en hospitales con menos de 140 reparaciones por año16.
La ecocardiografía transesofágica intraoperatoria es un componente esencial del éxito de la reparación de la válvula y debe ser llevada a cabo por médicos con experiencia para supervisar el procedimiento y asistir en la toma de decisiones intraoperatorias17.
Por lo tanto, la reparación de la válvula se ha vuelto extremadamente popular18 y, actualmente, el éxito de la reparación es >90% en pacientes con IM. Este alto porcentaje en la reparación ha sido posible al culminar la curva de aprendizaje inicial del cirujano y a través de la utilización de técnicas especiales, tales como la transposición cordal o la inserción de cuerdas artificiales en particular para la ruptura cordal de la valva anterior19,20. Desafortunadamente, la reparación mitral en lesiones reumáticas no es tan exitosa como en lesiones degenerativas21. Sin embargo, la reparación mitral en la IM reumática debe ser practicada cuando sea anatómica y funcionalmente posible, porque está asociada a una sobrevida superior cuando se la compara con el reemplazo valvular. El reemplazo mitral disminuye la reoperación en la IM reumática, pero limita la sobrevida y aumenta el riesgo de complicaciones embólicas22.
A pesar de esta elevada tasa de viabilidad, la reparación valvular mitral no debe considerarse como una panacea protectora de disfunción ventricular, debido a que en pacientes con FE<60%, un exceso de mortalidad se observa independientemente de la reparación o el reemplazo9. Por lo tanto, la posibilidad de realizar la reparación en un alto porcentaje de pacientes debería considerarse como un incentivo para llevar a cabo la cirugía temprana, debido a su bajo riesgo y buena sobrevida, y no como un incentivo para retrasar la cirugía y esperar una disfunción ventricular.
El centro del debate: el momento quirúrgico
Existen dos vertientes en el pensamiento actual, en relación al momento quirúrgico de la IM severa. Una recomienda “esperar atentamente” hasta la aparición de disfunción subclínica del VI en pacientes asintomáticos (ej.: FE<60%, DFS del VI>40 mm), evaluando al paciente con ecocardiografía cada 6 ó 12 meses. La otra recomienda considerar la “reparación mitral temprana” sin esperar síntomas y sin alcanzar indicadores de disfunción subclínica del VI, siempre y cuando exista certeza de la severidad de la IM con cuantificación ecocardiográfica apropiada (incluyendo Doppler cuantitativo y/o uso del método PISA, reportando valores de VolR y ORE), ofreciendo una probabilidad >95% de reparación, con una mortalidad operatoria del 1% o menor. Estas condiciones presuponen un cardiólogo capaz de cuantificar la IM y evaluar al paciente críticamente, un cirujano con experiencia adecuada en reparación mitral, y un equipo post-quirúrgico experimentado en el manejo de complicaciones posoperatorias. La estimación de la severidad de la IM debe incluir los métodos cuantitativos mencionados y los indicadores específicos o de soporte existentes (Tabla 2)23. La evaluación global del grado de regurgitación mitral se puede realizar por eco Doppler cuantitativo. El método más ampliamente utilizado de cuantificación de la regurgitación mitral es el método PISA, sobre la base del análisis de la zona de convergencia proximal del área del ORE24,25. Ambos métodos permiten el cálculo del VolR y del ORE26,27.
Sin embargo, nosotros consideramos estas dos vertientes no mutuamente excluyentes, sino complementarias y representativas del continuo de la severidad relativa y el riesgo de la IM severa. Las guías y ecomendaciones expertas no son leyes aplicables a todos los pacientes con IM severa, porque no todos los pacientes con IM severa son iguales. En la Mayo Clinic se estudiaron prospectivamente 456 pacientes asintomáticos con IM orgánica (198 pacientes con IM severa), edad promedio de 63 años, VolR promedio de 66 ml/latido, ORE promedio de 0,4 cm2. En pacientes con IM severa, el DFS promedio del VI fue de 37 mm y el diastólico de 61 mm28. Encontramos que un ORE>0,4 cm2 en pacientes asintomáticos está independientemente asociado a una menor sobrevida en 5 años (58% versus 78%, p=0,03) y la reparación quirúrgica asociada a mejor sobrevida; por lo tanto, recomendamos considerar la cirugía temprana en pacientes asintomáticos con IM severa. La incidencia de eventos clínicos en estos pacientes fue del 10-15% por año. Por el contrario, Rosenhek y col. evaluaron prospectivamente 132 pacientes asintomáticos con IM orgánica severa y encontraron que la sobrevida en 8 años era igual que en la población general cuando se “esperaba atentamente” a la aparición de síntomas o indicadores ecocardiograficos y concluyeron que esta estrategia era apropriada29. Sin embargo, la edad promedio de estos pacientes fue de 55 años, DFS del VI promedio de 34 mm y el diastólico de 56 mm (IM severa), la IM no fue cuantificada con Doppler cuantitativo o PISA, y la incidencia de eventos clínicos totales fue mucho menor que en el estudio anterior. De tal manera que en este último estudio, los pacientes portadores de IM padecían probablemente una IM moderada a severa o “levemente severa” y nuestro estudio incluyó pacientes con IM con mayor severidad. Además, la edad de los pacientes era distinta. En todos los estudios, la edad es un factor determinante para el pronóstico y desarrollo de complicaciones. Un tercer grupo de investigadores, Kang et al30, estudió recientemente 447 pacientes consecutivos con IM orgánica severa, edad promedio de 50 años, con orificio regurgitante efectivo promedio de 0,8 cm2, tratados con “reparación mitral temprana” o “espera atenta”. Se constituyó un subgrupo de “propensity matching” de 127 pares de pacientes para controlar las características clínicas de base, donde un alto porcentaje (44-46%) tenían ruptura cordal, DFS del VI promedio de 36 mm y diastólico de 59 mm. La cirugía temprana electiva con reparación estuvo asociada con una mortalidad del 0% en 7 años versus el 5% en 7 años para “espera atenta”. Este tercer estudio se asemeja al nuestro en los rasgos ecocardiográficos de severidad y grado de dilatación del VI, aunque los pacientes son más jóvenes. De tal manera, que ningún estudio es incorrecto, simplemente incluyen pacientes con distintos grados de IM severa.
No todas las IM orgánicas severas son iguales:
factores de riesgo
Derivándose de la discusión previa, existen diferentes grados y factores de riesgo dentro de la IM severa (Tabla 3). El primero de ellos es la edad. Los estudios coinciden en que pacientes mayores de 55-60 años tienen mayor riesgo de complicaciones, esto probablemente debido a la disminución de reserva sistólica y diastólica asociada con la edad. Sin embargo, establecer un punto de corte de edad por encima del cual el riesgo aumenta significativamente es muy difícil. Basado en la discusión anterior, la presencia de ruptura cordal y/o IM torrencial (VolR>100cc y ORE>0,5 cm2) es un factor de riesgo dentro del espectro de IM severa. La aparición de FA ocurre en un 5% por año en pacientes con IM orgánica significativa y su aparición se asocia a disminución de la sobrevida31. Inclusive después de reparar la válvula, la presencia de FA previo a la reparación se asocia a disminución leve de sobrevida en 5 años, comparado con un ritmo sinusal pre-reparación (87% versus 96%, p=0,002)32. Otro factor de riesgo es la elevación del péptido natriurético cerebral (BNP) que fue estudiado prospectivamente en 124 pacientes con IM orgánica y su elevación se relaciona a las consecuencias de la regurgitación (ej. volumen del VI y de la AI, FA y síntomas) y es un indicador independientemente predictivo de mortalidad y de falla cardíaca, sin importar la presencia de síntomas33. La observación de hipertensión pulmonar por ecocardiografía constituye otro factor de riesgo predictivo de peor pronóstico10.
Finalmente, el reconocimiento de síntomas por parte del paciente puede estar contaminado por diferentes grados de percepción idiosincrásicos, por temor a la cirugía y en pacientes que hacen mínima actividad física o acomodan su actividad física a las restricciones impuestas por síntomas leves. En 134 pacientes con IM orgánica severa y FE normal, auto-clasificados como asintomáticos, nosotros encontramos que uno de cada 4-5 de ellos tenía una reducción significativa del consumo pico de oxígeno (<85% de la predicción para edad y sexo) con evidencia de limitación del gasto cardíaco en ejercicio y baja capacidad funcional. Estos pacientes “asintomáticos” resultaron tener mayor número de eventos adversos o cirugía en 3 años de seguimiento34. De tal manera que resulta crítico evaluar con prueba de esfuerzo a pacientes con cualquier grado de incertidumbre en cuanto a la presencia de síntomas. Estos factores de riesgo deben ser tomados en cuenta a la hora de decidir el momento quirúrgico idóneo para cada paciente.
Manejo contemporáneo de la IM severa
La Figura 2 es un algoritmo sencillo que intenta resumir la complejidad del manejo de la IM severa en nuestra era. Cuando el paciente con IM es referido, se debe determinar la etiología/mecanismo de la regurgitación. Existen 3 mecanismos fundamentales basados en la movilidad de las valvas (Figura 3). El primero consiste en una movilidad normal y mal coaptación debida a dilatación del anillo o perforación de una valva. El segundo posee exceso de movilidad (prolapso o ruptura cordal) y el tercero disminución de la movilidad (retracción debido a proceso inflamatorio o enfermedad isquémica [“tethering”]) (Figura 3).

Figura 2. Algoritmo del manejo de la insuficiencia mitral severa.
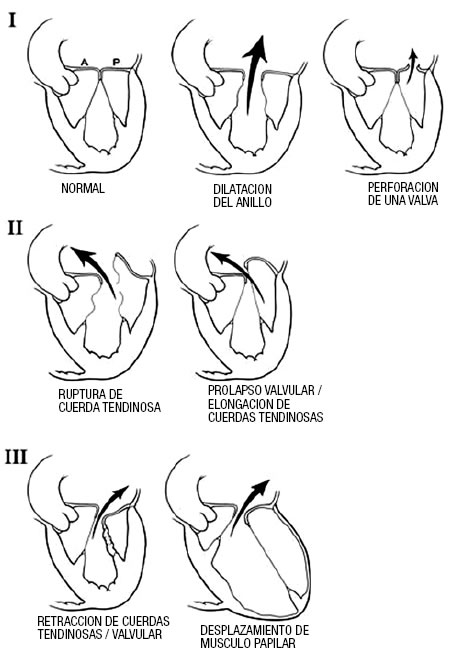
Figura 3. I. Movilidad normal con dilatación del anillo causando un jet central o perforación de una valva. II. Movilidad excesiva con ruptura cordal o prolapso severo causando un jet dirigido al lado opuesto de la valva afectada. III. Movilidad restringida debido a retracción del aparato cordal (IIIa, e.j enfermedad reumática) o desplazamiento del músculo papilar (remodelado isquémico) causando “tethering” de la valva (IIIb). Nótese que el jet está dirigido al mismo lado de la valva afectada. Figuras con permiso de la Mayo Clinic.
La IM orgánica pertenece al segundo mecanismo y la funcional al primero y tercero. La IM mediada por el segundo mecanismo es la más susceptible a la reparación, especialmente, cuando la valva posterior está involucrada y el anillo no presenta calcificación severa. Sin embargo, la reparación de la enfermedad de Barlow severa con prolapso bi-valvar extenso o prolapso aislado de la valva anterior son actualmente tan reparables como el prolapso aislado de la valva posterior. De tal manera que la gran mayoría de los casos de prolapso mitral son reparables20. Una vez establecido el mecanismo orgánico, se debe confirmar que la IM es definitivamente severa (Tabla 2). Si existen síntomas o FE<60% o DFS del VI>40 mm, se debe referir al paciente para cirugía de rescate (Figura 2), ya que existe una disfunción ventricular manifiesta y su pronóstico ya está afectado, debiéndose procurar reparar la válvula o reemplazarla si la reparación no es posible. Aunque la cirugía (reparación o reemplazo) en estos pacientes produce una mejoría sintomática, se asocia con un aumento del riesgo posoperatorio7,12, especialmente, si existe falla cardíaca congestiva o disminución importante de la FE, pero el pronóstico post-quirúrgico sigue siendo mucho mejor que en aquellos pacientes abandonados a tratamiento médico5. Una notable excepción es el paciente con IM severa, FE<20-30% sin posibilidad de reparar la válvula, donde el riesgo quirúrgico con reemplazo puede ser prohibitivo.
En ausencia de una disfunción ventricular manifiesta, se procede a estratificar el riesgo del paciente, investigando la presencia de factores de riesgo (Figura 2). Si existen factores de riesgo mayores para disfunción del VI (Tabla 3), se debe reparar la válvula tempranamente, no sin antes considerar factores intrínsecos del paciente y factores inherentes a la cirugía: si el paciente tiene buena expectativa de vida (ausencia de comorbilidades severas) y la válvula es reparable en un centro que garantiza alto porcentaje de éxito y baja mortalidad operatoria, se debe reparar la válvula para devolver al paciente su expectativa de vida normal (Figura 2). Debiéndose derivar al paciente a un centro especializado si es necesario. Si estas pre-condiciones no existen, se debe “esperar atentamente” (seguimiento por un cardiólogo con ecocardiograma cada 6 meses) a la aparición de signos ecocardiográficos y/o síntomas que indiquen necesidad de rescate con reparación o reemplazo. Si existen factores de riesgo menores, nosotros recomendamos la reparación temprana dado que existe riesgo de progresión a corto plazo; sin embargo, la “espera atenta” puede considerarse cautelosamente. Si no existen factores de riesgo, la “espera atenta” es recomendada y es segura.
IM isquémica: un grupo de alto riesgo
El alto riesgo asociado con la ruptura isquémica de un músculo papilar es bien conocido12 y requiere cirugía inmediata. Cabe mencionar que la mortalidad quirúrgica para la ruptura de músculo papilar ha disminuido considerablemente, siendo del 67% hasta 1990 y del 9% después de 1990, reflejando el alto uso de revascularización y avances quirúrgicos35.
Además, la sobrevida a cinco años en pacientes que sobreviven a la ruptura inicial es idéntica a pacientes con infarto sin ruptura papilar, lo cual resalta la importancia de un diagnóstico expedito y tratamiento quirúrgico agresivo en esta condición.
Después de un infarto de miocardio, la IM se puede desarrollar sin ruptura del músculo papilar, esto como consecuencia del remodelado ventricular izquierdo, debido al desplazamiento apical e inferior de los músculos papilares (Figura 3-IIIb), que jalan a las valvas mitrales (“tethering”), causando “tenting” de éstas con la resultante mal coaptación e IM. El fuerte impacto negativo de esta IM “funcional”- isquémica posterior al infarto de miocardio ha sido demostrado en 2 estudios donde se asocia la sola presencia de IM isquémica (aunque sea leve) con pobre sobrevida36,37. En pacientes con infarto previo, IM con un ORE≥0,2 cm2 se asocia con una sobrevida del 30% en 5 años, comparado con un 60% sin IM37. Por ello, nosotros consideramos un ORE>0,2 cm2 o VolR>30 cc en IM isquémica como IM severa (Figura 2). El valor de la ecocardiografía en pacientes con cardiopatía isquémica es crítico ya que la intensidad del soplo de la IM isquémica no se relaciona con su severidad38.
El momento quirúrgico en la IM isquémica es más complicado que en la IM orgánica. A pesar de que la reparación es a menudo posible, el riesgo de la cirugía es mayor que en la IM orgánica. Además, aunque existe mejoría sintomática con la corrección quirúrgica de la IM dilatada e isquémica (usualmente con anuloplastia)39, la existencia de beneficio real en la sobrevida a largo plazo de estos pacientes con corrección de la IM no ha sido comprobada, de tal manera que un estudio randomizado es necesario y todavía no existe. La pregunta de si la IM isquémica causa mal pronóstico per se o si simplemente es un marcador de la severidad de la cardiopatía isquémica que no ha sido aclarada40.
De igual manera, la anuloplastia con anillo mitral prostético puede resultar en estenosis mitral41 y no corrige el problema básico de desplazamiento del músculo papilar que resulta en “tethering” de las valvas. Por esto, la reducción de la IM con anuloplastia mitral en IM isquémica no es duradera y nuevas técnicas para la reparación mitral están siendo estudiadas. El concepto de reposicionar los músculos papilares parece prometedor y está en desarrollo42. Sin embargo, parece que cuando las valvas mitrales son sometidas a tensión, debido a “tethering”, se reactivan procesos embriogénicos que resultan en activación celular, transformación de células endoteliales en intersticiales, resultando en deposición de matrix nueva. Todo esto resulta en aumento del área valvular y engrosamiento de cuerdas tendinosas que puede resultar en aumento del área de coaptación de la válvula43. Este es un descubrimiento importante que promete posibilidades terapéuticas para la IM secundaria desde el punto de vista celular. Además, la extensión quirúrgica de la valva posterior utilizando pericardio bovino, aumenta el área de coaptación y promete ser también una posibilidad terapéutica con beneficio a corto y mediano plazo44.
En la cardiopatía dilatada, es ahora posible predecir con mayor exactitud la posibilidad de reparación, observando la movilidad del aspecto distal de la valva anterior. Si esta movilidad se conserva, la coaptación tiende a mantenerse aunque la valva posterior esté inmovilizada después de la reparación45. La movilidad distal de la valva anterior se puede predecir con un parámetro simple de medir en el ecocardiograma pre-operatorio45.
De tal manera, que se está avanzando hacia una mejor reparación de la IM funcional que aparenta ser más compleja y específica para cada paciente.
En nuestra era, cuando la cirugía de revascularización miocárdica se considera necesaria y la IM está presente, los datos recientes sugieren que en los pacientes con un área del orificio regurgitante efectivo >20 mm2 debe ofrecerse reparación (preferible) o reemplazo mitral (Figura 2). Cuando la cirugía de revascularización miocárdica se considera no indispensable pero posible, la presencia de miocardio viable e IM con ORE>20 mm2 debe llevar a la cirugía mitral combinada con revascularización, especialmente si existen síntomas de insuficiencia cardíaca. Cuando la revascularización esta planeada y existe IM isquémica de menor grado (ORE<0,2 cm2), se debe considerar su concomitante corrección con reparación (Figura 2).
Cuando la cirugía de revascularización no es posible o no está indicada y existe IM isquémica con ORE>0,2cm2, la indicación de cirugía mitral es más restrictiva y se debe considerar únicamente reparación, exclusivamente en pacientes con síntomas CF III-IV según la NYHA, a pesar de tratamiento médico óptimo, incluyendo resincronización.
Alternativamente, el trasplante cardíaco (Figura 5) puede considerarse en pacientes apropiados y puede ofrecer resultados óptimos.
Abordajes percutáneos para la IM
La anuloplastia mitral percutánea basada en la instalación de un dispositivo en el seno coronario está en estudio. A pesar de que el seno coronario está anatómicamente situado en un plano superior al anillo mitral, y de la posibilidad real de comprometer el flujo de la arteria coronaria circunfleja, se ha demostrado en 48 pacientes con cardiopatía dilatada que su uso es seguro en un número seleccionado de pacientes, resultando en un aumento de la capacidad funcional luego de la implantación de este dispositivo (CARRILON)46 con disminución de la severidad de la IM.
Otro abordaje percutáneo para la IM orgánica o funcional que se origina en el área de A2 y P2 utiliza el E-valve mitra-clip basado en la sutura de Alfieri. Este clip crea una válvula mitral con doble orificio y se ha estudiado en 107 pacientes con un éxito del 74% del procedimiento y del 66% de pacientes libres de muerte, de cirugía mitral y con IM<2+ en 12 meses47. Estos abordajes probablemente no constituirán el tratamiento por excelencia de la IM, pero prometen ser posibilidades terapéuticas reales para pacientes específicos.
Conclusiones
La alta prevalencia de insuficiencia mitral en la población y su progresión con deterioro de la función del ventrículo izquierdo debido al remodelado reverso, pone de manifiesto el grave pronóstico que acarrea esta enfermedad en los pacientes que no reciben tratamiento adecuado.
La detección de la disfunción subclínica del VI a través de parámetros ecocardiográficos (FE y DFS) nos debe llevar a considerar la cirugía mitral de rescate inmediata. De igual manera, la detección de síntomas, así sean mínimos, debe llevar a cirugía de rescate. Los pacientes con síntomas dudosos o sintomatología incierta deben ser evaluados con prueba de esfuerzo para determinar su capacidad funcional.
No todas las IM orgánicas severas son iguales. La presencia de factores de riesgo en la IM severa aumenta la probabilidad de deterioro de la función cardíaca, de aparición de síntomas y de peor pronóstico a largo plazo, por ello es necesario considerar en la evaluación a cada paciente en forma individual y considerar los mismos al momento de decidir el tratamiento. En ausencia de síntomas en pacientes con IM severa sin disfunción cardíaca, la presencia de factores de riesgo debe estimular la cirugía temprana con reparación, si el riesgo quirúrgico es bajo y la posibilidad de reparo es >90-95%. Se debe referir al paciente a un centro especializado si es necesario. El entrenamiento adecuado de cirujanos en la reparación mitral es crítico, si queremos devolver a los pacientes con IM severa orgánica su sobrevida normal. Una colaboración nacional e internacional para este adiestramiento es ineludible.
La IM isquémica acarrea un peor pronóstico, con mayor riesgo quirúrgico, y las decisiones en tratamiento deben ser específicas para cada paciente, tomando en cuenta la posibilidad de reparación, riesgo quirúrgico, y la necesidad de revascularización quirúrgica concomitante.
Nuevos procedimientos percutáneos están en estudio y prometen potencial utilidad para ciertos pacientes selectos.
1. Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet 2006;368:1005-11. 2. Enriquez-Sarano M, Basmadjian A, Rossi A, et al. Progression of mitral regurgitation: a prospective Doppler echocardiographic study. J Am Coll Cardiol 1999;34:1137-44. [ Links ] [ Links ]
3. Delahaye J, Gare J, Viguier E, et al. Natural history of severe mitral regurgitation. Eur Heart J 1991;12(suppl B):5-9. [ Links ]
4. Horstkotte D, Loogen F, Kleikamp G, et al. Effect of prosthetic heart valve replacement on the natural course of isolated mitral and aortic as well as multivalvular diseases. Clinical results in 783 patients up to 8 years following implantation of the Björk- Shiley tilting disc prosthesis. Z Kardiol 1983;72:494-503. [ Links ]
5. Ling H, Enriquez-Sarano M, Seward J, et al. Clinical outcome of mitral regurgitation due to flail leaflets. N Engl J Med 1996;335:1417-23. [ Links ]
6. Grigioni F, Enriquez-Sarano M, Ling L, et al. Sudden death in mitral regurgitation due to flail leaflet. J Am Coll Cardiol 1999;34:2078-85. [ Links ]
7. Enriquez-Sarano M, Tajik A, Schaff H, et al. Echocardiographic prediction of survival after surgical correction of organic mitral regurgitation. Circulation 1994;90:830-7. [ Links ]
8. Crawford M, Souchek J, Oprian C, et al. Determinants of survival and left ventricular performance after mitral valve replacement. Circulation 1990;81:1173-81. [ Links ]
9. Enriquez-Sarano M, Schaff H, Orszulak T, et al. Congestive heart failure after surgical correction of mitral regurgitation. A long-term study. Circulation 1995;92:2496-503. [ Links ]
10. Bonow RO, Carabello BA, Chatterjje K et al. 2008 Focused Update Incorporated Into the ACC/AHA 2006 Guidelines for the Management of Patients With Valvular Heart Disease: A Report of the American College of Cradiology/ American Heart Association Task Force on Practice Guidlines (Written Committe to Revise the 1998 Guidelines for the Managment of Patients With Valvular Heart Disease) Endorsed by the Society of cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons. J Am Coll Cardiol 2008;52:e1-e142. [ Links ]
11. Leung D, Griffin B, Stewart W, et al. Left ventricular function after valve repair for chronic mitral regurgitation: predictive value of preoperative assessment of contractile reserve by exercise echocardiography. J Am Coll Cardiol 1996;28:1198-205. [ Links ]
12. Cohn L, Couper G, Kinchla N, et al. Decreased operative risk of surgical treatment of mitral regurgitation with or without coronary artery disease. J Am Coll Cardiol 1990;16:1575-8. [ Links ]
13. Detaint D, Sundt TM, Nkomo VT, et al. Surgical correction of mitral regurgitation in the elderly: outcomes and recent improvements. Circulation 2006;114:265-72. [ Links ]
14. Cohn L, Kowalker W, Bhatia S, et al. Comparative morbidity of mitral valve repair versus replacement for mitral regurgitation with and without coronary artery disease. Ann Thorac Surg 1988;45:284-90. [ Links ]
15. Sand M, Naftel D, Blackstone E, et al. A comparison of repair and replacement for mitral valve incompetence. J Thorac Cardiovasc Surg 1987;94:208-19. [ Links ]
16. Gammie JS, O'Brien SM, Griffith BP, et al. Influence of hospital procedural volume on care process and mortality for patients undergoing elective surgery for mitral regurgitation. Circulation 2007;115:881-7. [ Links ]
17. Freeman W, Schaff H, Khanderia B, et al. Intraoperative evaluation of mitral valve regurgitation and repair by transesophageal echocardiography: incidence and significance of systolic anterior motion. J Am Coll Cardiol 1992;20:599-609. [ Links ]
18. Cosgrove D, Chavez A, Lytle B, et al. Results of mitral valve reconstruction. Circulation 1986;74:I-82-7. [ Links ]
19. Frater R, Gabbay S, Shore D, et al. Reproducible replacement of elongated or ruptured mitral valve chordae. Ann Thorac Surg 1983;35:14-28. [ Links ]
20. Lessana A, Escorsin M, Romano M, et al. Transposition of posterior leaflet for treatment of ruptured main chordae of the anterior mitral leaflet. J Thorac Cardiovasc Surg 1985;89:804-6. [ Links ]
21. Gillinov A, Cosgrove D, Blackstone E, et al. Durability of mitral valve repair for degenerative disease. J Thorac Cardiovasc Surg 1998;116:734-43. [ Links ]
22. Yau TM, Farag EL, Ghoneimi YA, et al. Mitral valve repair and replacement for rheumatic disease. J Thorac Cardiovasc Surg 2000; 119: 53-61. [ Links ]
23. Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003;16(7):777-802. [ Links ]
24. Enriquez-Sarano M, Miller FJ, Hayes S, et al. Effective mitral regurgitant orifice area: clinical use and pitfalls of the proximal isovelocity surface area method. J Am Coll Cardiol 1995;25:703-9. [ Links ]
25. Vandervoort P, Rivera J, Mele D, et al. Application of color Doppler flow mapping to calculate effective regurgitant orifice area. An in vitro study and initial clinical observations. Circulation 1993;88:1150-6. [ Links ]
26. Enriquez-Sarano M, Bailey K, Seward J, et al. Quantitative Doppler assessment of valvular regurgitation. Circulation 1993;87:841-8. [ Links ]
27. Enriquez-Sarano M, Seward J, Bailey K, et al. Effective regurgitant orifice area: a noninvasive Doppler development of an old hemodynamic concept. J Am Coll Cardiol 1994;23:443-51. [ Links ]
28. Enriquez-Sarano M, Avierinos JF, Messika-Zeitoun D, et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med 2005;352:875-83. [ Links ]
29. Rosenhek R, Rader F, Klaar U, Gabriel H, Krejc M, Kalbeck D, et al. Outcome of watchful waiting in asymptomatic severe mitral regurgitation. Circulation 2006;113:2238-44. [ Links ]
30. Kang HD, Kim JH, Rim JH, et al. Comparison of Early Surgery Versus Conventional Treatment in Asymptomatic Severe Mitral Regurgitation. Circulation 2009;119: 797-804. [ Links ]
31. Grigioni F, Avierinos JF, Ling LH, et al. Atrial fibrillation complicating the course of degenerative mitral regurgitation: determinants and long-term outcome. J Am Coll Cardiol 2002;40:84-92. [ Links ]
32. Eguchi K, Ohtaki E, Matsumura T, et al. Pre-operative atrial fibrillation as the key determinant of outcome of mitral valve repair for degenerative mitral regurgitation. Eur Heart J 2005;26:1866-72. [ Links ]
33. Detaint D, Messika-Zeitoun D, Avierinos JF, et al. B-type natriuretic peptide in organic mitral regurgitation: determinants and impact on outcome. Circulation 2005;111:2391-7. [ Links ]
34. Messika-Zeitoun D, Johnson BD, Nkomo V, et al. Cardiopulmonary exercise testing determination of functional capacity in mitral regurgitation: physiologic and outcome implications. J Am Coll Cardiol 2006;47:2521-7. [ Links ]
35. Russo A, Suri RM, Grigioni F, et al. Clinical Outcomes After Surgical Correction of Mitral Regurgitation Due To Papillary Muscle Rupture. Circulation 2008;118:1528-1534. [ Links ]
36. Lamas G, Mitchell G, Flaker G, et al. Clinical significance of mitral regurgitation after acute myocardial infarction. Circulation 1997;96:827-33. [ Links ]
37. Grigioni F, Enriquez-Sarano M, Zehr K, et al. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation 2001;103:1759-64. [ Links ]
38. Desjardins V, Enriquez-Sarano M, Tajik A, et al. Intensity of murmurs correlates with severity of valvular regurgitation. Am J Med 1996;100:149-56. [ Links ]
39. Bolling SF, Pagani FD, Deeb GM, et al. Intermediate-term outcome of mitral reconstruction in cardiomyopathy. J Thorac Cardiovasc Surg 1998;115:381-6; discussion 387-8. [ Links ]
40. Wu AH, Aaronson KD, Bolling SF, et al. Impact of mitral valve annuloplasty on mortality risk in patients with mitral regurgitation and left ventricular systolic dysfunction. J Am Coll Cardiol 2005;45:381-7. [ Links ]
41. Magne J, Senecal M, Mathieu P, Dumesnil JG, Dagenais F, Pibarot P. Restrictive annuloplasty for ischemic mitral regurgitation may induce functional mitral stenosis. J Am Coll Cardiol 2008;51:1692-701. [ Links ]
42. Hung J, Chaput M, Guerrero JL, et al. Persistent reduction of ischemic mitral regurgitation by papillary muscle repositioning: structural stabilization of the papillary muscle-ventricular wall complex. Circulation 2007;116(11 Suppl):I259-63. [ Links ]
43. Dal Bianco JP, Aikawa E, Bischoff J, et al. Active Adaptation of the Tethered Mitral Valve. Insights Into a Compensatory Mechanism for Functional Mitral Regurgitation. Circulation 2009;120: 334-342. [ Links ]
44. De Varennes B, Chaturvedi R, Sidhu S, et al. Initial Results of Posterior Leaflet Extension for Severe Type IIIb Ischemic Mitral Regurgitation. Circulation 2009; 119: 2837-2843. [ Links ]
45. Wai Lee AP, Acker M, Kubo SH, et al. Mechanisms of Recurrent Functional Mitral Regurgitation After Mitral Valve Repair in Nonischemic Dilated Cardiomyopathy. Circulation 2009;119:2606-2614. [ Links ]
46. Schofer J, Siminiak T, Haude M, et al. Percutaneous Mitral Annuloplasty for Functional Mitral Regurgitation. Results of the CARRILLON Mitral Annuloplasty Device European Union Study. Circulation 2009;120:326-333. [ Links ]
47. Feldman T, Kar S, Rinaldi M, et al. Percutaneous Mitral Repair With The MitraClip System. Safety and Midterm Durability in the Initial EVEREST (Endovascular Valve Edge- to- Edge Repair Study) Cohort. J Am Coll Cardiol 2009; 54:686-94. [ Links ]

















