Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. v.4 n.4 Ciudad Autónoma de Buenos Aires oct./dic. 2009
IV WEEKEND DE INSUFICIENCIA CARDÍACA E HIPERTENSIÓN PULMONAR
Inhibidores de la enzima convertidora y antagonistas de los receptores de angiotensina II en la insuficiencia cardíaca crónica#
Marcos J. Alvarez*
# IV Weekend de Insuficiencia Cardíaca e Hipertensión Pulmonar. Ciudad de Mendoza, República Argentina. 28 y 29 de Noviembre de 2008.
* Médico Cardiólogo. Coordinador del Equipo de Trasplante Cardíaco y Sub-Jefe de Unidad Coronaria. Clínica Privada Vélez Sarsfield. Córdoba, República Argentina.
Correspondencia: Dr. Marcos J. Alvarez.
Servicio de Cardiología. Clínica Privada Vélez Sarsfield.
Naciones Unidas 984. CP: X5016KET. Ciudad de Córdoba. República Argentina.
E-mail: marcosalvarezz@hotmail.com
Recibido: 17/02/2009
Aceptado: 25/05/2009
Palabras clave: Insuficiencia cardíaca crónica; Inhibidores de la enzima convertidora; Antagonistas de los receptores de angiotensina; Remodelado ventricular
Introducción
Se presentan grandes desafíos en el tratamiento de la insuficiencia cardíaca crónica (ICC), un síndrome que presenta una incidencia en sostenido aumento: es la primera causa de internación en Estados Unidos en pacientes mayores de 65 años, con 660.000 casos diagnosticados al año1. Algunos de estos desafíos son mejorar la calidad de vida, disminuir la progresión de la enfermedad y aumentar la sobrevida, para ello contamos con recursos como: medidas higiénico-dietéticas, rehabilitación, farmacoterapia, dispositivos como desfibriladores y resincronizadores, hasta el trasplante cardíaco. Un pilar fundamental en todo este arsenal terapéutico son los fármacos y dentro de este grupo, uno de los primeros con los que se logró mejorar la sobrevida fueron los inhibidores de la enzima convertidora de la angiotensina (IECA).
Los registros OPTIMIZE HF1 de pacientes internados e IMPROVE HF2 de pacientes ambulatorios (con más de 40.000 pacientes reclutados cada uno), diseñados para evaluar la adherencia del médico a las guías clínicas de medicina basada en la evidencia, mostraron que sólo el 27% de los pacientes contaban con tratamiento médico óptimo. Al realizar el análisis de cada droga por separado, aproximadamente el 80% de los pacientes elegibles recibía tratamiento con IECA/ARA (antagonistas de los receptores de la angiotensina).
Según estos registros, los IECA/ARA tienen buena adherencia a ser prescriptos; sin embargo, hay un 20% de pacientes elegibles que no los recibe, a pesar de ser los fármacos con la mayor experiencia y estudios clínicos avalados para su uso en la ICC.
Fisiopatogenia de la insuficiencia cardíaca
Al producirse una lesión miocárdica (lesión primaria) se conduce a una caída del volumen minuto, a una disminución de la perfusión tisular y a un aumento del trabajo miocárdico, estos eventos activan los mecanismos de compensación: la regulación heterométrica de Frank-Starling y la activación neurohumoral (el sistema nervioso autónomo simpático, la activación del eje renina-angiotensina-aldosterona, el péptido natriurético cerebral, el aumento de la hormona antidiurética, etc.). Estos mecanismos de compensación llevan al remodelado ventricular: la hipertrofia y/o dilatación.
En estadios tardíos del remodelado miocárdico, hay una marcada alteración de la homeostasia del calcio intracelular. La descompensación está asociada al adelgazamiento de la pared ventricular por proteolisis y muerte de miocitos (lesión secundaria), de esta forma se cierra un círculo vicioso también conocido como el continuo miocárdico3 (Figura 1).
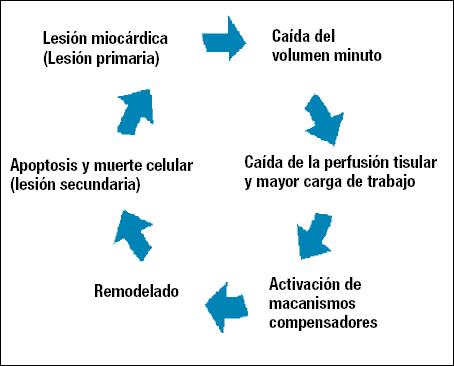
Figura 1. Esquema de la fisiopatogenia de la insuficiencia cardíaca
crónica.
De acuerdo al tipo o predominio de sobrecarga, de presión o de volumen, se activan señales intra y extracelulares que generan, respectivamente, un aumento de los sarcómeros en paralelo o en serie (Figura 2). En la hipertrofia concéntrica es muy marcado el aumento del grosor de la pared, no así en la hipertrofia excéntrica, donde hay un pequeño aumento del grosor parietal, sólo para contrarrestar el aumento del radio ventricular. Se altera la geometría ventricular y el grosor de su pared, con el fin de mantener sin cambios significativos el estrés parietal.

Figura 2. Esquema de los tipos de remodelado ventricular con sus
respectivos cambios ultraestructurales.
La sobrecarga por medio de fenómenos neurohumorales o por estrés mecánico directo a través de receptores de estiramiento e integrinas que relacionan la matriz extracelular con el citoesqueleto, activa diversos genes que codifican factores tróficos, presentes en la etapa embrionaria, pero latentes en el adulto4. Dando como resultado:
1- Aumento de miofibrillas y mitocondrias.
2- Núcleos de mayor tamaño y más lobulados.
3- Desorganización de las miofibrillas, pérdida del paralelismo, marcada alteración de las bandas Z.
El eje renina-angiotensina-aldosterona
El eje comienza con la síntesis de angiotensinógeno en el hígado (Figura 3), es una alfa-2 globulina, considerada un reactante de fase aguda. El angiotensinógeno se transforma en angiotensina I, reacción catalizada por la renina, una aspartil-proteasa sintetizada en el aparato yuxtaglomerular renal en la arteriola aferente (también en las glándulas suprarrenales y el miocardio).

Figura 3. Esquema del eje renina-angiotensina-aldosterona.
La liberación de renina es inducida por efecto ß1 adrenérgico, prostaglandinas, IECA, hipotensión (barorreceptores renales) e hiponatremia detectada en la mácula densa; y es inhibida por adenosina, angiotensina II (retroalimentación) y el péptido natriurético cerebral (BNP).
La angiotensina I, sin efectos biológicos significativos, es transformada principalmente por la enzima convertidora (ECA) en angiotensina II (80%), pero esta reacción también se puede producir por medio de otras proteasas (20%), por ejemplo: la quimasa. Estos dos caminos posibles para la síntesis de angiotensina II marcan un beneficio teórico de los ARA sobre los IECA en el tratamiento de pacientes con ICC, ya que éstos bloquean directamente el receptor, en cambio los IECA sólo bloquean una de las vías de síntesis, dejando libre la vía de las otras proteasas.
La ECA es una cinc-metalopeptidasa ubicada en la membrana celular de endotelios y neuroepitelios (sólo el 1% es circulante), que además de participar en la formación de angiotensina II, también degrada bradiquininas. La inhibición de la ECA aumenta los niveles plasmáticos de bradiquininas, un potente vasodilatador dependiente del endotelio. Además, este aumento de bradiquininas favorece la transformación de fosfolípidos en ácido araquidónico y prostaglandinas, también reductores de la resistencia vascular periférica. Por este aumento de bradiquininas y prostaglandinas los IECA imprimen una diferencia con los ARA en el tratamiento de la ICC.
La angiotensina II, molécula con mayor actividad biológica, actúa por medio de dos receptores asociados a proteína G: el AT1 y el AT2. Normalmente, la relación AT1/AT2 es 1:2, pero ésta se altera en la insuficiencia cardíaca.
El estímulo del receptor AT1 genera incremento del calcio intracelular, con efecto vasoconstrictor y cardiotóxico directo, también produce el aumento de los niveles plasmáticos de noradrenalina, aldosterona y hormona antidiurética, generando hipertensión arterial y sed. A su vez, el receptor AT2 genera aumento del óxido nítrico, con efecto antiproliferativo y vasodilatador. Los ARA actúan bloqueando los receptores AT1, permitiendo que la angiotensina II estimule a los recetores AT2.
La aldosterona, el último eslabón del eje, se libera por estímulo de la angiotensina II en la zona glomerular de la corteza suprarrenal. Su efecto agudo a nivel renal es retener sodio y eliminar potasio en el túbulo distal y colector, y el efecto crónico es el deposito de colágeno en riñón, miocardio y en la pared vascular. La síntesis y liberación de aldosterona es también estimulada por la hormona adrenocorticotrofina, la noradrenalina, la hormona antidiurética y la acetilcolina, por eso los IECA y ARA producen sólo un bloqueo transitorio en la síntesis de aldosterona en el tratamiento crónico5.
Tratamiento con IECA en insuficiencia cardíaca
Los IECA fueron los primeros en mejorar la historia natural de la insuficiencia cardíaca crónica, no sólo por el efecto vasodilatador; sino también, por la prevención del remodelado ventricular. En el estudio V-HeFT II que comparó enalapril con hidralazina más dinitrato de isosorbide, se demostró que los beneficios van más allá del efecto vasodilatador exclusivo, sino que también son por el aumento de bradiquininas que mejoran la función endotelial y generan vasodilatación, natriuresis y aumento de prostaglandinas6. Un estudio demostró que se produce una gran pérdida de los efectos hemodinámicos del captopril cuando se asocia a icatibant, un antagonista especifico de los receptores B2 de bradiquinina7. También se evidenció la pérdida parcial de estos efectos en combinación con ácido acetilsalicílico ya que se bloquea la síntesis de prostaglandinas8.
Los IECA demostraron, en grandes estudios multicéntricos como el SOLVD P, SOLVD T, V-HeFT II y CONSENSUS9-11, ser útiles en todas las etapas del síndrome de insuficiencia cardíaca, desde la clase funcional I a la IV de la tradicional clasificación de la New York Heart Association (NYHA), y desde el estadio B al D de la última clasificación propuesta en el año 2001 por el American College of Cardiology/American Heart Association (ACC/AHA). Incluso está demostrado su beneficio en la prevención primaria (estadio A) en ciertos pacientes: aquellos con alto riesgo de desarrollar insuficiencia cardíaca, con hipertensión arterial o con nefropatía diabética, como se objetivó en los estudios HOPE y micro-HOPE entre otros12,13. También, tienen efectividad en la prevención del remodelado ventricular y en la disminución de la mortalidad post-infarto agudo de miocardio como se vio en los estudios SAVE con captopril, el AIRE con ramipril y el TRACE con trandolapril14-16.
En la evaluación de la dosis óptima para lograr los efectos deseados y evitar las reacciones adversas, se diseñaron los estudios NETWORK y ATLAS. El primero de ellos, el NETWORK, fue un estudio prospectivo doble ciego que comparó enalapril en dosis diarias de 5 mg, 10 mg y 20 mg. El end-point primario fue muerte, hospitalización por insuficiencia cardíaca descompensada y empeoramiento de clase funcional, el seguimiento fue de 24 semanas. Este estudio demostró no haber diferencias significativas en los tres grupos17.
En el estudio ATLAS, se evaluó la seguridad de lisinopril en dosis bajas (2,5 a 5 mg) comparado con dosis altas (32,5 a 35 mg) en la aparición de reacciones adversas, enfocado principalmente en hipotensión arterial e insuficiencia renal aguda. El estudio evidenció que no hubo diferencias significativas entre ambos grupos en cuanto a la aparición de reacciones adversas y hubo una significativa reducción (p=0,002) de la mortalidad y hospitalización por insuficiencia cardíaca en el grupo de dosis altas18. Se debe tener en cuenta que en todos estos estudios se excluyeron los pacientes con hipotensión arterial o con creatinina basal mayor a 2,5 mg/dl.
La guía de insuficiencia cardíaca crónica del ACC/AHA sugiere comenzar con dosis iniciales bajas y aumentarlas paulatinamente hasta dosis óptimas, siempre monitorizando las reacciones adversas19:
- La hipotensión arterial sobre todo al inicio y en pacientes con hiponatremia o hipovolemia.
- La insuficiencia renal aguda. Normalmente tolerado el aumento de la creatinina sérica del 10% al 15%, con un margen de seguridad de hasta un 30%. Un predictor de insuficiencia renal es la hiponatremia, marcador de acentuada activación del eje renina-angiotensina-aldosterona.
- La hiperkalemia sobre todo en diabéticos.
- La tos, por aumento de las bradiquininas, más frecuente en mujeres, fue la principal causa de abandono de tratamiento en todos los estudios, se presenta en el 5% de los pacientes, pero llegó hasta el 30% en un estudio de población China.
- Alteración del gusto con captopril atribuido a un grupo sulfhidrilo presente en la molécula.
- El angioedema, una reacción adversa grave, pero poco frecuente (menos del 1%).
Tratamiento con ARA en insuficiencia cardíaca
Debido a que en el tratamiento crónico con IECA los niveles de angiotensina II aumentan nuevamente a través de vías alternativas, se comenzó a estudiar a los ARA en la insuficiencia cardíaca.
El estudio ELITE I comparó losartán con captopril en pacientes añosos, tuvo como end-point primario la disfunción renal y como end-point secundario la muerte de cualquier causa y las hospitalizaciones o muerte por insuficiencia cardíaca. En este estudio no se encontró diferencias significativas en los valores de creatinina sérica y en hospitalizaciones o muerte por insuficiencia cardíaca. Si evidenció diferencias significativas en la muerte por cualquier causa (p=0,035) a favor del losartán y fue mejor tolerado20.
A partir de estos resultados se diseñó el ELITE II, con la muerte por cualquier causa y la hospitalización por insuficiencia cardíaca como punto final compuesto primario y la muerte súbita como punto final secundario. No se encontró diferencias significativas en el punto final combinado primario (p=0,18) pero, a diferencia del ELITE I, hubo una tendencia no significativa a favor del captopril21.
Luego del ELITE II, se evaluaron a los ARA en pacientes con intolerancia a los IECA: una rama del estudio CHARM reclutó pacientes con fracción de eyección <40% y que no toleraban los IECA (CHARM-Alternative), los asignaron en uno de dos grupos, candesartán o placebo. El candesartán demostró una disminución significativa (p=0,0004) del punto final combinado: la mortalidad por causa cardiovascular y las internaciones por insuficiencia cardíaca descompensada22. Esta reducción se produjo en ambos componentes del punto final primario, pero la mortalidad por causa cardiovascular, por sí sola, mostró una reducción no significativa.
Entre otros tantos estudios, el Val-HeFT con valsartán versus placebo, cuyo objetivo fue el análisis de la estructura y función del ventrículo izquierdo, demostró un remodelado reverso ventricular en los tratados con valsartán, con una disminución del diámetro diastólico (p<0,00001) y un aumento en la fracción de eyección (p<0,00001). En cuanto a la mortalidad por cualquier causa, el valsartán no demostró diferencias significativas (p=0,801) versus placebo23.
Así como los IECA, los ARA también están indicados en la prevención primaria de la insuficiencia cardíaca (estadio A) en ciertos pacientes con riesgo de desarrollar el síndrome: los que presentan enfermedad vascular, hipertensión arterial o diabetes mellitus, demostrando en un reciente estudio que no son inferiores a los IECA en esta indicación24.
De acuerdo a toda esta evidencia, la guía de insuficiencia cardíaca crónica del ACC/AHA, sugiere reservar el uso de ARA a pacientes en estadios B al D que no toleren los IECA.
Asociación de IECA y ARA en insuficiencia cardíaca crónica
Al no demostrar beneficios los ARA sobre los IECA y considerando que estos últimos en forma crónica no disminuyen los niveles de angiotensina II, se comenzó a estudiar la asociación entre ambos.
En un marco teórico, es una buena combinación porque bloquea por completo el eje, ya sea que la angiotensina II se forme a partir de la ECA o por medio de otras proteasas, aumentando además, los niveles de bradiquininas.
En un metaanálisis recientemente publicado que evaluó los principales trials y papers (RESOLVD, CHARM-Added y Val-HeFT entre otros) con esta asociación, mostró una significativa inhibición del remodelado (un verdadero remodelado reverso), comparado con su uso por separado; así como también, evidenció una disminución en las hospitalizaciones, pero mostró una tendencia no significativa en aumentar la mortalidad e incrementar la aparición de reacciones adversas25.
Hacia el futuro del eje renina-angiotensina-aldosterona
A pesar que no es una droga de la familia de los IECA ni los ARA, la investigación en el bloqueo del eje se dirige hacia un inhibidor de la renina, el aliskiren (ALOFT Program), encabezado por el Dr. John McMurray que mostró los primeros resultados en el Congreso de la Sociedad Europea de Cardiología en septiembre de 2007 en Viena, Austria. Si bien todavía no se han evaluado puntos finales "duros" como la mortalidad, demostró que reduce significativamente el BNP y el pro-BNP plasmático, y también la aldosterona urinaria.
Conclusión
Los IECA están indicados en todas las clases funcionales de la insuficiencia cardíaca, desde la disfunción ventricular asintomática hasta la insuficiencia cardíaca severa y avanzada (desde el estadio B al D). Se reservan los ARA a los pacientes quienes no toleran los IECA.
Para un uso racional de la asociación de IECA y ARA, debe ser considerada en pacientes en estadios C y D, donde no hay bloqueo neurohumoral completo con reiteradas internaciones por insuficiencia cardíaca descompensada, siempre con un monitoreo estricto de la función renal y la kalemia19.
1. Fonarow GC, Abraham WT, Albert NM, et al. Influence of a performance-improvement initiative on quality of care for patients hospitalized with heart failure: Results of the organized program to initiate lifesaving treatment in hospitalized patients with heart failure (OPTIMIZE-HF). Arch Intern Med 2007;167:1493-1502. [ Links ]
2. Fonarow GC, Yancy CW, Albert NM, et al. Improving the use of evidence-based heart failure therapies in the outpatient setting: The IMPROVE HF performance registry. Am Heart J 2007;154:12-38. [ Links ]
3. Braunwald E, Zipes DP, Lobby P. Heart disease: A textbook of cardiovascular medicine, 6th ed. Edición en español, editorial Marbán, Madrid 2004;614-651. [ Links ]
4. Hill JA, Olson EN. Cardiac Plasticity. N Engl J Med 2008;358:1370-1380. [ Links ]
5. Bertolasi CA, Barrero C, Gimeno G, Liniado G, Mauro V. Cardiología 2000. Editorial Médica Panamericana, Buenos Aires 2001;3715-3720. [ Links ]
6. Cohn JN, Johnson G, Ziesche S, et al. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991;325:303-310. [ Links ]
7. Gainer JV, Morrow JD, Loveland A, et al. Effect of bradykininreceptor blockade on the response to angiotensin-convertingenzyme inhibitor in normotensive and hypertensive subjects. N Engl J Med 1998;339:1285-1292. [ Links ]
8. Spaulding C, Charbonnier B, Cohen-Solal A, et al. Acute hemodynamic interaction of aspirin and ticlopidine with enalapril: results of a double-blind, randomized comparative trial. Circulation 1998;98:757-765. [ Links ]
9. The SOLVD Investigators. Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992;327:685-691. [ Links ]
10. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991;325:293-302. [ Links ]
11. The CONSENSUS Trial Study Group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987;316:1429-1435. [ Links ]
12. Yusuf S, Phil D, Sleight P, et al. The HOPE Investigators. Effects of an angiotensin converting enzime inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000;342:145-53. [ Links ]
13. HOPE Study Investigators. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: results of the HOPE study and MICRO-HOPE substudy. Lancet 2000;355:253-9. [ Links ]
14. Pfeffer MA, Braunwald E, Moye LA, et al. The SAVE Investigators. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Results of the survival and ventricular enlargement trial. N Engl J Med 1992;327:669-677. [ Links ]
15. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. Lancet 1993;342:821-828. [ Links ]
16. Køber L, Torp-Pedersen C, Carlsen JE, et al. A clinical trial of the angiotensin-converting enzime inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infraccion. N Engl J Med 1995;333:1670-1676. [ Links ]
17. The NETWORK Investigators. Clinical outcome with enalapril in symptomatic chronic heart failure; a dose comparison. Eur Heart J 1998;18:481-489. [ Links ]
18. Packer M, Poole-Wilson P, Armstrong P, et al. The ATLAS Study Group. Comparative effects of low and high doses of the angiotensin-converting enzyme inhibitor, lisinopril, on morbidity and mortality in chronic heart failure. Circulation 1999;100:2312-2318. [ Links ]
19. Hunt SA, Abraham WT, Chin MH, et al. ACC/AHA 2005 Guideline update for the diagnosis and management of chronic heart failure in the adult. Circulation 2005;112:154-235. [ Links ]
20. Pitt B, Segal R, Martinez FA, et al. Randomised trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE). Lancet 1997;349:747-752. [ Links ]
21. Pitt B, Poole-Wilson P, Segal R, et al. Effects of losartan versus captopril on mortality in patients with symptomatic heart failure: Rationale, design, and baseline characteristics of patients in the losartan heart failure survival study-ELITE II. J Card Fail 1999;5:146-154. [ Links ]
22. Granger CB, McMurray JJV, Yusuf S, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensinconverting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003;362:772-776. [ Links ]
23. Wong M, Staszewsky L, Latini R, et al. Valsartan benefits left ventricular structure and function in heart failure: Val-HeFT echocardiographic study. J Am Coll Cardiol 2002;40:970-975. [ Links ]
24. Yusuf S, Teo KK, Pogue J, et al. For the ONTARGET investigators. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med 2008;358:1547-1559. [ Links ]
25. Shibata MC, Tsuyuki RT, Wiebe N. The effects of angiotensinreceptor blockers on mortality and morbidity in heart failure: a systematic review. Int J Clin Pract 2008;62:1397-1402. [ Links ]














