Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.5 no.1 Ciudad Autónoma de Buenos Aires Jan./Mar. 2010
ARTICULO DE ACTUALIZACION
¿Cuál es el rol del sistema neurohormonal en la insuficiencia cardíaca con fracción de eyección preservada?
Enrique Alonso*, Enrique Alonso (h)**
* Jefe del Servicio de Cardiología. Hospital "Ángel C. Padilla". San Miguel de Tucumán. Tucumán. República Argentina.
** Residente del Instituto Tucumán de Enfermedades del Corazón (ITEC). San Miguel de Tucumán. Tucumán. República Argentina.
Correspondencia: Dr. Enrique Alonso
Servicio de Cardiología. Hospital "Ángel C. Padilla".
Alberdi 550 - CP 4000. San Miguel de Tucumán. Tucumán. República Argentina.
E-mail: ealonso2001@arnet.com.ar
Recibido: 01/02/2010
Aceptado: 22/04/2010
Resumen
El rol del sistema neurohormonal (SNH) en la fisiopatología de la insuficiencia cardíaca sistólica (ICS) es trascendental. Sin embargo, su participación en la insuficiencia cardíaca con fracción de eyección preservada (ICFEP) no se encuentra del todo aclarada, ya que los datos aportados provienen de estudios observacionales en pacientes con ICS.
Pequeños estudios han demostrado que el grado de la activación del SNH en la ICFEP es menor que en la ICS.
Modelos experimentales de enfermedad cardíaca hipertensiva demostraron la activa participación del SNH en la progresión de la hipertrofia cardíaca hacia la ICS.
El aumento de los niveles sanguíneos de pro-BNP y BNP reflejan alteraciones estructurales y hemodinámicas en pacientes portadores de ICFEP que facilitan la identificación precoz de anormalidades subclínicas.
El estudio PROBE-HF demostró que pacientes diabéticos tipo II o hipertensos, con dosajes en sangre de pro-BNP> a 125pg/ml identifica a un grupo particular de pacientes que nos induce a solicitar estudios de rutina a los fines de obtener información funcional y estructural de la disfunción ventricular a los efectos de indicar precozmente las medidas terapéuticas pertinentes.
Palabras clave: Insuficiencia cardíaca con fracción de eyección preservada - Sistema nervioso simpático - Sistema neurohormonal - Sistema renina-angiotensina-aldosterona - Péptido natriurético
Summary
What is the role of neurohormonal system in heart failure with preserved ejection fraction?
The role of neurohormonal system (NHS) in the pathophysiology of systolic heart failure (SHF) is transcendental. However, their participation in heart failure with preserved ejection fraction (HFpEF) is not fully clear, since the data is provided from observational studies in patients with SHF.
Small studies have shown that the degree of activation of SNH in the HFpEF is lower than in the SHF.
Experimental models of hypertensive heart disease showed the active involvement of NHS in the progression of cardiac hypertrophy to SHF.
Increased blood levels of pro-BNP and BNP reflect structural and hemodynamic alterations in patients with HFpEF that facilitate early identification of subclinical abnormalities.
The PROBE-HF study showed that type II diabetic or hypertensive patients with blood dosages of pro-BNP > 125pg/ ml identify a particular group of patients which leads us to request routine tests to acquire functional and structural information about ventricular dysfunction, in order to indicate prematurely the appropriate therapeutic measures.
Keywords: Heart failure with preserved ejection fraction - Sympathetic nervous system - Neurohormonal system - Renin-angiotensin-aldosterone system - Natriuretic peptide
Resumo
¿Qual é o papel do sistema neurohormonal na insuficiência cardíaca com fração de ejeção preservada?
O papel do sistema neurohormonal (SNH) na fisiopatologia da insuficiência cardíaca sistólica (ICS) é transcendental. No entanto, sua participação na insuficiência cardíaca com fração de ejeção preservada (ICFEP) não é totalmente clara, uma vez que os dados são fornecidos a partir de estudos observacionais em pacientes com ICS.
Pequenos estudos têm mostrado que o grau de ativação do SNH na ICFEP é inferior ao do ICS.
Modelos experimentais de cardiopatia hipertensiva mostraram a participação ativa da SNH na progressão da hipertrofia cardíaca ao ICS. Níveis sanguíneos elevados de pro-BNP e BNP refletem alterações estruturais e hemodinâmicas em pacientes com ICFEP para facilitar a identificação precoce de disfunções subclínicas.
O estudo PROBE-HF mostrou que pacientes diabéticos tipo II ou hipertensos, com níveis sanguíneos de pro-BNP >125pg/ml identifica um grupo específico de pacientes que nos leva a solicitar exames de rotina para obtenção de informações funcionais e estruturais sobre a disfunção ventricular, a fim de indicar prematuramente as medidas terapêuticas adequadas.
Palavras chave: Insuficiência cardíaca com fração de ejeção preservada - Sistema nervoso simpático - Sistema neurohormonal - Sistema renina-angiotensina-aldosterona - Peptídeo natriurético
Introducción
La función crítica de los factores neurohormonales sobre la regulación de la circulación y el volumen es conocida desde hace muchos años atrás.
La importancia del sistema neurohormonal (SNH) en la fisiopatología de la insuficiencia cardíaca (IC) fue identificada a mediados y hacia el final del siglo XX, y constituye la base del modelo neurohormonal de la insuficiencia cardíaca1,2.
La evidencia y la mayor contribución para entender el papel del sistema neurohormonal fue aportada por un estudio observacional de largo seguimiento en una población bien caracterizada con falla sistólica y con intención de tratamiento.
En este estudio, el nivel de hormonas vasoactivas en el plasma (que estaban involucradas en la regulación de la función cardiocirculatoria y en la de la función renal, como vasopresina, renina, angiotensina II [AII], aldosterona, péptidos natriuréticos y norepinefrina [NE]) no sólo estaba elevado, comparado con controles normales; sino también, aportó información pronóstica3-5.
Este primer estudio, que arrojó datos precisos en la fisiopatología de la IC, fue confirmado por una variedad de estudios en distintas situaciones que aclararon varios puntos en este tema6-12.
La atención estuvo dirigida en el papel que cumplen el sistema nervioso simpático (SNS) y el sistema reninaangiotensina-aldosterona (SRAA), en la fisiopatología de la IC2,3,9.
Los estudios, que tomaron como blanco terapéutico el bloqueo del sistema neurohormonal, dieron pautas precisas en el manejo terapéutico de estos pacientes y agregaron datos importantes en cuanto a la reducción de la mortalidad en esta patología12-15.
El descubrimiento de recientes sistemas, como péptidos natriuréticos, endotelina y adrenomedulina16-18, son un reto que abre el campo de la investigación para ayudar al manejo de este síndrome, definiendo y conociendo mecanismos fisiopatológicos y nuevas opciones terapéuticas19-23.
La activación del sistema neurohormonal (SNS, SRAA) produce vasoconstricción, retención de sodio, interviene en el remodelado ventricular y vascular, y contribuye a la morbi-mortalidad en la IC sistólica24.
La administración de hormonas vasodilatadoras, como péptidos natriuréticos, urocortin, adrenomedulina y compuestos sintéticos agonistas de estos receptores, produce efectos beneficiosos sobre los sistemas cardiovascular y renal.
En el caso particular del péptido natriurético tipo-B (B-type natriuretic peptide: BNP), tiene una potencial aplicación terapéutica, opción que puede ser posible a otros péptidos25.
Últimamente, se ha puesto atención al rol potencial que tienen las neurohormonas como marcadores de disfunción e insuficiencia cardíaca. En particular el BNP, como marcador diagnóstico en IC y como guía terapéutica en estudios en actividad26-29.
El rol que cumple el sistema neurohormonal en pacientes portadores de IC con fracción de eyección (FE) preservada constituye una significativa limitación en este punto, ya que los datos con los que nos manejamos provienen de estudios observacionales con IC sistólica o en quienes la función ventricular no estaba claramente definida30,31.
Si nos guiamos por los estudios epidemiológicos, en donde se describen francas diferencias en la IC sistólica vs la IC con FE preservada, es altamente probable que el perfil neurohormonal difiera32-36.
Una mayor comprensión y conocimiento del sistema neurohormonal en la IC con FE preservada, ayudará a tratarla eficazmente.
Patente de la activación neurohormonal en pacientes con IC con FE normal
La activación neurohormonal puede preceder al comienzo de las manifestaciones clínicas de la IC y es un signo de disfunción ventricular asintomática37,38.
En el caso particular de la IC sistólica, la activación neurohormonal ha sido perfectamente caracterizada48,49.
En contraste, son pocos los datos que tenemos acerca de la IC con FE preservada38.
El primer punto a considerar son las diferencias epidemiológicas. En pacientes portadores de IC con FE preservada, prevalecen los adultos, mujeres, con antecedentes de hipertensión arterial y diabetes, y con una marcada disminución de los antecedentes de infarto de miocardio, si comparamos con la sistólica. Puede haber diferencias étnicas y raciales. En cada una de estas situaciones, puede estar afectado el perfil neurohormonal32.
El compromiso y la falla hemodinámica en la IC con FE preservada es menor que en la situación sistólica que está íntimamente relacionada a la activación del sistema neurohormonal39.
Los datos aportados en el estudio de Vasodilatadores en la Insuficiencia Cardíaca (V-HeFT: Vasodilator in Heart Failure Trial)40 indicaban que los pacientes con menor grado de falla sistólica tenían menos activación del sistema neurohormonal. Este estudio evaluó pacientes con disfunción sistólica leve a más severa (FE <35%). Los pacientes con FE >35% tenían menos activación del sistema neurohormonal y un seguimiento clínico favorable.
Se ha diseñado un número considerable de estudios para definir el perfil neurohormonal en la IC con FE preservada.
Estos estudios, en general, son pequeños, pero en el diseño la inclusión de los grupos de estudio fue bien seleccionada, y en general, demostraron que hay una activación leve del sistema neurohormonal, pero menos significativa que en la IC sistólica.
Un grupo del estudio SOLVD30, caracterizado por congestión pulmonar en la radiografía de tórax, fue dividido en tres sub-grupos (Figura 1): 1) con FE preservada >45%; 2) FE <45%; y 3) grupo control. Los niveles en plasma de norepinefrina, renina plasmática, vasopresina y péptido natriurético auricular (auricular natriuretic peptide: ANP), estuvieron francamente elevados en pacientes con IC sistólica comparados con el grupo control, con excepción de la vasopresina que estuvo elevada en pacientes con IC con FE normal. Estas diferencias fueron ajustadas a variables clínicas y de tratamiento. Sujetos con FE preservada tenían incremento de los niveles de renina plasmática y de vasopresina, comparados con controles. El ajuste de las variables de tratamiento, incluido inhibidores de la enzima de conversión (IECA) y diuréticos, puede haber contribuido a la diferencia del nivel de hormonas entre los grupos.
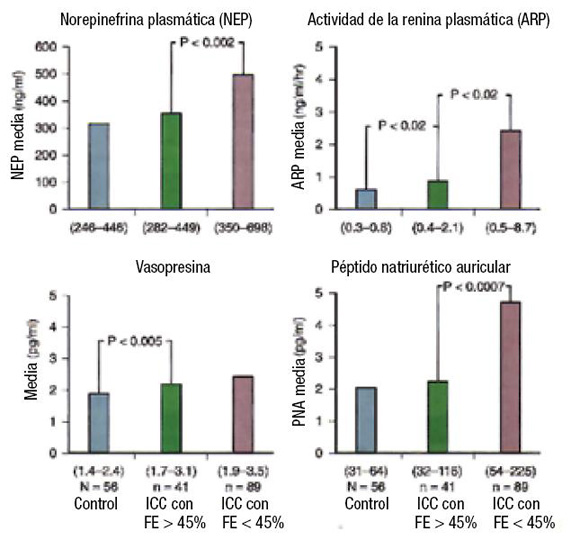
Figura 1. Activación neurohormonal en pacientes con insuficiencia cardíaca y función ventricular izquierda preservada (barras verdes) y reducida (barras moradas) en registros del Estudio de Disfunción del Ventrículo Izquierdo (SOLVD). Los valores de los controles sanos se muestran con barras azules. Modificado de Hogg et al. 200538
ICC: insuficiencia cardíaca congestiva. FE: fracción de eyección.
Kitzman y col.31 estudiaron 147 pacientes, clínicamente estables, con un promedio de edad menor a los 60 años. Cincuenta y nueve pacientes tenían IC con FE preservada, estables clínicamente y sin evidencia de patología valvular, cardiopatía isquémica ni enfermedad pulmonar. Un grupo de 60 sujetos tenía FE cercana al 35%. Estos dos grupos fueron comparados con 28 sujetos controles. A todos los pacientes se les efectuó ecocardiograma, test de ejercicio y análisis de sangre para testear las neurohormonas. En comparación con ambos controles, los pacientes con IC diastólica, eran mujeres, con mayor índice de masa corporal, alta frecuencia de hipertensión arterial y menos frecuentemente tratados con IECA, diuréticos y beta bloqueantes. Con mayor tendencia a presentar diabetes y ser tratados con antagonistas cálcicos. Estos pacientes tenían similares volúmenes y FE que el grupo control, pero mayor índice de masa del VI. El desarrollo de la prueba de esfuerzo y la incapacidad de completar el test, dependió del grado de IC sistólica o diastólica. El nivel en plasma de las neurohormonas fue significativamente alto, comparado con el grupo control, tanto en los pacientes con IC con FE disminuida como en aquellos con FE preservada.
El nivel de norepinefrina fue similar en los dos grupos de pacientes con IC, pero el ANP y el BNP fueron significativamente mayores en la IC sistólica vs IC con FE preservada.
En un estudio prospectivo de 556 pacientes con IC en la comunidad de Olmsted County41, Bursi y col.42,43 encontraron que el nivel de BNP fue significativamente más alto en sujetos con insuficiencia cardíaca asintomática (media 257 pg/ml) comparada con el grupo control (17-58 pg/ml).
Y el nivel de BNP fue significativamente mayor en pacientes con IC con FE <50% (388 pg/ml) comparados con pacientes con FE >50% (183 pg/ml, p < 0,001). En el grupo de pacientes con IC sisto-diastólica, cuanto más severa es la falla diastólica más se incrementa el BNP, y en el grupo de pacientes con FE preservada el nivel de BNP estuvo asociado, independientemente, con la edad, FE y la severidad de la disfunción diastólica. Estos hallazgos determinan que tanto la IC sistólica, como la diastólica son determinantes importantes del nivel de BNP.
La patente de la activación neurohormonal en la IC aguda con función sistólica preservada es menos clara. En un estudio pequeño de 14 de 30 pacientes con insuficiencia cardíaca aguda con FE >50%20. Los niveles de NE y BNP fueron medidos y se hizo un seguimiento. El nivel de NE al ingreso y durante el seguimiento, estuvo significativamente elevado tanto en la IC sistólica como en la IC diastólica. En contraste, el BNP se encontró elevado en las IC con FE preservada, pero en promedio, en menos de la mitad de los valores encontrados en pacientes con IC sistólica. Estos hallazgos sugieren un similar nivel de actividad simpática compensatoria, tanto en IC sistólica o diastólica aguda. El mayor nivel de BNP en la falla sistólica refleja el efecto del estrés de pared sobre la geometría de un ventrículo alterado, estímulo primario de segregación de BNP.
Iwanaga y col.44 (Figura 2) evaluaron 62 sujetos portadores de IC con FE preservada y 98 con IC sistólica y encontraron una fuerte correlación entre el nivel de BNP y el estrés de pared de fin de diástole, encontrándose más elevada en aquellos pacientes con falla sistólica, reflejando en parte en estos, un mayor volumen.

Figura 2. Diferencias entre péptido natriurético tipo B (BNP) y parámetros funcionales del ventrículo izquierdo (VI) en pacientes con insuficiencia cardíaca sistólica (ICS) (n=98) e insuficiencia cardíaca diastólica (ICD) (n=62). Los rectángulos definen el rango y la línea divisoria la media. Las barras de error indican el 10% y el 90%. PDFVI es similar en pacientes con insuficiencia cardíaca debido a alguna de estas causas, pero ESF, EDF y los niveles de plasma de BNP son todos mayores en ICS. Modificado de Iwanaga et al. 200644
PDF: presión diastólica final (mm Hg). EDF: estrés de pared diastólico final (kdynes/cm2). ESF: estrés de pared sistólico final (kdynes/cm2).
El nivel relativo de BNP en IC aguda con FE reducida vs FE preservada, fue evaluada en el estudio Breathing Not Properly (BNP)45-68, estudio multicéntrico que incluyó 1582 pacientes con disnea aguda. Se efectuó un ecocardiograma a los 30 días de la admisión en un subgrupo de 452 pacientes con insuficiencia cardíaca confirmada. Ciento sesenta (35%) de estos pacientes tenían función sistólica preservada, y el nivel de BNP estuvo elevado 413 pg/ml, comparado con el grupo control de pacientes normales (34 pg/ml), pero menor en comparación con los 283 pacientes con falla sistólica (821 pg/ml).
Yu y col.46-69 evaluaron el nivel de AM (adrenomedulina) en un estudio de 77 pacientes con IC, en uno con FE normal y el otro con FE disminuida. El nivel fue alto en pacientes con IC (47,5 ± 6,5 pmol/L) comparado con aquellos pacientes que no
la tenían (6,9 ± 1,2; p < 0,01). El nivel de AM, tuvo las siguientes variantes: fue significativamente elevado en IC sistólica y patente de flujo mitral restrictivo (92 ± 21) comparado con falla sistólica con patrón no restrictivo (38 ± 7) o con insuficiencia cardíaca con función sistólica preservada (34 ± 6).
Papel de las neurohormonas en la progresión de la hipertrofia a la insuficiencia cardíaca
El remodelado cardíaco adverso caracterizado por hipertrofia del miocito y fibrosis intersticial son una constante en los corazones con insuficiencia cardíaca con fracción de eyección preservada (ICFEP)47-49. Las condiciones hemodinámicas de carga, como la hipertensión arterial o la estenosis valvular aórtica son estímulos críticos para el remodelado adverso, donde los factores neurohormonales juegan un papel fundamental y actuarían como mediadores en el proceso evolutivo hacia la progresión de la hipertrofia a la insuficiencia cardíaca50-52. Se encontraron niveles elevados de angiotensina II, aldosterona y endotelina en modelos experimentales de enfermedad cardíaca hipertensiva53, observándose un lento desarrollo de fibrosis, hipertrofia del miocito, remodelado ventricular e insuficiencia cardíaca54-56. El incremento de las hormonas mencionadas incluida la norepinefrina es tóxico para el miocito57. El bloqueo de estas hormonas en estudios experimentales, atenúa el desarrollo de la hipertrofia y de la fibrosis, demorando el comienzo de la IC60-68. Las hormonas como adrenomedulina y péptidos natriuréticos, también se encuentran elevadas en estos estudios experimentales, pero atenúan el remodelado adverso.
Valor del péptido natriurético en el screening de la insuficiencia cardíaca
El péptido natriurético es secretado y sintetizado por los cardiomiocitos, y el estímulo primario para lograrlo es el estiramiento mecánico de la pared. Siendo el estrés de pared en diástole el estímulo más importante, explicando en parte el alto nivel de estas hormonas en la IC sistólica, por el aumento de los volúmenes de fin de diástole (Figura 3).
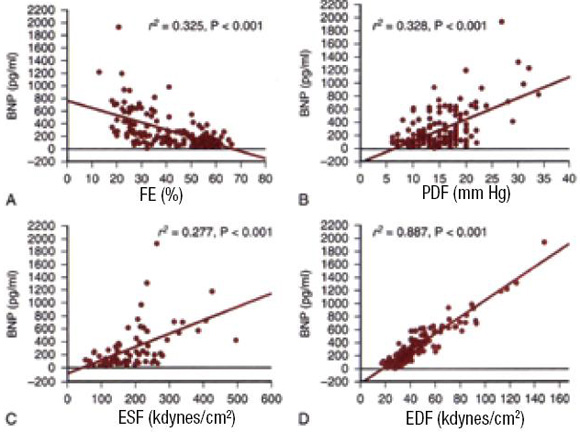
Figura 3. Correlación entre péptido natriurético tipo B (BNP) y parámetros funcionales del ventrículo izquierdo (VI) en 160 pacientes con insuficiencia cardíaca sistólica o diastólica. A: fracción de eyección ventricular izquierda (FE) (%). B: presión diastólica final (PDF) (mm Hg). C: estrés de pared sistólica final (ESF) (kdynes/cm2). D: estrés de pared diastólica final (EDF) (kdynes/cm2). Los niveles de plasma BNP están más relacionados a EDF. Modificado de Iwanaga et al. 200644
En pacientes hipertensos, el nivel de BNP se encuentra elevado, comparado con controles del mismo grupo etario, reflejando el estiramiento de la pared, la severidad de la hipertrofia y la dilatación de la aurícula izquierda61. El nivel de BNP es alto en pacientes con síntomas de IC con disfunción diastólica, comparada con grupos controles con hipertensión e hipertrofia del ventrículo izquierdo (VI)62.
El nivel en sangre del BNP y el NT-pro BNP, reflejan anormalidades funcionales y estructurales del VI, de tal manera que potencialmente pueden ser usados para evaluar e investigar la disfunción cardíaca63,64.
El nivel de BNP en sangre nos puede ayudar a identificar anormalidades subclínicas o puede facilitar la derivación de los pacientes a ecocardiografía, a fin de completar la investigación y los estudios65-67.
Varios estudios con una población de moderado tamaño han demostrado que el dosaje del BNP posee una excelente sensibilidad y especificidad en detectar disfunción sistólica y diastólica (FE <40-50%). El método tiene un alto valor predictivo negativo, cuando la prevalencia es baja, y un alto valor predictivo positivo y especificidad cuando la prevalencia es alta68,69.
Krishnaswamy y col.70 han estudiado 400 pacientes derivados a ecocardiografía y han demostrado una excelente correlación entre el dosaje de BNP y la disfunción cardíaca, tanto sistólica como diastólica, con valores aproximados de 75 pg/ml; teniendo una precisión del 90% para detectar disfunción sistólica (FE <50%; n=225) y para disfunción diastólica (trastorno de la relajación o de llenado; n=98).
Entre pacientes con disfunción diastólica aislada, el nivel de BNP se encontró francamente elevado en aquellos portadores del patrón restrictivo, comparados con los que tenían trastorno de relajación, teniendo en cuenta que los primeros poseen mayor presión de fin de diástole, estímulo importante para la liberación del péptido. También se lo presentó elevado en pacientes con IC sisto-diastólica, en mayor nivel cuando predominaba el patrón restrictivo.
Lubien y col.67 (Figura 4) evaluaron la utilidad del BNP para la detección de disfunción diastólica en sujetos con función ventricular conservada y diámetro diastólico del VI <55 mm. Fueron evaluados 294 pacientes, a los cuales se les realizó un ecocardiograma, de los cuales un 5% tenía clínica de IC.
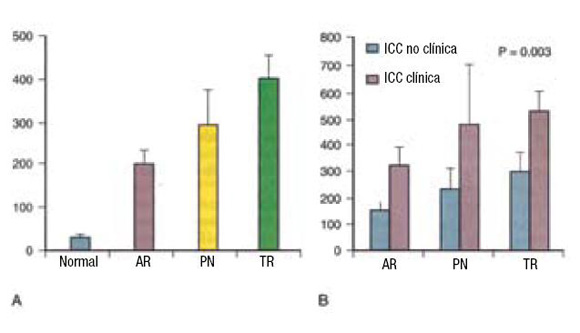
Figura 4. A: promedio ± DE (desvío estándar) para valores normales de péptido natriurético cerebral (BNP) vs alteración de la relajación (AR), pseudonormales (PN) y patrones de llenado tipo restrictivo (TR). Cada grupo anormal fue diferente del grupo normal (p<0,001). B: comparación de 3 patrones de llenado diastólico subdividido por pacientes con o sin síntomas. Los valores son promedios ± DE. El subgrupo de pacientes con disfunción diastólica e insuficiencia cardíaca congestiva clínica (ICC) tuvo en general mayores niveles de BNP que aquellos sin síntomas. Modificado de Lubien et al. 200267
La función diastólica fue clasificada en las siguientes categorías: normal, trastorno de relajación, pseudonormal y restrictivo. El nivel de BNP se incrementó a mayor grado de disfunción diastólica y con la presencia de clínica de IC. Un nivel de BNP de 65 pg/ml mostró una sensibilidad del 85%y una especificidad del 83% para detectar cualquiera de las categorías de disfunción diastólica, cuando la FE estaba conservada. Tuvo mayor precisión diagnóstica, cuando se consideró únicamente el patrón restrictivo y cuando había alteraciones estructurales y funcionales de la aurícula izquierda y aumento de la masa ventricular. Estos hallazgos sugieren que el nivel de BNP refleja la severidad de la disfunción diastólica y puede predecir la anormalidad de la función diastólica, particularmente el patrón restrictivo, en aquellos pacientes derivados a ecocardiografía.
En los estudios epidemiológicos en la comunidad en general, la mitad de los casos de disfunción asintomática del VI no son detectados clínicamente. Probablemente, la aplicación de un test sencillo y económico, podría ayudar a evaluar con mayor precisión a este grupo particular de pacientes. Una serie de estudios realizados en la población general han utilizado como método de screening al BNP o el NT-pro BNP para detectar disfunción sistólica (FE <50%), aumento de la masa ventricular y disfunción diastólica en sus distintos grados71-73.
En estos estudios, la prevalencia de estas anormalidades fue baja (<6%). El hallazgo más relevante fue un elevado valor predictivo negativo (93-99%) cuando el BNP era bajo, pero poco específico71. El grupo del estudio Framingham68-72 encontró que el BNP no mejora significativamente la detección de disfunción sistólica o hipertrofia del VI, comparado con parámetros clínicos y electrocardiográficos.
En el estudio Olmsted County74, se encontró diferencias entre hombres y mujeres utilizando el dosaje de BNP y de pro BNP. Valores muy bajos de BNP excluyen significativamente la disfunción del VI, recomendándose para su uso rutinario como screening en la población general. En este mismo grupo se testeó BNP y pro-BNP en 1869 sujetos de la comunidad y encontraron que el pro-BNP es menos efectivo que el BNP en detectar FE <40%, pero en hombres adultos el pro-BNP fue superior al BNP. Ajustando las variables edad y sexo estos método fueron más precisos en detectar disfunción diastólica o sistólica, con una sensibilidad y especificidad cercana al 90% en detectar FE <40%. Si mencionamos al pro-BNP, este último fue menos preciso en el caso de detectar disfunción diastólica sola o combinada con disfunción sistólica. Estos hallazgos sugieren que el pro-BNP puede ser usado para evaluar la disfunción sistólica (ajustando las variables sexo y edad), pero tiene poco valor en la disfunción diastólica.
En 2009, se publicó el estudio multicéntrico PROBE-HF77, diseñado con el propósito de evaluar el rol del dosaje del pro-BNP en detectar la prevalencia de la disfunción ventricular asintomática en pacientes hipertensos y diabéticos tipo II. Se incluyeron 1012 sujetos a los cuales se les efectuó la medición de pro-BNP y se la realización de un ecocardiograma. La disfunción diastólica estuvo presente en el 36,4% de los sujetos (32% con disfunción leve, 4% con disfunción moderada a severa) y disfunción sistólica en el 1,1%. Los niveles de pro-BNP, medidos fueron 170±206 pg/ml y 859±661pg/ml en la disfunción diastólica y en la sistólica, respectivamente, y 92±169 pg/ml en los sujetos normales (p<0,001). El punto de corte del dosaje de pro BNP para definir disfunción ventricular fue de 125 pg/ml, cifra ajustada a las variables sexo y edad, con un alto valor predictivo negativo. La prevalencia de disfunción ventricular asintomática en la muestra fue del 5,1%. El mensaje de este estudio refiere que en pacientes diabéticos tipo II o hipertensos, el simple dosaje de pro-BNP en cifras mayores de 125 pg/ml provee un diagnóstico simple y rápido, identificando un grupo particular de pacientes en los cuales nos obliga a completar los estudios de rutina electrocardiograma y ecocardiograma, para obtener información estructural y funcional de la disfunción ventricular, y así tomar las medidas terapéuticas pertinentes.
En el contexto de la IC, se debe tener en cuenta que existen una serie de situaciones clínicas que pueden hacer perder la especificidad del método, aumentando el nivel de BNP, disfunción del ventrículo derecho (VD), fibrilación auricular, insuficiencia renal, patologías tiroideas y cardiopatía isquémica75,76.
Un tema importante a considerar es el diagnóstico de la IC aguda, un reto en la actualidad. Según las estadísticas, el diagnóstico puede ser incorrecto en la mitad de los casos, siendo más frecuente en el marco de casos con FE preservada. El BNP y el pro-BNP han sido validados como marcadores diagnósticos de IC aguda, basados en los hallazgos de numerosos estudios observacionales, efectuados en diferentes países y usando distintos diseños. En la IC aguda, el nivel de estos marcadores se encuentra elevado.
Se han establecido para el diagnóstico cifras de 100 pg/ml y de 400 pg/ml, para el BNP y para el pro-BNP, respectivamente. Hay variables como sexo, edad y función renal que pueden estar asociadas al caso clínico en particular y pueden variar y elevar los valores de estos marcadores. Valores muy altos, como cifras de 1600 pg/ml de pro-BNP, tienen un alto valor predictivo positivo para el diagnóstico de IC aguda78,79.
En el estudio BNP80, se evaluó la utilidad del BNP en el diagnóstico de la IC aguda, asociada a una FE disminuida o normal, en una cohorte de 452 pacientes que luego fueron derivados a ecocardiografía a los 30 días de haber sido admitidos en el protocolo. El nivel de BNP fue alto en todos los pacientes con IC, tanto en pacientes con IC sistólica como en aquellos con FE preservada.
El simple hecho de elevar las cifras de BNP no puede discriminar estas situaciones clínicas; la combinación del aumento de BNP, baja saturación de oxígeno, historia previa de infarto de miocardio y alta frecuencia cardíaca sugieren que la falla aguda está relacionada con IC sistólica.
Dos recientes estudios randomizados han demostrado que el uso rutinario de BNP mejora la precisión diagnóstica y el manejo de la IC, y proveen datos del costo efectivo de estos métodos. Ambos estudios incluyen pacientes no seleccionados con disnea aguda, de los cuales el 50% presentaban IC, ya sea con FE disminuida o preservada. En el primer estudio mencionado81, Mueller y col. randomizaron 350 pacientes con disnea aguda con o sin dosaje de pro-BNP. En el grupo de pacientes en el que se midió pro-BNP, la precisión diagnóstica de IC aguda mejoró de un 50% a un 70% (p<0,001 comparado con controles).
En el segundo estudio78-82, se empleó un diseño similar al anterior y fue llevado a cabo en el servicio de emergencia, los pacientes con disnea aguda fueron randomizados a grupos de tratamiento con o sin dosaje de pro-BNP. Los sujetos randomizados al grupo de pro-BNP se internaron más precozmente en el hospital o en la unidad coronaria, disminuyendo los días de internación y el costo hospitalario.
No hubo diferencia a los 30 días de seguimiento, en cuanto a la mortalidad ni a la readmisión hospitalaria.
Conclusión
El rol del sistema neurohormonal en la fisiopatología de la IC sistólica es trascendental. Sin embargo, su participación en la insuficiencia cardíaca con fracción de eyección preservada no se encuentra del todo aclarada, ya que los datos aportados provienen de estudios observacionales en pacientes con IC sistólica.
Pequeños estudios han demostrado que el grado de la activación del SNH en la ICFEP es menor que en la IC sistólica. Los marcadores BNP y pro-BNP ayudan a precisar el diagnóstico de la falla aguda, pero es fundamental el juicioso razonamiento clínico y el examen clínico del paciente para elaborar un diagnóstico correcto.
1. Packer M. The neurohormonal hypothesis: a theory to explain the mechanism of disease progression in heart failure. J Am Coll Cardiol 1992;20:248-54. [ Links ]
2. Cohn J, Levine T, Olivari MT et al. Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure. N Engl J Med 1984;311:819-823. [ Links ]
3. Francis G, Cohn J, Johnson G, et al. Plasma norepinephrine, plasma renin activity and congestive heart failure. Relations to survival and the effects of therapy in V-HeFT II. The V-He ft VA Cooperative Studies Group. Circulation 1993;87(6 Suppl):V140-V148. [ Links ]
4. Loeb HS, Johnson G, Henrick A, et al. Effect of enalapril hydralazine plus isosorbide dinitrate and prazosin on hospitalization in patients with chronic congestive heart failure. The V-HeFT VA. Cooperative Studies Group. Circulation 1993;87(6 Suppl):V178-V187. [ Links ]
5. Johnson G, Carson P, Francis G et al. Influence of prerandomization variables on mortality and on the reduction of mortality by enalapril Veterans Affairs Cooperative Study on Vasodilatador Therapy of Heart Failure (V-He FT II). Circulation 1993;87 (6 Suppl):V132-V139. [ Links ]
6. Richards AM, Dougthy R, Nicholls MG, et al. Plasma N terminal pro-brain natriuretic peptide and adrenomedullin: prognostic utility and prediction of benefit from carvedilol in chronic ischemic left ventricular dysfunction. Australia -New Zeland Heart Failure. J Am Coll Cardiol 2001;37:1781-1787. [ Links ]
7. Mc Donagh TA, Cunnigham AD, Morrison CE, et al. Left ventricular dysfunction natriuretic peptides and mortality in an urban population. Heart 2001;86:21-26. [ Links ]
8. Packer M, Lee W, Keesler D, et al. Role of neurohormonal mechanisms in determining survival, in patients with severe chronic heart failure. Circulation 1987;75:IV80-IV92. [ Links ]
9. Swedberg K, Eneroth P, Kjekshus J, et al. Hormones regulating cardiovascular function in patients with severe congestive heart failure and their relation to mortality CONSENSUS Trial Study Group. Circulation 1990;82:1730-1736. [ Links ]
10. Cohn J, Archibald DG, Ziesche S, et al. Effects of vasodilatador therapy on mortality in chronic congestive heart failure. Results of a Veterans Administration Coopertive Study. N Eng J Med 1986;314:1547-1552. [ Links ]
11. Packer M, Bristow M, Cohn J, et al. The effects of carvedilol on morbidity and mortality in patients with chronic heart failure. N Eng J Med 1996;334:1349-1355. [ Links ]
12. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection and congestive heart failure. N Eng J Med 1991,325:293-302. [ Links ]
13. The SOLVD Investigators. Effects of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fraction. N Eng J Med 1992;327:685-691. [ Links ]
14. The Cardiac Insufficiency Bisoprolol Study II (CIBIS -II): a randomized trial. Lancet 1999;353:9-13. [ Links ]
15. Effect of metoprolol in chronic heart failure. Metoprolol CR/XL Randomized Intervention Trial in Congestive Heart Failure (MERITHF). Lancet 1999;353:2001-2007. [ Links ]
16. Mukoyama M, Nakao K, Hosoda K, et al. Brain natriuretic peptide as a novel hormone in humans. Evidence for an exquisite dual natriuretic peptide system atrial natriuretic peptide and brain natriuretic peptide. J Clin Invest 1991;87:1402-1412. [ Links ]
17. Nishikimi T, Matsuoka H. Cardiac adrenomedullin: its role in cardiac hypertrophy and heart failure. Curr Med Chem Cardiovasc Hematol Agents 2005;3:231-242. [ Links ]
18. Yanagisawa M, Kurihara H, Kimura S, et al. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988:332:411-415. [ Links ]
19. Nakamura R, Kato J, Kitamura K, et al. Adrenomedullin administration immediately alter myocardial infarction ameliorates progression of heart failure in rats. Circulation 2004;110:426-431. [ Links ]
20. Rademaker M, Cameron VA, Charles C, et al. Integrated hemodynamic hormonal and renal actions of urocortin 2 in normal and paced sheep: beneficial effects in heart failure. Circulation 2005;112:3624-3632. [ Links ]
21. Jougasaki M, Tachibana I, Luchner A, et al. Augmented cardiac cardiotrophin-1 in experimental congestive heart failure. Circulation 2000;101:14-17. [ Links ]
22. Jougasaki M, Leskinen H, Larsen A, et al. Ventricular cardiotrophin 1 activation precedes BNP in experimental congestive heart failure. Peptide 2003;24:889-892. [ Links ]
23. Wright S, Prickett T, Doughty RN, et al. Amino-terminal pro C-type natriuretic peptide in heart failure. Hypertension 2004;43:94-100. [ Links ]
24. Yusuf S, Pfeffer MA, Swedberg K, et al. Effects of candersartan in patients with chronic heart failure and preserved left ventricular ejection fraction: the CHARM-Preserved Trial. Lancet 2003;362:777-781. [ Links ]
25. Colucci W, Elkayam U, Horton D, et al. Intravenous neseritide a natriuretic peptide in the treatment of decompensated congestive heart failure. Neseritide Study Group. N Eng J Med 2000;343:246-253. [ Links ]
26. Januzzi J, van Kimmenade R, Lainchbury J, et al. NT-pro BNP testing for diagnosis and short -term prognosis in acute destabilized heart failure: an international pooled analysis of 1256 patients. The International Collaborative of NT-pro BNP Study. Eur Heart J 2006;27:330-337. [ Links ]
27. Brunner-La Rocca H, Buser T, Schindler R, et al. Management of elderly patients with congestive heart failure -design of the Trial of Intensified versus standard Medical therapy in Elderly patients with Congestive Heart Failure (TIME-CHF). Am Heart J 2006;151:949-955. [ Links ]
28. Lainchbury J, Trougthon R, Frampton C, et al. NT-pro BNP -guided drug treatment for chronic heart failure. Design and methods in the "BATTLESCARRED" trial. Eur J Heart Fail 2006;8:532-538. [ Links ]
29. Trougthon R, Frampton C, Yandle T, et al. Treatment of heart failure guided by plasma amino terminal brain natriuretic peptide (N-BNP) concentrations. Lancet 2000;355:1126-130. [ Links ]
30. Benedicts C, Weiner D, Johnstone D, et al. Comparative neurohormonal responses in patients with preserved and impaired left ventricular ejection fraction. Results of the SOLVD Registry. J Am Coll Cardiol 1993;22:146A-153A. [ Links ]
31. Kitzman D, Little W, Brubaker H, et al. Pathophysiological characterization of isolated diastolic heart failure in comparison to systolic heart failure. JAMA 2002;288:2144-2150. [ Links ]
32. Hoggs K, Swedberg K, Mc Murray J, et al. Herat failure with preserved left ventricular systolic function: epidemiology clinical characteristics and prognosis. J Am Coll Cardiol 2004;43:317-327. [ Links ]
33. Lenzen M, Scholte op Reimer W, Boersma E, et al. Differences between patients with a preserved and a depressed left ventricular function. A report from the EuroHeart Failure Survey. Eur Heart J 2004;25:1214-1220. [ Links ]
34. Berry C, Hogg K, Norrie J, et al. Heart failure with preserved left ventricular systolic function: a hospital cohort study. Heart 2005;91:907-913. [ Links ]
35. Varela-Roman A, Grigorian L, Barge E, et al. Heart failure in patients with preserved and deteriorated left ventricular ejection fraction. Heart 2005;91:489-494. [ Links ]
36. McDonagh TA, Morrison CE, Lawrence A, et al. Symptomatic and asymptomatic left ventricular systolic dysfunction in an urban population. Lancet 1997;350:829-833. [ Links ]
37. Francis G, Benedict C, Johnstone DE, et al. Comparison of neuroendocrine activation in patients with left ventricular dysfunction with and without congestive heart failure. A substudy of the Studies of Left Ventricular Dysfunction Circulation 1990;82:1724-1729. [ Links ]
38. Hoggs K, Mc Murray J. Neurohumoral pathways in heart failure with preserved systolic function. Prog Cardiovasc Dis 2005;47:357-366. [ Links ]
39. Schrier R, Abraham W. Hormones and hemodynamics in heart failure. N Eng J Med 1999;341:577-585. [ Links ]
40. Carson P, Johonson G, Fletcher R, et al. Mild systolic dysfunction in heart failure: baseline characteristics prognosis and response to therapy in the Vasodilatador in Heart Failure Trial (V-HeFT). J Am Coll Cardiol 1996;27:642-649. [ Links ]
41. Redfield MM, Rodeheffer R, Jacobsen S, et al. Plasma brain natriuretic peptide concentration. Impact of age and gender. J Am Coll Cardiol 2002;40:976-982. [ Links ]
42. Bursi F, Weston SA, Redfield M. Systolic and diastolic heart failure in the community. JAMA 2006;296:2209-2216. [ Links ]
43. Vinch CS, Aurigemma G, Hill JC, et al. Usefulness of clinical variables echocardiography and levels of brain natriuretic peptide and norepinephrine to distinguish systolic and diastolic causes of acute heart failure. Am J Cardiol 2003;91:1140-1143. [ Links ]
44. Iwanaga Y, Nishi I ,Furuichi S, et al. B-type natriuretic peptide strongly reflects diastolic wall stress in patients with chronic heart failure: comparison between systolic and diastolic heart failure. J Am Coll Cardiol 2006;47:742-748. [ Links ]
45. Maisel AS, McCord J, Nowak RM, et al. Bedside B-type natriuretic peptide in the emergency diagnosis of heart failure with reduced or preserved ejection fraction. Results from the Breathing Not Properly Multinational Study. J Am Coll Cardiol 2003;41:2010-2017. [ Links ]
46. Yu CM, Cheung BM, Leung R, et al. Increase in plasma adrenomedullin in patients with heart failure characterized by diastolic dysfunction. Heart 2001;86.155-160. [ Links ]
47. van Heerebeek L, Borbely A, Niessen H, et al. Myocardial structure and function differ in systolic and diastolic heart failure. Circulation 2006;113:1966-1973. [ Links ]
48. Katz AM, Zile MR. New molecular mechanism in diastolic heart failure. Circulation 2006;113:1922-1925. [ Links ]
49. Weber K, Brilla C. Structural basis for pathologic left ventricular hypertrophy. Clin Cardiol 1993;16(5 Suppl 2):II10-II14. [ Links ]
50. Lisy O, Redfield MM, Jovanovic S, et al. Mechanical unloading versus neurohumoral stimulation on myocardial structure and endocrine function in vivo. Circulation 2000;102:338-343. [ Links ]
51. Chinnaiyan K, Alexander D, McCullough A, et al. A role of angiotensin II in the evolution of diastolic heart failure. J Clin Hypertens 2005;7:740-747. [ Links ]
52. Malhotra R, Sadoshima J, Brosius F, et al. Mechanical stretch and angiotensin II differential upregulate the rennin-angiotensin system in cardiac myocytes in Vitro. Cir Res 1999;85:137-146. [ Links ]
53. Iwanaga Y, Kihara Y, Inagaki K, et al. Differential effects of angiotensin II versus endothelin-1 inhibitions in hypertrophic left ventricular myocardium during transition to heart failure. Circulation 2001;104:606-612. [ Links ]
54. Yamamoto K, Masuyama T, Sakata, et al. Roles of rennin-angiotensin and endothelin systems in development of diastolic heart failure in hypertensive hearts. Cardiovasc Res 2000;47(2):274-283. [ Links ]
55. Weber KT, Brilla CG. Pathological hypertrophy and cardiac interstitium fibrosis and renin-angiotensin-aldosterone system. Circulation 1991;83:1849-1885. [ Links ]
56. Mazzolai L, Nussberg J, Aubert J, et al. Blood pressure -independent cardiac hypertrophy induced by locally activated renin-angiotensin system. Hypertension 1998;31:1324-1330. [ Links ]
57. Bristow MR. Beta-adrenergic receptor blockade in chronic heart failure. Circulation 2000;101:558-569. [ Links ]
58. Brilla C, Matsubara L, Weber K, et al. Antifibrotic effects of spironolactone in preventing myocardial fibrosis in systemic arterial hypertension. Am J Cardiol 1993;71:12A-16A. [ Links ]
59. Emoto N, Raharjo S, Isaka D, et al. Dual ECE/NEP inhibition on cardiac and neurohumoral function during the transition from hypertrophy to heart failure in rats. Hypertension 2005;45:1145-1152. [ Links ]
60. Brilla C, Matsubara LS, Weber K, et al. Anti-aldosterone treatment and the prevention of myocardial fibrosis in primary and secondary hyperaldosteronism. J Mol Cell Cardiol 1993;25:563-575. [ Links ]
61. Yamamoto K, Burnett J, Jougasaki M, et al. Superiority of brain natriuretic peptide as a hormonal marker of ventricular systolic and diastolic dysfunction and ventricular hypertrophy. Hypertension 1996;28:988-994. [ Links ]
62. Yamaguchi H, Yoshida J, Yamamoto K, et al. Elevation of plasma brain natriuretic peptide is a hallmark of diastolic heart failure independent of ventricular hypertrophy. J Am Coll Cardiol 2004;43:55-60. [ Links ]
63. Pitt B, Riechek N, Willenbrock R, et al. Effects of eplerenone enalapril and eplerenone /enalapril in patients with essential hypertension and left ventricular hypertrophy. The 4E-left ventricular hypertrophy study. Circulation 2003:108:1831-1838. [ Links ]
64. Grandi A, Imperiale D, Santillo R, et al. Aldosterone antagonist improves diastolic function in essential hypertension. Hypertension 2002;40:647-652. [ Links ]
65. Niinuma H, Nakamura M, Hiramori K, et al. Plasma B - type natriuretic peptide measurments in a multiphasic healt screening program. Cardiology 1998;90:89-94362. [ Links ]
66. Rodeheffer R. Measuring plasma B -type natriuretic peptide in heart failure: Good to go in 2004? J Am Coll Cardiol 2004;44:740-749. [ Links ]
67. Lubien E, DeMaria A, Krishnaswamy P, et al. Utility of B - natriuretic peptide in detecting diastolic dysfunction: comparison with Doppler velocity recording. Circulation 2002;105:595-601. [ Links ]
68. Maisel AS, Koon J, Krishnaswamy P, et al. Utility of B- natriuretic peptide as a rapid point of care test for screening patients undergoing echocardiography to determine left ventricular dysfunction. Am Heart J 2001;141(3):367-374. [ Links ]
69. Latini, Masson S, DeAngelis N, et al. Role of brain natriuretic peptide in the diagnosis and management of heart failure: current concepts. J Card Fail 2002;8:288-99. [ Links ]
70. Krishnaswamy P, Lubien E, Clopton P, et al. Utility of B- natriuretic peptide levels in identifying patients with left ventricular systolic and diastolic dysfunction. Am J Med 2001;111:274-279. [ Links ]
71. Redfield MM, Rodeheefer R, Jacobsen S, et al. Plasma brain natriuretic peptide detect preclinical ventricular systolic or diastolic dysfunction: a community -based study. Circulation 2004;109:3176-3181. [ Links ]
72. Vasan RS, Benjamin EJ, Larson MG, et al. Plasma natriuretic peptides for community screening for left ventricular hypertrophy and systolic dysfunction: the Framingham Heart Study. JAMA 2002;288:1252-1259. [ Links ]
73. Bibbins-Domingo K, Ansari M, Schiller NB, et al. Is B- type natriuretic peptide a useful screening test for systolic or diastolic dysfunction in patients with coronary disease? Data from the Heart and Soul Study. Am J Med 2004;116:509-516. [ Links ]
74. Costello LC, Boerrigter G, Redfield MM, et al. Amino terminal pro B -type natriuretic peptide and B-type natriuretic peptide in the general community: determinants and detection of left ventricular dysfunction. J Am Coll Cardiol 2006;47:345-353. [ Links ]
75. Gerber IL, Steward RA, French J, et al. Associations between plasma natriuretic peptide levels symptoms and left ventricular function in patients with chronic aortic regurgitation. Am J Cardiol 2003;92:755-758. [ Links ]
76. Gerber IL, Steward RA, Legget ME, et al. Increased plasma natriuretic peptide levels reflect symptom onset in aortic stenosis. Circulation 2003;107:1884-1890. [ Links ]
77. Betti I, Maisel A, Zuppiroli A, et al. The Role of N-terminal PRO-Brain Natriuretic Peptide and Echocardiography FOR Screening Asymptomatic Left Ventricular Dysfunction in a Population at High Risk for Heart Failure. The PROBE -HG Study. J Cardiac Fail 2009;15:377-384. [ Links ]
78. Lainchbury J, Campbell E, Frampton CM, et al. Brain natriuretic peptide and n-terminal brain natriuretic peptide in the diagnosis of heart failure in patients with acute shortness of breath. J Am Coll Cardiol 2003;42:728-735. [ Links ]
79. Maisel A, Clopton P, Krishnaswamy P, et al. Impact of age race and sex on the ability of B-type natriuretic peptide to aid in the emergency diagnosis of heart failure: Results from the Breathing Not Properly (BNP) multinational study. Am Heart J 2004;147:1078-1084. [ Links ]
80. Maisel A, McCord J, Nowak R, , et al. Bedside B-type natriuretic peptide in the emergency diagnosis of heart failure with reduced or preserved ejection fraction: Results from the Breathing Not Properly Multinational Study. J Am Coll Cardiol 2003;41:2010-2017. [ Links ]
81. Mueller C, Scholer A, Laule K, et al. Use of B-type natriuretic peptide in the evaluation and management of acute dyspnea. N Eng J Med 2004;350:647-654. [ Links ]
82. Latini R, Masson S, Anand I, et al. The comparative prognostic value of plasma neurohormones at baseline in patients with heart failure enrolled in Val-HeFT. Eur Heart J 2004;25:292-299. [ Links ]














