Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Insuficiencia cardíaca
versão On-line ISSN 1852-3862
Insuf. card. vol.6 no.2 Ciudad Autónoma de Buenos Aires abr./jun. 2011
ARTÍCULO DE ACTUALIZACIÓN
Hipertensión arterial posterior a trasplante deórganos sólidos renal-hepático-cardíaco
Plinio D. Casola*
* Médico Clínico. Responsable del Departamento de Gestión Clínica. Hospital "Juan D. Perón". Ciudad de Formosa. Formosa. República Argentina.
Miembro del Distrito Nordeste de la Sociedad Argentina de Hipertensión Arterial.
Correspondencia: Dr. Plinio Darío Casola
Av. Nap. Uriburu 767. CP: 3600. Ciudad de Formosa. Formosa. República Argentina.
E-mail: pliniocasola@yahoo.com
Recibido: 11/03/2010
Aceptado: 12/01/2011
Resumen
La hipertensión arterial (HTA) es una complicación muy frecuente después del trasplante de órganos sólidos, y uno de los factores de riesgo más importante para la sobrevida del injerto y del paciente. La supervivencia de los trasplantes ha mejorado en forma sustancial con el advenimiento de nuevas drogas inmunosupresoras, sin embargo, no están exentas de efectos adversos, siendo la HTA uno de los efectos más importantes. Existen diferencias fisiopatológicas según el órgano trasplantado, tema a tener en cuenta en el momento de decidir un esquema de tratamiento. Se espera el desarrollo de nuevas drogas inmunosupresoras con menores efectos colaterales.
Por el momento, los bloqueantes cálcicos son las drogas más utilizadas en el tratamiento, quizás por contrarrestar los efectos de los inhibidores de la calcineurina, y por sus escasos efectos colaterales, no obstante, los IECA y los ARA II están siendo utilizados cada vez con más frecuencia, al igual que el carvedilol.
Palabras clave: Hipertensión post-trasplante; Drogas inmunosupresoras; Tratamiento
Summary
Arterial hypertension after cardiac-hepatic-renal solid organ transplantation
Hypertension (HT) is a very common complication after solid organ transplantation, and one of the most important risk factors for graft and patient survival. Transplant survival has improved substantially with the advent of new immunosuppressive drugs; however, they are not free of side effects, HT being one of the most important. Pathophysiological differences exist depending on the transplanted organ, matter to be considered when deciding on a treatment regimen. It is expected the development of new immunosuppressive drugs with fewer side effects.
For the moment, calcium channel blockers are the drugs most commonly used in treatment, perhaps to the counter the effects of calcineurin inhibitors, and their few side effects; however, ACE inhibitors and ARBs are being used increasingly more often, like carvedilol.
Keywords: Post-transplant hypertension; Immunosuppressive drugs; Treatment
Resumo
Hipertensão arterial após transplante de órgão sólido renal-hepático-cardíaco
Hipertensão arterial (HTA) é uma complicação muito comum após o transplante de órgãos sólidos, e um dos fatores de risco mais importante para a sobrevida do enxerto e do paciente. A sobrevivência do transplante melhorou substancialmente com o advento de novas drogas imunossupressoras; no entanto, eles não estão livres de efeitos colaterais. Sendo a HTA uma das mais importantes. Existem diferenças fisiopatológicas de acordo com o órgão transplantado, um assunto a ser conta ao decidir sobre um regime de tratamento. Prevê-se o desenvolvimento de novas drogas imunossupressoras com menos efeitos colaterais.
Para o momento, bloqueadores dos canais de cálcio são os medicamentos mais comumente utilizados no tratamento, talvez para compensar os efeitos de inibidores da calcineurina, e seus efeitos colaterais; no entanto, os IECA e os BRA estão sendo usados cada vez com mais freqüência, como carvedilol.
Palavras-chave: Hipertensão pós-transplante; Drogas imunossupressoras; Tratamento
Introducción
La hipertensión arterial (HTA) es una complicación muy frecuente después del trasplante de órganos sólidos, y un factor de riesgo importante en la sobrevida del injerto. Su incidencia llega al 98% en trasplantados cardíacos a los 10 años1, al 67-90% en los trasplantados renales2, y a más del 50% en los trasplantados hepáticos3. Aunque existen mecanismos comunes en el desarrollo de la misma, fundamentalmente por algunas drogas inmunosupresoras, en cada grupo existen diferencias fisiopatológicas, que llevan a la generación de hipertensión, tema a tener en cuenta en el momento de decidir un esquema de tratamiento.
Hipertensión arterial inducida por drogas inmunosupresoras
La supervivencia de los trasplantes ha mejorado en forma sustancial con el advenimiento de nuevas drogas inmunosupresoras; sin embargo, no está exenta de efectos adversos (Tabla 1)4, siendo la HTA uno de los efectos más importantes.
Tabla 1. Efectos adversos más comunes en drogas inmunosupresoras frecuentemente utilizadas

Inhibidores de la calcineurina (ciclosporina, tacrolimus)
La ciclosporina es un péptido cíclico lipofílico de 11 aminoácidos, y el tacrolimus es un antibiótico macrólido, ambas drogas han sido aisladas de hongos, y poseen efectos supresores similares sobre la respuesta inmune celular y humoral.
Ambos se unen con mucha afinidad a proteínas citoplasmáticas presentes en la mayoría de las células: ciclofilina para ciclosporina y proteínas de unión FK para tacrolimus. Este complejo droga-receptor se une específica y competitivamente a la calcineurina, una enzima calciocalmodulina fosfatasa-dependiente. Este proceso inhibe la translocación de una familia de factores de trascripción, NF-AT, induciendo una reducida activación transcripcional de genes de citoquinas como IL-2, TNF-alfa, IL-3, IL-4, CD40L, factor estimulante de colonias granulocitosmacrófagos, interferón gamma12.
La ciclosporina es capaz de inducir HTA en los trasplantes renales, hepáticos, cardíacos y de médula ósea, incluso en ausencia de tratamiento simultaneo con esteroides2. Su efecto inductor de HTA también se ha observado en pacientes tratados con ciclosporina por patologías diferentes al trasplante como artritis reumatoidea, uveítis, psoriasis y miastenia gravis.
El descubrimiento de calcineurina en el tejido liso vascular, a nivel renal y sistema nervioso central, todos tejido diana de ciclosporina, hace intuir el papel de calcineurina, no sólo en el efecto supresor de ciclosporina, sino también en su efecto nefrotóxico y su capacidad para inducir HTA5.
En los pacientes trasplantados renales, se han descripto tres tipos de hipertensión asociada a la ciclosporina. Elprimero, infrecuente actualmente, es asociado al síndrome urémico-hemolítico y es similar al que se observa en la hipertensión maligna. El segundo es el que acompaña a la toxicidad renal, es dosis dependiente y mejora con la disminución de la dosis o la retirada, si se puede, de los anticalcineuríticos. El tercer tipo, el más frecuente, está asociado con la vasoconstricción renal y sistémica que producen, depende de las dosis y nivel plasmático de la droga, es reversible y puede controlarse con el tratamiento antihipertensivo13.
Ciclosporina y tacrolimus inducen el aumento de las resistencias vasculares y renales a través de su acción vasoconstrictora, causando nefrotoxicidad aguda y crónica, así como HTA. Dicha vasoconstricción parece mediada por el aumento de la síntesis y liberación de endotelina-1 (ET-1), un disbalance entre prostaglandinas vasoconstrictoras (tromboxano) y vasodilatadores (prostaciclina), la inhibición del óxido nítrico sintasa, el aumento del tono simpático, y la alteración local del sistema reninaangiotensina-aldosterona (SRAA). La ciclosporina induce, además, dicha vasoconstricción a nivel de la arteriola aferente, con la consiguiente disminución del flujo sanguíneo renal y del filtrado glomerular. Esta capacidad nefrotóxica, bien conocida de la ciclosporina, también se asocia con la génesis de HTA a través de la retención de sodio y expansión del volumen intravascular. Se expone un resumen de los mecanismos implicados en la Figura 12.
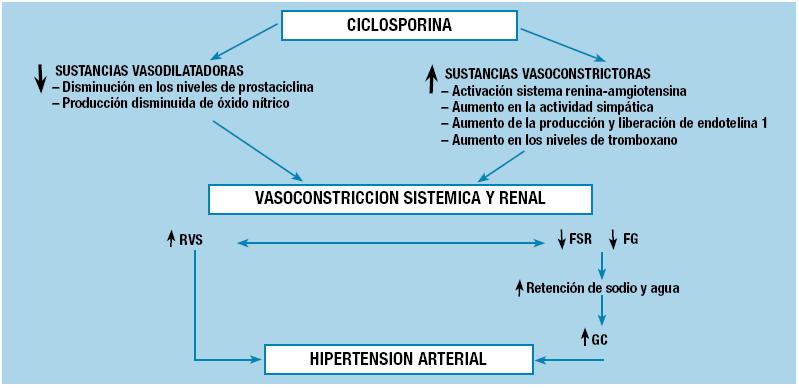
Figura 1. Mecanismos implicados en la hipertensión arterial (HTA) inducida por ciclosporina. El disbalance entre las sustancias vasoconstrictoras y vasodilatadoras, a favor de la vasoconstricción, genera un aumento en las resistencias vasculares sistémicas (RVS) y en la resistencia vascular renal. Este último efecto implica una disminución en el flujo sanguíneo renal (FSR) y en el filtrado glomerular (FG), lo que a su vez condiciona un aumento en el gasto cardíaco (GC) a través de la retención de sodio y agua.
Tacrolimus se considera tan nefrotóxico como ciclosporina, si bien parece inducir menos HTA que esta última en trasplantados hepáticos7.
En los más importantes estudios europeos8 y americanos9 que comparan ciclosporina y tacrolimus en pacientes trasplantados renales, los tratados con tacrolimus muestran una creatinina sérica similar, pero presentan una tendencia inferior a la HTA. En un estudio en el que 17 pacientes con función renal estable fueron convertidos temporalmente de ciclosporina a tacrolimus, se observó una disminución significativa de la presión arterial sistólica y diastólica, diurna y nocturna. Cuando los pacientes volvieron a recibir ciclosporina, las cifras de la presión arterial regresaron a los valores previos10.
Esteroides
Los esteroides pueden agravar la HTA a través de la retención de sodio y un incremento del volumen plasmático. Varios estudios han puesto de manifiesto que la dosis diaria de esteroides y la dosis acumulada de esteroides se correlaciona con la presión arterial11. Si se pueden retirar tempranamente los esteroides, se consigue un mejor control de las cifras tensionales.
Hipertensión arterial en trasplante renal
La HTA es muy frecuente en los pacientes trasplantados renales, y juega un rol importante en la supervivencia del injerto y del propio paciente. De una incidencia del 30% al 40% en la era pre-ciclosporina, la incidencia de HTA aumenta al 60-90% desde la introducción de la misma2-14.
Causas de hipertensión arterial
Las causas de la HTA en el trasplantado renal son multifactoriales, donde no sólo contribuyen los factores deldonante o receptor, sino también de la terapia inmunosupresora13.
Dentro de las causas más frecuentes, se encuentra la HTA previa del receptor, la obesidad, el tiempo de isquemia prolongado, el retardo de la función inicial del injerto, la estenosis de la arteria del injerto, la estenosis ureteral, la nefropatía crónica del injerto, las fístulas post-biopsia renal.
Las causas pueden variar de acuerdo al momento posttrasplante en que se presenta la hipertensión; la presentación en el período post-trasplante inmediato se debe generalmente a sobrecarga de volumen, disfunción del injerto por isquemia, rechazo agudo, o por inhibidores de la calcineurina. Revirtiendo el rechazo, controlando la sobrecarga de volumen y ajustando la dosis de los inhibidores de la calcineurina, la presión arterial generalmente se estabiliza12.
Hipertensión del receptor. La HTA previa del receptor es considerada como factor de riesgo importante en la HTA post-trasplante. Para algunos autores es el principal factor de riesgo en el desarrollo de HTA25.
Efecto presor de riñones nativos. Es una causa conocida de HTA post-trasplante, con aumento de secreción de renina y activación simpática, motivo por el cual se recomendaba la nefrectomía bilateral en el momento del trasplante. Actualmente, se ha dejado de lado esta práctica a raíz de algunos estudios que han demostrado que no mejora el control de la presión arterial2,27.
Estenosis de la arteria renal. Es importante reconocer esta complicación, debido a que es una causa corregible de HTA. Aunque puede presentarse en cualquier momento evolutivo, generalmente se hace presente entre el tercer mes y los dos años post-trasplante19.
Los factores de riesgo para la estenosis de la arteria renal trasplantada son dificultades en la técnica quirúrgica, enfermedad aterosclerótica, infección por citomegalovirus, retardo en la función del injerto. En un estudio retrospectivo se observó un riesgo aumentado de estenosis en forma significativa asociado a infección por citomegalovirus (41% versus 12%), y retardo en la función del injerto (48% versus 16%)20.
La incidencia de la estenosis de la arteria renal es difícil de evaluar, debido a las discrepancias en los criterios diagnósticos y en la definición de lesiones hemodinámicamente significativas20; no obstante, se estima una incidencia del 1% al 23%.
El deterioro rápido de la función renal, en pacientes que reciben inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de angiotensina II (ARA II), debe hacer sospechar este diagnóstico.
Si bien la arteriografía sigue siendo el gold standard en el diagnóstico, la ecografía Doppler en manos experimentadas tiene alta sensibilidad y especificidad21; la resonancia magnética nuclear, la arteriografía con tomógrafo helicoidal y el radiorrenograma radioisótopo son técnicas diagnósticas alternativas válidas.
La angioplastia, con o sin stent, es una opción de tratamiento con más del 80% de éxito, aunque presenta un 20% aproximadamente de re estenosis, en estos últimos casos se aconseja la colocación de un stent. El tratamiento quirúrgico está indicado en estenosis con extensa fibrosis, hipertensión arterial resistente y enfermedad arterioesclerótica proximal. Tiene éxito en el 60-90% de los casos22. La falta de adherencia al tratamiento crónico en los pacientes trasplantados es un factor importante de falla del injerto tardío, rechazo tardío, y muerte del paciente. Se estima que la no adherencia oscila alrededor del 50% para el tratamiento antihipertensivo, y del 2 al 26% para las drogas inmunosupresoras23,24.
Varios factores como: pacientes jóvenes, mal soporte familiar, bajo recursos, creencias y motivaciones del paciente y tratamientos complejos se observan con mayor frecuencia en la falta de adherencia. La simplificación del tratamiento, consultas más frecuentes e información sencilla ayudan a mejorarla.
Impacto de la presión arterial sobre la función del injerto
La HTA juega un rol importante en forma negativa sobre la función y sobrevida del injerto, así como del propio paciente. En un trabajo realizado por Opelz y colaboradores sobre 29.751 pacientes trasplantados renales, con un seguimiento promedio de 7 años, se demostró una correlación entre la presión arterial y la sobrevida del injerto, considerando a la HTA como factor de riesgo independiente sobre la función del injerto28. En otro estudio más reciente, Mange y col. demostraron que las presiones arteriales sistólica, diastólica y media al año del trasplante son un claro predictor de la función a largo plazo del éxito del mismo. Luego de ajustar los datos a la función renal, concluyen que aumenta un 30% la falla del injerto por cada 10 mm Hg de aumento de la presión arterial media29.
Complicaciones cardiovasculares luego del trasplante renal
La hipertensión arterial es uno de los factores de riesgo tradicionales que contribuyen en la alta incidencia de enfermedad cardiovascular entre los trasplantados renales30. Aunque el trasplante renal aumenta la expectativa de vida de los pacientes en 10 ó 20 años, la sobrevida de éstos está acortada por enfermedad arterioesclerótica cardiovascular. El riesgo anual de muerte por eventos cardiovasculares es del 3,5% al 5% en receptores de trasplante renal, el cual es 50 veces más alto que la población general. La insuficiencia cardíaca congestiva es 3 veces más alta en trasplantados comparado con la población general. El síndrome coronario agudo tiene alta incidencia en el período post-trasplante temprano, siendo la causa de muerte en alrededor del 30%, aproximadamente31.
Diagnóstico
El diagnóstico de HTA hecho sobre controles de consultorio o por el monitoreo ambulatorio de la presión arterial (MAPA) permanece en debate14. El MAPA ha demostrado utilidad para algunas particularidades de estos pacientes32:
a) Hasta el 90% de los pacientes trasplantados no presenta un adecuado descenso nocturno (non-dipper) de la presión arterial.
b) La hipertensión de guardapolvo blanco está presente entre el 12% y el 32% de los pacientes trasplantados.
c) El MAPA es más eficaz en predecir lesiones en órganos diana, como hipertrofia ventricular izquierda (HVI) y progresión de enfermedad renal en trasplantados33.
A pesar de estas observaciones, la verdadera utilidad del MAPA se verá cuando existan más estudios prospectivos con mayor número de pacientes trasplantados.
Tratamiento. Objetivos
Se debe controlar los factores de riesgo modificables del paciente, como peso, tabaquismo, dislipidemia, sedentarismo, varios de ellos componentes del síndrome metabólico, observado muy frecuentemente en estos pacientes, para reducir los eventos cardiovasculares.
El JNC VII (The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure) recomienda iniciar el tratamiento antihipertensivo con cifras por encima de 140 mm Hg de sistólica y 90 mm Hg de diastólica o mayores de 130/80 mm Hg en pacientes diabéticos o con enfermedad renal crónica15. The National Kidney Foundation Task Force recomienda una presión arterial menor de 135/85 mm Hg para los pacientes trasplantados renales sin proteinuria, y menor de 125/75 mm Hg para los que presentan proteinuria16. Las guías de The National Kidney Foundation (Kidney Desease Outcome Quality Initiative -KDOQI-) recomiendan como objetivo tensional en los pacientes trasplantados renales menos de 130/80 mm Hg17.
El control de la presión arterial (<130/80 mm Hg) en los hipertensos post-trasplante renal es pobre. En un reciente estudio, realizado con MAPA dentro del año post-trasplante, solamente el 5% de los pacientes estaban normotensos18.
El objetivo del tratamiento es reducir la injuria al riñón trasplantando y evitar las complicaciones cardiovasculares. No existe una clase de drogas antihipertensivas sobre otras como primera elección, si bien los bloqueantes cálcicos, IECA y ARA II son los más utilizados, los beta bloqueantes (BB) y diuréticos permanecen como arsenal terapéutico complementario.
Pacientes que ingieren inhibidores de calcineurina
Antes de iniciar el tratamiento con una droga antihipertensiva, se debe ajustar la dosis de las drogas inmunosupresoras. Si aún persiste la HTA se podría iniciar con:
Bloqueantes de canales cálcicos (BCC). Muchos médicos prefieren a los BCC como droga de elección; además de su efecto antihipertensivo eficaz, minimiza la vasoconstricción producida por la ciclosporina. En una revisión reciente de 29 estudios con 2.262 pacientes que compararon BCC con placebo o sin tratamiento y 7 estudios con 405 pacientes que compararon BCC con IECA, encontraron que el BCC es más efectivo como agente antihipertensivo34.
Los BCC pueden tener interacciones medicamentosas con drogas como: ciclosporina, tacrolimus, sirolimus, everolimus. Verapamilo, diltiazem, nicardipina, en menor grado amlodipina y no así nifedipina ni isradipina, disminuyen el metabolismo de ciclosporina y tacrolimus, aumentando su concentración plasmática.
IECA - ARA II. El rol de estos medicamentos en pacientes trasplantados renales, no está definido. En una reciente revisión, no pudieron demostrar que sean superiores a otras drogas, a pesar de todo su potencial beneficio, más allá del descenso de la presión arterial35-36. Ciclosporina y tacrolimus aumentan la concentración sérica de potasio por disminución de su excreción renal, este efecto podría ser potenciado por los IECA al disminuir las concentraciones de aldosterona. Se deberían evitar estas drogas cuando el potasio sérico es superior a 5 mEq/L.
En pacientes trasplantados, los IECA pueden inducir anemia, con caída del 5-10% del hematocrito37; este efecto podría ser potenciado por ciclosporina. No se conoce exactamente los mecanismos de estos efectos, pero podrían ser los mismos por lo cual se indica IECA a la eritrocitosis post-trasplante26.
Se esperan con urgencia ensayos prospectivos con mayor número de pacientes para definir el rol de estos medicamentos en este grupo de pacientes.
Los pacientes que no están tratados con inhibidores de calcineurina, podrían recibir BCC, IECA, ARA II, BB como droga inicial, asociado si es necesario a un diurético para controlar la sobrecarga de volumen.
Hipertensión arterial en trasplante hepático
El trasplante hepático es la indicación médica frecuente en las enfermedades hepáticas en estadios avanzados y en insuficiencia hepática fulminante; con los avances en el manejo médico y las técnicas quirúrgicas se ha logrado prolongar la sobrevida del injerto y del paciente en los últimos años en el trasplante hepático ortotópico (THO); no obstante, la sobrevida a los 5 años es del 85%, y los 10 años del 70%38.
La mortalidad temprana (dentro del primer año del THO) ha disminuido y es producida por infecciones, complicaciones quirúrgicas, fallo del injerto por disfunción primaria o rechazo. Las complicaciones tardías están aumentando y es producido por complicaciones cardiovasculares, alteraciones metabólicas, compromiso renal, enfermedad recurrente o tumores3.
La HTA es una de las más frecuentes complicaciones tardías del trasplante, y un factor de riesgo mayor para eventos cardiovasculares. La hipertensión arterial de novo en THO se considera cuando las cifras tensionales superan 140/90 mm Hg, en pacientes normotensos antes del trasplante. Su prevalencia excede el 50% y varios trabajos lo sitúan entre el 75% y el 85%3. Muchos mecanismos parecen estar involucrados en la HTA, pero los inhibidores de la calcineurina y el tratamiento con esteroides son causas importantes de ésta.
Cambios hemodinámicos portal y sistémico en pacientes trasplantados con cirrosis
Los pacientes con cirrosis presentan alteraciones en su función circulatoria, debido a una disminución de la resistencia vascular sistémica producido por vasodilatación arterial esplácnica, disparada por la hipertensión portal (HP). La causa de esta vasodilatación es por aumento en la actividad o la producción de sustancias vasodilatadoras (óxido nítrico, monóxido de carbono y cannabinoides endógenos), volcados a la circulación esplácnica39.
En estadios tempranos de cirrosis, cuando la HP es moderada, un aumento del trabajo cardíaco compensa la disminución de la resistencia vascular periférica, llevando el volumen sanguíneo arterial efectivo y la presión arterial cercana a límites normales (Figura 2)39.

Figura 2. Patogénesis de alteraciones de la circulación sistémica e insuficiencia renal en la cirrosis.
En cirrosis más avanzadas, la resistencia vascular periférica está marcadamente reducida y un mayor aumento del gasto cardíaco no logra compensar la presión arterial, poniéndose en juego mecanismos vasoconstrictores como el SRAA, el sistema nervioso simpático y finalmente la producción no osmótica de hormona antidiurética. Estos mecanismos compensatorios tratan de mantener un volumen sanguíneo arterial efectivo y una presión arterial cercana a lo normal, pero con efectos sobre la función renal, con retención de sodio y agua, que pueden llevar a la producción de ascitis y edemas, asociados a insuficiencia renal provocada por vasoconstricción renal e hipoperfusión.
La translocación bacteriana produce mayor producción de citoquinas pro-inflamatorias y de óxido nítrico, que se vuelca a la circulación esplácnica llevando a mayor vasodilatación (Figura 2)39.
En un estudio prospectivo, se ha demostrado que estas alteraciones hemodinámicas desaparecen después del THO. La resistencia periférica total y la presión arterial aumentan con la normalización de la función hepática y la presión portal y quizás también como efecto colateral de los inhibidores de la calcineurina40. Existen estudioscon resultados dispares con respecto al trabajo cardíaco, para algunos sigue aumentado con un estado hemodinámico hiperquinético, y otros muestran una normalización del trabajo cardíaco. Se demostró una recuperación total de la vasoconstricción renal luego del THO, con índices renales normales por Doppler interlobar al año del THO y con resistencia portal intrahepática y flujo portal también normalizados (Tablas 2 y 3).
Tabla 2. Datos hemodinámicos de pacientes pre y post trasplante hepático y controles40.

Tabla 3. Datos hemodinámicos esplácnicos pre y post trasplante y sujetos controles

Mecanismos de hipertensión arterial posttrasplante hepático
La HTA se manifiesta frecuentemente dentro de los primeros 6 meses post-THO, la vasoconstricción sistémica es la base por la cual se desarrolla ésta, pero los mecanismos que la producen no están todavía bien establecidos41.
El aumento de la renina plasmática se observa recién a partir de los 12 meses post-THO, en los primeros 4 meses permanece baja, aún en aquellos pacientes que desarrollan HTA42,43.
La endotelina-1 (ET1) aumenta a partir de los primeros días del trasplante, y sería el responsable del aumento de la resistencia arterial periférica, por aumento de la rigidez arterial. Esto último se puede medir a través del estudio de la velocidad de la onda de pulso.
David Neal y colaboradores realizaron un estudio con 32 pacientes con THO, observando que a los 3 meses el 47% de los pacientes presentaba HTA y el 50% a los 6 meses. Los parámetros hemodinámicos del total de los pacientes se observan en la Tabla 441.
Tabla 4. Parámetros hemodinámicos antes, 1 mes y 3 meses del trasplante41
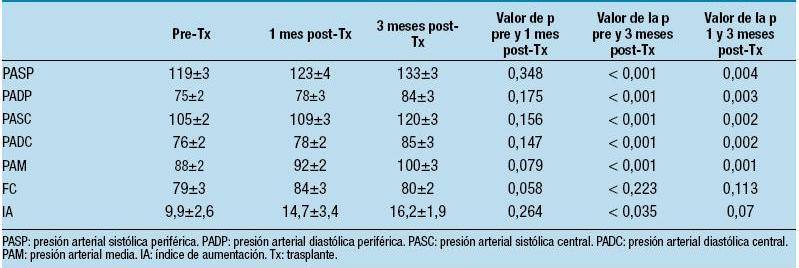
Los niveles plasmáticos de renina y aldosterona estaban elevados pre-trasplante, y descendieron en el post-trasplante a valores cercanos a lo normal, aún en aquellos pacientes que desarrollaron HTA. El SRAA no parece tener implicancia en el desarrollo de la hipertensión en los primeros 12 meses post-trasplante (Tabla 5).
Tabla 5. Comparación de los niveles de renina, aldosterona y ET 1 antes, al mes, 3 meses y 6 meses post-THO41.

El índice de aumentación elevado en la onda de pulso es reflejo de la rigidez arterial, y estaba aumentado en los pacientes pre-THO que posteriormente desarrollaron HTA, al igual que los promedios de presión arterial pre-THO. No obstante, debido al número pequeño de la muestra, no se puede predecir que umbral de presión arterial pre-THO sirve como marcador de HTA post-trasplante. Los pacientes con presión arterial media elevada pre-THO tienen menor vasodilatación y son más propensos a desarrollar HTA post-trasplante (Tabla 6).
Tabla 6. Parámetros hemodinámicos pre-trasplante en pacientes que presentaron hipertensión a los 3 meses, comparados con los que permanecieron normotensos

Los niveles de endotelina tuvieron un descenso en las primeras 2 a 4 semanas post-trasplante, y luego aumentaron en aquellos pacientes que desarrollaron HTA a niveles pre-trasplante, indicando un rol importante de ésta en el desarrollo de HTA. Existen estudios en ratas que demuestran que los antagonistas de endotelina pueden prevenir la HTA producida por los inhibidores de la calcineurina, como así también la vasoconstricción de la arteria aferente renal.
Diagnóstico
Se aconseja iniciar tratamiento cuando las cifras tensionales superan 140/90 mm de Hg en HTA de novo, y 130/80 mm de Hg en los pacientes con riesgo cardiovascular o diabéticos44. En pacientes con proteinuria, al igual que en los trasplantes renales, se aconseja una presión arterial por debajo de 125/75 mm Hg45.
No existen grandes estudios que permitan aconsejar al MAPA como procedimiento diagnóstico en el THO, aunque al igual que en otros trasplantes, los pacientes presentan alteración del ritmo circadiano de la tensión arterial, como también HTA de guardapolvo blanco.
Tratamiento
El tratamiento no farmacológico es el mismo a todos los trasplantes, modificaciones del estilo de vida, normalización del peso, suspensión del tabaco, actividad física regular, disminución del consumo de sal.
Los BCC son las drogas más utilizadas, seguidas de los BB, entre ellos el carvedilol y bisoprolol, IECA, ARA II y diuréticos completan el arsenal terapéutico.
En un estudio realizado por Galiotto y colaboradores, comparando nifedipina con carvedilol, se demostró un control de la presión arterial con monoterapia en el 20% del grupo nifedipina y en el 33,3% del grupo carvedilol3. Al agregar un IECA, se logró el control en el 19% más en ambos grupos, sugiriendo que el eje renina-angiotensina tiene poco juego en la hipertensión del THO. Hubo mejor tolerancia en el grupo carvedilol, pero la dosis de tacrolimus debió ser ajustada en menos, confirmando las observaciones previas de que el carvedilol influye en la absorción de los inhibidores de la calcineurina a través de su efecto sobre una proteína de membrana46.
Hipertensión arterial en trasplante cardíaco
La insuficiencia cardíaca (IC) se ha convertido en una verdadera pandemia en este nuevo siglo; para los pacientes con IC terminal, el trasplante cardíaco es la única opciónde mejorar la sobrevida y la calidad de vida. Debido a esto, se ha extendido universalmente esta práctica a los pacientes con indicaciones de la misma53 (Tabla 7), como también la selección del donante54 (Tabla 8). El donante ideal no debe exceder más de un 25-30% de índice de masa corporal con respecto al receptor; no debe tener trauma torácico con herida penetrante cardíaca, ni debe tener una FE<0,50 por ecocardiograma, ni estar utilizando dosis altas de inotrópicos. La diabetes mellitus no controlada, como la HTA no controlada del donante, puede influir en la evolución desfavorable del injerto. El uso de donantesno óptimos vendrá determinado por la urgencia de la situación del receptor, y la aceptación de estos injertos deberá ser evaluada en forma individualizada por el equipo de trasplante53.
Tabla 7. Indicaciones de trasplante cardíaco

Tabla 8. Selección del donante para trasplante cardíaco

Es importante descartar causas reversibles de insuficiencia cardíaca, como abuso de alcohol, miocarditis linfocítica, sarcoidosis, taquicardia54.
Las causas etiológicas más frecuentes de trasplante cardíaco son las miocardiopatías y la enfermedad isquémica coronaria55.
Con las actuales drogas inmunosupresoras, mejor manejo de inmunoprofilaxis, y control de las infecciones se logra una sobrevida al año cercana al 90%1-47. En la actualidad, la combinación más utilizada de inmunosupresores es tacrolimus, micofenolato mofetil y prednisona55. En los primeros 6 meses de 2009, el 54% de los pacientes tras-plantados recibió inducción inmunosupresora, comparado con el 53% en el 2002, y el 38% en 1997. La mayoría de los pacientes recibió antagonistas de los receptores de interleukina 2 (IL2R) (27%), y anticuerpos antilinfocíticos policlonales (23%)55.
Este avance en el manejo de la inmunosupresión, tratando de evitar el rechazo agudo y crónico, trae aparejado por otra parte mayores complicaciones de la misma como las infecciones oportunistas bacterianas, micóticas y virales, como así también los efectos colaterales de las mismas. Sin embargo, después del trasplante se observan importantes cambios fisiopatológicos que llevan a complicaciones tardías que complican la sobrevida del injerto y del paciente47 (Tabla 9).
Tabla 9. Complicaciones tardías del trasplante cardíaco

En los pacientes con insuficiencia cardíaca, la activación neurohormonal juega un rol importante en el pronóstico y progresión de la enfermedad; cabría esperar una reducción de los mismos luego del trasplante; sin embargo, se observa una marcada reducción de los péptidos vasodilatadores (adrenomedulina y PNA), no así de los vasoconstrictores como angiotensina II, noradrenalina y ET 1, que descienden lentamente, hallándose concentraciones elevadas de angiotensina II en el 50% de los pacientes al año del trasplante48.
Es posible que estas concentraciones elevadas de sustancias vasoconstrictoras predispongan a la aparición de edemas, HTA, disfunción endotelial, persistencia de la hipertensión pulmonar.
La hipertensión arterial post-trasplante cardíaco es una complicación importante, con una incidencia anual del 17% y una prevalencia en el seguimiento del 95%1-49. En un estudio realizado en la Argentina, se observa una incidencia de HTA en el 69% de los pacientes trasplantados cardíacos, con un seguimiento de 16 años50 (Tabla 10).
Tabla 10. Factores predisponentes de hipertensión post-trasplante cardíaco

Se considera hipertensión arterial a valores por encima de 140/90 mm Hg. Los factores predisponentes para la aparición de la misma son varios51. El tabaquismo, la miocardiopatía dilatada, receptor y donante masculino, la hipercolesterolemia, la edad y la insuficiencia renal son los factores más importantes. Los inhibidores de la calcineurina y los esteroides juegan un rol importante en el desarrollo de HTA post-trasplante.
El tabaquismo es un factor de riesgo independiente en la sobrevida del injerto y en el desarrollo de HTA posttrasplante. Se considera disfunción renal a valores de creatinina por encima de 1,4 mg%51.
Al igual que en los trasplantes comentados anteriormente, hay alteración del ritmo circadiano, con falta de descenso nocturno la presión arterial.
Tratamiento
Al igual que cualquier paciente hipertenso, las modificaciones del estilo de vida son importantes, principalmente la restricción de sal en este tipo de pacientes52.
Los bloqueantes cálcicos son las drogas más usadas para el tratamiento, seguidos de los IECA y ARA II49. El carvedilol puede elevar las concentraciones de ciclosporina, nopor acción a través del citocromo P 450, sino por inhibir la actividad de una enzima de membrana (glicoproteína P) a nivel intestinal, aumentado su absorción46.
Los pacientes con hipertensión arterial previa al trasplante, son más difíciles de controlar en el post-trasplante, requiriendo un mayor número de drogas para su control49.
Conclusiones
La hipertensión arterial en los pacientes trasplantados tiene una alta incidencia, y es uno de los factores de riesgo más importante para la sobrevida del injerto y del paciente. Los inhibidores de la calcineurina son drogas que han ayudado a prolongar la sobrevida de los injertos, pero la hipertensión arterial es un efecto colateral no deseado muy frecuente. Se espera el desarrollo de nuevas drogas inmunosupresoras con menores efectos colaterales.
Existen en la actualidad varios temas no muy claros en estos pacientes, por ejemplo, las cifras tensionales a partir de la cual consideramos hipertensión arterial, por ahora no hay uniformidad de criterios en la población trasplantada en general, a pesar de que en los trasplantes renales se está avanzando en su definición. Otro punto por aclarar es la utilidad del MAPA como herramienta diagnóstica; también se están desarrollando estudios para establecer su verdadero peso.
Por el momento, los bloqueantes cálcicos son las drogas más utilizadas en el tratamiento, quizás por contrarrestar los efectos de los inhibidores de la calcineurina, y por sus escasos efectos colaterales, no obstante, los IECA, y los ARA II están siendo utilizados cada vez con más frecuencia, al igual que el carvedilol.
1. Taylor DO, Edward LB, Boucek MM, Trulock EP, Aurora P, Christie J, et al. Registry of the International Society for Heart and Lung Transplantation: Twenty-fourth Official Adult Heart Transplant Report- 2007. J Heart Lung Transplant 2007;26:769- 81. [ Links ]
2. Domínguez-Gil B, Espejo B, Muñoz MA, Rodicio JL, Morales JM. Hipertensión arterial después del trasplante renal. Hipertensión 2002;9(2):80-90. [ Links ]
3. Galioto A, Sempli A, Zanus G, Fasolato S, Sticca A, Boccagni P, et al. Nifedipine versus carvedilol in the treatment of de novo arterial hypertension after liver transplantation: results of a controlled clinical trial. Liver Transplant 2008;14:1020-1028. [ Links ]
4. Benten D, Staufer K, Sterneck M. Orthotopic liver transplantation and what to do during follow-up: recommendations for the practitioner. Nat Clin Pract Gastroenterol Hepatol 2009;6(1):23-36. [ Links ]
5. Koomans HA, Ligtenberg G. Mechanisms and consequences of arterial hypertension after renal transplantation. Transplantation 2001;72(6 Suppl):S9-S12. [ Links ]
6. Plosker GL, Foster RH. Tacrolimus: a further uptodate of its pharmacology and therapeutic use in the management of organ transplantation. Drugs 2000;59(2):323-89. [ Links ]
7. Textor SC, Weisner R, Wilson DJ, Porayko M, Romero JC, Burnett JC Jr, et al. Sistemic and renal hemodynamic differences between FK 506 and ciclosporine in liver transplant recipients. Transplantation 1993;55:1332-7. [ Links ]
8. Mayer AD, Dmitrewski J, Squifflet JP, Besse T, Grabensee B, Klein B, et al. Multicenter randomized trial comparing tacrolimus (FK 506) and cyclosporine in the prevention of renal allograft rejection. A report of the European Tacrolimus Multicenter Renal Study Group. Transplantation 1997;64:436-43. [ Links ]
9. Pirsch JD, Miller J, Deierhoi MH, Vincenti F, Filo RS. A comparasion tacrolimus (FK506) and cyclosporine for immunosupression after cadaveric renal transplantation. Transplantation 1997; 63: 977-83. [ Links ]
10. Ligtenberg G, Gene RJ, Blankestijn PJ, Koomans HA. Cardiovascular risk factors in renal transplant patients: ciclosporin A vs tacrolimus. J Am Soc Nephrol 2001;12(2):368-73. [ Links ]
11. Taler SJ, Textor SC, Canzanello VJ, Schwartz L, Porayko M, Wiesner RH, Krom RA. Role of steroid dose in hypertension early after liver transplantation with tacrolimus and ciclosporine. Transplantation 1996;62:1588-92. [ Links ]
12. Magee CC. Pharmacology and side effects of cyclosporine and tacrolimus. UpToDate (cited 2010 March). Available from: http://www.uptodate.com/contents/pharmacology-and-sideeffects-of-cyclosporine-and-tacrolimus [ Links ]
13. Marin IR. Conducta ante una hipertensión arterial inducida por ciclosporina o tacrolimus. En: Coca A, Aranda P, Redón J. Manejo del paciente hipertenso en la práctica clínica. 1ª edición. Buenos Aires, Editorial Médica Panamericana, 2009. Cap 25, p 273-278. [ Links ]
14. Castillo-Lugo JA, Vergne-Marini P. Hypertension in kidney transplantation. Semin Nephrol 2005;25:252-260. [ Links ]
15. Chobanian AV, Bakris GL, Black HL, Cushman WC, Green LA, Izzo L jr, et al. Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. Hypertension 2003;42:1206-52. [ Links ]
16. Mailloux LU, Levey AS. Hypertensión in patients with cronic renal disease. Am J Kidney Dis 1998;32 (Suppl 3):120-141. [ Links ]
17. National Kidney Foundation. K/DOLQ clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am J Kidney Disease 2004;43(Suppl 1):176-182. [ Links ]
18. Paoletti E, Gherzi M, Amidone M, Massarino F, Cannella G. Association of arterial hypertension with renal target organ damage in kidney transplant recipients: the predictive role of ambulatory blood pressure monitoring. Transplantation 2009;87(12):1864-9. [ Links ]
19. Bruno S, Remuzzi G, Ruggenenti P. Transplant renal artery stenosis. J Am Soc Nephrol 2004;15(1):134-41. [ Links ]
20. Audard B, Matignon M, Hemery F, Snanoudi R, Desgranges P, Anglade MC, Kobeiter H. Risk factors and long-term outcome of transplant renal artery stenosis in adults recipients after treatment by percutaneous transluminal angioplasty. Am J Transplant 2006; 6(1):95-9. [ Links ]
21. O'neill WC, Baumgarten DA. Ultrasonography in renal transplantation. Am J Kidney Dis 2002;39(4):663-78. [ Links ]
22. Fervenza FC, Lafayette RA, Alfrey EJ, Petersen J. Renal artery stenosis in kidney transplant. Am J Kidney Dis 1998;31(1):142-8. [ Links ]
23. Butler JA, Roderick P, Mullee M, et al. Frequency and impact of non-adherence to immunosuppressant after kidney transplantation: a systematic review. Transplantation 2004;77:769-789. [ Links ]
24. Loghman-Adhams M. Medication noncompliance in patients with chronic disease: issues in dialysis and renal transplantation. Am J Manag Care 2003;9:155-171. [ Links ]
25. Budde K, Waiser J, Fritsche L, et al. Hypertension in patients after renal transplantation. Transplant Proc 1997;29:209-211. [ Links ]
26. Vella J, Brennan DC. Hypertension after renal transplantation. Up To Date (cited 2010 March). Available from: http://www.uptodate.com/contents/hypertension-after-renal-transplantation. [ Links ]
27. Midrvedt K, Hartmann A, Bentdal O, et al. Bilateral nephrectomy simultaneously with renal allografting does not alleviate hypertension 3 months following living-donor transplantation. Nephrol dial transplant 1996;11:2045-49. [ Links ]
28. Opelz G, Wujciak t, Ritz E. Association of chronic kidney graft failure with recipient blood pressure. Kidney Int 1998;53:217-222. [ Links ]
29. Mange KC, Cizman B, Joffe M, et al. Arterial hypertension and renal allograft survival. JAMA 2000;283(5):633-638. [ Links ]
30. Wheeler DC, Steiger J. Evolution and etiology of cardiovascular disease in renal transplant recipients. Transplantation 2000;70(Suppl):41-45. [ Links ]
31. Ojo AO. Cardiovascular complications after renal transplantation and their prevention. Transplantation 2006;82(5):603-611. [ Links ]
32. Mion D, Koch VH, Geraldo Pierin AM, Da Silva GV. Uso de monitorización ambulatoria de la presión arterial en poblaciones especiales. Uso de MAPA en Pacientes trasplantados. En: Coca A, Mion D, Pickering T, Ramos F. Manual de monitorización ambulatoria de la presión arterial y técnicas afines. Madrid; ACINDES, 2007. p 88-89. [ Links ]
33. Fernandez-Vega FF, Tejada F, Baltar J, Laures A, Gómez E, Alvarez J. Ambulatory blood pressure after renal transplantation. Nephrol Dial Transplant 2001;16(Suppl 1):110-113. [ Links ]
34. Cross NB, Webster AC, Masson P, O' Connell PJ, Craig JC. Antihypertensive treatment for Kidney transplant recipients. Cochrane Database Syst Rev 2009;(3):CD 003598. [ Links ]
35. Morath C, Schmied B, Mehrabi A, Weitz J, Schmidt J, Werner J, et al. Angiotensin-converting enzyme inhibitors and angiotensin II type 1 receptor blockers after renal transplantation. Clin Transplant 2009;23(Supl 21):33-36. [ Links ]
36. Hiremath S, Fergunsson D, Doucette S, Mulay AV, Knoll GA. Renin angiotensin system blockade in kidney transplantation: a systematic review of the evidence. Am J Transplant 2007;7:2350-2360. [ Links ]
37. Vlahakos DV, Canzanello BJ, Madaio MP, Madias NE. Enalapril associated anemia in renal transplant recipients treated for hypertension. Am J Kidney Dis 1991;17(2):199-205. [ Links ]
38. Rabkin JM, de La Melena V, Orloff SL, Corless CL, Rosen HR, Olyaei AJ. Late mortality after orthotopic liver transplantation. Am J Surg 1991;181:475-479. [ Links ]
39. Ginés P, Schrier RW. Renal failure in cirrhosis. N Engl J Med 2009;361:1279-90. [ Links ]
40. Piscaglia F, Zironi G, Giani S, Mazziotti A, Cavallari A, Gramantieri L, Valgimiri M, Bolondi L. Systemic and splanchnic hemodynamic changes after liver transplantation for cirrhosis: a long-term prospective study. Hepatology 1999;30(1):58-64. [ Links ]
41. Neal DA, Brown MJ, Wilkinson IB, Alexander GJ. Mechanisms of hypertension after liver transplantation. Transplantation 2005;79:935-940. [ Links ]
42. Julien F, Farge D, Kreft-Jais C, et al. Cyclosporine induced stimulation of the renin angiotensin system after liver and heart transplantation. Transplantation 1993;56:885-890. [ Links ]
43. Textor SC, Canzanello VJ, Taler SJ, et al. Activation of the renin-angiotensin system and sustained endothelin release two years after liver transplantation. Circulation 1994;90:123. [ Links ]
44. Muñoz SJ, El Genaidi H. Cardiovascular risk factors after liver transplantation. Liver Transpl 2005;11:S52-S56. [ Links ]
45. Mells G, Naubergerg J. Long-term care of the liver allograft recipient. Semin Liver Dis 2009;29:102-120. [ Links ]
46. Bader FM, Hagan ME, Crompton JA, Gilbert EM. The effect the of beta-blocker on cyclosporine level in cardiac transplant recipient. J Heart Lung Transpl 2005;24:2144-47. [ Links ]
47. Magaña-Serrano JA, Aguero-Sánchez J. Complicaciones crónicas del trasplante cardíaco. Implicaciones clínicas y estrategias futuras. Rev. Invest Clin 2005;57(2):338-343. [ Links ]
48. Pérez-Villa F, Roig E, Ferrer E, Cupoletti A, Llancaqueo M, Jiménez M, Sanz G. Activación neurohormonal en la insuficiencia cardíaca congestiva ¿Se normaliza después del trasplante cardíaco? Rev Esp Cardiol 2004;57(8):725-31. [ Links ]
49. Sánchez Lázaro IJ, Almenar Bonet L, Martínez Dolz L, Moro López J, Agüero Ramón-Llin J, Cano Pérez O, et al. Hypertension after heart transplantation: predictive factors and numbers and classes of drugs for its management. Transplantation Proceedings 2008;40:3051-3052. [ Links ]
50. Favaloro R, Peradejordi M, Bertolotti A, Diez M, Favaloro L, Gómez C, Martínez L, Moscoloni S. Results of heart transplantation: 16 years' experience in center in Argentina. Transplantation Proceedings 2010;42(1):321-323. [ Links ]
51. Sánchez Lázaro IJ, Almenar Bonet M, Martínez Dolz J, Moro López J, Agüero J, Ortiz Martínez V, Izquierdo MT, Salvador A. Predictor factors for the development of arterial hypertension following heart transplantation. Clin Transplant 2008; 22:760-764. [ Links ]
52. Singer DR, Markendu ND, Buckley MG, Miller MA, Sagnella GA, Lachno DR. Blood pressure and endocrine responses to changes in dietary sodium intake in cardiac transplant recipients: implications for the control of sodium balance. Circulation 1994;89:1153-1159. [ Links ]
53. Alonso-Pulpón L, Almenar L, Crespo MG, Silva L, Segovia J, Manito N, y col. Guías de actualización clínica de la Sociedad Española de Cardiología. Trasplante Cardíaco y de corazónpulmones. Rev Esp Cardiol 1999;52(10):821-839. [ Links ]
54. Pham M, Chen J, Berry G, Rose E, Schroeder J. Surgical treatment of the heart failure, cardiac transplantation, and mechanical ventricular support. In: Fuster V, O'Rourke RA, Walsh PA, poPoole-Wilson PA (eds) .Hurst's The Heart. 12th Edition. McGraw Hill, 2008;761-779. [ Links ]
55. Stehlik J, Edwards LB, Kucheryavaya AY, Aurora P, Christie JD, Kirk R, Dobbels F, et al. The Registry of the International Society for Heart and Lung Transplantation: Twenty-seventh official adult heart transplant rert - 2010. J Herat Lung Transplant 2010;29(10):1089-1103. [ Links ]














