Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.6 no.3 Ciudad Autónoma de Buenos Aires July/Sept. 2011
ARTÍCULO ORIGINAL
El ecocardiograma en la esclerodermia
Oscar Grosso1, Ariel K. Saad1, Verónica I. Volberg1, Eleonora Bresan2, Hugo Laborde2,C. Sara Berensztein1, Jorge Lerman1
1 División Cardiología. Hospital de Clínicas "José de San Martín". Universidad de Buenos Aires (UBA). Buenos Aires. República Argentina.
2 División Reumatología. Hospital de Clínicas "José de San Martín". Universidad de Buenos Aires (UBA). Buenos Aires. República Argentina.
Correspondencia: Dr. Ariel K. Saad.
Paraguay 5465 Piso 5º Depto.: "B". CP 1425. Ciudad de Buenos Aires. República Argentina.
Teléfono: 54-11-47760933.
E-mail: aksaad@arnet.com.ar
Recibido: 27/04/2011
Aceptado: 15/07/2011
Resumen
Marco teórico. La esclerosis sistémica es una enfermedad crónica caracterizada por afección microvascular y fibrosis tisular. El compromiso cardíaco es frecuente, pero se manifiesta clínicamente en un tercio de los casos y se asocia a peor evolución. El objetivo es describir las alteraciones ecocardiográficas en pacientes enfermos y compararlos con un grupo control.
Material y métodos. Se estudiaron 54 pacientes (57 ± 13 años; 93% sexo femenino) y 11 controles (48 ± 20 años; 80% de mujeres). Se les realizaron exámenes ecocardiográficos de acuerdo a recomendaciones de la Sociedad Americana de Ecocardiografía.
Resultados. El grupo esclerodermia presentó mayor tamaño del ventrículo derecho: 20,6 ± 4,5 mm vs 15,4 ± 4,3 mm; p=0,02. El análisis Doppler evidenció mayor presión sistólica pulmonar (27,3 ± 5,5 mm Hg vs 20,3 ± 3 mm Hg; p=0,0001) y menor tiempo eyectivo del ventrículo derecho (270 ± 57 mseg vs 333 ± 32 mseg; p=0,001) en el grupo de enfermos. El Doppler tisular reveló mayor tamaño de la onda A' del ventrículo izquierdo (15,3 ± 3,6 cm/ seg vs 12,7 ± 2,6 cm/seg; p=0,01), mayor tamaño de la onda A' del ventrículo derecho (17,6 ± 3,6 cm/seg vs 13,6± 3,4 cm/seg; p=0,001) con menor relación E'/A' (0,9 ± 0,39 vs 1,13 ± 0,18; p=0,01) en los pacientes portadores de colagenopatía.
Conclusiones. Los pacientes con esclerosis sistémica presentaron hallazgos que sugieren menor distensibilidad ventricular como consecuencia probable de la mayor presión pulmonar y de la afectación intrínseca del miocardio.
Palabras clave: Esclerodermia; Ecocardiografía Doppler; Función diastólica; Hipertensión pulmonar
Summary
Echocardiogram in scleroderma
Background. Scleroderma is an infrequent and chronic collagen vascular disease characterized by the vascular engagement of the small arteries and tisular fibrosis. Cardiac manifestations, though common, are present in only one third of the patients and there are associated to a deleterious outcome. The aim of this study was to describe the echocardiographic features present in patients with scleroderma and compare them with a control group.
Methods. Fifty four patients with scleroderma (57 ± 13 years; 93% female sex) and 11 normal patients (48 ± 20 years; 80% female sex) were included. Echocardiographic studies were achieved following the American Society of Echocardiography guidelines.
Results. Patients with scleroderma had larger right ventricles: 20.6 ± 4.5 mm vs 15.4 ± 4.3 mm; p=0.02. Doppler analysis showed a greater systolic pulmonary pressure (27.3 ± 5.5 mm Hg vs 20.3 ± 3 mm Hg; p=0.0001) and a shorter right ventricle ejective time (270 ± 57 ms vs 333 ± 32 ms; p=0.001) in the scleroderma group. Tisular Doppler revealed a greater left ventricular A' wave (15.3 ± 3.6 cm/sec vs 1.7 ± 2.6 cm/sec; p=0.01), a taller right ventricle A'wave (17.6 ± 3.6 cm/sec vs 13.6 ± 3.4 cm/sec; p=0.001) and a smaller E'/A' ratio (0.9 ± 0.39 vs 1.13 ± 0.18; p=0.01) in patients with scleroderma.
Conclusions. Patients with scleroderma had a larger right ventricle and higher pulmonary pressure. The tisular Doppler findings suggest a lesser ventricular distensibility. It may be a consequence of the greater pulmonary pressure and the intrinsic myocardial damage.
Keywords: Scleroderma; Doppler echocardiography; Diastolic function; Pulmonary hypertension
Resumo
O ecocardiograma na esclerodermia
Introdução. A esclerose sistêmica é uma doença crônica caracterizada por fibrose microvascular e tecida. As manifestações cardíacas são comuns, mas estão presentes em apenas um terço dos pacientes e estão associadas a piores resultados. O objetivo deste estudo foi descrever as características ecocardiográficas presentes em pacientes com esclerodermia em comparação com um grupo controle.
Material e métodos. Foram estudados 54 pacientes (57 ± 13 anos, 93% do sexo feminino) e 11 controles (48 ± 20 anos, 80% mulheres). Os exames ecocardiográficos foram realizados de acordo com recomendações da Sociedade Americana de Ecocardiografia.
Resultados. O grupo esclerodermia mostrou ventrículo direito maior: 20,6 ± 4,5 mm vs 15,4 ± 4,3 mm, p=0,02. A Ecocardiografia Doppler revelou aumento da pressão sistólica pulmonar (27,3 ± 5,5 mm Hg vs 20,3 ± 3 mm Hg; p=0,0001) e menor tempo de ejeção do ventrículo direito (270 ± 57 mseg vs 333 ± 32 mseg, p=0,001) no grupo de pacientes com esclerodermia. O Doppler tissular revelou aumento do tamanho da onda A' do ventrículo esquerdo (15,3 ± 3,6 cm/seg vs 12,7 ± 2,6 cm/seg; p=0,01), aumento do tamanho da onda A' do ventrículo direito (17,6± 3,6 cm/seg vs 13,6± 3,4 cm/seg; p=0,001) com menor E'/A' (0,9 ± 0,39 vs 1, 13 ± 0,18; p=0,01) em pacientes com doença de colágeno.
Conclusões. Pacientes com esclerose sistêmica apresentou os resultados sugerindo menor distensibilidad ventricular, como conseqüência provável da maior pressão pulmonar e os danos intrínsecos do miocárdio.
Palavras-chave: Esclerodermia; Ecocardiografia Doppler; Função diastólica; Hipertensão pulmonar
Introducción
La esclerosis sistémica (ES) o esclerodermia sistémica es una enfermedad crónica del tejido conectivo que se caracteriza por afección vascular de pequeños vasos y fibrosis tisular que involucra tanto la piel como otros órganos internos y ocurre como resultado de una interacción de factores genéticos, autoinmunes y ambientales (tóxicos o infecciosos) no del todo aclarada1. Si bien es de presentación relativamente infrecuente, se relaciona con una significativa morbimortalidad.
La afectación cardíaca puede ocurrir tanto a nivel de endocardio, miocardio y/o pericardio y ocurre en algún grado en prácticamente la totalidad de los pacientes con esta enfermedad. No obstante, sólo entre un 8 y un 28% de los enfermos tendrá alguna manifestación clínica, y cuando esto sucede el pronóstico es peor, constituyendo una de las principales causas de mortalidad2-5.
La prevalencia de compromiso cardíaco en los diferentes estudios varía según la sensibilidad de los métodos usados para su detección2 y puede ocurrir como consecuencia del desarrollo de hipertensión pulmonar (en ocasiones asociada a patología del parénquima pulmonar o a vasoespasmo de la microvasculatura pulmonar), hipertensión arterial sistémica vinculada o no a daño renal, y por lesión tisular intrínseca debido a la alteración microvascular6-7.
El Doppler tisular (DT) es una modificación del Doppler pulsado tradicional, que permite medir los movimientos de la pared ventricular que se caracterizan por ser de baja velocidad y gran amplitud (a diferencia de la sangre). Por lo tanto, esta técnica permite detectar anomalías a nivel del tejido miocárdico de manera más precoz y con una mayor sensibilidad, lo que podría permitir el uso temprano de medidas terapéuticas potencialmente beneficiosas. Actualmente, constituye un estudio rutinario en la mayoría de los laboratorios de ecocardiografía.
El objetivo del presente estudio es describir las alteraciones ecocardiográficas en una población de pacientes con criterios diagnósticos de ES y compararlos con un grupo control.
Material y métodos
Estudio descriptivo de corte transversal, de carácter retrospectivo, que se llevó a cabo entre Enero de 2008 y Mayo de 2010. Los criterios de inclusión fueron pacientes mayores de 18 años evaluados en forma consecutiva por la División Reumatología del Hospital de Clínicas "José de San Martín" (UBA, Buenos Aires, Rep. Argentina) con diagnóstico de ES de acuerdo a los criterios del Colegio Americano de Reumatología8. Dichos pacientes aceptaron participar mediante la firma del correspondiente consentimiento informado.
Se excluyeron los pacientes portadores de cardiopatía estructural de cualquier etiología (isquémica, hipertrófica, valvular, idiopática, etc.), valvulopatías de grado moderado o grave, como así también los que presentaban antecedentes de fibrilación auricular, diabetes mellitus e hipertensión pulmonar.
Los resultados se compararon con un grupo control teniendo en cuenta el sexo, la edad y factores de riesgo para enfermedad cardiovascular, seleccionados entre individuos que solicitaron una evaluación de rutina en los consultorios externos de la División Cardiología del Hospital de Clínicas "José de San Martín" (UBA, Buenos Aires, Rep. Argentina).
Todos los pacientes fueron evaluados desde el punto de vista clínico mediante una completa anamnesis y examen físico. Se solicitaron los siguientes estudios complementarios: laboratorio de análisis clínicos que desde el punto de vista inmunológico incluía la detección del factor antinuclear, anticuerpos anti-centrómero y anti-Scl70, electrocardiograma y ecocardiograma Doppler.
La evaluación ecocardiográfica se llevó a cabo en el Laboratorio de Ecocardiografía de la División Cardiología del Hospital de Clínicas "José de San Martín" (UBA, Buenos Aires, Rep. Argentina) con un ecocardiógrafo ATL 3000. La evaluación de los diámetros y espesores cavitarios, como así también de los flujos transvalvulares, se realizó de acuerdo a las recomendaciones de la Sociedad Americana de Ecocardiografía9. Se analizaron: diámetro diastólico del ventrículo izquierdo (VI), diámetro diastólico del ventrículo derecho (VD), fracción de acortamiento, espesor diastólico del septum interventricular, espesor diastólico de la pared posterior del VI, área de la aurícula izquierda, área de la aurícula derecha, excursión sistólica del plano del anillo mitral y excursión sistólica del plano del anillo tricuspídeo. La evaluación Doppler de la función diastólica incluyó a nivel mitral y tricuspídeo el registro de las velocidades pico de las ondas E (llenado precoz) y A (llenado tardío) y la relación entre ambas (E/A), como así también se estimó la presión sistólica pulmonar en base al gradiente de insuficiencia tricuspídea y a la presión de la aurícula derecha estimada por el tamaño de la vena cava inferior y su grado de colapso con la inspiración. El análisis del DT se realizó a nivel de los sectores laterales de los anillos mitral (ventrículo izquierdo) y tricuspídeo (ventrículo derecho), mediante la medición de la velocidad pico de la onda sistólica (S), la onda diastólica precoz (E'), la onda diastólica tardía (A') y la relación E'/A'. Como estimación de las presiones de llenado en ambos ventrículos se utilizó la relación E/E'10. Los autores poseen acceso completo a los datos y toman la responsabilidad de su integridad. Todos los autores han leído y acuerdan con el manuscrito que a continuación se reporta.
Análisis estadístico
Para el almacenamiento de los datos se utilizó el programa Microsoft Office Excel 2007©. El análisis se realizó empleando el paquete estadístico del programa Statistix 8.0©.
Para todas las variables se estableció la distribución de frecuencias y/o porcentajes en relación con el total de casos y los valores se expresaron como media, desvío estándar y proporciones. Para las variables continuas se utilizó el test de t o de Mann-Whitney según correspondiera. Para las proporciones, se utilizó el test exacto de Fischer o Chi2. Se consideró como diferencia significativa una p <0,05.
Resultados
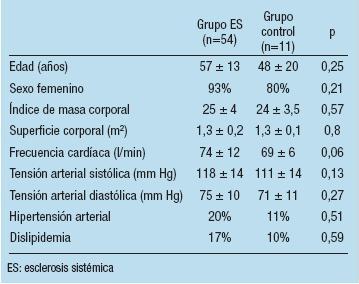
Se estudiaron 54 pacientes con diagnóstico de ES (edad media 57 ± 13 años; 93% sexo femenino) y 11 pacientes controles (edad media 48 ± 20 años; 80% de mujeres). De los pacientes con la enfermedad, 45 de ellos presentaban la forma limitada (83%) y 9 la difusa (17%). El 96% de los pacientes con ES tenían factor antinuclear positivo. No se observaron diferencias significativas en los resultados del resto de los análisis clínicos. Tampoco hubo discrepancias entre ambos grupos en lo que respecta a superficie corporal, índice de masa corporal y factores de riesgo cardiovascular. Se observó una tendencia a mayor frecuencia cardíaca y tensión arterial en los pacientes con diagnóstico de ES. Las características generales de ambos grupos se exponen en la Tabla 1.
Tabla 1. Características generales de los 2 grupos de estudio
Ecocardiograma modo M y bidimensional
Desde el punto de vista estructural, se observó mayor tamaño de la cavidad del VD en los pacientes con ES (20,6 ± 4 mm vs 15,4 ± 4,3; p=0,02) al igual que la fracción de acortamiento del VI que también fue significativamente mayor en este grupo (41 ± 4% vs 36 ± 3%; p=0,001). No se encontraron diferencias en el resto de las mediciones realizadas mediante el estudio en modo M y bidimensional, tal como se detalla en la Tabla 2.
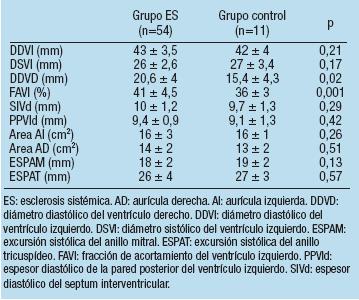
Tabla 2. Análisis del ecocardiograma bidimensional y modo M
Ecocardiograma Doppler
En el análisis Doppler de los flujos transvalvulares, sólo se evidenció diferencia significativa a nivel del VD. Los pacientes con diagnóstico de ES tuvieron menor tiempo eyectivo (270 ± 57 mseg vs 333 ± 32 mseg; p=0,001) y una tendencia a menor tiempo de aceleración del flujo anterógrado pulmonar (136 ± 28 mseg vs 144 ± 10 mseg; p=0,07). También la presión pulmonar sistólica fue mayor en los pacientes enfermos (27,3 ± 5,5 mm Hg vs 20,3 ± 3 mm Hg; p=0,0001). El análisis detallado se expone en la Tabla 3.
Tabla 3. Análisis Doppler de los flujos transvalvulares
Ecocardiograma Doppler tisular
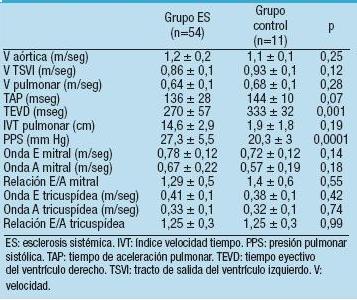
El estudio del DT reveló que los pacientes con ES presentaban mayor velocidad de la onda A' tanto a nivel del VI (15,3± 3,1 cm/seg vs 12,7 ± 2,6 cm/seg; p=0,01) como del VD (17,6 ± 3,6 cm/seg vs 13,6 ± 3,4 cm/seg; p=0,001). Esto provocaba una menor relación E'/A' en el VD (0,9 ± 0,39 cm/seg vs 1,13 ± 0,18 cm/seg; p=0,01) de estos pacientes. También se observó que la onda S del VD de los pacientes enfermos era mayor (16 ± 1,9 cm/seg vs 14,4 ± 1,6 cm/seg; p=0,001). No se evidenciaron diferencias en la relación E/E' de los 2 ventrículos. En la Tabla 4 se muestra el análisis en forma detallada.
Tabla 4. Análisis del Doppler tisular
Discusión
Si bien la afectación cardíaca en la esclerodermia es altamente frecuente, en la mayoría de los casos su curso es silente y sólo es manifiesta clínicamente en menos de un tercio de los casos. Un estudio multicéntrico reciente11, que involucró a casi 6000 pacientes con ES, evidenció que las causas de mortalidad más importantes fueron la fibrosis pulmonar (19%), la hipertensión pulmonar (14%), las neoplasias (13%) y la afección cardíaca (14%), esta última debida principalmente a arritmias e insuficiencia cardíaca. En cuanto a la sobrevida, la misma se relaciona en forma directa con la duración en años de la enfermedad, la afectación orgánica y el tipo de esclerodermia (difusa o localizada), con una expectativa media de vida de 12 años desde el momento del diagnóstico12.
A diferencia de otras enfermedades sistémicas del tejido conectivo de mayor prevalencia como el lupus eritematoso sistémico y la artritis reumatoidea, donde la enfermedad aterosclerótica macrovascular constituye la principal causa de mortalidad, en los pacientes portadores de ES, no se ha demostrado mayor prevalencia de enfermedad coronaria que en la población general con similar perfil de riesgo12.
En la ES, el sustrato fisiopatológico es el compromiso de la microcirculación. El fenómeno de Raynaud está presente en casi todos los pacientes y se produce debido a una disfunción crónica de los mecanismos que regulan el tono vasomotor entre los que se postulan una disminución de las sustancias vasodilatadoras (óxido nítrico, péptido generado por calcitonina) y/o aumento de vasoconstrictores como la endotelina-1, la 5-hidroxitriptamina y el incremento de la actividad de los adrenorreceptores alfa2 (sistema nervioso simpático). Esta disfunción no está restringida sólo al tejido cutáneo, sino que del mismo modo afecta otros órganos internos como los riñones, los pulmones, el tracto gastrointestinal y el corazón13.
La cronicidad de esta afección conduce a patología estructural en la microcirculación que fundamentalmente tiene lugar en pequeñas arterias y arteriolas de entre 50-500 µ de diámetro. El estudio histológico de los tejidos evidencia hipertrofia concéntrica de la pared vascular con focos intramurales de necrosis fibrinoide y fibrosis14, y en algunos casos con pequeños trombos en la luz13.
Estas alteraciones en el tejido miocárdico a nivel microvascular ocasionan fenómenos de isquemia y necrosis con el posterior desarrollo de parches de fibrosis que no guardan relación estricta con la anatomía de las arterias coronarias epicárdicas15.
Sulli y col. estudiaron la reserva coronaria en 29 pacientes con ES en comparación con 11 individuos controles y demostraron una disminución significativa de la misma en casi el 50% de los pacientes con ES, particularmente, en la forma difusa en comparación con el 0% del grupo control16. En el mismo sentido, se han reportado diversos estudios de medicina nuclear que demuestran defectos reversibles de perfusión miocárdica gatillados por inducción al frío en pacientes con ES6. Más recientemente, similares hallazgos se han descripto mediante el uso de resonancia magnética. Vignaux y col. demostraron mejoría en la perfusión miocárdica en pacientes con ES luego del tratamiento con bloqueantes cálcicos (nifedipina), lo que podría representar una interesante alternativa terapéutica en estos individuos17.
En nuestro estudio, desde el punto de vista estructural, sólo se observó mayor tamaño de la cavidad del VD, lo que podría tener relación con la presión pulmonar más elevada de estos pacientes. En cuanto a la función sistólica, se evidenció que los pacientes con ES presentaron cifras más elevadas en la fracción de acortamiento del VI y en la velocidad de la onda S del VD, lo que podría atribuirse a mayor simpaticotonía de este grupo de pacientes teniendo en cuenta que presentaron una tendencia a mayores cifras de frecuencia cardíaca y tensión arterial. En lo que respecta a la función diastólica, no se encontraron variaciones significativas en el análisis de los flujos de llenado de ambos ventrículos. Por el contrario, sí se observaron diferencias en las velocidades tisulares que reflejan menor distensibilidad en el llenado diastólico ventricular, esto podría ser consecuencia de la afectación intrínseca del miocardio que produce esta enfermedad y/o del aumento de la presión pulmonar en los pacientes portadores de ES, que si bien en la mayoría de los casos se encontraba dentro de valores considerados como normales, la media era significativamente mayor que en los individuos controles. Además, no puede descartarse la presencia de un fenómeno de Raynaud en el árbol vascular pulmonar18.
Un estudio multicéntrico realizado en Francia involucró 570 pacientes consecutivos con diagnóstico de ES (sexo femenino: 85% y edad media de 54 ± 13 años) que fueron evaluados mediante ecocardiografía Doppler. Se demostró hipertensión pulmonar en un 3% de los pacientes (confirmada por hemodinamia), disfunción sistólica del ventrículo izquierdo en el 1,4% (disminución de la fracción de eyección≤45%), disfunción diastólica en el 17,7% (según la relación de las ondas E/A del flujo mitral), dilatación de la aurícula izquierda en casi el 12% de los casos, signos de hipertrofia del VI en el 23% de los pacientes, insuficiencia mitral en el 7% e insuficiencia valvular aórtica en el 2,5%. En este estudio, no se contó con un grupo control y se excluyeron pacientes con antecedentes de patología pulmonar y/o cardíaca de significación19. Otro registro multicéntrico de ES que incluyó poco más de 7000 pacientes (edad media: 56 ± 14 años y 86% de mujeres), observó una prevalencia del 5,4% de disfunción sistólica del VI (fracción de eyección <55%). Los factores de riesgo independientes de disfunción sistólica del VI en el análisis multivariado fueron: edad, sexo masculino, presencia de miositis, úlceras digitales, compromiso pulmonar y ausencia de tratamiento con bloqueantes cálcicos20.
El empleo del DT permite mayor sensibilidad en la búsqueda de anormalidades. Lindqvist y col. evaluaron mediante DT a 26 pacientes con ES (70% con la forma limitada, 80% mujeres, con una edad media de 56 ± 15 años) y los compararon con 25 controles de similar edad y sexo. No se encontraron diferencias en las cavidades izquierdas en lo que respecta a dimensiones, función sistólica ni función diastólica. Por el contrario, se evidenció mayor tamaño de la aurícula derecha y del grosor de la pared libre del VD en los pacientes con ES. No se evidenciaron discrepancias en cuanto a la función sistólica del VD, pero en el análisis de la función diastólica los pacientes con ES presentaron mayor velocidad de la onda A tricuspídea (36 ± 12,7 cm/seg vs 25,9± 7,5 cm/seg; p<0,001) y menor cociente en la relación E/A (1,2 ± 0,4 vs 1,7 ± 0,6; p<0,01). No hubo diferencias en las presiones pulmonares en las mediciones realizadas en ambos grupos (mediante ecocardiografía), aunque es importante destacar que el 59% de los pacientes con ES tenía alteración en la prueba de difusión de monóxido de carbono. Por consiguiente, no puede descartarse un incipiente y quizás intermitente aumento de la presión de la presión pulmonar en el grupo de enfermos. Una observación que podría avalar esta hipótesis, es el menor tiempo de aceleración del flujo pulmonar que presentaban los pacientes con diagnóstico de ES (119 ± 34 mseg vs 141 ± 29 mseg; p<0,05) que podría reflejar un aumento de la impedancia vascular pulmonar21, si bien es cierto que este parámetro es poco específico y recién cobra notoriedad como indicador de hipertensión pulmonar cuando es menor a 100 mseg.
En un estudio más reciente, Meune y col. estudiaron en forma consecutiva 100 pacientes con diagnóstico de ES sin antecedentes de cardiopatía ni hipertensión pulmonar y los compararon con 26 individuos control por edad y sexo con el objetivo de determinar la prevalencia de disfunción sistólica y diastólica mediante el análisis del DT (edad media 54 ±14 años, 86% sexo femenino, 58% con ES limitada). A nivel estructural, los pacientes con ES presentaron mayor diámetro en la aurícula izquierda (34 ± 0,5 mm vs 31 ± 1 mm; p=0,02). También se observó en estos pacientes menor cociente en la relación E/A del flujo transmitral (1 ± 0,3 m/seg vs 1,2 ± 0,6 m/seg; p=0,038). En cuanto al DT, no se observaron diferencias al analizar los valores como variables continuas, pero al tener en cuenta los límites de la normalidad generalmente aceptados, se evidenció una mayor prevalencia de disfunción sistólica del VI (onda S <7,5 cm/seg: 14% vs 0%; p=0,04), mayor disfunción diastólica del VI (onda E' <10 cm/seg: 30% vs 2%; p=0,022) y mayor disfunción sistólica del VD (onda S <11,5 cm/seg: 15% vs 0%; p=0,039)22.
Finalmente, otro trabajo que merece comentarse es el de Dimitroulas y col. que recientemente evaluaron 52 pacientes con ES (edad media 56 ± 10 años, 98% mujeres, 54% ES limitada) y los compararon con 25 pacientes controles. También se observó mayor diámetro de AI. Se comprobó a nivel del flujo transmitral menor cociente E/A (1 ± 0,16 vs 1,5 ± 0,17; p=0,0001) a expensas de mayor velocidad de la onda A (0,79 ± 0,03 m/seg vs 0,53 ± 0,09 m/seg; p=0,0001). Se observaron resultados idénticos en el flujo transtricuspídeo. En el DT, los pacientes con ES presentaron a nivel del VI menor velocidad de la onda S (0,07 ± 0,02 m/seg vs 0,10 ± 0,02 m/seg; p=0,0001), menor velocidad de la onda E' (0,07 ± 0,01 m/seg vs 0,10 ± 0,01 m/seg; p=0,0001) y mayor relación E/E' (11,3 ± 2,3 vs 5,9 ± 0,6; p=0,0001). En cuanto al VD, se evidenció menor velocidad de la onda E' (0,08 ± 0,03 m/seg vs 0,13 ± 0,02 m/seg; p=0,006) y mayor relación E/E' (10,9 ± 2,1 vs 6,1 ± 1,5; p=0,002). Tomando los mismos parámetros que en el estudio anterior, se encontró una prevalencia de disfunción sistólica (onda S <7,5 cm/ seg) del VI del 15% vs 0% en el grupo control (p= 0,0016) y disfunción diastólica (onda E' <10 cm/seg o relación E/E'>15) de 24% vs 0% (p=0,0001)23.
Entre las limitaciones de nuestro estudio merecen destacarse el poco número de pacientes que formaron parte del grupo control, el haber sido realizado en un solo laboratorio ecocardiográfico y el no contar con confirmación hemodinámica de los gradientes transvalvulares.
Conclusiones
De acuerdo a los resultados del estudio realizado, los pacientes con ES evidencian una temprana e incipiente afectación en lo que respecta a la función diastólica ventricular. Podría ser consecuencia de la mayor presión pulmonar y de la afectación intrínseca del miocardio.
Conflicto de intereses
Los autores no tienen que reportar ningún conflicto de intereses.
Recursos financieros
No hubo apoyo financiero para este trabajo.
1.Ferri C, Valentini G, Cozzi F, Sebastiani M, Michelassi C, La Montagna G et al. Systemic Sclerosis Study Group of the Italian Society of Rheumatology (SIR-GSSSc). Systemic Sclerosis. Demographic, clinical and serological features and survival in 1012 Italian patients. Medicine (Baltimore) 2002; 81:139-153. [ Links ]
2.Allanore Y, Meune C, Kahan A. Systemic Sclerosis and cardiac dysfunction: evolving concepts and diagnostic methodologies. Curr Opin Rheumatol. 2008; 20: 697-702. [ Links ]
3.Kahan A, Coghlan G, McLaughlin V. Cardiac complications of systemic sclerosis. Rheumatology (Oxford) 2009; 48: iii45-iii48. [ Links ]
4.Meune C, Vignaux O, Kahan A, Allanore Y. Heart involvement in systemic sclerosis: evolving concept and diagnostic methodologies. Arch Cardiovasc Dis 2010; 103: 46-52. [ Links ]
5.Ferri C, Giuggioli D, Sebastiani M, Colaci M, Emdin M. Heart involvement and systemic sclerosis. Lupus 2005; 14: 702-707. [ Links ]
6.Kahan A, Allanore Y. Primary myocardial involvement in systemic sclerosis. Rheumatology. 2006; 45: iv14-iv17. [ Links ]
7.Barimboim E. Hipertensión pulmonar en las enfermedades del tejido conectivo. Insuf Card 2009; 3: 101-106. [ Links ]
8.Subcommittee for Scleroderma Criteria of the American Rheumatism Association Diagnostic and Therapeutic Criteria Committee. Preliminary criteria for the classification of the systemic sclerosis (scleroderma). Arthritis Rheum. 1980; 23: 581-590. [ Links ]
9.Lang R, Bierig M, Devereux R, Flachskampf F, Foster E, Pellikka P et al. Recommendations for Chamber Quantification: A Report from the American Society of Echocardiographys Guidelines and Standards Committee and the Chamber Quantification Writing Group, Developed in Conjunction with the European Association of Echocardiography, a Branch of the European Society of Cardiology. J Am Soc Echocardiogr. 2005; 18: 1440-1463. [ Links ]
10.Nagueh S, Appleton C, Gillebert T, Marino P, Oh J, Smiseth O, Waggoner A, Flachskampf F, Pellikka P, Evangelista A. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography. J Am Soc Echocardiogr. 2009; 22: 107-133. [ Links ]
11.Tyndall A, Bannert B, Vonk M, Airo P, Cozzi F, Carreira P et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010; 69: 1809-1815. [ Links ]
12.Mayes M. Scleroderma epidemiology. Rheum Dis Clin North Am. 2003; 29: 239-254. [ Links ]
13.Flavahan N, Flavahan S, Mitra S, Chotani N. The vasculopathy of Raynaud´s phenomenon and scleroderma. Rheum Dis Clin North Am. 2003; 29: 275-291. [ Links ]
14.James T. Coronary Arteries and Conduction System in Scleroderma Heart Disease. Circulation. 1974; 50: 844-856. [ Links ]
15.Bulkley B, Ridolfi R, Salyer WHutchins G. Myocardial Lesions of Progressive Systemic Sclerosis. A cause of Cardiac Dysfunction. Circulation. 1976; 53; 483-490. [ Links ]
16.Sulli A, Ghio M, Bezante P, Deferrari L, Craviotto C, Sebastiani V, Setti M, Filaci G, Puppo F, Barsotti A, Cutolo M, Indiveri F. Blunted coronary flow reserve in systemic sclerosis: a sign of cardiac involvement in asymptomatic patients. Ann Rheum Dis. 2004; 63: 210-211. [ Links ]
17.Vignaux O, Allanore Y, Meune C, Pascal O, Duboc D, Weber S, Legmann P, Kahan A. Evaluation of the effect of nifedipine upon myocardial perfusion and contractility using cardiac magnetic resonance imaging and tissue Doppler echocardiography in systemic sclerosis. Ann Rheum Dis. 2005; 64: 1268-1273. [ Links ]
18.Sakamoto K, Houva I, Inoue K, Tanaka M, Suzuki T, Sakamoto Y, Matsou H. An imbalance in plasma prostanoids in patients with Raynaud's phenomenon and pulmonary vasospasm. Eur Respir J 1999; 13: 137-144. [ Links ]
19.De Groote P, Gressin V, Hachulla E, Carpentier P, Guillevin L, Kahan A et al. Evaluation of cardiac abnormalities by Doppler echocardiography in a large nationwide multicentric cohort of patients with systemic sclerosis. Ann Rheum Dis. 2008; 67: 31-36. [ Links ]
20.Allanore Y, Meune C, Vonk M, Airo P, Hachulla E, Caramaschi P, et al. Prevalence and factors associated with left ventricular dysfunction in the EULAR Scleroderma Trial and Research Group (EUSTAR) database of patients with systemic sclerosis. Ann Rheum Dis. 2010; 69: 218-221. [ Links ]
21.Lindqvist P, Caidahl K, Neuman-Andersen G, Ozolins C, Rant apää-Dahlqvist S, Waldeenström A, Kazzam E. Disturbed Right Ventricular Diastolic Function in Patients With Systemic Sclerosis. A Doppler Tissue Imaging Study. Chest. 2005; 128: 755-763. [ Links ]
22.Meune C, Avouac J, Wahbi K, Cabanes L, Wipff J, Mouthon L, Guillevin L, Kahan A, Allanore Y. Cardiac Involvement in Systemic Sclerosis Assessed by Tissue-Doppler Echocardiography During Routine Care. A controlled Study of 100 Consecutive Patients. Arthritis Rheum. 2008; 58: 1803-1809. [ Links ]
23.Dimitroulas T, Giannakoulas G, Papadopoulou K, Karvounis H, Dimitroulas H, Koliakos G, Karamitsos T, Parcharidou D, Settas L. Early Detection of Cardiac Involvement in Systemic Sclerosis Assessed by Tissue-Doppler Echocardiography: Relationship with Neurohormonal Activation and Endothelial Dysfunction. J Rheumatol. 2010; 37: 993-999. [ Links ]














