Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.7 no.1 Ciudad Autónoma de Buenos Aires Jan./Mar. 2012
ARTICULO ORIGINAL
Inflamación y disfunción endotelial en la insuficiencia cardíaca aguda y crónica
Ignacio J. Sánchez Lázaro1,3, Luis Almenar Bonet1, Virtudes Vila Liante2, Vicenta Martínez Sales2, Edelmiro Reganon Salvador2, Luis Martínez Dolz1, Antonio Salvador Sanz1
1 Unidad de Insuficiencia Cardíaca y Trasplante. Servicio de Cardiología. Hospital La Fe Universitari i Politècnic. Valencia. España.
2 Centro de Investigación. Hospital La Fe Universitari i Politècnic. Valencia. España.
3 Departamento de Medicina. Universidad Autónoma de Barcelona. Barcelona. España.
Este artículo es parte de la tesis doctoral de Ignacio J. Sánchez Lázaro en el Departamento de Medicina de la Universidad Autónoma de Barcelona. España.
Correspondencia: Dr. Ignácio J. Sánchez Lázaro
Avda. Ausias March 2, esc 2, pta 15. CP 46111. Ciudad de Rocafort. Valencia. España.
Tel.: +34-629821756
Fax: +34-961246237
E-mail: ignaciosanchezlazaro@gmail.com
Recibido: 05/08/2011
Aceptado: 10/12/2011
Resumen
Introducción. En la insuficiencia cardíaca (IC) existe una importante activación neurohormonal e inflamatoria. También parece existir una disfunción endotelial. Nuestro objetivo ha sido comparar ambos procesos (inflamación y disfunción endotelial) en pacientes con IC.
Material y métodos. Comparamos marcadores de disfunción endotelial (células endoteliales circulantes, macropartículas circulantes y factor von Willebrand) y de inflamación (proteína C reactiva, interleuquina 6 y fibrinógeno funcional) en 16 pacientes con insuficiencia cardíaca aguda (ICA), 16 con insuficiencia cardíaca crónica (ICC) estable y 32 controles sanos.
Resultados. El número de células endoteliales circulantes fue mayor en los pacientes con ICA que en el grupo ICC y que en el grupo control (115,10 ± 63,44 vs 19,67 ± 3,17 vs 11,71 ± 2,92 cel/mL). La cantidad de macropartículas circulantes fue mayor en el grupo ICA que en el ICC y en ambos grupos frente al grupo control (9.627 ± 4.986 vs 3.970 ± 3.452 vs 1.371 ± 739 p/µL). El factor von Willebrand fue mayor en ambos grupos IC que en el control (234,3 ± 45,31 vs 245,92 ± 117,89 vs 100,14 ± 20,7%). Los valores de proteína C reactiva fueron mayores en el grupo ICA que en el ICC y que en el control (20,29 ± 17,56 vs 7,65 ± 4,27 vs 1,44 ± 1,10 mg/dL). La interleuquina 6 se encontró más elevada en los pacientes con ICA respecto al resto de grupos y en los pacientes con ICC respecto a los sanos (9,73 ± 9,37 vs 1,69 ± 1,36 vs 1,01 ± 1,09 pg/mL). Referente al fibrinógeno funcional, sólo encontramos diferencias significativas entre el grupo ICA y el resto de grupos (350 ± 60,48 vs 264,08 ± 67,02 vs 254,29 ± 23,69 mg/dL).
Conclusiones. De forma paralela a la inflamación ya conocida en la IC, se produce una disfunción endotelial que a su vez parece ser proporcional a la gravedad de la IC.
Palabras clave: Insuficiencia cardíaca; Disfunción endotelial
Summary
Endothelial dysfunction and inflammation in chronic and acute heart failure
Background. There is a neurohormonal an inflammatory activation in heart failure. There is also an endothelial dysfunction. Our objective war to compare both processes (inflammation and endothelial dysfunction) in patients with heart failure.
Material and method. We compared endothelial dysfunction markers (circulating endothelial cells, circulating microparticles and Von Willebrand factor) and inflammatory markers (C reactive protein, interleukin-6 and functional fibrinogen) in 16 patients with acute heart failure (AHF), 16 with stable chronic heart failure (SHF) and 32 healthy controls.
Results. The number of circulating endothelial cells was greater in AHF patients than in SHF and controls (115.10± 63.44 vs 19.67 ± 3.17 vs 11.71 ± 2.92 cel/mL). The amount of circulating microparticles was greater in the AHF group than in the SHF and in both than controls (9,627 ± 4,986 vs 3,970 ± 3,452 vs 1,371 ± 739 p/µL). Von Willebrand factor was greater in both heart failure groups than in controls (234.3 ± 45.31 vs 245.92 ± 117.89 vs 100.14± 20.7%). C reactive protein was greater in the AHF group than in the SHF group or controls (20.29 ± 17.56 vs 7.65± 4.27 vs 1.44 ± 1.10 mg/dL). Interleukin-6 was also higher in the AHF group than in the SHF and in this greater than in controls (9.73 ± 9.37 vs 1.69 ± 1.36 vs 1.01 ± 1.09 pg/mL). Functional fibrinogen was only greater in the AHF group (350 ± 60.48 vs 264.08 ± 67.02 vs 254.29 ± 23.69 mg/dL).
Conclusions. Inflammation and endothelial dysfunction run together in heart failure patients. The endothelial dysfunction observed seems to be proportional to the inflammatory state.
Keywords: Heart failure; Endothelial dysfunction
Resumo
Inflamação e disfunção endotelial na insuficiência cardíaca aguda e crônica
Introdução. Na insuficiência cardíaca existe uma importante ativação neurohormonal e inflamatória. Também parece existir uma disfunção endotelial. Nosso objetivo foi o de comparar ambos processos (inflamação e disfunção endotelial) em pacientes com insuficiência cardíaca.
Materiais e métodos. Comparamos marcadores de disfunção endotelial (células endoteliais circulantes, micropartículas circulantes e fator Von Willebrand) e de inflamação (proteína C reativa, interleuquina 6 e fibrinogênio funcional) em 16 pacientes com insuficiência cardíaca aguda (ICA), 16 com insuficiência cardíaca crônica estável (ICC) e 32 controles sãos.
Resultados. O número de células endoteliais circulantes foi maior nos pacientes com ICA que no de ICC e que no controle (115,10 ± 63,44 vs 19,67 ± 3,17 vs 11,71 ± 2,92 cel/mL). A quantidade de micropartículas circulantes foi maior no grupo de ICA que no de ICC e em ambos grupos de pacientes em frente ao grupo controle (9.627 ± 4.986 vs 3.970 ± 3.452 vs 1.371 ± 739 p/µL). O fator Von Willebrand foi maior em ambos grupos de insuficiência cardíaca que no controle (234,3 ± 45,31 vs 245,92 ± 117,89 vs 100,14 ± 20,7%). Os valores de proteína C reativa foram maiores no grupo de ICA que no de ICC e que no de sãos (20,29 ± 17,56 vs 7,65 ± 4,27 vs 1,44 ± 1,10 mg/dL). A interleuquina seis encontrou-se mais elevada nos pacientes com ICA com respeito ao resto de grupos e nos pacientes com ICC com respeito aos sãos (9,73 ± 9,37 vs 1,69 ± 1,36 vs 1,01 ± 1,09 pg/mL). Com respeito ao fibrinogênio funcional só encontramos diferenças significativas entre o grupo de ICA e o resto de grupos (350 ± 60,48 vs 264,08± 67,02 vs 254,29 ± 23,69 mg/dL).
Conclusões. De forma paralela à inflamação já conhecida na insuficiência cardíaca, se produz uma disfunção endotelial que a sua vez parece ser proporcional à gravidade da insuficiência cardíaca.
Palavras-chave: Insuficiência cardíaca; Disfunção endotelial
Introducción
Pese a los avances diagnósticos y terapéuticos de los últimos años, la insuficiencia cardíaca (IC) sigue siendo un problema sanitario de primer orden a nivel mundial1. En la evolución de la IC, y con independencia de su etiología, existe una activación neuroendocrina que acaba afectando a otros órganos y favoreciendo la progresión de la propia IC2. Junto a esta activación neuroendocrina clásica, en los últimos años se ha demostrado en la IC una elevación de marcadores de inflamación sistémicos (MI) y de parámetros de disfunción endotelial (DE)3,4.
La evidencia acumulada sobre los MI ha permitido demostrar que su evolución es paralela a la gravedad de la IC, existiendo un mayor nivel de inflamación en aquellos pacientes con insuficiencia cardíaca aguda (ICA) o descompensada, y a su vez mayor en los pacientes con insuficiencia cardíaca crónica (ICC) estable que en los controles sanos5. Igualmente, se ha demostrado que algunos MI, como la interleuquina 6 (IL-6) y la proteína C reactiva (PCR), poseen valor pronóstico en pacientes con ICA6.
Estudios previos han evidenciado, tanto mediante marcadores en suero, como por mediciones en el flujo arterial, que en la IC existe una DE clara7. A los marcadores más clásicos de DE como el factor Von Willebrand y la trombomodulina hay que añadir recientemente las células endoteliales circulantes (CEC) y las micropartículas circulantes (MPC). Las CEC, apenas presentes en sujetos sanos, provienen de la denudación que se produce en el endotelio en situaciones de estrés, como por ejemplo, en el contexto de un síndrome coronario agudo. Según apuntan diversos autores, su determinación sería la forma más directa de demostrar la presencia de DE8. Las MPC tienen su origen en varias líneas celulares, entre ellas las CEC, y por ello, al igual que las CEC, su presencia también traduce DE8.
En el presente trabajo hemos comparado el grado de inflamación y de DE entre una población de pacientes con IC descompensada (ICA), otra de pacientes con IC estable (ICC) y otra de sujetos sanos.
Material y métodos
Desde el 1 de febrero al 31 de abril de 2010 analizamos de forma consecutiva a 19 pacientes con ICA, 17 con ICC y 32 controles sanos. En todos los casos el diagnóstico de IC se realizó según los signos y síntomas del paciente y de acuerdo a los criterios de Framingham9. Los pacientes con ICA fueron reclutados de los que ingresaron en el Servicio de Cardiología con el diagnóstico de ICA, y los pacientes con ICC de la consulta ambulatoria del mismo servicio. Todos los pacientes con ICA presentaban un estadio funcional ≥ III según New York Heart Association (NYHA), y los de ICC se encontraban todos en una clase funcional II según NYHA. Los sujetos sanos no presentaban ningún tipo de comorbilidad y fueron reclutados del personal del hospital y de voluntarios ajenos al mismo.
La etiología de la IC se estableció en función de la exploración física, de las pruebas complementarias y de la historia clínica de los pacientes. Se excluyeron aquellos pacientes con ingresos hospitalarios en los tres meses previos o los que no firmaron el consentimiento. Finalmente, el número de pacientes incluido fue de 16 con ICA, 16 con ICC y 32 sujetos sanos.
El estudio se llevó a cabo de acuerdo a la Declaración de Helsinki y fue aprobado por el Comité Ético de Investigación de nuestro Hospital. Todos los pacientes dieron por escrito su autorización para participar en el estudio.
Variables analizadas y pruebas complementarias
Se consideraron a los pacientes portadores de las siguientes patologías: hipertensión arterial, dislipemia o diabetes mellitus, de acuerdo a si éstos recibían algún tipo de tratamiento para estas enfermedades.
Se practicó un electrocardiograma a todos los pacientes y controles, así como una ecocardiografía a todos los pacientes para evaluar la fracción de eyección.
Marcadores incluidos en el estudio y determinaciones bioquímicas
En un intento de minimizar el efecto del tratamiento instaurado tras el ingreso hospitalario, las muestras de sangre de los pacientes con ICA se obtuvieron dentro de las primeras 24 horas del ingreso.
Los marcadores de DE analizados fueron CEC, las MPC y el factor Von Willebrand (FvW), y los de inflamación: PCR, IL-6 y fibrinógeno funcional (FF).
Análisis estadístico
Las variables continuas se expresan como media ± desviación estándar. Los test empleados fueron t de Student y ANOVA para las variables cuantitativas y el método de Chi-cuadrado para las cualitativas. Las correlaciones se realizaron mediante el método de Pearson. El paquete estadístico empleado fue el SPSS®, v. 15.0 (SPSS Inc. Chicago, Ill, USA).
Resultados
Análisis comparativo de las características basales
En la Tabla 1, se resumen las características clínicas, bioquímicas y los tratamientos que recibían los diversos grupos. Ninguno de los controles tomaba medicación de forma habitual.
Tabla 1. Características basales
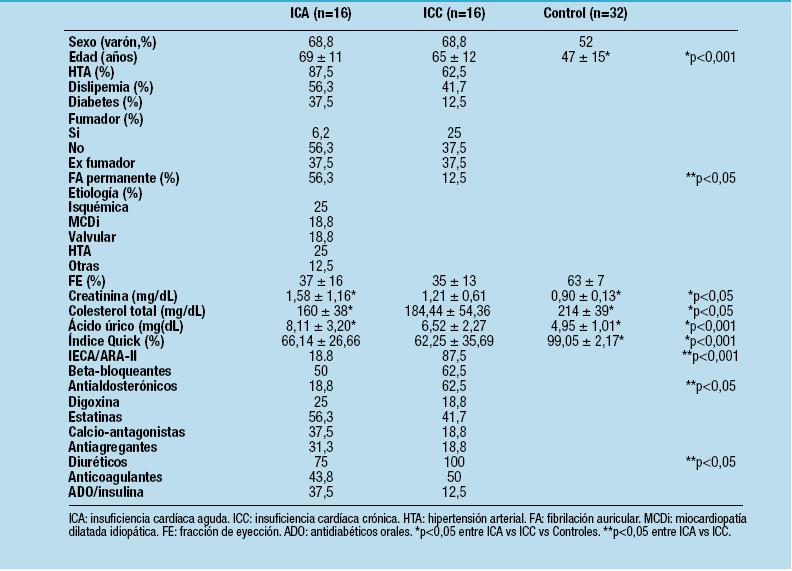
Marcadores de disfunción endotelial
Como se observa en la Figura 1, el número de CEC fue significativamente mayor en los pacientes con ICA que en el de ICC y que en el control, pero no entre el grupo ICC y el control (115,10 ± 63,44 vs 19,67 ± 3,17 vs 11,71 ± 2,92 cel/mL). La cantidad de MPC fue significativamente mayor en el grupo ICA que en el ICC y en ambos grupos de pacientes frente al grupo control (9.627 ± 4.986 vs 3.970 ± 3.452 vs 1.371 ± 739 p/µL). No hubo diferencias en el FvW entre el grupo ICA y el ICC, pero sí entre ambos grupos de pacientes y el grupo control (234,3 ± 45,31 vs 245,92 ± 117,89 vs 100,14 ± 20,7 %).
Marcadores de inflamación
Como se puede ver en la Figura 2, los valores de PCR fueron mayores en el grupo ICA que en el ICC y que en el de sanos, pero no entre estos dos últimos (20,29± 17,56 vs 7,65 ± 4,27 vs 1,44 ± 1,10 mg/dL). La IL-6 se encontró significativamente más elevada en los pacientes con ICA respecto al resto de grupos y en los pacientes con ICC respecto a los sanos (9,73 ± 9,37 vs 1,69 ± 1,36 vs 1,01 vs 1,09 pg/mL). Respecto al FF sólo encontramos diferencias significativas entre el grupo ICA y los otros dos grupos (350 ± 60,48 vs 264,08 ± 67,02 vs 254,29± 23,69 mg/dL).

Figura 1. Marcadores de disfunción endotelial, diferencias entre grupos. CEC: células endoteliales circulantes.
MPC: micropartícula circulantes. FvW: factor von Willebrand. ICA: insuficiencia cardíaca aguda.
ICC: insuficiencia cardíaca crónica. NS: no significativo.
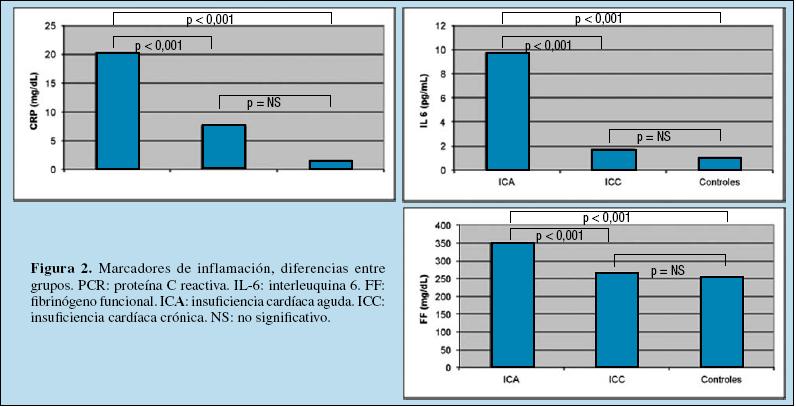
Figura 2. Marcadores de inflamación, diferencias entre grupos. PCR: proteína C reactiva. IL-6: interleuquina 6.
FF: fibrinógeno funcional. ICA: insuficiencia cardíaca aguda. ICC: insuficiencia cardíaca crónica. NS: no significativo.
Correlaciones
El resultado de las correlaciones se observa en la Tabla 2.
Encontramos correlaciones significativas en las siguientes parejas:
CEC-MPC (r=0,497; p<0,001), CEC-PCR
(r=0,485; p<0,001), CEC-IL-6 (r=0,619; p<0,001), CECFF
(r=0,423; p<0,001), MPC-FF (r=0,451; p=0,002), PCRFF
(r=0,632; p<0,001) e IL-6-FF (r=0,626; p<0,001).
Discusión
En el presente trabajo, hemos pretendido hacer una comparación de los niveles de determinados marcadores de DE y de inflamación en diferentes poblaciones de pacientes con IC y compararlos con un grupo control. De forma similar a artículos previos, los pacientes con IC descompensada presentan niveles mayores de DE y de inflamación que los pacientes con ICC y que los controles5,10. Igualmente, con este trabajo hemos vuelto a poner de manifiesto que los pacientes con ICC, pese a encontrarse en una situación estable clínicamente, presentan también mayor grado de DE y de inflamación que los controles sanos. Todo esto sugiere que tanto los parámetros de DE como los MI analizados se elevan de forma proporcional a la gravedad de la IC.
Respecto a las características basales, las principales diferencias son de forma lógica frente al grupo control. La diferencia más importante es la edad, claramente inferior en el grupo control. Pese a esto y de acuerdo con trabajos ya publicados, aclaramos que este hecho no invalida los resultados, ya que el objetivo es la comparación frente a un grupo sano10.
Las CEC son un grupo maduro de células que circulan por el torrente sanguíneo procedentes de la íntima del endotelio vascular. En sujetos sanos, el número de CEC es muy bajo (<10 cel/mL), por lo que se considera que su presencia, aunque en cantidades bajas, traduce la existencia de un daño en el endotelio vascular8,11. Su liberación se produce como consecuencia de un estrés o daño directo sobre el propio endotelio, por la acción de proteasas liberadas desde los leucocitos y por medio de diversas citoquinas como el factor de necrosis tumoral alfa. Actualmente, se considera que su determinación es una medida directa del grado de DE, frente a otras medidas indirectas como el FvW o la e-selectina12.
En nuestro caso, las CEC se encuentran significativamente más elevadas en los pacientes con ICA que en aquellos con ICC y que en los controles, pero no entre estos dos últimos grupos. Este hecho puede deberse a la inestabilidad hemodinámica propia de la ICA, que produciría un estrés importante sobre el endotelio vascular con una mayor denudación del mismo. Los pacientes con ICC al encontrarse estables hemodinámicamente, sufrirían menos estrés endotelial y tendrían unos valores cercanos a la normalidad aunque siempre por encima de éstos, lo que traduce una DE de bajo grado, pero continua en la ICC.
El conocimiento actual sobre las MPC es menor que sobre las CEC. Las MPC se originan a través de múltiples vías y se pueden detectar de forma sencilla en plasma fresco13,14. Diversos trabajos han relacionado a las MPC con procesos trombóticos y como marcadores de DE, ya que en parte tienen su origen en las propias CEC13,15.
Nuestros resultados muestran una mayor presencia de MPC en el grupo ICA que los otros dos grupos, y en el grupo ICC respecto al control. El aumento de las MPC se debe al estrés vascular, la activación de otras células como los leucocitos y a la propia elevación de las CEC, pues parte de las MPC proceden de las propias CEC. Las MPC son partículas protrombóticas, lo que podría explicar en parte la mayor tasa de eventos trombóticos de los pacientes con ICA16. Al igual que con las CEC, el hecho de que en pacientes estables siga habiendo diferencias respecto a los controles sanos apoya la teoría de una DE permanente y de bajo grado en la IC.
El FvW es el parámetro de DE más clásico de los estudiados en este trabajo, pero el que aporta una información más imprecisa17. Pocos estudios han comparado de forma simultánea el FvW con las CEC y MPC. Al contrario que las CEC y las MPC, no hemos encontrado diferencias en el nivel de FvW entre ambos grupos de IC, pero sí entre éstos y el grupo control. Así pues, parece claro que el FvW es menos sensible que las CEC y las MPC para detectar la DE presente en la ICA.
Los MI escogidos para este trabajo son marcadores ya conocidos, pues la intención no fue repetir lo demostrado por otros artículos (que evidenciaron que estos parámetros se encuentran elevados en la ICA e ICC)18-20, sino establecer una comparación y una relación con los marcadores de DE analizados. Los tres MI siguen un patrón similar: mayor elevación estadísticamente significativa en la ICA que en los otros dos grupos y ausencia de diferencias estadísticas
entre el grupo ICC y el grupo control.
Como se observa en la Tabla 2, existen múltiples correlaciones entre todos los parámetros a pesar del bajo número de pacientes. Estas correlaciones se dan principalmente con las CEC y MPC y no con el FvW, indicando de nuevo la mayor especificidad de los dos primeros. De igual forma, las correlaciones apoyan el hecho de que ambos procesos, DE e inflamación, corren paralelos cuando se produce la descompensación de la IC.
La mayor limitación del presente trabajo es el número tan bajo de pacientes, que ha impedido que obtuviéramos más diferencias significativas y tal vez correlaciones estadísticas con parámetros clínicos. Pese a esto, pensamos que los datos obtenido son válidos y de interés.
Conclusión
La principal conclusión de este trabajo es que de forma paralela a la inflamación, ya conocida en la insuficiencia cardíaca, se produce una disfunción endotelial que a su vez parece ser proporcional a la gravedad de la insuficiencia cardíaca. Pese a esto, serán necesarios estudios con un mayor número de pacientes y prospectivos, para relacionar mejor la inflamación y la disfunción endotelial y para conocer la evolución exacta de estos marcadores, así como su posible utilidad pronóstica.
Agradecimientos
A Mónica Cebrián Pinar por su inestimable ayuda en la creación de las tablas y figuras.
Recursos financieros
Este trabajo ha sido financiado en parte por una beca de la Fundación Mutua Madrileña, parte por una beca del Ministerio de Ciencia, Tecnología e Innovación, Instituto de Salud Carlos III, FIS PI08124; Generalitat Valenciana, Cancillería Sanitat, AP037/07 y la Sección de Insuficiencia Cardíaca y Trasplante de la Sociedad Española de Cardiología, 2009.
Conflicto de intereses
Los autores declaran que no poseen conflictos de interés.
1. McLean AS, Eslick GD, Coats AJ. The epidemiology of heart failure in Australia. Int J Cardiol. 2007;118(3):370-4. [ Links ]
2. Yndestad A, Damas JK, Oie E, Ueland T, Gullestad L, Aukrust P. Role of inflammation in the progression of heart failure. Curr Cardiol Rep. 2007; 9(3):236-41. [ Links ]
3. Anker SD, Von Haehling S. Inflammatory mediators in chronic heart failure: an overview. Heart. 2004;90(4):464-70. [ Links ]
4. Katz SD, Hryniewicz K, Hriljac I, et al. Vascular endothelial dysfunction and mortality risk in patients with chronic heart failure. Circulation. 2005; 111(3):310-4. [ Links ]
5. Sánchez-Lázaro IJ, Almenar L, Reganon E, Vila V, Martínez-Dolz L, Martínez-Sales V, Moro J, Agüero J, Ortiz-Martínez V, Salvador A. Inflammatory markers in stable heart failure and their relationship with functional class. Int J Cardiol. 2008; 129(3):388-93. [ Links ]
6. Miettinen KH, Lassus J, Harjola VP, et al. Prognostic role of pro- and anti-inflammatory cytokines and their polymorphisms in acute decompensated heart failure. Eur J Heart Fail. 2008; 10(4):396-403. [ Links ]
7. Chong AY, Blann AD, Patel J, Freestone B, Hughes E, Lip GY. Endothelial dysfunction and damage in congestive heart failure: relation of flow-mediated dilation to circulating endothelial cells, plasma indexes of endothelial damage, and brain natriuretic peptide. Circulation. 2004; 110(13):1794-8. [ Links ]
8. Sabatier F, Lacroix R, Camoin-Jau L, Anfosso F, Sampol J, Dignat-George F. Circulating endothelial cells, micro particles and progenitors: Towards the definition of vascular competence. Rev Med Interne. 2011; 32(1):54-63. Epub 2010. [ Links ]
9. McKee PA, Castelli WP, McNamara PM, Kannel WB. The natural history of congestive heart failure: The Framingham study. N Engl J Med. 1971; 285(26):1441-6. [ Links ]
10. Nonaka-Sarukawa M, Yamamoto K, Aoki H, Nishimura Y, et al. Circulating endothelial progenitor cells in congestive heart failure. Int J Cardiol. 2007; 119(3):344-348. [ Links ]
11. Shantsila E, Blann AD, Lip GY. Circulating endothelial cells: from bench to clinical practice. J Thromb Haemost. 2008;6(5):865-8. [ Links ]
12. Blann AD. Endothelial cell activation, injury, damage and dysfunction: separate entities or mutual terms? Blood Coagul Fibrinolysis. 2000;11(7):623-30. [ Links ]
13. Bulut D, Maier K, Bulut-Streich N, Börgel J, Hanefeld C, Mügge A. Circulating endothelial micro particles correlate inversely with endothelial function in patients with ischemic left ventricular dysfunction. J Card Fail. 2008;14(4):336-40. [ Links ]
14. Sabatier F, Camoin-Jau L, Anfosso F, Sampol J, Dignat-George F. Circulating endothelial cells, micro particles and progenitors: key players towards the definition of vascular competence. J Cell Mol Med. 2009;13(3):454-71. [ Links ]
15. Leroyer AS, Anfosso F, Lacroix R, Sabatier F, et al. Endothelial derived micro particles: Biological conveyors at the crossroad of inflammation, thrombosis and angiogenesis. Thromb Haemost. 2010;104(3):456-63. [ Links ]
16. Cugno M, Mari D, Meroni PL, et al. Haemostatic and inflammatory biomarkers in advanced chronic heart failure: role of oral anticoagulants and success full heart transplantation. Br J Haematol 2004; 126:85-92. [ Links ]
17. Vila V, Martínez-Sales V, Almenar L, Lázaro IS, Villa P,Reganon E. Inflammation, endothelial dysfunction and angiogenesis markers in chronic heart failure patients. Int J Cardiol. 2008;130(2):276-7. [ Links ]
18. Ihenetu K, Espinosa R, de Leon R, Planas G, Perez-Pinero A,Waldbeser L. Digoxin and digoxin-like immuno reactive factors (DLIF) modulate the release of pro-inflammatory cytokines. Inflamm Res. 2008; 57(11):519-23. [ Links ]
19. Gombos T, Förhécz Z, Pozsonyi Z, Wallentin S, Papassotiriou J, Kunde J, Morgenthaler NG, Jánoskuti L, Prohászka Z. Adrenomedullin and endothelin-1 are related to inflammation in chronic heart failure. Inflamm Res. 2009; 58(6):298-305. [ Links ]
20. Torre-Amione G. Immune activation in chronic heart failure. Am J Cardiol. 2005; 95(11A):3C-8C. [ Links ]















