Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.12 no.1 Ciudad Autónoma de Buenos Aires Mar. 2017
ARTICULO ORIGINAL
Disfunción grave de ventrículo derecho por ecocardiografía en hipertensión arterial pulmonar: prevalencia, predictores clínicos, ecocardiográficos y tratamiento
Guillermo Cursack1*, Cristian Núñez2*, María Lorena Coronel3*, Diego Echazarreta4*, Lilia Luz Lobo Márquez5*, Luis Lema6*, Eduardo Escudero7 y Eduardo Perna8*
1 Médico cardiólogo. Coordinador Unidad Coronaria. Sanatorio Esperanza. Santa Fe. República Argentina.
Magister de Ultrasonido en Cardiología. Departamento de Postgrado. Facultad de Ciencias Médicas. Universidad Nacional de la Plata. Buenos Aires. República Argentina.
2 Médico cardiólogo. Coordinador Unidad de Insuficiencia Cardíaca e Hipertensión pulmonar. CMAC y Clínica El Castaño. San Juan. República Argentina.
3 Médica cardióloga. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
4 Médico cardiólogo. Hospital San Juan de Dios. La Plata. Buenos Aires. República Argentina.
5 Médica cardióloga. Jefe del Departamento de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología. San Miguel de Tucumán. Tucumán. República Argentina.
6 Médico cardiólogo. Jefe del Departamento de Hipertensión pulmonar. Instituto Modelo de Cardiología. Córdoba. República Argentina.
7 Médico Cardiólogo. Director del Magister de Ultrasonido en Cardiología. Facultad de Medicina. Universidad Nacional de la Plata. Buenos Aires. República Argentina.
8 Médico cardiólogo. Jefe de División de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
* Miembro del Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar. Federación Argentina de Cardiología. República Argentina.
Correspondecia: Dr. Guillermo Cursack.
Sanatorio Esperanza. Belgrano 2381 (CP: S3080) Esperanza. Santa Fe. República Argentina.
Tel/Fax: +54 3496 420035
E-mail: gcursack@yahoo.com.ar
Recibido: 08/12/2016
Aceptado: 02/02/2017
Resumen
Introducción. La disfunción del ventrículo derecho (VD) es un marcador de alto riesgo en pacientes con hipertensión arterial pulmonar (HAP).
Objetivo. Evaluar la prevalencia, predictores independientes clínicos y ecocardiográficos, y el tratamiento de la disfunción grave del VD (DGVD) por ecocardiografía en la hipertensión arterial pulmonar.
Material y método. Entre Enero de 2010 y Diciembre de 2011, se incluyeron prospectivamente 422 pacientes (31 centros de 13 provincias argentinas). De ellos, 124 (29,4%) con HAP fueron incluidos en este análisis. La DGVD se definió por la presencia de deterioro moderado a severo de la función del VD o un TAPSE <15 mm.
Resultados. La edad media fue de 45 ± 17 años y el 78% fueron mujeres. La DGVD se identificó en 37 casos (29,8%). Los predictores clínicos independientes fueron fatiga (HR=5,2; IC95%=1,9-14,1; p=0,001), frecuencia cardíaca (HR=1,045; IC95%=1,003-1,088; p=0,033) y cardiomegalia (HR=2,9; IC95%=1,2-7,5; p=0,024). El ecocardiograma en DGVD mostró mayor dilatación de aurícula derecha (84 vs 61%; p=0,013) y presión sistólica pulmonar (89 ± 28 vs 77 ± 27 mm Hg; p=0,045), con menor fracción de eyección ventricular izquierda (59 ± 12 vs 67 ± 10%; p=0,002). El tratamiento fue diferente en la DGVD con diuréticos (87 vs 63%; p=0,010) y digoxina (38 vs 20%; p=0,031), con similar uso de sildenafil (87 vs 74%), iloprost (11 vs 10%), bosentán (19 vs 9%), treprostinil (5 vs 5%) y ambrisentán (5 vs 5%).
Conclusiones. Uno de cada tres pacientes con HAP presenta DGVD. El examen físico y la Rx de tórax permiten identificarlos clínicamente. La tasa similar de prescripción de fármacos específicos sugiere la necesidad de optimizar el tratamiento en estos casos más graves.
Palabras clave: Hipertensión arterial pulmonar; Disfunción de ventrículo derecho; Resistencia vascular pulmonar; Circulación pulmonar; Cardiopatías; Argentina
Summary
Severe right ventricular dysfunction by echocardiography in pulmonary arterial hypertension: prevalence, clinical predictors, echocardiograph and treatment
Introduction. Severe right ventricular dysfunction (SRVD) is a high risk marker in patients with pulmonary arterial hypertension (PAH). However, its clinical characteristics in Latin-Americans are poorly known.
Objective. We sought to assess the prevalence, clinical markers and treatment of SRVD in Argentinean patients with PAH.
Material and methods. Between Jan-10/Dec-11, 422 patients with diagnosis of pulmonary hypertension were prospectively included in 31 centers from 13 provinces from Argentina. Of them, 124 (29.4%) with diagnosis of PAH were included in the present analysis. SRVD was defined by moderate to severe RV dysfunction or TAPSE <15 mm.
Results. Mean age was 45±17 and 78% were female. In logistic regression analysis, independent clinical predictors were fatigue (HR=5.2, 95%CI=1.9-14.1, p=0.001), heart rate (HR=1.045, 95%CI=1.003-1.088, p=0.033), and cardiomegaly (HR=2.9, 95%CI=1.2-7.5, p=0,024). Echocardiogram in SRVD showed more frequently right atrial dilation (84 vs 61%, p=0.013), and higher systolic pulmonary artery pressure (89±28 vs 77±27 mmHg, p=0.045), with lower left ventricular ejection fraction (59±12 vs 67±10 %, p=0.002). Treatment in SRVD was different in the use of diuretics (87 vs 63%, p=0.010) and digoxin (38 vs 20%, p=0.031), and it was similar in the use of sildenafil (87 vs 74%); iloprost (11 vs 10%); bosentan (19 vs 9%); treprostinil (5 vs 5%), and ambrisentan (5 vs 5%).
Conclusion. One out of three patients with PAH presented SRVD. Physical examination and chest x-ray permit clinical identification. These patients received similar rate of specific drugs, suggesting the need of optimization of therapy driven to PAH in these more severe cases.
Keywords: Arterial pulmonary hypertension; Right ventricular dysfunction; Vascular resistance; Pulmonary circulation; Heart diseases; Argentine
Resumo
Disfunção grave do ventrículo direito por ecocardiografia na hipertensão arterial pulmonar: prevalência, preditores clínicos, ecocardiográficos e tratamento
Introdução. A disfunção grave do ventrículo direito (VD) é um marcador de alto risco em pacientes com hipertensão arterial pulmonar (HAP). Entretanto, suas características clínicas nos latino-americanos são mal conhecidas.
Objetivo. Avaliar a prevalência, os marcadores clínicos e o tratamento da disfunção grave do VD em pacientes com HAP.
Material e métodos. Entre janeiro de 2010 e dezembro de 2011, foram incluídos prospectivamente 422 pacientes com diagnóstico de hipertensão pulmonar em 31 centros de 13 províncias da Argentina. Destes, 124 (29,4%) com diagnóstico de HAP foram incluídos na presente análise. A disfunção grave do VD foi definida por disfunção do VD moderada a grave ou TAPSE <15 mm.
Resultados. A idade média foi de 45 ± 17 e 78% eram do sexo feminino. Na análise de regressão logística, os preditores clínicos independentes foram fadiga (HR=5,2; IC 95% = 1,9-14,1; p=0,001), freqüência cardíaca (HR=1,045; IC95% = 1,003-1,088; p=0,033) e cardiomegalia (HR=2,9; IC 95% = 1,2-7,5; p=0,024). O ecocardiograma na disfunção grave do VD apresentou maior freqüência de dilatação atrial direita (84 vs 61%; p=0,013) e maior pressão arterial sistólica (89 ± 28 vs 77 ± 27 mm Hg; p=0,045), com fração de ejeção ventricular esquerda menor (59 ± 12 vs 67 ± 10%; p=0,002). O tratamento foi diferente na disfunção grave do VD com diuréticos (87 vs 63%; p=0,010) e digoxina (38 vs 20%; p=0,031), sendo semelhante no uso de sildenafilo (87 vs 74%), iloprost (11 vs 10%), bosentano (19 vs 9%), treprostinil (5 vs 5%) e ambrisentano (5 vs 5%).
Conclusão. Um em cada três pacientes com HAP apresentou disfunção grave do VD. O exame físico e a radiografia de tórax permitem a identificação clínica. Esses pacientes receberam taxa similar de medicamentos específicos, sugerindo a necessidade de otimização da terapia dirigida à HAP nesses casos mais graves.
Palavras-chave: Hipertensão arterial pulmonar; Disfunção ventricular direita; Resistência vascular pulmonar; Circulação pulmonar; Doenças cardíacas; Argentina
Introducción
La hipertensión arterial pulmonar (HAP) es una enfermedad de baja prevalencia, estimada en 15 casos por millón de habitantes y una incidencia de 2,4 casos por millón por año, pero con un pronóstico grave1,2. Habitualmente, se utiliza el término HAP para referirse al grupo 1 de la actual clasificación de hipertensión pulmonar (HP)3. En los últimos 25 años, ha habido avances importantes en el conocimiento de la HP, lo cual puede ser atribuido en gran parte a la adquisición de información relacionada a su epidemiología y curso clínico a través de diferentes registros internacionales4-13.
Aunque la lesión inicial en la HAP compromete a la vasculatura pulmonar, la supervivencia de estos pacientes está estrechamente relacionada con la función del ventrículo derecho (VD)14-25. El VD se adapta al aumento de la postcarga mediante el engrosamiento de su pared. Sin embargo, en la gran mayoría de los pacientes, estos mecanismos compensatorios son insuficientes y, finalmente, la disfunción del VD ocurre15. Varios estudios con ecocardiografía han demostrado el valor pronóstico de la excursión sistólica del plano anular tricuspídeo (TAPSE), el índice de rendimiento miocárdico del VD (índice de Tei), el tamaño de la aurícula derecha (AD) y el derrame pericárdico en este grupo de pacientes16-20,24,26.
Recientes investigaciones se han focalizado en el tratamiento de la disfunción ventricular derecha grave en estos pacientes con HAP. Todavía no están claros el beneficio del tratamiento específico en la HAP y la extrapolación del tratamiento de la disfunción ventricular izquierda.
Finalmente, poco se conoce de las características ecocardiográficas del ventrículo izquierdo (VI) en este grupo con HAP grave y pronóstico reservado.
El Registro HINPULSAR (HIpertensióN PULmonar y aSociaciones en la ARgentina) coordinado por el Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar de la Federación Argentina de Cardiología, a través de sus sociedades y delegaciones federadas permitió conocer la realidad de la hipertensión pulmonar en Argentina y en este análisis, las características de aquellos pacientes con HAP y disfunción grave del ventrículo derecho (DGVD)27.
Objetivos
Determinar mediante el análisis ecocardiográfico la prevalencia de pacientes con disfunción ventricular derecha grave, analizar sus predictores clínicos y su tratamiento.
Definir los parámetros ecocardiográficos tanto del VD como del VI que acompañan a la DGVD en pacientes con HAP.
Material y método
Hipótesis
La DGVD es un reconocido marcador pronóstico en HAP, enfermedad de baja prevalencia, pero de mal pronóstico. El tratamiento específico y precoz de esta patología permite mejorar su sobrevida, a un alto costo. El ecocardiograma Doppler nos permitirá, seleccionando los pacientes con DGVD y otros parámetros ecocardiográficos, identificar variables epidemiológicas, clínicas y de tratamiento para ofrecer mejores recursos a los pacientes que más se benefician.
Población de estudio
Análisis retrospectivo del Registro HINPULSAR que incluyó 422 pacientes entre Enero de 2010 y Diciembre de 2011. De ellos, 124 (29,4%) con HAP fueron incluidos en este análisis (Figura 1).
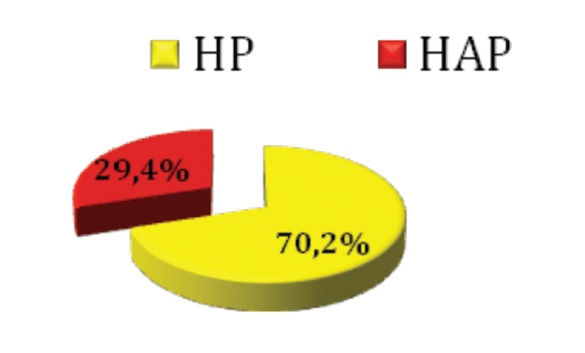
Figura 1. Pacientes incluidos en el Registro HINPULSAR del cual se analizaron el 29,4% que representaban el grupo con HAP.
HP: hipertensión pulmonar. HAP: hipertensión arterial pulmonar
De acuerdo a la clasificación de Dana Point, la HAP incluyo a la hipertensión pulmonar idiopática, hereditaria, asociada a drogas y toxinas, asociada a enfermedades del tejido conectivo, infección por el virus de la inmunodeficiencia humana, hipertensión portal, enfermedad cardíaca congénita, esquistosomiasis o anemia hemolítica crónica, hipertensión pulmonar persistente del recién nacido, enfermedad venooclusiva pulmonar y/o hemangiomatosis capilar pulmonar.
La DGVD se definió por la presencia de deterioro de la fracción de eyección (FE) del VD por análisis cualitativo o un TAPSE <15 mm en el ecocardiograma.
Puntos finales
Clínicos: subgrupo HAP de la clasificación de Dana Point, presencia de fatiga, clase funcional (CF) según la New York Heart Association (NYHA) al diagnóstico, frecuencia cardíaca, internaciones previas por insuficiencia cardíaca, cardiomegalia en la radiografía de tórax.
Ecocardiográficos: dilatación de AD (>18 cm2), dilatación de VD (basal >42 mm), dilatación de arteria pulmonar (AP) (distal >27 mm), disfunción diastólica (si-no), septum paradojal (si-no), derrame pericárdico (si-no), insuficiencia tricuspídea (no-leve-moderadasevera), insuficiencia pulmonar (no-leve-moderadasevera), presión sistólica pulmonar (PSP) (mm Hg), TAPSE (mm), aurícula izquierda (AI) (mm), diámetro diastólico de VI (mm), fracción de acortamiento (%), FE (normal-disfunción leve-moderado-severa).
Todos los estudios fueron realizados por ecocardiografistas experimentados. La señal de insuficiencia tricuspídea fue obtenida con el Doppler continuo desde el plano apical 4 cámaras.
El TAPSE se obtuvo colocando el cursor del modo M a través del anillo tricuspídeo, y midiendo la cantidad de movimiento longitudinal del anillo en el pico de la sístole.
La presión sistólica del VD (PSVD) fue determinada por el pico de velocidad de la insuficiencia tricuspídea, usando la ecuación simplificada de Bernoulli, y combinando este valor con un estimado de la presión de la AD: PSVD=4(V2) + PAD, donde V es el pico de velocidad (en metros por segundo) del jet de insuficiencia tricuspídea, y la PAD (presión de aurícula derecha) se estimó del diámetro de la vena cava inferior (VCI) y los cambios respiratorios, según lo recomendado por Asociación Americana de Ecocardiografía.
El registro se realizó cumpliendo la ley de protección de datos personales y de acuerdo con las recomendaciones internacionales sobre investigación clínica de la Declaración de Helsinki de la Asociación Médica Mundial.
Los autores poseen acceso completo a los datos y toman la responsabilidad de su integridad. Todos los autores han leído y acuerdan con el manuscrito que a continuación se reporta.
Análisis estadístico
Las variables categóricas fueron expresadas como porcentajes y comparadas con el test del Chi cuadrado de Pearson. Las variables continuas fueron presentadas como media y desvió estándar y se compararon con el test de Student y U de Mann-Whitney. Se evaluaron en un análisis univariado y multivariado los factores relacionados con la mortalidad e internaciones a través del análisis proporcional de Cox. Fueron consideradas estadísticamente significativas diferencias en el valor de p<0,05. Todos los análisis estadísticos fueron realizados con el programa SPSS 18.0 (SPSS Inc., Chicago, Il.).
Resultados
La edad promedio de nuestra población fue de 45±17 años y el 78% de los pacientes fueron mujeres. La DGVD se identificó en 37 casos (29,8%) de los 124 pacientes analizados con HAP. De acuerdo a la clasificación de Dana Point, la HAP fue idiopática en el 51,6%, hereditaria el 1,6%, por drogas el 2,4%, en pacientes portadores de colagenopatías el 15,3%, en pacientes con hipertensión portal el 1,6% y en pacientes con cardiopatías congénitas el 27,4%, con una prevalencia de DGVD de 33, 0, 0, 33, 32 y 27%, respectivamente (p=ns) (Figura 2). Las características clínicas en pacientes con y sin DGVD fueron diferentes en la presencia de fatiga (73 vs 39%; p=0,001), CF al diagnóstico (CF I: 0 y 13, CF II:37 y 26, CF III: 25 y 51, CF IV: 53 y 10%; p=0,012), frecuencia cardíaca (FC) (82±11 vs 76±13; p=0,017), internaciones previas por insuficiencia cardíaca (41 vs 22%; p=0,033) y cardiomegalia en la radiografía de tórax (65 vs 32%; p=0,001).

Figura 2. Subgrupos etiológicos de pacientes con y sin DGVD e HAP.
DGVD: disfunción grave de ventrículo derecho. HAP: hipertensión arterial pulmonar.
Los predictores clínicos independientes de DGVD fueron fatiga (HR=5,2; IC95%=1,9-14,1; p=0,001), FC (HR=1,045; IC95%=1,003-1,088; p=0,033) y cardiomegalia (HR=2,9; IC95%=1,2-7,5; p=0,024). El ecocardiograma en DGVD mostró mayor dilatación de AD (84 vs 61%; p=0,013) y PSP (89±28 vs 77±27 mm Hg; p=0,045), con menor FE del VI (59±12 vs 67±10 %; p=0,002). En la Tabla 1, se pueden analizar los parámetros derivados del estudio ecocardiográfico. Un segundo modelo multivariado, incluyendo estos datos, demostró que los factores asociados a la DGVD fueron fatiga (HR=9,5; IC95%=2,6-35; p=0,001), FC (HR=1,073; IC95%=1,020-1,128; p=0,007), CF (HR=2,4; IC95%=1,1-5,5; p=0,030) y FE del VI (HR=0,92; IC95%=0,86-0,97; p=0,003) (Tabla 2). El tratamiento fue diferente en la DGVD con diuréticos (87 vs 63%; p=0,010) y con digoxina (38 vs 20%; p=0,031), con similar uso de sildenafil (87 vs 74%), iloprost (11 vs 10%), bosentán (19 vs 9%), treprostinil (5 vs 5%) y ambrisentán (5 vs 5%) (Figura 3).
Tabla 1. Resultados del ecocardiograma Doppler de pacientes con y sin DGVD e HAP
(DGVD: disfunción grave de ventrículo derecho. HAP: hipertensión arterial pulmonar)
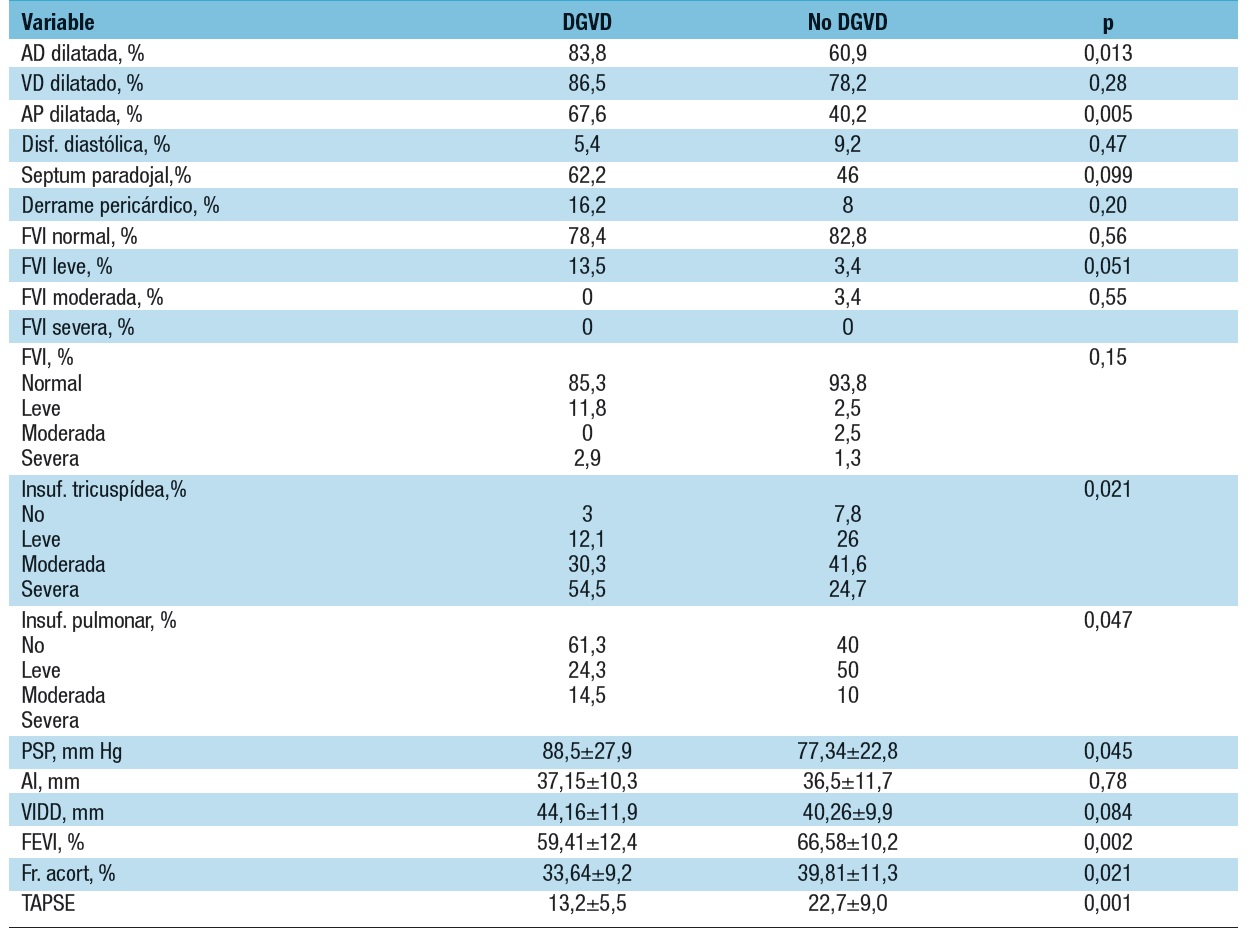 AD: auricular derecha. VD: ventrículo derecho. AP: arteria pulmonar. Disf. diastólica: disfunción diastólica. FVI: función del ventrículo izquierdo. Insuf.: insuficiencia. PSP: presión sistólica pulmonar. AI: aurícula izquierda. VIDD: diámetro diastólico del ventrículo izquierdo. FEVI: fracción de eyección del ventrículo izquierdo. Fr. acort.: fracción de acortamiento. TAPSE: excursión sistólica del plano anular tricuspídeo.
AD: auricular derecha. VD: ventrículo derecho. AP: arteria pulmonar. Disf. diastólica: disfunción diastólica. FVI: función del ventrículo izquierdo. Insuf.: insuficiencia. PSP: presión sistólica pulmonar. AI: aurícula izquierda. VIDD: diámetro diastólico del ventrículo izquierdo. FEVI: fracción de eyección del ventrículo izquierdo. Fr. acort.: fracción de acortamiento. TAPSE: excursión sistólica del plano anular tricuspídeo.
Tabla 2. Resultados del análisis multivariado de pacientes con y sin DGVD e HAP
(DGVD: disfunción grave de ventrículo derecho. HAP: hipertensión arterial pulmonar)

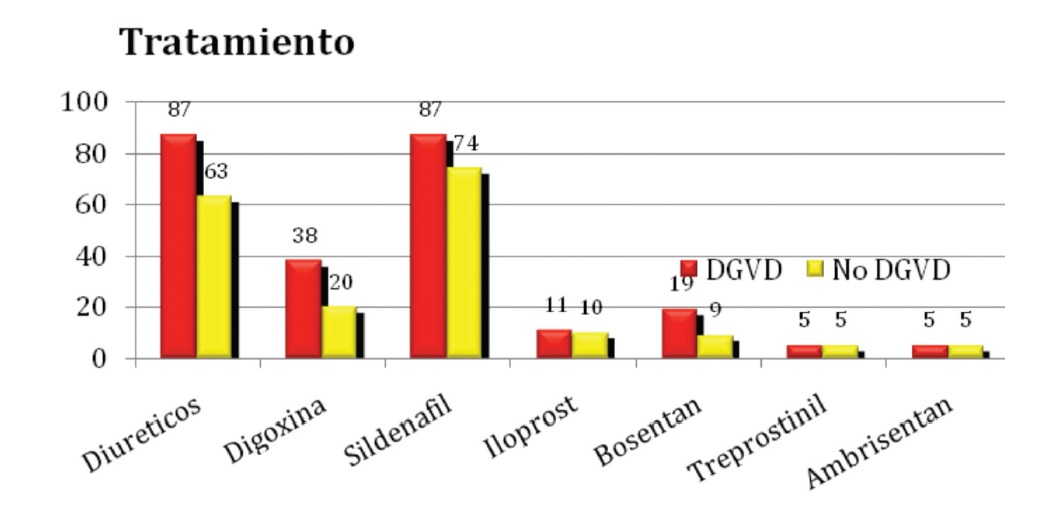
Figura 3. Gráfico de barras que expresa el porcentaje de pacientes con y sin DGVD e HAP que recibieron los diferentes tratamientos instituidos.
DGVD: disfunción grave de ventrículo derecho. HAP: hipertensión arterial pulmonar.
Discusión
El principal hallazgo de este estudio, analizando la base de datos del Registro HINPULSAR, nos revela que uno de cada tres pacientes con HAP presentó disfunción grave de ventrículo derecho.
Cabe recordar que el VD es muy sensible al aumento de la postcarga y responde de manera poco adecuada a los cambios agudos de presión. Los incrementos crónicos de presión son mejor tolerados por el VD. Éste, responde alterando su geometría, con hipertrofia de sus paredes y con aumento progresivo de la precarga. La alteración geométrica de la cámara derecha le confiere una forma elíptica similar a la del VI y, si los mecanismos compensatorios son inadecuados, se produce una progresión hacia la falla de bomba. Habitualmente, se desarrolla una insuficiencia tricuspídea temprana y la regurgitación severa es un signo de insuficiencia ventricular derecha avanzada28.
Es de destacar que el síndrome clínico que acompaña a la DGVD es producto de un subóptimo drenaje sanguíneo y/o aumento de la presión venosa sistémica en reposo o esfuerzo consecuencia de elevación de la postcarga del VD. Los síntomas clásicos son limitación del ejercicio y sobrecarga hídrica. Otros síntomas acompañantes son las taquiarritmias supraventriculares y el síncope28.
En el registro de un centro de referencia en Argentina, el 58,7% de los pacientes mostraban deterioro significativo de la función sistólica del ventrículo derecho (71/121 pacientes) y 18 tenían derrame pericárdico (14,9%; 18/121 pacientes). El análisis de subgrupo de este mismo registro reveló que el deterioro significativo de la función sistólica del ventrículo derecho prevaleció entre los pacientes del grupo con HAP idiopática (64%) y los pacientes con cardiopatías congénitas (60%)29.
Entre las razones que podrían explicar esta diferencia podemos destacar: lo inexacto y operador dependiente que resulta evaluar la función sistólica ventricular derecha en forma cualitativa, como lo hizo parte de nuestra población y la totalidad de dicho registro, y otra, estaría determinada por las características de la población del registro unicéntrico caracterizado por una población en promedio más joven que la nuestra [34 (±15,7) vs 45(±17) años], con posiblemente enfermedad más avanzada por ser centro de derivación, especialmente, en los subgrupos etiológicos de cardiopatías congénitas y colagenopatías, donde la DGVD alcanzó el doble de prevalencia que en nuestra cohorte29.
Si analizamos ahora el registro multicéntrico más importante de los últimos años (REVEAL), la DGVD fue solo un poco menos frecuente que en nuestro estudio. Cabe destacar que, en comparación con nuestra población, este registro norteamericano mostró una población en promedio 5 años mayor y con pacientes con mejores variables pronósticas25.
Respecto a los predictores clínicos y al análisis del tratamiento de pacientes con DGVD, no pudimos encontrar estos sub-análisis y así poder compararlos con nuestro registro. Resulta llamativo que el tratamiento específico con sildenafil, iloprost, bosentán, treprostinil y ambrisentán no sea más utilizado en pacientes más graves, como los que presentan DGVD.
Al momento de definir los parámetros ecocardiográficos tanto del VD como del VI, que acompañan a la DGVD en pacientes con HAP, múltiples trabajos y registros establecieron los parámetros de mal pronóstico consensuados en las guías: el derrame pericárdico, el agrandamiento y/o disfunción del VD por TAPSE y el agradamiento de la AD1.
A diferencia de otros registros, el derrame pericárdico no alcanzo la significación estadística en nuestro registro; probablemente, por ser independiente a los otros factores relacionados a la DGVD.
La AD y AP dilatadas, la insuficiencia tricuspídea, la insuficiencia pulmonar y la PSAP se relacionaron con DGVD en forma estadísticamente significativa, quizás como variables subrogadas y no como indicadores pronósticos.
Otras variables no analizadas fueron descriptas por algunos autores como pronósticas: la presión arterial pulmonar media y diastólica, curva septal anormal de fin de diástole y el diámetro y variación respiratoria de la VCI32.
El motivo por el cual otras variables ecocardiográficas no fueron incluidas en el registro tiene varias explicaciones: falta de conocimiento y tiempo por parte de los operadores al momento de hacer el estudio, equipos cuya tecnología no permitió determinar algunos parámetros y, finalmente, falta de convicción respecto a la utilidad clínica de algunos parámetros, reflejando la heterogénea población de los investigadores argentinos, con características regionales muy diferentes.
La misma dificultad fue reflejada en el Registro REVEAL, donde no pudo incluirse el TAPSE en el análisis multivariado pronóstico por la disparidad de la captura de esta variable entre los centros participantes25.
El único parámetro ecocardiográfico relacionando circulación sistémica con la DGVD que alcanzó significación estadística en nuestro registro fue la FE del VI. Las clásicas explicaciones fisiopatológicas de este hallazgo son la interdependencia ventricular debido a que ambos ventrículos están rodeados por fibras musculares comunes, comparten una pared (septum interventricular) y por estar envueltos por una “bolsa” común (pericardio)28.
Analizando otros datos ecocardiográficos relacionados al VI, resulta interesante la poca bibliografía relacionada al estudio del VI en pacientes con HAP y DVGD. En un trabajo realizado por Jessup y col. hace más de 25 años con pocos pacientes, se evidenciaba la falta de compromiso de la función ventricular izquierda en pacientes con disfunción ventricular derecha y desplazamiento septal. El propio S. Rich, pionero en describir la evolución natural de la enfermedad, en 1995, analizó el comportamiento de la función sistólica ventricular izquierda entre las diferentes causas de HAP, concluyendo que no habría una diferencia sustancial y que la función ventricular izquierda está preservada en etapas avanzadas de la enfermedad, en discordancia con nuestros resultados30,31.
En los últimos años, se han descripto otros marcadores pronósticos derivados del ecocardiograma Doppler: presión media en arteria pulmonar, presión diastólica en arteria pulmonar y curva septal anormal de fin de diástole32 y de nuevas tecnologías: el strain y el strainrate33. También, se ha publicado mucho recientemente sobre DGVD evaluado con ecocardiografía 3D y resonancia magnética cardíaca, aunque todavía no han logrado el grado de difusión y validación necesarios para utilizarlos en la práctica diaria34.
Conclusión
Uno de cada tres pacientes con HAP presenta DGVD. El examen físico y la Rx de tórax permiten sospecharla clínicamente aunque el ecocardiograma Doppler nos confirma el diagnóstico. La presencia de DGVD permite identificar una población de pacientes con HP con peor pronóstico y sugiere la necesidad de optimizar el tratamiento específico en estos casos más graves.
Limitaciones
Por ser un análisis retrospectivo, el Registro HINPULSAR no incluyó algunas variables ecocardiográficas indiscutidas, que sí se están incluyendo en registros actuales. Por otro lado, al ser un registro patrocinado por la Federación Argentina de Cardiología (FAC), los investigadores y los centros que incluyeron pacientes no representan la totalidad de la población argentina, sino un grupo de pacientes relacionado con las zonas evaluadas.
Agradecimientos
A los miembros de Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar de FAC. A los compañeros del Magister de Ultrasonido. A mi familia y amigos.
Recursos financieros
Los autores no recibieron ningún apoyo económico para la investigación.
Conflicto de intereses
Los autores declararon no tener conflicto de intereses.
1. Galie N, Hoeper MM, Humbert M, et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009; 30, 2493-2537. [ Links ]
2. Humbert M, Sitbon O, Chaouat A, et al. Pulmonary arterial hypertension in France: results from a national registry. Am J Respir Crit Care Med 2006; 173:1023-1030. [ Links ]
3. Simonneau G, et al. Updated Clinical Classification of Pulmonary Hypertension. J Am Coll Cardiol 2009; 54: S43-54. [ Links ]
4. D’Alonzo GE, Barst RJ, Ayres SM, et al. Survival in patients with primary pulmonary hypertension: results from a national prospective registry. Ann Intern Med 1991; 115:343-349.
5. Peacock AJ, Murphy NF, McMurray JJV, Caballero L, Stewart S. An epidemiological study of pulmonary arterial hypertension. Eur Respir J 2007; 30:104-109. [ Links ]
6. Tuellera C, Strickerb H, Soccalc P, Tammd M, Auberte JD, Maggiorinif M, et al., for the Swiss Society for Pulmonary Hypertension. Epidemiology of pulmonary hypertension: new data from the Swiss registry. Swiss Med Wkly 2008; 138:379-384. [ Links ]
7. Zagolin M, Wainstein E, Uriarte P, Parra C. Caracterización clínica, funcional y hemodinámica de la población con hipertensión pulmonar arterial evaluada en el Instituto Nacional del Tórax. Rev Méd Chile 2006; 134:589-595. [ Links ]
8. Escribano Subías P, Morales Marín P, Baloira Villar A, y col. REHAP: Registro Español de Hipertensión Arterial Pulmonar. https://www.rehap.org. [ Links ]
9. McGoon MD, Krichman A, Farber HW, Barst RJ, Raskob GE,Liou TG, et al. Design of the REVEAL Registry for US patients with pulmonary hypertension. Mayo Clin Proc 2008; 83:923-931. [ Links ]
10. Melero MJ. Estado actual de la hipertensión arterial pulmonar. Insuf Card 2009; 4(1):23-26. [ Links ]
11. Hoeper M, Barberá JA, Channick RN, Hassoun PM, Lang IM, Manes A, et al. Diagnosis, assessment, and treatment of non-pulmonary arterial hypertension. J Am Coll Cardiol 2009; 54:85-96. [ Links ]
12. Bonderman D, Martisching AM, Moertl D, Lang IM. Pulmonary hypertension in chronic heart failure. Int J Clin Pract 2009; 63:4-10. [ Links ]
13. McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Lindner JR, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension: a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents. J Am Coll Cardiol 2009; 53:1573-1619. [ Links ]
14. Bortman G. Presentación clínica y clasificación actual de la hipertensión arterial pulmonar. Insuf Card 2009; 4(1):27-32. [ Links ]
15. Vonk-Noordegraaf A, and col. Right heart adaptation to pulmonary arterial hypertension: physiology andpathobiology. J Am Coll Cardiol 2013; 62(25 Suppl):D22-33. [ Links ]
16. Campo A, Mathai SC, Le Pavec J, et al. Hemodynamic predictors of survival in scleroderma-related pulmonary arterial hypertension. Am J Respir Crit Care Med 2010; 182:252-60. [ Links ]
17. Forfia PR, Fisher MR, Mathai SC, et al. Tricuspid annular displacement predicts survival in pulmonary hypertension. Am J Respir Crit Care Med 2006; 174:1034-41. [ Links ]
18. Gan CT, Lankhaar JW, Westerhof N, et al. Non-invasively assessed pulmonary artery stiffness predicts mortality in pulmonary arterial hypertension. Chest 2007; 132:1906-12. [ Links ]
19. Ghio S, Klersy C, Magrini G, et al. Prognostic relevance of the echocardiographic assessment of right ventricular function in patients with idiopathic pulmonary arterial hypertension. Int J Cardiol 2010; 140:272-8. [ Links ]
20. Ghio S, Pazzano AS, Klersy C, et al. Clinical and prognostic relevance of echocardiographic evaluation of right ventricular geometry in patients with idiopathic pulmonary arterial hypertension. Am J Cardiol 2011; 107:628-32. [ Links ]
21. Humbert M, Sitbon O, Chaouat A, et al. Survival in patients with idiopathic, familial, and anorexigen-associated pulmonary arterial hypertension in the modern management era. Circulation 2010; 122: 156-63. [ Links ]
22. Mahapatra S, Nishimura RA, Sorajja P, Cha S, McGoon MD. Relationship of pulmonary arterial capacitance and mortality in idiopathic pulmonary arterial hypertension. J Am Coll Cardiol 2006; 47: 799-803. [ Links ]
23. Raymond RJ, Hinderliter AL, Willis PW, et al. Echocardiographic predictors of adverse outcomes in primary pulmonary hypertension. J Am Coll Cardiol 2002; 39:1214-9. [ Links ]
24. Sachdev A, Villarraga HR, Frantz RP, et al. Right ventricular strain for prediction of survival in patients with pulmonary arterial hypertension. Chest 2011; 139:1299-309. [ Links ]
25. Benza RL, Miller DP, Gomberg-Maitland M, Frantz RP, Foreman AJ, Coffey CS, Frost A, Barst RJ, Badesch DB, Elliott CG, Liou TG, McGoon MD. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early and Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL). Circulation 2010; 122(2):164-72. [ Links ]
26. Vonk MC, Sander MH, van den Hoogen FH, van Riel PL, Verheugt FW, Van Dijk AP. Right ventricle Tei-index: a tool to increase the accuracy of non-invasive detection of pulmonary arterial hypertension in connective tissue diseases. Eur J Echocardiogr 2007; 8: 317-21. [ Links ]
27. Federación Argentina de Cardiologia. Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar. Diseño del Registro HINPULSAR: Hipertensión Pulmonar y Asociaciones en la Argentina. Insuf Card 2010;5(3): 126-131. [ Links ]
28. Tazar J, Álvarez MS. Cuantificación de la función sistólica del ventrículo derecho en pacientes con hipertensión pulmonar. Rev Fed Arg Cardiol 2012; 41(2): 89-95. [ Links ]
29. Talavera ML, Cáneva JO, Favaloro LE, Klein F, Boughen RP, Bozovich GE, Ossés JM, Favaloro RR, Bertolotti AM. Hipertensión arterial pulmonar. Registro de un centro de referencia en Argentina. RAMR 2014;14(2):144-152. [ Links ]
30. Jessup M, Sutton MS, Weber KT, Janicki JS. The effect of chronic pulmonary hypertension on left ventricular size, function, and interventricular septal motion. Am Heart J 1987;113(5):1114-22. [ Links ]
31. Louie EK, Lin SS, Reynertson SI, Brundage BH, Levitsky S, Rich S. Pressure and volume loading of the right ventricle have opposite effects on left ventricular ejection fraction. Circulation 1995;92(4):819-24. [ Links ]
32. Brierre G, Blot-Souletie N, Degano B, Têtu L, Bongard V, Carrié D. New echocardiographic prognostic factors for mortality in pulmonary arterial hypertension. Eur J Echocardiogr 2010; 11(6):516-22. [ Links ]
33. Sachdev A, Villarraga HR, Frantz RP, McGoon MD, Hsiao JF, Maalouf JF, AmmashNM, McCully RB, Miller FA, Pellikka PA, Oh JK, Kane GC. Right ventricular strain for prediction of survival in patients with pulmonary arterial hypertension. Chest 2011; 139(6):1299-309. [ Links ]
34. Grapsa J, O’Regan DP, Pavlopoulos H, Durighel G, Dawson D, Nihoyannopoulos P. Right ventricular remodeling in pulmonary arterial hypertension with three-dimensional echocardiography: comparison with cardiac magnetic resonance imaging. Eur J Echocardiogr 2010; 11(1):64-73.














