Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.12 no.2 Ciudad Autónoma de Buenos Aires June 2017
ARTICULO DE REVISION
Evaluación ecocardiográfica de la función ventricular derecha para la detección temprana de la cardiotoxicidad inducida por antraciclinas
Jenny Karina Villasmil Camacho1, Eduardo Escudero2
1 Médica cardióloga. Magister de Ultrasonido en Cardiología. Departamento de Postgrado. Facultad de Ciencias Médicas. Universidad Nacional de La Plata. Buenos Aires. República Argentina.
2 Médico cardiólogo. Director del Magister de Ultrasonido en Cardiología. Facultad de Medicina. Universidad Nacional de La Plata. Buenos Aires. República Argentina.
Correspondencia: Dr. Eduardo M. Escudero
Magister de Ultrasonido en Cardiología. Facultad de Ciencias Médicas. Universidad de La Plata.
Calle 6 Nº 212. CP: 1900. La Plata. Buenos Aires. República Argentina.
E-mail: magisterecounlp@gmail.com
Recibido: 15/12/2016
Aceptado: 25/03/2017
Resumen
Las enfermedades cardiovasculares y el cáncer son las principales causas de muerte. Actualmente, existe un importante progreso en la oncología en cuanto a su diagnóstico precoz y su correspondiente tratamiento, como a la mejora de la sobrevida y de la calidad de vida debido al uso de tratamientos antineoplásicos combinados. Al mismo tiempo, se han incrementado los efectos adversos cardiológicos de dichos tratamientos, dando origen a una nueva cohorte de pacientes, quienes alcanzarán una supervivencia suficiente como para padecer complicaciones cardíacas derivadas del tratamiento oncológico.
Este trasfondo clínico hace que la cardiotoxicidad derivada del tratamiento oncológico (quimioterapia y radioterapia) se transforme en una de sus principales complicaciones, por lo cual una respuesta multidisciplinaria que asocie el conocimiento de los oncólogos e internistas al de los cardiólogos será cada vez más necesaria para el mejor manejo de una población crónica en crecimiento constante.
La ecografía ha sido validada como el método diagnóstico que proporciona mayor precisión en el cálculo de la fracción de eyección, siendo el método de elección para la evaluación inicial y el seguimiento de los pacientes tratados oncológicamente.
La detección temprana de alteraciones cardiovasculares en pacientes tratados con quimioterapia presenta el beneficio de obtener terapias alternativas, disminuyendo así la incidencia de cardiotoxicidad y su morbilidad y mortalidad asociadas.
Palabras clave: Ecocardiografía; Función ventricular; Ventrículo derecho; Quimioterapia; Cardiotoxicidad; Antraciclinas; Trastuzumab
Summary
Echocardiographic evaluation of right ventricular function for the early detection of anthracycline-induced cardiotoxicity
Cardiovascular diseases and cancer are the leading causes of death. Currently, there is an important progress in oncology regarding early diagnosis and its corresponding treatment, as well as the improvement of survival and quality of life due to the use of combined antineoplastic treatments. At the same time, the cardiological adverse effects of these treatments have been increased, creating a new cohort of patients who will experience sufficient survival to develop the cardiac complications derived from oncological treatment.
This clinical background makes the cardiotoxicity derived from oncologic treatment (chemotherapy and radiotherapy) become one of its main complications, so a multidisciplinary response that associates the knowledge of oncologists and internists with that of cardiologists will be increasingly necessary for the best management of a chronic population in constant growth.
Ultrasonography has been validated as the diagnostic method that provides greater accuracy in the calculation of ejection fraction, being the method of choice for the initial evaluation and follow-up of patients treated oncologically.
The early detection of cardiovascular alterations in patients treated with chemotherapy has the benefit of obtaining alternate therapies, thereby decreasing the incidence of cardiotoxicity and its associated morbidity and mortality.
Keywords: Echocardiography; Ventricular function; Right ventricle; Chemotherapy; Cardiotoxicity; Anthracyclines; Trastuzumab
Resumo
Avaliação ecocardiográfica da função ventricular direita para a detecção precoce de cardiotoxicidade induzida por antraciclinas
As doenças cardiovasculares e o câncer são as principais causas de morte. Atualmente, há um importante progresso em oncologia em relação ao diagnóstico precoce e seu correspondente tratamento, bem como a melhoria da sobrevida e qualidade de vida devido à utilização de tratamentos antineoplásicos combinados. Ao mesmo tempo, os efeitos adversos cardiológicos destes tratamentos foram aumentados, criando uma nova coorte de pacientes que alcançaram uma sobrevivência suficiente para desenvolver as complicações cardíacas derivadas do tratamento oncológico.
Este contexto clínico faz que a cardiotoxicidade derivada do tratamento oncológico (quimioterapia e radioterapia) se torne uma de suas principais complicações, portanto, uma resposta multidisciplinar que associe o conhecimento de oncologistas e internistas com os cardiologistas será cada vez mais necessária para o melhor manejo de uma população crônica em constante crescimento.
A ultrassonografia foi validada como o método de diagnóstico que fornece maior precisão no cálculo da fração de ejeção, sendo o método de escolha para avaliação inicial e seguimento de pacientes tratados oncologicamente.
A detecção precoce de alterações cardiovasculares em pacientes tratados com quimioterapia tem o benefício de obter terapias alternativas, diminuindo assim a incidência de cardiotoxicidade e sua morbidade e mortalidade associadas.
Palavras-chave: Ecocardiografia; Função ventricular; Ventrículo direito; Quimioterapia; Cardiotoxicidad; Antraciclinas; Trastuzumab
Introducción
Las enfermedades cardiovasculares y el cáncer son las principales causas de muerte. En Argentina, el cáncer es responsable de 143 muertes/100.000 habitantes1,2.
Actualmente, existe un importante progreso en la oncología en cuanto a su diagnóstico precoz y su correspondiente tratamiento, como a la mejora de la sobrevida y de la calidad de vida debido al uso de tratamientos antineoplásicos combinados. Al mismo tiempo, se han incrementado los efectos adversos cardiológicos de dichos tratamientos (desde insuficiencia cardíaca hasta espasmo coronario, enfermedad microvascular, isquemia originada en arterias coronarias epicárdicas, hipertensión arterial, alteraciones de la coagulación con eventos tromboembólicos, compromiso pericárdico, alteraciones valvulares, prolongación del segmento QT y arritmias), dando origen a una nueva cohorte de pacientes, quienes alcanzan una supervivencia suficiente como para padecer complicaciones cardíacas derivadas del tratamiento oncológico. La mejora en la sobrevida de los pacientes tratados con terapia oncológica nos enfrenta a una población que se transforma en portadora de una patología cardiológica crónica. En el pasado estas complicaciones cardiovasculares eran menos evidentes, pues la expectativa de vida de los pacientes con cáncer era escasa, impidiendo que ellas se manifestaran en forma crónica. Más aún, al presente, el riesgo de mortalidad cardiovascular puede incluso superar al riesgo oncológico3,4. En niños sobrevivientes de cáncer la mortalidad por complicaciones cardiológicas por tratamiento oncológico puede aumentar hasta ocho veces5 . Paralelamente, la mayor edad agrega factores de riesgo clásicos en esta población. Este trasfondo clínico hace que la cardiotoxicidad derivada del tratamiento oncológico (quimioterapia y radioterapia) se transforme en una de sus principales complicaciones, por lo cual una respuesta multidisciplinaria que asocie el conocimiento de los oncólogos e internistas al de los cardiólogos será cada vez más necesaria para el mejor manejo de una población crónica en crecimiento constante, utilizando las mejores estrategias de diagnóstico y tratamiento de estos pacientes, unificar criterios y conductas, racionalizar los recursos diagnósticos y terapéuticos, enfatizar el valor de las guías como fuente de educación y promover el intercambio de información y experiencia entre la cardiología, la oncología y la medicina interna para lograr resultados satisfactorios6.
Cáncer
El término latino cáncer proviene del griego "karkinoma" y fue descrito por Hipócrates en el año 1600 a.C como "carcinos", debido a que la forma del crecimiento celular simula el cuerpo del cangrejo7. El cáncer es una enfermedad genética compleja, en la cual las células son insensibles a las señales que regulan su diferenciación, supervivencia, proliferación, muerte y como consecuencia, estas células se acumulan y producen lesión e inflamación del tejido local en respuesta al daño en los genes que regulan el crecimiento celular8. De manera general, esta enfermedad es el resultado de dos procesos sucesivos: un aumento de la proliferación de un grupo de células que dan origen a un tumor o neoplasia y la propiedad invasiva que les permite proliferar en otros tejidos u órganos, lo que se denomina metástasis9.
La descripción molecular del origen del cáncer se explicó por primera vez por el fisiólogo alemán, ganador del premio Nobel, Otto Heinrich Warburg, en 1924; quien demostró que las células tumorales generan energía (ATP: adenosin trifosfato), principalmente, por medio de la degradación no oxidativa de la glucosa o glicólisis anaeróbica (a diferencia de las células normales, que generan energía a partir de la degradación oxidativa del piruvato); planteándose de esta manera la hipótesis de Warburg o teoría del origen del cáncer. Esta hipótesis sostiene que el cáncer se produce por un defecto de la respiración celular causada por un daño en las mitocondrias, de manera que las células cancerosas fermentan la glucosa, manteniendo el mismo nivel de respiración presente antes del proceso de carcinogénesis, y por lo tanto, exhiben la glicólisis con secreción de lactato, alterando la respiración mitocondrial incluso en presencia de oxígeno. Por ello, el uso de la glicólisis en las células cancerosas, seguida de fermentación láctica como fuente de energía, es conocido actualmente como el efecto Warburg10. A partir de ello, se han publicado numerosos estudios que pretenden describir y conocer la biología tumoral en el cáncer, lo que permite comprender el impacto de las drogas anticancerosas en estas células, que tienen la capacidad de evadir los mecanismos que generan apoptosis, inactivar las vías reparadoras de señales y crear interacciones bioquímicas que les permiten sobrevivir, generar energía y replicarse descontroladamente11.
Actualmente, se han descrito más de 200 tipos diferentes de cánceres, con una incidencia que alcanzan cifras alarmantes a nivel mundial, ocupando los primeros lugares entre las causas de morbi-mortalidad en muchos países12. En 2013 en Estados Unidos, hubo una incidencia de 580.350 muertes por cáncer (1600 muertes por día) y un incremento del 19% de nuevos casos diagnosticados en comparación con datos previos de 2009 (entre éstos, 112.800 latinoamericanos). Pero a su vez, el avance en los métodos de diagnóstico y tratamiento causaron la disminución de la mortalidad por cáncer en un 24%, un aumento de la supervivencia a 5 años del 65% de los casos recién diagnosticados y la existencia de más de 10 millones de sobrevivientes12,13.
Quimioterapia
En general, se dispone de tres tratamientos convencionales contra el cáncer: la cirugía, la radioterapia y la quimioterapia (QT). Los dos primeros cumplen su objetivo terapéutico cuando las células tumorales se encuentran puntualmente localizadas; por el contrario, cuando se sospecha que éstas se han diseminado, se recurre a la QT con el fin de destruir las células cancerosas sistémicas13. Lamentablemente, la quimioterapia no posee especificidad tumoral y también lesiona a las células sanas, incluyendo a las células cardíacas y este daño orgánico limita su aplicación y seguridad terapéutica9,13.
La palabra quimioterapia fue empleada por el químico alemán Paul Ehrlich en el año 1900, para hacer referencia al uso de productos químicos para tratar enfermedades14,18. El primer fármaco antineoplásico eficaz se descubrió de forma incidental a principios de 1940, cuando en un barco de guerra, se desató un derrame de mostaza de azufre (gas mostaza), utilizado como arma química por los alemanes en la primera guerra mundial (1917), conocido como agente vesicante, porque inducía la formación de vesículas en la piel, mucosas e hipoplasia del tejido linfoide15 ; todos estos efectos indeseables lo presentaron los marineros expuestos accidentalmente por el derrame marítimo, despertando el interés médico para su utilidad terapéutica en una situación clínica opuesta: la leucocitosis inducida por cáncer hematológico. De esta manera, en 1946 dos farmacólogos de la universidad de Yale, Louis Goodman y Alfred Gilman, lograron sintetizar la mustina o mostaza de nitrógeno, lo aplicaron a ratones portadores de tumores linfoides y observaron una evolución favorable con descenso marcado de la celularidad y el tamaño tumoral; posteriormente, la mustina fue aplicada a un paciente con linfoma no Hodgkin avanzado, pero sólo se observó una regresión parcial del tumor y los síntomas16. A pesar de que la aplicación clínica fue limitada, estos resultados forjaron la investigación de varios compuestos alquilantes que dieron origen a la ciclofosfamida, uno de los fármacos antineoplásicos más utilizados actualmente17.
A partir de 1960, se inició la producción, desarrollo y aplicación clínica de antibióticos con posible efecto antitumoral, quienes habían sido utilizados en la Segunda Guerra Mundial para combatir las infecciones de heridas y como consecuencia de su aplicación, los pacientes presentaban serias alteraciones hematológicas, por lo que se les destinó su uso a la terapéutica anticancerosa14,15 . El antibiótico antitumoral más representativo fue la actinomicina D, utilizado ampliamente en tumores pediátricos con éxito moderado18. Posteriormente, se descubrió una sustancia más activa que fue sintetizada de manera simultánea por 2 grupos de investigadores, uno en Italia y otro en Francia, quienes aislaron cepas de Streptomyces peuceticus, y a través de éste, la formación de un pigmento rojo con actividad antibiótica, que demostraba buena actividad contra tumores murinos (roedores). Ambos equipos llamaron a la sustancia daunorrubicina, debido a Daunos, una tribu romana que habitaba el área donde aislaron los microorganismos (del suelo de Castel del Monte, una fortaleza del siglo XIII); y rubis, palabra francesa que significa rubí, alegórico al color del pigmento. Con este descubrimiento se dio origen a las antraciclinas17. Posteriormente, el Dr. Federico Arcamone, logró la mutación de una cepa de Streptomyces, creando un nuevo antibiótico, también de color rojo, al que nombraron adriamicina, en reconocimiento al mar Adriático, obteniendo una mejor actividad contra tumores que la daunorrubicina; posteriormente a la adriamicina se le nombró doxorrubicina (Dox), como se le conoce actualmente19. En 1967, se comenzó a relacionar a la daunorrubicina con la aparición de insuficiencia cardíaca (IC) en niños con leucemia tratados con altas dosis. De la misma manera, la Dox demostró buena actividad antitumoral, pero sin reducir a la aparición de IC en los pacientes tratados15,18.
Los datos estadísticos y la relación con las bases fisiopatológicas de la cardiotoxicidad (CT) se describen por primera vez en 1983, en un trabajo publicado por el Dr. Michael Bristow20 , donde explica algunos mecanismos citotóxicos de las antraciclinas y el efecto dosis dependiente de la lesión miocárdica, en el cual, involucró a 3.941 pacientes que recibieron Dox, con una incidencia entre el 2,2 al 5,1% en la aparición de IC a una dosis de 400 mg/m2 , un incremento del 20% (7% de los casos) si la dosis se encuentra por encima de 500 mg/m2 y, específicamente, la aparición de disfunción sistólica del ventrículo izquierdo (VI), entre el 50-60%, con dosis de 430 a 600 mg/m2; por el contrario, si la dosis recibida era menor (de 240 a 360 mg/m2), se detectaba disfunción diastólica y una incidencia de IC del 1,6%. Estas observaciones han generado gran interés desde entonces y, actualmente, existen recomendaciones para la evaluación ecocardiográfica de los pacientes que reciben Dox tomando en cuenta la dosis administrada (Tabla 1).
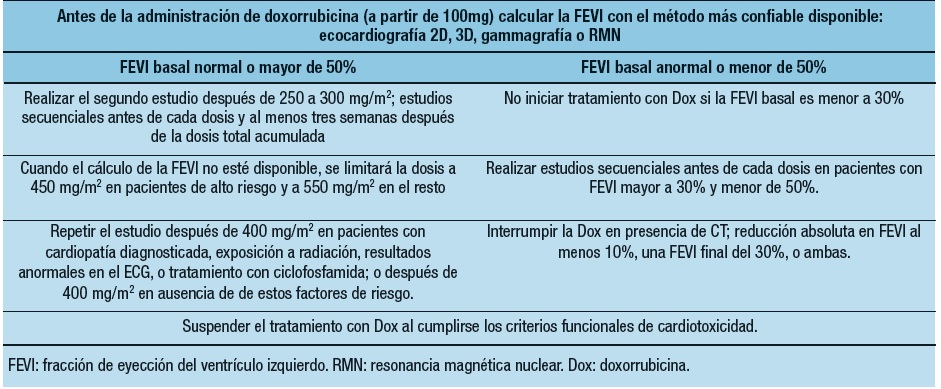
Tabla 1. Esquema actual de monitorización de la cardiotoxicidad por doxorrubicina
La miocardiopatía inducida por antraciclinas se asocia a un pronóstico desfavorable, con una mortalidad a 2 años de aproximadamente el 60%21. A pesar de estos resultados, los mecanismos moleculares que causan la CT dependiente de la dosis son controvertidos, debido a que existe evidencia de cambios celulares y lesión miocárdica con cualquier dosis aplicada de antraciclina22. La IC sintomática se desarrolla generalmente después de un año de inicio del tratamiento, pero el riesgo de presentar eventos cardiovasculares se magnifica al superponerse el daño cardíaco subclínico que resulta una cardiotoxicidad progresiva, con aparición tardía de la disfunción ventricular, tras años o décadas después del inicio de la QT21,22.
Hoy en día, las antraciclinas son los fármacos antineoplásicos más prescritos debido a su alta eficacia, pero a pesar que la investigación se ha extendido por más de siete décadas, aún existe incomprensión sobre los mecanismos patogénicos involucrados en la CT (Tabla 2), lo que impide ofrecer una óptima prevención a la aparición de la miocardiopatía o la IC23.

Tabla 2. Factores predisponentes para la aparición de cardiotoxicidad por antracíclicos
Diversos estudios se enfocaron en buscar estrategias que eviten la aparición de la CT, uno de los más destacados ofrece una estrategia farmacológica, se trata del estudio OVERCOME (preventiOn of left Ventricular dysfunction with Enalapril and caRvedilol in patients submitted to intensive ChemOtherapy for thetreatment of Malignant hEmopathies), liderado por el Dr. Bosch del hospital clínico de Barcelona y publicado en el Journal American College of Cardiology en 2013; donde se demostró que tanto los inhibidores de enzima conversora de angiotensina (IECA) como los betabloqueantes son eficaces para prevenir la aparición de disfunción ventricular izquierda en la cardiomiopatía inducida por antraciclinas24.
Cardiotoxicidad
A pesar que la prevención farmacológica ha sido una estrategia reciente, la búsqueda de métodos clínicos y paraclínicos para la identificación, detección precoz y prevención de la CT ha tenido una trayectoria histórica. En 1974, se implementó el análisis en conjunto del electrocardiograma, la radiografía de tórax, la fonocardiografía y el registro del pulso carotídeo mediante fotografías seriadas, como signos indirectos de disfunción ventricular post QT13, al inferir el cociente entre el período pre-eyectivo y el tiempo de eyección del VI. Para que la ecocardiografía formara parte del diagnóstico de CT, debió evolucionar desde sus inicios, desde 1954 con el modo M, luego en 1970 con el Doppler bidimensional, pulsado, continuo y color; en 1980 el ecocardiograma transesofágico (ETE) y en 1990 el ecocardiograma tridimensional. La ecocardiografía bidimensional revolucionó la manera de evaluar el corazón, porque permite una visión real de las estructuras cardíacas y, a su vez, permite realizar cálculos matemáticos aplicados a la fisiología mediante fórmulas de inferencia geométricas, obteniendo así la fracción de eyección del ventrículo izquierdo (FEVI), que aporta información sobre el estado, pronóstico y alteración del VI, con resultados comparables a los obtenidos por los estudios nucleares con radioisótopos25 . Con todas estas ventajas, en poco tiempo, la FEVI se estableció como el método de evaluación inicial y de seguimiento de la función ventricular durante la administración de QT26. De manera que, el impacto que tuvo el cálculo de la FEVI para definir el pronóstico de los pacientes con cáncer fue tan determinante, que permitió, a través del tiempo obtener múltiples definiciones de CT, pero siempre con dos puntos en común: los valores obtenidos de la fracción de eyección (FE) del ecocardiograma bidimensional y la presencia de síntomas25,28.
La CT fue definida por el Instituto Nacional del Cáncer de Estados Unidos, como la toxicidad que afecta al corazón27; sin embargo, este concepto simple adoptó muchas interpretaciones y fue ampliado por el grupo de investigación del trastuzumab, quienes adoptaron los siguientes criterios: miocardiopatía dilatada de nueva aparición; presencia de síntomas y/o signos de falla cardíaca; disminución de la FEVI <5% ó <55% con síntomas, y por último, disminución de más del 10% de la FEVI ó <55% sin síntomas28. Más allá de los efectos cardíacos propiamente dichos de la CT por QT, existen otros eventos cardiovasculares diferentes a la lesión del miocito; por esto, en el año 2014, se publicó un consenso de expertos en las revistas de las sociedades Europea y Americana de Cardiología, liderado por el Dr. Plana, quienes sugieren sustituir el término "cardiotoxicidad" por "disfunción cardíaca relacionada a la quimioterapia", con la idea de incluir aquellas lesiones cardiovasculares también desencadenadas por la QT, como son: hipertensión arterial (HTA), alteraciones del ritmo o del intervalo Q-T, trombosis, isquemia, miocarditis, pericarditis, entre otros. La nueva definición de CT de igual manera, se basa en los parámetros de la FEVI y en la presencia de síntomas; sin embargo, presenta las siguientes diferencias: la disminución en la FEVI debe ser de al menos 0,10 puntos porcentuales, por debajo del 53% global, confirmado por estudios sucesivos de dos a tres semanas después el estudio de diagnóstico (basal), mostrando la disminución inicial de la FE (la FE basal de 53% se debe a la reciente actualización de valores de referencia por ecocardiografía bidimensional). Esta caída de la FEVI puede clasificarse como sintomática o asintomática y, a su vez, según su reversibilidad puede ser reversible, cuando se encuentra a menos de 5 puntos porcentuales del estudio basal; parcialmente reversible, cuando mejoró al menos 10 puntos porcentuales desde el nadir, pero no sobrepasa los 0,5 puntos porcentuales por debajo del basal; irreversible, cuando existe más de 10 puntos porcentuales desde el nadir y el resto de 0,5 puntos porcentuales por debajo del basal; e indeterminado, cuando el paciente no está disponible para la reevaluación29.
Aunque la FEVI es el parámetro cardíaco que se monitoriza con mayor frecuencia durante la QT; el valor pronóstico de éste, actualmente, es controvertido. En un estudio de 28 pacientes con linfoma no Hodgkin tratados con Dox, se demostró una reducción significativa de la FEVI que predecía la aparición de cardiotoxicidad30.
Sin embargo, en un estudio de 120 pacientes con cáncer de mama seguidas antes, durante y después de 3 años de tratamiento con epirubicina, la monitorización de la FEVI no mostró correlación con la aparición de CT31.
Por otra parte, Alexander y colaboradores demostraron su utilidad en la evaluación secuencial de la FEVI en la práctica clínica32. A través del tiempo, se ha reconocido que el gran aporte de la FEVI es poder estimar con alta certeza la cantidad relativa de volumen eyectado durante la sístole33; sin embargo, en la disfunción sistólica ventricular, el volumen eyectado no es lo único afectado; por tanto, la FE enfrenta limitaciones que le impide ser un método único e infalible, sembrando la necesidad de buscar alternativas para evaluar la función sistólica ventricular. Esto requirió nuevos métodos a partir del ecocardiograma bidimensional que otorgaran información adicional, superaran las ventajas de la FE y que carecieran de las desventajas que lo limitan, como son, la interferencia con la calidad de las imágenes adquiridas, la reducción de error técnico dependiente del operador y la detección de cardiopatías que cursan con FEVI normal34.
Alrededor del año 2000, la descripción del modelo de banda única ventricular, por parte del Dr. Francisco Torrent-Guasp, abre una nueva visión en la cardiología para la evaluación de la función cardíaca, en la cual se fusiona el análisis de la anatomía, la fisiología y la patología, determinando que el corazón es una estructura multiplanar, que permitió el impulso y mejoramiento de las técnicas de imagen diagnósticas para evaluar y predecir la aparición de la lesión miocárdica antes que ocurran fenómenos irreversibles35. Con esa iniciativa nacen las medidas de deformación tisular derivados del Doppler, el strain y el análisis de rastreo de puntos (speckle tracking), que detectan alteraciones miocárdicas antes que exista disfunción sistólica o diastólica detectada por otros métodos36. Diversos estudios comenzaron a aplicar estas técnicas a los pacientes que recibían QT36-39, como el publicado por Fallah-Rad y col.40, quienes utilizaron la técnica de Doppler tisular (DTI) para demostrar que los índices de velocidad tisular (IVT) registrados en la base del anillo mitral lateral y los parámetros de deformación, permitían la detección temprana de disfunción cardíaca subclínica. Posteriormente, esto estuvo soportado por otros estudios que sospechaban CT crónica con FE normal, donde se estimaron parámetros en la velocidad del flujo pico temprano, la velocidad de flujo máximo auricular (E/A), el tiempo de desaceleración y tiempo de relajación isovolumétrica (disfunción diastólica tipo I); los cuales estuvieron todos afectados en más del 50% de los pacientes tratados con antraciclinas41.
Los estudios previamente descritos que demostraron cambios subclínicos sin provocar la caída de la FEVI, impulsaron el desarrollo de investigaciones que intentan predecir la aparición de lesión no visible, mediante el método de strain o spekle tracking (ST) en pacientes sin cardiopatía previa que recibían fármacos antineoplásicos40-56, con resultados alentadores. Entre los más representativos se destaca el estudio de Hare y col.34, quienes fueron los primeros en determinar que los cambios en la deformación del tejido evaluado a través de strain rate (SR), podían identificar la disfunción del ventrículo izquierdo antes que la FEVI, en mujeres con cáncer de mama que recibían trastuzumab. Posteriormente, se determinó que las técnicas de deformación auguran un valor pronóstico, como es el caso del trabajo publicado por la Dra. Scherrer-Crosbie y col., quienes incluyeron además de parámetros por ultrasonido, biomarcadores sanguíneos; observando en las pacientes con cáncer de mama que recibían antraciclinas, una disminución en las medidas de deformación longitudinal o elevación de la troponina ultrasensible, con un aumento del riesgo de cardiotoxicidad nueve veces mayor a los seis meses posterior a la QT43. Las nuevas técnicas ecocardiográficas están cada día más incluidas en la toma de decisiones clínicas, complementan las evaluaciones tradicionales y son implementadas en algunos centros de cardiología a nivel mundial.
Alteraciones del ventrículo derecho por quimioterapia
Actualmente, el concepto de CT está enfocado a las alteraciones mecánicas y fisiológicas del VI40-56; sin embargo, existe un creciente interés por detectar las probables alteraciones en el ventrículo derecho (VD), con la intención de determinar parámetros pronósticos, que detecten la disfunción ventricular temprana, el desarrollo de IC o cambios de la estructura ventricular previo a los síntomas durante la QT57,58. La estructura anatómica compleja tridimensional es la principal limitante en la evaluación ecocardiográfica funcional del VD, lo que ha dificultado la óptima estandarización de parámetros funcionales que permitan obtener resultados reales precisos57,59.
Históricamente, se ha retrasado el entendimiento de la función, la hemodinamia, los mecanismos moleculares y celulares participes de la disfunción del VD, probablemente, porque se le había dado una connotación errónea como cámara pasiva, con una función de bombeo restringida y vulnerable solo a los procesos patológicos del VI; ignorando las descripciones realizadas en 1616 por William Harvey en su tratado De Motu Cordis, donde reflejó la importancia del VD como una partícipe cámara activa60; sembrando la idea que el VD es un órgano funcional inmerso en la actividad cardíaca, lejos del concepto de ser una cámara pasiva.
En el año 1910, se formuló una hipótesis que sugería que el crecimiento del VI podía afectar la función del VD, y se empezaba a comprender el papel del VD en la IC60,61. Posteriormente, esta hipótesis fue soportada por las observaciones hechas durante 30 años por cirujanos cardiovasculares (desde 1950 hasta 1970) a pacientes con hipoplasia cardíaca derecha sometidos a procedimientos quirúrgicos (por ejemplo, cirugía de Glenn y Fontan), quienes desarrollaban una mala evolución clínica y una corta expectativa de vida, otorgando reconocimiento e importancia al VD en la sobrevida de los pacientes62. De esta manera se comienza a ampliar la mirada hacia la función del VD, con la presencia de disfunción de cámaras derechas en la IC, el infarto del VD, las cardiopatías congénitas y la hipertensión pulmonar.
En cuanto a la relación del VD con la CT por QT, desde el año 2010 han surgido ciertas publicaciones sobre el efecto deletéreo de algunos fármacos antineoplásicos en esta cámara58,63-66, gracias a los avances en las imágenes ecocardiográficas, tomográficas y de resonancia magnética nuclear (RMN), que han creado nuevas oportunidades para el estudio de la anatomía y la fisiología derecha, apoyando la idea de que el VD al igual que el VI son susceptibles a la lesión por estos agentes. Sin embargo, la información en relación al deterioro y función ventricular derecha posterior a QT y al comportamiento en varios estados del cáncer es limitada y ciertamente incomprendida.
El grupo de la Dra. Tanindi58 demostró una disminución subclínica en la función sistólica del VD (TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo -tricupid annulus plane systolic excursion-, onda S´, CAF: cambio de área fraccional) y de los índices ecocardiográficos de disfunción diastólica (DTI), aunque en su mayoría, se mantuvieron en el rango normal. Recientemente, se publicó un estudio por Calleja y col.63, quienes observaron signos de disfunción sistólica biventricular, utilizando parámetros del DTI y de strain rate.
De esta manera, la trascendencia histórica del estudio del cáncer, los fármacos antineoplásicos y las enfermedades cardiovasculares (ECV) están llenos de múltiples sucesos positivos que han permitido crear drogas más efectivas, herramientas imagenológicas más precisas, obtener un enfoque preventivo de la CT, establecer terapias dirigidas, plantear estrategias de tratamiento individualizadas y reducir la estandarización del tratamiento. Para todo esto se necesita contar con un equipo multidisciplinario que analice cada caso como un universo, filosofía que pretende alcanzar la cardiooncología.
Antraciclinas
Mecanismo de acción y efectos citotóxicos
Los antineoplásicos poseen efecto sobre las células en distintas fases del ciclo celular, dividiéndose en drogas fase específicas (su efecto se observa sólo en una fase del ciclo celular); ciclo específicas (no poseen efecto significativo en células Go o reposo) y ciclo no específicas (con efecto en el ciclo celular y efecto citotóxico importante sobre las células en Go)65,71. Los fármacos antineoplásicos se agrupan de acuerdo a su mecanismo de acción, estructura o interacción con otras drogas (Tabla 3).
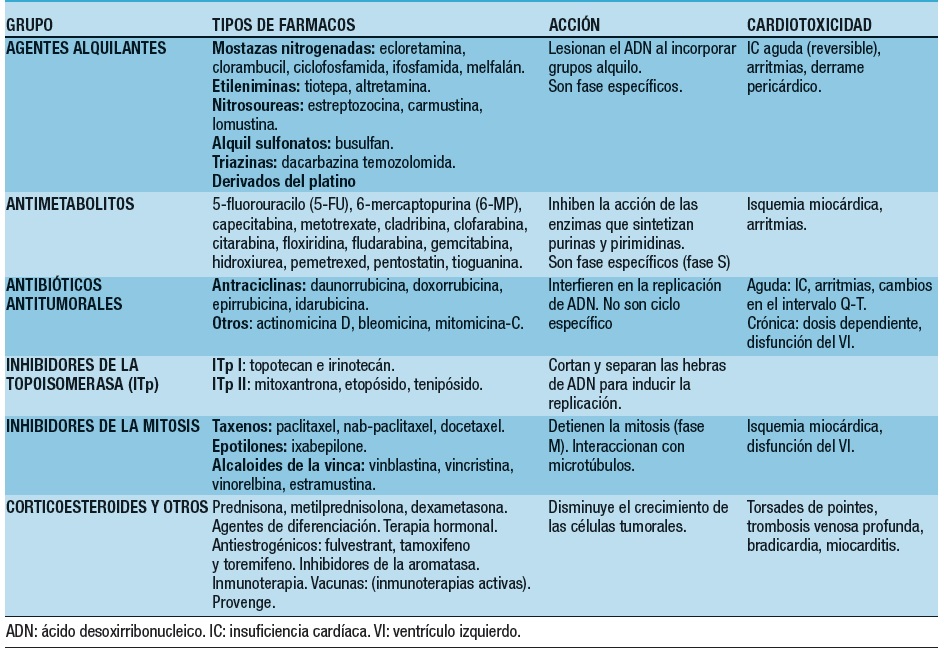
Tabla 3. Clasificación de fármacos antineoplásicos
Específicamente, las antraciclinas (del grupo de antibióticos antitumorales) han persistido durante décadas en el arsenal terapéutico contra el cáncer, debido a su alta efectividad en la inhibición del crecimiento tumoral, la cual es posible principalmente a través de los siguientes mecanismos:
1. Intercalación en el ADN con alteración de la replicación, la transcripción del ARN e inhibición de la síntesis de proteínas.
2. Formación de radicales libres (RL), inducción de la peroxidación lipídica y de las especies reactivas de oxígeno (ROS).
3. Alquilación, reticulación e interferencia con el ADN.
4. Anulación y separación de la cadena de ADN por parte de la helicasa.
5. Daño directo de la membrana con una interrupción de la estructura de la bicapa, debido a la oxidación de los lípidos.
6. Iniciación de daño en el ADN a través de la inhibición de la topoisomerasa 2 (Tp2)72.
Dos de estos mecanismos se destacan principalmente en provocar un efecto citotóxico: la formación de ROS y las acciones sobre la Tp272-75.
Para que una mutación genética pueda ocurrir, debe irrumpir la estructura molecular del ADN, el cual posee un mecanismo que desenrolla y separa las hélices y de esa manera permite el acceso a la información contenida; esto es posible gracias a las enzimas llamadas topoisomerasas (Tp) que desempeñan un papel fundamental en los procesos de replicación, transcripción y reparación65,68. Se han identificado tres tipos de Tp (I, II y III) y son un blanco terapéutico en el tratamiento del cáncer. Cabe destacar que de manera específica, las células tumorales con alta capacidad de división o en fase de proliferación, expresan niveles altos de Tp II alfa (Tp2α) y los cardiomiocitos expresan exclusivamente Tp II beta (Tp2β)68.
Un radical libre es una molécula que incluye un átomo al que le falta un electrón, por tanto, es fuertemente electrofílico y para poder obtener electrones de otros átomos debe oxidarlos73. Los electrones liberados por las antraciclinas, en unión al ADN, generan un ciclo redox de la forma quinona/semiquinona presentes en la estructura química de la droga (por acción de la enzima NADH, citocromo P450 reductasa), y como resultado de esta oxidación, las semiquinonas reaccionan con el oxígeno, forman ROS y alteran los fosfolípidos de las membranas, las cuales permiten la interacción con las reservas celulares de hierro, quienes forman de RL superóxido y peróxido de hidrógeno (anión superóxido), ambos inductores de la vía proapoptótica74; por tanto, el objetivo final de la acción celular de las antraciclinas es la muerte celular por apoptosis (Figura 1).

Figura 1. A. En respuesta al estrés oxidativo, la neuregulina activa los mecanismos compensatorios a través de receptores HER2. B. En presencia de trastuzumab, los dímeros HER2/HER2 y HER2/ HER4 se bloquean y los mecanismos de compensación se inactivan, lo que induce la apoptosis y la posterior insuficiencia cardíaca. Modificado de Di Cosimo S. Target Oncol 2011;6:189-95 y Adão R, de Keulenaer G, Leite-Moreira A, Brás-Silva C. Rev Port Cardiol 2013;32(5):395-409.
A pesar de que los mecanismos previamente señalados han sido ampliamente estudiados, la interacción del ROS con los elementos celulares y la formación de RL (inducido por las antraciclinas) no son los mecanismos directamente responsables de la injuria celular; esto fue demostrado por primera vez por la Dra. Yi Lisa Lyu y col.75, quienes utilizaron cultivos de células de ratón expuestos a antraciclinas y observaron que las roturas en el ADN y la muerte celular dependen de la presencia de Tp2β. Basándose en este hallazgo, el grupo del Dr. Zhang realizó estudios en tejido cardíaco de ratones salvajes deficientes de Tp2β (mediante ingeniería genética) tratados con Dox, quienes demostraron que el primer paso para el daño de los cardiomiocitos es independiente del ROS y sólo depende de un complejo ternario formado por la Tp2β - ROS (generado por antraciclina) - ADN; lo que conduce a supresión de los factores de transcripción (por la vía de activación de la p53), degradación del ADN y la inevitable apoptosis por disfunción mitocondrial (Figura 2). En contraste con los casos controles, los animales mutantes (ausentes de Tp2β), después de la exposición a la Dox, no presentaron lesión cardíaca aguda o crónica, ni reducción de la FEVI76.

Figura 2: Mecanismos de injuria celular inducidas por antraciclinas. El modelo clásico de cardiotoxicidad por antraciclinas involucra la generación de ROS (especies reactivas de oxígeno) por la especie quinona que comparten en común todas las antraciclinas. Un modelo alternativo (Zhang y col.), propone que la toxicidad es causada por la desactivación de la función de la topoisomerasa 2 beta (TOP 2β) por las antraciclinas (interrumpe el ciclo catalítico normal de la topoisomerasa). Sin una TOP 2β funcional, ocurre el acúmulo de las cadenas rotas de ADN, dando lugar a eventos como la activación de la proteína supresora de tumores p53, la disfunción mitocondrial, biogénesis mitocondrial defectuosa, y la generación de ROS, resultando en desorden miofibrilar y vacuolización de los cardiomiocitos, que inducen a la muerte celular cardíaca, apoptosis y eventual insuficiencia cardíaca. Modificado de Sawyer DB. N Engl J Med 2013;368(12):1154-6.
Los mecanismos que inducen la muerte celular varían según la concentración o la dosis acumulada de la droga, en la cual, ocurre apoptosis a concentraciones bajas y necrosis en presencia de altas concentraciones; sin embargo, estos hallazgos son controvertidos porque también se ha detectado apoptosis posterior a la exposición in vivo de las antraciclinas77 (Figura 3).

Figura 3. Apoptosis inducida por doxorrubicina. Se demuestra secciones del miocardio de ratón en condición basal (A) y luego de la exposición a doxorrubicina (B). Las marcas brillantes señaladas con flechas, muestran la destrucción nuclear luego de 1 día de administración de la droga. Modificado de Neilan TG, Jassal DS, Perez-Sanz TM, Raher MJ, Pradhan AD, Buys ES et al. Eur Heart J 2006; 27: 1868-1875.
Mecanismos cardiotóxicos de las antraciclinas A diferencia de otras células, el cardiomiocito es, de cierta forma, vulnerable a los efectos lesivos de las antraciclinas, más allá de los mecanismos citotóxicos (Tabla 4). Esta vulnerabilidad puede ser inherente a la acción de las drogas con elementos celulares o puede ser propios de la célula per se68,73,78 . La mayoría de las reacciones adversas de los fármacos antineoplásicos se deben a la citotoxicidad sobre los tejidos de alta fracción de crecimiento, observándose a nivel histopatológico, cambios degenerativos dispuestos a manera de focos múltiples en los cardiomiocitos. Estas alteraciones de los cardiomiocitos se presentan dispersos en todo el miocardio afectado (Figura 4), donde típicamente se caracterizan por un desorden y pérdida de miofibrillas con vacuolización citoplasmática. Los cardiomiocitos dañados pueden someterse a una remodelación patológica, conteniendo miofibrillas, material disperso de la banda Z y mitocondrias anormales, evolucionando hacia la apoptosis y a la fibrosis de reemplazo72.73,78.

Tabla 4. Alteraciones ultraestructurales de los cardiomiocitos por las antraciclinas

Figura 4. Morfología histológica medio ventricular (rata) en la cardiotoxicidad crónica por antraciclinas y el seguimiento post tratamiento. Se observan fibras colágeno teñidas de azul (Masson's blue trichrome); en un grupo control (A y C) y el grupo tratado con doxorrubicina (B y D). Existe una prominente fibrosis perivascular (azul claro) en el grupo doxorrubicina. Modificado de Migrino RQ, Aggarwal D, Konorev E, Brahmbhatt T, Bright M, Kalyanaraman B. Ultrasound Med Biol 2008; 34(2): 208-214.
Los mecanismos por los que se producen las formas agudas y crónicas de CT son muy diversos y no siempre similares a su efecto citotóxico70 . Recientemente, se estableció la diferenciación de la lesión miocárdica en dos grupos según el mecanismo involucrado (Figura 5 y Tabla 5): la cardiotoxicidad tipo 1 cuyo prototipo son las antraciclinas y la cardiotoxicidad tipo 2, principalmente, producida por el trastuzumab78-80.

Figura 5. Mecanismos de lesión cardiovascular inducidos por los antineoplásicos. Modificado de Navarrete Hurtado S, Castellanos Mejía AM, Chaparro Sanabria A. Insuf Card 2011; 6(3):131-143.

Tabla 5. Diferencias entre lesión cardíaca aguda y crónica inducida por antraciclinas
La larga lista de mecanismos que se han propuesto a través de los años para explicar el desarrollo de la cardiopatía inducida por QT, demuestra que la causa probablemente es compleja y multifactorial; sin embargo, la mayor evidencia se centra en alteraciones que permiten la producción de ROS, la lesión mitocondrial y el fracaso bioenergético; sucesos que inducen la apoptosis.
A continuación se puntualizará algunos de estos aspectos a fin de comprender la presencia de CT y su expresión clínica (Figura 6):
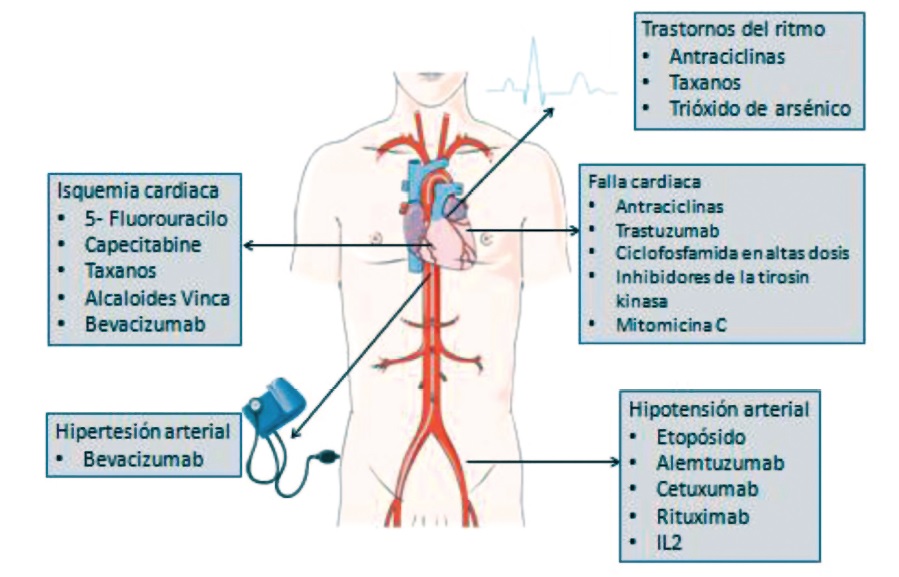
Figura 6. Efectos cardiovasculares de los fármacos antineoplásicos.
1- Mecanismos cardiotóxicos inherentes a los antracíclicos
- Reducción de los mecanismos protectores
Las antraciclinas afectan la expresión de aminoácidos que ejerce efecto cardioprotector, quienes son una fuente de acetil-CoA y NADH, ambos eliminadores de radicales libres. Los aminoácidos más afectados luego de la exposición a Dox son la serina, lisina, valina y la β-alanina73,82.
- Formación del complejo hierro férrico-antraciclina
Las antraciclinas aumentan la generación de RL quienes contribuyen a la conversión de hierro ferroso a férrico, formándose un círculo vicioso que lleva a la destrucción de las membranas celulares, mitocondriales, nucleares y del retículo endoplásmico; produciendo en éste un descenso del calcio intracelular y, por lo tanto, disminución de la contractilidad miocárdica83.
- Afinidad por la cardiolipina
La cardiolipina es un cofactor de las enzimas de la cadena respiratoria (citocromo C oxidasa, NADH y oxidoreductasa), que posee una alta densidad en fosfolípidos, otorgándole afinidad a los antracíclicos, en especial a la Dox, con el que forma un complejo cardiolipina- Dox para vulnerar la membrana mitocondrial interna e inhibir la fosforilación oxidativa, perdiendo de esta manera su función como cofactor84.
- Degradación de la titina
La titina es una proteína que forma parte del sarcómero en el músculo estriado, sirviendo como andamio para el ensamblaje de proteínas de miofilamentos en el sarcómero y media la función de la fuerza contráctil pasiva y la restauración de los miocitos, de manera que regula la sensibilidad de calcio dependiente de la longitud. Las antraciclina degradan la titina e inducen alteraciones de la estructura sarcomérica cardíaca (sarcopenia), mediante la pérdida y desorganización de las miofibrillas del sarcómero, la dilatación del retículo sarcoplásmico, el edema mitocondrial y la vacuolización citoplasmática; por lo tanto, la degradación de la titina puede conducir a la disfunción diastólica y sistólica progresiva, con la supresión de la transcripción de las proteínas del sarcómero82-84 .
- Regulación en baja y degradación de proteínas del sarcómero CARP (proteína de repetición cardíaca) GATA-4 y P300, con activación de la capacidad proteolítica de la calpaína
Después de la exposición a las antraciclinas, estas proteínas se degradan rápidamente, alteran su regulación y contribuyen a la sarcopenia83,85.
- Interacción entre las antraciclinas y las drogas anti trastuzumab (TK)
La interacción de los antracíclicos con los nuevos fármacos antineoplásicos dirigidos a los receptores de TK a través de erbB2, afectan la neuregulina (ligando del HER2) mediante vías metabólicas en común, generando pérdida de sarcómeros y de la fuerza de acoplamiento de los miocitos86,87.
- Inducción de la traslocación nuclear de p53
La traslocación nuclear de p53 induce la expresión de genes asociados con la lesión celular, la reparación del ADN, y apoptosis80,83,84.
- Las antraciclinas agotan las reservas de GATA-4
El GATA-4 que es un factor transcripcional que regula la vía apoptótica y preserva la función mitocondrial80.
- Pérdida de la capacidad mitocondrial a la reserva de calcio
La pérdida de la capacidad de carga de calcio en las mitocondrias se debe al aumento de la inducción en el poro de transición de permeabilidad mitocondrial (MPT), induciendo la muerte celular mediante estrés oxidativo, sobrecarga de calcio o despolarización irreversible en el MPT y, como consecuencia, aumenta la permeabilidad de la membrana mitocondrial interna con apertura del poro no selectivo a proteínas, alteración osmótica, edema y daños estructurales de las mitocondrias que finaliza con la liberación de proteínas proapoptóticas.
- Daño del ADN mitocondrial por antraciclinas
Como consecuencia existirá una cadena respiratoria defectuosa, incapaz de responder a las demandas de alta energía, con mayor fuga de electrones de oxígeno, aumento de la producción de ROS, que perpetuará el fracaso de la bioenergética mitocondrial. Cuando esto ocurre, las mitocondrias cardíacas pierden la capacidad de responder a diferentes situaciones de estrés o tensión, dando como resultado la aparición de IC décadas después del tratamiento con QT, debido a la degeneración progresiva del ADN mitocondrial88.
- Formación de complejos Dox-aminoácidos en el miocito
Ello produce una reducción significativa de los niveles de todos los aminoácidos después de la exposición a la Dox, en el cual la lesión es dosis dependiente73.
2- Características de los cardiomiocitos que favorecen la CT
- Poca capacidad de regeneración celular
Los miocitos comprenden aproximadamente el 80% de la masa cardíaca, pero éstos no aumentan el número celular total después del período postnatal. Los adultos jóvenes tienen una media de 8,2 mil millones de núcleos de miocitos, pero alrededor de 52 millones (0,6%) se pierden por año, lo que resulta en una reducción del 35% en el número de miocitos durante la vida adulta. Por tanto, el espesor de la pared ventricular se mantiene mediante el aumento de volumen de los miocitos (110 μm3/año); pero sin embargo, hay una pérdida total de la masa ventricular de 0,9 g/año83.
- Capacidad limitada para la mitosis
Capacidad limitada para la mitosis sugiere que cualquier pérdida adicional de miocitos se traducirá en una reducción permanente de los mismos, una mayor dependencia a los mecanismos de adaptación y un aumento de la vulnerabilidad dependiente del envejecimiento celular28,83.
- Alta densidad mitocondrial
El cardiomiocito posee una gran densidad y volumen de mitocondrias por célula (hasta 35% del volumen celular), uno de los destinos principales de ROS inducida por la QT89.
- Alto consumo de oxígeno
El elevado consumo de oxígeno potencia la presencia de estrés oxidativo y la inevitable la apoptosis, destino final de la vía de acción de las antraciclinas72.
- Baja cantidad de antioxidantes potentes
Existe una baja cantidad de antioxidantes potentes en comparación con otros tejidos, con bajos niveles de catalasa (oxidorreductasa) y de superóxido dismutasa. El tejido cardíaco posee un sistema de defensa antioxidantes poco desarrollados, que lo hace susceptible al daño por radicales de oxígeno90.
- Pocos mecanismos de defensa a la toxicidad
Ejemplo del caso de la enzima glutation peroxidasa y caspasa, que se encuentran reducida por la acción estas drogas82,83.90.
- Daño celular condicionado
Entre otros, existe daño celular condicionado por la variabilidad genética que varía el grado de daño celular, así como la presencia de enfermedad cardíaca preexistente y el estado de reserva contráctil en el momento de la administración de la QT2.
- La condición genética determina la respuesta a los fármacos y la toxicidad
La presencia de un componente genético se sospecha por la amplia variación en la sensibilidad individual a las antraciclinas. Algunos pacientes toleran dosis elevadas de Dox, hasta 1.000 mg/m2 , a diferencia de otros que desarrollan CT con solo 200 mg/m2 . Sin embargo, se desconoce sobre la identidad de los genes y variantes que subyace a esta variabilidad. La sobreexpresión de ciertos genes, como por ejemplo el gen MDR1, produce resistencia a múltiples fármacos y protege al corazón de los efectos tóxicos de Dox8,69.
- Posibilidad de perpetuar mecanismos en gatillo
Existe la posibilidad de perpetuar mecanismos en gatillo por pérdida de capacidad de reparación sucesiva luego de cada ciclo de QT, expresado en episodios subclínicos de disfunción ventricular80.
- Envejecimiento afecta la farmacocinética
Se ha demostrado el envejecimiento se correlaciona altamente con el clearance (aclaramiento) de la Dox, con una alta acumulación de ésta, disminución del flujo sanguíneo regional y alteración del tiempo de la droga en plasma, en los cardiomiocitos de los pacientes de edad avanzada, promoviendo aún más la CT27.
Ventrículo izquierdo versus ventrículo derecho
Vulnerabilidad a los antineoplásicos
La mayor evidencia descrita sobre los efectos tóxicos de las antraciclinas, se basan en estudios de biopsias endomiocárdicas y análisis inmunohistoquímico del VI en modelos animales; por tanto, existe una gran incertidumbre sobre si estas alteraciones observadas son equivalentes al VD. El estudio más significativo sobre los cambios moleculares detectados en el VD, posterior a la exposición con antraciclinas, tuvo resultados poco contundentes, en el cual se describieron las lesiones del VI y la ausencia de éstas en el VD, sin precisar los mecanismos involucrados en la lesión del miocito derecho. El mismo fue realizado en conejos expuestos a daunorrubicina (dau), cuyo objetivo se centró en demostrar cuan propenso son ambos ventrículos al desarrollo de CT8.
Los aportes más relevantes incluyen:
1- Evidencia de un marcado remodelado molecular casi exclusivo del VI en los miocitos, células no miocitos y la matriz extracelular, entre los que se incluye: cambios en la expresión genética de las proteínas sarcoméricas (principalmente, la titina y componentes de filamentos gruesos, ligeros e intermedios); remodelado de la matriz extracelular, con inestabilidad de las miofibrillas (a través de la desmina) y la activación de los fibroblastos (por medio de la vimentina); insuficiencia del sistema ubiquitina-proteosoma (quien lleva a cabo la eliminación de las proteínas dañadas en los cardiomiocitos) y alteraciones en el metabolismo del calcio.
2- Marcada asimetría histológica entre las lesiones observadas en el VI y VD, en la cual, existen dos aéreas particularmente propensas a la lesión por la CT: la pared libre del VI y el septum interventricular (tanto del VI como del VD); a su vez, la arteria coronaria izquierda y en el surco longitudinal anterior, con menor afectación de la rama interventricular posterior de la arteria coronaria derecha.
3- El VD presentó cambios leves, no significativos en comparación a los observados en el VI, planteándose la hipótesis que el VD posee baja carga tóxica.
4- El VD no desarrolló tejido fibrótico ni cambios degenerativos (los animales que sobrevivieron más de 10 semanas en el post-tratamiento presentaron en miocitos del VI luego de la apoptosis, reemplazo por tejido conjuntivo fibrótico, organizado en forma de cicatrices finas).
5- Los cambios celulares en el VD se observaron sólo en fase crónica en animales con IC en etapa terminal, con dilatación ventricular, IC congestiva, hipertensión pulmonar (HTP), derrame pleural y marcada disfunción del VI tanto sistólica como diastólica; por tanto, los cambios del VD se explicaron como consecuencia de la carga de presión inducida por el VI (Tabla 6). Estos resultados son sorprendentes, debido a que existe evidencia clínica e imagenológica de CT del VD durante el tratamiento con QT, que se presenta con síntomas de IC global, IC con FEVI normal y signos de HTP; en la cual, la afectación parece ser más marcada en el VI que en el VD, pero la razón por la cual esto sucede se desconoce90,91.

Tabla 6. Alteraciones moleculares por daunorrubicina no detectadas en el ventrículo derecho
En pro de conseguir algunas respuestas a estas diferencias, a continuación se puntualizan otras consideraciones moleculares, fisiológicas y hemodinámicas que pudieran influir a la presencia de mayor vulnerabilidad izquierda a la CT (Tabla 7):

Tabla 7. Diferencias entre VI y VD
- Doble función del VD
El VD tiene una doble función mantener una baja presión venosa sistémica y una adecuada perfusión pulmonar. De manera que ambos ventrículos difieren en su arquitectura, fisiopatología, metabolismo y flujo coronario60,91,92.
- El VI y el VD presentan diferentes orígenes embriológicos
El tubo cardíaco primitivo en su porción ventral da lugar a las cámaras auriculares y al VI, mientras que las células de la porción anterior del tubo formarán el VD75 . Además, las células que forman el tracto de salida del VD (TSVD) no pertenecen al tubo cardíaco primitivo, éstas son células que emigran de la región parafaríngea y se establecen en el TSVD, lo que explica el comportamiento de algunas enfermedades exclusivas del TSVD, el gradiente dinámico del VD y la diferencia entre la porción lisa y rugosa de esta cámara93.
- Diferentes factores genéticos
Ambos ventrículos poseen factores genéticos que los diferencian e influyen en el desarrollo de los miocardiocitos, entre ellos el Nkx 2-5 y los miembros de la familia GATA (principalmente GATA-4, -5 y -6), que generan señales para la formación del tubo cardíaco y así como marcadores genéticos que coordinan los fenómenos de plegamiento, diferentes para ambos ventrículos, como son el e-HAND (futuro VI) y d-HAND (futuro VD)82,97,94. Recientemente, se ha reconocido que existe expresión de genes específicos para cada cámara ventricular, con diferentes eventos transcripcionales para la formación del VI y del VD, el más representativo es el factor de transcripción Bop (regulador del desarrollo del VD junto al GATA y al e-HAND), que regula la expresión cardíaca muscular y el gen que codifica factor natriurético auricular95. Por otra parte, esta expresión génica coordina la formación temprana de las proteínas contráctiles y de sostén como son la actina, miosina, tropomiosina y la movilización del calcio en el retículo sarcoplásmico a través del fosfolamban, que se observa con una particular distribución regional, mayor en las regiones más caudales del tubo primitivo y en el tracto de salida del VI (TSVI). Por tanto, puede haber una diferencia genotípica debido a un polimorfismo genético, que condicionen diferentes respuestas patológicas con el mismo grado de postcarga8.
- Diferente carga mecánica
El VI enfrenta mayor carga mecánica (en cuanto a trabajo y estrés parietal) que determina las diferencias en el manejo del calcio, fosforilación oxidativa, oferta y demanda de oxígeno, en comparación al miocardio del VD60,93,94.
- El VD es una continuación del VI
El VD está formado por la lazada basal (inicia en la arteria pulmonar) y abraza la lazada apical del VI, formando entre ambas una banda única; la diferencia entre ellas ocurre cuando se acoplan o condicionan según el funcionamiento requerido, para contribuir a la eyección bilateral35.
- Diferentes resistencias
El VI, al eyectar, se enfrenta a altas resistencias periféricas; mientras que el VD, por el contrario, se enfrenta a bajas resistencias pulmonares y como consecuencia presenta una presión sistólica notablemente inferior a la del VI40,60,61.
- Diferente fase de eyección
El VD posee una fase de eyección prolongada92 .
- Diferente contracción
El VD se contrae de forma peristáltica, demostrado en un estudio realizado por Ginés y col., donde utilizaron corazones de oveja y observaron que en la sístole del VD, la eyección máxima se alcanza precozmente y que el fin de la sístole es significativamente mayor que en el VI. La contracción del VD avanza desde la porción de entrada hasta la porción de salida. Debido a estos hallazgos, se realizaron estudios de imágenes mediante ecocardiografía cuantificada acústica y con RMN, en el que se confirmó que existen diferencias regionales entre la porción de entrada y el infundíbulo del ventrículo derecho, de tal forma que el infundíbulo se expande cuando se contrae la porción de entrada y se contrae luego del componente aórtico del segundo ruido, con inexistencia de la fase de relajación isovolumétrica92,95.
- Diferentes fases y curvas de presión/volumen
En el VD no existe succión, ésta es una hipótesis a la que se intenta dar respuesta debido a la ausencia de la fase de relajación isovolumétrica, al parecer, exclusivo del VI; esto ocurre posiblemente debido a la contracción de dos cámaras independientes: el tracto de entrada (TE) y el infundíbulo, que pudiera ocurrir como dos acontecimientos distintos, pero simultáneos. Otra posibilidad se explica por la baja impedancia pulmonar que no requiere fase de succión para el llenado del VD. Lo cierto es que existe diferencias entre la forma de las curvas de presión/ volumen (triangular en el VD, cuadrangular en el VI), en la cual el volumen sistólico es impulsado de manera lenta y gradual, con el fin de generar un pico de presión significativo, pero de valor absoluto bajo49.
Características eco-anatómicas del VD
Para comprender la compleja anatomía del VD, se requiere tener una visión tridimensional. Esto se logra gracias a estudios anatómicos y de imágenes que incluye al ultrasonido 3D y 2D con adquisición de imágenes secuenciales, que proporcionan diferentes planos transversales para reconstruir la cavidad en conjunto. Con el objetivo de integrar la anatomía in vivo y ecocardiográfica, se describirá tres maneras de visualizar el VD. Esta descripción pretende obtener una idea tridimensional que reúna algunas vistas adquiridas cotidianamente.
Visión anterior: el VD triangular
El VD es la cámara cardíaca más anterior y está situada inmediatamente detrás del esternón, ocupando la porción anterolateral del VI; por este motivo se le ha denominado ventrículo anteromedio. Desde esta visión anterior, el VD adopta una forma triangular, curvándose sobre el VI, lo que le permite diferenciar ambos tractos de salida (tanto del VI como del VD), que están delimitados por la curvatura del septum interventricular (SIV), quien posiciona al TSVD en una situación anterocefálica con respecto al TSVI; obteniendo de esta manera una disposición cruzada (Figura 7); de manera que, al observar el corazón in situ, el VD rodea al VI, otorgándole al SIV una forma convexa, si se mira desde la derecha y cóncava desde la izquierda en todas las fases del ciclo cardíaco. Desde una vista diafragmática, tanto el VI como el VD y las aurículas forman una intersección denominada crux cordis, sitio donde se alcanza el plano ecocardiográfico apical de cuatro cámaras. Cuando se ve desde el ápex o vértice, el borde derecho del VD forma el margen agudo cardíaco y cabe destacar que éste es de menor tamaño que el izquierdo, que el VD no forma el ápex cardíaco y que tiene un diámetro transverso menor al VI. El margen superior del VD lo delimita la válvula pulmonar, ubicada por encima del SIV; mientras que la válvula tricúspide marca el margen derecho (Figura 7). En resumen, se puede describir tres paredes en el VD: la pared libre o retroesternal (que se divide en pared anterior y lateral), la pared inferior o diafragmática y el SIV; todas estas visibles mediante el ultrasonido92-95.

Figura 7. Visión anterolateral del ventrículo derecho (VD). A. Vista anterior con forma triangular, donde se observa la disposición de cruce entre el tracto de salida del ventrículo izquierdo (TSVI) (flecha punteada blanca) y el tracto de salida del ventrículo derecho (TSVD) (flecha negra). La válvula pulmonar (VP) (flecha blanca) se encuentra superiormente. B. La línea negra punteada indica la posición de la válvula tricúspide (VT). C. Vista desde el ápex que muestra como el VD envuelve todo el ventrículo izquierdo (VI). Ao: aorta. AI: aurícula izquierda. TP: tronco pulmonar. VCS: vena cava superior. VCI: vena cava inferior. Modificado de Ho SY, Nihoyannopoulos P. Heart 2006; 92(Suppl 1):i2-i13.
La visión epicárdica mediante ecocardiografía bidimensional, permite evaluar diversos planos segmentarios que aportan una idea del conjunto tridimensional de la cavidad. La Figura 8 muestra la relación ecoanatómica del VD y sus relaciones con las estructuras anexas.

Figura 8. Vistas epicárdicas del ventrículo derecho (VD) desde un ángulo anterior y lateral. A. Vista principal del tronco arteria pulmonar (TAP) con sus ramas: arteria pulmonar derecha (APD) y arteria pulmonar izquierda (API). B. Vista de eje corto. C. Eje largo del ventrículo izquierdo (VI). D. Eje corto basal del VI. E. vista del TSVD. F. Vista auricular y de la cavidad del VD.
Ao: aorta. VCS: vena cava superior. VAo: válvula aórtica. TSVD: tracto de salida del ventrículo derecho. AD: aurícula derecha. AI: aurícula izquierda. AL: ántero-lateral. PM: póstero-medial. VM: válvula mitral. VCI: vena cava inferior. VTA: válvula tricúspide anterior. VTP: válvula tricúspide posterior. Modificado de Haddad F, Couture P, Tousignant C, Denault AY. Anesth Analg 2009;108:407-21.
Desde la visión epicárdica, también se observan las arterias responsables de la perfusión del VD, con una característica anatómica que diferencia a los individuos: la dominancia. El término dominancia, se le otorga a la arteria de la cual se origina la rama descendente posterior (DP), es decir, cuando la dominancia es derecha, la DP nace de la arteria coronaria derecha, permitiendo la irrigación de la pared inferior y el septum inferior, este tipo de dominancia representa el 80% de la población. De esta coronaria también nacen ramas agudas marginales que irrigan la pared lateral del VD. Cuando la dominancia es izquierda, la DP se origina de la arteria coronaria izquierda (circunfleja). La pared anterior y el septum anterior del VD dependen de la arteria descendente anterior, rama de la coronaria izquierda y el infundíbulo es irrigado por la rama conal; por tanto, ambas coronarias contribuyen a la perfusión del VD. El aporte sanguíneo coronario al VD, a diferencia del VI, se realiza tanto en sístole como en diástole y cuenta con presencia de colaterales que optimizan la demanda de oxígeno94.
La compleja red tridimensional, que conforma el miocardio ventricular derecho, está integrada por miocitos dispuestos dentro de una matriz, donde la mayoría de las miofibras resultantes poseen una orientación longitudinal (Figura 9). Además de las fibras en posición longitudinal, el VD posee fibras superficiales o subepicárdicas, dispuestas de manera circunferencial, rodeando el infundíbulo subpulmonar, específicamente en dirección paralela desde una vista anterior (esternocostal), se dirigen oblicuamente hacia el ápex, cruzan el surco interventricular y se unen a las fibras superficiales del VI. En el vértice del VD, las fibras superficiales se invaginan en forma de espiral para formar las fibras profundas o subendocárdicas, alineadas longitudinalmente desde el ápex a la base. De manera sistemática, la contracción del VD se inicia en el TE, continúa hacia ápex y finaliza en el TSVD o infundíbulo, siguiendo un patrón peristáltico. Este movimiento incluye tres componentes: el desplazamiento de la masa hacia dentro de la pared libre, la tracción de las fibras en los puntos de inserción en el VI y el desplazamiento de las mismas hacia el anillo tricúspide (debido a las fibras longitudinales)92,94.

Figura 9. Movimiento de la pared libre del ventrículo derecho. Modificado de Zarco P. Rev Esp Cardiol 1999; 52: 43-46.
Por lo tanto, el principal mecanismo de contracción del VD es la tracción de las fibras miocárdicas longitudinales en dirección al TSVD (Figuras 9 y 10). Ciertos aspectos morfológicos del VD, entre los que se destacan la manera como están unidas las fibras entre sí y poseer un delgado grosor (espesor) parietal (de 3 a 5 mm), hacen que las fibras se orienten a predominio longitudinal y circunferencial, y así, cumplir sus objetivos principales: cambiar la forma de la cavidad para generan la fuerza de expulsión necesaria en la sístole; contribuir con la expulsión biventricular mediante la tracción de la pared libre (por la continuidad de las fibras musculares) y mantener la interdependencia ventricular92-96.

Figura 10. Disecciones secuenciales del miocardio. A. Vista anterior donde se observa en el subepicardio la dirección oblicua y circunferencial de las fibras. B. Las fibras penetran más allá del subepicardio, manteniendo la disposición circunferencial en el ventrículo derecho (VD) y adoptando una disposición oblicua en el ventrículo izquierdo (VI). C. VD abierto que demuestra la disposición longitudinal de las fibras subendocárdicas. Modificado de Ho SY, Nihoyannopoulos P. Heart 2006; 92(Suppl 1): i2-i13. TSVD: tracto de salida del ventrículo derecho. Ao: aorta. AD: aurícula derecha. TAP: tronco arteria pulmonar. VT: válvula tricúspide.
Naturalmente, el VD está acoplado al VI con el fin de bombear el mismo volumen latido, con la diferencia de que el VD utiliza sólo el 20% del trabajo (en comparación al VI), al contraerse hacia una vasculatura de baja resistencia y por tanto mayor distensibilidad. Tomando en cuenta este enunciado, se aclara el concepto de la interdependencia ventricular, que no es más que la mutua dependencia de las funciones ventriculares, debido a que comparten fibras miocárdicas (a predominio septal) y un mismo espacio dentro del pericardio.
Visión interna: el VD cónico
El VD posee una forma cónica visto desde la aurícula, donde la base superior es marcada por la válvula tricúspide, que junto a los músculos papilares (MP) componen el complejo valvular tricuspídeo, conformado por tres grupos:
1) MP anteriores, de mayor tamaño, cercanos al ápex del VD, quienes envían cuerdas tendinosas a las valvas anterior y septal; unido a la válvula tricúspide por medio de la banda moderadora.
2) MP septales, localizados en la región central del SIV (a diferencia del VI) y envían cuerdas a las valvas septal y posterior. Cerca de TS, se encuentra un músculo único denominado músculo del cono, del TS o de Lushka, que envía cuerdas a la valva septal.
3) MP posteriores, que se encuentran en la cara diafragmática y forma parte da la pared libre del VD, quien posee cuerdas dirigidas a las valvas anterior y posterior. Sistemáticamente, los MP se agrupan como: de primer orden (se diferencian porque se separan del endocardio ventricular), de segundo orden (unen dos paredes ventriculares) y de tercer orden (más que puentes musculares, son engrosamientos elevados del endocardio ventricular). Son los detalles en las estructuras que lo componen lo que identifican al VD anatómico y no su posición o relaciones. Utilizando imágenes del ecocardiograma, a través de las proyecciones subcostal y apical de cuatro cámaras, se puede definir el VD anatómico por las presencia de: la banda moderadora; la inserción de la valva septal de la tricúspide en un plano más apical con respecto a la válvula mitral; poseer tres o más MP; tener inserción de algunas cuerdas tendinosas en los MP del septum, y contar con la presencia de trabeculaciones92-97.
Visión transversal: el VD curvo o en medialuna
Esta visión se logra con el ecocardiograma desde la izquierda, cuando se gira el transductor 30 grados, mostrándose el VD en su eje corto, permitiendo una sección transversal de la cavidad en forma de medialuna (Figura 9). En esta vista, se puede observar que el VD se compone de 3 partes bien diferenciadas: la región de entrada (medial con respecto al VI), que corresponde a la porción receptora de la sangre que proviene del sistema venoso; región trabecular apical o cámara principal y la región de salida o infundibular (proximal a la base del VI). Las transiciones anatómicas de las fibras musculares que componen el SIV, dividen la región del TE de la porción trabecular. Este concepto tripartito, fue sugerido por Goor y Lillehei y se considera más útil que la división tradicional del VD.
La visión en medialuna del eje corto, proyecta principalmente el TSVD (se extiende desde la cresta supraventricular hasta la válvula pulmonar, incluyendo al infundíbulo o estrechamiento superior liso) y el TE del VD (conteniendo el aparato valvular tricuspídeo, desde el anillo valvular, hasta la inserción de los MP); ambas estructuras, junto al cuerpo de la cavidad, forman una «V» torcida en una visión tridimensional, cuyo vértice es el miocardio apical (Figura 11). La válvula pulmonar se separa de la válvula tricúspide por un pliegue muscular conocido como pliegue ventrículo infundibular o espolón de Wolff, diferenciándose del VI que posee continuidad de las válvulas92-96.

Figura 11. Procesamiento offline de base de datos. Las reconstrucciones se realizan para generar imágenes de las vistas de 4 cámaras, eje corto y 2 cámaras del VD. Las curvas de nivel se aplican en los 3 planos en la sístole y la diástole final y se propagan de forma semi automática. Esto permite la generación de una imagen volumétrica de resolución temporal, a su vez de una curva de volumen/tiempo del que se obtienen los datos funcionales. Modificado de Crean AM, Maredia N, Ballard G, Menezes R, Wharton G, Forster J, Greenwood JP, Thomson JD. Journal of Cardiovascular Magnetic Resonance 2011; 13:78.
VFS: volumen de fin de sístole. VFD: Volumen de fin de diástole. FE: Fracción de eyección. VS: volumen sistólico.
Para reconstruir una visión externa tridimensional de la anatomía del VD, es necesario integrar varias imágenes segmentarias y tomográficas desde el eco bidimensional, como se demuestra en la Figura 11. La forma triangular, en medialuna y conal, forman en el 3D una compleja estructura que demuestra por qué se dificulta su evaluación por eco y por qué la precisión de los datos de medición no siempre son exactos.
De manera que en la evaluación ecocardiográfica, el VD se considera una estructura compleja que requiere el análisis anatómico del TE, el TSVD y el ápex, los cuales no pueden ser visualizados simultáneamente en los planos ortogonales; por tanto amerita múltiples vistas para visualizar toda su segmentación. Además de esto, la evaluación de la contractilidad regional es complicada debido a que la orientación de las fibras epicárdicas circunferenciales y endocárdicas longitudinales permiten una contracción torsional, peristáltica y asincrónica con diferencias en la activación desde el TE al TSVD97. Es importante destacar que en la evaluación del VD por ecocardiografía, todos los índices son susceptibles a las condiciones de carga, en el que el 81% del volumen diastólico final (VDF) del VD está en el TSVD, pero el 87% del volumen latido lo genera el TE92.
Las recomendaciones internacionales acuerdan que se debe iniciar la evaluación ecocardiográfica del VD con un análisis cualitativo, comparándolo con el VI y las estructuras vecinas, así como obtener las mediciones en todas las vistas posibles, en al menos cinco, con el fin de obtener una apreciación tridimensional de la cavidad57,59 (Tabla 8).

Tabla 8. Protocolo ecocardiográfico en el cáncer según ASE
Evaluación ecocardiográfica del VD en el cáncer
La ecocardiografía es el método de elección para la evaluación de pacientes antes, durante y después de la terapia anticancerosa, por su amplia disponibilidad, fácil reproducibilidad y ausencia de radiación, por ende es una herramienta segura. Sin embargo, presenta limitaciones por la situación retroesternal del VD, la mala definición de su superficie endocárdica y la dificultad para aplicar modelos volumétricos que permitan emplear una fórmula geométrica para calcular su volumen. A pesar de esto, el ecocardiograma del VD durante la QT pretende evaluar las dimensiones, la función sistólica (FS) y diastólica (FD) en reposo y durante el estrés, las repercusiones hemodinámicas, las lesiones valvulares y los signos precoces de disfunción ventricular29.
Como se ha descrito hasta ahora, las alteraciones en el VD durante la terapia del cáncer ocurren por diversas razones, entre ellas: la disfunción preexistente del VD, la participación neoplásica (primaria o metastásica) o como resultado de los efectos cardiotóxicos propios de la QT. Algunos de estos hallazgos se demostraron en los primeros estudios de CT que incluían biopsias del VD. Las guías de actuación ecocardiográfica de las sociedades científicas americana (ASE: American Society of Echocardiography) y europea (EAE: European Society of Cardiology) recomiendan que la evaluación del VD en la QT debe incluir evaluaciones cualitativas y cuantitativas, del tamaño de la cámara, el tamaño de la aurícula derecha (estimado en área), la evaluación cuantitativa longitudinal del VD mediante la determinación de la excursión sistólica del plano anular tricuspídeo en modo M (TAPSE), de la velocidad pico sistólica del anillo tricuspídeo, derivada de la onda pulsada del DTI (onda S) y la evaluación funcional radial, por la estimación del acortamiento del área fraccional. Además, se recomienda proporcionar una estimación de la presión sistólica pulmonar (en especial en pacientes tratados con dasatinib, un inhibidor de la Tk, que induce la aparición de HTP)25,29.
No existe recomendaciones puntuales por otros métodos en referencia a la evaluación de la FS o FD del VD en pacientes sometidos a QT, como es el caso del cálculo de la FEVD, la aplicación de nuevas técnicas, ni la utilización del eco tridimensional; debido a que el valor pronóstico de la disfunción del VD no se ha demostrado ni estudiado adecuadamente en estos pacientes; sin embargo como se mencionó previamente, está establecido que se debe realizar una evaluación cuantitativa y cualitativa de la anatomía y función del VD, por la notable evidencia que demuestra la afectación del VD por la QT.
En contraparte, para evaluar la FS del VI, las sociedades científicas de ecocardiografía recomiendan utilizar la FEVI como un parámetro útil, pero debido a sus limitaciones,éste debe realizarse con el mejor método disponible. El método ecocardiográfico ideal para la evaluación de la FE tanto del VI como del VD es el eco 3D y en el caso de disponer del método bidimensional (2D), la técnica de elección es el método de Simpson biplano modificado (método de los discos), estableciéndose como rango normal de referencia una FEVI de entre el 53% y el 73%29. En cuanto a la FEVI, a pesar que se ha asociado con IC sintomática, su capacidad para identificar y prevenir la CT es controversial; sin embargo, un gran estudio que involucró mujeres con cáncer de mama tratadas con antraciclinas con o sin trastuzumab, midió la FEVI antes y después de la terapia, demostrando que aquellas pacientes que presentaban una FEVI reducida tuvieron mayores tasas de eventos cardíacos en el seguimiento98. Un detalle importante ocurre cuando se compara la FEVI con la FEVD, ya que esta última es inferior a los parámetros izquierdos porque el volumen del VD es un 10-20% superior al del VI, con lo cual, para conseguir un volumen latido igual al VI debe tener una menor FE (FEVD normal ≥44%)99 . La medición de la FEVD por el método bidimensional de Simpson no está ampliamente recomendado, porque excluye el volumen del VD de la cuarta cámara o del TSVD y, por ende, se subestima el volumen real. Aunque el VD es, en apariencia, más pequeño que el VI, el volumen del VD es superior. Esto se demuestra en los estudios con RMN, en el cual, el rango normal de volumen diastólico final del VD (VDFVD) es de 49 a 101 ml/m2 (hombres: 55 a 105 ml/m2 ; mujeres: 48 a 87 ml/m2 ) y el volumen telediastólico del VI es 44-89 ml/m2 (hombres: 47-92 ml/m2 ; mujeres: 41-81 ml/m2 )29,98,99.
Por otra parte, debido a que la FEVI por eco 2D no detecta cambios sutiles de la contractilidad regional y es afectada por las condiciones de carga de los pacientes sometidos a QT, este método debe combinarse con
otros para aumentar su validez, como son: el cálculo del índice de motilidad, el strain longitudinal global (SLG) y la velocidad sistólica máxima (onda S) por onda pulsada DTI. Actualmente no están disponibles los valores de corte que permitan predecir la presencia de CT por QT con estos métodos; sin embargo, una disminución progresiva de los parámetros obtenidos, debe hacer sospechar la presencia de disfunción ventricular subclínica21.
A continuación se describirán los métodos ecocardiográficos utilizados en la búsqueda de lesión ventricular subclínica, aunque la mayoría están descritos en la búsqueda de lesión del VI, éstos también son totalmente aplicables al VD, los cuales presentan gran interés en esta investigación:
Strain y strain rate
La deformación (strain) y la velocidad de deformación (strain rate) son parámetros útiles para la estimación de la función sistólica global y regional del VD100 . El strain longitudinal se define como el cambio en la longitud de un objeto en una dirección determinada en relación con su longitud basal:
strain (%) = (Lt - L0) / L0
donde Lt es la longitud en el tiempo t y L0 es la longitud inicial en el tiempo53. La medida basada en strain más comúnmente utilizada para la función sistólica global es el SLG; el cual usualmente es calculado por el método de ecocardiografía con speckle tracking (eco-ST)45,46,53. En eco 2D, el pico de SLG describe el cambio de longitud relativa del miocardio entre la telediástole y telesístole:
SLG (%) = (MLs - MLd) / MLd
donde ML significa longitud miocárdica al final de la sístole (MLs) y al final de la diástole (MLd)43,45. Debido a que MLs es menor que MLd, el pico de SLG es un número negativo. El término SLG del VD se refiere indistintamente tanto al promedio de la pared libre del VD y los segmentos septales, o sólo para los segmentos de pared libre del VD. La deformación longitudinal se calcula como el porcentaje de acortamiento sistólico de la pared libre del VD medida desde la base al ápex, mientras la velocidad de deformación longitudinal es la velocidad de ese acortamiento51,53,59.
La deformación longitudinal del VD está menos influenciada por el movimiento cardíaco, pero depende de las condiciones de carga, de la forma y el tamaño del VD59,100. Para un adecuado análisis de la deformación miocárdica, se debe obtener un ecocardiograma de alta calidad técnica y emplearse un rango de frecuencias entre 40 y 80 cuadros/segundos (lo ideal es que sea aproximadamente el 80% de la frecuencia cardíaca)20 . Este método tiene una ventaja superior al DTI porque no posee ángulo de dependencia, pero está influenciado por la calidad de la imagen, artefactos y la atenuación46 (Figura 12). La adquisición del strain es rápida; sin embargo, para que los resultados puedan procesarse y sean representativos se requiere que la duración del ciclo sea estable, de manera que sean consistentes en las tres vistas.

Figura 12. Interpretación de las curvas de strain del ventrículo derecho. Curvas derivadas del análisis del speckle tracking (eje X tiempo, eje Y strain). Puntos amarillos: onda Q del electrocardiograma. Línea punteada blanca representa el promedio del strain global de los seis segmentos. Flechas amarillas indican el strain pico sistólico y el strain pico. El strain post sistólico se refiere al ocurrido luego del cierre de la válvula aortica (línea verde discontinua). CVAo: cierre de la válvula aórtica. Modificado de Valsangiacomo ER et al. Eur Heart J 2012; 33, 949-960.
Cabe destacar que la visión del ojo humano experimentado o entrenado en métodos ecocardiográficos sólo es capaz de analizar la excursión y el engrosamiento (radial y transversal) hasta treinta cuadros por segundo, mientras que el software de los actuales equipos permite un análisis con más del doble de cuadros por segundo y cuantifica la deformación en todos sus ejes (longitudinal, radial, circunferencial y transversal), convirtiéndolo en una herramienta muy sensibles a cambios sutiles en la contractilidad miocárdica48,52 . En el VD, el término strain global adopta las mediciones del VI, y el software actualmente utilizado para estimarlo está diseñado para las mediciones del VI y posteriormente adaptado al VD.
Una revisión sistemática del año 2014 demuestra que los índices de deformación (deformación, velocidad de deformación y twist) son sensibles para la detección subclínica de disfunción del VI en pacientes tratados con QT101 (Tabla 9). La disminución de la FS parece ser extremadamente rápida, aproximadamente 2 horas después de la primera dosis de QT38. La disminución de los índices de deformación precedió a la disminución de la FEVI y persistieron durante el siguiente ciclo de tratamiento102-104 . En uno de los estudios mencionados se demostró que, los índices de strain radial disminuyeron antes que los índices longitudinales, al concluir tres ciclos de antraciclinas. La magnitud de la disminución en el strain longitudinal se reporta en promedio entre el 10% y el 20%. El valor pronóstico de la medición inicial de los índices de deformación sistólica en la predicción de la FS del VI es muy útil porque predice la CT, pero cabe destacar que, a pesar de la disminución de estos valores a lo largo del tratamiento, no se sabe cuál es su evolución en cuanto a la aparición de la lesión, si existirá una disminución persistentes en la FEVI o se presentará como IC sintomática103. En cuanto al VD, Jurcut y col.105 reportaron una significativa reducción de la tensión radial después de tres ciclos con Dox, administrado cada 3 semanas y una reducción significativa en ambas velocidades de deformación longitudinal y radial después de seis ciclos del mismo régimen. En otro estudio, se mostró que esta alteración puede persistir hasta 20 años posterior al tratamiento106.

Tabla 9. Características del strain para la cardiotoxicidad subclínica
El método de eco-ST (rastreo de marcas) se basa en el principio de análisis del desplazamiento (tracking) de los puntos observados en el tejido miocárdico (speckle) producidos por la interacción del ultrasonido con la estructura cardíaca, interpretadas como marcas acústicas naturales52 . Como se mencionó recientemente, la deformación miocárdica bidimensional estudia el movimiento miocárdico en relación al miocardio adyacente, en el cual estas espículas están distribuidas uniformemente y cada una puede ser detectada, permitiendo identificar el cambio de su posición cuadro a cuadro durante un ciclo cardíaco. Su gran ventaja, comparado con el DTI, es que no depende del ángulo del ultrasonido ni del movimiento de traslación cardíaca, consume menos tiempo, es más fácil, más preciso y permite analizar el ápex del VI; además obtiene de manera simultánea los componentes longitudinales, radiales y circunferenciales de la deformación en todos los segmentos miocárdicos; por tanto, la deformación miocárdica derivada del eco-ST permite medir desde las vistas apicales la deformación longitudinal y transversal, y desde el eje corto paraesternal la deformación radial y circunferencial45 (Figura 13). El eco-ST aporta únicamente valores transmurales indirectos, divididos por segmento; esta tecnología utiliza una región de interés (ROI) de aproximadamente 40 pixeles y sólo proporciona datos transmurales promediados, sin poder separar endocardio y epicardio46,51,52.

Figura 13. Procesamiento de datos de speckle tracking. A. Imagen de tracking aprobado por el software; segmentos con el rastreo tracking adecuado son asignados con la marca verde V. B. Perfiles de strain para cada vista apical. Promedio de segmentos con valores de cada uno utilizando la descripción paramétrica "bull's eye", de todo el ventrículo izquierdo. 2CH: 2 cámaras. 4CH: 4 cámaras. ANT: anterior. APLAX: apical eje largo. Modificado de Marwick TH, Leano RL, Brown J, Sun JP, Hoffmann R, Lysyansky P, Becker M, Thomas JD. J Am Coll Cardiol Img 2009;2:80-84.
Excursión sistólica del anillo tricuspídeo
Basado en el principio en el cual el desplazamiento del ápex del VD hacia el anillo tricuspídeo se debe al acortamiento de las fibras longitudinales para la óptima eyección del VD, el TAPSE pretende ser un índice que permite cuantificar el movimiento o "excursión" miocárdica sistólica del plano valvular tricuspídeo, que en la cual, en condiciones normales debe ser superior a 1,6cm59,107-109; por tanto, el TAPSE representa una medida de la función longitudinal del VD. Se mide por modo M con el cursor alineado a lo largo de la dirección del anillo lateral tricuspídeo en la vista apical de 4 cámaras. Aunque este índice refleja predominantemente la función longitudinal del VD, ha demostrado una buena correlación con parámetros de estimación de función sistólica global del VD, tales como FEVD y la reducción del área fraccional del VD por eco 2D. Como medida unidimensional relativa a la posición del transductor, la medición de TAPSE puede sobreestimar o infra estimar la función del VD debido a la traslación cardíaca114. Diversos estudios con pacientes oncológicos utilizan este parámetro, donde demuestran una reducción progresiva durante todo el proceso de QT54,110,111.
Doppler tisular
El DTI es un método que evalúa la velocidad de la pared regional ventricular con una alta resolución espacial y temporal. Se puede utilizar para evaluar no sólo anormalidades regionales; sino también, la función ventricular global59. La velocidad del tejido miocárdico es menor a la del flujo sanguíneo; pero el movimiento de la pared ventricular se acelera, considerablemente, debido a la activación de las células musculares cardíacas inducida por la contracción muscular, generando así una deformación del tejido112 . La velocidad de deformación representada en imágenes, ha sido desarrollada para analizar dicha deformación del tejido y demostrando su utilidad para la evaluación global de la función del VI y VD. El DTI ha sido aplicado en numerosos estudios de pacientes expuestos a QT para evaluar la función ventricular, demostrando su amplia utilidad58,105,106,110; pero específicamente, en la CT del VD, el estudio realizado por Ganame y col.106, demuestra una disminución de los parámetros del DTI bajo los efectos a corto plazo de la QT, especialmente, en la relación e'/a' tricuspídea como parámetro de disfunción diastólica (que precedían la aparición de disfunción sistólica) y la onda S para la evaluación sistólica, la cual está adoptada como una medida simple y reproducible que evalúa la función de la pared libre basal del VD. Una onda S' menor a 9,5 cm/s (Doppler pulsado) o menor de 6 cm/s (Doppler color); sugiere la sospecha de disfunción del VD107,112,113 .
Aceleración miocárdica durante la contracción isovolumétrica
Las velocidades miocárdicas del período eyectivo medido por DTI en el VD, han demostrado buena correlación con la FEVD; sin embargo, es un parámetro dependiente de la precarga y de la postcarga. Recientemente, se ha estimado un parámetro derivado del DTI que mide la aceleración miocárdica durante la contracción isovolumétrica (IVA), correlacionándose efectivamente con la FS del VD y está validado como un índice fiable independiente de las condiciones de carga59,60,107. La aceleración miocárdica durante la contracción isovolumétrica se define como el pico de la velocidad miocárdica isovolumétrica dividido entre la distancia del tiempo al pico de velocidad, medido a partir del DTI del anillo tricuspídeo lateral114,115 (Figuras 13, 14 y 15). Para el cálculo de la IVA, el inicio de la aceleración miocárdica está a nivel del cero de la velocidad miocárdica durante la contracción isovolumétrica. En una serie de pacientes cardíacos bajo anestesia, la variable IVA apareció como el parámetro del DTI más consistente para la evaluación de la función del VD, y ha demostrado correlación con la severidad de la enfermedad en condiciones que afectan la función del VD61. Los valores normales de la IVA del VD difieren de la técnica con la que se adquiere, los resultados con DTI pulsado son un 20% más altos que los valores derivados del DTI color (Figuras 14 y 15). El límite de referencia inferior con DTI pulsado59,107,116 es 2,2 m/s2 .

Figura 14. Doppler tisular. A. Esquema de registro Doppler tisular de la porción lateral del anillo tricuspídeo. Durante la contracción isovolumétrica, precediendo a la onda S' se registra una onda que comienza antes del pico de la onda R del electrocardiograma. El tiempo (t) es el que transcurre entre el comienzo de esta onda y el pico de la misma. La velocidad pico en m/s dividido (t) en s es el parámetro denominado aceleración isovolumétrica del miocardio (IVA). IVA= velocidad pico/t. B. Electrocardiograma. Modificado de Vogel M, Schmidt MR, Kristiansen SB, Cheung M, White PA, Sorensen K, Redington AN. Circulation 2002;105:1693-1699.

Figura 15. Curva de velocidad derivada del Doppler tisular color. Línea gris mide la velocidad pico de contracción sistólica. Línea roja refleja la aceleración isovolumétrica (IVA). El índice de performance miocárdico fue calculado desde el tiempo isovolumétrico (IVT) / el tiempo de eyección (ET). DTI: Doppler tisular. Modificado de Jon M. Appel y col. 2011.
En cuanto a su utilización en pacientes que reciben QT, se ha aplicado en pequeños estudios, la mayoría en población pediátrica, los cuales coinciden que existe una reducción importante de su valor absoluto, y describiéndose como un parámetro prometedor para la aplicación de estudios a mayor escala. Por ende, la relación de la velocidad pico de esta onda en m/seg dividido por el intervalo de tiempo en segundos entre el comienzo de esta onda y su velocidad pico ha demostrado, como se mencionó, ser un índice de contractilidad del VD, independiente de condiciones de pre y postcarga96,114,117,118. Este parámetro se ha evaluado en una variedad de entornos clínicos y experimentales (tetralogía de Fallot, estenosis mitral, obesidad, esclerosis sistémica, hipertensión arterial). Varios estudios han demostrado que los pequeños cambios en la función contráctil se pueden detectar mediante la medición de IVA, mientras que los cambios en pre y postcarga dentro del rango fisiológico no afectaron a este parámetro114-118-120. En contraste con DTI derivados velocidades sistólica máxima, la tensión y la velocidad de deformación, IVA es un parámetro robusto y relativamente independiente de la pre y postcarga119. Además, los resultados en estas situaciones demuestran que el IVA del VD, tiene el poder predictivo más alto para la detección de la disfunción sistólico temprana, con una baja variabilidad inter e intraobservador y puede ser utilizado como un parámetro exacto, no invasivo para la evaluación de la función sistólica del VD. En el caso de la esclerosis sistémica, un IVA<3,0 m/s2 predijo lesión subclínica del VD con el 100% de sensibilidad y el 91% de especificidad120.
Índice de performance miocárdico
El índice de performance miocárdico (IPM), conocido también como índice de Tei, es una medida que expresa la función sistólica y diastólica ventricular global, estimándose mediante la suma del tiempo de contracción isovolumétrica y el tiempo de relajación isovolumétrica, dividido entre el tiempo de eyección, a través del Doppler pulsado (valor normal mayor a 0,43) o el DTI (valor normal mayor a 0,54)59 . Este índice se correlaciona con medidas invasivas y es independiente de la geometría ventricular o los cambios de la presión arterial. Un IPM >0,43 por Doppler pulsado y >0,54 por TDI indican disfunción del VD116,121 (Figura 16).

Figura 16. Intervalos medidos por Doppler tisular desde el anillo tricuspídeo lateral. tICT: tiempo de contracción isovolumétrica. tET: tiempo de eyección. tIVRT: tiempo de relajación isovolumétrica. MPI: índice de performance miocárdico. Modificado de Per Lindqvist et al. Eur J Echocardiogr 2008;9(2):225-34
Como se mencionó, el IPM también puede estimarse mediante Doppler convencional; pero tiene el inconveniente respecto del DTI de que no todas las mediciones necesarias pueden obtenerse en un mismo ciclo cardíaco. En efecto, utilizando Doppler convencional deben efectuarse dos medidas separadas en diferentes ciclos, a saber: 1) el registro del flujo diastólico de la válvula tricúspide, y 2) el registro del flujo sistólico en el tracto de salida del VD. Específicamente en pacientes con cáncer, el índice de Tei se ha utilizado para evaluar la función cardíaca, tanto en la población pediátrica como en adultos en tratamiento con antraciclinas, los cuales coinciden con demostrar un deterioro significativo de la función del VI y no así del VD, donde los cambios fueron no significativos. Las alteraciones demostradas fueron independientes de la dosis de antraciclinas y con mayor impacto en pacientes con antecedentes de disfunción diastólica, mayor edad y mayor postcarga ventricular121-126.
Función diastólica del VD
La evaluación de la función diastólica (FD) pretende clasificar el grado de disfunción y estimar la presión de llenado ventricular, mediante el uso de la relación E/e'; sin embargo sigue siendo cuestionable en los casos oncológicos, porque estos pacientes presentan fluctuación en las velocidades de las ondas como consecuencia de los cambios en las condiciones de carga debido a los efectos secundarios asociados a la QT (náuseas, vómitos y diarrea), ajenos a un cambio real en el rendimiento diastólico del VI. Diversos estudios sugieren que la presencia de disfunción diastólica altera el pronóstico y predice disfunción ventricular, reportando prolongación en el tiempo de relajación isovolumétrica como predictor de la caída de la FEVI >10%127; aumentos significativos en el índice de rendimiento de miocardio justo después de la administración de antraciclinas, que predicen la disminución tardía de la FEVI113 ; y otros estudios que registran una caída de la onda E transmitral, asociado a una reducción de la tensión longitudinal por strain, en pacientes con FE normal después de culminar el tratamiento QT64. Actualmente, no existen parámetros diastólicos que asuman un valor pronóstico para el desarrollo de CT por QT; sin embargo, se debe realizar en todos los pacientes la estimación y clasificación convencional de la FD, así como el cálculo de las presiones de llenado128 .
Conclusión
Considerando lo analizado anteriormente es evidente que el descubrimiento de una enfermedad cardíaca y sus variables hemodinámicas inducidas por las drogas antineoplásicas, ha dificultado las opciones terapéuticas en los pacientes oncológicos que la padecen. Las consecuencias clínicas que derivan de esta enfermedad influyen en la sobrevida de los pacientes, quienes ameritan un equipo multidisciplinario para su tratamiento. De esta manera, la cardio-oncología pretende investigar, promover, prevenir y tratar a los pacientes en riesgo o con la enfermedad establecida, siendo la ecocardiografía el método de elección para la evaluación de pacientes antes, durante y después de la terapia antineoplásica. El ecocardiograma bidimensional, junto a los parámetros de disfunción sistólica mediante speckle tracking y Doppler tisular, permite estimar la presencia de cardiotoxicidad subclínica del VD en los pacientes con cáncer que reciben QT. Tanto el strain longitudinal como el IVA, son herramientas de alto valor predictivo para detectar disfunción sistólica temprana del VD en estos pacientes.
La inclusión de los parámetros de deformación miocárdica en el VD, aportan una valiosa información para la estratificación de CT subclínica en el paciente oncológico y por tanto, deben ser tomadas en cuenta en todas las fases de la evaluación ecocardiográfica durante la QT.
La herramienta más precisa para detectar la cardiotoxicidad subclínica del VD es el análisis de la velocidad miocárdica (strain longitudinal e IVA), los cuales son predictores independientes de la aparición de cardiotoxicidad subclínica; sin embargo, existe reducción de todos los parámetros de disfunción sistólica del VD. Por tanto, debe ser implementado el uso combinado de estos parámetros, en etapas tempranas de tratamiento de todos los pacientes que reciben antraciclinas.
Es preciso la realización de estudios posteriores que definan la persistencia o no de la reducción de los parámetros en el tiempo (recuperación de la FEVD o deformación), o si éstos serán blanco para el pronóstico y calidad de vida del paciente.
Recursos financieros
Los autores no recibieron ningún apoyo económico para la investigación.
Conflicto de intereses
Los autores declararon no tener conflicto de intereses.
1. Health situation in the Americas: basic indicators 2011. Pan American Health Organization/World Health Organization Regional Health Observatory, 2011. www.paho.org/rho [ Links ]
2. Primer reporte de vigilancia de enfermedades no transmisibles 2011. Grupo ad hoc de vigilancia de enfermedades no transmisibles/ Comisión de vigilancia en salud/ Mercosur. [ Links ]
3. Yeh ET. Cardiotoxicity induced by chemotherapy and antibody therapy. Annu Rev Med 2006;57:485-98. [ Links ]
4. Hanrahan EO, Gonzalez-Angulo AM, Giordano SH. Overall survival and cause-specific mortality of patients with stage T1a, bN0M0 breast carcinoma. J Clin Oncol 2007;25:4952-60. [ Links ]
5. Mertens AC, Yasul Y, Neglia JP. Late mortality experience in five year survivors of childhood and adolescent cancer: the Childhood Cancer Survivor Study. J Clin Oncol 2001;19:3163-72. [ Links ]
6. Lax J, Piñeiro D et al. Consenso de diagnóstico, prevención y tratamiento de la cardiotoxicidad por tratamiento médico del cáncer. Rev Argent Cardiol 2013;81(Suppl.5): 5-64. [ Links ]
7. Salaverry, O. La etimología del cáncer y su curioso curso histórico. Rev Peru Med Exp Salud Pública 2013; 30:137-41. [ Links ]
8. Shalkey V, Hahn D, Lenihan J et al. Cancer Therapy-Induced Cardiotoxicity: Basic Mechanisms and Potential Cardioprotective Therapies. J Am Heart Assoc 2014; 3: e000665. [ Links ]
9. Siegel R, Naishadm D, Jemal A. Cancer statistics. Cancer J Clin 2013; 63: 11. [ Links ]
10. Shafrir E. Otto Heinrich Warburg-pioneer in enzymatic biochemistry and physiology of respiration. Isr J Med Sci 1993; 29:823. [ Links ]
11. Chargari C, Kirov KM, Bollet MA, Magné N, Védrine L, Cremades S, Beuzeboc P, Fourquet A, Kirova YM. Cardiac toxicity in breast cancer patients: From a fractional point of view to a global assessment. Cancer Treat Rev 2011; 37(4):321-30. [ Links ]
12. Siegel R, Cokkinides V, Jemal A. Datos y Estadísticas sobre el cáncer entre los hispanos/latinos 2012-2014. American Cancer Society 2012. www.cancer.org/content/dam/cancer-org/ research/cancer-facts-and-statistics/cancer-facts-and-figuresfor- hispanics-and-latinos/datos-y-estadísticas-sobre-el-cáncerentre- los-hispanos-latinos-2012-2014.pdf [ Links ]
13. Arruebo M, Vilaboa N, Sáez B et al. Assessment of the Evolution of Cancer Treatment therapies. Cancer 2011;3:3279-3330. [ Links ]
14. DeVita VT. The evolution of therapeutic research in cancer. N Engl J Med 1978; 298:907-10. [ Links ]
15. Chabner B, Roberts T, et al. Timeline: Chemotherapy and the war on cancer. Nature Rev Cancer 2005; 5: 65-72. [ Links ]
16. Gilman A. Advances in pharmacology resulting from war research: therapeutic applications of chemical warfare agents. Fed Proc 1946; 5:285-292. [ Links ]
17. Goodman L, Wintrobe M, Gilman A, et al. Nitrogen mustard therapy: use of methyl-bis amine hydrochloride and tris amine hydrochloride for Hodgkin's disease, lymphosarcoma, leukemia, and certain allied and miscellaneous disorders. JAMA 1946; 132:126-32. [ Links ]
18. DeVita V, Chu E. A History of Cancer Chemotherapy. Cancer Res 2008; 68(21):8643-53. [ Links ]
19. Arcamone F, Franceschi G, Penco S, et al. Adriamycin (14-hydroxydaunomycin), a novel antitumor antibiotic. Tetrahedron Lett 1969; 13:1007-1010. [ Links ]
20. Bristow M. Cardiotoxic Effects of Anthracyclines. West J Med 1983; 139(3): 369-371. [ Links ]
21. Smith L, Cornelius V, Plummer C. Cardiotoxicity of anthracycline agents for the treatment of cancer: Systematic review and meta-analysis of randomised controlled trials. BMC Cancer 2010, 10:337. [ Links ]
22. Cardinale D, Colombo A, Lamantia G et al. Anthracyclineinduced cardiomyopathy: clinical relevance and response to pharmacologic therapy. J Am Coll Cardiol 2010; 55: 213-220. [ Links ]
23. Jensen B, Skovsgaard T, Nielsen L. Functional monitoring of anthracycline cardiotoxicity: a prospective, blinded, long-term observational study of outcome in 120 patients. Ann Oncol 2002;13(5):699-709. [ Links ]
24. Bosch X, Rovira M, Sitges M et al. Enalapril and Carvedilol for Preventing Chemotherapy-Induced Left Ventricular Systolic Dysfunction in Patients With Malignant Hemopathies The OVERCOME Trial. J Am Coll Cardiol 2013;61(23):2355-62. [ Links ]
25. McKillop J, Bristow M, Goris M et al. Sensitivity and specificity of radionuclide ejection fractions in doxorubicin cardiotoxicity. Am Heart J 1983;106:1048-56. [ Links ] 97
26. Plana J. La quimioterapia y el corazón. Rev Esp Cardiol 2011; 64(5):409-415. [ Links ]
27. Brana I, Tabernero J. Cardiotoxicity. Ann Oncol 2010;21 Suppl 7:vii173-9 [ Links ]
28. Navarrete S, Castellano A, Chaparro A. Cardiotoxicidad por quimioterapia. Un enfoque práctico para el clínico. Insuf Card 2011; 6(3):131-143. [ Links ]
29. Plana J, Galderisi M, Barac A et al. Expert Consensus for Multimodality Imaging Evaluation of Adult Patients during and after Cancer Therapy: A Report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2014; 27:911-39. [ Links ]
30. Yoon G, Telli M, Kao D, Matsuda K. Left Ventricular dysfunction in Patients receiving Cardiotoxic Cancer Therapies. Are Clinicians Responding Optimally? J Am Coll Cardiol 2010;56(20):1644-50. [ Links ]
31. Appel J, Sogaard P, Christiane E. Tissue-Doppler Assessment of Cardiac Left Ventricular Function during Short-Term Adjuvant Epirubicin Therapy for Breast Cancer. J Am Soc Echocardiogr 2011; 24:200-6. [ Links ]
32. Alexander J, Dainiak N, Berger HJ, Goldman L, Johnstone D, Reduto L, et al. Serial assessment of doxorubicin cardiotoxicity with quantitative radionuclide angiocardiography. N Engl J Med 1979; 300:278-83. [ Links ]
33. Nousiainen T, Jantunen E, Vanninen E. Early decline in left ventricular ejection fraction predicts doxorubicin cardiotoxicity in lymphoma patients. Br J Cancer 2002; 86(11): 1697-1700. [ Links ]
34. Codón J, Rosillo S, Rodríguez T et al. Cardiotoxicity from the cardiologist's perspective. Future Cardiol 2015; 11, 425-432 [ Links ]
35. Torrent-Guasp F. Estructura y función del corazón. Rev Esp Cardiol 1998; 51: 91-102. [ Links ]
36. Mele D, Rizzo P, Pollina A. Cancer therapy-induced cardiotoxicity: role of ultrasound deformation imaging as an aid to early diagnosis. Ultrasound Med Biol 2015: 41(3); 627-643. [ Links ]
37. Mercuro G, Cadeddu C, Piras A. Early epirubicin-induced myocardial dysfunction revealed by serial tissue Doppler echocardiography: correlation with inflammatory and oxidative stress markers. Oncologist 2007; 12:1124-1133. [ Links ]
38. Migrino R, Aggarwal D, Konorev E. Early Detection of Doxorubicin Cardiomyopathy Using 2Dimensional Strain Echocardiography. Ultrasound Med Biol 2008; 34-2: 208-214. [ Links ]
39. Altena R, Perik P, van Veldhuisen D, et al. Cardiovascular toxicity caused by cancer treatment: strategies for early detection. Lancet Oncol 2009;10:391-9. [ Links ]
40. Fallah-Rad N, Walker J, Wassef A, et al. The Utility of Cardiac Biomarkers, Tissue Velocity and Strain Imaging, and Cardiac Magnetic Resonance Imaging in Predicting Early Left Ventricular Dysfunction in Patients With Human Epidermal Growth Factor Receptor II-Positive Breast Cancer Treated With Adjuvant Trastuzumab Therapy. J Am Coll Cardiol 2011; 57: 2263-2270. [ Links ]
41. Dias M, Pazin A, O'Connel J. Early detection of doxorubicin myocardial injury by ultrasonic tissue characterization in an experimental animal model. Cardiovasc Ultrasound 2012; 10: 40. [ Links ]
42. Hare L, Brown J, Leano R. Use of myocardial deformation imaging to detect preclinical myocardial dysfunction before conventional measures in patients undergoing breast cancer treatment with Trastuzumab. Am Heart J 2009; 158:294-301. [ Links ]
43. Sawaya H, Scherrer-Crosbie M, Plana J et al. Assessment of Echocardiography and Biomarkers for the Extended Prediction of Cardiotoxicity in Patients Treated With Anthracyclines, Taxanes, and Trastuzumab. Circulation Cardiovascular Imaging 2012; 5:596-603. [ Links ]
44. Eidem BW. Identification of Anthracycline Cardiotoxicity: Left Ventricular Ejection Fraction Is Not Enough. J Am Soc Echocardiogr 2008;21(12):1290-2. [ Links ]
45. Stanton T, Leano R, Marwick TH. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring. Circ Cardiovasc Imaging 2009; 2:356-64. [ Links ]
46. Morno C, Athanasios J, Cozma D et al. The Value of Left Ventricular Global Longitudinal Strain Assessed by Three- Dimensional Strain Imaging in the Early Detection of Anthracycline Mediated Cardiotoxicity. Hellenic J Cardiol 2014; 55: 235-244. [ Links ]
47. Ho E, Brown A, Barrett P. Subclinical anthracycline and Trastuzumab induced cardiotoxicity in the long-term followup of asymptomatic breast cancer survivors: a speckle tracking echocardiographic study. Heart 2010; 96:701-707. [ Links ]
48. Ionescu E, Espinosa H, Pérez J. Comparación de la ecocardiografía convencional y el método Strain en la evaluación de la cardiotoxicidad por agentes antineoplásicos. Avances Cardiol 22014;34(2):119-127
49. Geyer H, Caracciolo G, Abe H. Assessment of Myocardial Mechanics Using Speckle Tracking Echocardiography: Fundamentals and Clinical Applications. J Am Soc Echocardiogr 2010;23(4):351-69; [ Links ]
50. Stoodley P, Richards D, Hui R et al. Two-dimensional myocardial strain imaging detects changes in left ventricular systolic function immediately after anthracycline chemotherapy. Eur J Echocardiogr 2012;12(12):945-52 [ Links ]
51. Stoodley P, Richards D, Meikle S. The potential role of echocardiographic strain imaging for evaluating cardiotoxicity due to cancer therapy. Heart Lung Circ 2011; 20:3-9. [ Links ]
52. Marwick T, Leano R, Brown J. Myocardial Strain Measurement with 2-Dimensional Speckle-Tracking Echocardiography. J Am Coll Cardiol Cardiovasc Imaging 2009;2(1):80-4. [ Links ]
53. Stanton T, Rodel L, Thomas H et al. Prediction of All-Cause Mortality From Global Longitudinal Speckle Strain Comparison With Ejection Fraction and Wall Motion Scoring. Circ Cardiovasc Imaging 2009;2(5):356-64. [ Links ]
54. Rosner A, Jakob O, Aarsæther E. High Resolution Speckle Tracking Dobutamine Stress Echocardiography Reveals Heterogeneous Responses in Different Myocardial Layers: Implication for Viability Assessments. J Am Soc Echocardiogr 2010; 23:439-447. [ Links ]
55. Alici H, Balakan O, Ercan S et al. Evaluation of early subclinical cardiotoxicity of chemotherapy in breast cáncer. Anatolian J Cardiol 2015; 15: 56-60. [ Links ]
56. Migliore R, Darú V. Is It Still Valid to Measure Ejection Fraction When There Are New Deformation Indices to Evaluate Ventricular Function? Rev Argent Cardiol 2011;79:5. [ Links ]
57. Voelkel N, Quaife R, Leinwand L, et al. Right Ventricular Function and Failure: Report of a National Heart, Lung, and Blood Institute Working Group on Cellular and Molecular Mechanisms of Right Heart Failure. Circulation 2006; 114:1883-1891. [ Links ]
58. Tanindi A, Demirci U, Tacoy G et al. Assessment of right ventricular functions during cancer chemotherapy. Eur J Echocardiogr 2011;12(11):834-40. [ Links ]
59. Rudski G, Wyman W, Afilalo J, et al. Guías para la Evaluación Ecocardiográfica de las Cámaras Derechas en el Adulto: Un Reporte de la Asociación Americana de Ecocardiografía. J Am Soc Echocardiogr 2010; 23:685-713. [ Links ]
60. Zarco, P. Diferencias hemodinámicas entre el ventrículo derecho e izquierdo. Rev Esp Cardiol 1999; 52: 43-46. [ Links ]
61. Grignola JC, Pontet J, Vallarino M, Ginés F. Características propias de las fases del ciclo cardíaco del ventrículo derecho. Rev Esp Cardiol 1999; 52: 37-42. [ Links ]
62. Toro-Salazar OH, Gillan E, O'Loughlin MT. Occult Cardiotoxicity in Childhood Cancer Survivors Exposed to Anthracycline Therapy. Circ Cardiovasc Imaging 2013; 6:873-880. [ Links ]
63. Calleja A, Poulin F, Khorolsky C. Right Ventricular Dysfunction in Patients Experiencing Cardiotoxicity during Breast Cancer. Therapy 2015, Article ID 609194. [ Links ]
64. Calzas J, Lianes P, Cortés-Funes H. Corazón y neoplasias. Rev Esp Cardiol 1998; 51: 314- 331. [ Links ]
65. Curigliano G, Cardinale D, Suter T. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines. Ann Oncol 2012;23 Suppl 7:vii155-66. [ Links ]
66. Coronato S, Laguens GE, Spinelli OM, Di Girolamo W. Marcadores tumorales en cancer de mama. Medicina (Buenos Aires) 2002; 62: 73-82. [ Links ]
67. Adão R, Keulenaer G, Leite-Moreira A. Cardiotoxicity associated with cancer therapy: Pathophysiology and prevention. Rev Port Cardiol 2013; 32:395-409. [ Links ]
68. Wang JC. Cellular roles of DNA topoisomerases: A molecular perspective. Nat Rev Mol Cell Biol 2002; 3:430-40. [ Links ]
69. Wojnowski L, Kulle B; Schirmer M, et al. NADPH Oxidase and Multidrug Resistance Protein Genetic Polymorphisms Are Associated With Doxorubicin Induced Cardiotoxicity. Circulation 2005; 112:3754-3762. [ Links ]
70. Ceballos G, Hernández N. Moduladores de Progresión en Cáncer de Mama. Cancerología 2008;3: 41-49. [ Links ]
71. Monsuez J. Detection and prevention of cardiac complications of cancer chemotherapy. Arch Cardiovasc Dis 2012;105(11):593-604. [ Links ]
72. Alexieva B, Sainova I, Pavlova V et al. Insights into Mechanisms of Doxorubicin Cardiotoxicity. J Phys Pharm Adv 2014, 4: 342- 348. [ Links ]
73. Gianni L, Herman E, Lipshultz S. Anthracycline Cardiotoxicity: From Bench to Bedside. J Clin Oncol 2008; 26: 3777-3784. [ Links ]
74. Tan T, Neilan T, Plana J et al. Anthracycline-Induced Cardiomyopathy in Adults. Compr Physiol 2015;5(3):1517-40. [ Links ]
75. Lyu YL et al. Role of Topoisomerase IIβ in the Expression of Developmentally Regulated Genes Mol Cell Biol 2006; 26:7929-41.
76. Legha S. Reduction of doxorubicin cardiotoxicity by prolonged continuous intravenous infusion. Ann Intern Med 1982; 96:133- 9. [ Links ]
77. Vejpongsa P, Yeh E. Prevention of anthracycline-induced Cardiotoxicity. J Am Coll Cardiol 2014;64(9):938-45. [ Links ]
78. Force T, Wang Y. Mechanism Based Engineering against Anthracycline Cardiotoxicity. Circulation 2013; 128(2):98-100. [ Links ]
79. Minotti G, Menna P, Salvatorelli E et al. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacol Rev 2004;56(2):185-229. [ Links ]
80. Sawyer D, Peng X, Chen B. Mechanisms of Anthracycline Cardiac Injury: Can we identify strategies for cardio-protection? Prog Cardiovasc Dis 2010; 53(2): 105-113. [ Links ]
81. Geisberg C, Sawyer D. Mechanisms of Anthracycline Cardiotoxicity and Strategies to Decrease Cardiac Damage. Curr Hypertens Rep 2010;12(6):404-10. [ Links ]
82. McHowat J, Swift L, Crown K. Changes in Phospholipid Content and Myocardial Calcium Independent Phospholipase A2 Activity during Chronic Anthracycline Administration. J Pharmacol Exp Ther 2004;311(2):736-41. [ Links ]
83. Tessler J, Varela M, Rosso D. Quimioterápicos antineoplásicos. Farmacología 2004 https://es.scribd.com/doc/102530503/ antineoplasicos. [ Links ]
84. Carvalho F, Burgeiro A, Garcia R, et al. Doxorubicin-Induced Cardiotoxicity: From Bioenergetic Failure and Cell Death to Cardiomyopathy. Med Res Rev 2014;34(1):106-35. [ Links ]
85. Sawyer D. Anthracyclines and Heart Failure. N Engl J Med 2013; 368:1154-1156. [ Links ]
86. Levine MN. Trastuzumab cardiac side effects: only time will tell. J Clin Oncol 2005;23(31):7775-6. [ Links ]
87. Kiliçaslan B, Özdoan Ö, Pikin G, et al. Echocardiographic signs of right ventricle changes after Trastuzumab treatment in breast cancer patients with erb-2 overexpression. Anatol J Cardiol 2015;15(2):143-8. [ Links ]
88. Halestrap A, Clarke S, Khaliulin I. The role of mitochondria in protection of the heart by Preconditioning. Biochim Biophys Acta 2007; 1767: 1007-1031. [ Links ]
89. Sharikabad M, Østbye M, Lyberg T et al. Effect of extracellular Mg21 on ROS and Ca21 accumulation during reoxygenation of rat cardiomyocytes. Am J Physiol Heart Circ Physiol 2001;280:344-353. [ Links ]
90. Marín-García J, Goldenthal M. La mitocondria y el corazón. Rev Esp Cardiol 2002; 55(12):1293-310. [ Links ]
91. Lencova O, Jirkovsky E, Mazurova Y, et al. Molecular Remodeling of Left and Right Ventricular. Myocardium in Chronic Anthracycline Cardiotoxicity and Post-Treatment Follow Up. PLoS One 2014; 9(5): e96055. [ Links ]
92. Capelastegui A, Astigarraga E, Paz M et al. Estudio del ventrículo derecho mediante resonancia magnetic. Radiología 2012; 54(3):231-245. [ Links ]
93. San Mauro M. Anatomía cardíaca Una manera integral de estudiar las estructuras del corazón y los grandes vasos. 2013. Editorial de la Universidad Nacional de La Plata (EDULP). [ Links ]
94. Ho SY, Nihoyannopoulos P. Anatomy, echocardiography and normal right ventricular dimensions. Heart 2006; 9: 2-13. [ Links ]
95. Crean A, Maredia N, Ballard G et al. 3D Echo systematically underestimates right ventricular volumes compared to cardiovascular magnetic resonance in adult congenital heart disease patients with moderate or severe RV Dilatation. J Cardiovasc Magn Reson 2011; 13(1): 78. [ Links ]
96. Valsangiacomo E, Buechel L, Mertens L. Imaging the right heart: the use of integrated multimodality imaging. Eur Heart J 2012; 33, 949-960. [ Links ]
97. Lindqvist P, Calcutteea A, Henein M. Echocardiography in the assessment of right heart function. Eur J Echocardiogr 2008;9(2):225-34. [ Links ]
98. Carver J. Management of Trastuzumab-Related Cardiac Dysfunction Prog Cardiovasc Dis 2010;53(2):130-9. [ Links ]
99. Kjaergaard J, Petersen C, Kjaer J et al. Evaluation of right ventricular volume and function by 2D and 3D echocardiography compared to MRI. Eur J Echocardiography 2006; 7: 430-438. [ Links ]
100. Medvedofsky D, Addetia K, Patel AR, Sedlmeier A, Baumann R, Mor-Avi V, Lang RM. Novel Approach to Three- Dimensional Echocardiographic Quantification of Right Ventricular Volumes and Function from Focused Views. J Am Soc Echocardiogr 2015;28(10):1222-31. [ Links ]
101. Motoki H, Koyama J, Nakazawa H. Torsion analysis in the early detection of anthracycline-mediated cardiomyopathy. Eur Heart J Cardiovasc Imaging 2012;13(1):95-103. [ Links ]
102. Tan T, Bouras S, Sawaya H et al. Time Trends of Left Ventricular Ejection Fraction and Myocardial Deformation Indices in a Cohort of Women with Breast Cancer Treated with Anthracyclines, Taxanes, and Trastuzumab. J Am Soc Echocardiogr 2015;28(5):509-14. [ Links ]
103. Negishi K, Negishi T, Plana J. Independent and Incremental Value of Deformation Indices for Prediction of Trastuzumab- Induced Cardiotoxicity. J Am Soc Echocardiogr 2013;26(5):493-8. [ Links ]
104. Neilan TG, Jassal DS, Perez-Sanz TM, et al. Tissue Doppler imaging predicts left ventricular dysfunction and mortality in a murine model of cardiac injury. Eur Heart J 2006; 27: 1868. [ Links ]
105. Jurcut R, Sorin G, La Gerche A, et al. The echocardiographic assessment of the right ventricle: what to do in 2010? Eur J Echocardiogr 2010;11(2):81-96. [ Links ]
106. Ganame J, Claus P, Eyskens B, et al. Acute cardiac functional and morphological changes after Anthracycline infusions in children. Am J Cardiol 2007; 99:974-7. [ Links ]
107. Lang RM, Badano L, Mor-Avi V et al. Recomendaciones para la Cuantificación de las Cavidades Cardíacas por Ecocardiografía en Adultos: Actualización de la Sociedad Americana de Ecocardiografía y de la Asociación Europea de Imagen Cardiovascular. J Am Soc Echocardiography 2015; 28:1-39. [ Links ]
108. Jassal D, Han S, Hans C et al. Utility of Tissue Doppler and Strain Rate Imaging in the Early Detection of Trastuzumab and Anthracycline Mediated Cardiomyopathy. J Am Soc Echocardiogr 2009; 22:418-424. [ Links ]
109. Mavinkurve Groothuis AM, Marcus C et al. Myocardial 2D strain echocardiography and cardiac biomarkers in children during and shortly after anthracycline therapy for acute lymphoblastic leukaemia (ALL): a prospective study. Eur Heart J Cardiovasc Imaging 2013;14(6):562-9. [ Links ]
110. Steinherz L, Steinherz P, Tan C et al. Cardiac toxicity 4 to 20 years after completing anthracycline therapy. JAMA 1991; 266(12):1672-7. [ Links ]
111. Gunther G, William R, Koestenberger M. Relevance of Tricuspid Annular Peak Systolic Velocity to Detect Systolic Right-Ventricular Impairment after Anthracycline Cancer Treatment in Childhood. Pediatr Cardiol 2014; 35:188. [ Links ]
112. Galderisi M, Marra F, Esposito R. Cancer therapy and cardiotoxicity: The need of serial Doppler echocardiography. Cardiovasc Ultrasound 2007; 5:410 -1186. [ Links ]
113. Stapleton G, Stapleton S, Martinez A. Evaluation of Longitudinal Ventricular Function with Tissue Doppler Echocardiography in Children Treated with Anthracyclines. J Am Soc Echocardiogr 2007; 20:492-497. [ Links ]
114. Vogel M, Schmidt M, Kristiansen S, Cheung M. Validation of Myocardial Acceleration During Isovolumic Contraction as a Novel Noninvasive Index of Right Ventricular Contractility: Comparison With Ventricular Pressure-Volume Relations in an Animal Model. Circulation 2002;105(14):1693-9. [ Links ]
115. Cottin Y, Touzery C, Coudert B et al. Impairment of diastolic function during shortterm anthracycline chemotherapy. Br Heart J 1995; 73:61-64. [ Links ]
116. Heger Z, Cernei N, Kudr J et al. A Novel Insight into the Cardiotoxicity of Antineoplastic Drug Doxorubicin. Int J Mol Sci 2013; 21629-21646. [ Links ]
117. Gunther G, William R, Koestenberger M. Relevance of Tricuspid Annular Peak Systolic Velocity to Detect Systolic Right-Ventricular Impairment after Anthracycline Cancer Treatment in Childhood. Pediatr Cardiol 2014; 35:188. [ Links ]
118. Hashimoto I, Li X-K, Hejmadi Bhat A, et al. Quantitative assessment of regional peak myocardial acceleration during isovolumic contraction and relaxation times by tissue Doppler imaging. Heart 2005;91(6): 811-816. [ Links ]
119. Belham M, Kruger A, Pritchard C. The Tei Index Identifies a Differential Effect on Left and Right Ventricular Function with Low dose Anthracycline Chemotherapy. J Am Soc Echocardiogr 2006;19(2):206-10. [ Links ]
120. Schattke S, Knebel F, Grohmann A. Early right ventricular systolic dysfunction in patients with systemic sclerosis without pulmonary hypertension: a Doppler Tissue and Speckle Tracking echocardiography study. Cardiovasc Ultrasound 2010;8:3. doi: 10.1186/1476-7120-8-3. [ Links ]
121. Tayyareci Y, Nisanci Y, Umman B, et al. Early detection of right ventricular systolic dysfunction by using myocardial acceleration during isovolumic contraction in patients with mitral stenosis. Eur J Echocardiogr 2008; 9, 516-521 [ Links ]
122. Oreto L, Todaro MC, Umland MM, Kramer C, Qamar R, Carerj S, Khandheria BK, Paterick TE. Use of echocardiography to evaluate the cardiac effects of therapies used in cancer treatment: what do we know? J Am Soc Echocardiogr 2012;25(11):1141-52. [ Links ]
123. Nagai H, Omi W, Yuasa T, Sakagami S, Takata S, Kobayashi K.Ultrasonic analysis of anthracycline-induced myocardial damage using cyclic variation of integrated backscatter. J Am Soc Echocardiogr 2003;16(8):808-13. [ Links ]
124. Gabriel N, Hortobagyi. Progress in Systemic Chemotherapy of Primary Breast Cancer: an Overview. JNCI Monographs 2001;30(30):72-9.
125. Tigen MK, Karaahmet T, Gürel E, et al. The role of isovolumic acceleration in predicting subclinical right and left ventricular systolic dysfunction in hypertensive obese patients. Turk Kardiyol Dern Ars 2011; 39: 9-15. [ Links ]
126. Saeed M, Premecz S, Goyal V et al. Catching broken hearts: pre-clinical detection of doxorubicin and trastuzumab mediated cardiac dysfunction in the breast cancer setting. Can J Physiol Pharmacol 2014; 92: 546-550. [ Links ]
127. Milano G, Raucci A, Scopece A, et al. Doxorubicin and trastuzumab regimen induces biventricular failure in mice. J Am Soc Echocardiogr 2014; 27(5):568-79. [ Links ]
128. Schlitt A, Jordan K, Vordermark D, Schwamborn J, Langer T, Thomssen C. Cardiotoxicity and oncological treatments. Dtsch Arztebl Int 2014;111(10):161-8. [ Links ]














