Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.13 no.2 Ciudad Autónoma de Buenos Aires June 2018
ARTICULO DE ACTUALIZACION
Tratamiento congestivo: diuréticos, resistencia diurética y alternativas
Papel de la ultrafiltración
Laura Salanova Villanueva1, Begoña Santos Sánchez2, David Sapiencia Sanjines2
1 Doctora en Medicina. Médico Adjunto Atención Continuada. Servicio de Nefrología. Hospital Universitario de La Princesa. Madrid. España.
2 Médico residente. Servicio de Nefrología. Hospital Universitario de La Princesa. Madrid. España.
Correspondencia: Dra. Laura Salanova Villanueva.
Servicio de Nefrología. Hospital Universitario de La Princesa. Madrid. España.
Email: aelita.sv@gmail.com
Recibido: 26/02/2018
Aceptado: 20/05/2018
Resumen
Los pacientes con insuficiencia cardíaca descompensada presentan un estado congestivo. La inmensa mayoría de las veces es debido a la activación de mecanismos neurohormonales que provocan la retención de sodio y agua a nivel renal. Esta activación y la congestión pueden devenir en la alteración de la función renal (síndrome cardio-renal). El tratamiento de la congestión se basa en el uso de diuréticos, pero la inmensa mayoría de estos pacientes presentan resistencia a los mismos, además de sufrir diferentes efectos secundarios por su uso, como las alteraciones hidroelectrolíticas. Terapias como la ultrafiltración o la diálisis peritoneal se han valorado en el tratamiento de la insuficiencia cardíaca congestiva. Nuestro objetivo es hacer una aproximación al lector de las alternativas al tratamiento diurético en el paciente congestivo, centrándonos, prioritariamente, en la ultrafiltración.
Palabras clave: Insuficiencia cardíaca; Congestión; Diuréticos; Ultrafiltración
Summary
Congestive treatment: diuretic treatment, diuretic resistance and alternatives
Ultrafiltration role
Patients with decompensated heart failure have a congestive state. Volume overloaded state is due to neurohormonal mechanisms activation that cause the retention of sodium and water by the kidney. This activation and congestion can lead to impaired renal function (cardio-renal syndrome). Congestive treatment is based on use of diuretics but the vast majority of these patients have diuretic resistance, as well as suffering from different side effects due to their use such as hydroelectrolytic alterations. Therapies such ultrafiltration or peritoneal dialysis have been evaluated in the treatment of congestive heart failure. Our objective is to make an approximation of other therapeutic strategies specially on ultrafiltration to resolve congestive state.
Keywords: Heart failure; Congestion; Diuretics; Ultrafiltration
Resumo
Tratamento congestivo: diuréticos, resistência diurética e alternativas
Papel da ultrafiltração
Pacientes com insuficiência cardíaca descompensada apresentam um estado congestivo. A grande maioriaé devido à ativação de mecanismos neuro-hormonais que causam a retenção de sódio e água nos rins. Essa ativação e congestão podem resultar em comprometimento da função renal (síndrome cardio-renal). O tratamento da congestão baseia-se no uso de diuréticos, mas a grande maioria destes pacientes têm a mesma resistência, e sofrem de diversos efeitos colaterais por utilização, como perturbações electrolíticas. Terapias como ultrafiltração ou diálise peritoneal foram avaliadas no tratamento da insuficiência cardíaca congestiva. Nosso objetivoé aproximar o leitor das alternativas ao tratamento diurético no paciente congestivo, enfocando, principalmente, a ultrafiltração.
Palavras-chave: Insuficiência Cardíaca; Congestão; Diuréticos; Ultrafiltração
Introducción
La insuficiencia cardíaca (IC) congestiva conlleva una morbimortalidad elevada a nivel mundial1,2. En España, el estudio PRICE demostró una prevalencia del 7% en mayores de 45 años3. La coexistencia de enfermedad renal en el seno del fallo cardíaco es frecuente2-4. Así, el paciente renal presenta un incremento del riesgo cardiovascular 20 veces superior a la población general. El estudio ADHERE demostró que, sobre 100.000 pacientes con IC, el 30% presentaban disfunción renal moderada-severa2; otros estudios han relacionado el empeoramiento de la clase funcional cardiológica con mayor deterioro de la función renal5. Esta interrelación entre ambos órganos, conocida como síndrome cardiorenal (SCR), fue definida por Ronco y colaboradores6 como un desorden fisiopatológico del riñón o del corazón de forma aguda o crónica que puede conllevar la alteración del otro órgano. La interconexión entre ambos órganos es debido a una serie de mecanismos neurohormonales-neuroendocrinos (sistema renina angiotensina aldosterona: SRAA, sistema nervioso simpático: SNS, péptidos natriuréticos: PN, vasopresina u hormona antidiurética: ADH, etc.) descritos como la “conexión cardio-renal” basada en la regulación del volumen extracelular por parte de ambos órganos7. Estos sistemas son “mecanismos compensadores” para mantener el volumen intravascular y la presión arterial; pero también provocan, en su mayoría, una vasoconstricción periférica, descenso de la perfusión renal, alteraciones en el remodelado cardiológico y una respuesta inflamatoria sistémica. A su vez, provocan retención de sodio/agua, perjudicando la función cardíaca debido a la congestión (salvo los PNs). El estado congestivo complica el manejo y pronóstico de estos pacientes. Además de las restricción de sodio y agua, los diuréticos han sido, y siguen siendo, el pilar del tratamiento de la sobrecarga de volumen en la IC con o sin fallo renal con una mejoría rápida del estado congestivo2,8,9; sin embargo, no han demostrado beneficio en morbimortalidad, relacionándose inclusive con efectos secundarios graves10,11. A pesar de ello, hasta el 81% de los pacientes con IC presentan tratamiento diurético2. Los diuréticos pierden su eficacia con las diferentes exposiciones, es lo que se conoce como resistencia diurética (RD)12-14. La ultrafiltración (UF) y la diálisis peritoneal (DP) se han postulado como complementarias al tratamiento diurético15-18. En esta revisión repasaremos las causas de la RD y evaluaremos las distintas terapias complementarias al mismo; centrando nuestra exposición en el papel de la UF en el tratamiento de la IC.
Aproximación al SCR. Clínica congestiva
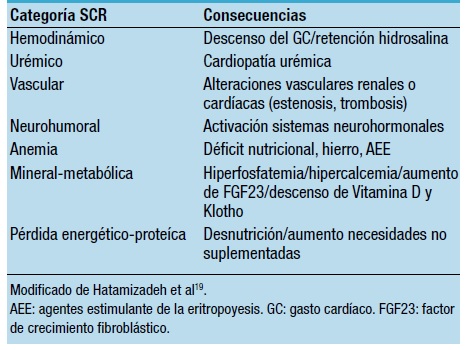
Hemos mencionado como Ronco y col.6 propusieron un esquema en la clasificación del SCR en 5 tipos: SCR-I, el fallo cardíaco conlleva fallo agudo renal; SCR-II, el fallo cardíaco crónico conlleva fallo renal crónico; SCR-III, el fallo renal agudo conlleva fallo cardíaco agudo; SCR-IV, el fallo renal crónico conlleva fallo crónico cardíaco, y SCR-V, donde hay una alteración a nivel sistémico (Figura 1). Otros autores han clasificado el SCR como una entidad clínica y funcional con el propósito de identificar la manifestación clínica más relevante y el mecanismo que prioriza en la disfunción como objetivo de cara al tratamiento. Así Hatamizadeh y col.19 clasifican al SCR como: hemodinámico, urémico, vascular, neurohumoral, por anemia, alteraciones mineral-ósea, por pérdida energético-proteica (Tabla 1).
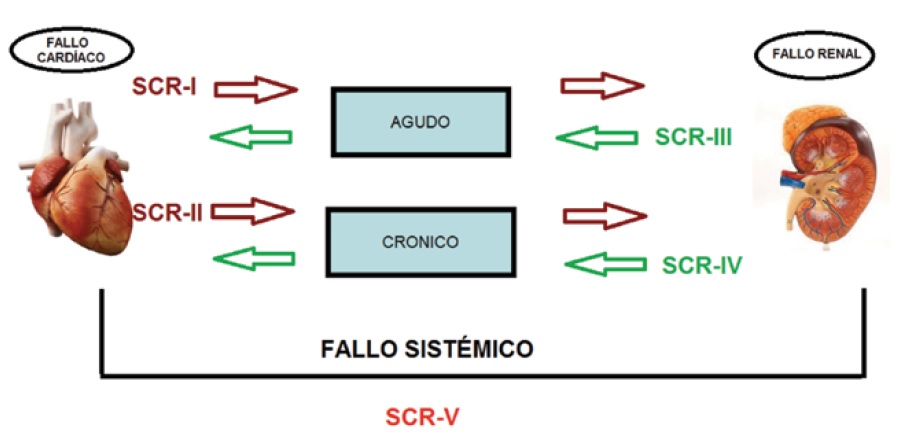
Figura 1. Clasificación del síndrome cardio-renal. Modificado de Ronco et al6.
Tabla 1. Clasificación del síndrome cardio-renal
Diferentes mecanismos se han propuestos como causantes del fallo renal en el seno del fallo cardíaco; el principal de ellos es la activación neurohormonal donde diferentes sistemas: SNS, SRAA, ADH, endotelina, etc., se activan por un relleno vascular inadecuado debido al descenso del gasto cardíaco (GC), provocando vasoconstricción periférica en un intento de preservar el flujo a los órganos más importantes y de mantener la estabilidad hemodinámica7,20,21; otro mecanismo relevante es la congestión venosa que se produce por la retención de sodio y agua que, en el riñón, provocan estos ejes neuroendocrinos, y también debido a la menor presencia de receptores de PNs a este nivel22. El estado congestivo conlleva el aumento de la precarga y de síntomas retrógrados entre los que se encuentra el aumento de la presión venosa renal, que provoca un descenso en la presión de filtración renal y del filtrado glomerular20-24 (FG). A su vez, la congestión implica la depleción intravascular así como aumento del espacio intersticial en una errática redistribución del espacio extracelular; ocasionando mayor estimulación de los mecanismos neuroendocrinos para mantener la volemia, entrando así en un círculo vicioso25. Finalmente, esta situación crea una cascada inflamatoria y de disfunción endotelial que influye en la función de ambos órganos con alteraciones en el tono vascular, hemodinamia renal, el remodelado cardíaco y finalmente fibrosis26,27. En definitiva, tanto el aumento de la precarga y postcarga cardíaca conlleva mayores requerimiento metabólicos en un miocardio previamente dañado, y el daño renal provoca una errática eliminación de productos de desecho y alteraciones hidroelectrolíticas perjudiciales para el corazón.
Parece lógico pensar que la disfunción renal en el seno del fallo cardíaco es un indicador de mal pronóstico2,28. Pero tal vez la implicación de la disfunción renal como marcador pronóstico en la IC esté supeditada a la presencia o no de congestión en este tipo de enfermos. Así, cuando el fallo renal se presenta con poca repercusión clínica y analítica y es breve en el tiempo, junto con mejoría del estado congestivo, podría ser un indicador de buen pronóstico en el seno de la IC29,30, de hecho la presencia de congestión en pacientes que ingresan por IC y mejoría de función renal se ha relacionado con peores resultados clínicos31. Es por tanto el estado congestivo el síntoma principal a tratar en el seno del SCR agudo, principalmente, porque es la causa más frecuente de ingreso en estos pacientes2,32 y porque, frecuentemente, la resolución completa de la misma no se produce cara al alta según datos del Acute Descompesated Heart Failure National Registry americano33.
Además, existe una relación clara entre la congestión y la disfunción renal; en diferentes estudios no se ha demostrado una asociación entre el daño renal y marcadores cardíacos como el índice cardíaco, fracción de eyección del ventrículo izquierdo (FEVI) o las resistencias vasculares periféricas en el seno de la IC, sino con la presión de la aurícula derecha32,34. Damman y col.35 demostraron en 2557 enfermos la relación entre el aumento de la presión venosa central y la disfunción renal como predictor de mortalidad5. De hecho, como hemos comentado anteriormente, un marcador precoz de disfunción renal en el SCR es el aumento de la presión venosa renal23,24. Por lo tanto, el diagnóstico del estado congestivo (exploración física, parámetros bioquímico como PNs, bioimpedancia eléctrica -BIA-, ecocardiografía, medición de presiones venosas etc.), así como su celeridad en el tratamiento, se asocia a una mejora clínica del enfermo con descenso de la morbimortalidad de causa cardíaca y a una protección del fallo renal.
El objetivo en este tipo de pacientes es conseguir un volumen circulante eficaz (VCE) adecuado para las necesidades corporales, incluida la renal, sin someter al miocardio a un trabajo excesivo. Si aparece un aumento del VCE o una mala redistribución del volumen extracelular a expensas del espacio intersticial se provocará bajo GC y clínica congestiva que desencadenará en fallo renal (Figura 2). La manera más eficaz de llegar a la euvolemia en este tipo de pacientes no es sencilla y la terapia no está exenta de efectos adversos como a continuación detallaremos.
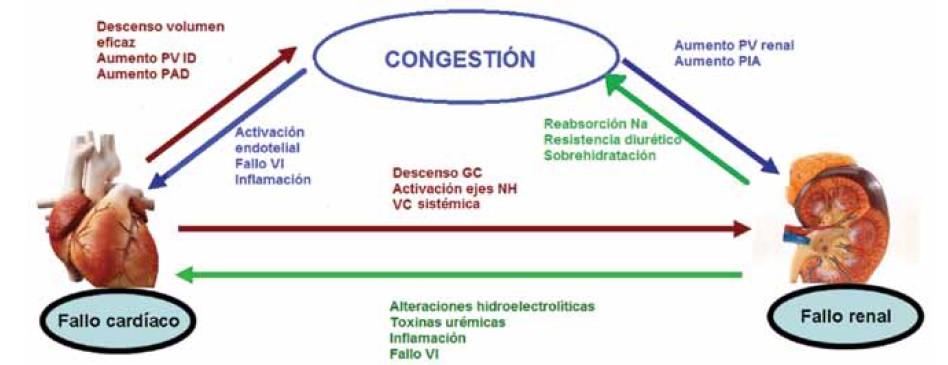
Figura 2. Mecanismos fisiopatológicos de la congestión y consecuencias cardio-renales. GC: gasto cardíaco. Na: sodio. NH: neurohormonales. PAD: presión aurícula derecha. PIA: presión intraabdominal. PV: presión venosa. PVID: presión ventricular izquierda diastólica. VC: vasoconstricción. VI: ventrículo izquierdo.
Tratamiento de la congestión
Diuréticos
Los diuréticos siguen siendo el pilar en el tratamiento de la congestión en el seno de la IC; hasta el 81% de estos pacientes presentan tratamiento diurético2; sin embargo, no han demostrado beneficio en morbimortalidad, relacionándose inclusive con efectos secundarios graves36,37. No obstante las guías de práctica clínica clasifican a los diuréticos como terapia de primera línea con recomendación I, pero el nivel de evidencia es B38. El tratamiento diurético ha de ir acompañado de otras medidas como la restricción de sodio y agua39; debido a la retención que se produce de estos elementos por parte de los mecanismos neuroendocrinos mencionados previamente. Se propone una restricción hídrica y de sal en los pacientes con IC moderada-severa de 1,5 a 2 litros/ día y <1,5 gramos a 2 gramos/día respectivamente40,41.
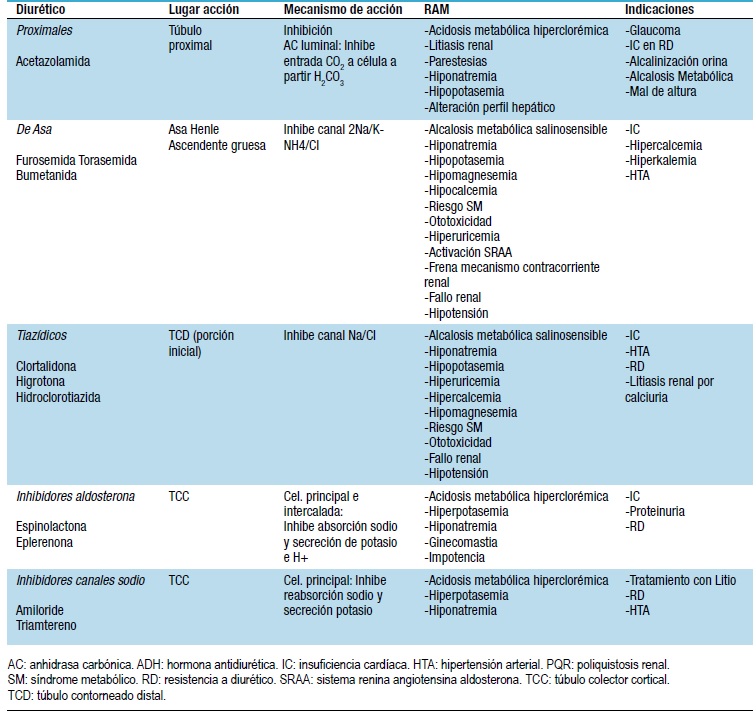
Dentro de los diuréticos clásicos encontramos distintas familias que detallamos a continuación y en la Tabla 2:
Tabla 2. Fármacos aprobados para el uso del estado congestivo con acción renal y efecto diurético
- Diuréticos de asa (DDA)
Básicos en el tratamiento congestivo de la IC. Actúan inhibiendo la bomba 2Na/K-NH4/Cl (NKCC) del asa de Henle renal, porción ascendente gruesa; provocando la excreción de un 20-25% de la carga de sodio filtrada. Su unión a proteínas es elevada y su vida media está aumentada en el fallo renal37,42. La bomba NKCC tiene 2 isoformas: tipo 1, expresada en distintos tejidos que explicaría la acción vasodilatadora de los DDA; y tipo 2 o renal37,42,43. A nivel cardiológico, los DDA crean un balance negativo de sodio y agua, disminuyen las presiones de llenado cardíaco, el volumen ventricular izquierdo con descenso de la precarga e inclusive provocan un descenso en la isquemia44,45; además su efecto anticongestivo conlleva mejoría de la función renal al desplazar la curva de Frank-Starling a la izquierda en los pacientes con IC y mejorar la perfusión renal; pero si el descenso del VCE es excesivo, el efecto en la funcionalidad renal es contrario39. Un tema muy debatido en el uso de los DDA es la infusión continua versus los bolos. Furosemida es el DDA con menor vida media (unas 6 horas) y el más usado; provoca una respuesta de excreción de sodio importante en esas 6 horas, cayendo bruscamente tras ella y con riesgo de “reabsorción post diurética de sodio” (ver más adelante) debido al estímulo del SRAA y el SNS46,47. A priori, este efecto se podría evitar con las dosis continuas39. El estudio DOSE48 comparó el efecto de furosemida intravenosa (IV) en dosis continua versus bolos (cada 12 horas), y de altas dosis (2,5 veces la dosis oral) vs baja dosis (la misma dosis que oral) en pacientes con IC. No observaron diferencias significativas a las 72 horas, ni en los niveles de creatinina ni en la valoración clínica entre bolos o infusión continua o alta o baja dosis. No obstante el empeoramiento de la función renal, en algún momento de las 72 horas, era más frecuente en los enfermos asignados a las altas dosis; este deterioro era reversible y en un subanálisis secundario, este hecho se asoció a mejor pronóstico48. El meta-análisis de Wu y col.49 demostró una asociación entre la infusión continua y mayor pérdida de peso significativa, pero no mayores beneficios estadísticamente significativos en cuanto a hospitalización, morbimortalidad cardíaca u otra causa o alteraciones hidroelectrolíticas.
Como efectos secundarios los DDA estimulan al SRAA: altera el feed-back túbulo-glomerular, provocando secreción de renina y al inhibir la NKCC en la arteriola aferente de la mácula densa37,42, aumenta la carga de sodio al segmento distal de la nefrona, estimulando la expresión de aldosterona y, por la depleción de volumen que provoca, activaría la angiotensina II. También provocan alteraciones hidroelectrolíticas, actúan sobre el metabolismo del ácido úrico e hidratos de carbono, aumentándolos en sangre y provocando alcalosis metabólica por la activación del SRAA37,42. Por último, frena el mecanismo contracorriente del asa de Henle y provoca fallo renal por la depleción de volumen. También es ototóxico37,42.
- Diuréticos proximales37,42
Inhiben la anhidrasa carbónica que ejerce su efecto sobre el ácido carbónico luminal, transformándolo en CO2+H2O que se reabsorbe a nivel del túbulo proximal. Potencian a los DDA y tiazidas al aumentar el sodio luminal a lo largo de la nefrona; también actúan sobre el feed-back túbulo-glomerular al aumentar la carga de cloro y sodio luminal, inhibiendo la expresión de renina50. Además, inhibe la expresión del canal sodio/cloro/ yodo pendrina a nivel distal51, potenciando nuevamente el efecto de las tiazidas. Como efectos secundarios: alteraciones hidroelectrolíticas y acidosis metabólica hiperclorémica.
- Tiazidas37,42
Actúan sobre la porción inicial del túbulo contorneado distal, inhibiendo el canal sodio/cloro. Bloquean un 5-10% de la carga filtrada de sodio. Presentan similares efectos secundarios a los DDA a los cuales potencian.
- Inhibidores de aldosterona y canales de sodio de la célula principal del túbulo colector37,42
Inhiben la reabsorción de sodio; en el caso de los inhibidores del receptor de aldosterona frenan otros posibles efectos deletéreos de esta hormona. Posee efecto antiproteinúrico52. Potencian a los DDA.
Resistencia y eficacia diurética
En la terapia diurética hay que tener en cuenta dos conceptos: eficacia diurética (ED) y RD. El primero se refiere a la correlación que hay entre la cantidad de diuresis con respecto a una determinada dosis de diurético53 (frecuentemente, 40 mg de furosemida por lo que el término más apropiado sería eficacia a DDA), representando la habilidad del DDA para aumentar la excreción fraccional del sodio filtrado54. El término RD se refiere a la inadecuada respuesta a un aumento de la dosis de diurético14 o la no resolución del estado congestivo a pesar de dosis plenas de diuréticos14. Definir la “dosis plena de diurético” es complejo: podría ser “persistencia de congestión a pesar de dosis repetidas de furosemida 80 mg”, o “dosis mayores de 250 mg/24 h”, o “combinación diurética inefectiva donde siempre hay DDA”, entre otras definiciones14,37,42,55; la RD es un indicador de severidad y morbimortalidad en IC53,55,56, independientemente del FG53, presente en un 25-30% de los pacientes11,14,57.
A continuación procedemos a enumerar los distintos mecanismos de la RD y las posibles soluciones. Es importante matizar que las dos causas reales de la RD son una inadecuada llegada de sodio a los sitios de acción de los diuréticos y la reabsorción de sodio compensatoria debido a hipertrofia tubular, especialmente, en zonas distales del asa de Henle58-61:
Falta de sodio en la red tubular
Representa el 21% de las causas de RD61. La ED va a depender ya no sólo de la cantidad del agente farmacológico en su lugar de acción, sino también, del sustrato con el que actúan los diuréticos, en este caso el sodio. De hecho, Paterna y col.62 emplearon cloruro sódico hipertónico intravenoso (150 mEq/día), añadido al tratamiento diurético en pacientes cardiópatas con RD, obteniendo un descenso en la tasa de reingresos y mayor diuresis. Esta medida mejora el flujo renal al provocar expansión del VCE con aumento de la presión hidrostática a nivel glomerular y peritubular, incrementándose la natriuresis y la concentración diurética62,63; dosis de 2 gramos/día (87 mEq/día) de sal vía oral sería suficiente para mantener un aporte tubular adecuado de sodio de manera crónica62,63.
Hipertrofia e hiperplasia tubular renal por uso de diuréticos
Tema ampliamente estudiado en estudios con animales64-66, se le atribuye hasta el 75% de las razones de RD61,67. La exposición prolongada a diuréticos proximales (DDA, especialmente) provoca una hipertrofia del túbulo distal (zona del cotransportador sodio/cloro sensible a tiazidas), túbulo colector61,64,65,67, y aumento de la secreción de aldosterona, debido al aumento de la carga de sodio en el lumen en esas zonas. La aldosterona, a su vez, es capaz de activar el canal tiazídico, además de su acción sobre la célula principal e intercalada del túbulo colector cortical65. Además, la hipopotasemia y la alcalosis metabólica, secundarias al uso de DDA, activa y por tanto influye en el remodelado del canal tiazídico68,69. A su vez, los DDA podrían provocar hipertrofia a nivel del túbulo proximal con mayor avidez hacia la absorción de sodio y agua debido al estímulo de angiotensina-II (A-II) que en parte también provocan los DDA. De esta manera se explicaría el hecho de que la excreción de sodio en orina no corresponda a la magnitud de la inhibición de NKCC como queda reflejado en el estudio de Rao y col.61, donde la excreción fraccional de litio (la reabsorción de litio ocurre en paralelo a la de sodio en el asa de Henle) no se corresponde a la de sodio en pacientes con IC, cosa que sí ocurre en pacientes sin IC61,70. También el aumento de plasmina (proteasa) y pendrina, aumentada en el paciente con IC, activa el canal tiazídico71.
Una manera clara de solventar este problema es la combinación de diferentes tipos de diuréticos a los DDA, especialmente, distales y concretamente tiazidas8,14,72,73. Las tiazidas siguen siendo el diurético predilecto para combinar; bloquean el 5-10% de la reabsorción de sodio filtrado frente al 25% de DDA; pero ante aumentos de la carga de sodio a nivel distal de la nefrona, este segmento aumenta su capacidad de reabsorción sódica por lo que su bloqueo aumentaría el efecto natriurético73. También, el uso de diuréticos proximales como acetazolamida o distales sobre el túbulo colector cortical estarían indicados, además éstos evitan efectos indeseables de los DDA como la alcalosis metabólica excesiva8,14,72-74.
Otras causas de RD
- Falta de adherencia al tratamiento + ingesta elevada de sodio. En un paciente estable, un sodio urinario >100 mEq/L puede hacernos sospechar trasgresión dietética. Pero los diuréticos clásicos precisan sodio para ejercer su acción en la nefrona por lo que dietas carentes de sodio provocan también una respuesta inadecuada diurética75.
- Alteración perfusión renal. Conforme la IC avanza, la perfusión renal se puede ver alterada y con ello la llegada de diurético a sus distintos puntos de acción. Además el fallo cardíaco estimula mecanismos neuroendocrinos retenedores de sal y agua; algo que queda patente tras la infusión de diurético, especialmente DDA, esto se conoce como “retención de sal postdiurético”. Una posible solución podría ser la infusión continua o la mayor frecuencia en el tiempo de los bolos39 (no menor a cada 6 horas para la furosemida). También el uso de drogas vasoactivas que pudiesen mejorar la perfusión renal.
- Mala distribución del VCE20,21,76,77 (hipoproteinemia, síndrome nefrótico, alteraciones en el glicocaliz endotelial). Cuando el VCE decae, la respuesta natriurética de los diuréticos falla; esto es debido, principalmente, al hecho de que decrecerá la perfusión renal y por tanto el diurético será incapaz de llegar a su lugar de acción. Además un descenso en el VCE provocaría activación de ejes neurohormonales con capacidad de retención de sodio y agua y con efecto vasoconstrictor20,21,76,77. En estos pacientes es importante valorar la redistribución del agua corporal total y la relación volumen intracelular/ extracelular; la BIA y el uso de coloides serían un arma diagnóstica y terapéutica respectivamente76-79.
- Activación mecanismos neurohormonales/endocrinos8,20,21. Además del efecto retenedor de sodio y agua a nivel túbulo proximal (SNS, A-II), distal (aldosterona) o colector (ADH) algunas de estas sustancias como la ADH o la A-II aumentan la actividad de NKCC. La inhibición de dichos ejes neurohormonales con fármacos como los inhibidores de la enzima conversora de angiotensina (IECA), antagonistas de receptores de A-II (ARA-II), o vaptanes podrían mejorar la eficacia del diurético clásico, inhibiendo la reabsorción de sodio y agua a nivel renal además de la mejora de la funcionalidad cardíaca que algunos de ellos puede provocar, especialmente en enfermos con FEVI deprimida.
- Proteinuria80. Incrementa la afinidad de unión de los DDA a proteínas en el lumen tubular impidiendo su acción.
- Alteraciones de absorción intestinal. La biodisponibilidad de la furosemida es del 50%, mientras que la de torasemida y bumetanida es del 90%. Esto es especialmente relevante, no sólo por el ajuste de dosis que precisarán uno u otro diurético; sino por el hecho de que en la IC existe edema y descenso de la perfusión intestinal25 que merman la absorción de los diuréticos, haciendo que éstos sean ineficaces por vía oral. Además la ingesta alimentaria reduce la absorción de furosemida81.
- Acidosis metabólica82. El 90% de DDA está unido a proteínas, por lo que sólo una pequeña cantidad es filtrado por el glomérulo mediante la secreción con aniones orgánicos. La acidosis metabólica puede inhibir la secreción de los diuréticos a nivel luminal. Por lo tanto habrá de ser tratada con bicarbonato cuando suceda.
- Antiinflamatorios no esteroideos. Inhiben prostaglandinas y su efecto natriurético8,14,73. Evitarlos.
Respuesta inadecuada a diuréticos
Un tema interesante es valorar los iones en orina y su excreción fraccional (sodio especialmente) si se sospecha RD o para valorar la eficacia de los mismos8,83,44. El SCR presenta una relación entre excreción fraccional de sodio y RD dado que la reabsorción de sodio se verá aumentada ante un VCE disminuido, como ocurre en la IC8,83,84. La concentración de iones en orina ayuda a decidir el tipo de diurético a asociar: una concentración de sodio y potasio bajas indica que el diurético distal será poco efectivo (el sodio que llega a esa zona no basta para que el diurético actúe), pero si la de sodio es baja y la de potasio elevada indica intercambio de iones a nivel de la nefrona distal; el diurético distal podría aumentar la eficacia diurética8,73,74,84. Al llegar a la euvolemia, muchas veces la concentración de sodio en orina va descendiendo a pesar de un output de diuresis adecuado con el uso de diuréticos, produciéndose también un aumento en la eliminación de urea; aunque si el paciente permanece congestivo un sodio urinario bajo puede indicar un descenso del VCE y una alteración en el refilling (relleno vascular) del enfermo y RD84. Por tanto, la seriación de los iones en orina podría ayudarnos a titular la dosis de diurético. Así en pacientes que alcanzan euvolemia con mejoría del estado congestivo, el descenso de sodio y cloro en la orina nos indicarían que es el momento de disminuir dosis y los pacientes cuya eliminación de sodio fuese elevada nos indicaría mantener la dosis de diurético para evitar una acumulación hídrica.
En la Figura 3 resumimos los pasos a seguir ante la sospecha de RD.
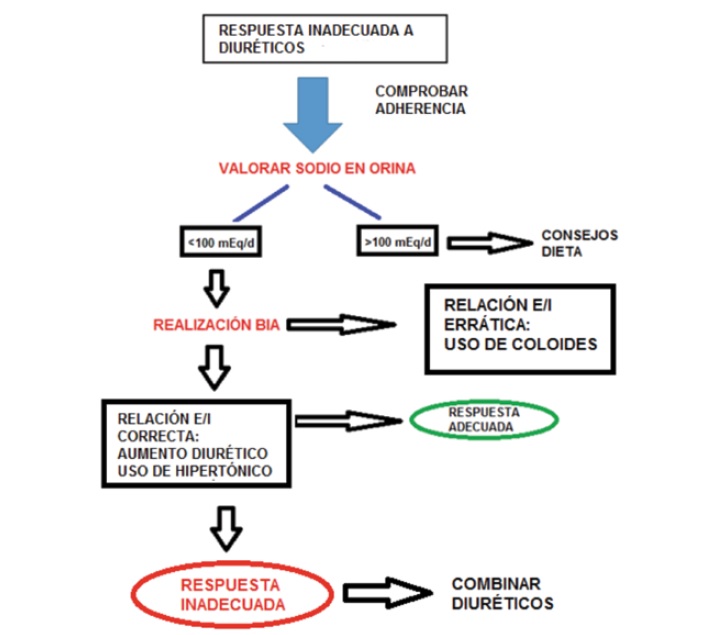
Figura 3. Protocolo ante una sospecha de resistencia a diuréticos.
BIA: bioimpedancia. Relación E/I: relación volumen extracelular/intracelular.
Alternativas al uso de diuréticos en el SCR
Ultrafiltración
Al tratamiento diurético, en el estado congestivo, habrá que añadir otra serie de fármacos para mejorar la funcionalidad cardíaca y con ello la perfusión de la economía corporal, incluyendo la renal. Tal es el caso de los IECA y ARA-II, los primeros reducen la mortalidad y hospitalización del paciente con IC y FEVI reducida85 y se consideran nefroprotectores86,87 (inhibición de la proteinuria, efecto antiinflamatorio, etc.); pueden mejorar la RD. Los ARA-II añadidos a inhibidores de la neprilisina evitan la degradación de los PNs y la retención de sodio y agua88,89; diferentes estudios han demostrados su eficacia en la IC con descenso de las hospitalizaciones y muerte cardiovascular o de todas las causas88-90. No hay experiencia con FG <30 ml/min y están contraindicados asociados a IECA38. Encontramos fármacos con efecto diurético demostrado como los vaptanes (antagonistas del receptor de vasopresina a nivel renal) y los péptidos natriuréticos, ninguno ha demostrado un impacto verdadero en la tasa de hospitalización o mortalidad cardiovascular, teniendo incluso efectos deletéreos como fallo hepático o renal respectivamente91,92. Otros fármacos con cierta utilidad en mejorar la eficacia diurética o por poseer cierto efecto diurético serían38,93,94: serelaxina y antagonistas de adenosina.
Por lo tanto, a veces el tratamiento farmacológico no es capaz de controlar el estado congestivo, en este sentido la UF podría ser una alternativa o bien un complemento al tratamiento estándar de la congestión por IC. La UF se basa en el principio del transporte convectivo; representaría la cantidad de agua plasmática (agua y pequeños solutos como el sodio) que atraviesa la membrana del filtro por unidad de tiempo y superficie debido a una diferencia de presión hidrostática (gradiente de presión transmembrana)95,96. La técnica se realiza a través de máquinas especialmente diseñadas para el tratamiento congestivo de la IC (Aquadex FlexFlow) o bien con máquinas que también pueden realizar tratamientos de aclaramiento difusivo y/o convectivo; la sangre se extrae del enfermo a través de un acceso venoso periférico o central a 10-40 mL/min ó 300-400 mL/min respectivamente, pasa por una membrana biocompatible y se extrae el ultrafiltrado deseado o efluente (agua plasmástica isotónica que contiene cloruro sódico), finalmente devuelve la sangre al enfermo por el acceso venoso. El principal inconveniente de esta técnica son los potenciales riesgos como necesidad de anticoagulación del sistema, infecciones o mal funcionamiento del acceso vascular, embolismos aéreos, complejidad del aparataje. No obstante los monitores de UF están dotados de detectores de aire, alarmas de presión del acceso vascular95,96, etc. En la UF es importante decidir la tasa de UF, que podrá ser variable según las necesidades y el estado hemodinámico del enfermo; si la tasa de UF excede el relleno vascular del enfermo del espacio intersticial al intravascular se producirá hipotensión arterial y alteraciones en el flujo renal, y su funcionalidad, así como nuevamente, la activación de mecanismos neurohormonales, por lo que será importante tener en cuenta la redistribución del volumen extracelular y tomar las medidas oportunas para evitarlo97 (BIA, uso de coloides intratécnica, sesiones más largas y con menos tasa de UF). El uso de la UF en IC remonta a hace más de 20 años con pequeños estudios que demostraban beneficios como la no activación de ejes neurohormonales y la mejoría de la capacidad funcional de los enfermos98-102. También se han diseñados estudios randomizados que han comparado el tratamiento diurético con la UF en el seno del cuadro congestivo cardíaco103-108 (Tabla 3).
Tabla 3. Resumen de los estudios randomizados más relevantes que enfrentan a UF versus diuréticos
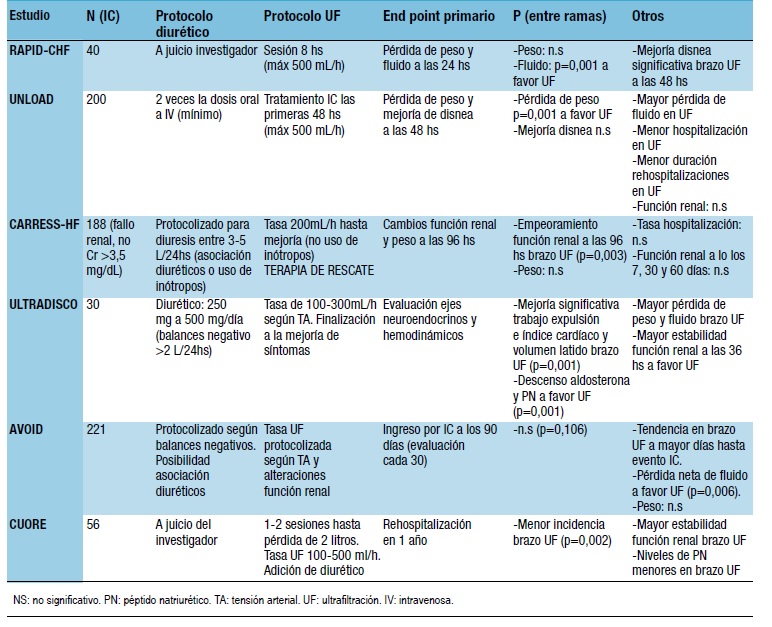
A continuación desglosaremos las características de la UF frente a diuréticos, frecuentemente DDA, sobre distintos parámetros clínicos y analíticos a partir de estos estudios:
- Eliminación del exceso de líquido
El meta-análisis de Kwok y col.109 demostró una tendencia más favorable de la UF frente al diurético en la eliminación de líquidos (p=0,003) y pérdida de peso (p=0,04); Jain y col.110 en su meta-análisis llegan a similares conclusiones para pérdida de peso (p=0,001) y pérdida neta de fluido (p=0,01) a favor de la UF en los estudios analizados. Por separado, el estudio UNLOAD104 o el RAPID103 mostraron diferencias significativas favorables a la UF en la pérdida neta de peso y fluido (p=0,001), respectivamente, y mayor eliminación de sodio. Sin embargo, el estudio CARRES-HF105, AVOID-HF107 y CUORE108 no demostraron diferencias significativas en cuanto al peso (el AVOID-HF sí en cuanto a pérdida de líquido). Estos datos son interesantes, dado que hay una relación entre la congestión y el fallo cardíaco111.
- Rehospitalizaciones/morbimortalidad
La UF no ha demostrado beneficios, en cuanto a mortalidad, frente a diuréticos109,110; sí en rehospitalizaciones con menor incidencia109. El estudio UNLOAD104 y el AVOID-HF107 mostraban tasas de rehospitalización significativas menores a los 30 días con la UF; en el caso del AVOID no a los 90 días107. El estudio CUORE108 sí mostraba menor tasas de rehospitalizaciones al año en el brazo de la UF. Sin embargo, el estudio de Bartone y col.112 o el CARRESS-HF105 no mostraban diferencias. La estancia media suele ser más larga con la UF109.
- Activación neurohormonal y parámetros de función cardíaca/hemodinámica
A diferencia de los diuréticos, apenas hay datos sobre activación neurohormonal con UF46. Algunos estudios parámetros como aldosterona y el SRAA106,113,114. Esta inhibición se acompañaría de mejor perfusión renal115. El estudio ULTRADISCO106 valoró parámetros de funcionalidad cardíaca en pacientes con FEVI deprimida con mejoría del índice de volumen sistólico y cardíaco; y GC con la UF frente al tratamiento diurético. Tampoco se produjeron alteraciones en la prensión arterial sistólica, diastólica o media frente al descenso que provocaba el tratamiento diurético106. Por último, los estudios coinciden en que el uso de diuréticos, y especialmente de la UF, descienden los niveles de PNs104,106,107.
- Hipotensión
No hay diferencias entre el tratamiento diuréticos y la UF103,104,106,107; pero en los estudios se solía desechar al paciente inestable o con inótropos. Ningún estudio se planteó la necesidad de terapia más continua, con tasas de UF más bajas que sesiones intermitentes con mayores tasas de UF que podrían perjudicar la hemodinamia en pacientes con patología cardíaca, y frecuentemente renal, con tendencia a la inestabilidad; evento evitable con la terapia más continua de UF116,117.
- Función renal
La UF puede provocar un descenso del VCE si las tasas de UF son elevadas y hay mal refilling del espacio intersticial al intravascular conllevando alteraciones hemodinámicas a nivel renal; se aconseja realización de BIA. En general, los estudios arrojan un efecto neutro en el brazo de la UF frente al tratamiento diurético109,110; el estudio UNLOAD104 no demostró diferencias de creatinina o urea entre ambas ramas de tratamiento aunque el subanálisis de Rogers y col.118, con un diseño similar al del UNLOAD, no mostró diferencias en el flujo renal o el FG entre grupos. Similares resultados obtuvo el AVOID-HF107 o el estudio de Hanna119 y col. Sin embargo, el estudio CARRESS-HF105 mostró un empeoramiento significativo de la función renal en el brazo de la UF a las 96 horas. No obstante, en este estudio todos los pacientes presentaban inicialmente una función renal deteriorada; cabría preguntarse si estos enfermos se hubiesen beneficiado de otro tipo de técnicas que asociaran el aclaramiento convectivo y difusivo. A su vez, el brazo de la UF no estaba protocolizado y mantenía unas tasas fijas de UF, que podrían no permitir un adecuado refilling y el uso de inótropos, en el caso de inestabilidad hemodinámica, estaba prohibido, a diferencia del brazo diurético, que sí estaba permitido105. Otros estudios demuestran mejoría de la función renal120 o estabilidad frente al diurético como el estudio CUORE108. Los meta-análisis no llegan a conclusiones claras dado que los estudios difieren en demasía en cuanto a la definición de fallo renal, usan diferentes tiempos en su medición y algunos usan el aclaramiento de creatinina frente a la propia creatinina109,110,121.
-Pacientes con FEVI conservada vs FEVI deprimida
En la mayoría de los estudios presentados, los pacientes presentaban FEVI deprimida. Jeffries y col.122 sí compararon la terapia con UF en pacientes con tasa de FEVI reducida o conservada. Los pacientes con FEVI conservada tenían menor tasas de mortalidad (p=0,088). Tal vez en este grupo, la UF podría ser más ventajosa.
-Alteraciones hidroelectrolíticas
La UF presentaría un perfil más amable que los diuréticos en este sentido104; pero hay estudios que no demuestran diferencias103.
-Coste123
La UF es más costosa, precisa de unidades y maquinaria especializada y la colaboración entre especialistas (cardiólogos-nefrólogos-intensivistas). Si hubiese una tendencia real al descenso en las rehospitalizaciones sería un ahorro económico.
- Diálisis peritoneal en el SCR124-127
Hay evidencia de mejoría clínica, clase funcional y menores reingresos en pacientes con IC refractaria sometidos a 1-4 intercambios/día (independientemente de su función renal). Además la DP preserva más adecuadamente la función renal residual. En la eliminación de sodio se indican las soluciones con sodio bajo128 (125 mmol/L) y, en el caso de uso de cicladoras, disminuir el número de intercambios nocturnos alargando permanencias. El uso de DP podría estar indicado inclusive en casos de SCR tipo 1 como ha demostrado el pequeño estudio de Ponce129 y col. Sin embargo muchos de los estudios en DP y congestión en IC tienen limitaciones: ausencia de grupo control, seguimientos cortos entre otros.
La UF como pilar del tratamiento congestivo dista mucho de ser una realidad, quedando relegada a una recomendación IIb en las Guías Europeas de Cardiología y si hay deterioro de función renal IIa38. Una revisión minuciosa de los estudios nos plantean dudas sobre el diseño de los mismos: cohortes pequeñas, diseño estadístico tergiversado (ej. el AVOID se diseñó para aproximadamente 10.000 pacientes siendo sólo 100 por rama), en algunos de ellos la rama del tratamiento diurético está protocolizada, pudiendo inclusive añadir diferentes diuréticos en dependencia de la respuesta diurética y, sin embargo, el brazo de la UF es menos flexible, en ninguno de los estudios se ha realizado BIA que puede ayudar en la elección de la tasa de UF y uso de coloides o diuréticos, la definición de RD es diferente en cada estudio, etc. La aplicación de métodos de medida de congestión como la BIA o el diámetro de la vena cava inferior podrían mejorar estos estudios y su relación con la pérdida de peso, valorando el refilling y pudiendo adaptar el tratamiento. Tampoco se ha valorado, en los diferentes estudios, la implantación de aclaramiento convectivo o difusivo si se precisara en el brazo de la UF, especialmente, en pacientes con fallo renal establecido; este punto cobra interés dado que los estudios valoraban, mayoritariamente, la función renal según creatinina y no FG, poniendo el punto de corte en creatinina >3 mg/dL como criterio de exclusión, pero en algunos pacientes ese rango puede indicar una FG muy baja, precisando el aclaramiento difusivo y convectivo simultáneo y no sólo la UF130-132. En este sentido, podría teorizarse que los datos hubiesen sido más favorables cara a parámetros clínicos o inflamación (no medidos) en los pacientes sometidos a la técnica extracorpórea como se ha demostrado en estudios de fallo renal130-131. Por último, rara vez los estudios comparan FEVI deprimida con conservada. Como retos futuros sería interesante comparar resultados de UF + diuréticos como lo hizo el estudio CUORE108. La DP podría estar indicada en pacientes más estables.
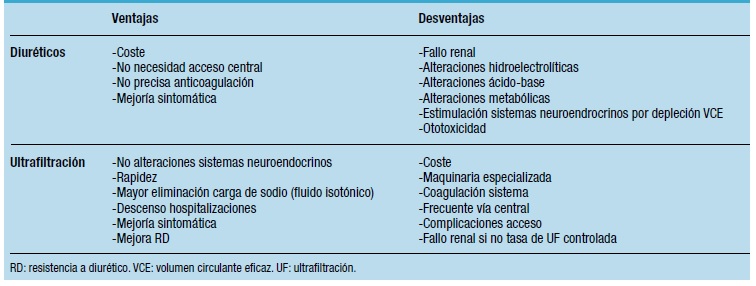
En definitiva, la UF y la DP aislada deberían ser consideradas una opción terapéutica complementaria y no alternativa al tratamiento con diuréticos en pacientes con IC refractaria en el caso de RD (Tabla 4; ventajas y desventajas de UF y diuréticos). Permite una mayor eliminación de sodio y agua, con una mejoría hemodinámica en pacientes con IC y, al parecer, preservación de la función renal. Una colaboración más afín entre cardiólogos, nefrólogos e intensivistas podrían mejorar los resultados de la UF.
Tabla 4. Ventajas y desventajas de diuréticos y ultrafiltración
Conclusiones
El SCR es una entidad compleja y de difícil manejo que implica un conocimiento de diferentes mecanismos neuroendocrinos que implican repercusiones tanto a nivel renal como cardíaco. En la fase aguda es prioritario solucionar la clínica congestiva donde el pilar sigue siendo el tratamiento diurético, el cual se ve limitado dada la creciente tasa de RD que presentan estos pacientes, por lo que debemos incluir nuevas terapias y soluciones para solventarla. Técnicas como la UF o la DP son prometedoras, pero han de ser vistas como un tratamiento complementario no alternativo al diurético en la actualidad. Una aproximación entre cardiólogos, nefrólogos e intensivistas parece crucial para una mejora asistencial en el paciente cardio-renal.
Los puntos claves son:
- El síndrome cardio-renal engloba una serie de alteraciones hemodinámicas con repercusión renal, cardíaca y sistémica.
- El síntoma por excelencia es la congestión.
- El tratamiento base del estado congestivo es el uso de diuréticos.
- La resistencia a diuréticos es creciente, por lo tanto se han de buscar nuevas alternativas al uso de diuréticos y la forma de combatirla.
- La UF y la DP se podrían considerar técnicas complementarias al uso de diuréticos.
- La adición de técnica difusiva y convectiva debería ser valorada según el grado de disfunción renal en mayor o menor medida.
- La colaboración entre distintas especialidades médicas es esencial en el SCR.
Recursos financieros
Los autores no recibieron ningún apoyo económico para la investigación.
Conflicto de intereses
Los autores declararon no tener conflicto de intereses.
1. Heidenreich P, Albert N, Allen L, Bluemke D, Butler J, Fonarow G, et al. Forecasting the impact of heart failure in the United States: a policy statement from the American Heart Association. Circ Heart Fail 2013;6(3):606-619. [ Links ]
2. Adams K, Fonarow G, Emerman C, LeJemtel TH, Costanzo MR, Abraham WT, et al. Characteristics and outcomes of patients hospitalized for heart failure in the United States: rationale, design and preliminary observations from the first 100.000 cases in the acute decompensated heart failure National registry. Am Heart J 2005;149:209-216. [ Links ]
3. Anguita M, García-Crespo M, de Teresa M, Jiménez M, Alonso- Pulpón L, Muñiz J. Prevalencia de la insuficiencia cardíaca en la población general española mayor de 45 años. Estudio PRICE. Rev Esp Cardiol 2008;61:1041-1049. [ Links ]
4. Damman K, Valente M, Voors A, O´Connor C, van Veldhuisen D, Hillege H. Renal impairment, worsening renal function, and outcome in patients with heart failure: an updated meta-analysis. Eur Heart J 2014;35:455-469. [ Links ]
5. McAlister F, Ezekowitz J, Tonelli M, Armstrong PW. Renal insufficiency and heart failure: prognostic and therapeutic implications from a prospective cohort study. Circulation 2004;109(8):1004-1009. [ Links ]
6. Ronco C, Haapio M, House AA, Anavekar N, Bellomo R. Cardiorenal Syndrome. J Am Coll Cardiol 2008;52:1527-1539. [ Links ]
7. Bongartz L, Cramer M, Doevendans P, Joles JA, Braam B. The severe cardiorenal syndrome: ’Guyton revisited’. Eur Heart J 2005;2(1):11-17.
8. Ellison D, Felker M. Diuretic treatment in heart failure. N Engl J Med 2017;377:1964-1975. [ Links ]
9. Felker GM, Lee K, Bull D, Redfield M, Stevenson L, Goldsmith S, et al. Diuretic Strategies in Patients with Acute Decompensated Heart Failure. N Engl J Med 2011;364: 797- 805. [ Links ]
10. Huang X, Dorhout Mees E, Vos P, Hamza S, Braam B. Everything we always wanted to know about furosemide but were afraid to ask. Am J Physiol Renal Physiol 2016;310: F958-F971. [ Links ]
11. Neuberg G, Miller A, O’Connor CM, Van Veldhuisen DJ, Massie BM, O’Connor CM, et al. Diuretic resistance predicts mortality in patients with advanced heart failure. Am Heart J 2002;144(1):31-38.
12. Singh D, Shrestha K, Testani JM, Verbrugge FH, Dupont M, Mullens W, et al. Insufficient natriuretic response to continuous intravenous furosemide is associated with poor long-term outcomes in acute decompensated heart failure. J Card Fail 2014;20: 392-399. [ Links ]
13 Rao V, Planavsky N, Hanberg J, Ahmad T, Brisco-Bacik M, Wilson F, et al. Compensatory Distal Reabsorption Drives Diuretic Resistance in Human Heart Failure. J Am Soc Nephro 2017;l28:3414-3424. [ Links ]
14. Hoorn E, Ellison D. Diuretic Resistance. Am J Kidney Dis 2016;69(1):136-142. [ Links ]
15. Premuzic V, Basic-Jukic N, Jelakovic B, Kes P. Continuous Veno-Venous Hemofiltration Improves Survival of Patients With Congestive Heart Failure and Cardiorenal Syndrome Compared to Slow Continuous Ultrafiltration. Ther Apher Dial 2017;21(3):279-286. [ Links ]
16. Sánchez E, Rodríguez C, Ortega T, Díaz-Molina B, García- Cueto C. Tratamiento de la sobrecarga de volumen en IC refractaria. Insuf Card 2011;6(1):19-26. [ Links ]
17. Lu R, Mucino-Bermejo MJ, Ribeiro LC, Tonini E, Estremadoyro C, Samoni S, et al. Peritoneal dialysis in patients with refractory congestive heart failure: a systematic review. Cardiorenal Med 2015;5(2):145-156. [ Links ]
18. Ponce D, Góes C, Oliveira M, Balbi A. Peritoneal Dialysis for the Treatment of Cardiorenal Syndrome Type 1: A Prospective Brazilian Study. Perit Dial Int 2017;37(5): 578-583. [ Links ]
19. Hatamizadeh P, Fonarow GC, Budoff MJ, Darabian S, Kovesdy CP, Kalantar-Zadeh K. Cardiorenal syndrome: pathophysiology and potential targets for clinical management. Nat Rev Nephrol 2013;9(2):99-111. [ Links ]
20. Blankstein R, Bakris GL. Renal hemodynamic changes in heart failure. Heart Fail Clin 2008;4:411-423. [ Links ]
21. Schrier RW, Abraham WT. Hormones and hemodynamics in heart failure. N Engl J Med 1999;341:577-578. [ Links ]
22. Egom EE, Feridooni T, Hotchkiss A, Kruzliak P, Pasumarthi KB. Mechanisms of renal hyporesponsiveness to BNP in heart failure. Can J Physiol Pharmacol 2015;93:399-403. [ Links ]
23. Mullens W, Abrahams Z, Francis GS, Sokos G, Taylor D, MD FACC, Starling RC, et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure. J Am Coll Cardiol 2009;53(7):589-596. [ Links ]
24. Winton F. The influence of venous pressure on the isolated mammalian kidney. J. Physiol 1931;72:49-61. [ Links ]
25. Verbrugge FH, Dupont M, Steels P, Grieten L, Malbrain M, Tang WH, et al. Abdominal contributions to cardiorenal dysfunction in congestive heart failure. J Am Coll Cardiol 2013;62(6):485- 495. [ Links ]
26. Kazory A, Elkayam U. Cardiorenal interactions in acute decompensated heart failure: contemporary concepts facing emerging controversies. J Card Fail 2014;20(12):1004-1011. [ Links ]
27. Metra M, Cotter G, Gheorghiade M, Dei Cas L, Voors AA. The role of the kidney in heart failure. Eur Heart J 2012;33:2135- 2142. [ Links ]
28. Kociol RD, Greiner MA, Hammill BG, Phatak H, Fonarow GC, Curtis LH, et al. Long-term outcomes of medicare beneficiaries with worsening renal function during hospitalization for heart failure. Am J Cardiol 2010;105(12):1786-1793. [ Links ]
29. Testani JM, Chen J, McCauley BD, Kimmel SE, Shannon RP. Potential effects of aggressive decongestion during the treatment of decompensated heart failure on renal function and survival. Circulation 2010;122:265-72. [ Links ]
30. Metra M, Davison B, Bettari L, Sun H, Edwards C, Lazzarini V, et al. Is worsening renal function an ominous prognostic sign in patients with acute heart failure? The role of congestion and its interaction with renal function. Circ Heart Fail 2012;5:54-62. [ Links ]
31. Testani JM, McCauley BD, Kimmel SE, Shannon RP. Characteristics of patients with improvement or worsening in renal function during treatment of acute decompensated heart failure. Am J Cardiol 2010;106(12):1763-1769. [ Links ]
32. Heywood JT, Fonarow GC, Costanzo MR, Mathur VS, Wigneswaran JR, Wynne J. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: A report from the ADHERE database. J Card Fail 2007;13:422-430. [ Links ]
33. Gheorghiade M, Filippatos G. Reassessing treatment of acute heart failure syndromes: The ADHERE Registry. Eur Heart J 2005;7(Suppl B):B13-B19. [ Links ]
34. Nohria A, Hasselblad V, Stebbins A, Pauly DF, Fonarow GC; Shah M, et al. Cardiorenal interactions: Insights from the ESCAPE trial. J Am Coll Cardiol 2008;51: 1268-1274. [ Links ]
35. Damman K, van Deursen VM, Navis G, Voors AA, van Veldhuisen DJ, Hilleg HL. Increased central venous pressure is associated with impaired renal function and mortality in a broad spectrum of patients with cardiovascular disease. J Am Coll Cardiol 2009;53: 582-588. [ Links ]
36. Butler J, Forman D, Abraham W, Gottlieb SS, Loh E, Massie BM, et al. Relationship between heart failure treatment and development of worsening renal function among hospitalized patients. Am Heart J 2004;147(2):331-338. [ Links ]
37. Echazarreta DF. Insuficiencia cardíaca y síndrome cardio-renal. Insuf Card 2010;5(2):92-96. [ Links ]
38. Ponikowski P, Voors AA, Anker SD, Cleland J, Coats AJ, Falk V, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC) developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J 2016;37:2129-2200. [ Links ]
39. Obi Y, Kim T, Kovesdy CP, Amin A, Kalantar-Zadeh K. Current and Potential Therapeutic Strategies for Hemodynamic Cardiorenal Syndrome. Cardiorenal Med 2016;6:83-98. [ Links ]
40. Aliti GB, Rabelo ER, Clausell N, Rohde LE, Biolo A, Beckda- Silva L. Aggressive fluid and sodium restriction in acute decompensated heart failure: a randomized clinical trial. JAMA Intern Med 2013;173:1058-1064. [ Links ]
41. Smyth A, O’Donnell MJ, Yusuf S, Clase CM, Teo KK, Canavan M , et al. Sodium intake and renal outcomes: a systematic review. Am J Hypertens 2014;27:1277-1284.
42. Brater DC. Diuretic therapy. N Engl J Med 1998;339:387-395. [ Links ]
43. Huang X, Dorhout Mees E, Vos P, Hamza S, Braam B. Everything we always wanted to know about furosemide but were afraid to ask. Am J Physiol Renal Physiol 2016;310: F958-F971. [ Links ]
44. Freda BJ, Slawsky M, Mallidi J, Braden GL. Decongestive treatment of acute decompensated heart failure: Cardiorenal implications of ultrafiltration and diuretics. Am J Kidney Dis 2011;58:1005-1017. [ Links ]
45. Alvarez MS. Digital y diuréticos en el tratamiento de la insuficiencia cardíaca crónica. Insuf Card 2009;4(4):161-167. [ Links ]
46. Francis GS, Siegel RM, Goldsmith SR, Olivari MT, Levine TB, Cohn JN. Acute vasoconstrictor response to intravenous furosemide in patients with chronic congestive heart failure. Activation of the neurohumoral axis. Ann Intern Med 1985;103:1-6. [ Links ]
47. Ellison DH. Diretic resistance: physiology and therapeutics. Semin Nephrol 1999; 19(6):581-597. [ Links ]
48. Brisco MA, Zile MR, Hanberg JS, Wilson FP, Parikh CR, Coca SG, et al. Relevance of changes in serum creatinine during a heart failure trial of decongestive strategies: insights from the DOSE Trial. J Card Fail 2016;22:753-60. [ Links ]
49. Wu MY, Chang NC, Su CL,, Hsu YH, Chen TW, Lin YF, et al: Loop diuretic strategies in patients with acute decompensated heart failure: a meta-analysis of randomized controlled trials. J Crit Care 2014;29:2-9. [ Links ]
50. Schnermann J. Juxtaglomerular cell complex in the regulation of renal salt excretion. Am J Physiol 1998;274:63-79. [ Links ]
51. Zahedi K, Barone S, Xu J, Soleimani M. Potentiation of the effect of thiazide derivatives by carbonic anhydrase inhibitors: molecular mechanisms and potential clinical implications. PLoS One 2013;8:e79327. [ Links ]
52. Morales E, Huerta A, Gutiérrez E, Gutiérrez-Solis E, Segura J, Praga Ma. Efecto antiproteinúrico del bloqueo del sistema renina-angiotensina-aldosterona (SRAA) en los pacientes obesos. ¿Cuál es la opción terapéutica más eficaz? Nefrología 2009;29(5):421-429. [ Links ]
53. Testani J, Brisco M, Turner J. Loop diuretic efficiency a metric of diuretic responsiveness with prognostic importance in acute decompensated heart failure. Circ Heart Fail 2014;7:261-270. [ Links ]
54. Verbrugge FH, Mullens W. Management of Cardio-Renal syndrome and diuretic resistance. Curr Treat Options Cardio Med 2016; 18:11. [ Links ]
55. Ter Maaten JM, Valente MA, Damman K, Hillege HL, Navis F, Voors AA. Diuretic response in acute heart failurepathophysiology, evaluation, and therapy. Nat Rev Cardiol 2015;12:184-192. [ Links ]
56. Verbrugge FH, Dupont M, Bertrand PB, Nijst P, Penders J, Dens J, et al. Determinants and impact of the natriuretic response to diuretic therapy in heart failure with reduced ejection fraction and volume overload. Acta Cardiol 2015;70:265-273. [ Links ]
57. Liu PP. Cardiorenal syndrome in heart failure: A cardiologist’s perspective. Can J Cardiol 2008;24(1B);25B-29B.
58. Reilly RF, Ellison DH. Mammalian distal tubule: Physiology, pathophysiology, and molecular anatomy. Physiol Rev 2000;80:277-313. [ Links ]
59. Wilcox CS, Mitch WE, Kelly RA, Skorecki K, Meyer TW, Friedman PA, et al. Response of the kidney to furosemide. Effects of salt intake and renal compensation. J Lab Clin Med 1983;102:450-458. [ Links ]
60. Kaissling B, Stanton BA. Adaptation of distal tubule and collecting duct to increased sodium delivery. I. Ultrastructure. Am J Physiol 1988;255:F1256-F1268. [ Links ]
61. Rao VS, Planavsky N, Hanberg JS, Ahmad T, Brisco-Bacik MA, Wilson FP, et al. Compensatory distal reabsorption drives diuretic resistance in human heart failure. J Am Soc Nephrol 2017;28:3414-3424. [ Links ]
62. Paterna S, Di Pasquale P, Parrinello G, Amato P, Cardinale A, Follone G, et al. Effects of high-dose furosemide and smallvolume hypertonic saline solution infusion in comparison with a high dose of furosemide as a bolus, in refractory congestive heart failure. Eur J Heart Fail 2000;2:305-313. [ Links ]
63. Paterna S, Parrinello G, Amato P. Tolerability and efficacy of high-dose furosemide and small-volume hypertonic saline solution in refractory congestive heart failure. Adv Ther 1999;16(5):219-228. [ Links ]
64. Kaissling B, Bachmann S, Kriz W. Structural adaptation of the distal convoluted tubule to prolonged furosemide treatment. Am J Physiol 1985;248:F374-F381. [ Links ]
65. Abdallah JG, Schrier RW, Edelstein C, Jennings SD, Wyse B, Ellison DH. Loop diuretic infusion increases thiazide-sensitive Na(+)/Cl (-) cotransporter abundance: Role of aldosterone. J Am Soc Nephrol 2001;12:1335-1341. [ Links ]
66. Ter Maaten JM, Rao VS, Hanberg JS, Perry Wilson F, Bellumkonda L, Assefa M, et al. Renal tubular resistance is the primary driver for loop diuretic resistance in acute heart failure. Eur J Heart Fail 2017;19:1014-1022. [ Links ]
67. Ellison DH, Velázquez H, Wright FS. Adaptation of the distal convoluted tubule of the rat: structural and functional effects of dietary salt intake and chronic diuretic infusion. J Clin Invest 1989;83:113-126. [ Links ]
68. Terker AS, Zhang C, Erspamer KJ, Gamba G, Yang CL, Ellison DH. Unique chloride-sensing properties of WNK4 permit the distal nephron to modulate potassium homeostasis. Kidney Int 2016;89:127-134. [ Links ]
69. Terker AS, Zhang C, McCormick JA, Lazelle RA, Zhang C, Meermeier NP. Potassium modulates electrolyte balance and blood pressure through effects on distal cell voltage and chloride. Cell Metab 2015;21:39-50. [ Links ]
70. Dorhout Mees EJ, Beutler JJ, Boer WH, Koomans HA. Does lithium clearance reflect distal delivery in humans? Analysis with furosemide infusion. Am J Physiol 1990;258: F1100-F1104. [ Links ]
71. Zheng H, Liu X, Sharma NM, Li Y, Pliquett RU, Patel KP. Urinary proteolytic activation of renal epithelial Na+ channels in chronic heart failure. Hypertension 2016; 67:197-205. [ Links ]
72. Oster JR, Epstein M, Smoller S. Combined therapy with thiazide-type and loop diuretic agents for resistant sodium retention. Ann Intern Med 1983;99:405-406. [ Links ]
73. De Bruyne. Mechanisms and management of diuretic resistance in congestive heart failure. Postgrad Med J 2003;79: 268-271. [ Links ]
74. Knauf H, Mutschler E. Sequential nephron blockade breaks resistance to diuretics in edematous states. J Cardiovasc Pharmacol 1997;29:367-372. [ Links ]
75. de Teresa E. Tratamiento diurético de la insuficiencia cardíaca. Rev Esp Cardiol Supl 2007;7(F):34-44. [ Links ]
76. Myburgh JA, Mythen MG. Resuscitation Fluids. N Engl J Med 2013;369(13):1243-1251. [ Links ]
77. Davison D, Basu R, Goldstein SL, Chawla LS. Fluid management in adults and children: Core Curriculum 2014. Am J Kidney Dis 2014;63(4):700-712. [ Links ]
78. Parrinello G, Paterna S, Di Pasquale P, Torres D, Fatta A, Mezzero M, et al. The usefulness of bioelectrical impedance analysis in differentiating dyspnea due to decompensated heart failure. J Card Fail 2008;14:676-686. [ Links ]
79. Sergy G, Bussolotto M, Perini P, Calliari I, Giantin V, Ceccon A, et al. Accuracy of bioelectrical impedance analysis in estimation of extracellular space in healthy subjects and in fluid retention states. Ann Nutr Metab 1994;38:158-165. [ Links ]
80. Kirchner KA, Voelker JR, Brater DC. Intratubular albumin blunts the response to furosemide-A mechanism for diuretic resistance in the nephrotic syndrome. J Pharmacol Exp Ther 1990;252:1097-1101. [ Links ]
81. Hammarlund MM, Paalzow LK, Odlind B. Pharmacokinetics of furosemide in man after intravenous and oral administration: application of moment analysis. Eur J Clin Pharmacol 1984;26:197-207. [ Links ]
82. Loon NR, Wilcox CS. Mild metabolic alkalosis impairs the natriuretic response to bumetanide in normal human subjects. Clin Sci (Lond) 1998;4:287-292. [ Links ]
83. Caramelo C, Albalate M, Baldoví S, Tejedor A, Alcázar R, García-Pérez A, et al. Vigencia de la acetazolamida en la terapéutica diurética actual: aplicaciones en el edema refractario y la hiperpotasemia relacionada al bloqueo aldosterónico. Nefrología 2008; 28(2):234-238. [ Links ]
84. Verbrugge FH, Nijst P, Dupont M, et al. Urinary composition during decongestive treatment in heart failure with reduced ejection fraction. Circ Heart Fail 2014;7:766-772. [ Links ]
85. SOLVD Investigators, Yusuf S, Pitt B, Davis CE, Hood WB, Cohn JN. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1992;325:293-302. [ Links ]
86. Mehdi UF, Adams-Huet B, Raskin P, Vega GL, Toto RD. Addition of angiotensin receptor blockade or mineralocorticoid antagonism to maximal angiotensin-converting enzyme inhibition in diabetic nephropathy. J Am Soc Nephrol 2009;20:2641-2650. [ Links ]
87. Mizobuchi M, Morrisey J, Finch JL, Martin DR, Liapis H, Akizawa T, et al. Combination therapy with an angiotensinconverting enzyme inhibitor and a vitamin D analog suppresses the progression of renal insufficiency in uremic rats. J Am Soc Nephrol 2007;18:1796-1806. [ Links ]
88. King J, Bress A, Reese A, Munger MA. Neprilysin inhibition in heart failure with reduced ejection fraction: a clinical review. Pharmacother J Hum Pharmacol Drug Ther 2015;35:823-837. [ Links ]
89. Mangiafico S, Costello-Boerrigter LC, Andersen IA, Cataliotti A, Burnett JC Jr.. Neutral endopeptidase inhibition and the natriuretic peptide system: an evolving strategy in cardiovascular therapeutics. Eur Heart J 2013;34:886-893. [ Links ]
90. McMurray J, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014; 371:993-1004. [ Links ]
91. Konstam MA, Gheorghiade M, Burnett JC Jr, Grinfeld L, Maggioni AP, Swedberg K, et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007;297(12):1319-1331. [ Links ]
92. O’Connor C, Starling R, Hernandez A, Armstrong PW, Dickstein K, Hasselblad V, et al. Effect of Nesiritide in Patients with Acute Decompensated Heart Failure. N Engl J Med 2011;365:32-43.
93. Dschietzig T, Teichman S, Unemori E, Wood S, Boehmer J, Richter C, et al. Intravenous recombinant human relaxin in compensated heart failure: a safety, tolerability, and pharmacodynamic trial. J Card Fail 2009;15(1):182-190. [ Links ]
94. Gottliebs SS, Skettino SL, Wolff A, Beckman E, Fisher ML, Freudenberger R, et al. Effect of BG9719 (CVT-124), an A1- adenosine receptor antagonist, and furosemide on glomerular filtration rate and natriuresis in patients with congestive heart failure. J Am Coll Cardiol 2000;35:56-59. [ Links ]
95. Pourafshar N, Karimi A, Kazory A. Extracorporeal ultrafiltration therapy for acute decompensated heart failure. Expert Rev Cardiovasc Ther 2016;14(1):5-13. [ Links ]
96. Mittal MK, Katta N, Alpert MA. Role of isolated ultrafiltration in the management of chronic refractory and acute decompensated heart failure. Hemodial Int 2016;20:S30-S39. [ Links ]
97. Costanzo MR, Ronco C. Isolated ultrafiltration in heart failure patients. Curr Cardiol Rep 2012;14(3):254-264. [ Links ]
98. Guazzi MD, Agostoni P, Perego B, Lauri G, Salvioni A, Giraldi F, et al. Apparent paradox of neurohumoral axis inhibition after body fluid volume depletion in patients with chronic congestive heart failure and water retention. Br Heart J 1994;72(6):534-539. [ Links ]
99. Agostoni PG, Marenzi GC, Pepi M, Doria E, Salvioni A, Perego G, et al. Isolated ultrafiltration in moderate congestive heart failure. J Am Coll Cardiol 1993;21(2):424-431. [ Links ]
100. Jaski BE, Romeo A, Ortiz B, Hoagland PM, Stone M, Glaser D, et al. Outcomes of volume-overloaded cardiovascular patients treated with ultrafiltration. J Card Fail 2008; 14:515-520. [ Links ]
101. Dev S, Shirolkar SC, Stevens SR, Shaw LK, Adams PA, Felker GM, et al. Reduction in body weight but worsening renal function with late ultrafiltration for treatment of acute decompensated heart failure. Cardiology 2012;123:145-153. [ Links ]
102. Patarroyo M, Wehbe E, Hanna M, Taylor DO, Starling RC, Demirjian S, et al. Cardiorenal outcomes after slow continuous ultrafiltration therapy in refractory patients with advanced decompensated heart failure. J Am Coll Cardiol 2012;60:1906- 1912. [ Links ]
103. Bart BA, Boyle A, Bank AJ, Anand I, Olivari MT, Kraemer M, et al. Ultrafiltration versus usual care for hospitalized patients with heart failure: the Relief for Acutely Fluid-Overloaded Patients With Decompensated Congestive Heart Failure (RAPID-CHF) trial. J Am Coll Cardiol 2005;46(11):2043- 2046. [ Links ]
104. Costanzo MR, Guglin ME, Saltzberg MT, Jessup ML, Bart BA, Teerlink JR, et al. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J Am Coll Cardiol 2007;49(6):675-683. [ Links ]
105. Bart BA, Goldsmith SR, Lee KL, Givertz MM, O’Connor CM, Bull DA, et al. Ultrafiltration in decompensated heart failure with cardiorenal syndrome. N Engl J Med 2012;367(24):2296- 2304.
106. Giglioli C, Landi D, Cecchi E, Chiostri M, Gensini GF, Valente S, et al. Effects of ULTRAfiltration vs. DIureticS on clinical, biohumoral and haemodynamic variables in patients with deCOmpensated heart failure: the ULTRADISCO study. Eur J Heart Fail 2011;13(3):337-46. [ Links ]
107. Costanzo MR, Negoianu D, Fonarow GC, Jaski BE, Bart BA, Heywood JT, et al. Rationale and design of the Aquapheresis Versus Intravenous Diuretics and Hospitalization for Heart Failure (AVOID-HF) trial. Am Heart J 2015;170(3):471-482. [ Links ]
108. Marenzi G, Muratori M, Cosentino ER, Rinaldi ER, Donghi V, Milazzo V, et al. Continuous ultrafiltration for congestive heart failure: The CUORE trial. J Card Fail 2014;20:9-17. [ Links ]
109. Kwok CS, Wong CH, Rushton C, Ahmed F, Cunnington C, Davies SJ, et al. Ultrafiltration for acute decompensated cardiac failure: A systematic review and meta-analysis. Int J Cardiol 2017;228:122-128. [ Links ]
110. Jain A, Agrawal N, Kazory A. Defining the role of ultrafiltration therapy in acute heart failure: a systematic review and metaanalysis. Heart Fail Rev 2016;21(5):611-619. [ Links ]
111. Colombo PC, Onat D, Harxhi A, Demmer RT, Hayashi Y, Jelic S, et al. Peripheral venous congestion causes inflammation, neurohormonal, and endothelial cell activation. Eur Heart J 2014;35(7):448-454. [ Links ]
112. Bartone C, Saghir S, Menon SG, Brosmer J, Kereiakes DJ, Mazur W, et al. Comparison of ultrafiltration, nesiritide, and usual care in acute decompensated heart failure. Congest Heart Fail 2008;14(6):298-301. [ Links ]
113. Bart BA. Treatment of congestion in congestive heart failure: ultrafiltration is the only rational initial treatment of volume overload in decompensated heart failure. Circ Heart Fail 2009;2(5):499-504. [ Links ]
114. Marenzi G, Grazi S, Giraldi F, Lauri G, Perego G, Guazzi M, et al. Interrelation of humoral factors, hemodynamics, and fluid and salt metabolism in congestive heart failure: effects of extracorporeal ultrafiltration. Am J Med 1993;94(1):49-56. [ Links ]
115. Agostoni P, Marenzi G, Lauri G, Perego G, Schianni M, Sganzerla P, et al. Sustained improvement in functional capacity after removal of body fluid with isolated ultrafiltration in chronic cardiac insufficiency: failure of furosemide to provide the same result. Am J Med 1994;96(3):191-199. [ Links ]
116. Tolwani A. Continuous renal-replacement therapy for acute kidney injury. N Engl J Med 2012;367:2505-2514. [ Links ]
117. Lins RL, Elseviers MM, Van der Niepen P, Hoste E, Malbrain ML, Damas P, et al: Intermittent versus continuous renal replacement therapy for acute kidney injury patients admitted to the intensive care unit: results of a randomized clinical trial. Nephrol Dial Transplant 2009;24:512-518. [ Links ]
118. Rogers HL, Marshall J, Bock J, et al. A randomized, controlled trial of the renal effects of ultrafiltration as compared to furosemide in patients with acute decompensated heart failure. J Card Fail 2008;14:1-5. [ Links ]
119. Hanna MA, Tang WH, Teo BW, O’Neill JO, Weinstein DM, Lau SM, et al. Extracorporeal ultrafiltration vs. conventional diuretic therapy in advanced decompensated heart failure. Congest Heart Fail 2012;18:54-63.
120. Bart BA, Walsh MM, Blake D, Goldsmith SR. Ultrafiltration for cardiorenal syndrome. J Card Fail 2008;14(6):531-532. [ Links ]
121. Makki N, Maliske S, Blevins A, Girotra S, Cram P. The impact of ultrafiltration in acute decompensated heart failure: A systematic review and meta-analysis. IJC Metabolic Endocrine 2014;2:19-25. [ Links ]
122. Jefferies JL, Bartone C, Menon S, Egnaczyk GF, O’brien TM, Chung ES. Ultrafiltration in heart failure with preserved ejection fraction: Comparison with systolic heart failure patients. Circ Heart Fail 2013;6:733-739.
123. Bradley SM, Levy WC, Veenstra DL. Cost-consequences of ultrafiltration for acute heart failure: a decision model analysis. Circ Cardiovasc Qual Outcomes 2009;2(6):566-573. [ Links ]
124. Mehrotra R, Khanna R. Peritoneal ultrafiltration for chronic congestive heart failure: rationale, evidence and future. Cardiology 2001;96(3-4):177-182. [ Links ]
125. Gotloib, Fundin R, Yakubovich M, Vienken J. Peritoneal dialysis in refractory end stage congestive heart failure: a challenge facing a no-win situation. Nephrol Dial Transplant 2005;20(7):vii32-vii36.
126. Mehrotra R, Kathuria P. Place of peritoneal dialysis in the management of treatment-resistant congestive heart failure. Kidney Int 2006;70:S67-S71. [ Links ]
127. Sánchez E, Rodríguez C, Ortega T, Díaz-Molina B, García- Cueto C. Papel de la diálisis peritoneal en el tratamiento de la insuficiencia cardíaca. Insuf Card 2010;5(3):105-112. [ Links ]
128. Rutkowski B, Tam P, van der Sande FM, Vychytil A, Schwenger V, Himmele R, et al. Low-sodium versus standard-sodium peritoneal dialysis solution in hypertensive patients: A randomized controlled trial. Am J Kidney Dis 2016;67(5):753-761. [ Links ]
129. Ponce D, Góes C, Oliveira M, Balbi A. Peritoneal Dialysis for the Treatment of Cardiorenal Syndrome Type 1: A Prospective Brazilian Study. Perit Dial Int 2017;37(5): 578-583. [ Links ]
130. Saudan P, Niederberger M, De Seigneux S, Romand J, Pugin J, Perneger T, et al. Adding a dialysis dose to continuous hemofiltration increases survival in patients with acute renal failure. Kidney Int 2006;70(7):1312-1317. [ Links ]
131. Leskovar B, Furlan T, Poznič S, Potisek M, Adamlje A. Hemodialysis treatment of cardiorenal syndrome. Clinical Nephrology 2017;88:S57-S60. [ Links ]
132. Premuzic V, Basic-Jukic N, Jelakovic B, Kes P. Continuous venovenous hemofiltration improves survival of patients with congestive heart failure and cardiorenal syndrome compared to slow continuous ultrafiltration. Ther Apher Dial 2017;21(3): 279-286. [ Links ]














