Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Insuficiencia cardíaca
On-line version ISSN 1852-3862
Insuf. card. vol.14 no.1 Ciudad Autónoma de Buenos Aires Mar. 2019
CONSENSO DE ENFERMEDAD DE CHAGAS
Insuficiencia cardíaca en miocardiopatía chagásica crónica
Guillermo Cursack1, Griselda Maidana2, Carlos Manfredi3, Clara María Huerta4, Juan Pablo Címbaro Canella5, María Josefina Blanchet6, María Lorena Coronel7, Eduardo Perna8, Luis Aguinaga9, Cristian Núñez10, Moira Álvarez11, Juan Pablo Escalante12, María Cecilia Moris13, Daniela García Brasca14 y Lilia Luz Lobo Márquez15
1 Médico cardiólogo. Coordinador Unidad Coronaria. Sanatorio Esperanza. Esperanza. Santa Fe. República Argentina.
2 Médica cardióloga. Centro Modelo de Cardiología. San Miguel de Tucumán. Tucumán. República Argentina.
3 Médico cardiólogo. Clínica Yunes. Santiago del Estero. Santiago del Estero. República Argentina.
4 Médica cardióloga. Clínica Universitaria Reina Fabiola. Hospital Córdoba. Córdoba. República Argentina.
5 Médico cardiólogo. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
6 Médica cardióloga. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
7 Médica cardióloga. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
8 Médico cardiólogo. Jefe de División de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
9 Médico cardiólogo. Centro Integral de Arritmias. San Miguel de Tucumán. Tucumán. República Argentina.
10 Médico cardiólogo. Coordinador Unidad de Insuficiencia Cardíaca e Hipertensión pulmonar. CIMAC y Clínica El Castaño. San Juan. San Juan. República Argentina.
11 Médico cardiólogo. Coordinador Unidad de Insuficiencia Cardíaca e Hipertensión pulmonar. CIMAC y Clínica El Castaño. San Juan. San Juan. República Argentina.
12 Médico cardiólogo. Instituto Cardiovascular de Rosario. Rosario. Santa Fe. República Argentina.
13 Médica cardióloga. Servicio Cardiológico Sarmiento. Sanatorio Sarmiento. San Miguel de Tucumán. Tucumán. República Argentina.
14 Médica cardióloga. Instituto de Cardiología. Hospital Italiano de Córdoba. Córdoba. República Argentina.
15 Médica cardióloga. Jefe del Departamento de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología. San Miguel de Tucumán. Tucumán. República Argentina.
Institución: Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar de la Federación Argentina de Cardiología.
Correspondencia: Dr. Guillermo Cursack.
Email: gcursack@yahoo.com.ar
Recibido: 17/11/2018
Aceptado: 18/02/2019
Resumen
Acorde al último reporte epidemiológico de la Organización Mundial de la Salud del año 2015, en Argentina existen 1,5 millones de personas infectadas por el Trypanosoma cruzi y alrededor de 370.000 pacientes con distintas manifestaciones de la enfermedad de Chagas. El objetivo de esta revisión es analizar una de las manifestaciones clínicas más graves e invalidantes de esta enfermedad: la miocardiopatía chagásica crónica. Esta patología, que presenta una distribución geográfica dispar en la Argentina, comparte varias características comunes con otras formas etiológicas de insuficiencia cardíaca, aunque su epidemiología, presentación clínica y respuesta al tratamiento médico, eléctrico y quirúrgico le otorgan una distinción particular y en muchos casos, poco conocida.
Por tal motivo, existe en la comunidad médica, un creciente interés en alcanzar un mayor conocimiento de esta enfermedad a fin de implementar manejos y decisiones terapéuticas, que si bien demostraron beneficio en otras poblaciones de pacientes con insuficiencia cardíaca, aun no han sido adecuadamente avaladas para su aplicación en insuficiencia cardíaca chagásica. Muchas de las indicaciones e intervenciones se basan en experiencia más que evidencia científica.
Es por ello que esta revisión es un desafío oportuno para optimizar el tratamiento y pronóstico de esta población.
Palabras clave: Insuficiencia cardíaca; Enfermedad de Chagas; Cardiopatía chagásica; Miocardiopatía chagásica crónica
Summary
Heart failure in chronic chagasic cardiomyopathy
According to the last epidemiological report of the World Health Organization in 2015, in Argentina there are 1.5 million people infected with Trypanosoma cruzi and around 370,000 patients with different manifestations of Chagas disease. The objective of this review is to analyze one of the most serious and invalidating clinical manifestations of this disease: chronic chagasic myocardiopathy. This pathology, which has a disparate geographical distribution in Argentina, shares several common characteristics with other etiological forms of heart failure, although its epidemiology, clinical presentation and response to medical, electrical and surgical treatment give it a particular distinction and in many cases, little known.
For this reason, there is a growing interest in the medical community to achieve greater knowledge of this disease in order to implement management and therapeutic decisions, which although they have shown benefit in other populations of patients with heart failure, have not yet been adequately endorsed. for its application in chagasic heart failure. Many of the indications and interventions are based on experience rather than scientific evidence.
That is why this review is a timely challenge to optimize the treatment and prognosis of this population.
Keywords: Heart failure; Chagas disease; Chagasic heart disease; Chronic chagasic cardiomyopathy
Resumo
Insuficiência cardíaca na cardiomiopatia chagásica crônica
De acordo o último relatório epidemiológico da Organização Mundial da Saúde em 2015, na Argentina existem 1,5 milhão de pessoas infectadas pelo Trypanosoma cruzi e cerca de 370.000 pacientes com manifestações diferentes da doença de Chagas. O objetivo desta revisão é analisar uma das manifestações clínicas mais graves e invalidantes dessa doença: miocardiopatia chagásica crônica. Esta condição, que tem uma distribuição geográfica desigual na Argentina, compartilha várias características comuns com outras formas etiológicos de insuficiência cardíaca, embora sua epidemiologia, apresentação clínica e resposta ao tratamento médico, elétrico e cirúrgico dar uma distinção especial e, em muitos casos, pouco conhecido.
Portanto, há na comunidade médica, um crescente interesse na obtenção de uma melhor compreensão da doença, a fim de implementar as decisões de manejo e tratamento, que embora benefício mostrou em outras populações de pacientes com insuficiência cardíaca ainda não foram adequadamente apoiados para sua aplicação na insuficiência cardíaca chagásica. Muitas das indicações e intervenções são baseadas na experiência e não na evidência científica.
Este por isso que esta revisão é um desafio oportuno para otimizar o tratamento e o prognóstico dessa população.
Palavras-chave: Insuficiência cardíaca; Doença de Chagas; Cardiopatia chagásica; Cardiomiopatia chagásica crônica
4. Aporte de las imágenes cardíacas en pacientes con enfermedad de Chagas
Cristian Núñez, Moira Álvarez
Las diferentes modalidades de imágenes en cardiología, tales como la radiografía de tórax, ecocardiografía, medicina nuclear, tomografía computada, resonancia magnética cardíaca aportan información valiosa sobre la estructura y función cardíaca en la enfermedad de Chagas1.
Rol de la ecocardiografía
La ecocardiografía es una de las herramientas no invasivas diagnóstica más útiles para la evaluación de los pacientes con enfermedad de Chagas. La evaluación de la función ventricular es uno de los puntos clave del método, y aporta datos para orientar el tratamiento y definir el pronóstico2. En general, la evaluación ecocardiográfica debe ser realizada de acuerdo a las sugerencias de las Guías de Cuantificación de Cámaras de la Sociedad Americana de Ecocardiografía (ASE), con especial énfasis en la morfología y función de ambos ventrículos como la presencia de valvulopatias3.
Es razonable realizar al menos un ecocardiograma en todo paciente con serología positiva para la enfermedad y repetirlo si se detectan nuevos hallazgos anormales en el ECG para documentar progresión de la enfermedad4. Los hallazgos ecocardiográficos más frecuentes en los pacientes con esta enfermedad, incluyen alteraciones segmentarias de la motilidad parietal, lo que permite identificar a individuos con riesgo de empeoramiento progresivo de la función ventricular5. El aneurisma apical es una lesión típica en la enfermedad cardíaca por Chagas, con diferencias en la prevalencia según población estudiada y la herramienta diagnóstica empleada. Cabe destacar que el aneurisma también puede localizarse en la cara inferior e inferolateral (Figuras 1 y 2) y puede afectar a ambos ventrículos. La disfunción diastólica es otro hallazgo en pacientes con enfermedad de Chagas crónico que proporciona información clínica útil para la estratificación y el pronóstico6.
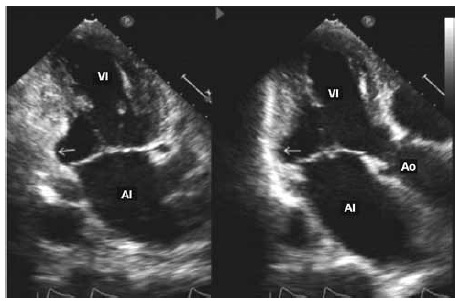
Figura 1. Aneurismas del ventrículo izquierdo en las paredes inferior e inferolateral (flechas). Vistas apicales de 2 y 3 cámaras. AI: aurícula izquierda. VI: ventrículo izquierdo. Ao: aorta.
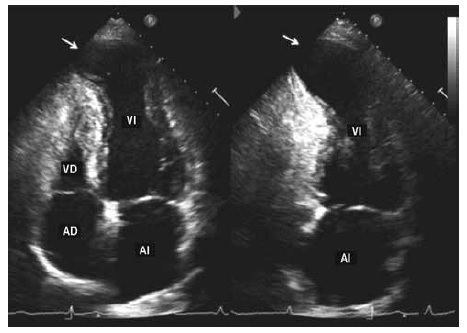
Figura 2. Aneurisma apical del ventrículo izquierdo (flechas). Vistas apicales de 4 y 2 cámaras. AD: aurícula derecha. AI: aurícula izquierda. VD: ventrículo derecho. VI: ventrículo izquierdo.
Clásicamente, el aneurisma apical se asocia a un sustrato arrítmico; sin embargo. este hallazgo no parece ser un factor predictivo independiente de mortalidad7,8. La mayor parte de los trombos del ventrículo izquierdo (VI) se producen en el aneurisma apical, las ventanas apical y subxifoidea son las más útiles para este análisis. También puede ser de utilidad obtener múltiples proyecciones, a menudo no convencionales o simplificadas, colocando el transductor con una ligera angulación para visualizar mejor el vértice cardíaco (Figura 3)7.
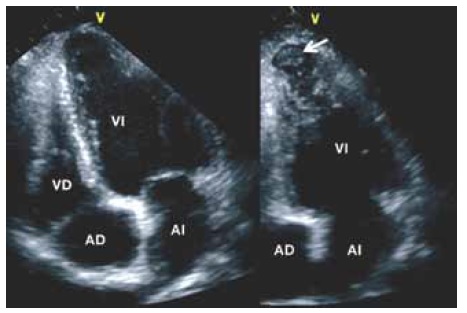
Figura 3. Ecocardiografía bidimensional transtorácica vista apical cuatro cámaras. Se observa pequeño aneurisma ventricular izquierdo (izquierda) y un trombo (flecha, derecha). Se emplean proyecciones no estándares con el objeto de explorar la totalidad del ápex ventricular izquierdo.
AD: aurícula derecha. AI: aurícula izquierda. VD: ventrículo derecho. VI: ventrículo izquierdo.
Los pacientes con IC avanzada por enfermedad cardíaca chagásica pueden frecuentemente presentar: dilatación e hipocinesia global del VI con baja fracción de eyección o dilatación biventricular7 (Figura 4). Recientemente se han introducido también nuevas técnicas ecocardiográficas, como el Doppler tisular, las técnicas de strain y strain rate y la ecocardiografía tridimensional, que permiten un abordaje morfológico y funcional del corazón de manera más exacta y reproducible3.
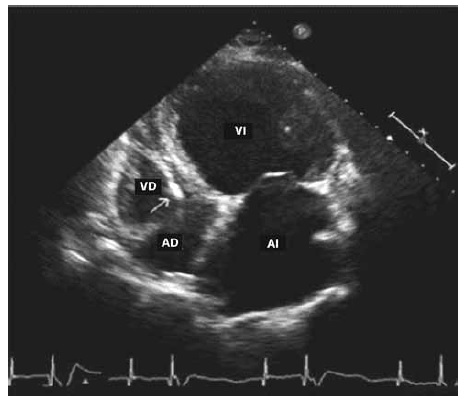
Figura 4. Ecocardiograma bidimensional de superficie. Vista apical de 4 cámaras en paciente con enfermedad cardíaca chagásica con insuficiencia cardíaca congestiva. Se observa dilatación global, hipoquinesia global severa y baja fracción de eyección. AD: aurícula derecha. AI: aurícula izquierda. VD: ventrículo derecho. VI: ventrículo izquierdo.
Ecocardiografía de strain y speckle tracking
El estudio de la deformación miocárdica basado en el speckle tracking, el cual no es ángulo dependiente, es una herramienta nueva que permite indagar información acerca de la deformación (strain) y la velocidad de la deformación (strain rate), tanto regional como global del VI y ventrículo derecho (VD)8,9.
El strain longitudinal global es el método más validado para la detección de daño subclínico funcional del VI en pacientes con enfermedad de Chagas crónico y FEVI normal. También ha sido evaluado como una variable predictora de progresión de la enfermedad y tiene una alta correlación con la cantidad de fibrosis miocárdica evaluada con resonancia magnética nuclear cardíaca (RMNC)3 (Figura 5). En el contexto de la enfermedad de Chagas, está por definirse el impacto clínico de cambios tisulares tempranos evaluados por estas técnicas ecocardiográficas avanzadas, en su eventual capacidad de predecir progresión de la enfermedad9. Otro hallazgo, detectado con speckle traking en pacientes con enfermedad de Chagas, es la dispersión electromagnética que se asocia con arritmias ventriculares y MS10.
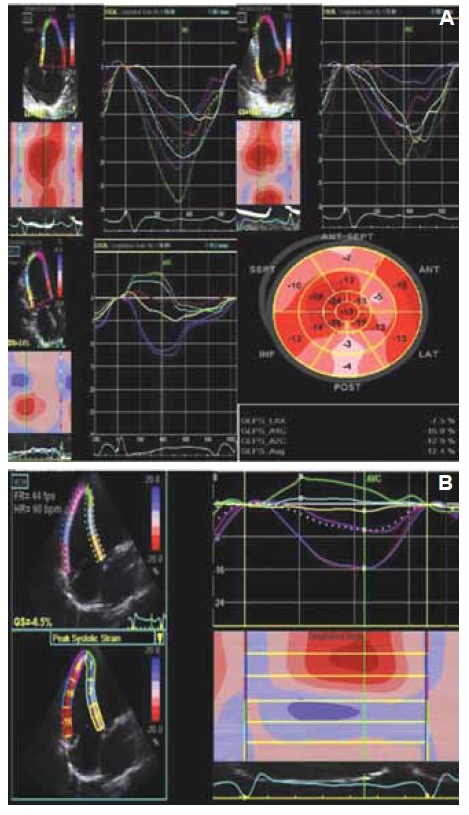
Figura 5. Strain longitudinal global de los ventrículos izquierdo. A. Strain longitudinal anormal en pacientes portador de enfermedad cardíaca por Chagas con alteración del ECG (BCRD). B. Strain longitudinal del ventrículo derecho global (-6,5%) y pared libre (-12,6%) en paciente con enfermedad cardíaca por Chagas asintomático.
Ecocardiografía tridimensional
La aplicabilidad del eco bidimensional (2D) en el estudio de la estructura cardíaca, tamaño y dimensiones, es limitada. Por consiguiente, la exactitud en el uso de técnicas e imágenes tridimensional (3D), que se obtienen con transductores especiales para la adquisición de volúmenes, permite mayor grado de reconstrucción y geométricas completa de las cámaras cardíacas10.
El volumen por ecografía 3D puede obtenerse en un solo latido o por la unión de volúmenes menores de latidos consecutivos. La ecocardiografía 3D tiene ventajas significativas sobre el ecocardiograma 2D, en la visualización completa del VI, facilita la medición de los volúmenes y FEVI como también, se aplica para el estudio de la aurícula izquierda (AI) y del VD, pudiendo ayudar en la detección de pequeños aneurismas del VI7,11. Los resultados obtenidos por ecocardiografía 3D han sido bien validados al compararlos con otras técnicas de imágenes 3D como RMNC7,9,11. Al igual que el estudio de otros tipos de miocardiopatías, esta técnica tridimensional puede ser utilizada en pacientes con enfermedad cardíaca por Chagas para evaluar el tamaño y función ventricular (Figura 6), principalmente obtener información del VD13.
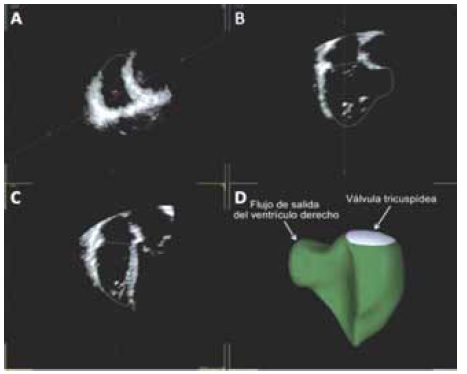
Figura 6. Estudio por ecocardiografía 3D. Evaluación de volumen y fracción de eyección del ventrículo derecho mediante ecocardiografía 3D en tiempo real. El software muestra tres planos: sagital (A), coronal (B) y cuatro cámaras (C). En D, se muestra la reconstrucción del ventrículo derecho en 3 dimensiones.
Estudio del ventrículo derecho
La compleja disposición geométrica y anatomía del VD, caracterizado por sus paredes más delgadas, prominentes trabeculaciones y banda moderadora hace el análisis ecocardiográfico más dificultoso en una vista única biplano, como mayor dificultad en efectuar cálculos de volúmenes con ecografía 2D. Por consiguiente, al contrario del VI, no se recomienda el cálculo de la fracción de eyección del VD (FEVD) por ecografía 2D. La aplicación de 3D puede ser una herramienta prometedora, que permitan la determinación de la FEVD en la práctica clínica12,13. Las guías de la ASE14 recomiendan una serie de parámetros de utilidad clínica a la hora de valorar el VD y tienen buena correlación con la función sistólica global del mismo como: la excursión sistólica del plano del anillo tricúspide (TAPSE: tricuspid annular plane systolic excursion), la velocidad sistólica del Doppler tisular del anillo tricuspídeo (S'), cambio del área de fracción de acortamiento (diferencia entre las áreas del VD al final de la diástole y de la sístole, dividido por el área diastólica multiplicado por 100), y el índice de eficiencia miocárdica del VD (índice de Tei, que expresa tanto la función sistólica como diastólica del VD)13,14. La ecocardiografía speckle-tracking ha permitido el análisis del strain del VD, una medida de la deformación miocárdica, que ha demostrado una mayor precisión para la detección de la disfunción sistólica del VD (Figura 5 B)15, especialmente disfunción incipiente, antes que se torne clínicamente importante. El deterioro del VD es un hallazgo frecuente, demostrado incluso en las primeras etapas de la enfermedad. Seguramente, como en otras patologías, la presencia de áreas de fibrosis desencadenada, por la miocarditis crónica que origina la enfermedad de Chagas, debe tener correlación con la función ventricular y quizás también con el riesgo de arritmias, por lo tanto, la capacidad de detectar fibrosis en la enfermedad de Chagas, tanto en el VI como en el VD es relevante16.
Resonancia magnética nuclear cardíaca
La RMNC ha demostrado ser un estudio de imágenes no invasivo de gran versatilidad, debido a su excelente resolución espacial y a su capacidad de caracterización tisular de edema y fibrosis, brinda información fisiopatológica de la enfermedad17. Se utilizan diferentes secuencias de RMNC para evaluar anatomía, función y caracterización tisular. Secuencias de cine que permite con gran exactitud determinar la severidad y extensión del compromiso biventricular, el cálculo preciso de los volúmenes, FEVI y la evaluación de anormalidades de motilidad parietal, el adelgazamiento parietal, la presencia de aneurisma, detección de trombos intracavitarios (Figura 7). Secuencias de T2 (tiempo de relajación transversal) sin contraste permite la evaluación de edema miocárdico en cualquiera de las etapas de la enfermedad con muy buena correlación con el estudio tradicional de realce tardío con gadolinio (LGE)18. Las imágenes de realce tardío se obtienen en secuencia inversión recuperación (T1: tiempo de relajación longitudinal), aproximadamente 10 minutos posteriores a la administración del contraste (Figura 8). Diferentes patrones de distribución del realce tardío han sido identificados en pacientes con enfermedad cardíaca chagásica, subendocárdicos y transmurales (ambos difíciles de diferenciar de patrones de infarto miocárdico previo), intramiocárdicos o subepicárdicos. El realce tardío tiende más comúnmente a mostrar los compromisos de los segmentos basal ínfero lateral y ápex (Figura 9).
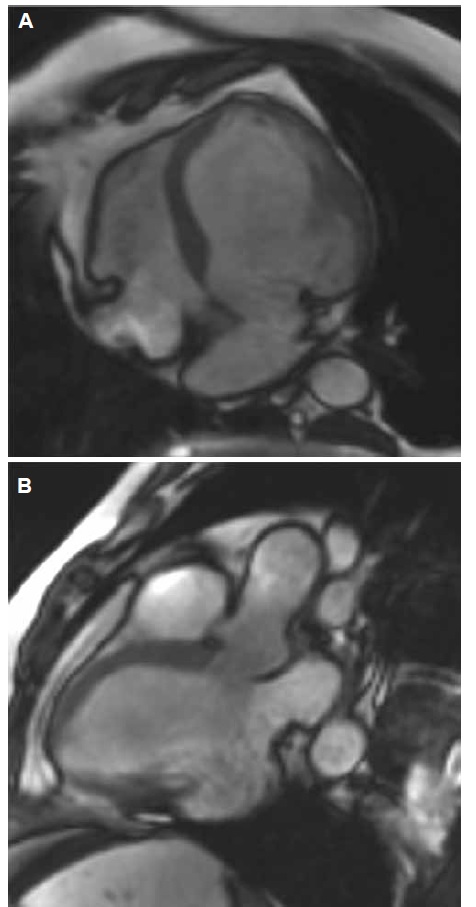
Figura 7. Resonancia magnética nuclear cardíaca: secuencias de cine. Paciente con miocardiopatía chagásica. A. Vista de cuatro cámaras: dilatación del ventrículo izquierdo con severa disminución de la función sistólica, adelgazamiento parietal a nivel de la pared lateral en el segmento basal. B. Vista tres cámaras: se evidencia claramente aneurisma a nivel de la pared inferolateral en el segmento basal.
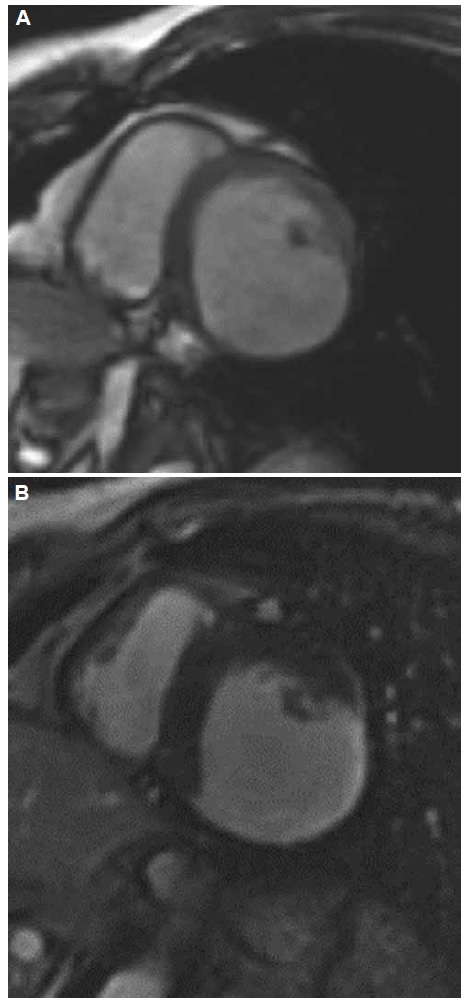
Figura 8. Resonancia magnética nuclear cardíaca, eje corto. A. Secuencia de cine, donde se evidencia adelgazamiento parietal del segmento inferolateral. B. Secuencia de realce tardío donde se evidencia fibrosis en la región adelgazada.
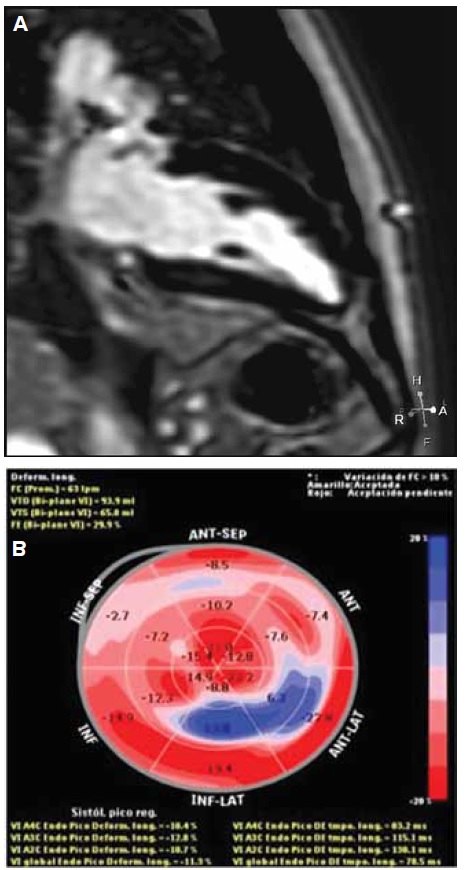
Figura 9. Resonancia magnética nuclear cardíaca, 2 cámaras, secuencias de realce tardío a nivel de la pared inferior intramiocárdica (fibrosis). Se correlaciona con las imágenes de strain, en un paciente con serología positiva para enfermedad de Chagas, con ECG normal y ecocardiograma bidimensional con función sistólica conservada.
En pacientes con enfermedad chagásica con serología positiva a pesar de ECG y ecocardiograma normales, la fibrosis miocárdica puede encontrarse hasta en un hasta 20%19 .Es importante destacar, que la presencia y extensión de la fibrosis tiene buena correlación con la CF según la NYHA, y con la posibilidad de arritmias ventriculares, en especial cuando el patrón de realce tardío es transmural y abarca 2 ó más segmentos contiguos20,21. Además, el grado de fibrosis se correlaciona en forma inversa con la función sistólica del VI22. Por ello, la evaluación del grado de fibrosis con realce tardío ha mostrado ser un excelente marcador de severidad de la enfermedad. La RMNC es una excelente modalidad para estratificación de riesgo y pronóstico en la enfermedad chagásica, pero aún no se encuentra disponible en la mayoría de las regiones rurales en donde la enfermedad es endémica.
Si bien actualmente los estudios de RMNC están contraindicados en pacientes portadores de dispositivos cardíacos tales como cardiodesfibriladores, resincronizadores o marcapasos convencionales, las nuevas tecnologías de estos dispositivos permitirán acceder a esta posibilidad.
Conclusiones
En este resumen detallamos el rol de las diferentes modalidades de imágenes, encontrándose en primer lugar, la ecocardiografía (Figura 10), por su disponibilidad y costo, y en segundo lugar la RMC, aportando ambos métodos información no sólo diagnóstica sino también pronóstica, lo que resulta útil para la estratificación de riego en esta enfermedad.
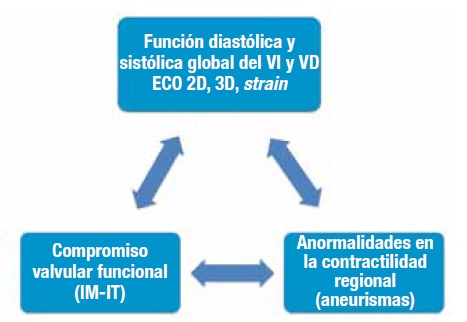
Figura 10. Parámetros y hallazgos ecocardiográficos de utilidad en la enfermedad de Chagas.
VD: ventrículo derecho. VI: ventrículo izquierdo. IM: insuficiencia mitral. IT: insuficiencia tricuspídea.
1. Bern C, Kjos S, Yabsley MJ, et al. Trypanosoma cruzi and Chagas' Disease in the United States. Clin Microbiol Rev 2011;24:655-81. [ Links ]
2. Acquatella H. Echocardiography in Chagas heart disease. Circulation 2007; 115:1124-31. [ Links ]
3. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015;28:1-39.e14. [ Links ]
4. Acquatella H, Asch FM, et al. Recommendations for Multimodality Cardiac Imaging in Patients with Chagas Disease: A Report from the American Society of Echocardiography in Collaboration With the InterAmerican Association of Echocardiography (ECOSIAC) and the Cardiovascular Imaging Department of the Brazilian Society of Cardiology (DIC-SBC). J Am Soc Echocardiogr 2018;31(1):3-25. [ Links ]
5. Pazin-Filho A, Romano MM, Almeida-Filho OC, et al. Minor segmental wall motion abnormalities detected in patients with Chagas' disease have adverse prognostic implications. Braz J Med Biol Res 2006; 39:483-7. [ Links ]
6. Cianciulli TF, Lax JA, Saccheri MC, et al . Early detection of left ventricular diastolic dysfunction in Chagas' Disease. Cardiovascular Ultrasound 2006, 4:18. [ Links ]
7. Nunes MCP, Barbosa MM, Rocha MO. Peculiar aspects of cardiogenic embolism in patients with Chagas' cardiomyopathy: a transthoracic and transesophageal echocardiographic study. J Am Soc Echocardiogr 2005;18:761-7. [ Links ]
8. Goncalves JG, Dias Silva VJ, Calzada Borges MC, et al. Mortality indicators among chronic Chagas patients living in an endemic area. Int J Cardiol 2010;143:235-42. [ Links ]
9. Perk G, Tunick PA, Kronzon I et al. Non-Doppler, Two dimensional (2D) strain imaging by echocardiography from technical considerations to clinical applications. J Am Soc Echocardiogr 2007; 20 (3): 234-243. [ Links ]
10. Barros MVL, Leren IS, Edvardsen T et al .Mechanical Dispersion Assessed by Strain Echocardiography Is Associated with Malignant Arrhythmias in Chagas Cardiomyopathy. J Am Soc Echocardiogr 2016;29:368-74. [ Links ]
11. Lang RM, Badano LP, Tsang W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. J Am Soc Echocardiogr 2012;25:3-46. [ Links ]
12. Vieira ML, Nomura CH, Tranchesi B, et al. Real-time threedimensional echocardiographic left ventricular systolic assessment: side-by-side comparison with 64-slice multidetector cardiac computed tomography. Eur J Echocardiogr 2010;11:257-63. [ Links ]
13. Marin-Neto JA, Marzullo P, Sousa AC, et al. Radionuclide angiographic evidence for early predominant right ventricular in patients with Chagas' disease. Can J Cardiol 1988;4: 231-6. [ Links ]
14. Rudski LG, Lai WW, Afilalo J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography, a registered branch of the European Society of Cardiology, and the Canadian Society of Echocardiography. J Am Soc Echocardiogr 2010;23:685-713; quiz 786. [ Links ]
15. Moreira HT, Volpe GJ, Marin-Neto JA, et al. Right Ventricular Systolic Dysfunction in Chagas Disease Defined by Speckle- Tracking Echocardiography: A Comparative Study with Cardiac Magnetic Resonance Imaging. J Am Soc Echocardiogr 2017;30(5):493-502. [ Links ]
16. Barros MV, Machado FS, Ribeiro AL, et al. Detection of early right ventricular dysfunction in Chagas' disease using Doppler tissue imaging. J Am Soc Echocardiogr 2002;15(10 Pt 2):1197-201. [ Links ]
17. Rochitte CE, Nacif MS, de Oliveira Júnior AC, et al. Cardiac magnetic resonance in Chagas' disease. Artif Organs 2007;31:259-67. [ Links ]
18. Torreão JA, Ianni BM, Mady C, et al. Myocardial tissue characterization in Chagas' heart disease by cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2015;17:97. [ Links ]
19. Rochitte CE, Oliveira PF, Andrade JM, et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with Chagas' disease: a marker of disease severity. J Am Coll Cardiol 2005; 46(8): 1553-1558. [ Links ]
20. Mello RP, Szarf G, Schvartzman PR, Nakano EM, et al. Delayed enhancement cardiac magnetic resonance imaging can identify the risk for ventricular tachycardia in chronic Chagas' heart disease. Arq Bras Cardiol 2012;98:421-30. [ Links ]
21. Rochitte CE, Oliveira PF, Andrade JM, et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with Chagas' disease: a marker of disease severity. J Am Coll Cardiol 2005;46:1553-8. [ Links ]
22. Bern C, Montgomery SP, Herwaldt BL, et al. Evaluation and treatment of chagas disease in the United States: a systematic review. JAMA 2007;298:2171-81. [ Links ]














