Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.14 no.1 Ciudad Autónoma de Buenos Aires mar. 2019
CONSENSO DE ENFERMEDAD DE CHAGAS
Insuficiencia cardíaca en miocardiopatía chagásica crónica
Guillermo Cursack1, Griselda Maidana2, Carlos Manfredi3, Clara María Huerta4, Juan Pablo Címbaro Canella5, María Josefina Blanchet6, María Lorena Coronel7, Eduardo Perna8, Luis Aguinaga9, Cristian Núñez10, Moira Álvarez11, Juan Pablo Escalante12, María Cecilia Moris13, Daniela García Brasca14 y Lilia Luz Lobo Márquez15
1 Médico cardiólogo. Coordinador Unidad Coronaria. Sanatorio Esperanza. Esperanza. Santa Fe. República Argentina.
2 Médica cardióloga. Centro Modelo de Cardiología. San Miguel de Tucumán. Tucumán. República Argentina.
3 Médico cardiólogo. Clínica Yunes. Santiago del Estero. Santiago del Estero. República Argentina.
4 Médica cardióloga. Clínica Universitaria Reina Fabiola. Hospital Córdoba. Córdoba. República Argentina.
5 Médico cardiólogo. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
6 Médica cardióloga. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
7 Médica cardióloga. División Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
8 Médico cardiólogo. Jefe de División de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología de Corrientes. Corrientes. República Argentina.
9 Médico cardiólogo. Centro Integral de Arritmias. San Miguel de Tucumán. Tucumán. República Argentina.
10 Médico cardiólogo. Coordinador Unidad de Insuficiencia Cardíaca e Hipertensión pulmonar. CIMAC y Clínica El Castaño. San Juan. San Juan. República Argentina.
11 Médico cardiólogo. Coordinador Unidad de Insuficiencia Cardíaca e Hipertensión pulmonar. CIMAC y Clínica El Castaño. San Juan. San Juan. República Argentina.
12 Médico cardiólogo. Instituto Cardiovascular de Rosario. Rosario. Santa Fe. República Argentina.
13 Médica cardióloga. Servicio Cardiológico Sarmiento. Sanatorio Sarmiento. San Miguel de Tucumán. Tucumán. República Argentina.
14 Médica cardióloga. Instituto de Cardiología. Hospital Italiano de Córdoba. Córdoba. República Argentina.
15 Médica cardióloga. Jefe del Departamento de Insuficiencia Cardíaca e Hipertensión pulmonar. Instituto de Cardiología. San Miguel de Tucumán. Tucumán. República Argentina.
Institución: Comité de Insuficiencia Cardíaca e Hipertensión Pulmonar de la Federación Argentina de Cardiología.
Correspondencia: Dr. Guillermo Cursack.
Email: gcursack@yahoo.com.ar
Recibido: 17/11/2018
Aceptado: 18/02/2019
Resumen
Acorde al último reporte epidemiológico de la Organización Mundial de la Salud del año 2015, en Argentina existen 1,5 millones de personas infectadas por el Trypanosoma cruzi y alrededor de 370.000 pacientes con distintas manifestaciones de la enfermedad de Chagas. El objetivo de esta revisión es analizar una de las manifestaciones clínicas más graves e invalidantes de esta enfermedad: la miocardiopatía chagásica crónica. Esta patología, que presenta una distribución geográfica dispar en la Argentina, comparte varias características comunes con otras formas etiológicas de insuficiencia cardíaca, aunque su epidemiología, presentación clínica y respuesta al tratamiento médico, eléctrico y quirúrgico le otorgan una distinción particular y en muchos casos, poco conocida.
Por tal motivo, existe en la comunidad médica, un creciente interés en alcanzar un mayor conocimiento de esta enfermedad a fin de implementar manejos y decisiones terapéuticas, que si bien demostraron beneficio en otras poblaciones de pacientes con insuficiencia cardíaca, aun no han sido adecuadamente avaladas para su aplicación en insuficiencia cardíaca chagásica. Muchas de las indicaciones e intervenciones se basan en experiencia más que evidencia científica.
Es por ello que esta revisión es un desafío oportuno para optimizar el tratamiento y pronóstico de esta población.
Palabras clave: Insuficiencia cardíaca; Enfermedad de Chagas; Cardiopatía chagásica; Miocardiopatía chagásica crónica
Summary
Heart failure in chronic chagasic cardiomyopathy
According to the last epidemiological report of the World Health Organization in 2015, in Argentina there are 1.5 million people infected with Trypanosoma cruzi and around 370,000 patients with different manifestations of Chagas disease. The objective of this review is to analyze one of the most serious and invalidating clinical manifestations of this disease: chronic chagasic myocardiopathy. This pathology, which has a disparate geographical distribution in Argentina, shares several common characteristics with other etiological forms of heart failure, although its epidemiology, clinical presentation and response to medical, electrical and surgical treatment give it a particular distinction and in many cases, little known.
For this reason, there is a growing interest in the medical community to achieve greater knowledge of this disease in order to implement management and therapeutic decisions, which although they have shown benefit in other populations of patients with heart failure, have not yet been adequately endorsed. for its application in chagasic heart failure. Many of the indications and interventions are based on experience rather than scientific evidence.
That is why this review is a timely challenge to optimize the treatment and prognosis of this population.
Keywords: Heart failure; Chagas disease; Chagasic heart disease; Chronic chagasic cardiomyopathy
Resumo
Insuficiência cardíaca na cardiomiopatia chagásica crônica
De acordo o último relatório epidemiológico da Organização Mundial da Saúde em 2015, na Argentina existem 1,5 milhão de pessoas infectadas pelo Trypanosoma cruzi e cerca de 370.000 pacientes com manifestações diferentes da doença de Chagas. O objetivo desta revisão é analisar uma das manifestações clínicas mais graves e invalidantes dessa doença: miocardiopatia chagásica crônica. Esta condição, que tem uma distribuição geográfica desigual na Argentina, compartilha várias características comuns com outras formas etiológicos de insuficiência cardíaca, embora sua epidemiologia, apresentação clínica e resposta ao tratamento médico, elétrico e cirúrgico dar uma distinção especial e, em muitos casos, pouco conhecido.
Portanto, há na comunidade médica, um crescente interesse na obtenção de uma melhor compreensão da doença, a fim de implementar as decisões de manejo e tratamento, que embora benefício mostrou em outras populações de pacientes com insuficiência cardíaca ainda não foram adequadamente apoiados para sua aplicação na insuficiência cardíaca chagásica. Muitas das indicações e intervenções são baseadas na experiência e não na evidência científica.
Este por isso que esta revisão é um desafio oportuno para otimizar o tratamento e o prognóstico dessa população.
Palavras-chave: Insuficiência cardíaca; Doença de Chagas; Cardiopatia chagásica; Cardiomiopatia chagásica crônica
9. Trasplante cardíaco en enfermedad de Chagas
Juan Pablo Címbaro Canella, María Josefina Blanchet, María Lorena Coronel, Eduardo R. Perna
En el pasado se ha generado controversia respecto a la utilidad del trasplante cardíaco (TC) en pacientes con IC y enfermedad de Chagas, por tratarse de una enfermedad infecciosa incurable y con riesgo de reactivación. Ciertos aspectos como la patogénesis de la enfermedad, la falta de indicaciones específicas y de un adecuado esquema inmunosupresor, la alta tasa de neoplasias observadas principalmente en el pasado, el temor a la reactivación de la infección por el Trypanosoma cruzi (T cruzi) y los resultados en el seguimiento a largo plazo la han convertido durante muchos años en una contraindicación para el TC.
Esta situación se modificó en la década del 80, estableciéndose en América del Sur la viabilidad del TC en sujetos con cardiopatía chagásica (CCh), el cual fue realizado por primera vez en Brasil en el año 1985, desde entonces la experiencia y evidencia acumulada ha ido en aumento. Actualmente, la CCh constituye la tercera indicación más frecuente de TC1,2. El objetivo de este capítulo es revisar la evidencia actual que demuestra que el TC es seguro y eficaz en pacientes con estadio terminal de IC por CCh.
Evaluación de riesgo e indicación de trasplante cardíaco en cardiopatía chagásica
El pronóstico de pacientes con IC crónica por miocardiopatía chagásica es peor que el observado en pacientes con otras etiologías3,4, con una mortalidad al año de hasta 22%5 y a 5 años de 32%, y con una mayor tasa de admisión hospitalaria no planeada que los pacientes no chagasicos6.
Los pacientes con IC con una probabilidad de muerte anual â¥70% son usualmente considerados para TC, las variables utilizadas habitualmente para predecir mortalidad en IC crónica no han sido lo suficientemente evaluadas en pacientes con CCh. En 104 pacientes con CCh se halló que la presencia de CF IV de la NYHA y deterioro de la FEVI se asoció a una supervivencia anual del 20%, mientras que aquellos con un consumo máximo de oxígeno en el test de ejercicio cardiopulmonar<10 ml.kg-1.min-1 tuvieron una probabilidad de supervivencia al año del 0%7. Pacientes que presentaron los siguientes factores de riesgo independientes de mortalidad: ausencia de tratamiento con BB, hiponatremia, FEVI <31%, CF IV de la NYHA y el uso de digoxina, tuvieron una supervivencia al año de seguimiento del 23%5. También, se ha diseñado un score de riesgo con variables clínicas, electrocardiográficas y radiológicas para predecir la mortalidad a 10 años en pacientes chagásicos8.
La enfermedad de Chagas como etiología de IC es un predictor independiente de mortalidad en pacientes incluidos en lista de espera de TC, aquellos con CCh tienen un peor pronóstico comparados con otras etiologías, con una supervivencia del 50%, 25% y 0% a los 2, 4 y 8 meses, respectivamente9. Es por ello que, teniendo en cuenta que la mortalidad perioperatoria por fallo agudo del injerto luego del TC en centros con alto porcentaje de pacientes con CCh es del 19%10, se recomienda el TC en este grupo de pacientes dado que presentan una probabilidad de supervivencia anual<30%. Se resumen los potenciales indicadores para TC en CCh en la Tabla 6. Actualmente, se encuentran establecidas las indicaciones de TC en pacientes con enfermedad de Chagas2,11 (Tabla 7).
Tabla 6. Indicaciones potenciales de trasplante cardíaco en IC terminal con cardiopatía chagásica

Tabla 7. Recomendaciones y nivel de evidencia de trasplante cardíaco en cardiopatía chagásica

Evaluación de trasplante
El diagnostico de enfermedad de Chagas se basa en la detección de anticuerpos contra antígenos del T cruzi. Todos los pacientes que se encuentren en evaluación para TC, con cardiomiopatía de causa no isquémica, nacidos en países donde la enfermedad de Chagas es endémica deben realizarse pesquisa serológica12. En nuestro país la evaluación se aplica a todos los pacientes evaluados. Se deben utilizar al menos dos pruebas, generalmente por inmunofluorecencia indirecta (IFI) y ensayo por inmunoabsorción ligado a enzimas (ELISA). Ambas pruebas tienen alta sensibilidad y especificidad para confirmar el diagnóstico. Cuando los resultados son discordantes un tercer método puede ser utilizado. Potenciales donantes deben ser evaluados y la presencia de enfermedad de Chagas es una contraindicación para donación cardíaca2,13.
La evaluación para TC del paciente con IC y CCh sigue las mismas directrices que en pacientes no chagásicos, con algunas particularidades a tener en cuenta:
- Hipertensión pulmonar. La presentación clínica más frecuente del paciente con CCh es la IC biventricular con predominio de los síntomas relacionados con disfunción del ventrículo derecho. En general estos pacientes presentan valores menores de resistencia vascular pulmonar, presiones pulmonares y de gradiente transpulmonar (GTP), la hipertensión pulmonar es una entidad poco habitual en el paciente chagásico con menor probabilidad de fallo de ventrículo derecho en el posoperatorio del TC14.
- Evaluación ventricular. La ecocardiografía ha demostrado su utilidad para el análisis segmentario y de la contractilidad ventricular, evaluación de la función sistólica y diastólica y la detección de aneurismas y trombos ventriculares en pacientes con CCh15, a pesar de ser un método no invasivo y de fácil realización presenta limitaciones para la evaluación del ventrículo derecho. La resonancia magnética nuclear presenta ventajas, el aneurisma apical muchas veces de difícil visualización con el ecocardiograma puede ser mejor definido con este método. También permite cuantificar la presencia de fibrosis ventricular, con implicancias pronósticas en la CCh16.
- Evaluación del tracto gastrointestinal. El megaesófago y/o megacolon se presentan hasta en el 15-20% de los receptores de TC con enfermedad de Chagas, y de acuerdo a su gravedad aumentan los riesgos de complicaciones en el posoperatorio17,18. Se debe realizar una evaluación individualizada en la pesquisa de megaesófago, la realización de radiografía seriada esófago-gástrica, endoscopia digestiva y el examen manométrico están indicados. Puede constituir una causa de malnutrición proteico-calórica y comorbilidad seria, constituyendo una contraindicación relativa. Con respecto al megacolon, los métodos diagnósticos más utilizados son la radiografía de colon por enema y la endoscopia digestiva baja. En esta situación, el riesgo aumenta por la posibilidad de perforación intestinal, fecaloma o vólvulo de sigmoides en el período posoperatorio. Se debe considerar el tratamiento médico conservador o la estrategia quirúrgica y ambas complicaciones pueden ser contraindicaciones para el TC, dependiendo de su gravedad.
Inmunosupresión
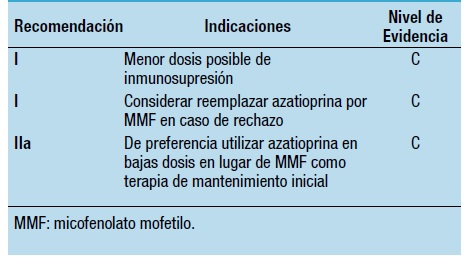
La terapia inmunosupresora convencional, en la mayoría de los centros, para los pacientes chagásicos consiste en el triple esquema: esteroides, anticalcineurínicos y antiproliferativos19. En etapas iniciales del TC en CCh, los esquemas empleados incluían altas dosis de esteroides, ciclosporina y azatioprina, logrando baja incidencia de rechazo, con una aceptable tasa de reactivación de la enfermedad y de mayor incidencia de neoplasias, con una sobrevida superior a otras etiologías como isquémica e idiopática. Esta mejor evolución pudo vincularse con el tratamiento antiparasitario efectivo con benznidazol, baja incidencia de rechazo agudo y crónico. La menor tasa de enfermedad vascular del injerto (EVI) observada se relacionó a menor presencia de factores de riesgo en la población chagásica comparados con los isquemicos20. En la década del 90, Fiorelli y col. compararon dos protocolos de tratamiento: una fase inicial que incluyó 10 pacientes con una dosis de ciclosporina entre 5 y 10 mg/kg/día (dosis media de 6,70 ± 1,77 mg/kg/día) con el objetivo de lograr un nivel de 700 a 1200 ng/mL en el primer trimestre y luego 500 a 700 ng/mL, y una segunda fase que evaluó 49 pacientes donde la dosis de ciclosporina fue reducida a 3-5 mg/kg/día, intentando lograr niveles entre 200 y 300 ng/mL durante el primer trimestre y entre 100 y 150 ng/mL posteriormente, lográndose una dosis media significativamente menor (2,79 ± 1,02 mg/kg/día). Con dosis medias utilizadas de azatioprina y esteroides similares entre ambos grupos. El porcentaje de reactivaciones fue mayor en el primer grupo (2,3 por paciente vs 0,25 por paciente) y la sobrevida fue superior en el grupo de dosis menor de ciclosporina (p<0,05). Sin diferencias en la incidencia de rechazo entre los dos grupos. La tasa de neoplasias fue mayor en el primer grupo. Estos hallazgos sugieren que dosis menores de ciclosporina se asocian a menor incidencia de reactivación y neoplasias con mejoría en la sobrevida21. Finalmente se introdujo el micofenolato mofetilo (MMF), reemplazando a azatioprina, apreciándose un incremento en los episodios de reactivación. Bacal y col. evidenciaron en 39 pacientes que el uso de MMF, comparado con azatioprina, se asoció a un incremento de la tasa de reactivación a dos años de seguimiento (p<0,0001, hazard ratio 6,06), sin diferencias en los episodios de rechazo22. Otros estudios retrospectivos basados en protocolos con MMF muestran hallazgos similares23,24. Sin embargo, en situaciones de rechazo severo o persistente se sugiere reemplazar azatioprina por MMF, y en relación a la terapia con esteroides está recomendada la discontinuación luego del sexto mes, a fin de lograr una menor carga imunosupresora14. No existe suficiente evidencia para pacientes chagásicos en relación al uso de los inhibidores de la mTOR, metotrexato y/o terapias de inducción, por lo que podrían usarse según protocolos de cada centro. Como concepto general: considerar el empleo del menor grado de inmunosupresión a fin de evitar reactivaciones y neoplasias, con esquemas personalizados en función del riesgo individual (co-morbilidades, sensibilizados, etc.) (Tabla 8).
Tabla 8. Recomendaciones y nivel de evidencia del uso de inmunosupresión en trasplante cardíaco en cardiopatía chagásica14
Reactivación
El tratamiento inmunosupresor incrementa riesgo de reactivación de la infección por T cruzi. La incidencia luego del TC varía del 21-45%25,26, con una mortalidad de alrededor del 0,9%6. El diagnóstico se basa en la presencia de signos y síntomas clínicos y/o en la evidencia de parásitos en sangre, médula ósea u otros tejidos. Usualmente, se manifiesta con fiebre, pancitopenia, nódulos subcutáneos, paniculitis y más raramente como meningoencefalitis. La miocarditis puede presentarse con insuficiencia cardíaca, bloqueo AV de alto grado, shock cardiogénico en casos severos; siendo difícil el diagnóstico diferencial con rechazo agudo y en ocasiones un error diagnóstico puede llevar al empeoramiento del cuadro, intensificando el tratamiento inmunosupresor14,27. El objetivo del monitoreo es identificar cualquier señal de reactivación, antes del establecimiento de síntomas cardíacos y extracardíacos. El diagnóstico de reactivación se confirma cuando las formas de tripomastigote se detectan mediante un examen microscópico directo de sangre periférica teñida con Giemsa o frotis de líquido cefalorraquídeo, o en presencia de amastigotes (forma latente intracelular) en muestras de tejidos. Otra técnica utilizada es la de inmunohistoquímica en muestras de piel, miocardio, médula ósea o cerebro2. Estos procedimientos presentan una baja sensibilidad, de allí que en la actualidad la reacción en cadena de la polimerasa (PCR) en sangre y tejido se ha convertido en la herramienta de elección para detectar infecciones tempranas, con resultados positivos días o semanas antes de que se detecten los tripomastigotes circulantes y las manifestaciones clínicas28,29.
Valoración y cronograma de control post TC
1. Evaluación clínica: presencia de síntomas y signos (fiebre, lesiones cutáneas, disnea, fatiga).
2. Electrocardiograma.
3. Ecocardiograma Doppler.
4. Test de laboratorio: PCR en sangre y examen microscópico de biopsia endomiocárdica (BEM).
Control post TC:
- Semana 1 a 6: control semanal.
- Semana 7 a 12: control quincenal.
- Mes 3 a 6: control mensual.
- Mes 6 a 12: control bimestral.
- Luego del 1er año: control trimestral con BEM anual.
Tratamiento de la reactivación
Ante el diagnóstico de reactivación se debe iniciar tratamiento etiológico inmediatamente. El benznidazol (derivado nitroimidazólico) es el medicamento recomendado como tratamiento de primera línea2. La dosis recomendada es de 5 mg/kg/día dividida en dos o tres tomas durante 60 días. El efecto colateral más frecuente es la dermatitis urticariforme (30-60%) con buena respuesta a antihistamínicos. Otros menos frecuentes incluyen la polineuropatía y anorexia. La leucopenia significativa y agranulocitosis son raras, pero determinan la interrupción del tratamiento. Por ello es mandatorio el monitoreo de laboratorio (hemograma, función renal y hepática). Alopurinol a la dosis de 600 mg/día durante 60 días para lesiones cutáneas, y 900 mg/día por 60 días en casos de miocarditis es una alternativa en casos de reacciones adversas al benznidazol aunque sus beneficios aún requieran confirmación en mayor número de pacientes30. El tratamiento actualmente disponible no actúa a nivel intracelular, por lo que el parasito en su forma de amastigote permanece latente con un constante riesgo de reactivación, requiriendo continuar con la vigilancia. No esta recomendado el tratamiento anti tripanosomicida de manera profiláctico.
Supervivencia
En un análisis multicéntrico de 117 pacientes con CCh sometidos a TC en Brasil, la probabilidad de supervivencia a los 6 meses, 1 y 10 años fue del: 76%, 71% y 46%, respectivamente; evidenciando también una menor mortalidad en comparación con las etiologías isquémicas e idiopáticas20, atribuyendo este hallazgo a una edad menor de los receptores y a una baja tasa de reactivación. Sin embargo, esta supervivencia fue menor a la reportada por el registro ISHLT19.
En una serie más reciente de tan solo 11 pacientes sometidos a TC en Estados Unidos, se reportó una supervivencia a 6 meses del 82%27.
1. Benatti RD, Oliveira GH, Bacal F. Heart transplantation for Chagas cardiomyopathy. J Heart Lung Trasplant 2017;36:597- 603. [ Links ]
2. Andrade JP, Marin Neto JA, Paola AA, et al. I Latin American guidelines for the diagnosis and treatment of Chagas' heart disease: executive summary. Arq Bras Cardiol 2011;96:434-442. [ Links ]
3. Bestetti RB, Muccillo G. Clinical course of Chagas' heart disease: a comparison with dilated cardiomyopathy. Int J Cardiol 1997; 60: 187-93. [ Links ]
4. Freitas HF, Chizzola PR, Paes AT, Lima AC, Mansur AJ. Risk stratification in a Brazilian hospital-based cohort of 1220 outpatients with heart failure: role of Chagas' heart disease. Int J Cardiol 2005;102: 239-47. [ Links ]
5. Theodoropoulos TAD, Bestetti RB, Otaviano AP, et al. Predictors of all-cause mortality in chronic Chagas' heart disease in the current era of heart failure therapy. Int J Cardiol 2008;128:22-9. [ Links ]
6. Abuhab A, Trindade E, Aulicino GB, et al. Chagas' cardiomyopathy: the economic burden of an expensive and neglected disease. Int J Cardiol 2013;168:2375-80. [ Links ]
7. Mady C, Cardoso RH, Barreto ACP, et al. Survival and predictors of survival in patients with congestive heart failure due to Chagas' cardiomyopathy. Circulation 1994;90: 098-102. [ Links ]
8. Rassi A Jr, Rassi A, Little WC, et al. Development and validation of a risk score for predicting death in Chagas' heart disease. N Engl J Med 2006;355:799-808. [ Links ]
9. Leirner AA, Moreira LFP, Stolf NAG. The role of circulatory assistance and heart transplantation in Chagas' disease cardiomyopathy. Art Organs 2007;31:245-8. [ Links ]
10. Bocchi EA, Fiorelli A. The Brazilian experience with heart transplantation: a multicenter report. J Heart Lung Transplant 2001;20:637-45. [ Links ]
11. Mehra MR, Canter CE, Hannan MM, et al. The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update. J Heart Lung Transplant 2016;35:1-23. [ Links ]
12. Chin-Hong PV, Schwartz BS, Bern C, et al. Screening and treatment of Chagas disease in organ transplant recipients in the United States: Recommendations from the Chagas in Transplant Working Group. Am J Transplant 2011;11:672-80. [ Links ]
13. Schwartz BS, Mawhorter SD. Parasitic infections in solid organ transplantation. Am J Transplant 2013;13:280-303. [ Links ]
14. Bacal F, Marcondes-Braga FG, Rohde LEP, et al. 3a Diretriz Brasileira de Transplante Cardiaco. Arq Bras Cardiol 2018; 111(2):230-289. [ Links ]
15. Barros MV, Ribeiro AL, Machado FS, Rocha MO. Doppler tissue imaging to assess systolic function in Chagas disease. Arq Bras Cardiol 2003;80(1):36- 40. [ Links ]
16. Rochitte CE, Oliveira PF, Andrade JM, Ianni BM, Parga JR, Avila LF, et al. Myocardial delayed enhancement by magnetic resonance imaging in patients with Chagas' disease: a marker of disease severity. J Am Coll Cardiol 2005;46(8):1553-8. [ Links ]
17. Oliveira GC, Lopes LR, Andreollo NA, Braga Nda S, Coelho NetoJde S. Surgical treatment of megaesophagus at UNICAMP Hospital of Clinics - associated factors with better and worse results. Rev Col Bras Cir 2009;36(4):300-6. [ Links ]
18. Garcia RL, Matos BM, Feres O, Rocha JJ. Surgical treatment of Chagas megacolon. Critical analysis of outcome in operative methods. Acta Cir Bras 2008;23 Suppl 1:83-92. [ Links ]
19. Lund LH, Edwards LB, Kucheryavaya AY, et al; International Society of Heart and Lung Transplantation. The registry of the International Society for Heart and Lung Transplantation: thirty-first official adult heart transplant report--2014; focus theme: retransplantation. J Heart Lung Transplant 2014;33(10):996-1008. [ Links ]
20. Bocchi EA, Fiorelli AI. The paradox of survival results after heart transplantation for cardiomyopathy caused by Trypanosoma cruzi. Ann Thorac Surg 2001: 71: 1833. [ Links ]
21. Fiorelli AI, Stolf NAG, Honorato R, et al. Later evolution after cardiac transplantation in Chagas disease. Transplant Proc 2005: 37: 2793-279. [ Links ]
22. Bacal F, Silva CP, Bocchi EA et al. Mycophenolate mofetil increased Chagas disease reactivation in heart transplantedpatients: comparison between two different protocols. Am J Transplant 2005:5: 2017. [ Links ]
23. Bestetti RB, Souza TR, Lima MF et al. Effects of a mycophenolate mofetil-based immunosuppressive regimen in Chagas heart transplant recipients. Transplantation 2007: 84: 441. [ Links ]
24. Campos SV, Strabelli TM, Amato Neto V et al. Risk factors for Chagas disease reactivation after heart transplantation. J Heart Lung Transplant 2008: 27: 597. [ Links ]
25. Fiorelli AI, Santos RH, Oliveira JL Jr, Lourenço-Filho DD, Dias RR, Oliveira AS, et al. Heart transplantation in 107 cases of Chagas' disease. Transplant Proc 2011;43(1):220-4. [ Links ]
26. Godoy HL, Guerra CM, Viegas RF, Dinis RZ, Branco JN, Neto VA, et al. Infections in heart transplant recipients in Brazil: the challenge of Chagas' disease. J Heart Lung Transplant 2010;29(3):286-90. [ Links ]
27. Kransdorf EP, Czer LS, Luthringer DJ, et al. Heart transplantation for Chagas cardiomyopathy in the United States. Am J Transplant 2013;13:3262-8. [ Links ]
28. Maldonado C, Albano S, Vettorazzi L, Salomone O, Zlocowski JC, Abiega C, et al. Using polymerase chain reaction in early diagnosis of re-activated Trypanosoma cruzi infection after heart transplantation. J Heart Lung Transplant 2004;23(12):1345-8. [ Links ]
29. Diez M, Favaloro L, Bertolotti A, Burgos JM, Vigliano C, Lastra MP, et al. Usefulness of PCR strategies for early diagnosis of Chagas' disease reactivation and treatment follow-up in heart transplantation. Am J Transplant 2007;7(6):1633-40. [ Links ]
30. Almeida DR, Carvalho AC, Branco JN, Pereira AP, Correa L, Vianna PV, et al. Chagas' disease reactivation after heart transplantation: efficacy of allopurinol treatment. J Heart Lung Transplant 1996;15(10):988-92. [ Links ]














