Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.14 no.2 Ciudad Autónoma de Buenos Aires jun. 2019
ARTICULO DE REVISION
Dispositivos de asistencia ventricular en insuficiencia cardíaca avanzada
María Josefina Blanchet1
1 Médica cardióloga. Servicio de cardiología. Instituto de Cardiología de Corrientes Juana F. Cabral. Ciudad de Corrientes. Corrientes. República Argentina.
Monografía presentada en el Curso de Posgrado Universitario de Insuficiencia Cardíaca Avanzada. Facultad de Medicina. Universidad Católica Argentina.
Correspondencia: Dra. María Josefina Blanchet
E-mail: josefinablanchet@hotmail.com
Recibido: 30/07/2018
Aceptado: 21/01/2019
Resumen
La insuficiencia cardíaca (IC) continúa siendo una enfermedad de alta prevalencia, afectando al 1-2% de la población en países desarrollados y constituye por ello un problema de salud por los altos costos que esto conlleva. A pesar de los avances en el tratamiento farmacológico y mediante dispositivos implantables presenta un pronóstico pobre. Aproximadamente un 5% de los pacientes con diagnóstico de IC se hallan en un estadio avanzado de la enfermedad o estadio D. En las últimas tres décadas el trasplante cardíaco (TC) se ha convertido en el tratamiento de elección para este grupo de altísimo riesgo. Desafortunadamente, un pequeño porcentaje de pacientes cumple con la edad adecuada y con la ausencia de comorbilidades necesarias para poder acceder a este tratamiento, además de la limitante de la escasez de donantes en la actualidad. Debido a ello y a las largas listas de espera a nivel mundial, cada vez es mayor el desarrollo y la utilización de dispositivos de asistencia ventricular (DAV), que han mejorado la supervivencia a corto y largo plazo, dada la calidad de vida de pacientes con esta grave afección, generando una reducción progresiva de la tasa de complicaciones. Estos beneficios no solo aportan una alternativa a pacientes que esperan un TC, sino que permiten a aquellos con contraindicaciones reversibles a disponer del tiempo y la oportunidad de convertirse en candidatos adecuados, o en caso de que esto no sea posible, su final utilización como terapia de destino. Aun así son muchas las limitaciones de estos dispositivos: su costo, su durabilidad, la tasa de complicaciones y su aplicación a un espectro limitado de pacientes. El avance tecnológico para paliar las complicaciones, la mayor experiencia en los centros de manejo y su generalización para permitir un costo más reducido son estrategias que permitirán que la utilización de DAV en los pacientes con IC avanzada se continúe afianzando.
Palabras clave: Dispositivos de asistencia ventricular; Insuficiencia cardíaca; Trasplante cardíaco; Soporte circulatorio mecánico; Complicaciones
Summary
Ventricular assist devices in advanced heart failure
Heart failure (HF) continues to be a highly prevalent disease, affecting 1-2% of the population in developed countries and is therefore a health problem due to the high costs that this entails. Despite advances in pharmacological treatment and implantable devices, it has a poor prognosis. Approximately 5% of patients diagnosed with HF are in an advanced stage of the disease or stage D. In the last three decades, heart transplantation (HT) has become the treatment of choice for this group of very high risk. Unfortunately, a small percentage of patients meet the appropriate age and the absence of comorbidities necessary to access this treatment, in addition to the limitation of the shortage of donors at present. Due to this and the long waiting lists worldwide, the development and use of ventricular assist devices (VAD), which have improved short and long-term survival, due to the quality of life of patients with This serious condition, generating a progressive reduction in the rate of complications. These benefits not only provide an alternative for patients waiting for a HT, but also allow those with reversible contraindications to have the time and opportunity to become suitable candidates, or in case this is not possible, their final use as therapy of destiny. Even so, there are many limitations of these devices: their cost, their durability, the rate of complications and their application to a limited spectrum of patients. The technological advance to alleviate the complications, the greater experience in the centers of management and its generalization to allow a lower cost are strategies that will allow the use of VAD in patients with advanced HF to continue strengthening.
Keywords: Ventricular assist devices; Heart failure; Heart transplant; Mechanical circulatory support; Complications
Resumo
Dispositivos de assistência ventricular na insuficiência cardíaca avançada
A insuficiência cardíaca (IC) continua a ser uma doença altamente prevalente, afetando 1-2% da população nos países desenvolvidos e, portanto, é um problema de saúde devido aos altos custos que isso acarreta. Apesar dos avanços no tratamento farmacológico e dispositivos implantáveis, tem um mau prognóstico. Aproximadamente 5% dos pacientes com diagnóstico de IC estão em estágio avançado da doença ou estágio D. Nas últimas três décadas, o transplante cardíaco (TC) tornou-se o tratamento de escolha para esse grupo de risco muito alto. Infelizmente, uma pequena porcentagem de pacientes atinge a idade adequada e a ausência de comorbidades necessárias para acessar esse tratamento, além da limitação da falta de doadores no momento. Devido a isso e as longas listas de espera em todo o mundo, o desenvolvimento e uso de dispositivos de assistência ventricular (DAV), que melhoraram a sobrevivência a curto e longo prazo, devido Í qualidade de vida dos pacientes com Esta condição séria, gerando uma redução progressiva na taxa de complicações. Esses benefícios não apenas fornecem uma alternativa para pacientes que aguardam um TC, mas também permitem que aqueles com contraindicações reversíveis tenham tempo e oportunidade de se tornarem candidatos adequados ou, caso isso não seja possível, seu uso final como terapia. de destino. Mesmo assim, existem muitas limitações desses dispositivos: seu custo, sua durabilidade, a taxa de complicações e sua aplicação a um espectro limitado de pacientes. O avanço tecnológico para aliviar as complicações, a maior experiência nos centros de gestão e sua generalização para permitir um menor custo são estratégias que permitirão que o uso do DAV em pacientes com IC avançada continue fortalecendo-se.
Palavras-chave: Dispositivos de assistência ventricular; Insuficiência cardíaca; Transplante cardíaco; Suporte circulatório mecânico; Complicações
Introducción
La insuficiencia cardíaca (IC) continúa siendo una enfermedad de alta prevalencia, afectando al 1-2% de la población en países desarrollados y constituye por ello un problema de salud por los altos costos que esto conlleva1.
A pesar de los avances en el tratamiento farmacológico y mediante dispositivos implantables presenta un pronóstico pobre.
Aproximadamente un 5% de los pacientes con diagnóstico de IC se hallan en un estadio avanzado de la enfermedad o estadio D2.
La IC avanzada se define actualmente3:
- Presencia de síntomas en reposo o mínimos esfuerzos, clase funcional (CF) III-IV según New York Heart Association (NYHA).
- Clínica compatible con evidencia de congestión y/o hipoperfusión sistémica.
- Disfunción cardíaca severa:
Fracción de eyección del ventrículo izquierdo (FEVI) <30%.
Ecocardiograma Doppler con patrón pseudonormal o restrictivo en el flujograma mitral.
Aumento de las presiones de llenado izquierdas: presión
de oclusión de la arteria pulmonar >16 mm Hg
y/o presión de la aurícula derecha (AD) >12 mm Hg.
Aumento de péptidos natriuréticos en ausencia de causas no cardíacas.
- Alteración severa de la capacidad funcional:
Intolerancia al ejercicio.
Test de la marcha de 6 minutos <300 metros.
Consumo pico de oxígeno <12-14 ml/kg/min.
- Historia de hospitalización por IC descompensada en los últimos 6 meses.
- Presencia de todos los criterios previos a pesar de tratamiento farmacológico óptimo y terapia de resincronización cardíaca.
En las últimas tres décadas, el trasplante cardíaco (TC) se ha convertido en el tratamiento de elección para este grupo de altísimo riesgo. Desafortunadamente, un pequeño porcentaje de pacientes cumple con la edad adecuada y con la ausencia de comorbilidades necesarias para poder acceder a este tratamiento, además de la limitante de la escasez de donantes en la actualidad. Anualmente, se realizan aproximadamente 2200 TC en Estados Unidos y 250-300 en España4,5. Las largas listas de TC han sido el sustrato para el desarrollo de distintos dispositivos de soporte circulatorio mecánico (SCM).
Tanto, los dispositivos de asistencia ventricular (DAV) de corta duración como los de larga duración, han tenido un gran desarrollo en los últimos años; hoy en día su indicación se encuentra bien delimitada como terapia de puente a la recuperación, puente al TC, puente a la decisión, puente a la candidatura o terapia de destino (Tabla 1).
Tabla 1. Indicaciones para soporte circulatorio mecánico

Historia
En el año 1953, se inicia la era moderna de la cirugía cardíaca con la utilización por primera vez del bypass cardiopulmonar para recuperación de pacientes con shock cardiogénico post cardiotomía, sentando las bases para el posterior desarrollo de los DAV6. Hacia la década del 60 los DAV simples comienzan a reemplazar al bypass cardiopulmonar en el tratamiento de este gravísimo cuadro. El primer reporte del uso de un ventrículo artificial implantable fue en 19637, consistiendo en un dispositivo neumático que conectaba la aurícula izquierda (AI) a la aorta descendente, proporcionando asistencia ventricular parcial durante 4 días en el posoperatorio de cirugía cardíaca. En 1966, Debakey utiliza el primer DAV neumático de manera exitosa durante 10 días en el posoperatorio de cirugía cardíaca8 y en 1969 se reporta la utilización de un corazón artificial total como puente al TC9. Luego de estos hechos se sucedieron décadas de investigación en la búsqueda de dispositivos de implantación sencilla y duradera. En la década del 70, aparece la primera generación de DAV neumáticos extracorpóreos, los cuales podían permanecer colocados durante escasos días por las altas tasas de hemólisis y trombosis, con altos costos y baja efectividad como bomba. En 1984, Novacor implanta de manera exitosa su dispositivo eléctrico y pulsátil como DAV izquierdo como puente al trasplante10 y, en 1985, se realiza el primer puente al TC exitoso con un corazón artificial tipo Jarvik 7. Comienza entonces la llamada era de las asistencias de primera generación, todas de flujo pulsátil, pero solo 3 subtipos fueron aprobadas por la FDA (Food and Drugs Administration) de EEUU, como puente al trasplante:
1) De tipo soporte izquierdo intracorpóreo, siendo el primero en demostrar su eficacia fue el Thoratec IP LVAS en 1995, un dispositivo neumático; siendo posteriormente lanzado el HeartMate VE/XVE con plato pulsátil eléctrico.
2) Dispositivos paracorpóreos de soporte uni o biventricular, neumáticos como el Thoratec PVAD.
3) Dispositivos tipo corazón artificial como el Cardiowest conocido en la actualidad como Syncardia. Luego de la publicación del REMATCH la tecnología pulsátil demostró su superioridad sobre el tratamiento médico al poner de manifiesto una reducción del 48% de la mortalidad luego de 12 meses de seguimiento a expensas de una alta tasa de complicaciones con los DAV11.
La segunda generación de dispositivos se centró en un menor tamaño, menor tasa de complicaciones y mayor durabilidad para implementarlos como terapia de destino o puente al trasplante. Aparecieron bombas de flujo continuo y axial como el Jarvik 2000, Heart Assist 5 o Incor de Berlin Heart. El HeartMate II se aprueba en 2008 como puente al trasplante y en 2010 como terapia de destino, con una clara superioridad frente a otros dispositivos pulsátiles12,13. En los últimos años, se ha desarrollado la tercera generación de asistencia ventricular, dispositivos de tipo continuo, pero de tipo centrífugo. Se destaca entre los diferentes dispositivos el HeartWare de implante intrapericárdico, recibiendo su aprobación como puente al trasplante por la FDA en 2012.
El último dispositivo diseñado fue el HeartMate III con pulsatibilidad sobreañadida.
Con respecto al SCM de corta duración, el esfuerzo en su desarrollo se ha orientado a un implante rápido y sencillo por ser necesarios en situaciones agudas, buscando una estabilización como puente a decisión, a recuperación, a implante de un dispositivo de larga duración o al TC. Tienen un papel más limitado y menor evidencia como indicación de puente al trasplante. Algunos de los más utilizados han sido Abiomed AV y BVS 5000 de tipo pulsátil y extracorpóreos, pero con menos de 10 días de duración de soporte. Otros como Thoratec PVAD o Excor Berlin Heart nacieron como dispositivos de larga duración, siendo relegados en la actualidad a dispositivos de corto-mediano plazo. La novedad más reciente en este campo ha sido el CentriMag que permite un soporte uni o biventricular en posible combinación con un ECMO (ExtraCorporeal Membrane Oxygenation: oxigenación por membrana extracorpórea).
Tipos de dispositivos de asistencia ventricular
El objetivo de los diferentes DAV es la restitución de la perfusión tisular, aumentando el suministro sanguíneo; sin embargo, su manejo puede ser un desafío, así como el reconocimiento de las diversas complicaciones que se pueden presentar con su utilización, siendo algunas de ellas una amenaza para la vida. Ya sea, por sus diferentes indicaciones, los médicos tratantes deben familiarizarse con los diferentes tipos de dispositivos, entender su mecanismo de acción, la fisiología relacionada a éstos y la identificación y manejo de complicaciones.
Dependiendo de su indicación, los DAV pueden ser implantados como dispositivos paracorpóreos o extracorpóreos (ubicados fuera del cuerpo del paciente) o de manera intracorpórea, estos últimos pueden ubicarse en el espacio pericárdico o por debajo del diafragma, o pueden ser de tipo percutáneo; independientemente de su forma de implante o su localización, todos los sistemas disponibles en la actualidad presentan controladores externos y fuentes de energía14.
Se los puede clasificar según el soporte que brinden: al ventrículo izquierdo (VI), al ventrículo derecho (VD) o soporte biventricular. En los casos de pacientes con función cardíaca remanente casi nula y bajas probabilidades de recuperación, un corazón artificial total puede ser una opción, reemplazando por completo la función del corazón nativo.
La forma más frecuente de clasificar los DAV es por la duración para su utilización15:
- Corta duración: soporte hemodinámico durante días o semanas.
Percutáneos: Balón de contrapulsación intra-aórtica, IMPELLA®, TANDEM-Heart®.
Quirúrgicos: ECMO-VA, CentriMag.
- Larga duración: soporte hemodinámico que puede extenderse de meses a varios años.
INCOR, EXCOR, HeartMate I, HeartMate II, Heart- Ware, HeartMate III.
Dispositivos de asistencia ventricular izquierda de corta duración
En las últimas décadas, estos dispositivos han ganado lugar en el soporte de pacientes con shock cardiogénico refractario al tratamiento médico; así como durante la realización de procedimientos de alto riesgo, como revascularización percutánea o ablación de arritmias.
Cuando el método de soporte ventricular es elegido y aplicado de manera adecuada, el mismo puede de manera eficaz ayudar como puente a la recuperación, puente al puente o al TC. Estos dispositivos pueden asistir al VI o VD y en algunos casos dar asistencia biventricular. Si bien su indicación más frecuente no es la IC avanzada, éstos pueden ser utilizados de manera segura en el evento agudo de este grupo de pacientes, en su estabilización y ser utilizados hasta la decisión de una terapia más duradera (puente a la decisión o a terapia de destino) o pueden servir para optimizar al paciente previo implante de un dispositivo de larga duración o realización del TC (puente al puente o puente al TC).
1.- Balón de contrapulsación intra-aórtica
Aunque su eficacia en el marco del shock cardiogénico es controversial16, ya sea como un puente a la recuperación o al TC, continúa siendo un tratamiento de amplia utilización por su mayor disponibilidad al compararlo con otros dispositivos de SCM. Su implante es de menor complejidad, menos invasivo y presenta menor riesgo de complicaciones. Puede mejorar la función cardíaca, disminuyendo la poscarga y mejorando la demanda de oxígeno por el miocardio. Su principal desventaja es su incapacidad para reemplazar la función cardiopulmonar, tanto de manera parcial como total.
Consiste en un balón cilíndrico ubicado en la aorta descendente cercano a la arteria subclavia izquierda, conectado a una bomba externa y consola a través de un catéter flexible (Figura 1). El concepto de contrapulsación diastólica consiste en el inflado del balón durante la diástole y su desinflado en la sístole temprana durante la contracción isovolumétrica17, aumentando el flujo de las arterias coronarias y disminuyendo la poscarga del VI, generando disminución del consumo de oxígeno por parte del miocardio, aumento del gasto cardíaco y reducción del estrés parietal.

Figura 1. Representación esquemática del balón de contrapulsación intra-aórtica.
Sus efectos hemodinámicos dependen de: el volumen del balón, los parámetros programados en la consola, posición dentro de la aorta, relación entre el tamaño del balón y la aorta, ritmo y frecuencia cardíaca, por lo que su efecto hemodinámico puede ser variable. Sin embargo, hay suficiente evidencia para asegurar que en pacientes con shock cardiogénico la presión sistólica disminuye el 20%, la presión diastólica aumenta el 30%, la presión media pulmonar desciende el 23% y el gasto cardíaco aumenta entre 20-24%. Mejora la perfusión tisular y disminuye el consumo miocárdico de oxígeno, entre sus efectos más importantes18. Las complicaciones son infrecuentes (0,5%), incluyendo isquemia de miembros inferiores y renal. La mortalidad relacionada a este dispositivo es menor al 0,05%.
2.- Sistema Impella (ABIOMED Inc.)
Se trata de un sistema de flujo axial sobre un catéter, el cual se posiciona a través de la válvula aórtica (Figura 2). El flujo de entrada está localizado en el interior del VI y el de salida en la aorta. De esta manera desprecarga al ventrículo proporcionando un flujo no pulsátil a la aorta ascendente. Existen diversos tipos de Impella: 2.5 (2,5 litros/minuto de flujo), CP (3,5 litros/minuto de flujo), 5.0 (5 litros/minuto de flujo), todos disponibles para su implante percutáneo por vía femoral19. Las contraindicaciones para su implante son grados moderados o severos de estenosis o insuficiencia valvular aórtica, presencia de defectos del septum ventricular, trombo a nivel del VI o enfermedad arterial periférica significativa20.

Figura 2. Representación esquemática del sistema Impella.
Sus complicaciones más frecuentes son la isquemia de miembros, la injuria vascular, el sangrado con requerimiento de transfusión y la hemólisis. Cuando se compararon los perfiles de seguridad de este dispositivo y el balón de contrapulsación intra-aórtica no se evidenciaron diferencias entre ambos21.
3.- Sistema TandemHeart® (Cardiac Assist)
Sistema de bomba centrífuga externa con una cánula con flujo de entrada ubicada de manera transeptal a nivel de la AI y una cánula con flujo de salida a nivel de la arteria femoral (Figura 3). La sangre oxigenada es bombeada de esta manera a nivel de la arteria femoral y puede proveer un gasto cardíaco de 3,5 a 4,5 litros/minuto. El hecho de requerir una punción transeptal aumenta el riesgo y la complejidad del implante. Las complicaciones más frecuentes son: taponamiento cardíaco, isquemia de miembros inferiores, arritmias y persistencia del defecto septal que puede requerir cierre posteriormente22.

Figura 3. Representación esquemática del sistema TandemHeart.
4.- Membrana de oxigenación extracorpórea (ECMO)
Disponible para su utilización desde el año 1972, supliendo la función tanto cardíaca como pulmonar, dado por el hecho de que la sangre no oxigenada es extraída del organismo mediante un sistema de cánulas y luego de su paso por un oxigenador es devuelta a la circulación sistémica. Este oxigenador es un dispositivo intercambiador de gases que de manera directa oxigena, mientras remueve el dióxido de carbono sanguíneo. El flujo sanguíneo es generado por una bomba centrífuga con alta velocidad
de la sangre, generando el mínimo trauma posible de los componentes sanguíneos20, aportando un flujo continuo, no pulsátil de hasta 3,5-4,5 litros/ minuto y oxigenación extracorpórea.
Si la sangre es extraída desde una vena central y devuelta al sistema venoso, el proceso es denominado ECMO veno-venoso (ECMO-VV); mientras que si la sangre es extraída desde el sistema venoso y devuelta al sistema arterial, esto se denomina ECMO veno-arterial (ECMO-VA). El primer caso provee un soporte respiratorio, únicamente; mientras que el segundo es utilizado para soporte cardio-respiratorio y es utilizado en situaciones como el shock cardiogénico (Figura 4). Sus complicaciones más frecuentes son: hemorragias mayores, accidente cerebrovascular, fenómenos embólicos, infecciones y disfunción multiorgánica (Tabla 2):
- ECMO-VA: la canulación para este modo de DAV puede realizarse de manera central o periférica. Con la canulación central la sangre es drenada directamente de la AD y devuelta a la aorta ascendente, mientras que con la canulación periférica el flujo sanguíneo se drena del sistema venoso (vena femoral o yugular) de manera quirúrgica o por técnica de Seldinger y devuelta a la circulación arterial por canulación de la arteria carótida, axilar o femoral23.
- ECMO-VV: de preferencia para soporte pulmonar parcial o total en el manejo de la insuficiencia respiratoria severa con función cardíaca conservada. Ambas cánulas, de drenaje y de retorno se ubican en el sistema venoso.

Figura 4. Representación esquemática del sistema de membrana de oxigenación extracorpórea: ECMO-AV y ECMO-VV23.
Tabla 2. Diferencias entre modalidades de ECMO

5.- CentriMag®
Es una bomba centrífuga extracorpórea, de implante quirúrgico, que puede proveer hasta 10 litros/minuto de flujo sanguíneo (Figura 5). Es una bomba continua de tercera generación con un rotor suspendido magnéticamente. Tiene una fricción mínima por lo que reduce la fuerza de cizallamiento entre glóbulos rojos y su hemólisis. Se halla aprobada su utilización como soporte al VI y VD, colocando una cánula con flujo de entrada a nivel de la AI o AD y con la cánula de salida a nivel de la aorta o arteria pulmonar respectivamente25.

Figura 5. Representación del CentriMag.
En la Tabla 3 se resumen las contraindicaciones y complicaciones de los DAV de corta duración.
Tabla 3. Dispositivos de asistencia ventricular de corta duración

Dispositivos de asistencia ventricular de larga duración
Definiciones
Las siguientes definiciones son importantes para entender el funcionamiento y programación de los diferentes dispositivos disponibles en la actualidad:
- Velocidad de la bomba (revoluciones por minuto): determinan la velocidad del flujo de la bomba, se programa en cada dispositivo en función del paciente y a criterio médico.
- Flujo de la bomba (litros/minuto): el flujo del dispositivo es directamente proporcional a la velocidad del rotor e inversamente proporcional a la diferencia de presiones entre las cánulas de entrada y salida de la bomba; por lo que en adición a una disminución de las revoluciones por minuto, una disminución del flujo puede estar causada por varias condiciones que disminuyan la precarga del DAV (disminución del volumen intravascular, fallo del VD, taponamiento, obstrucción de la cánula de entrada).
- Poder de la bomba (pump power): es una medida de la energía y voltaje aplicado al motor, varía con la velocidad y el flujo de la misma.
- Índice de pulsatibilidad: corresponde a la magnitud del flujo a través de la bomba, nos da una aproximación de cuanto está colaborando el VI al flujo generado. Fluctúa con cambios en los volúmenes y de la contractilidad cardíaca, a mayor índice de pulsatibilidad mayor es la precarga o la contractilidad del ventrículo.
Tipos de dispositivos
Los DAV actualmente disponibles se han clasificado en tres generaciones en función del orden en que han sido desarrollados y el tipo de mecanismo de bombeo que utilizan:
1.- Dispositivos de primera generación o de flujo pulsátil: fueron los primeros en desarrollarse, también llamadas bombas de desplazamiento positivo. Se caracterizaron por su gran tamaño para pacientes de superficie corporal mediana y por presentar en su diseño diferentes partes expuestas al riesgo de falla mecánica (válvulas, conductos de entrada y salida, etc.). Eficaces para vaciar el VI y mantener una circulación sistémica con capacidad de bombeo de hasta 10 litros/minuto. Ejemplos de estos DAV son: HeartMate I o XVE y Novacor VAD. Se los implanta de manera quirúrgica a nivel abdominal en un bolsillo bajo el músculo recto del abdomen o de manera preperitoneal y son conectados al VI y a la aorta ascendente26. En la mayoría de los estudios en que fueron evaluados la duración máxima de soporte no ha superado los 6 meses, la mayoría oscilando entre 50-60 días27.
2.- Dispositivos de segunda generación o de flujo continuo (axial): mucho más pequeños, de mayor duración y menor complejidad para su implante en comparación con los de primera generación. Ejemplos de estos dispositivos son: HeartMate 2 VAD (Thoratec Inc.), Jarvik 2000 (Jarvik Heart Inc., New York), Micromed Debakey VAD and Berlin Heart Incor (Berlin Heart AG). La única parte móvil del DAV es el rotor, por lo que su durabilidad es mayor. Su utilización requiere de doble terapia antiagregante plaquetaria y anticoagulante. El HeartMate 2 es el DAV de segunda generación mayormente colocado, aprobado por la FDA como puente al trasplante en 2008 y como terapia de destino en 2010.
3.- Dispositivos de tercera generación o de flujo continuo (centrífugo): son DAV de pequeño tamaño en los cuales el rotor está suspendido de manera magnética. Ejemplos de este grupo de dispositivos son HeartWare y HeartMate III. Ambos son de implante intrapericárdico por lo que no es necesaria la realización de un bolsillo abdominal o pre-peritoneal.
La Tabla 4 describe las características de los DAV de larga duración y la Figura 6 muestra una representación esquemática de los diferentes DAV de larga duración.
Tabla 4. Características de los DAV de larga duración


Figura 6. Representación esquemática de los dispositivos de asistencia ventricular de larga duración: a. HeartMate II LVAD (Thoratec Corp). b. HeartWare LVAD (HeartWare Inc.). c. Corazón total artificial SynCardia. d. INCOR (Berlin Heart; Berlin, Alemania). e. Jarvik 2000. f. HeartMate III (Thoratec Corp).
Selección del paciente
Los pacientes candidatos a SCM son aquellos con IC avanzada definida previamente. Esta definición abarca un espectro amplio de pacientes con diferentes presentaciones clínicas, gravedad y pronóstico, es por ello que el grupo INTERMACS ha desarrollado una clasificación en 7 estadios para subclasificar a estos pacientes (Tabla 5).
Tabla 5. Clasificación en 7 estadios de pacientes. Descripciones de perfil de INTERMACS
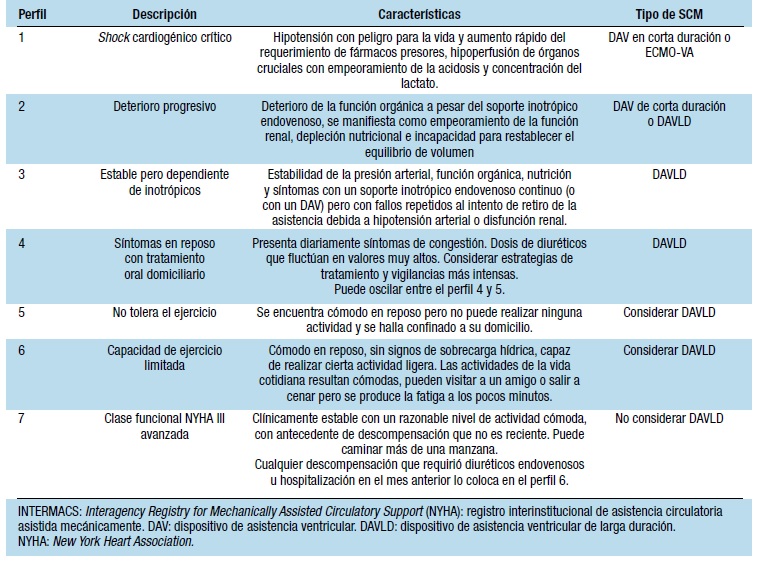
En los pacientes con un perfil INTERMACS 1 y 2, el implante de DAV de larga duración debe ser evitada por su baja supervivencia; en su lugar deben considerarse dispositivos de corta duración. El grupo INTERMACS 3 son los pacientes que más beneficio obtienen de los DAV de larga duración.
Con respecto a los pacientes con IC ambulatoria y no dependiente de terapia con inotrópicos (perfil de INTERMACS â¥4), el ROADMAP28 evaluó la terapia de DAV de larga duración en comparación con el tratamiento médico óptimo. Se evidenció una mejoría de la supervivencia y del estatus funcional al año de seguimiento en los pacientes tratados con asistencia ventricular; sin embargo, los eventos adversos fueron el doble en este grupo de tratamiento.
El score de riesgo HeartMate II fue desarrollado para predecir el riesgo de pacientes candidatos al implante de este DAV de larga duración, ya sea como terapia de destino o como puente al TC. Se identificaron a variables como: hipoalbuminemia, fallo renal, experiencia del centro donde se lleve a cabo el implante y la edad del paciente como factores de riesgo para mortalidad a 90 días29.
En el octavo reporte anual del INTERMACS, se han reportado más de 20.000 pacientes con implante de DAV de larga duración de más de 180 hospitales30. Con una tasa de implante de 2.500 dispositivos por año. De los 18.987 DAV al VI implantados, más del 90% han sido de tipo continuo.
Desde 2013, bombas tanto centrífugas como axiales, han sido utilizadas. Aproximadamente el 50% de los dispositivos son implantados como terapia de destino, el 26% lo representan pacientes en lista de espera para TC y el 23% pacientes en estrategia de puente a la candidatura. El porcentaje de pacientes con implante de DAV durante un cuadro de shock cardiogénico se ha estabilizado en un 14-16% desde el año 2008, la mayor proporción la constituyen pacientes con perfil 3 (estables pero con requerimiento de inotrópicos) representando el 38% del total de los implantes. Los perfiles 4 a 7 (considerados IC ambulatoria) han disminuido a un 12,8% del total de implantes (Tabla 5).
Evidencia clínica
Los DAV de larga duración fueron evaluados inicialmente como puente al TC en los pacientes en listas de espera, a medida que los dispositivos se volvieron más duraderos, portátiles, más sencillos de programar su aplicación como terapia de destino se ha vuelto cada vez más frecuente.
En la Tabla 6 se resumen los principales estudios clínicos que han evaluado la supervivencia en estos dispositivos31.
Tabla 6. Estudios clínicos publicados sobre los dispositivos de asistencia ventricular izquierda

El estudio REMATCH11 publicado en 2001 fue la piedra angular para establecer el beneficio del tratamiento con DAV de larga duración en pacientes con IC avanzada, aunque este estudio demostró una mejoría en la supervivencia, la durabilidad y tasa de complicaciones asociadas al HeartMate XVE fue subóptima. Estudios realizados posteriormente con dispositivos de flujo continuo (Heart- Mate II y HeartWare) demostraron un claro beneficio en la supervivencia a un año32-34. La expansión de la indicación como terapia de destino se inició en 2010 con la aprobación del HeartMate II por la FDA y desde 2012 el número de implante con esta finalidad ha superado a la indicación de puente al TC30. La evidencia más reciente con el dispositivo de tercera generación (HeartMate III) fue reportada de 10 centros de Europa, Australia y Canadá, en un estudio prospectivo, no randomizado. En esta experiencia inicial en 50 pacientes, los investigadores reportaron una supervivencia libres de stroke o de necesidad de cambio de dispositivo del 92%35. Actualmente, se está llevando a cabo el estudio que compara la no inferioridad de HeartMate III con HeartMate II como puente al trasplante o como terapia de destino.
Complicaciones de los DAV de larga duración
Trombosis del DAV
En estos pacientes, una de las causas de estado de bajo gasto cardíaco es la trombosis del dispositivo, que ocurre en aproximadamente el 8% de los DAV de flujo continuo implantados36, obstruyendo tanto la cánula de entrada como la de salida. La trombosis puede originarse en el mismo dispositivo o ser arrastrado desde otro lugar hasta el interior del mismo37. Este cuadro puede darse aun en pacientes que se hallan correctamente anticoagulados y antiagregados por el estado de crónico de hipercoagulabilidad que generan los DAV. La trombosis del dispositivo puede manifestarse como un cuadro de shock cardiogénico y a la auscultación cardíaca pueden identificarse ruidos ásperos generados por el trombo en el dispositivo. A nivel del laboratorio, se puede evidenciar aumento de los niveles de LDH por la intensa hemólisis que esto genera. La radiografía de tórax puede poner de manifiesto una malposición de las cánulas de entrada o salida, o signos de congestión pulmonar, acompañando el cuadro de IC descompensada. En el ecocardiograma Doppler, la presencia de dilatación del VI, la presencia de insuficiencia mitral severa y la apertura frecuente de la válvula aórtica indican una descarga subóptima y deben hacer sospechar este diagnóstico38. Para su tratamiento se puede considerar la optimización del tratamiento anticoagulante, la terapia fibrinolítica, el reemplazo del dispositivo o el TC de manera urgente.
Fallo agudo de ventrículo derecho
Ocurre en el 5-10% de los pacientes luego del implante de un DAV de larga duración39. Los elementos de sospecha en el ecocardiograma Doppler incluyen la dilatación de cavidades derechas y deterioro de la función sistólica, la presencia de insuficiencia tricuspídea y disminución de la excursión del anillo tricuspídeo. Mientras que en el cateterismo cardíaco derecho se manifiesta como un aumento de las presiones pulmonares y presión venosa central con una presión de oclusión de la arteria pulmonar normal. Para su manejo, el inicio de fármacos inotrópicos como dobutamina, milrinona o norepinefrina es frecuente. Si el tratamiento farmacológico no logra la mejoría del cuadro se debe considerar el implante de DAV de corta duración derecha como Impella RP o TandemHeart, hasta la recuperación o como puente al implante de asistencia de larga duración al VD40.
Sangrado gastrointestinal
La incidencia reportada de esta complicación es del 22 al 40%41. Se ha postulado que las causas de esta frecuente complicación son las alteraciones en los patrones de flujo sanguíneo, especialmente con los dispositivos de flujo continuo y la deficiencia adquirida del factor de Von Willebrand. La apertura mínima o nula de la válvula aórtica genera en estos pacientes patrones similares a los observados en aquellos con estenosis aórtica severa (síndrome de Heyde), provocando curvas de pulso anormales, hipoperfusión intestinal, distensión de los plexos venosos submucosos del tracto gastrointestinal, llevando a la angiodisplasia, malformaciones arteriovenosas y sangrado.
Infección y sepsis
Los dispositivos de flujo continuo tienen una tasa menor de infecciones en comparación con los pulsátiles; a pesar de esto, las tasas de infección constituyen una complicación frecuente (30-50% de los dispositivos implantados)42. Los pacientes con el DAV, por indicación como terapia de destino, tienen mayor frecuencia de infecciones que por puente para TC, dado que tienden a tener más edad, estado de la enfermedad más avanzado y duración más prolongada de asistencia ventricular. El diagnóstico y manejo de sepsis se realiza con los mismos criterios e indicaciones que para la población general.
Conclusiones
El TC continúa siendo el mejor tratamiento disponible para pacientes con IC avanzada; sin embargo, debido a la escasez de donantes y las largas listas de espera a nivel mundial, el desarrollo y la utilización cada vez mayor de DAV ha mejorado la supervivencia a corto y largo plazo, dada la calidad de vida de pacientes con esta grave afección, generando una reducción progresiva de la tasa de complicaciones. Estos beneficios no sólo aportan una alternativa a pacientes que esperan un TC, sino que permiten a aquellos con contraindicaciones reversibles a disponer del tiempo y la oportunidad de convertirse en candidatos adecuados, o en caso de que esto no sea posible, su final utilización como terapia de destino. Aun así, son muchas las limitaciones de estos dispositivos: su costo, su durabilidad, la tasa de complicaciones y su aplicación a un espectro limitado de pacientes. El avance en la tecnología para paliar las complicaciones, la mayor experiencia en los centros de manejo y su generalización para permitir un costo más reducido son estrategias que permitirán que la utilización de DAV en los pacientes con IC avanzada se continúe afianzando.
Recursos financieros
La autora no recibió ningún apoyo económico para la investigación.
Conflicto de intereses
La autora declaró no tener conflicto de intereses.
1. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Eur J Heart Fail 2016;18:891-975. [ Links ]
2. Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2013;62: e147-e239. [ Links ]
3. Metra M, Ponikowski P, Dickstein K, et al. Advanced chronic heart failure: A position statement from the Study Group on Advanced Heart Failure of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail 2007;9:684-694. [ Links ]
4. Lund LH, Edwards LB, Kucheryavaya AY, et al. The Registry of the International Society for Heart and Lung Transplantation. Thirty-second Official Adult Heart Transplantation Report-2015. J Heart Lung Transplant 2015;34:1244-1254. [ Links ]
5. Gonzalez-Vilchez F, Segovia Cubero J, Almenar L, et al. Spanish Heart Transplantation Registry. 26th Official Report of the Spanish Society of Cardiology Working Group on Heart Failure and Heart Transplantation (1984-2014). Rev Esp Cardiol 2015;68:1008-1021. [ Links ]
6. Gibbon JH Jr. Application of a mechanical heart and lung apparatus to cardiac surgery. Minn Med 1954;37:171-185. [ Links ]
7. Liotta D, Hall CW, Henly WS, Cooley DA, Crawford ES, DeBakey ME. Prolonged assisted circulation during and after cardiac or aortic surgery prolonged partial left ventricular bypass by means of intracorporeal circulation. Am J Cardiol 1963;12:399-405. [ Links ]
8. DeBakey ME. Left ventricular bypass pump for cardiac assistance. Clinical experience. Am J Cardiol 1971;27:3-11. [ Links ]
9. Cooley DA, Liotta D, Hallman GL, Bloodwell RD, Leachman RD, Milam JD. Orthotopic cardiac prosthesis for two-staged cardiac replacement. Am J Cardiol 1969;24:723-730. [ Links ]
10. Portner PM, Oyer PE, Pennington DG, et al. Implantable electrical left ventricular assist system: bridge to transplantation and the future. Ann Thorac Surg 1989;47:142-150. [ Links ]
11. Rose EA, Gelijns AC, Moskowitz AJ, Heitjan DF, Stevenson LW, Dembitsky W, et al. Long-term use of a left ventricular assist device for end-stage heart failure. N Engl J Med 2001;345:1435-43. [ Links ]
12. Slaughter MS, Rogers JG, Milano CA, Russell SD, Conte JV, Feldman D, et al. Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med 2009;361:2241-51. [ Links ]
13. Pagani FD, Miller LW, Russell SD, Aaronson KD, John R, Boyle AJ, et al. Extended mechanical circulatory support with a continuous-flow rotary left ventricular assist device. J Am Coll Cardiol 2009;54:312-21. [ Links ]
14. Sen A, Larson JS, Kashani KB, et al. Mechanical circulatory assist devices: a primer for critical care and emergency physicians. Critical Care 2016;20:153. [ Links ]
15. Sanchez-Enrique C, Jorde UP, Gonzalez-Castello J. Heart Transplant and Mechanical Circulatory Support in Patients With Advanced Heart Failure. Rev Esp Cardiol 2017;70:371-81. [ Links ]
16. Thiele H, Zeymer U, Neumann FJ, et al. Intraaortic balloon support for myocardial infarction with cardiogenic shock. N Engl J Med 2012;367:1287-96. [ Links ]
17. Capoccia M, Bowles CT, Pepper JR, et al. Evidence of clinical efficacy of counter pulsation therapy methods. Heart Fail Rev 2015; 20(3):323-35. [ Links ]
18. Khir AW, Price S, Henein MY, et al. Intra-aortic balloon pumping: effects on left ventricular diastolic function. Eur J Cardiothorac Surg 2003; 24:277-282. [ Links ]
19. Takayama H, Truby L, Takeda K, et al. Short-Term Ventricular Assist Devices: Implantable and Percutaneous. Curr Surg Rep 2014; 2:58. [ Links ]
20. Gilani FS, Farooqui S, Doddamani R, et al. Percutaneous Mechanical Support in Cardiogenic Shock: A Review. Clinical Medicine Insights: Cardiology 2015:9(S2) 23-28. [ Links ]
21. Boudoulas KD, Pederzolli A, Saini U, et al. Comparison of Impella and intraaortic balloon pump in high-risk percutaneous coronary intervention: vascular complications and incidence of bleeding. Acute Card Care 2012;14(4):120-4. [ Links ]
22. Naidu SS. Novel percutaneous cardiac assist devices: the science of and indications for hemodynamic support. Circulation 2011; 123(5):533-43. [ Links ]
23. Sidebotham D, McGeorge A, McGuinness S, Edwards M, Willcox T, Beca J. Extracorporeal membrane oxygenation for treating severe cardiac and respiratory failure in adults: part 2-technical considerations. J Cardiothorac Vasc Anesth 2010;24(1):164-72. [ Links ]
24. Cove ME, MacLaren G. Clinical review: MCS for cardiogenic shock complicating acute myocardial infarction. Crit Care 2010;14:235. [ Links ]
25. Gilotra NA, Stevens GR. Temporary Mechanical Circulatory Support: A Review of the Options, Indications, and Outcomes. Clinical Medicine Insights: Cardiology 2014;8(S1):75-85. [ Links ]
26. Patel ND, Weiss ES, Schaffer J, Ullrich SL, Rivard DC, Shah AS, et al. Right heart dysfunction after left ventricular assist device implantation: a comparison of the pulsatile HeartMate I and axial-flow HeartMate II devices. Ann Thorac Surg 2008;86(3):832-840. [ Links ]
27. Frazier OH, Rose EA, Oz MC, et al. Multicenter clinical evaluation of the HeartMate vented electric left ventricular assist system in patients awaiting heart transplantation. J Thoracic Cardiovasc Surg 2001;122: 1186-1195. [ Links ]
28. Estep JD, Starling RC, Horstmanshof DA, et al. Risk Assessment and Comparative Effectiveness of Left Ventricular Assist Device and Medical Management in Ambulatory Heart Failure Patients: Results from the ROADMAP Study. J Am Coll Cardiol 2015;66:1747-1761. [ Links ]
29. Cowger J, Sundareswaran K, Rogers JG, et al. Predicting survival in patients receiving continuous flow left ventricular assist devices: the HeartMate II risk score. J Am Coll Cardiol 2013;61: 313-321. [ Links ]
30. Kirklin JK, Pagani FD, Kormos RL, et al. Eighth annual INTERMACS report: Special focus on framing the impact of adverse events. J Heart Lung Transplant 2017;36:1080-1086. [ Links ]
31. Mancini D, Colombo PC. Left Ventricular Assist Devices. J Am Coll Cardiol 2015;65:2542-65. [ Links ]
32. Slaughter MS, Rogers JG, Milano CA, et al., for the HeartMate II Investigators. Advanced heart failure treated with continuousflow left ventricular assist device. N Engl J Med 2009; 361:2241-51. [ Links ]
33. Miller LW, Pagani FD, Russell SD, et al., for the HeartMate II Clinical Investigators. Use of a continuous-flow device in patients awaiting heart transplantation. N Engl J Med 2007;357:885-96. [ Links ]
34. Aaronson KD, Slaughter MS, Miller LW, et al., for the HeartWare Ventricular Assist Device (HVAD) Bridge to Transplant ADVANCE Trial Investigators. Use of an intrapericardial, continuous flow, centrifugal pump in patients awaiting heart transplantation. Circulation 2012;125:3191-200. [ Links ]
35. Netuka I, Sood P, Pya Y, et al. Fully magnetically levitated left ventricular assist system for treating advanced HF: a multicenter study. J Am Coll Cardiol 2015;66:2579-89. [ Links ]
36. Mehra MR, Stewart GC, Uber PA. The vexing problem of thrombosis in longterm mechanical circulatory support. J Heart Lung Transplant 2014;65(1):1-11. [ Links ]
37. Najjar SS, Slaughter MS, Pagani FD, et al. An analysis of pump thrombus events in patients in the HeartWare ADVANCE bridge to transplant and continued access protocol trial. J Heart Lung Transplant 2014;33(1):23-34. [ Links ]
38. Adatya S, Masri C, John R, Eckman P. Loading conditions influence reliability of the echocardiographic ramp test in continuous-flow left ventricular assist devices. J Heart Lung Transplant 2013;32(11):1142-4. [ Links ]
39. Morgan JA, Paone G, Nemeh HW, et al. Impact of continuousflow left ventricular assist device support on right ventricular function. J Heart Lung Transplant 2013;32(4): 398-403. [ Links ]
40. Goldstein JA, Kern MJ. Percutaneous mechanical support for the failing right heart. Cardiol Clin 2012;30(2):303-10. [ Links ]
41. Morgan JA, Paone G, Nemeh HW, et al. Gastrointestinal bleeding with the HeartMate II left ventricular assist device. J Heart Lung Transplant 2012;31(7):715-8. [ Links ]
42. Nienaber J, Wilhelm MP, Sohail MR. Current concepts in the diagnosis and management of left ventricular assist device infections. Expert Rev AntiInfect Ther 2013;11(2):201-10. [ Links ]














