Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Insuficiencia cardíaca
versión On-line ISSN 1852-3862
Insuf. card. vol.14 no.3 Ciudad Autónoma de Buenos Aires set. 2019
ARTICULO DE ACTUALIZACION
Manejo de la frecuencia cardíaca en la insuficiencia cardíaca
José Luis Barisani1
1Médico cardiólogo. Jefe de Unidad Coronaria del Instituto Cardiovascular Adventista. Clínica Adventista Belgrano. Buenos Aires. República Argentina. Coordinador del Írea de Insuficiencia Cardíaca. Hospital Presidente Perón. Avellaneda. Buenos Aires. República Argentina. Delegado por la Sociedad Argentina de Cardiología en el Consejo Interamericano de Falla Cardíaca e Hipertensión Pulmonar. Sociedad Interamericana de Cardiología.
Correspondencia: Dr. José Luis Barisani. E-mail: jlbarisani@gmail.com
Recibido: 10/06/2019
Aceptado: 30/07/2019
Resumen
La asociación entre el aumento de la frecuencia cardíaca (FC) y eventos cardiovasculares está bien establecida para la población general, así como en todas las cardiopatías. En la insuficiencia cardíaca con fracción de eyección reducida y ritmo sinusal, la FC es un factor de riesgo modificable. Su reducción a valores que han demostrado mejorar el pronóstico debe ser un objetivo terapéutico. Se discute cuál debe ser el valor óptimo de FC en los enfermos con insuficiencia cardíaca crónica y en la fase vulnerable del paciente hospitalizado por falla cardíaca aguda. El sinergismo entre los betabloqueantes y la ivabradina puede resultar una alternativa terapéutica útil en estos casos. En los pacientes con fibrilación auricular, en cambio, no hay evidencias concluyentes que demuestren cambios evolutivos con el control de la FC.
Insuf Card 2019;14(3):88-95
Palabras clave: Insuficiencia cardíaca; Frecuencia cardíaca; Betabloqueantes; Ivabradina; Fase vulnerable; Fibrilación auricular
Summary
Management of heart rate in heart failure
The association between increased heart rate (HR) and cardiovascular events is well known for the general population, as for all heart diseases. In heart failure with reduced ejection fraction and sinus rhythm, HR is a modifiable risk factor. Its reduction to values that have been shown to improve prognosis should be a therapeutic objective. We discuss what the optimal HR value should be in patients with chronic heart failure and in the vulnerable phase of the hospitalized patient for acute heart failure. The synergism between beta-blockers and ivabradine can be a useful therapeutic option in these cases. In patients with atrial fibrillation, however, there is no conclusive evidence demonstrating evolutionary changes with the HR control.
Keywords: Heart failure; Heart rate; Beta-blockers; Ivabradine; Vulnerable phase; Atrial fibrillation
Resumo
Manejo da frequência cardíaca na insuficiência cardíaca
A associação entre aumento da frequência cardíaca (FC) e eventos cardiovasculares está bem estabelecida para a população em geral, bem como para todas as doenças cardíacas. Na insuficiência cardíaca com fração de ejeção reduzida e ritmo sinusal, a FC é um fator de risco modificável. Sua redução para valores que demonstraram melhorar o prognóstico deveria ser um objetivo terapêutico. Discutimos qual deve ser o valor ideal da FC em pacientes com insuficiência cardíaca crônica e na fase vulnerável do paciente hospitalizado por insuficiência cardíaca aguda. O sinergismo entre betabloqueadores e ivabradina pode ser uma alternativa terapêutica útil nesses casos. Em pacientes com fibrilação atrial, no entanto, nãoháevidências conclusivas que demonstrem mudanças evolutivas com o controle da FC.
Palavras-chave: Insuficiência cardíaca; Frequência cardíaca; Betabloqueadores ; Ivabradina ; Fase vulnerável; Fibrilação atrial
Introducción
Un ratón tiene una frecuencia cardíaca (FC) de reposo de 600 latidos por minuto (lpm) y vive sólo un par de años, mientras que una tortuga de galápagos con una FC de 6 a 8 lpm llega a vivir 200 años. En realidad, casi todas las especies se gastan unos mil millones de latidos en la vida, pero unos lo hacen en menos tiempo que otros1. Esta observación motivó el estudio del comportamiento de la FC en el ser humano, el cual es similar al del resto del reino animal, aunque llegando aproximadamente al triple de latidos en la vida. La primera demostración del vínculo entre FC elevada y mortalidad en la población sana fue hace más de 70 años, cuando en 1942, en el contexto de la segunda guerra mundial, una investigación estudió a 22.000 oficiales enrolados en la Armada de Estados Unidos e informó que la presencia de taquicardia transitoria es un marcador de riesgo cardiovascular (CV)2. Posteriormente, el estudio de Framingham mostró, también en la población supuestamente sana, que la mortalidad global aumenta en un 14% por cada aumento de 10 lpm en la FC de reposo3. La asociación entre el aumento de la FC y eventos CV está bien establecida para la población general, así como en pacientes con enfermedad cerebrovascular, renal, pulmonar, sepsis, cáncer y casi todas las enfermedades CV. Cuando no hay disfunción ventricular, el umbral para aumentar el riesgo es de aproximadamente 78-85 lpm4,5. De esta manera, podemos afirmar que la FC es un importante predictor de riesgo de mortalidad CV. Sin embargo, el papel de la reducción selectiva de la FC sigue sin estar claro en estos pacientes, ya que el beneficio potencial de las intervenciones para lograrlo no se ha explorado o no ha podido demostrar mejoría de resultados. En pacientes con enfermedad coronaria, la FC es un marcador de riesgo bien demostrado. Una reducción de FC podría impactar favorablemente sobre los eventos CV, mejorando la función endotelial, retrasando la progresión de la aterosclerosis y previniendo la ruptura de placa, a la vez que podría reducir la rigidez aórtica6,7. Sin embargo, en la cardiopatía isquémica estable sin insuficiencia cardíaca (IC), la reducción farmacológica de la FC no proporciona beneficios sobre la mortalidad; sino sólo alivio de los síntomas, reducción de la incidencia de infarto y de la necesidad de revascularización8. Tampoco se pudo demostrar beneficios en pacientes con IC, pero sin disfunción sistólica del ventrículo izquierdo (VI)9.
Frecuencia cardíaca como predictor de riesgo en la insuficiencia cardíaca
Al ser expresión de activación neurohormonal, la FC juega un papel fisiopatológico importante en el desarrollo de IC. El mejor ejemplo es la miocardiopatía inducida por taquicardia (taquimiocardiopatía), una entidad bien conocida que confirma los mecanismos fisiopatológicos de la FC elevada, tanto en modelos animales como en estudios clínicos. La activación continua y persistente del sistema nervioso autónomo no sólo conduce a injuria miocárdica, sino también a efectos sistémicos en detrimento de los vasos sanguíneos, músculos y riñones. Cuando la IC ya está instalada, una FC en reposo elevada puede causar mayor disfunción miocárdica. La regulación en baja (down-regulation) de los receptores beta-adrenérgicos, la alteración de la homeostasis del calcio intracelular y del acoplamiento excitación-contracción, son algunos de los mecanismos que profundizan la disfunción miocárdica5. En el estudio BEAUTIFUL, realizado en pacientes con enfermedad coronaria y disfunción del VI, cuando la FC basal superó los 70 lpm, el riesgo de mortalidad CV aumentó en un 34% y las hospitalizaciones por IC en un 54%, en comparación con pacientes con menor FC10. En la IC, el valor pronóstico de la FC basal quedó bien establecido en el análisis del brazo placebo del estudio SHIFT11. En este estudio, en pacientes con miocardiopatía isquémica y no isquémica, por cada aumento de un latido en la FC de reposo se observó un aumento de casi el 3% en el punto final combinado (muerte CV u hospitalización por IC), que llega al 16% por cada incremento de 5 latidos (Figura 1)12. Un estudio más reciente confirmó, después de ajustar por las comorbilidades, que cada aumento de 5 lpm en FC conlleva un 14% de aumento del riesgo de mortalidad y 10% más ingresos hospitalarios por empeoramiento de la IC13.
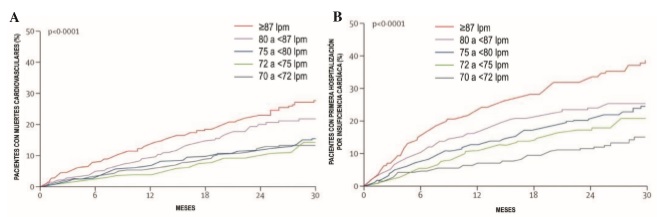
Figura 1. Riesgo de muerte por causas cardiovasculares (A) y de hospitalización por insuficiencia cardíaca (B) según la frecuencia cardíaca basal de reposo en el grupo placebo del estudio SHIFT. Modificado de BͶhm M, y col.11
Reducción de la frecuencia cardíaca en la insuficiencia cardíaca
Numerosos estudios han demostrado que en pacientes con IC y fracción de eyección (FE) reducida, la reducción relativa de la mortalidad guarda una relación directa con la modificación de la FC después de iniciado el tratamiento14. La reducción de la FC aumenta la duración de la diástole y, consecuentemente, la perfusión miocárdica. Por otra parte, se reducen las necesidades de energía del miocardio, mejora la disponibilidad de fosfatos de alta energía y su metabolismo, disminuye la vasoconstricción y reduce la producción de citoquinas y radicales libres. Esto a la vez mejora la isquemia local, el remodelado del VI, la relación fuerza-frecuencia y el inotropismo miocárdico15. El primer ensayo clínico que sugirió que la reducción farmacológica de la FC era beneficiosa en la IC, fue el estudio GESICA realizado en Argentina hace más de 20 años. En él se evidenció diferencias de supervivencia en pacientes con IC, según la FC basal menor o mayor a 90 lpm, y su reducción con amiodarona16. Los betabloqueantes (BB) tienen indicación en los pacientes con IC con FE reducida por haber demostrado reducir significativamente la mortalidad y las hospitalizaciones y mejorar el remodelado ventricular y la capacidad de ejercicio. Su efecto beneficioso está relacionado con muchos de los mecanismos derivados del bloqueo simpático, pero sobretodo con su capacidad de reducir la FC. Varios metaanálisis indican que la disminución de la FC es más importante que la dosis de los BB. Una reducción de la FC en 5 lpm, lograda con la titulación de los BB, proporciona una disminución en el riesgo de mortalidad del 14%17,18. La ivabradina es un agente reductor de la FC que actúa específicamente sobre la corriente If de las células del nódulo sinusal sin afectar otras corrientes iónicas cardíacas. No produce hipotensión, vasoconstricción coronaria, ni efectos inotrópicos negativos y demostró efectos beneficiosos sobre la remodelación cardíaca, la densidad capilar y la disfunción del VI15. De esta manera, al ser un agente que produce reducción exclusiva de la FC sin afectar la contractilidad, preserva el volumen minuto cardíaco a expensas del aumento del volumen sistólico. Un análisis ecocardiográfico confirmó que, después de un período de 8 meses, los pacientes que recibieron ivabradina, presentaron reducción del volumen ventricular telediastólico y mejoría de la FE con una significativa inhibición de la remodelación cardíaca19. El estudio SHIFT informó que, en pacientes sintomáticos por IC crónica con FE reducida y con ritmo sinusal, una FC superior a 70 lpm aumenta el riesgo de morbimortalidad y que la reducción de la FC en 11 lpm, obtenida con ivabradina, redujo significativamente el punto final primario de hospitalización por IC y muerte CV11. Este ensayo ha demostrado que la FC en la IC es un factor de riesgo modificable, ya que, a través de su disminución, se redujo la morbimortalidad. Hubo una asociación directa entre la FC inicial y los resultados. La subpoblación del SHIFT con FC basal â¥75 lpm tenía aún mayor riesgo de muerte y de ingreso hospitalario por IC. En estos enfermos, la ivabradina redujo significativamente todos los criterios de valoración primarios y secundarios, incluida la muerte total y la muerte CV12. La asociación de BB con ivabradina ha demostrado un efecto sinérgico con mayor efectividad que el uso aislado de cualquiera de los dos. En el SHIFT, casi todos los pacientes recibían ambos fármacos. En el estudio CARVIVA-HF se evidenció una mayor tolerancia al ejercicio y mejoría en la calidad de vida en pacientes con IC que recibieron una combinación de carvedilol e ivabradina20. Este efecto se podría explicar por el hecho de que los BB pueden incrementar la vasoconstricción coronaria por acción indirecta alfa-adrenérgica, lo que no sucede con ivabradina. En forma similar, Bagriy y col. encontraron que la adición de ivabradina en pacientes con IC crónica permite una mayor titulación de los BB, incrementa la capacidad de ejercicio y la FE del VI21.
¿A qué FC debemos llevar a los pacientes con insuficiencia cardíaca crónica?
El objetivo reconocido en los pacientes con IC, FE deteriorada y ritmo sinusal es el de lograr una FC de reposo â¤70 lpm. Quedaría por dilucidar cuál es la FC, por debajo de ésta, con la que se logran los mejores beneficios. Entre los 7.599 pacientes inscriptos en el programa CHARM se encontró una relación flexible entre la FC en reposo en cualquier visita y el riesgo de desarrollar muerte CV u hospitalización por IC22. En los pacientes con ritmo sinusal, cualquier aumento de 10 lpm en la FC, se asoció con un riesgo del 8% de mortalidad por todas las causas. Después de ajustar los predictores de mal pronóstico, los pacientes en el tercilo de FC más alta (80-91 lpm) tuvieron peores resultados en comparación con los del grupo de FC más baja (57-64 lpm). Esta relación entre la FC y los resultados fue similar en todas las categorías de FE (reducida y preservada) y no resultó influenciada por el uso de BB. Sin embargo, en los pacientes con fibrilación auricular (FA), esta relación no tenía valor predictivo22. En un subanálisis de la población del CHARM, se observó que no sólo la FC basal en reposo, sino también el cambio con respecto a la visita anterior es un potente predictor de malos resultados en una amplia población de pacientes con IC crónica con FE conservada o reducida. Hay una relación casi lineal donde cualquier aumento en la FC desde la consulta anterior aumenta significativamente el riesgo de morbimortalidad y, por el contrario, una disminución de la FC desde la visita previa reduce el riesgo23. El valor predictivo de los cambios en la FC se ve reforzado por el hecho de que persiste incluso después de la introducción o el ajuste de la dosis de los BB (Figura 2). Cullintong y col. encontraron que la FC alcanzada, una vez titulado el tratamiento BB, se asoció con la sobrevida y no hubo ninguna relación con la dosis que recibieron. Cuanto más baja la FC, mejores resultados; siendo los pacientes con una FC de 58-64 lpm los que obtuvieron el mejor pronóstico. Curiosamente se observó una tendencia a peores resultados cuando la FC se redujo por debajo de los 57 lpm24. El estudio de Lupón y col. en pacientes con IC ambulatoria, sugiere que los pacientes menores de 75 años pueden beneficiarse de una FC objetivo de 68 lpm e incluso por debajo de los 55 lpm, pero no pasaría lo mismo en los mayores de esa edad25. Esta observación no se reprodujo en otros estudios. En el estudio CIBISELD, en 728 pacientes ancianos con IC tratados con bisoprolol, el rango de FC con la mortalidad más baja y el menor número de eventos adversos relacionados con el tratamiento fue 55-64 lpm26. Los pacientes con FC â¤64 lpm presentaron menor mortalidad en comparación con aquellos con FC >64 lpm (HR 1,84; IC 95% 1,20-2,88; P=0,005), pero una FC <55 lpm no resultó ser más beneficiosa26. El estudio SHIFT, en pacientes ya tratados con BB, confirmó el beneficio clínico derivado de la reducción de la FC con ivabradina, por debajo de los 70 lpm11. Un análisis adicional reveló que los pacientes del grupo ivabradina con una reducción más significativa de la FC tuvieron una morbimortalidad aún menor, y que, después de un mes de tratamiento, los pacientes, en los que se llegó a menor FC (60 lpm) o cuando ésta bajó en más de 15 lpm, alcanzaron las tasas más bajas de eventos posteriores en el seguimiento12 (Figura 3). Parece ser, entonces, que el objetivo en los enfermos con IC sistólica y ritmo sinusal es llevar la FC de reposo en torno a los 60 lpm.

Figura 2. Morbimortalidad en el Programa CHARM según la frecuencia cardíaca (FC). A. Cualquier aumento o disminución en la FC desde la consulta anterior (ÎFC) modifica significativamente el riesgo del punto final combinado de hospitalización por insuficiencia cardíaca o muerte cardiovascular. La línea azul muestra una relación casi lineal entre ÎFC y el riesgo de la combinación de muerte cardiovascular u hospitalización por insuficiencia cardíaca, de modo que cualquier aumento en la FC (>1 lpm) de la visita anterior parece aumentar el riesgo significativamente. Sin embargo, una caída en la FC de >15 lpm a partir de la visita anterior redujo significativamente el riesgo. Las curvas amarilla y verde representan los límites de confianza superior e inferior del 95%, respectivamente. La línea roja horizontal representa el índice de riesgo de 1. B. La FC en reposo en cualquier visita se relaciona con aumento significativo del punto final combinado de hospitalización por insuficiencia cardíaca o muerte cardiovascular, a partir de los 76 lpm. La línea azul muestra que una FC en reposo entre 60 a 76 lpm no se asoció con un riesgo elevado de muerte cardiovascular o hospitalización por insuficiencia cardíaca en relación con una FC de 60 lpm. Sin embargo, una FC en reposo >76 lpm. Parece estar asociado con un aumento pronunciado del riesgo con valores más altos de la FC en reposo. Modificado de Vazir A, y col.23

Figura 3. Efecto de la reducción de la frecuencia cardíaca (FC) con ivabradina sobre la morbimortalidad. A. Curvas de eventos acumulativos según los grupos definidos por quintiles de FC a los 28 días de tratamiento. B. Reducción del punto final primario según FC alcanzada y cantidad de latidos por minuto (lpm) reducidos. Modificado de BͶhm M y col.11,12
FC en la insuficiencia cardíaca aguda y fase vulnerable
El papel como marcador pronóstico y terapéutico de la FC en pacientes con IC aguda está menos establecido. La taquicardia puede actuar como mecanismo de compensación ante la caída aguda del gasto cardíaco y en la etapa inicial debe manejarse con cuidado. La FC en la admisión es un marcador inmediato de la gravedad de la afección, que representa el estado hemodinámico en el momento de la observación clínica. Por otro lado, la disminución de la FC durante la hospitalización y su valor en el momento del alta se correlacionan con la morbilidad y la mortalidad a corto y largo plazo. Con cada hospitalización, se agrava el daño miocárdico y renal que contribuye al deterioro progresivo de la función ventricular y renal, dando lugar a un inevitable espiral descendente. La rehospitalización y la muerte son más frecuentes durante los primeros meses después de la externación27. A este período lo llamamos "fase vulnerable" de la IC. Aproximadamente, 1 de cada 4 pacientes que damos de alta serán readmitidos dentro de los 30 días y hasta el 50% a los 6 meses. Las guías recomiendan como criterios para dar el alta hospitalaria a un paciente con IC aguda o descompensada, que debe estar hemodinámicamente estable y euvolémico, con la función renal estabilizada, recibiendo los fármacos basados en la evidencia y con una FC adecuada28,29. Muchos estudios han demostrado que la FC elevada al alta es un predictor de rehospitalización temprana y mortalidad. Por otro lado, la disminución de la FC durante la hospitalización y su valor en el momento del alta se correlacionan con la morbimortalidad a corto y largo plazo. En el estudio OFICA, los pacientes que se externaron con FC >80 lpm tuvieron una mortalidad de más del 40% que los que se retiraron con menos de 64 lpm330. Durante la estadía en el hospital, es importante controlar la FC en el período de estabilización y antes de la externación. La optimización farmacológica de la FC antes del alta podría contribuir a limitar la readmisión temprana, durante los primeros 3-6 meses, lo que representa un problema clínico y epidemiológico significativo en el tratamiento de pacientes con IC15. Los BB son agentes de elección, pero en ocasiones difíciles de titular en el paciente agudo. En esos casos, la ivabradina puede ser muy útil para mejorar el efecto de los BB, porque a menudo los pacientes no toleran dosis más elevadas debido a la hipotensión. La utilización de ivabradina ha demostrado reducir las rehospitalizaciones en un 30% al año del alta31. El ensayo ETHIC-AHF es un pequeño estudio randomizado que comparó, en pacientes hospitalizados por IC descompensada con FE <40%, el tratamiento con BB versus la combinación de BB e ivabradina indicados desde las 24 hs de la admisión hospitalaria. La combinación resultó segura, redujo significativamente la FC y se asoció a mejor capacidad funcional y función sistólica del VI a los 28 días y que se mantuvo al año32. El Programa Optimize Heart Failure Care estudió retrospectivamente el impacto de agregar ivabradina a los BB en 370 pacientes hospitalizados por IC, con ritmo sinusal y FC >70 lpm33. El grupo que recibió la combinación desde antes del alta hospitalaria presentó una reducción significativa de la mortalidad total u rehospitalización por IC a los 12 meses, en relación a los que recibían sólo BB (HR: 0,45; IC: 0,32-0,64; p=0,0001)33. De esta manera, el efecto sinérgico de BB e ivabradina pueden mejorar las expectativas en la "fase vulnerable".
Frecuencia cardíaca en la fibrilación auricular
En pacientes con FA, se recomienda que la FC se controle de manera óptima entre 70 y 80 lpm en reposo y entre 90 y 115 lpm durante el ejercicio moderado, ya que la FC sostenida por encima de 100 lpm puede ser perjudicial y conducir a dilatación cardíaca y progresión a IC con activación neurohormonal5. Sin embargo, no contamos con evidencias sólidas para estas recomendaciones en el paciente con IC. Si bien en el estudio CHARM se encontró que la FC en reposo es un importante predictor de morbimortalidad en pacientes con IC crónica estable y FE reducida o preservada, esta relación no tuvo valor predictivo entre los pacientes en FA al inicio del estudio22. Según la evidencia actual, la FC en pacientes con IC y FA no predice el pronóstico en términos de supervivencia, ya que se ha demostrado que una mayor FC en estos pacientes no se asoció con una mayor mortalidad, independientemente de la FE o tratamiento con BB, excepto cuando es >120 lpm34,35. Un importante estudio mostró que, después de ajustar los modelos de regresión de Cox, no hubo asociación entre la FC (por incrementos de 10 lpm) y la supervivencia en pacientes con FA. Sólo se registró una tendencia a menor sobrevida en pacientes con FA y FC >98 lpm36. Estos hallazgos fueron respaldados por los resultados de un metaanálisis sobre el uso de BB bien titulados en pacientes con IC y FE reducida, en el que los pacientes con FA no redujeron los eventos37. Una revisión sistemática de los metaanálisis y registros publicados en los últimos años sobre BB en pacientes con IC y FA confirmó que, en los ensayos clínicos aleatorizados, el efecto beneficioso de los BB sobre la morbimortalidad en pacientes con ritmo sinusal no se reproduce en los enfermos con FA38. Sin embargo, en los registros esto no es tan así. Se hace difícil analizar, ya que existen diferencias poblacionales entre los estudios, diferencias en la severidad y duración de la FA, entre los diferentes BB utilizados y en las dosis alcanzadas. Podría suceder que la rigurosa titulación en alta, en los ensayos clínicos aleatorizados, provoque pausas y bloqueos con efecto negativo. Los beneficios de la reducción de la FC durante el día podrían equilibrarse con un mayor riesgo, posiblemente debido a la exacerbación de las pausas nocturnas. También la digoxina ha sido cuestionada en los últimos años en metaanálisis que sugieren un aumento de la mortalidad. De todas formas, hay que ser cuidadosos a la hora de interpretarlos, ya que si bien en los estudios observacionales la digoxina aumenta la mortalidad, en los estudios randomizados los resultados tienden a ser neutros39. El efecto proarrítmico de la digoxina en dosis no adecuadas ni controladas con digoxinemia y el mayor compromiso que, en general, presentan los enfermos tratados con digital, podrían explicar en parte este comportamiento. El ensayo RACE II es un estudio interesante, donde se asignaron aleatoriamente a 614 pacientes con FA permanente a someterse a una estrategia de control de frecuencia no estricto (FC en reposo <110 lpm) o a una estrategia de control de frecuencia estricta (FC en reposo <80 lpm y FC de ejercicio <110 lpm)40. La mayoría de los pacientes recibía BB. No se encontraron diferencia en los eventos o síntomas con un control estricto respecto del "indulgente" y los resultados fueron similares en el análisis del subgrupo de pacientes con IC40.
Si es ventajoso reducir la FC en pacientes con IC con FA a un rango similar al recomendado para pacientes en ritmo sinusal (<70 lpm) es incierto y requiere mayor investigación. Ante esta incertidumbre, tal vez sea adecuado volver a discutir la posibilidad del control del ritmo en los pacientes con IC y FA paroxística o permanente. La ablación por catéter de las venas pulmonares podría tener valor pronóstico en casos seleccionados41,42.
Adherencia al control de la frecuencia cardíaca
A pesar de que el control de la FC es uno de los objetivos de tratamiento recomendados por las guías de IC, su implementación ha sido laboriosamente lenta. Está claramente demostrado que los pacientes que no son llevados a una FC adecuada empeoran su función ventricular y tienen peor pronóstico43. En la práctica clínica, como lo muestran varios registros, los BB se prescriben ampliamente, pero no se dosifican en las dosis que se alcanzaron en los ensayos aleatorizados. En el Registro Europeo de IC, que incluyó a 12.000 pacientes, recibían BB el 93% de los pacientes ambulatorios con FE <45%, pero sólo el 17% de ellos alcanzó la dosis objetivo, de acuerdo con las guías44. Las razones de la subdosificación fueron: hipotensión sintomática, bradicardia, empeoramiento de la IC, broncoespasmo, enfermedad arterial periférica y disfunción sexual, entre otras. Si bien dos metaanálisis han demostrado que las ventajas en la sobrevida con el tratamiento BB dependen más de la reducción de la FC que la de la dosis, en la práctica clínica esto no se suele cumplir17,18. Desafortunadamente el objetivo de llevar la FC por debajo de 70 lpm es alcanzado en sólo la mitad de los pacientes. En un registro italiano, que incluyo 3.755 pacientes ambulatorios con IC crónica, el 53% tenían una FC de al menos 70 lpm, 30% más de 75 lpm y 17% más de 80 lpm45. El estudio de FC en pacientes con IC realizado en Suecia (HR-HF Survey) investigó el estado del control de la FC en la IC, centrándose en el conocimiento y cumplimiento de las guías46. Si bien la mayoría de la población recibía BB, casi el 40% informó efectos adversos: cansancio (20%), extremidades frías (9%), impotencia sexual (8%), pesadillas (3%) y depresión (3%). En esta encuesta, el 34% de los pacientes con IC y FE reducida que tenían ritmo sinusal, tenía una FC >70 lpm. Estos pacientes tenían una menor FE y fueron más sintomáticos. Llamativamente, casi la mitad de los médicos consideró que la FC estaba bien controlada. Los autores concluyen que el control subóptimo de la FC es atribuible a la toma de decisiones equivocada del médico y no al uso de BB46. Por lo tanto, estos resultados subrayan la necesidad de una mayor atención al control de la FC en pacientes con IC sistólica y ritmo sinusal, lo que puede cambiar el curso de evolución de la enfermedad.
Conclusiones
Podríamos sintetizar los objetivos inmediatos del manejo de la IC crónica con FE reducida en tres estándares del tratamiento farmacológico: 1) reducir la congestión (diuréticos); 2) bloqueo neurohormonal (inhibidores del sistema renina angiotensina, inhibidor del receptor de angiotensina/neprilisina, BB, antagonistas de la aldosterona); y 3) manejo de la FC. En los enfermos con FA, este manejo no es claro y, a pesar de los cuestionamientos actuales, la recomendación sigue siendo la utilización de BB y digoxina cuando la FC alcanzada no sea adecuada. Pero, la FC es un factor de riesgo modificable en la IC con FE reducida y ritmo sinusal. La reducción de la FC por debajo de 70 lpm debe ser un objetivo del tratamiento; pero, de acuerdo a la mayoría de los estudios, es recomendable intentar llegar a una FC de reposo idealmente entre 55 y 65 lpm. Siempre lo primero será buscar la titulación óptima de los BB. Sabemos que muchos pacientes con IC no reciben BB en la dosis suficiente para disminuir la FC a los niveles deseables, probablemente, porque los efectos secundarios de estos agentes limitan su uso. La hipotensión y la fatiga suelen impedir la titulación ascendente. La asociación de ivabradina ofrece un recurso para este objetivo por su fácil implementación y buena tolerancia. La simple medida del pulso durante el curso de la enfermedad debe ser una señal de advertencia que puede identificar a los pacientes con alto riesgo de muerte u hospitalización y debe conducir a la intensificación del tratamiento. Por lo tanto, la sencilla y económica evaluación de la "carga de la FC" debería ponerse en práctica como un procedimiento estándar.
Recursos financieros
El autor no recibió ningún apoyo económico para la investigación.
Conflicto de intereses
El autor declaró no tener conflicto de intereses.
Referencias bibliográficas
1. Boudoulas KD, Borer JS, Boudoulas H. Heart Rate, Life expectancy and the cardiovascular system: Therapeutic considerations. Cardiology 2015;132:199-221. [ Links ]
2. Levy RL, White PD, Stroud WD, et al. Transient tachycardia: prognostic significance alone and in association with transient hypertension. JAMA 1945;129:585-588. [ Links ]
3. Kannel WB, Kannel C, Paffenbarger RS Jr, Cupples LA. Heart rate and cardiovascular mortality: the Framingham Study. Am Heart J 1987;113:1489-94. [ Links ]
4. NikolovskaVukadinovic A, Vukadovik E, Borer J, Cowie M, Komajda M, Lainscak M et al. Heart rate and its reduction in
chronic heart failure and beyond. Eur Heart J 2017;19:12301241.
5. Hori M, Okamoto H. Heart rate as a target of treatment of chronic heart failure. J Cardiol 2012;60:86-90. [ Links ]
6. Heidland UE, Strauer BE. Left ventricular muscle mass and elevated heart rate are associated with coronary plaque disruption. Circulation 2007;104:1477-1482. [ Links ]
7. Whelton SP, Blankstein R, Al-Mallah MH, Lima JA, Bluemke DA, Hundley WG et al. Association of resting heart rate with carotid and aortic arterial stiffness: multi-ethnic study of atherosclerosis. Hypertension 2013;62:477-484. [ Links ]
8. Fox K, Ford I, Steg PG, Tardif JC, Tendera M, Ferrari R and SIGNIFY Investigators. Ivabradine in stable coronary artery disease without clinical heart failure. N Engl J Med 2014;371:1091-1099. [ Links ]
9. Komajda M, Isnard R, Cohen-Solal A, Metra M, Pieske B, Ponikowski P et al. Effect of ivabradine in patients with heart failure with preserved ejection fraction: the EDIFY randomized placebo-controlled trial. Eur J Heart Fail 2017;19:1495-1503. [ Links ]
10. Fox K, Ford I, Steg PG, Tendera M, Robertson M, Ferrari R and BEAUTIFUL investigators. Heart rate as a prognostic risk factor in patients with coronary artery disease and left-venticular systolic dysfunction: a subgroup analysis of a randomized controlled trial. Lancet 2008;372:817-821. [ Links ]
11. BͶhm M, Swedberg K, Komajda M, Borer JS, Ford I, DubostBrama A, et al. Heart rate as a risk factor in chronic heart failure (SHIFT): the association between heart rate and outcomes in a randomised placebo-controlled trial. Lancet 2010;376:886-894. [ Links ]
12. BͶhm M, Borer J, Ford I, Gonzalez-Juanatey JR, Komajda M, Lopez-Sendon J et al. Heart rate at baseline influences the effect of ivabradine on cardiovascular outcomes in chronic heart failure: analysis from the SHIFT study. Clin Res Cardiol 2013;102:11-22. [ Links ]
13. Parikh KS, Greiner MA, Suzuki T, DeVore AD, Blackshear C, Maher J et al. Resting heart rate and long-term outcomes among the africanamerican population. Insights from the Jackson Heart Study. JAMA Cardiol 2017; 2:172-180. [ Links ]
14. Kjekshus J, Gullestad L. Heart rate as a therapeutic target in heart failure. Eur Heart J 1999;Suppl 1:H64-69. [ Links ]
15. Natale E, Marsocci A. Decreasing heart rate in heart failure: pros and cons. J Cardiovasc Med 2018;19 (suppl 1):e96-e98. [ Links ]
16. Nul D, Doval H, Grancelli H, Varini S, Soifer S, Perrone SV et al. Heart rate is a marker of amiodarone mortality reduction in severe heart failure. Grupo de Estudio de la Sobrevida en la Insuficiencia Cardiaca en Argentina. J Am Coll Cardiol 1997;29:1199-205. [ Links ]
17. McAlister F Wiebe N, Ezekowitz J, Leung A, Armstrong P. Meta-analysis: beta-blocker dose, heart rate reduction, and death in patients with heart failure. Ann Intern Med 2009;150:784794. [ Links ]
18. Lee HY, Baek SH. Optimal use of beta-blockers for congestive heart failure. Circ J 2016; 80:565-571. [ Links ]
19. Tardif J, O"Meara E, Komajda M, BͶhm M, Borer JS, Ford I et al. Effects of selective heart rate reduction with ivabradine on left ventricular remodeling and function: results from the SHIFT echocardiography substudy. Eur Heart J 2011;32:2507-15. [ Links ]
20. Volterrani M, Cice G, Caminiti G, Vitale C, D"Isa S, Perrone Filardi P et al. Effect of Carvedilol, Ivabradine or their combination on exercise capacity in patients with heart failure (the CARVIVA HF trial). Int J Cardiol 2011;151:218-24. [ Links ]
21. Bagriy A, Schukina E, Samoilova O, Pricolota O, Malovichko S, Pricolota A et al. Addition of ivabradine to β-blocker improves exercise capacity in systolic heart failure patients in a prospective, open-label study. Adv Ther 2015;32:108-19. [ Links ]
22. Castagno D, Skali H, Takeuchi M, Swedberg K, Yusuf S, Granger CB et al. Association of heart rate and outcomes in patients with chronic HF: results from the CHARM program. J Am Coll Cardiol 2012;59:1785-1795. [ Links ]
23. Vazir A, Claggett B, Jhund P, Castagno D, Skali H, Yusuf S et al. Prognostic importance of temporal changes in resting heart rate in heart failure patients: an analysis of the CHARM program. Eur Heart J 2015;36:669-675. [ Links ]
24. Cullington D, Goode KM, Clark AL, Cleland JG. Heart rate achieved or beta-blocker dose in patients with chronic heart failure: which is the better target? Eur J Heart Fail 2012;14:737747. [ Links ]
25. Lupón J, Domingo M, de Antonio M, Zamora E, Santesmases J, Díez-Quevedo C et al. Aging and heart rate in heart failure: Clinical implications for long-term mortality. Mayo Clin Proc 2015;90:765-72. [ Links ]
26. Dͼngen HD, Musial-Bright L, Inkrot S, ApostoloviÄ S, Edelmann F, LainÅ¡Äak M et al. Heart rate following short-term beta-blocker titration predicts all-cause mortality in elderly chronic heart failure patients: insights from the CIBIS-ELD trial. Eur J Heart Fail 2014;16:907-14.
27. O"Connor CM, Miller AB, Blair JE, Konstam MA, Wedge P, Bahit MC et al. Causes of death and rehospitalization in patients hospitalized with worsening heart failure and reduced left ventricular ejection fraction: results from Efficacy of Vasopressin Antagonism in Heart Failure Outcome study with Tolvaptan (EVEREST) program. Am Heart J 2010;159:841-849. [ Links ]
28. Heart Failure Society of America. HFSA 2010 Comprehensive Heart Failure Practice Guideline. J Card Fail 2010;16:475539;e1-e194. [ Links ]
29. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure. Eur J Heart Fail 2016 Aug;18(8):891-975. [ Links ]
30. Logeart D, Isnard R, Resche-Rigon M, Seronde MF, de Groote P, Jondeau G et al. Current aspects of the spectrum of acute heart failure syndromes in a real-life setting: the OFICA study. Eur J Heart Fail 2013;15:465-76. [ Links ]
31. Zugck C, StͶrk S, StͶckl G and RELIf-CHF study investigators. Long-term treatment with ivabradine over 12months in patients with chronic heart failure in clinical practice: Effect on symptoms, quality of life and hospitalizations. Int J Cardiol 2017;240:258-264. [ Links ]
32. Hidalgo F, Carrasco F, Castillo J, Rodríguez S, Pardo L, Durán E et al. Early therapy with beta blockers plus ivabradine versus beta blockers alone in patients hospitalised with heart failure and reduced ejection fraction (ETHIC-AHF Study): Results at One-Year Follow-Up. Int J Clin Cardiol 2017;4:093. [ Links ]
33. Lopatin Y, Cowie M, Grebennikova A, Sisakian H, Pagava Z, Hayrapetyan H et al. Optimization of heart rate lowering therapy in hospitalized patients with heart failure: Insights from the Optimize Heart Failure Care Program. Int J Cardiol 2018;260:113-117. [ Links ]
34. Takada T, Sakata Y, Miyata S, Takahashi J, Nochioka K, Miura M et al. Impact of elevated heart rate on clinical outcomes in patients with heart failure with reduced and preserved ejection fraction: a report from the CHART-2 Study. Eur J Heart Fail
2014;16:309-316.
35. Simpson J, Castagno D, Doughty RN, Poppe KK, Earle N, Squire I et al. Meta-Analysis Global Group in Chronic Heart Failure (MAGGIC). Is heart rate a risk marker in patients with chronic heart failure and concomitant atrial fibrillation? Eur J Heart Fail 2015;17:1182-1191. [ Links ]
36. Cullington D, Goode KM, Zhang J, Cleland JG, Clark AL et al. Is heart rate important for patients with heart failure in atrial fibrillation? J Am Coll Cardiol 2014;2:213-20. [ Links ]
37. Kotecha D, Holmes J, Krum H, Altman DG, Manzano L, Cleland JG et al. Efficacy of beta-blockers in patients with heart failure plus atrial fibrillation: an individual-patient data meta-analysis. Lancet 2014;384:2235-2243. [ Links ]
38. Filippatos G, Farmakis D. How to Use beta-blockers in heart failure with reduced ejection fraction and atrial fibrillation. J Am Coll Cardiol 2017;69:2897-2900. [ Links ]
39. Ziff OJ, Lane D, Samra M, Griffith M, Kirchhof P, Lip G et al. Safety and efficacy of digoxin: systematic review and meta-analysis of observational and controlled trial data BMJ 2015;351:h4451. [ Links ]
40. Van Gelder I, Groenveld H, Crijns H, Tuininga Y, Tijssen J et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362:1363-1373. [ Links ]
41. Marrouche N, Brachmann J, Andresen D, Siebels J, Boersma L, Jordaens L et al for the CASTLE-AF Investigators. Catheter ablation for atrial fibrillation with heart failure. N Engl J Med 2018; 378:417-427. [ Links ]
42. Noseworthy PA, Gersh B, Kent D, Piccini J, Packer D, Shah N et al. Atrial fibrillation ablation in practice: assessing CABANA generalizability. Eur Heart J 2019;40:1257-1264. [ Links ]
43. Scalia G, Scalia I, Scalia W, Rafter L, Rafter T, Cross D. Heart rate target treatment shortfall in contemporary beta-blocker therapy of heart failure in 446 patients in sinus rhythm. Heart Lung Circ 2015;24:S207. [ Links ]
44. Maggioni AP, Anker SD, DahlstrͶm U, Filippatos G, Ponikowski P, Zannad F et al. Are hospitalized or ambulatory patients with heart failure treated in accordance with European Society of Cardiology guidelines? Evidence from 12,440 patients of the ESC Heart Failure Long-Term Registry. Eur J Heart Fail 2013;15:1173-84. [ Links ]
45. Tavazzi L, Senni M, Metra M, Gorini M, Cacciatore G, Chinaglia A et al. Outcome Investigators. Multicenter prospective observational study on acute and chronic heart failure: one-year follow-up results of IN-HF (Italian Network on Heart Failure) outcome registry. Circ Heart Fail 2013;6:473-481. [ Links ]
46. Fu M, Ahrenmark U, Berglund S, Lindholm C, Lehto A, Broberg A et al. Adherence to optimal heart rate control in heart failure with reduced ejection fraction: insight from a survey of heart rate in heart failure in Sweden (HR-HF study). Clin Res Cardiol 2017:960-973. [ Links ]














