Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Argentina de Ciencias del Comportamiento
versión On-line ISSN 1852-4206
Rev Arg Cs Comp. vol.7 no.3 Córdoba dic. 2015
ARTICULO DE REVISION
Aprendizaje espacial y geometría. Los anfibios en la evolución de los sistemas cognitivos cerebrales
Sotelo, María Inésa b y Muzio, Rubén Néstor,a b
a Grupo de Aprendizaje y Cognición Comparada, Laboratorio de Biología del Comportamiento, Instituto de Biología y Medicina Experimental (IBYME-CONICET), Argentina.
b Cátedra de Biología del Comportamiento e Instituto de Investigaciones, Facultad de Psicología, Universidad de Buenos Aires (UBA), Argentina.
Enviar correspondencia a: rnmuzio@gmail.com
Resumen
En este artículo se realiza una revisión comparativa de los trabajos que han estudiado el aprendizaje espacial en vertebrados usando información de la geometría y las claves visuales del ambiente. Se describen experimentos realizados en nuestro laboratorio que muestran aprendizaje de navegación espacial en anfibios y su dependencia de un Pallium Medial funciónal (área homóloga al hipocampo de los mamíferos). Los resultados obtenidos indican que estos animales utilizan tanto la información brindada por la geometría como por las claves visuales, pero que cuando ambos tipos de referencia se presentan en conflicto prefieren para orientarse la información geométrica (al igual que los resultados hallados en amniotas). Globalmente, estas evidencias indican que la habilidad de orientarse en el espacio es una característica conservada evolutivamente y apoyan la idea de que el papel del hipocampo en la cognición espacial precede a la evolución de los vertebrados plenamente terrestres.
Palabras clave: Aprendizaje espacial y geometría; Anfibios; Pallium medial; Hipocampo; Evolución de sistemas cognitivos cerebrales.
Abstract.
Spatial Learning and Geometry. Amphibians in the Evolution of the Brain Cognitive Systems. This article presents a comparative review of the works that have studied the spatial learning in vertebrates using geometry information and visual cues from the environment. We describe experiments conducted in our laboratory showing spatial navigation learning in amphibians and their dependence on a functional medial pallium (homologous area to the mammalian hippocampus). The results indicate that these animals use both the information provided by the geometry as visual cues, but when both types of reference are presented in conflict they prefer geometry to orient (as results found in amniotes). Broadly, these findings suggest that the ability to orient in space is a characteristic evolutionarily preserved and support the idea that the role of the hippocampus in spatial cognition precedes the evolution of fully terrestrial vertebrates.
Key words: Spatial learning and geometry; Amphibians; Medial pallium; Hippocampus; Evolution of brain cognitive systems
Recibido el 27 de Mayo de 2015; Recibida la revisión el 15 de Agosto de 2015; Aceptado el 22 de Agosto de 2015
1. Introducción
La combinacion de neurociencia, biología evolutiva y psicología comparada ha revelado mucho sobre cómo la organización del cerebro ha sido moldeada por la evolución para explicar el alcance de las capacidades cognitivas que se encuentran en diversos animales, entre ellos, el humano. Una de esas estructuras, el hipocampo, ha generado un gran interés en los últimos años. Las evidencias indican que el papel del hipocampo en la memoria y la navegación espacial es una característica general compartida por un amplio número de especies de vertebrados (Bingman, Salas & Rodríguez, 2009; Rodríguez et al., 2002). Sin embargo, la organización neuronal del hipocampo y su papel en la cognición presentan diferencias interesantes en las especies animales con diferentes ecologías de comportamiento (Bingman, Jechura & Kahn, 2006; Pravosudov & Clayton, 2002).
El estudio comparado del comportamiento requiere abordar el análisis de la evolución y el desarrollo de la conducta en relación con la evolución y el desarrollo del sistema nervioso asociado (Papini, 2009). En este sentido, el comportamiento y su desarrollo se explican principalmente desde un punto de vista funciónal; esto es, como parte de un fenotipo que contribuye al éxito reproductivo de un individuo. Así, para entender el comportamiento desde esta perspectiva, es necesario estudiar los patrónes de evolución del cerebro y la conducta como dos facetas de un mismo fenomeno (Muzio, 2013; Papini, 2009). Los sistemas nerviosos simples tienen algunas propiedades comportamentales propias, pero a su vez muchas otras que son comunes al funciónamiento de sistemas nerviosos más complejos. De esta forma, la organización del cerebro en los vertebrados presenta un patrón común que refleja la filogenia, en tanto que las variaciones estructurales que aparecen en cada grupo reflejan adaptaciones a modos de vida particulares (Papini, 2009). Teniendo en cuenta esta perspectiva de evolución cerebro-conducta, los anfibios constituyen un grupo crucial dentro de los vertebrados porque son representantes cuyos ancestros sobrellevaron la transición del agua a la tierra, y las implicaciones que esta transición puede haber tenido en la organización cerebral. Por esta razón, es sorprendente lo poco que se ha estudiado hasta el momento la organización cerebral de los anfibios, y en particular del hipocampo, en relación a su comportamiento en general y con la memoria y la navegación espacial en particular (Daneri & Muzio, 2013; Muzio, 1999, 2013).
2. El hipocampo y la navegación espacial
Desde su asociación con el procesamiento de la memoria a partir del estudio en el paciente H.M., que padecía una severa pérdida de memoria luego de una lesion quirúrgica en la formación hipocampal (Scoville & Milner, 1957), la relación entre hipocampo y funciónes de memoria ha sido un importante área de investigación en las neurociencias cognitivas (Anderson, Morris, Amaral, Bliss & O´Keefe, 2007). Con el descubrimiento de las llamadas células de lugar del hipocampo en la década del 70 (O’Keefe & Dost ky, 1971), junto con la observación de que el daño hipocampal tenía efectos consistentes sobre la cognición espacial en particular, se incrementó el interés en analizar cómo la actividad neuronal en el hipocampo representa al espacio y cómo se utiliza esa representacion para guiar los procesos de memoria y navegación. Aunque también hay que destacar que la información recogida sobre el papel del hipocampo en la cognición no está limitada exclusivamente al espacio (para una revisión, ver Wood, Dudchenko, Robitsek & Eichenbaum, 2000), el estudio del área hipocampal en relación a la orientación espacial ha ido en aumento y se ha extendido incluso a otras clases de vertebrados.
Es importante destacar aquí que la habilidad de orientarse en el espacio es una característica compartida por todos los animales de las distintas clases zoologicas. Especies tan diversas como las hormigas y los humanos necesitan ubicarse en el ambiente donde habitan para acceder a los recursos que disponen en su entorno. La supervivencia y el éxito reproductivo dependen de manera directa de la capacidad del animal para desplazarse y encontrar los recursos para luego, por ejemplo, llevarlos a su nido o volver a encontrarlos, según el caso. Estas habilidades están directamente relaciónadas a la capacidad de los animales para orientarse en el espacio y para reconocer señales del ambiente. El reconocimiento de señales se realiza a través de los sentidos, pero su integración en un gradiente espacial es aquello que depende en gran parte del área hipocampal (O’Keefe & Nadel, 1978). Así, en general, los animales no se desplazan de manera meramente azarosa, sino en un sentido determinado y siguiendo las características de un ambiente polarizado. La orientación en el espacio tiene sentido adaptativo para los animales y es quizás por ello que se encuentra tan conservada evolutivamente (Daneri & Muzio, 2013; Muzio, 2013; Papini, 2009).
2.1 El hipocampo y la navegación espacial en los vertebrados: diferencias y similitudes
Anatómicamente la formación hipocampal reside en el lobulo temporal medial de los mamíferos y en la corteza dorsomedial de aves y reptiles (Figura 1). En los anfibios y peces, el área homologa a la formación hipocampal se ha encontrado en el palio medial ( Figura 1 ), aunque en el caso de los peces teleosteos, el establecimiento de homologías se ve dificultado debido a la eversión que sufre el telencéfalo durante el desarrollo que posiciona al palio medial en la zona lateral de los hemisferios (Papini, Salas & Muzio, 1999).
La información disponible respecto del papel del hipocampo en la cognición espacial presenta una condición dual: aunque muchas características son comunes a especies pertenecientes a diferentes clases de vertebrados (i.e., que muestran un alto grado de conservación), también hay diferencias en la cognición, y en el volumen y composición de la formación hipocampal entre especies cercanamente emparentadas, como por ejemplo, dentro del grupo las aves (Bingman, Hough II, Kahn & Siegel, 2003). Al respecto, se puede enfatizar que existe evidencia de que la selección natural ha producido el desarrollo de partes específicas relaciónadas con la evolución de conductas especializadas. Uno de los ejemplos más llamativos es la diferencia en el volumen y la composición citoarquitectonica cerebral de aves que almacenan alimento y luego deben recuperarlo utilizando memoria espacial. La formación hipocampal de estas aves tiene un tamaño mayor, está compuesta por mayor número de células e incluso por tipos celulares diferentes que las de otras aves que no tienen este comportamiento (Papini et al., 1999).
Figura 1. Esquemas de cortes transversales comparativos del telencéfalo en especies de varios grupos de vertebrados mostrando la ubicación de la formación hipocampal y sus regiones homólogas.
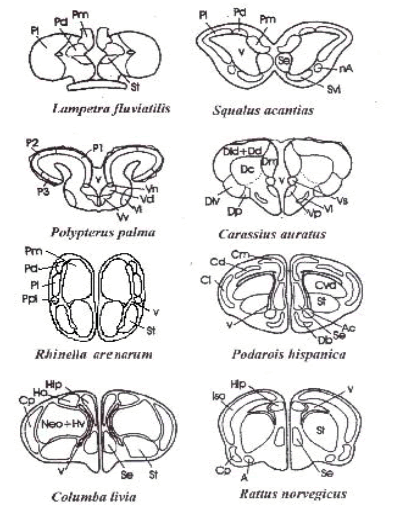
Nota: Pd/Dl: Corteza Dorsolateral (peces); Pm: Pallium Medial (anfibios); Cm: Corteza Dorsomedial (reptiles); Hip: Hipocampo (aves y mamíferos). También se muestran otras áreas significativas: Pd: Pallium Dorsal; Pl: Pallium Lateral; Se: Septum; Str: Striatum; v: ventrículos. Adaptado de Papini, Salas & Muzio (1999).
La información disponible respecto del papel del hipocampo en la cognición espacial presenta una condición dual: aunque muchas características son comunes a especies pertenecientes a diferentes clases de vertebrados (i.e., que muestran un alto grado de conservación), también hay diferencias en la cognición, y en el volumen y composición de la formación hipocampal entre especies cercanamente emparentadas, como por ejemplo, dentro del grupo las aves (Bingman, Hough II, Kahn & Siegel, 2003). Al respecto, se puede enfatizar que existe evidencia de que la selección natural ha producido el desarrollo de partes específicas relaciónadas con la evolución de conductas especializadas. Uno de los ejemplos más llamativos es la diferencia en el volumen y la composición citoarquitectonica cerebral de aves que almacenan alimento y luego deben recuperarlo utilizando memoria espacial. La formación hipocampal de estas aves tiene un tamaño mayor, está compuesta por mayor número de células e incluso por tipos celulares diferentes que las de otras aves que no tienen este comportamiento (Papini et al., 1999).
3. ¿Cómo se orientan los animales en el espacio usando la información geométrica? Distintas explicaciones teóricas
Existen numerosas teorías acerca de cómo se representa internamente la información geométrica espacial y cuál es la que prevalece a la hora de navegar (Cheng, Huttenlocher & Newcombe, 2013). Por ejemplo, Cheng (1986) describe a la geometría del espacio sencillamente como la distancia entre puntos o líneas presentes en el ambiente. Teniendo en cuenta esta definición, la geometría comprende por ejemplo la distancia entre dos arbustos en un ambiente dado, pero además la forma relativa que estos arbustos presentan (i.e., el contorno representado por sus ramas, la forma del tronco, etc.). En tanto que características como el color de las hojas del arbusto estarían clasificadas como claves visuales. Además de las anteriores, también se podrían considerar otro tipo de claves, como el aroma de las hojas (clave olfatoria). De esta forma, la geometría estaría representada en el sujeto como un módulo aparte de las claves, constituyendo la información más estable del ambiente (i.e., la menos propensa a cambiar en el tiempo). Por ejemplo, la coloración de las hojas o su olor pueden variar de una estación del año a otra, pero es probable que la forma del arbusto y su distancia a otros arbustos se mantenga constante (para una explicacion más detallada de esta teoría, denominada teoría modular, ver Cheng et al., 2013). En este sentido, retomando el ejemplo de las aves que se valen de su memoria espacial para recobrar su alimento con el paso de las estaciones, se ha comprobado que las mismas se guían mucho más por características menos sujetas a variaciones temporales, como la información geométrica dada por la ubicacion relativa de los árboles o las montañas. Y a diferencia de otras especies emparentadas, estas aves no utilizan tanto las características puntuales de los objetos (Kamil & Balda, 1985).
Todas las teorías que analizan el uso de la geometría en la orientación espacial se basan en diferentes experimentos realizados en especies que van desde hormigas (Cheng, Narendra, Sommer & Wehner, 2009; Wystrach, Cheng, Sosa & Beugnon, 2011) hasta los humanos (Doeller & Burgess, 2008; Huttenlocher & Lourenco, 2007; Nardi, Newcombe & Shipley, 2013). Globalmente, estos estudios abarcan procedimientos donde los sujetos deben aprender a ubicar un lugar meta en un ambiente geométricamente polarizado (incluyendo también ensayos de prueba donde deben reorientarse de acuerdo a cambios introducidos en las relaciónes entre las claves de referencia espacial). Hasta el momento, dada la escasa cantidad relativa de estudios en este tema, hay disparidad en los resultados encontrados para distintos taxa y también entre las interpretaciones de esas evidencias. Debido a esta razón, se han propuesto distintas teorías para explicar la información obtenida sobre el uso de la geometría en la orientación espacial. Entre ellas, además de la citada teoría modular (Cheng, 1986), están las siguientes: (1) teoría modular modificada (Lee & Spelke, 2010), que discute la distinción básica entre geometría y claves visuales comparando experimentos realizados en laboratorio y en ambientes naturales, donde esta diferencia puede ser controvertida; (2) teoría de imágenes coincidentes o view-matching approach (Stürzl, Cheung, Cheng & Zeil, 2008), que resalta las posibles similitudes y diferencias entre distintas especies en relación con la información contenida en imágenes panorámicas; (3) teoría asociativa (Miller & Shettleworth, 2008), que enfatiza el fenómeno de competencia de estímulos en esta situación; (4) teoría de combinación adaptativa (Cheng, Shettleworth, Huttenlocher & Rieser, 2007), que discute sobre aspectos de la ontogenia y el efecto de la experiencia; y (5) teorías basadas en sustratos neurales (e.g., Doeller & Burgess, 2008; Sheynikhovich, Chavarriaga Strösslin, Arleo & Gerstner, 2009), en donde se analizan los circuitos neurales implicados en la navegación espacial (para una revisión detallada de estas teorías, ver Cheng et al., 2013).
En términos generales, dentro de estas aproximaciones teóricas se pueden distinguir dos corrientes diferentes. Primero, las teorías abstractas que modelan la representacion de los sistemas de información ambiental (e.g. la teoría modular, la teoría de imágenes coincidentes, o la teoría asociativa). Segundo, las teorías que se basan en los sustratos neurales asociados a la navegación y generan a partir de ellos modelos predictivos (e.g. la teoría de dos factores hipocampal-estriatal, [Doeller & Burgess, 2008]; y otra aproximacion similar, la teoría computacional de dos factores basada neuralmente, [Sheynikhovich et al., 2009]).
Básicamente, las teorías abstractas se diferencian de las teorías de base neural en que proponen modelos de utilización de la información espacial sin preocuparse de los sustratos neurales que almacenan dicha información. Por ejemplo, la citada teoría modular de Cheng (1986) enuncia que la información geométrica se almacenaría en un módulo independiente del resto de las claves (sin establecer en qué circuitos se codificaría). Otro ejemplo es la teoría asociativa, la cual propone (sin considerar tampoco sus bases neurales) que la utilización de uno u otro tipo de información estaría sujeto a la asociación entre estímulos (apoyándose en la teoría de Rescorla & Wagner, 1972), y que la saliencia o ensombrecimiento dado entre un estímulo y otro generaría la preferencia a la hora de orientarse. Así, esta teoría predice que de acuerdo a como se presenten los estímulos (en nuestro caso, la información de geometría y claves visuales), puede generarse bloqueo, ensombrecimiento o incluso facilitación del aprendizaje. Algunas modificaciones de esta teoría suponen un efecto adicional debido a la experiencia del animal con cada tipo de información o al tamaño del ambiente.
En contraste, si consideramos por ejemplo el caso de la teoría computacional de dos factores basada neuralmente (Sheynikhovich et al., 2009), se propone una utilización y codificación diferencial de dicha información de acuerdo a los circuitos neuronales intervinientes. La teoría supone que el animal se guía en el ambiente mediante dos estrategias o mecanismos, uno egocéntrico y otro alocéntrico. El circuito egocéntrico dependería de un sistema llamado de taxón, que tendría su base neural en el núcleo estriado y codificaría información que depende del punto de vista del sujeto (e.g., seguir en línea recta hacia la imagen de una recompensa). En cambio, el circuito alocéntrico estaría relaciónado con un sistema local que procesaría señales en las células de lugar del hipocampo, en las células de red de la corteza entorrinal y en células visuales (no identificadas), codificando la información como un mapa no dependiente del punto de vista del individuo. Ambos circuitos, de taxón y local, utilizarían información visual de una forma similar a la propuesta por la teoría de imágenes coincidentes: la similitud entre la imagen actualmente procesada y la imagen recordada de un objetivo sería lo que dirige el comportamiento motor. En este caso, la geometría y las claves serían detalles de la misma imagen y no modulos o aspectos separados (Sheynikovich et al, 2009).
Ahora bien, más allá de las diferencias encontradas en estas teorías en cuanto al almacenamiento o codificación de la información espacial, existe un alto consenso en que la mayoría de los vertebrados utilizan principalmente dos fuentes de información para orientarse: las claves visuales y la geometría del ambiente (Tabla 1). De acuerdo a cada enfoque teórico particular, estos dos tipos de información pueden almacenarse o no como informaciónes independientes.
Tabla 1. Resumen de los principales resultados obtenidos en experimentos sobre el uso de la geometría y las claves visuales para orientarse en el ambiente en diferentes especies de varios grupos de animales.

* Ver Teoría de imágenes coincidentes (View-matching approach) en hormigas (Cheng et al., 2013).
La utilización de uno u otro tipo de información es variable. Existen diferencias según: el grupo estudiado, las condiciónes del entorno (e.g., entornos pequeños vs entornos amplios; o ambientes rectangulares vs ambientes circulares o irregulares), la experiencia del animal (animales jovenes vs. animales adultos) (Brown, Spetch & Hurd, 2007; Ratliff & Newcombe, 2008; Twyman, Newcombe & Gould, 2013), y las citadas diferencias según las ecologías del comportamiento particulares (como las aves con conductas especializadas, [Bingman et al., 2003]; o habilidades de navegación espacial en las hormigas del desierto, [Cheng, Schultheiss, Schwarz, Wystrach & Wehner, 2014]).
Por último, es importante destacar que la comparación de animales que ocupan un nicho ecológico similar en diferentes hábitats puede brindar interesantes similitudes y diferencias que conforman el tema del presente trabajo. Por ejemplo, los estudios en animales invertebrados como las hormigas de la especie Gigantiops destructor (Wystrach et al, 2011), muestran evidencias de otros tipos de procesamiento de la información espacial que no se corresponden exactamente con los de los vertebrados. A diferencia de estos últimos, las hormigas parecen guiarse por claves visuales globales, como contornos del paisaje, más que por claves visuales puntuales o la geometría del ambiente. Estos resultados apoyan la mencionada teoría de imágenes coincidentes (view-matching approach), la cual propone que lo que guía a los animales es una imagen recordada del objetivo-meta donde el animal dirige su comportamiento, de manera que los pixeles de la imagen recordada concuerden exactamente con los de la imagen que observa (representacion píxel a píxel). En este caso, no se habla de utilización de geometría ni de claves visuales ya que la imagen se considera como un todo (Cheng et al., 2013). Sin embargo, está en discusión si esta teoría se aplica también a otros representantes dentro de los vertebrados dado que existe información poco clara al respecto (Wystrach, 2009; Wystrach & Beugnon, 2009). De esta forma, no existe todavía un cúmulo de información disponible que permita determinar el grado de similitud o diferencia en el procesamiento de la información espacial entre invertebrados y vertebrados. Estas evidencias contradictorias son las que dificultan por el momento el desarrollo de modelos generales de orientación espacial.
4. Importancia evolutiva del estudio del aprendizaje espacial en los anfibios
Como hemos mencionado anteriormente, los anfibios son un grupo crucial dentro de los vertebrados ya que han colonizado tempranamente el ambiente terrestre, pudiendo tener asociado a este evento alguna modificacion en su organización cerebral. En este sentido, si bien hay estudios morfológicos acerca de la anatomía del sistema nervioso en anfibios (Northcutt, 1974; Northcutt & Kicliter, 1980; Northcutt & Ronan, 1992), hasta hace poco existía escasa información acerca del papel de la formación hipocampal de los anfibios en relación con sus habilidades de memoria y navegación en el espacio (Daneri & Muzio, 2013; Muzio, 2013).
Una amplia serie de trabajos previos realizados en nuestro grupo de investigación utilizando el sapo terrestre Rhinella arenarum, ha permitido recolectar una buena cantidad de información acerca de las capacidades de aprendizaje de esta especie de anfibios desde hace más de veinte años (para una revisión detallada ver: Daneri, Casanave & Muzio, 2011; Daneri & Muzio, 2013; Daneri, Papini & Muzio, 2007; Muzio, 1999, 2013; Muzio et al., 2011 ; Muzio, Ruetti & Papini, 2006; Muzio, Segura & Papini, 1992, 1993; Papini, Muzio & Segura, 1995; Puddington & Muzio, 2013; Puddington, Papini & Muzio, 2013).
Con respecto a la navegación y orientación en el espacio, la información disponible para el grupo de los anfibios es escasa y en general corresponde a estudios aislados sobre aspectos diversos (Adler, 1980; Brattstrom, 1990; Crane & Mathis, 2011; Muzio, 2013; Sinsch, 2006). En los últimos años hemos iniciado en nuestro laboratorio un estudio sistemático de la capacidad de orientación espacial de los sapos. Hemos demostrado que estos animales pueden utilizar la información brindada por claves visuales ambientales, así como también a través de información propioceptiva. Por ejemplo, usando una estrategia de giro de 90 grados a derecha o a izquierda en un laberinto en cruz (Daneri et al., 2011), o tomando como referencias claves visuales cercanas o lejanas en una arena circular (Daneri, Casanave & Muzio, 2015a) para alcanzar una meta. Sin embargo, hasta el momento poco se había estudiado en anfibios acerca de la utilización de la información geométrica para orientarse en el ambiente.
5. Uso de claves visuales vs geometría
Como vimos, existe una amplia evidencia de la utilización de geometría y claves visuales en distintas especies de grupos de vertebrados, como mamíferos (e.g. ratas, [Cheng, 1986; Gallistel, 1990]; humanos, [Newcombe, Ratliff, Shallcross & Twyman, 2010; Sturz, Gurley & Bodily, 2011]), aves (e.g. palomas, [Bingman et al., 2006; Nardi & Bingman, 2007]; pollitos, [Pecchia & Vallortigara, 2010]), y peces (e.g. pez dorado, [Vargas, Bingman, Portavella & López, 2006; Vargas, López, Salas & Thinus- Blanc, 2004]). También aparece alguna evidencia en tortugas (López, Vargas, Gómez & Salas, 2003). Pero solo en el último tiempo se ha incorporado información acerca del grupo de los anfibios a partir de los estudios realizados en sapos en nuestro laboratorio (Sotelo, Bingman & Muzio, 2015a).
En general, el abordaje comparado del aprendizaje de geometría se enfoca en uno de los paradigmas más estudiados en los vertebrados, el cual analiza la utilización de información geométrica y de información de clave en un ambiente de forma rectangular con una clave visual distintiva, y posteriormente evalúa mediante una prueba la preferencia por uno u otro tipo de información. Los resultados encontrados para reptiles, aves y mamíferos (grupos amniotas y plenamente terrestres) bajo el presente paradigma de comportamiento indican que para orientarse estos grupos son capaces de utilizar tanto la geometría como las claves visuales, pero que prefieren la geometría cuando los dos tipos de información se hallan en conflicto (Bingman et al., 2006; Cheng, 1986). Dentro del grupo de los peces, también se ha revelado la utilización tanto de información de geometría como de clave en estudios realizados en peces dorados, pero a diferencia de los resultados en amniotas, la preferencia frente al conflicto es por la información de clave visual (Vargas et al., 2004). El análisis de la actividad neural en todos estos grupos estudiados (evaluados a través de técnicas como lesiones cerebrales o tinciones neurohistologicas postmortem), revela que el procesamiento de la información de la geometría del espacio y las claves visuales dependería del área hipocampal (Bingman et al., 2003, 2006, 2009; Bingman & Sharp, 2006; Vargas et al., 2006).
Teniendo en cuenta estos antecedentes, hemos desarrollado recientemente un estudio en anfibios acerca del uso de la información geométrica y de claves visuales para navegar en el espacio, analizando también sus bases neurales. Como se detallará más adelante, utilizamos un dispositivo rectangular similar al empleado para los otros grupos de vertebrados en el sapo terrestre Rhinella arenarum (Sotelo et al., 2015a).
5.1. Análisis comportamental del aprendizaje de geometría en anfibios
A continuación se resumen los primeros resultados obtenidos acerca de la utilización de la información de geometría del entorno y la participación del pallium medial (área homologa a la formación hipocampal de los mamíferos) en la orientación espacial.
Usando agua como recompensa, hemos estudiado si los sapos también son capaces de codificar la información geométrica y de claves visuales para navegar hasta una ubicacion meta como los demás grupos de vertebrados (Sotelo et al., 2015a). Se entrenaron sapos parcialmente deshidratados, para motivarlos en la búsqueda de agua, ya sea en una arena rectangular blanca (condición solo geometría) o en la misma arena con un panel removible con rayas de color horizontales en una de las paredes angostas de la arena (condición clave-geometría). Se utilizaron cuatro piletas con agua en cada una de las esquinas de la arena, pero solo había agua accesible a los animales entrenados en una (condición clave-geometría), o en dos de las esquinas geométricamente equivalentes (condición solo geometría). Haciendo una breve descripción del procedimiento utilizado, ambos grupos tuvieron dos sesiones de pre-entrenamiento en la arena rectangular sin claves y con todas las piletas con agua accesible a fin de aclimatarlos a la situación experimental. Luego comenzó la etapa de entrenamiento, que consistió en sesiones diarias de tres ensayos cada una, donde los sapos debían encontrar la pileta reforzada o alguna de las dos piletas reforzadas (dependiendo si se trataba de animales del grupo clave-geometría o del grupo solo geometría, respectivamente). Se estableció como criterio de aprendizaje que los animales alcancen durante tres días consecutivos al menos un 75% de respuestas correctas para el grupo solo geometría (respuesta esperada por azar: 50% de elecciones correctas) y al menos un 50% de respuestas correctas para el grupo clave-geometría (respuesta esperada por azar: 25% de elecciones correctas). Finalizada la etapa de entrenamiento, comenzaron las sesiones de evaluación del aprendizaje. En estas sesiones se intercalaron distintos ensayos de prueba no reforzados entre las tres sesiones diarias de entrenamiento regular. Para el grupo solo geometría se administró un único tipo de ensayo de prueba, donde se anulaba la geometría rectangular agregando a la arena dos paneles blancos que generaban una geometría cuadrada. En este caso, todas las esquinas resultaban geométricamente iguales y, al no haber otro tipo de información, el comportamiento esperado era el azar (es decir, 25% de elecciones para cada esquina de la arena). Para el grupo clave-geometría se realizaron tres tipos de ensayos de prueba: (1) prueba de geometría, donde se eliminaba el panel rayado (clave visual) y se dejaba únicamente la geometría rectangular, (2) prueba de clave, donde se eliminaba la geometría transformando la arena a un cuadrado y manteniendo el panel rayado sobre una de las paredes, y (3) prueba de conflicto, donde se mantenía la geometría rectangular, pero la clave visual se colocaba ahora sobre una de las paredes anchas de la arena. Así, la pileta correcta indicada por la geometría difería de la pileta correcta indicada por la nueva ubicacion de la clave visual. De este modo, si los animales habían aprendido todos los tipos de información disponibles, se esperaba que: (1) fueran capaces de elegir las dos piletas correctas con respecto a la geometría al no estar presente la clave visual; (2) eligieran correctamente la pileta reforzada al estar únicamente la clave visual; y (3) en el caso de conflicto, se esperaba que optaran por la información de la clave visual o por la información de la geometría de la arena, según su preferencia. Los resultados de los ensayos de prueba revelaron que, en las condiciónes experimentales empleadas, los sapos pueden utilizar tanto la geometría de la arena como la clave visual (panel rayado) para localizar una meta, pero que la geometría es más potente como señal de navegación, ya que fue preferida en una situación de conflicto (Figura 2; para más detalles ver Sotelo et al., 2015a). Si bien la relación entre estímulos usada en la situación experimental en sapos fue análoga a la empleada en las otras clases de vertebrados (Cheng et al., 2013), es importante considerar en este punto que los resultados obtenidos podrían variar si la relación de saliencia entre ambos tipos de estímulo (i.e., entre ambas fuentes de información) fuera distinta a la utilizada.
Figura 2. Resumen de resultados del aprendizaje de geometría y claves visuales en el sapo terrestre Rhinella arenarum. A:

Nota: Porcentaje de respuestas correctas del grupo Clave-Geometría durante el entrenamiento. Los animales usaron el contorno geométrico de la arena rectangular y la gran clave visual polarizante para orientarse. B: Porcentaje de respuestas correctas durante la prueba de disociación. Cuando las dos fuentes de información están en conflicto, los sapos prefirieron la geometría para localizar la meta. Los asteriscos indican diferencias significativas entre condiciones (**: p < 0.01). Adaptado de Sotelo, Bingman & Muzio (2015).
Estos resultados confirmaron así que los sapos, como representantes del grupo de los anfibios, se comportan de manera similar a los vertebrados plenamente terrestres (amniotas). En cambio, los resultados obtenidos en un representante de los peces (el pez dorado), parecerían indicar que tienen una preferencia por la información de clave, al menos bajo este paradigma de entrenamiento. En este sentido, a fin de corroborar este perfil de respuesta diferencial y ahondar sobre la posible divergencia de este grupo, todavía es necesario que se realicen más estudios en otras especies de peces.
5.2. Análisis de la actividad neural asociada al aprendizaje de geometría en anfibios
Los animales entrenados bajo los dos experimentos comportamentales anteriores fueron sacrificados inmediatamente después del último ensayo de entrenamiento y analizados histológicamente para estudiar su actividad neural (Sotelo, Bingman & Muzio, 2015b). Para este análisis se adicionó un tercer grupo de animales controles (animales no entrenados) que solo habían sido expuestos a la arena rectangular sin claves y con todas las piletas con agua accesible a fin de habituarlos al aparato experimental y obtener así una medida de la actividad neuronal basal sin entrenamiento (asociada solo a otros factores distintos del aprendizaje de la situación experimental, tal como estímulos visuales, auditivos, propioceptivos, etc.).
Para evaluar la actividad neural asociada al aprendizaje de geometría se empleó la técnica inmunohistoquímica de c-Fos, que se basa en la medicion de la proteína producto de la expresion del gen de activación temprana c-Fos. Esta proteína de localización nuclear, es un factor de transcripción que se utiliza como marcador molecular de neuroplasticidad y activación neural. El protocolo ya había sido utilizado exitosamente en otras especies de heterotermos (e.g., salamandras, [Laberge, Feldhoff, Feldhoff & Houck, 2008]; lagartijas, [Neal & Wade, 2007]) y fue adaptado en nuestro laboratorio para su aplicación en anfibios en el sapo terrestre Rhinella arenarum. Todos los animales (de ambos grupos experimentales y del grupo control) fueron sacrificados por sobredosis de anestesia el último día del experimento una hora después de finalizado el protocolo correspondiente (en el caso de los animales entrenados, grupo clave-geometría y grupo solo geometría, luego de la última sesion de adquisicion; para los animales controles, después de su última sesion de habituacion). Se tomaron entonces cortes del telencéfalo de cada animal mediante criostato para ser tratados con la técnica de c-Fos y estudiados al microscopio optico. La Figura 3 muestra las áreas representativas seleccionadas de cuatro zonas del telencéfalo (Pallium Medial, Pallium Lateral, Septum y Striatum), donde luego se contabilizaron los núcleos neuronales activados.
Figura 3. A: Diagrama de la vista dorsal del telencéfalo del sapo terrestre Rhinella arenarum mostrando el nivel del corte transversal mostrado en B.

Nota: BO: bulbos olfatorios. T: telencéfalo. D: diencéfalo. LO: lóbulos ópticos. C: cerebelo. BR: bulbo raquídeo. IIIv/IVv: tercer y cuarto ventrículo. V/VII/VIII/IX/X: nervios craneanos. B: Esquema de un corte transversal a nivel medio telencefálico. PM: Pallium Medial. PD: Pallium Dorsal. PL: Pallium Lateral. Sep: Septum. Str: Striatum. VL: Ventrículo lateral.
5.2.1. Breve descripción de la técnica inmunohistoquímica de c-Fos
Los cortes fueron hidratados y lavados. Luego se bloquearon las uniones inespecíficas del anticuerpo c-Fos con el agregado de suero antiGOAT. Se realizaron nuevos lavados y se aplicó el anticuerpo primario c-Fos (sc-253, Santa Cruz Biotechnology, Santa Cruz, CA, USA) durante toda la noche dejándolo en heladera. Se lavaron los cortes nuevamente y se aplicó el anticuerpo secundario (Vectastain Rabbit PK-4001 Kit, Vector Laboratories, Burlingame, CA, USA) durante 3 horas. Se revelaron los anticuerpos utilizando el ABC Kit de Vector Labs, diaminobenzamida (DAB) y agua oxigenada. Posteriormente, los cortes se montaron en los portaobjetos y se observaron al microscopio. Se tomaron fotos donde se identificaron las áreas del telencéfalo y se delimitaron áreas para contar los núcleos inmunomarcados. Los resultados se promediaron para cada área de cada grupo y se realizaron análisis estadísticos multivariados y univariados (MANOVA, análisis discriminante multivariado, perfiles multivariados y ANOVAs simples).
El análisis de los resultados mediante la técnica de c-Fos mostró activación neural en todos los grupos estudiados (clave-geometría, solo geometría y control) y en todas las zonas del telencéfalo registradas (Figuras 4 y 5). Esta actividad generalizada era la esperada, ya que el anticuerpo c-Fos muestra áreas de activación de manera inespecífica.
Figura 4. Ejemplo de imágenes tomadas del Pallium Medial (PM) donde se observan las inmunomarcas c-Fos para cada grupo entrenado (Clave-Geometría y Solo Geometría) y del grupo Control.

Nota: Las marcas corresponden a núcleos neuronales. Los grupos entrenados Clave-Geometría y Sólo Geometría presentan una activación significativamente mayor de c-Fos que el grupo Control sin entrenamiento.
Sin embargo, la zona del Pallium Medial mostró mayor activación para los grupos entrenados en tareas espaciales (clave-geometría y solo geometría) con respecto a la activación del grupo control (Figura 5, primer grupo de barras), confirmando la participacion de esta área en la orientación en el espacio.
Figura 5. Densidad de núcleos neuronales marcados con c-Fos (M +/- DS) de las cuatro áreas del telencéfalo analizadas para cada uno de los grupos (Clave-Geometría, Sólo Geometría y Control).

Nota: PM: Pallium Medial. PL: Pallium Lateral. Sep: Septum. Str: Striatum. Los asteriscos indican diferencias significativas entre grupos (*p: < 0.05).
Por otro lado, la zona del Pallium Lateral, mostró una mayor activación neural solo para el grupo clave-geometría (Figura 5, segundo grupo de barras). Esta activación diferencial con respecto al otro grupo entrenado podría corresponderse con el procesamiento adicional de la información de tipo visual, ya que estos animales tenían la clave visual (panel rayado) adicionada a la geometría rectangular. Para hacer un análisis más detallado de la intervencion del Pallium Lateral (o quizás también del Pallium Dorsal, ver discusión) en el procesamiento de las claves visuales del ambiente, serán necesarios más estudios futuros.
6. Discusión y Conclusiones
A partir de toda la información acumulada hasta el presente, la navegación espacial en vertebrados parece ser dependiente de la formación hipocampal y utiliza diferentes fuentes de información según las condiciónes ambientales y los grupos estudiados (Bingman et al., 2003, 2006, 2009; Cheng et al., 2013; Rodríguez et al., 2002).
La gran mayoría de las especies de vertebrados estudiadas, incluyendo a los humanos, coinciden en la utilización de la información geométrica y de claves visuales del ambiente para orientarse en el espacio. El uso de estas fuentes de información no es tan claro en el caso de los invertebrados (hormigas, abejas), más allá de que indudablemente utilizan complejos sistemas de orientación espacial recorriendo muchas veces grandes distancias.
Las características del ambiente por el que circula un organismo, además de las conductas particulares de cada especie, son fundamentales a la hora de pensar en el tipo información codificada para orientarse (Cheng et al., 2013). Por eso, no es extraño que encontremos diferencias entre animales que poseen diferentes ecologías del comportamiento y/o se mueven en ambientes completamente distintos. Por ejemplo, las diferencias entre el ambiente acuático de los peces y el terrestre de la mayoría de los tetrápodos, o ambientes sujetos a grandes cambios estacionales durante el año (Kamil & Balda, 1985). En el mencionado caso de las aves que almacenan semillas a grandes distancias para sobrevivir en el invierno, estas se guían mucho más por características menos sujetas a variaciones temporales como la información geométrica dada por la ubicacion relativa de los árboles o las montañas. A diferencia de otras especies emparentadas, no utilizan tanto las características puntuales de los objetos (e.g., las hojas de los árboles caen, los árboles se llenan de nieve y las características perceptibles de esos objetos están muy sujetas a cambios estacionales). Además, esta mayor memoria espacial está correlaciónada con un mayor volumen y mayor número de células y tipos celulares en la formación hipocampal (Papini et al., 1999).
Asimismo, las distancias relativas en que se mueve cada animal, sumadas a los distintos sistemas de percepción sensorial y a los sustratos neurales que procesan la información ambiental, pueden llevar a encontrar diferencias importantes entre los taxa (Bingman et al., 2003). Así, en el conocido caso de las especies de peces eléctricos del género Eigenmannia, por ejemplo, se conoce la existencia de órganos de recepción de campos eléctricos en la línea lateral que les permite extraer información espacial en un ambiente con pobre visibilidad (Heiligenberg, 1991). En el caso de las aves, también se conoce la utilización de campos magnéticos terrestres como información espacial de gran importancia durante las migraciones (Bingman et al., 2006). Otro ejemplo de un sistema sensorial particular se observa en murciélagos, donde también se ha demostrado que utilizan preferentemente la geometría del ambiente, aunque su modo de percibirla no es a través de la vista sino por ecolocalización (Thiele & Winter, 2003).
En conjunto, la información precedente muestra que la navegación involucra una gran cantidad de información sensorial, de variada procedencia y de diferentes fuentes de procesamiento, según el animal bajo estudio. De ahí también, la complicación de establecer un modelo predictivo global de navegación espacial. Sin embargo, es interesante ver que más allá del procesamiento diferencial de estímulos, las estrategias y la información utilizada para navegar se conservan ampliamente.
Si consideramos las bases neurales, en general, se conoce mucho más sobre la organización comparativa y la función del hipocampo en los mamíferos, aves y reptiles (véase Papp, Witter & Treves, 2007) que en los peces (Salas, Broglio & Rodríguez, 2003), y menos aún en los anfibios (Muzio, 2013; Northcutt & Ronan, 1992). Respecto de la función hipocampal en la orientación en el espacio, el papel similar del hipocampo de los mamíferos, aves y reptiles en la cognición espacial es sorprendente (Colombo & Broadbent, 2000). Así, se ha planteado de forma natural tratar de conocer cuáles fueron las presiones evolutivas que han llevado a esta función similar en la cognición, mientras que al mismo tiempo permitieron diferencias importantes en la organización anatómica y fisiológica entre las distintas clases de amniotas (Bingman & Sharp, 2006), y diferencias en pequeña escala entre especies estrechamente relaciónadas con distintas historias naturales (e.g., Pravosudov & Clayton, 2002).
Sin embargo, desde una perspectiva evolutiva, el momento tal vez más dramático en la evolución de los vertebrados es cuando los anfibios tetrápodos invadieron la tierra. De hecho, los anfibios representan como grupo esa transición. Aunque ninguna de las especies existentes puede ser considerada un remanente de los primeros anfibios, más que ningún otro grupo de vertebrados, los anfibios modernos probablemente conservan características de la organización cerebral que se asemejan a los tetrápodos anfibios de hace unos 400 millones de años atrás, ofreciendo una oportunidad única para examinar el hipocampo desde una perspectiva evolutiva muy remota. Así, la información que hemos recogido recientemente en anfibios sugiere que el área homologa al hipocampo de los mamíferos, el Pallium Medial, al igual que en los demás vertebrados amniotas, también tiene un papel en el aprendizaje de tareas espaciales. Por ejemplo, en experimentos donde se lesionó el Pallium Medial, los sujetos perdieron completamente su capacidad de orientación espacial utilizando estrategias taxonómicas (i.e., respuestas de giro y respuestas de guía con claves visuales en un laberinto en cruz) (Daneri, Casanave & Muzio, 2015b). Estos estudios previos, junto a los descriptos anteriormente sobre la activación del Pallium Medial en el aprendizaje de geometría (Sotelo et al., 2015b), apoyan la idea de que la función de la formación hipocampal en la orientación en el espacio habría surgido tempranamente en el curso de la evolución.
Un ítem aparte lo constituye la activación del Pallium Lateral encontrada solo en los animales entrenados con geometría y clave visual, lo que podría indicar que esta área está involucrada en la integracion de la información de claves visuales a la información geométrica. En este sentido, esta interpretación debe ser tomada con reserva, ya que todavía no existe un consenso entre los neuroanatomistas comparados acerca de la extensión del Pallium Lateral y los límites con su área vecina, el Pallium Dorsal (Moreno & González, 2004; Neary, 1984; Northcutt & Royce, 1975; Roth, Grunwald & Dicke, 2003; Westhoff & Roth, 2002). Por lo tanto, no podemos descartar la posibilidad de que algunos núcleos neuronales activados del Pallium Dorsal fueran procesados en nuestra muestra como parte del Pallium Lateral, ya que la zona seleccionada podría ser considerada por algunos neuroanatomistas como en el límite entre ambas. Para aclarar esta cuestión se deben realizar otros estudios anatómicos y de comportamiento en el sapo Rhinella arenarum, evaluando particularmente los límites entre estas dos áreas del palio, a fin de entender sus implicaciones en la codificación de la información de navegación. En cualquier caso, la prediccion era que esta área debería estar involucrada con el procesamiento de la discriminacion visual relaciónada con las diferentes fuentes de información de navegación proporcionada por la geometría y las señales visuales. Pero serán necesarios más estudios futuros para tener un mejor entendimiento de este tema.
6.1. Comentarios finales
Más allá de las diferencias encontradas entre taxa, también se da una notoria conservación de la utilización de la geometría y las claves visuales del ambiente en los distintos grupos de vertebrados (Tabla 1 ). Resumiendo los antecedentes presentados, en general, podemos decir que en casi todos los grupos analizados hasta el momento se ha demostrado que utilizan tanto la información de claves visuales como la de geometría del ambiente, aunque en alguno de ellos se ha encontrado diferencias en las preferencias por uno u otro tipo de información al presentarse estas dos fuentes de referencia en conflicto. Así, en amniotas (distintas especies de reptiles, aves y mamíferos) se encontró una marcada preferencia por la geometría, mientras que en el pez dorado (la única especie estudiada hasta el momento dentro de los peces), se halló una preferencia por la información de claves visuales. Este hecho, como se discutió previamente, podría estar asociado a las características diferenciales que presenta el ambiente acuático frente al ambiente terrestre. Sin embargo, faltarían analizar especies de peces con diferentes ecologías del comportamiento o que se mueven en ambientes distintos a fin de comprobar si esta preferencia se mantiene (e.g., analizar peces estuariales, peces migratorios, o peces del bajo fondo, donde el relieve del suelo podría otorgar información contundente para la navegación). De la misma manera, el estudio de otros anfibios más asociados al ambiente acuático que el sapo terrestre Rhinella arenarum en su vida adulta, podrían mostrar preferencias dispares a las encontradas para esta especie. Para poder estimar el grado de generalización de los resultados obtenidos en nuestro laboratorio faltaría por lo tanto realizar trabajos en un mayor número de especies de anfibios.
Aunque los trabajos realizados hasta el presente aún no permiten establecer un modelo de cómo se codifica la información espacial en los anfibios, sí muestran claramente la utilización de la geometría y las claves visuales para orientarse y navegar en el ambiente. Es importante destacar también que estos estudios aportan las primeras evidencias del uso de la información geométrica en el aprendizaje espacial para este grupo, capacidad ampliamente demostrada en otras clases de vertebrados.
En cuanto a la actividad neural asociada a este tipo de aprendizaje en anfibios, la evidencia de una mayor activación del Pallium Medial (área homologa al hipocampo de los mamíferos) obtenida en los animales entrenados en tareas espaciales, apoya la hipotesis de que esta área está involucrada en el procesamiento de la información de geometría y claves visuales. De esta forma, además de reafirmar el pensamiento de que el hipocampo es una estructura ampliamente conservada entre los vertebrados (mostrando así un alto grado de homología entre grupos), se suma la idea de que presentaría en los distintos grupos de vertebrados un alto grado de equivalencia funciónal (Sotelo et al., 2015b ). El alto consenso acerca de que la formación hipocampal está implicada en la orientación espacial está apoyado a partir de evidencias anatómicas que muestran que esta región tiene muchísimas conexiones desde las áreas de procesamiento sensorial (como el tálamo, la corteza y el bulbo olfativo en los mamíferos, o el tálamo y el bulbo olfatorio en los anfibios [Westhoff & Roth, 2002 ]). Estas conexiones, que dan un relevamiento casi directo de la información sensorial disponible, sugieren un procesamiento integral de la información ambiental que es esperable de un área de la cual depende la orientación en el espacio. Los estudios del efecto de lesiones realizadas en el área hipocampal de diferentes grupos de vertebrados sustentan esta misma idea. Esto ocurre incluso en distintas especies de peces teleosteos registradas en varias situaciónes de memoria espacial (Rodríguez et al., 2002 ; Salas et al., 2003 ), a pesar de que tienen un desarrollo diferencial del sistema nervioso por eversión (Salas et al., 2003 ). Sin embargo, es importante destacar que además de la formación hipocampal, también existen otras áreas cerebrales que complementan el procesamiento de la información durante la orientación en el espacio. Como se mencionó, el núcleo estriado ha mostrado evidencias de procesar información espacial (e.g., de claves visuales), y es probable que además haya otras áreas involucradas. En el caso del presente estudio en anfibios, parecen estar implicadas áreas del Pallium dorso-lateral.
Como conclusión final, es importante destacar la existencia de un patrón común entre anfibios y todos los amniotas en cuanto a la preferencia por las referencias geométricas en la navegación espacial y un procesamiento hipocampal de dicha información. Este hecho indicaría, por un lado, una conservación evolutiva de esta habilidad, y por otro, apoya la idea de que el papel del hipocampo en la cognición espacial precede a la evolución de los vertebrados plenamente terrestres.
Referencias
Adler, K. (1980). Individuality in the use of orientation cues by green frogs. Animal Behaviour, 28(2), 413-425. doi: 10.1016/S0003-3472(80)80050-9
Anderson, [ Links ] P., Morris, R., Amaral, D., Bliss, T., & O’Keefe, J. (2007). The hippocampal formation. In P. Anderson, R. Morris, D. Amaral, T. Bliss & J. O´Keefe (Eds.), The hippocampus book (1st. ed. pp.3 -8). New York: Oxford University Press.
Bingman, V. P., Hough II, G. E., Kahn, M. C., & Siegel, J. J. (2003). The homing pigeon hippocampus and space: In search of adaptive specialization. Brain, Behavior and Evolution, 62(2), 117-127. doi: 10.1159/000072442
Bingman, [ Links ] V. P., Jechura, T., & Kahn, M. C. (2006). Behavioral and neural mechanisms of homing and migration in birds. In M. F. Brown & R. G. Cook (Eds.), Animal Spatial Cognition: Comparative, Neural, and Computational Approaches . Recuperado de http://www.pigeon.psy.tufts.edu/asc/Bingman
Bingman, [ Links ] V. P., Salas, C., & Rodríguez, F. (2009). Evolution of the Hippocampus. In M. Binder, N. Hirokawa & U. Windhorst (Eds.), Encyclopaedia of Neuroscience (pp. 1356-1360). Berlin: Springer-Verlag. [ Links ]
Bingman, V. P., & Sharp, P. E. (2006). Neuronal implementation of hippocampal-mediated spatial behavior: A comparative-evolutionary perspective. Behavioral and Cognitive Neuroscience Reviews, 5(2), 80-91. doi: 10.1177/1534582306289578
Brattstrom, [ Links ] B. H. (1990). Maze learning in the fire-bellied toad, Bombina orientalis. Journal of Herpetology, 24(1), 44-47. doi: 10.2307/1564288
Brown, [ Links ] A. A., Spetch, M. L., & Hurd, P. L. (2007). Growing in circles: Rearing environment alters spatial navigation in fish. Psychological Science, 18(7), 569-573. doi: 10.1111/j.1467-9280.2007.01941.x
Cheng, [ Links ] K. (1986). A purely geometric module in the rat’s spatial representation. Cognition, 23, 149-178.
Cheng, K., Huttenlocher, J., & Newcombe, N. S. (2013). 25 years on research on the use of geometry in spatial orientation: A current theoretical perspective. Psychonomic Bulletin and Review, 20, 1033-1054. [ Links ]
Cheng, K., Narendra, A., Sommer, S., & Wehner, R. (2009). Traveling in clutter: Navigationin the Central Australian desert ant Melophorus bagoti. Behavioural Processes, 80(3), 261-268. doi: 10.1016/j.beproc.2008.10.015
Cheng, [ Links ] K., Schultheiss, P., Schwarz, S., Wystrach, A., & Wehner, R. (2014). Beginnings of a synthetic approach to desert ant navigation. Behavioural Processes, 102, 51-61. doi: 10.1016/j.beproc.2013.10.001
Cheng, [ Links ] K., Shettleworth, S. J., Huttenlocher, J., & Rieser, J. J. (2007). Bayesian integration of spatial information. Psychologial Bulletin, 133(4), 625-637. doi: 10.1037/0033-2909.133.4.625
Colombo, [ Links ] M., & Broadbent, N. (2000). Is the avian hippocampus a functional homologue of the mammalian hippocampus? Neuroscience and Biobehavioral Reviews, 24(4), 465-484. doi: 10.1016/S0149-7634(00)00016-6
Crane, [ Links ] A., & Mathis, A. (2011). Landamark learning by the Ozark zigzag salamander Plethodon angusticlavius. Current Zoology, 57(4), 485-490. [ Links ]
Daneri, M. F., Casanave, E. B., & Muzio, R. N. (2011). Control of spatial orientation in terrestrial toads (Rhinella arenarum). Journal of Comparative Psychology, 125(3), 296-307. doi 10.1037/a0024242. [ Links ]
Daneri, M. F., Casanave, E. B., & Muzio, R. N. (2015a). Use of local visual landmarks for spatial orientation in toads (Rhinella arenarum): The role of distance to a goal. Journal of Comparative Psychology, 129(3), 247-255. doi: 10.1037/a0039461
Daneri, [ Links ] M. F., Casanave, E. B. & Muzio, R. N. (2015b). Medial Pallium lesion affects both turn and cue spatial learning in terrestrial toads (Rhinella arenarum). Manuscrito en preparacion. [ Links ]
Daneri, M. F., & Muzio, R. N. (2013). El aprendizaje espacial y su relevancia en anfibios. Revista Argentina de Ciencias del Comportamiento, 5(3), 38-49. [ Links ]
Daneri, M. F., Papini, M. R., & Muzio, R. N. (2007). Common toads (Bufo arenarum) learn to anticipate and avoid hypertonic saline solutions. Journal of Comparative Psychology, 121(4), 419-427. doi: 10.1037/0735-7036.121.4.419
Doeller, [ Links ] C. F., & Burgess, N. (2008). Distinct error-correcting and incidental learning of location relative to landmarks and boundaries. Proceedings of the National Academy of Sciences of the United States of America, 105(15), 5909-5914. doi: 10.1073/pnas.0711433105
Gallistel, [ Links ] C. R. (1990). The Organization of Learning. Cambridge, MA: MIT Press. [ Links ]
Heiligenberg, W. (1991). Neural Nets in Electric Fish. Cambridge, MA: MIT Press. [ Links ]
Huttenlocher, J., & Lourenco, S. F. (2007). Coding location in enclosed spaces: Is geometry the principle? Developmental Science, 10(6), 741-746. doi: 10.1111/j.1467-7687.2007.00609.x
Kamil, [ Links ] A. C., & Balda, R. P. (1985). Cache recovery and spatial memory in Clark’s nutcrackers (Nucifraga colombiana). Journal of Experimental Psychology: Animal Behavior Processes, 11, 95-111.
Laberge, F., Feldhoff, R. C., Feldhoff, P. W., & Houck, L. D. (2008). Courtship pheromone-induced c-Fos-like immunolabeling in the female salamander brain. Neuroscience, 151(2), 329-339. doi: 10.1016/j.neuroscience.2007.11.006
Lee, [ Links ] S. A., & Spelke, E. S. (2010). Two systems of spatial representation underlying navigation. Experimental Brain Research, 206(2), 179-188. doi: 10.1007/s00221-010-2349-5
Ló [ Links ]pez, J. C., Vargas, J. P., Gómez, Y., & Salas, C. (2003). Spatial and non-spatial learning in turtles: The role of medial cortex. Behaviorual Brain Research, 143(2), 109-120. doi: 10.1016/S0166-4328(03)00030-5
Miller, [ Links ] N. Y., & Shettleworth, S. J. (2008). An associative model of geometry learning: A modified choice rule. Journal of Experimental Psychology: Animal Behavior Processes, 34(3), 419-422. doi: 10.1037/0097-7403.34.3.419
Links ]lez__2004" id="Moreno_González__2004">Moreno, N., & González, A. (2004). Localization and Connectivity of the Lateral Amygdala in Anuran Amphibians. The Journal of Comparative Neurology, 479(2), 130-148. doi: 10.1002/cne.20298
Muzio, [ Links ] R. N. (1999). Aprendizaje instrumental en anfibios. Revista Latinoamericana de Psicología, 31(1), 35-47. [ Links ]
Muzio, R. N. (2013). Aprendizaje en anfibios, el eslabon perdido: Un modelo simple cerebral en el estudio de conductas complejas. Cuadernos de Herpetología, 27(2), 87-100. [ Links ]
Muzio, R. N., Pistone Creydt, V., Iurman, M., Rinaldi, M., Sirani, B., & Papini, M. R. (2011). Incentive or Habit Learning in Amphibians? PLoS One 6(11): e25798. doi: 10.1371/journal.pone.0025798. [ Links ]
Muzio, R. N., Ruetti, E., & Papini, M. R. (2006). Determinants of instrumental extinction in terrestrial toads (Bufo arenarum). Learning and Motivation, 37(4), 346-356. doi: 10.1016/j.lmot.2005.12.003
Muzio, [ Links ] R. N., Segura, E. T., & Papini, M. R. (1992). Effect of schedule and magnitude of reinforcement on instrumental acquisition and extinction in the toad, Bufo arenarum. Learning and Motivation, 23, 406-429. [ Links ]
Muzio, R. N., Segura, E. T., & Papini, M. R. (1993). Effects of lesions in the medial pallium on instrumental learning in the toad (Bufo arenarum). Physiology and Behavior, 54(1), 185-188. doi: 10.1016/0031-9384(93)90064-M [ Links ]
Nardi, D., & Bingman, V. P. (2007). Asymmetrical participation of the left and right hippocampus for representing environmental geometry in homing pigeons. Behavioural Brain Research, 178(1), 160-171. doi: 10.1016/j.bbr.2006.12.010
Nardi, [ Links ] D., Newcombe, N. S., & Shipley, T. F. (2013). Reorienting with terrain slope and landmarks. Memory and Cognition, 41(2), 214-228. doi: 10.3758/s13421-012-0254-9
Neal, [ Links ] J. K., & Wade, J. (2007). Effects of season, testosterone and female esposure on c-Fos expression in the preoptic area and amygdala of male green anoles. Brain Research, 1166, 124-131. [ Links ]
Neary, T. J. (1984). Anterior thalamic nucleus projections to the dorsal pallium in ranid frogs. Neuroscience Letters, 51(2), 213-218. doi: 10.1016/0304-3940(84)90553-6
Newcombe, [ Links ] N. S., Ratliff, K. R., Shallcross, W. L., & Twyman, A. D. (2010). Young children’s use of features to reorient is more than just associative: Further evidence against a modular view of spatial processing. Developmental Science, 13(1), 213-220. doi: 10.1111/j.1467-7687.2009.00877.x
Northcutt, R. G. (1974). Some histochemical observations on the telencephalon of the bullfrog, Rana catesbeiana Shaw. Journal of Comparative Neurology, 157(4), 379-390. doi: 10.1002/cne.901570403
Northcutt, [ Links ] R. G., & Kicliter, E. (1980). Organization of the amphibian telencephalon. In S. O. E. Ebbesson (Eds.), Comparative neurology of the telencephalon (pp. 203-255). New York: Plenum. [ Links ] doi: 10.1007/978-1-4613-2988-6_8
Northcutt, R. G., & Ronan, M. (1992). Afferent and efferent connections of the bullfrog medial pallium. Brain, Behavior and Evolution, 40(1), 1-16. doi: 10.1159/000113898
Northcutt, [ Links ] R. G., & Royce, G. J. (1975). Olfactory bulb projections in the bullfrog Rana catesbeiana. Journal of Morphology, 145(3), 251-268. [ Links ]
O’Keefe, J., & Dostrovsky, J. (1971). The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research, 34(1), 171-175. doi: 10.1016/0006-8993(71)90358-1
O’ [ Links ]Keefe, J., & Nadel, L. (1978). The hippocampus as a cognitive map. Oxford: Clarendon Press. [ Links ]
Papini, M. R. (2009). Psicologia comparada. Evolución y desarrollo del comportamiento. Bogotá, Colombia: Editorial Manual Moderno. [ Links ]
Papini, M. R., Muzio, R. N., & Segura, E. T. (1995). Instrumental learning in toads (Bufo arenarum): Reinforcer magnitude and the medial pallium. Brain, Behavior and Evolution, 46(2), 61-71. doi: 10.1159/000113259
Papini, [ Links ] M. R., Salas, C., & Muzio, R. N. (1999). Análisis comparativo del aprendizaje en vertebrados. Revista Latinoamericana de Psicología, 31(1), 15-34. [ Links ]
Papp, G., Witter, M. P., & Treves, A. (2007). The CA3 network as a memory storage for spatial representation. Learning and Memory, 14, 732-744. doi: 10.1101/lm.687407
Pecchia, [ Links ] T., & Vallortigara, G. (2010). Reorienting strategies in a rectangular array of landmarks by domestic chicks (Gallus gallus). Journal of Comparative Psychology, 124(2), 147-158. doi: 10.1037/a0019145
Pravosudov, [ Links ] V. V., & Clayton, N. S. (2002). A test of the adaptive specialization hypothesis: population differences in caching, memory and the hippocampus in black-capped chickadees (Poecile atricapilla). Behavioral Neuroscience, 116(4), 515-522. doi: 10.1037/0735-7044.116.4.515
Puddington, [ Links ] M. M., & Muzio, R. N. (2013). Análisis comparado del aprendizaje aversivo en anfibios. Revista Argentina de Ciencias del Comportamiento, 5(3), 50-63. [ Links ]
Puddington, M. M., Papini, M. R., & Muzio, R. N. (2013). Vulnerability of long-term memory to temporal delays in amphibians. Behavioural Processes, 99, 7-11. doi: 10.1016/j.beproc.2013.05.010
Ratliff, [ Links ] K. R., & Newcombe, N. S. (2008). Reorienting when cues conflict: Evidence for an adaptive combination view. Psychological Science, 19(12), 1301-1307. doi: 10.1111/j.1467-9280.2008.02239.x
Rescorla, [ Links ] R. A., & Wagner, A. R. (1972). A theory of pavlovian conditioning: Variations in the effectiveness of reinforcment and nonreinforcement. In A. H. Black & W. F. Prokasy (Eds.), Classical conditioning II: Current theory and research (pp. 64-99). New York: Appleton-Century-Crofts. [ Links ]
Rodríguez, R., López, J. C., Vargas, J. P., Gómez, Y., Broglio, C. & Salas, C. (2002). Conservation of spatial memory function in the pallial forebrain of reptiles and ray-finned fishes. Journal of Neuroscience, 22(7), 2894-2903. [ Links ]
Roth, G., Grunwald, W., & Dicke, U. (2003). Morphology, axonal projection pattern, and responses to optic nerve stimulation of thalamic neurons in the fire-bellied toad Bombina orientalis. The Journal of Comparative Neurology, 461(1), 91-110. [ Links ]
Salas, C., Broglio, C., & Rodríguez, F. (2003). Evolution of forebrain and spatial cognition in vertebrates: Conservation across diversity. Brain, Behavior and Evolution, 62(2), 72-82. doi: 10.1159/000072438
Scoville, [ Links ] W. B., & Milner, B. (1957). Loss of Recent Memory After Bilateral Hippocampal Lesions. The Journal of Neurology, Neurosurgery and Psychiatry, 20(1), 11-21. doi: 10.1136/jnnp.20.1.11
Sheynikhovich, [ Links ] D., Chavarriaga, R., Strösslin, T., Arleo, A., & Gerstner, W. (2009). Is there a geometric module for spatial orientation? Insights from a rodent navigation model. Psychological Review, 116(3), 540-566. doi: 10.1037/a0016170
Sinsch, [ Links ] U. (2006). Orientation and navigation in Amphibia. Marine and Freshwater Behavior and Physiology, 39(1), 65-71. doi: 10.1080/10236240600562794
Sotelo, [ Links ] M. I., Bingman, V. P., & Muzio, R. N. (2015a). Goal orientation by geometric and feature cues: spatial learning in the terrestrial toad Rhinella arenarum. Animal Cognition, 18(1), 315- 323. doi: 10.1007/s10071-014-0802-8. [ Links ]
Sotelo, M. I., Bingman, V. P., & Muzio, R. N. (2015b). Neural activity associated to spatial learning based on geometric and feature cues in the terrestrial toad Rhinella arenarum. Manuscrito en preparacion
Sturz, [ Links ] B. R., Gurley, T., & Bodily, K. D. (2011). Orientation in trapezoid-shaped enclosures: Implications for theoretical accounts of geometry learning. Journal of Experimental Psychology: Animal Behavior Processes, 37(2), 246-253. doi: 10.1037/a0021215
Stü [ Links ]rzl, W., Cheung, A., Cheng, K., & Zeil, J. (2008). Information content of panoramic images: I. Rotational errors and the similarity of views in rectangular arenas. Journal of Experimental Psychology: Animal Behavior Processes, 34(1), 1-14. doi: 10.1037/0097-7403.31.1.1
Thiele, [ Links ] J., & Winter, Y. (2003). Hierarchical strategy for relocating food targets in flower bats: Spatial memoray vs. cue-directed search. Animal Behaviour, 69, 315-327. doi: 10.1016/j.anbehav.2004.05.012
Twyman, [ Links ] A. N. D., Newcombe, N. S., & Gould, T. G. (2013). Malleability in the development of spatial orientation. Developmental Psychology, 55, 243-253. doi: 10.1002/dev.21017
Vargas, [ Links ] J. P., Bingman, V. P., Portavella, M., & López, J. C. (2006). Telencephalon and geometric space in goldfish. European Journal of Neuroscience, 24(10), 2870-2878. doi: 10.1111/j.1460-9568.2006.05174.x
Vargas, [ Links ] J. P., López, J. C., Salas, C., & Thinus- Blanc, C. (2004). Encoding of geometrical and featural spatial information by goldfish (Carassius auratus). Journal of Comparative Psychology, 118(2), 206-216. [ Links ]
Westhoff, G., & Roth, G. (2002). Morphology and projection pattern of medial and dorsal pallial neurons in the frog Discoglossus pictus and the salamander Plethodon jordani. The Journal of Comparative Neurology, 445(2), 97-121. [ Links ]
Wood, E. R., Dudchenko, P. A., Robitsek, R. J., & Eichenbaum, H. (2000). Hippocampal neurons encode information about different types of memory episodes occurring in the same location. Neuron, 27(3), 623-633. doi: 10.1016/S0896-6273(00)00071-4
Wystrach, [ Links ] A. (2009). Ants in rectangular arenas: A support for the global matching theory. Communicative & Integrative Biology, 2(5), 388-390. doi: 10.4161/cib.2.5.8717
Wystrach, [ Links ] A., & Beugnon, G. (2009). Ants learn geometry and features. Current Biology, 19(1), 61-66. doi: 10.1016/j.cub.2008.11.054
Wystrach, [ Links ] A., Cheng, K., Sosa, S., & Beugnon, G. (2011). Geometry, features and panoramic views: Ants in rectangular arenas. Journal of Experimental Psychology. Animal Behaviour Processes, 37(4), 420-435. doi: 10.1037/a0023886 [ Links ]
Citar este artículo como: Sotelo, M. I. y Muzio, R. N. (2015). Aprendizaje espacial y geometría. Los anfibios en la evolución de los sistemas cognitivos cerebrales. Revista Argentina de Ciencias del Comportamiento, 7(3), 64-78.














