Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Cuadernos de herpetología
On-line version ISSN 1852-5768
Cuad. herpetol. vol.24 no.2 San Salvador de Jujuy Aug./Dec. 2010
NOTA
Estructura del ensamble de anuros de la Reserva Integral Laguna de los Padres (Buenos Aires, Argentina)
Oscar Aníbal Stellatelli1 & Laura Estela Vega2
1 Consejo Nacional de Investigaciones Científicas y Técnicas, Argentina. Laboratorio Vertebrados. Departamento de Biología. Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata. Funes 3250 (7600) Mar del Plata,Argentina. os2830@gmail.com
2 Laboratorio Vertebrados. Departamento de Biología. Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata. Funes 3250 (7600) Mar del Plata,Argentina. levega@mdp.edu.ar
Recibido: 17/06/10
Revisado: 08/09/10
Aceptado: 29/11/10
La Reserva Municipal Integral Laguna de los Padres (RILaPa) contiene al humedal más grande del Partido de General Pueyrredón que conserva una fracción valiosa del patrimonio cultural y natural de los humedales pampeanos. Su flora nativa con bosques de tala (Celtis tala) en el límite de su distribución meridional y arbustales de curro (Colletia paradoxa) endémicos del sudeste de la provincia (Cabrera, 1976), la convierten en un sitio de especial interés para su conservación. En los últimos años se han realizado numerosos estudios sobre diversos grupos de vertebrados que habitan la reserva, como los peces (Campana et al. 2001; Petcoff et al., 2002) y las aves (Bó et al., 1996, 2000; Cardoni et al., 2008), sin embargo, la información para anfibios es escasa y sólo se conoce un listado de las especies presentes, citadas en un informe inédito de la Subsecretaria de Medio Ambiente de la Municipalidad de General Pueyrredón (Bellagamba, 1997).
Recientemente se han encontrado trazas de pesticidas organoclorados y bifenilos policlorinados en organismos de distintos niveles tróficos: plantas, crustáceos y peces (González Sagrario et al., 1998; Miglioranza et al., 1999; Campana et al., 2001; González Sagrario et al., 2002; Miglioranza et al., 2002), lo cual constituye una amenaza sobre la diversidad biológica de la Reserva. Conocer no sólo el listado de las especies de anfibios presentes, sino también el "dónde, cuándo y cómo se localizan esas especies", es información que sirve como punto de partida para monitorear posteriormente su estado y evaluar las causas de posibles fluctuaciones numéricas (Heyer et al., 1994). Por estas razones, el objetivo general de este trabajo es relevar la composición, abundancia relativa, distribución espacial y estado sanitario general de las poblaciones, haciendo un énfasis comparativo entre las áreas destinadas a la conservación y a la recreación.
Mensualmente, desde diciembre de 2005 a noviembre de 2006 inclusive, se realizaron muestreos de las poblaciones de anfibios en la Reserva Integral Laguna de los Padres (37º 55'- 38º 02' S y 57º 34' -57º 33' W) del Partido de General Pueyrredón, Provincia de Buenos Aires, Argentina, en cuatro estaciones: dos dentro del área destinada a conservación, una en la zona intangible (zi) y otra en la zona de conservación (zc) y las dos restantes en el área destinada a uso recreativo, una en la zona de transición (zt) y la otra en la zona de usos múltiples (zum) (Fig. 1). El relevamiento se realizó mediante transectos de registro de encuentros visuales (Heyer et al., 1994) y trampeo (Vogt y Hine, 1982). En cada estación se trazaron dos réplicas de transectos de recorrido fijo, de 6 m de ancho y 20 m de largo distanciados entre sí por 300 m, que fueron recorridos dos veces por semana entre las 09:00 y las 18:00 hs. Se colocaron dos réplicas de trampas de caída cerco-embudo construidas según Leynaud y Bucher (2001) en la zi y dos réplicas en la zc, las cuales fueron revisadas dos veces por semana. En las zt y zum no pudieron instalarse dispositivos de trampeo por ser lugares de circulación de personas y vehículos.
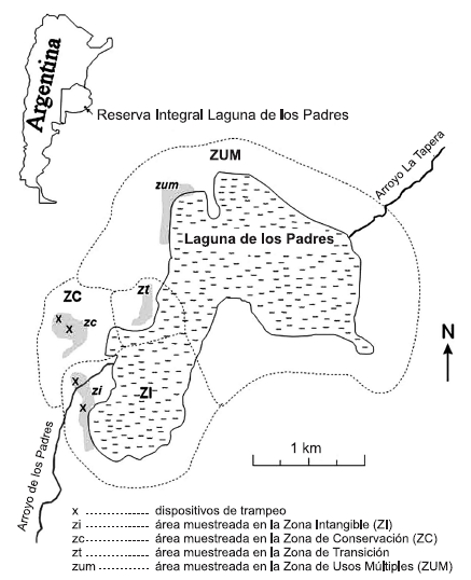
Figura 1. Mapa de la Reserva Integral Laguna de Los Padres con zonificaciones. Las áreas sombreadas abarcan las 4 estaciones de muestreo y las cruces señalan la ubicación de los dispositivos de trampeo.
Para cada individuo se registró especie, edad (postmetamórfico, juvenil y adulto), sexo (cuando fue posible) y se midió el largo hocico-cloaca (LHC) mediante calibre digital con precisión 0,01 mm. Cada ejemplar fue marcado mediante la técnica de corte de falanges según Vogt y Hine (1982) y posteriormente liberado en el mismo sitio de captura. Los ejemplares que presentaban anormalidades fueron transportados al laboratorio para su análisis. La edad de los individuos capturados fue estimada teniendo en cuenta las tallas mínimas reproductivas determinadas según la madurez gonadal de especímenes depositados en la Colección Herpetológica de la Universidad Nacional de Mar del Plata (UNMdP, ver Anexo 1) a partir del grado de pigmentación y el volumen de vitelo que presentaron los óvulos en hembras y el volumen testicular y desarrollo de epidídimos en machos y también en base a la presencia de caracteres sexuales secundarios externos de los individuos vivos (callosidades nupciales, sacos gulares). Fueron considerados postmetamórficos los individuos que presentaron resabios de cola. Para analizar la estructura de cada ambiente se midieron mensualmente sobre los mismos transectos utilizados para el registro de anfibios las variables: a- cobertura de estratos, estimando visualmente el porcentaje de suelo cubierto por cada estrato de vegetación (arbóreo, arbustivo y herbáceo); b- riqueza florística del estrato herbáceo, contando el número de especies vegetales; c- altura media del estrato herbáceo (en cm), todas ellas siguiendo a Gyesel y Lyon (1987) y d- humedad del suelo, usando una escala de 4 categorías (1) seco (sin humedad evidente), (2) húmedo (con un poco de agua pero no fangoso), (3) fangoso (suelo saturado pero no cubierto por agua) y (4) inundado (presencia de agua en la superficie) (Isacch y Martínez, 2003). Se calcularon para cada mes las temperaturas promedio y las precipitaciones acumuladas con datos del Servicio Meteorológico Nacional. Se indagaron las relaciones entre la abundancia de anuros y las condiciones ambientales mediante modelos lineales generalizados (GLM) en donde la variable respuesta fue la abundancia de cada especie y las explicativas fueron las variables de microhábitat y meteorológicas (temperatura media mensual y precipitaciones mensuales acumuladas). Para este análisis se asumió una distribución de Poisson para el error de las variables respuesta y una función logarítmica de enlace (Crawley, 2007). Las variables de microhábitat se compararon entre las cuatro estaciones de muestreo utilizando el test de Kruskall-Wallis y posteriormente el test de Dunn. Para determinar si las proporciones sexuales observadas se aproximaron a las esperadas (1:1), se realizó el test de Chi-cuadrado con corrección de Yates (Zar, 1984).
Los resultados revelaron cuatro especies de anuros correspondientes a tres familias: Rhinella arenarum (Hensel, 1867), Rhinella dorbignyi (Duméril y Bibron, 1841)(Bufonidae), Hypsiboas pulchellus (Duméril y Bibron, 1841) (Hylidae)y Leptodactylus latrans (Steffen, 1815) (Leptodactylidae).
Se capturaron 1349 individuos, el 31.30% visualmente en transectos y el 68.70% mediante trampeo. Un total de 1271 ejemplares representados por tres especies fueron capturados y marcados en las zonas destinadas a conservación (zi y zc), de éstos, 1030 individuos correspondieron a Rhinella arenarum, 239 a Hypsiboas pulchellus y 2 a Leptodactylus latrans. En las zonas de recreación (zt y zum) se capturaron 59 individuos de R. arenarum y 19 de R. dorbignyi.
La abundancia relativa de las especies varió de acuerdo al método de muestreo: mediante registros visuales se detectaron las cuatro especies con abundancias relativas de R. arenarum y H. pulchellus similares (n = 422) (Fig. 2), mientras que con trampeo se registraron tres especies y una mayor abundancia de R. arenarum en relación a H. pulchellus y L. latrans (n = 927) (Fig.2). Ambas metodologías mostraron una mayor frecuencia de R. arenarum y de H. pulchellus en la zi (Fig. 3). Mediante registros visuales se detectó a R. arenarum en la zum, a R. dorbingnyi únicamente en la zt y a un individuo de L. latrans en la zi. Otro ejemplar de L. latrans fue capturado con trampeo en la zc (Fig. 2).
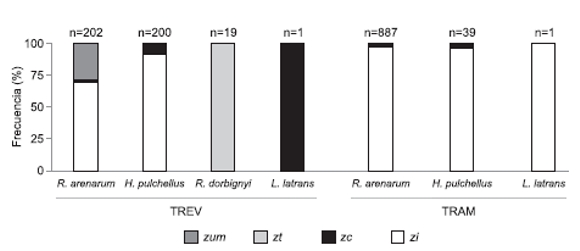
Figura 2. Abundancia relativa en cada estación según el método de muestreo. Referencias: TREV: transectos de registros de encuentros visuales; TRAM: trampeo. Sobre cada barra se indica el tamaño muestral.
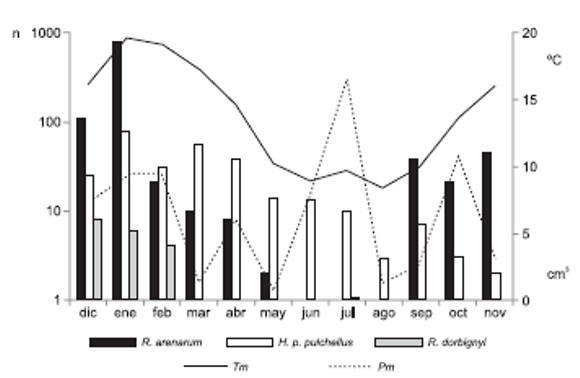
Figura 3. Número total capturas mensuales de R. arenarum, H. pulchellus y R. dorbignyi, temperatura mensual promedio en ºC (Tm) y precipitación mensual acumulada en cm (Pm) a lo largo del año.
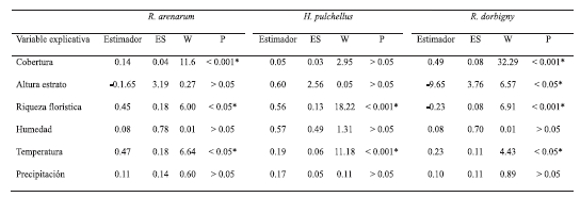
En la zi fue predominante el estrato herbáceo (X ± DS: 81.80% ± 10.30%) sobre el arbóreo (16.35% ± 10.30%), mientras que en la zc el estrato dominante fue el arbustivo (55.69 % ± 19.00%) seguido por el herbáceo (39.59 % ± 19.31%) y el arbóreo (4.71% ± 2.57). La zt sólo presentó estrato herbáceo (78.00 % ± 6,59%) y parches de suelo desnudo (20.58% ± 6.51%) y la zum presentó únicamente estrato herbáceo (89.30% ± 8.43%) y parches sin vegetación inundados (11.31% ± 8.43). El único estrato vegetal utilizado por los anfibios en las cuatro estaciones fue el herbáceo, cuyas diferencias para las variables medidas se muestran en la Tabla 1. Las abundancias de R. arenarum y H. pulchellus se relacionaron positivamente con la riqueza florística, y además R. arenarum se relacionó positivamente con el porcentaje de cobertura del estrato herbáceo (Tabla 2). El número de individuos de R. dorbignyi también se relacionó positivamente con el porcentaje de cobertura del estrato herbáceo, pero se asoció negativamente con la altura y con la riqueza florística (Tabla 2). Al mismo tiempo, las abundancias de estas tres especies se relacionaron positivamente con la temperatura media mensual, y no con las precipitaciones acumuladas mensualmente (Tabla 2, Fig. 3).
Tabla 1. Comparación de medianas de las variables de microhábitat en las cuatro estaciones de muestreo. Test a posteriori de Dunn (α rech.= 0,05) muestra por pares las estaciones entre las que se hallaron diferencias significativas. Referencias: zi = zona intangible; zc = zona de conservación; zt = zona de transición; zum = zona de usos múltiples. H = estadístico K-W (α rech.= 0,05; g.l. = 3); * = diferencia significativa.
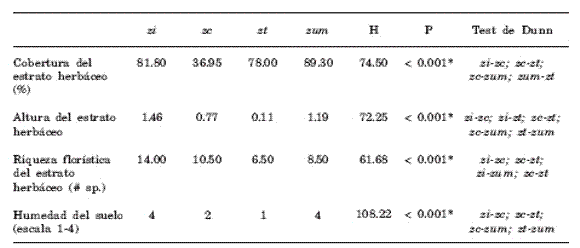
Tabla 2. GLM de la abundancia de especies (variables respuesta) en relación a variables de microhábitat y meteorológicas (variables explicativas). Referencias: ES = error estándar; W = estadístico de Wald; * = diferencia significativa.
La Figura 4 muestra la variación de la frecuencia relativa de los grupos etarios a lo largo de los meses del año para cada especie. Las proporciones sexuales observadas no difirieron significativamente de las esperadas (1:1) para las especies (R. arenarum (test de Chi-cuadrado, Χ2obs = 0.017; P > 0.05; n = 29); H. pulchellus (test de chi-cuadrado, Χ2obs = 0.005; P > 0.05, n = 101) y R. dorbignyi (test de Chi-cuadrado, Χ2obs = 0.00; P > 0.05; n = 6).
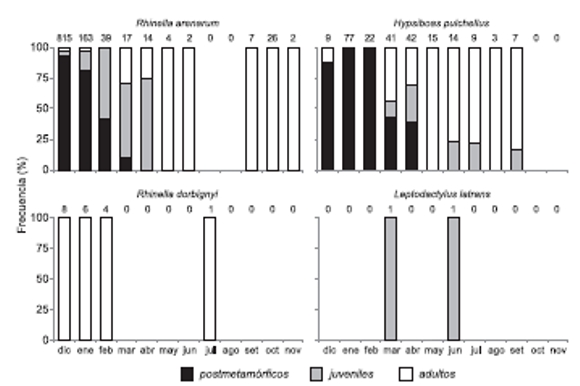
Figura 4. Porcentajes relativos de postmetamórficos, juveniles y adultos por especie en cada mes del año. Sobre las barras se indica el tamaño muestral.
Con respecto al estado sanitario, sólo el 0.37% de los individuos de R. arenarum (n = 1089) presentó anormalidades morfológicas: tres individuos con radio y ulna acortados y ausencia de carpales, metacarpales y falanges en el miembro derecho y otro con acortamiento de los elementos del tarso y sólo tres elementos metatarsales en el miembro trasero izquierdo. El 1.25% de los individuos de H. pulchellus (n = 240) presentó anormalidades: un ejemplar con ausencia del ojo izquierdo y otro con radio y ulna acortados y ausencia de carpales, metacarpales y falanges en la extremidad izquierda. Por su parte, el 22% de los individuos en R. dorbignyi (n = 18) presentaron acortamiento de los elementos del tarso con sólo tres elementos metatarsales en uno de sus miembros traseros (dos en el izquierdo y uno en el derecho) y un ejemplar presentó acortamiento de los elementos del tarso con sólo dos elementos metatarsales en su miembro trasero derecho. Los ejemplares de L. latrans no presentaron anomalías (n = 2).
Las cuatro especies de Anuros que constituyen la comunidad de anfibios de la RILaPa poseen una amplia distribución en Argentina y en el sudeste bonaerense (Cei, 1980; Gallardo, 1974; 1987), habiéndose previamente confirmado en estudios herpetológicos puntuales del ecosistema serrano de Mar del Plata y Balcarce lindante con la RILaPa (Vega y Bellagamba, 1990) y de la franja medanosa oriental de la costa atlántica bonaerense (Vega, 2001; Isacch y Barg, 2002). Se confirman cuatro de las seis especies citadas en el informe flori-faunístico preliminar de la reserva (Bellagamba, 1997), ya que no fueron detectados Odontophrynus americanus y Ceratophrys ornata. El escuercito O. americanus es una especie fosorial tolerante a una amplia variedad de hábitats que habita tanto en pastizales abiertos y sabanas (Aquino et al., 2008) como en bosques de Celtis tala (Moschione, 2006). La ausencia de O. americanus y C. ornata podría estar relacionada a sus patrones reproductivos particularmente irregulares y explosivos que pueden dificultar la detección de estas especies, más aún, si se tiene en cuenta que este trabajo se desarrolló en un período de tiempo relativamente breve. Otra explicación podría ser que la pérdida del pastizal nativo de la RILaPa como consecuencia de la agresiva invasión por zarzamora (Mazzolari y Comparatore, 2007) haya disminuido o eliminado los hábitat requeridos para estas especies.
Las zonas destinadas a la conservación (zi y zc) constituyen el núcleo de mayor riqueza y abundancia de anfibios. Tanto R. arenarum como H. pulchellus fueron más abundantesen estas zonas que en las recreativas, a pesar de que la primera es una especie oportunista y bastante tolerante a ambientes modificados (Gallardo, 1974) y si bien H. pulchellus no es una especialista, ocupó sólo aquellas zonas que presentaron mayor riqueza florística, especialmente con hierbas de hojas largas (Stipa, Scirpus y Eryngium). Es conocido que una mayor heterogeneidad en la estructura de la vegetación genera una mayor disponibilidad de microambientes y de recursos para los anfibios (Vargas y Castro, 1999) y, en este sentido, la zi mostró, no sólo la mayor riqueza florística del estrato herbáceo, sino también una mayor disponibilidad de agua en forma de charcas y fitotelmas. En comparación, la zc presentó un pastizal estructuralmente más homogéneo y con dominancia de la zarzamora invasora. Los ambientes de uso recreativo (zt y zum) fueron áreas estructuralmente más simples y abiertas, con mayor incidencia de la luz solar y menor disponibilidad de sitios húmedos. Esto último explicaría su ocupación por parte de las especies más tolerantes a la desecación como R. arenarum y R. dorbingyi. La presencia exclusiva de esta última en el área transicional se debería a la presencia de un pastizal bajo, cercano a la laguna, cuyo corte artificial sostenido favorecería el terreno para la construcción de sus cuevas.
La abundancia de las especies varió de acuerdo al método de muestreo utilizado. La dominancia de R. arenarum en las capturas con trampaspodría explicarse por sus hábitos caminadores que lo hacen más susceptible a la caída en fosas; mientras que los hábitos más trepadores de H. pulchellus podrían disminuir su probabilidad de caída en trampas y/o facilitar su escape de las mismas. Si bien el trampeo pudo haber sido sensible a los hábitos locomotores de las especies (terrícolas y trepadoras), significó un esfuerzo de muestreo continuo durante día y noche, mientras que los transectos de registros visuales permitieron relevar minuciosamente la actividad de las especies en horas diurnas, por lo que ambos métodos de detección actuaron complementariamente. En el caso de L. latrans su escasa colecta durante el presente relevamiento coincide con lo observado en otros ambientes antropizados y en agroecosistemas donde la abundancia de las especies con fuertes hábitos acuáticos es sustantivamente menor a las del resto de la comunidad (Lajmanovich et al., 2003).
Las estructura poblacional de R. arenarum e H. pulchellus mostró un predominiode individuos postmetamórficos entre fines de la primavera y principios del verano, coincidiendo con el periodo reproductivo. Al igual que muchos otros hylidos y bufónidos presentan una estrategia reproductiva tipo "r" con alta fecundidad y ausencia de cuidados parentales (Basso, 1990). Por otro lado, la estructura poblacional de R. dorbignyi estuvo totalmente sesgada hacia los adultos, lo cual pudo deberse a una deficiencia en el muestro de juveniles y larvas o a bajas tasas de reclutamiento durante el presente relevamiento.
Los picos de abundancia de R. arenarum e H. pulchellus coincidieron con los picos mensuales máximos de la temperatura del aire, pero no con los de las precipitaciones. Rossa-Feres y Jim (1994) han sugerido que en las regiones templadas la combinación de la temperatura y las precipitaciones son los factores determinantes de la actividad circanual de los anfibios. El desfasaje entre los periodos de máximas temperaturas y los de máximas precipitaciones durante el relevamiento sugeriría que la temperatura y, quizás también, otras variables (fotoperiodo, presión atmosférica, velocidad del viento), podrían estar afectando los patrones de actividad de los anuros de la RILaPa en coincidencia con lo hallado en otras localidades al sur de Sudamérica, las cuales tampoco poseen una marcada estacionalidad de lluvias a lo largo del año y en donde la temperatura y el fotoperiodo juegan el rol más importante en la sincronización circanual de la actividad de los anuros (Both et al., 2008; Canavero et al., 2008; Canavero y Arim, 2009).
El grado de anormalidades morfológicas de R. arenarum y H. pulchellus fue menor al 2%, y teniendo en cuenta que valores hasta el 2% son considerados históricamente normales en poblaciones naturales (Eaton et al., 2004), el estado de estas poblaciones sería saludable. No obstante, el hallazgo de un 22% de anormalidades morfológicas en R. dorbignyi, resultó ser mucho mayor que los normales, por lo que merecería un estudio más detallado. Investigaciones recientes sugieren diferentes causas o combinaciones de causas para estas anormalidades, que van desde la contaminación química y la radiación UV-B a parásitos y depredación (Meteyer et al., 2000; Ouellet, 2000; Johnson et al., 2002; Blaustein y Johnson, 2003; Sessions, 2003; Lannoo, 2008; Rohr et al., 2008), por lo que identificar los factores que generan estas anormalidades permitiría obtener información sobre la calidad ambiental de la reserva y fijar medidas de conservación a largo plazo para estas poblaciones de anfibios.
Las condiciones macro y micro-ambientales dadas por un pastizal con mayor heterogeneidad estructural y la mayor disponibilidad de charcas, humedad y sitios protegidos de las zonas intangibles y de conservación, son el factor clave para el asentamiento, actividad y reproducción de las poblaciones de anfibios. Esto se vio reflejado en la mayor abundancia relativa de las especies en estas dos zonas. La presencia humana directa en el área de recreación no parecería afectar significativamente la presencia y/o actividad de los anfibios, como sí ocurre con ciertas aves de la laguna (Cardoni et al., 2008), sino que su menor abundancia se debería a las características estructurales del paisaje original de la zona de usos múltiples y al impacto indirecto de ciertas actividades asociadas a la recreación de los visitantes. Afortunadamente, las estrategias del plan de manejo vigentes en la Reserva tienden a proteger las zonas de mayor calidad ambiental para los anfibios del impacto de la presencia de visitantes y de sus actividades. No obstante, se recomienda a las autoridades locales mantener las restricciones de uso actuales y reforzar los controles para su cumplimiento en todas las zonas, paralelamente con la implementación de un plan de control de especies vegetales invasoras y un programa de monitoreo de las poblaciones de anfibios a largo plazo que incluya estudios ecotoxicológicos.
AGRADECIMIENTOS
A Patricio Bellagamba y al Cuerpo de Guardaparques de la Reserva Integral Laguna de los Padres por el apoyo brindado durante la realización de los muestreos. A la Dra. Gabriela Perotti por sus valiosas recomendaciones y aportes. A Alejandro Baladrón, Carolina Block, Germán García, Matías Delpiani, Eugenia Levy y María José Rodríguez Colman por su colaboración en el muestreo. Este trabajo fue financiado por subsidios otorgados por la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires (CIC) y de la Universidad Nacional de Mar del Plata.
Rhinella arenarum: UNMdP 90, 94-96, 99,100, 376-378, 482, 495, 544, 680, 860, 861, 872, 877, 880, 1091-1100, 1112, 1113.
Rhinella dorbignyi: UNMdP 373, 499-504, 526-533, 1777.
Hypsiboas pulchellus: UNMdP 268-288, 570-590, 1077-1090, 1101-1103, 1119, 1193.
Leptodactylus latrans: UNMdP 1117, 1118, 1160, 1222.
LITERATURA CITADA
1 AQUINO, L.; A. KWET; S. REICHLE; D. SILVANO; N. SCOTT; E. LAVILLA & I. DI TADA. 2008. Odontophrynus americanus. En: IUCN 2010. IUCN Red List of Threatened Species. Version 2010.2. www.iucn.redlist.org [ Links ]
2 BASSO, N. G. 1990. Estrategias adaptativas en una comunidad subtropical de anuros. Cuadernos de Herpetología, serie Monografías 1, 70 pp. [ Links ]
3 BELLAGAMBA, P. 1997. Reserva Integral Laguna de los Padres. Subsecretaría de Medio Ambiente. Municipalidad del Partido de General Pueyrredón. Informe inédito. 19 pp. [ Links ]
4 BLAUSTEIN A. R. & P. T. J. JOHNSON. 2003. The complexity of deformed amphibians. Frontiers in Ecology and Environment 1: 87-94. [ Links ]
5 BÓ, M. S.; S. M. CICCHINO & M. M. MARTÍNEZ. 1996. Diet of long-winged harrier (Circus buffoni) in southeastern Buenos Aires Province, Argentina. Journal of Raptor Research 30 (4): 237-239. [ Links ]
6 BÓ, M. S.; S. M. CICCHINO & M. M. MARTÍNEZ. 2000. Diet of breeding cinereus harriers (Circus cinereus) in southeastern Buenos Aires Province, Argentina. Journal of Raptor Research 34 (3): 237-241. [ Links ]
7 BOTH, C.; I. L. KAEFER; T. G. SANTOS & S. T. Z. CECHIN. 2008. An austral anuran assemblage in the Neotropics: seasonal occurrence correlated with photoperiod. Journal Natural History 42: 205-222. [ Links ]
8 BURGOS, J. J. & A. L. VIDAL.1995. Los climas de la República Argentina según la nueva clasificación de Thornthwaite. Meteoros 1 (1): 3-32. [ Links ]
9 CABRERA, A. L. 1976. Regiones fitogeográficas argentinas. Enciclopedia Argentina de Agricultura y Jardinería. Fascículo 1. ACME. Buenos Aires. 85 pp. [ Links ]
10 CAMPANA, M. A.; A. M. PANZERI; A. H. ESCALANTE; V. J. MORENO & F. L. DULOUT. 2001. Micronucleus test in fish from a pampasic pond (Argentina): An estimation of the presence of genotoxic compounds. Journal of Enviromental Pathology, Toxicology and Oncology 20 (4): 325-331. [ Links ]
11 CANAVERO, A. & M. ARIM. 2009. Clues supporting photoperiod as the main determinant of seasonal variation in amphibian activity. Journal Natural History 43: 2975-2984. [ Links ]
12 CANAVERO, A.; M. ARIM; A. NAYA DE CAMARGO; I. DA ROSA & R. MANEYRO. 2008. Calling activity patterns in an anuran assemblage: the role of seasonal trends and weather determinants. North-Western Journal of Zoology. 4: 29-41. [ Links ]
13 CARDONI, D.A.; M. FAVERO & J. P. ISACCH. 2008. Recreational activities affecting the habitat use by birds in Pampa's wetlands, Argentina: Implications for waterbird conservation. Biological Conservation 141 (3):797-806. [ Links ]
14 CEI, J. M. . Amphibians of Argentina. Monitore Zoologico Italiano, Monografía Nº 2, 609 pp. [ Links ]
15 CRAWLEY, M. J. 2007. The R Book. John Wiley & Sons Ltd., The Atrium, Southern Gate, Chichester, UK. [ Links ]
16 EATON, B. R.; S. EAVES; R.STEVENS; A. PUCHNIAK & R.A. PASZKOWSKI. 2004. Deformity levels in wild populations of the Wood Frog (Rana sylvatica) in three ecorregions of western Canada. Journal of Herpetology 38: 283-287. [ Links ]
17 GALLARDO, J. M. 1974. Anfibios de los alrededores de Buenos Aires. Eudeba. Buenos Aires. 231 pp. [ Links ]
18 GALLARDO, J. M. 1987. Anfibios argentinos. Guía para su identificación. Biblioteca Mosaico. Librería Agropecuaria. Buenos Aires. 98 pp. [ Links ]
19 GONZÁLEZ SAGRARIO, M. DE LOS A.; J. E. AIZPÚN DE MORENO; V. J. MORENO & A. H. ESCALANTE. 1998. Dynamics of organochlorine compounds in different trophic levels of Los Padres pond in Argentina. Environmental Sciences 6 (3): 153-169. [ Links ]
20 GONZÁLEZ SAGRARIO, M. DE LOS A.; K. S. B. MIGLIORANZA; J. E. AIZPÚN DE MORENO; V. J. MORENO & A. H. ESCALANTE. 2002. Polychlorinated biphenyls in different tropic levels from a shallow lake in Argentina. Chemosphere 48 (10):1113-1122. [ Links ]
21 GYESEL, L. W. & L. J. LYON. 1987. Análisis y evaluación del hábitat: 331-334 pp. En: Rodríguez Tarrés, R. (ed.), Manual de técnicas de gestión de vida silvestre. The Wildlife Society. Washington D.C., USA. [ Links ]
22 HEYER, W. R.; M. A. DONNELLY; R. W. MCDIARMID; L. R.HAYEK & M. S. FOSTER. 1994. Measuring and monitoring biological diversity: Standard methods for amphibians. Smithsonian Institution. Washington D. C., USA. 600 pp. [ Links ]
23 ISACCH, J. P. & M. BARG. 2002. Are bufonid toads specialized ant-feeders? A case test from the Argentinian flooding pampa. Journal of Natural History 36 (16): 2005-2012. [ Links ]
24 ISACCH, J. P. & M. M. MARTÍNEZ. 2003. Habitat use by non-breeding shorebirds in flooding Pampas Grasslands of Argentina. Waterbirds 26 (4): 494-500. [ Links ]
25 JOHNSON, P. T. J.; K. B. LUNDE; E. M. THURMAN; E. G. RITCHIE; S. W. WRAY; D. R. SUTHERLAND; J. M. KAPFER; T. J. FREST; J. BOWERMAN & A. R. BLAUSTEIN. 2002. Parasite (Ribeiroia ondatrae) infection linked to amphibian malformations in the western United States. Ecological Monographs 72 (2): 151-168. [ Links ]
26 LAJMANOVICH, R.C.; M. T. SANDOVAL & P. M. PELTZER. 2003. Induction of mortality and malformation in Scinax nasicus tadpoles exposed by glyphosate formulations. Bulletin of Environmental Contamination and Toxicology 70 (3): 612-618. [ Links ]
27 LANNOO, M. J. 2008. Malformed frogs: the collapse of aquatic ecosystems. Berkeley and Los Angeles, California and London, England: University of California Press. [ Links ]
28 LEYNAUD, G. R. & E. H. BUCHER. 2001. Composition, relative abundance and activity patterns of the snake fauna of Los Colorados Biological Station (Western Chaco of Argentina). Boletín de la Academia Nacional de Ciencias 66:121-132. [ Links ]
29 MAZZOLARI, A. R. & V. M. COMPARATORE. 2007. Respuesta de la flora nativa frente a distintos métodos de control de la especie invasora Rubus ulmifolius (zarzamora) en la Reserva Integral Laguna de los Padres, Pcia. de Buenos Aires. En: Actas de III Jornadas Nacionales de Flora Nativa y IV Encuentro de Cactáceas, Córdoba. 309 pp. [ Links ]
30 METEYER C. U.; I. K. LOEFFLER; J. F. FALLON; K. A.CONVERSE; E. GREEN; J. C. HELGEN; S. KERSTEN; R. LEVEY; L. EATON-POOLE & J. G. BURKHART. 2000. Hind limb malformation in free-living northern leopard frogs (Rana pipiens) from Maine, Minnesota, and Vermont suggest multiple etiologies. Teratology 62:151-171. [ Links ]
31 MIGLIORANZA, K. S. B.; M. DE LOS A. GONZÁLEZ SAGRARIO; J. E. AIZPÚN DE MORENO; V. J. MORENO; A. H. ESCALANTE & M. L. OSTERRIETH. 2002. Agricultural soil as a potential source of input of organochlorine pesticides into nearby pond. Environmental Science & Pollution Research 9 (4): 250-256. [ Links ]
32 MIGLIORANZA, K. S. B; J. E. AIZPÚN DE MORENO; V. J. MORENO; M. L. OSTERRIETH & A. H. ESCALANTE. 1999. Fate of organochlorine pesticides in soils and terrestrial biota of "Los Padres" pond watershed, Argentina. Enviromental Pollution 105 (1): 91-99. [ Links ]
33 MOSCHIONE, F. 2006. Biodiversidad y áreas prioritarias para la conservación de los talares bonaerenses: 98-183. En: Mérida, E. & J. Athor (eds.), Talares bonaerenses y su conservación. Fundación de Historia Natural "Félix de Azara". Buenos Aires. [ Links ]
34 OUELLET, M. 2000. Amphibian deformities: current state of knowledge. En: Linder, G.; Bishop, C. A. & Sparling, D. W. (eds.), Ecotoxicology of amphibians and reptiles. Florida: Society of Environmental Toxicology and Chemistry (SETAC) Press. 617-661. [ Links ]
35 PETCOFF, G. M.; A. O. DÍAZ; A. H. ESCALANTE & A. L. GOLDEMBERG. 2002. Comparative histology of the kidney of Oligosarcus jenynsi and Rhamdia sapo from Los Padres Lake (Buenos Aires Province, Argentina). Revista de la Real Academia Gallega de Ciencias 21: 19-30. [ Links ]
36 PROHASKA, F. 1976. The climate of Argentina, Paraguay y Uruguay: 13-112. En: Schewerdtfeger, E. (ed.), Climates of Central and South America. World Survey of Climatology. Elsevier, Amsterdam. [ Links ]
37 ROHR, J. R.; A. M. SCHOTTHOEFER; T. R. RQAFFEL; H. T. CARRICK; N. HALSTEAD; J. T. HOVERMAN; C. M. JOHNSON; L. B. JOHNSON ; C. LIESKE ; M. D. PIWONI; P. K. SCHOFF & V. R. BEASELEY. 2008. Agrochemicals increase trematode infections in a declining amphibian species. Nature 455:1235-1239. [ Links ]
38 ROSSA-FERES, D. & J. JIM. 1994. Distrubução sazonal em comunidades de anfíbios anuros na região de Botucatu, São Paulo. Revista Brasileira de Biologia 54:323-334. [ Links ]
39 SESSIONS, S. K. 2003. What is causing deformed amphibians?: 168-186. En: Semlitsch, R. D. (ed.) Amphibian conservation. Washington, DC: Smithsonian Press. [ Links ]
40 VARGAS, F. & H. CASTRO. 1999. Distribución y preferencias de microhábitat en anuros (Amphibia) en bosque maduro y áreas perturbadas en Anchicayá, Pacífico Colombiano. Caldasia 21: 95-109. [ Links ]
41 VEGA, L. & P. BELLAGAMBA. 1990. Lista comentada de la herpetofauna de las Sierras de Balcarce y Mar del Plata, Buenos Aires, Argentina. Cuadernos de Herpetología 5: 10-14. [ Links ]
42 VEGA, L. 2001. Herpetofauna: diversidad, ecología e historia natural: 213-226. En: Iribarne, O. (ed.), Reserva de la Biosfera Mar Chiquita. Características físicas, biológicas y ecológicas. Editorial Martín. Mar del Plata, Argentina. [ Links ]
43 VOGT, R. R. & R. L. HINE. 1982. Evaluation of techniques for assessment of Amphibian and Reptile Populations in Wisconsin. En: Scott, N. Jr (ed.), Herpetological Communities. United States Department of the Interior Fish and Wildlife Service. Wildlife Research Report, 13. USA. [ Links ]
44 ZAR, J. H. 1984. Biostatistical analysis. Prentice Hall. New Jersey, USA. 718 pp. [ Links ]














