Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.27 no.1 San Salvador de Jujuy mayo 2013
TRABAJOS
Hacia una Taxonomía Integral: poniendo a prueba especies candidatas relacionadas a Liolaemus buergeri Werner 1907 (Iguania: Liolaemini) mediante análisis morfológicos
Cintia Débora Medina, Luciano Javier Avila, Mariana Morando
Centro Nacional Patagónico (CENPAT-CONICET) Blvd. Alte. Brown 2915. U9120ACD, Puerto Madryn, Chubut.
Recibido: 22/03/12
Revisado: 06/07/12
Aceptado: 14/11/12
RESUMEN
La taxonomía tradicional ha estado basada en caracteres de morfología externa o interna, delimitando morfo-especies. En los últimos años comenzó a desarrollarse la denominada taxonomía integral, con el objetivo de integrar los conceptos y métodos básicos de la taxonomía tradicional con nuevos conceptos y metodologías. Dentro de esta aproximación las especies son hipótesis, y las hipótesis de especies más estables, son aquellas avaladas por diferentes tipos de caracteres independientes. Liolaemus es el género de lagartijas con más número de especies de América austral, y dentro del mismo se han propuesto varios clados y complejos. Uno de ellos es el grupo kriegi, que incluye las especies L. buergeri, L. ceii y L. kriegi. En base a tres marcadores mitocondriales, se han propuesto como especies candidatas a tres taxa cercanamente relacionados a L. buergeri: L. sp. A, L. sp. B y L. sp. C. El objetivo de este trabajo es analizar las variaciones morfológicas entre los taxa propuestos y los individuos de la localidad tipo de L. buergeri, a fin de aportar una fuente de evidencia nueva e independiente al análisis de las hipótesis de especies propuestas para este grupo. Se estudiaron individuos de toda el área de distribución de L. buergeri y de las especies candidatas. Para cada ejemplar se registraron caracteres morfométricos, de escamación y el número de poros precloacales en machos. Se encontraron diferencias significativas entre los taxa para las variables analizadas, y se hallaron diferencias en el grado de dimorfismo sexual. Los resultados de estos análisis indican que los taxa candidatos se pueden diferenciar morfológicamente y por lo tanto apoyan, de manera independiente, las hipótesis de especies planteadas por el análisis de DNA mitocondrial.
PALABRAS CLAVE: Lagartijas; Dimorfismo sexual; Variación morfológica; Patagonia; Sistemática.
ABSTRACT
Traditional taxonomy has usually been based mainly on characters of external or internal morphology to delimit morphospecies. Recent years have seen the emergence of "integrative taxonomy", with the objective of integrating the basic concepts and methods of traditional taxonomy with new concepts and methodologies. In this conceptual framework, species are treated as hypotheses and stable species' hypotheses are those supported by different types of independent characters. The lizard genus Liolaemus has the highest species richness of southern South America, and several clades and complexes have been proposed. One of these is the kriegi group, which includes the species L. buergeri, L. ceii and L. kriegi. Based on three mitochondrial markers, three haploclades closely related to L. buergeri have been proposed as candidate species: L. sp. A, L. sp. B and L sp. C. The aim of this paper is to analyze the morphological variation in the proposed clades and individuals from the type locality of L. buergeri, in order to provide a source of new and independent evidence for the analysis of candidate species proposed for this group. We studied individuals across all the distributional range of L. buergeri and the candidate species. For each specimen we registered morphometric and meristic characters, and precloacal pores in males. We found significant differences among taxa for the analyzed variables, as well as in the degree of sexual dimorphism. The results of these analyzes indicate that the candidate taxa can be identified morphologically and therefore support, based on independent evidence, the "candidate species" hypotheses proposed based on mitochondrial DNA.
KEYWORDS: Lizards; Sexual dimorphism; Morphological variation; Patagonia; Systematics.
INTRODUCCIÓN
Una pregunta fundamental de la Sistemática es cómo delimitar especies, especialmente cuando éstas pertenecen a un mismo linaje (Sites y Marshall, 2004). Parte del problema de la delimitación de especies en estos casos, es que la morfología tiene algunas limitantes (por ejemplo cuando una misma especie presenta un alto grado de polimorfismo entre sus poblaciones o cuando dos o más especies presentan convergencia en su morfología). La taxonomía tradicional usualmente basada casi exclusivamente en caracteres de morfología externa o interna, sólo produce morfo-especies (especies establecidas exclusivamente en base a morfología). Durante los últimos 15 años se han desarrollado varios métodos nuevos para delimitar especies y poner a prueba hipótesis de especies (Avise, 2000; Sites y Marshall, 2003), y muchos científicos han obtenido resultados fuertemente respaldados combinando estos métodos con la taxonomía tradicional. Dado que la complejidad de la biología de las especies requiere que los límites de especies sean estudiados desde perspectivas múltiples y complementarias, una aproximación integral a la taxonomía debería volverse una práctica generalizada (Padial y De la Riva, 2007). En los últimos años comenzó a tener más desarrollo este tipo de aproximación, con el objetivo de integrar los conceptos y métodos básicos de la taxonomía tradicional con nuevos conceptos y metodologías, lo que se ha dado en llamar Taxonomía Integral (Integrative Taxonomy, Dayrat, 2005). La taxonomía integral es un marco conceptual en el cual las especies son hipótesis, y para construir hipótesis estables de especies se utilizan grupos de caracteres independientes (Padial y De la Riva, 2007). Además, el nivel de confianza en límites de especies apoyadas por diferentes tipos de datos, es mucho más alto que aquellas soportadas por un solo tipo de evidencia (Dayrat, 2005). Algunos de los problemas de la taxonomía actual no surgen solamente de los métodos utilizados, sino también sobre el nunca terminado debate sobre qué es una especie. Aunque la adopción general entre los taxónomos de un concepto de especie basado en linaje podría ocasionar una inflación taxonómica en ciertos casos; en otros, los estudios detallados e integrales contribuyen a un mejor conocimiento acerca de qué son las especies (Padial y De la Riva, 2007).
Las lagartijas son ampliamente usadas como organismos modelo para estudios evolutivos debido a que la diversidad de las mismas es indicativo de áreas de endemismo, de alta diversidad genética y de diferentes procesos evolutivos (Camargo et al., 2010). Liolaemus es el género de lagartijas con más número de especies de América austral y posee más de 230 especies descriptas (Breitman et al., 2011). El género se distribuye en una amplia región geográfica ocupando latitudes desde los 14º S hasta los 52º S, altitudes desde los 0 m s.n.m hasta los casi 5000 m s.n.m (Donoso-Barros, 1966; Cei, 1986, 1993). Dentro de Liolaemus se reconocen dos grandes grupos (o subgéneros) de especies, Eulaemus y Liolaemus (Laurent, 1983; Etheridge, 1995; Schulte et al., 2000; Espinoza et al., 2004, Morando, 2004). Dentro del subclado Liolaemus sensu stricto, denominado también grupo chiliensis, se han propuesto varios agrupamientos y complejos de especies. Uno de ellos es el grupo kriegi propuesto por Cei (1972), redefinido como Liolaemus elongatus-kriegi pocos años después (Cei, 1974) y más tarde vuelto a definir como grupo kriegi (Cei, 1986). Dentro de este grupo se incluyen las especies Liolaemus buergeri, L. ceii y L. kriegi distribuidas en ambientes rocosos de los Andes Patagónicos Septentrionales y formaciones volcánicas occidentales relacionadas a la Meseta de Somuncurá. Liolaemus buergeri fue descripto en el año 1907 por Werner con localidad tipo en "El Planchón, Cordillera de Curicó, Chile" (Werner, 1907). Es una especie grande (largo hasta 105 mm.), con extremidades cortas, posee escamas vertebrales más pequeñas y aquilladas que las demás dorsales, presenta coloración ocre con bandas longitudinales oscuras (Cei, 1986). Además de la pequeña distribución geográfica señalada en su descripción original para Chile, poblaciones asignables a esta especie fueron señaladas para Mendoza y Neuquén (Cei, 1986). Morando et al. (2003), realizaron un estudio utilizando tres marcadores mitocondriales y, además de encontrar consistencia en la composición del grupo denominado kriegi (igual que Schulte et al., 2000; Lobo, 2001), proponen como especies candidatas a tres taxa cercanamente relacionados a L. buergeri, denominados como L. sp. A, L. sp. B y L. sp. C. En el mencionado trabajo los autores aclaran que, aunque el taxa L. sp. B, con esos marcadores, está cercanamente relacionado a L. buergeri, su fenotipo general es muy diferente a L. buergeri y se corresponde a otra especie del área, L. austromendocinus; por otro lado trabajos en preparación muestran evidencia acerca del posible origen híbrido del taxa L. sp. B (Medina et al., en prep.), por lo que la asignación del mismo a algún grupo taxonómico sería ambigua. Las especies L. sp. A, y L. sp. C son fenotípicamente más similares a L. buergeri, aunque presentan variaciones en patrones de coloración y morfología con respecto a individuos de la localidad tipo. Posteriormente, Lobo (2005) y Lobo et al. (2010), en base a caracteres casi exclusivamente morfológicos, incluyen a L. cristiani en el grupo kriegi.
El objetivo de este trabajo es analizar las variaciones morfológicas en base a datos morfométricos, de escamación, y conteo de poros precloacales, entre L. sp. A y L. sp. C, propuestos como especies candidatas cercanamente relacionadas a L. buergeri (Morando et al., 2003) y los individuos de la localidad tipo de L. buergeri, a fin de aportar una fuente de evidencia nueva e independiente al análisis de las hipótesis de especies propuestas.
MATERIALES Y MÉTODOS
Área de estudio
Se estudiaron individuos provenientes de 40 locali-dades de todo el rango de distribución geográfica de Liolaemus buergeri (Fig. 1), incluyendo las provincias de Mendoza y Neuquén en Argentina y la VII y VIII Región Administrativa en Chile. Estas localidades corresponden a toda el área de distribución geográfica conocida para L. buergeri, incluyendo a las de los taxa L. sp. A y L. sp. C, excepto localidades de la Sierra del Nevado (Mendoza), citadas por Abdala y Robles (2007). También se incluye la localidad tipo de L. buergeri que no estaba considerada en el trabajo de Morando et al. (2003).
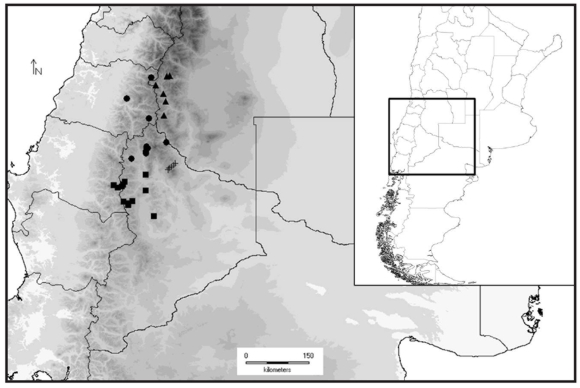
Figura 1. Distribución geográfica de los taxa relacionados a L. buergeri. Las localidades relacionadas con la localidad tipo de esta especie están marcadas con círculos. Las localidades asignadas a la especie candidata L. sp. A están marcadas con cuadrados. Las localidades asignadas a la especie candidata L. sp. C están marcadas con cruces. La especie denominada L. buergeri en Morando et al., 2003, en este trabajo se considera especie candidata L. sp. D (triángulos).
Individuos utilizados
Para realizar el estudio morfológico se utilizaron 121 individuos adultos depositados en la colección LJAMM-CNP (http://200.9.244.24/colecciones03.html). Los individuos fueron asignados de la siguiente manera: 1-los individuos provenientes de la localidad tipo de L. buergeri se denominan L. buergeri (LT = Localidad Tipo), y la muestra está compuesta por 28 hembras y 17 machos; 2-los individuos asignados a L. buergeri por Morando et al. (2003), en base a datos de secuencias de genes (mitocondriales y nucleares) no conforman un clado con los individuos de la localidad tipo (Medina et al., en prep.), pero están cercanamente relacionados, por lo que se denominan L. sp. D, y la muestra está conformada por ocho hembras y 11 machos; 3-la muestra de L. sp. A incluye 21 hembras y 23 machos; y 4-la de L. sp. C nueve hembras y cuatro machos.
Análisis morfológicos
Para cada ejemplar se registraron dos tipos de caracteres, que usualmente son informativos en otros grupos de especies de Liolaemus (Cei, 1974; Etheridge, 1992; Etheridge y Christie, 2003; Abdala, 2007). Caracteres morfológicos o continuos provenientes de mediciones que representan tamaño corporal: Largo hocico-cloaca (LHC): desde el extremo anterior del hocico hasta el borde posterior de las escamas precloacales. Largo tercer dedo anterior (L3DC): longitud de la extremidad anterior desde el codo hasta la uña del tercer dedo. Distancia axila-ingle (DAI): desde la axila de la extremidad anterior derecha hasta la ingle de la extremidad posterior. Largo de la tibia (LT): longitud del hueso tibia. Largo de la cabeza (LC): longitud entre el extremo anterior del hocico hasta la cavidad auricular. Alto de la cabeza (ALCA): alto de la cabeza a la altura de las escamas frontoparietales, el sitio más alto de la cabeza. Largo narina ojo (LNO): longitud entre la narina del lado derecho del cuerpo hasta la comisura del ojo del mismo lado. Distancia entre narinas (DEN): longitud entre la narina izquierda y la derecha. Largo rostro-interparietal (LRI): longitud entre la escama rostral y la interparietal. El segundo tipo de caracteres fueron conteos de escamas o merísticos, donde se contó el número de escamas entre dos puntos determinados. Escamas alrededor del cuerpo (ALR): número de escamas alrededor del cuerpo a la altura de la mitad del cuerpo. Escamas ventrales (VEN): número de escamas sobre una línea recta ventral imaginaria desde el hocico hasta la línea de la ingle. Escamas dorsales (DOR): número de escamas sobre una línea recta dorsal imaginaria desde el comienzo de las escamas dorsales típicas hasta la línea de la ingle. Los datos morfológicos se registraron con calibre digital de precisión 0.05 mm. Los caracteres de conteo de escamas y el conteo de poros precloacales a los individuos machos se realizaron con microscopio estereoscópico.
Análisis estadísticos
Para estudiar el grado de dimorfismo sexual de cada uno de los cuatro taxa, se realizó un MANCOVA de todas las variables en su conjunto, utilizando el programa InfoStat versión 2009 con la variable largo hocico cloaca como co-variable. Al realizarse el MANCOVA para el taxa L. sp. C, dado que el número de observaciones menos el número de tratamientos para este taxón es menor o igual que el número de variables, se eliminaron tres variables (Largo de la cabeza, Distancia axila ingle y Largo rostral interparietal) altamente correlacionadas.
Para la comparación entre taxa, se identificaron los grupos a ser comparados de acuerdo al resultado del análisis de dimorfismo sexual. En los taxa que presentan dimorfismo sexual estadísticamente significativos, para la comparación entre taxa se analizan los sexos por separado. Una vez identificados los grupos se realizó un MANCOVA con Largo hocico cloaca como co-variable para estudiar el efecto del tamaño sobre las restantes variables. Luego, se realizaron dos análisis, una comparación de medias con contraste posterior (MANOVA) y un análisis discriminante. Los análisis estadísticos multivariados se realizaron para todas las variables (tanto continuas como merísticas) de acuerdo a la tendencia de los últimos años en este tipo de estudios (Crochet et al., 2003; Scolaro et al., 2007; Renoult et al., 2009). Para la comparación del número de poros precloacales entre los taxa se realizó una estadística descriptiva y una prueba de Kruskal-Wallis con contrastes a posteriori.
RESULTADOS
Los resultados del análisis de dimorfismo sexual (Tabla 1) indican que los taxa L. buergeri (LT) (p<0.0001) y L. sp. A (p=0.0043) son significativamente dimórficos. En base a estos resultados, los grupos a comparar en el análisis de MANOVA son: machos de L. buergeri (LT) (L. buergeri_M), hembras de L. buergeri (LT) (L. buergeri_H), machos de L. sp. A (L. sp. A_M) y hembras de L. sp. A (L. sp. A_H), machos y hembras de L. sp. D, machos y hembras de L. sp. C.
Tabla 1. Comparación de medias de hembras y machos para todas las variables mediante un MANCOVA para los diferentes taxa relacionados a L. buergeri (LT): L .sp. A, L. sp. C y L. sp. D. del estadístico Lambda de Wilks, del estadístico F consus respectivos grados de libertad y la significancia estadística (p) asociados a la prueba deMANCOVA para muestras independientes. Los correspondientes p < 0.05 están marcadosen negrita. * Dado que el numero de observaciones menos el número de tratamientos para L. sp. C, es menor o igual que el número de variables, se eliminaron tres variables altamente correlacionadas (Largo de la cabeza, Distancia axila ingle y Largo rostral parietal) para realizar esta prueba. 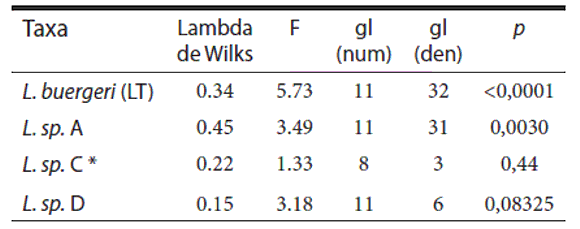
Tanto el análisis de MANCOVA como el MANOVA dieron resultados cuantitativamente iguales y la variable Largo Hocico Cloaca (LHC) tuvo un efecto significativo sobre el resto de las variables. La igualdad en los resultados de ambos análisis puede deberse a que el efecto del LHC no altera la relación entre los taxa y el resto de las variables. Por lo tanto se realizan las inferencias en base al MANOVA. En el análisis de las medias de los diferentes grupos se obtuvo una diferencia significativa (MANOVA, p<0.0001); y en los contrastes a posteriori se obtuvo que todos los grupos son significativamente distintos entre sí (Tabla 2a y b).
Tabla 2. Resultados del MANOVA para los taxa divididos por sexo en los casos en que fueron significativamente dimórficos. a- Se muestran los valores del estadístico Lambda de Wilks, del estadístico F con sus respectivos grados de libertad y la significancia esta-dística (p) asociados a la prueba MANOVA. b- Contraste a posteriori. Letras distintas indican diferencias significativas del contraste a posteriori con un p≤ 0.05. Largo hocico-cloaca (LHC), Largo de la cabeza (LC), Alto de la cabeza (ALCA), Distancia entre narinas (DEN), Largo tercer dedo anterior (L3DC), Largo de la tibia (LT), Distancia axila-ingle (DAI), Largo narina ojo (LNO), Largo rostro-interparietal (LRI), Escamas dorsales (DOR), Escamas ventrales (VEN), Escamas alrededor del cuerpo (ALR). 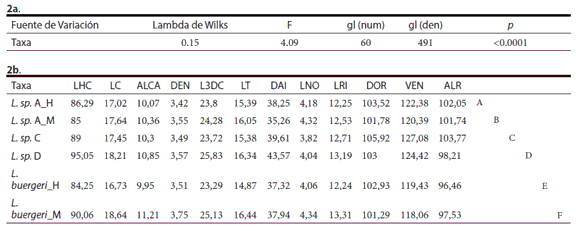
En el análisis discriminante (Tablas 3 y 4, Fig. 2) se obtuvo un error total del 38%, el porcentaje de variabilidad explicada con los dos primeros ejes canónicos es del 80,51%, siendo las variables más explicativas: Largo hocico cloaca, Largo de la cabeza y Largo de la tibia (para el primer eje canónico) y Escamas alrededor del cuerpo (segundo eje canónico).
Tabla 3. Proporción de los autovalores, que representan la variabilidad de los datos en cada una de las direcciones de los autovectores (conjunto de vectores bases para graficar los datos) del análisis de componentes principales para todas las variables y su proporción acumulada, relacionados a la Fig. 2. El primer eje canónico (asociado con el mayor de los autovalores), permite visualizar la máxima separación entre los grupos.
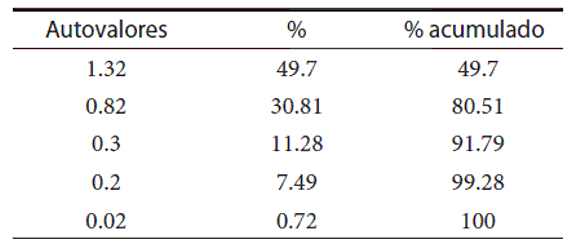
Tabla 4. Funciones discriminantes: datos estandarizados con la varianzas comunes del análisis discriminante. En negrita los valores de las variables más explicativas. 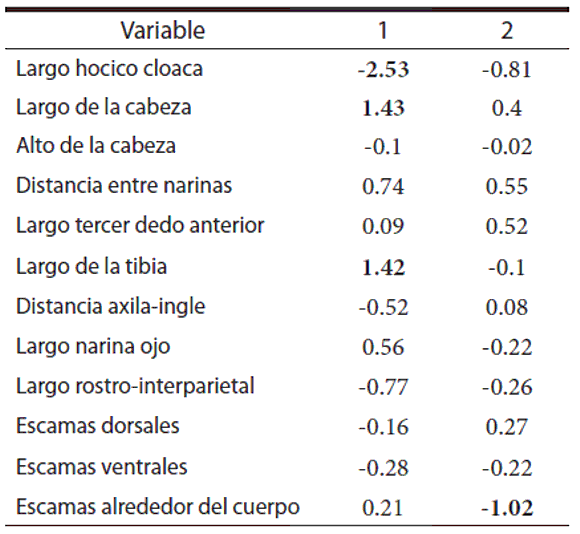
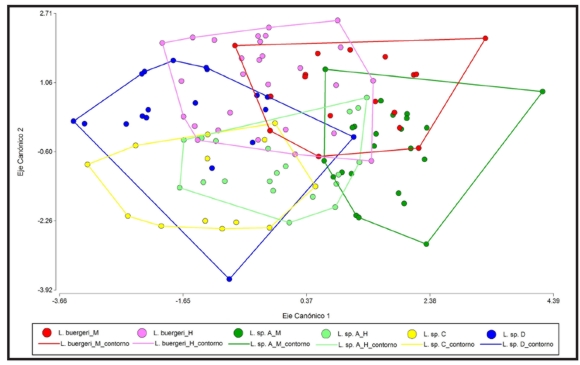
Figura 2. Resultado del análisis discriminante entre los grupos seleccionados de acuerdo a la presencia o ausencia de dimorfismo sexual.
Los resultados de la estadística descriptiva y com paración de número de poros por medio de la prueba de Kruskal-Wallis entre los taxa se muestran en la Tabla 5 y los contrastes en la Tabla 6. Existen diferencias significativas en el número de poros precloacales entre los distintos taxa. Los machos de L. buergeri tienen un número significativamente distinto a los machos de L. sp. D y los machos de los taxa L. sp. A y L. sp. C tienen un número intermedio a los primeros.
Tabla 5. Resultados de la estadística descriptiva del conteo de poros en los machos de cada taxa. Mediana (Med), Media, Des-vío Estándar (DE), Mínimo (Mín), Máximo (Máx), estadístico de la prueba de Kruskal-Wallis (H), probabilidad asociada a la prueba (p). 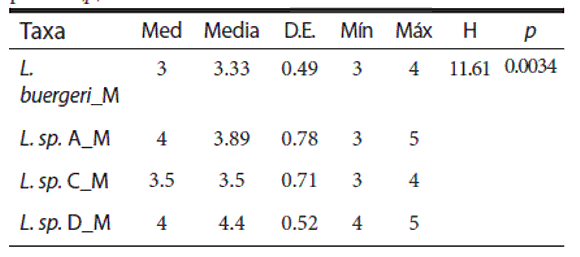
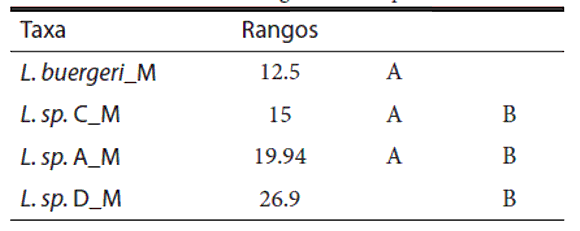
Tabla 6. Resultado del contraste a posteriori de la prueba de Kruskal-Wallis para el número de poros precloacales. Letras distintas indican diferencias significativas (p≤ 0.05).
DISCUSIÓN y CONCLUSIÓN
El objetivo de este trabajo fue analizar las variaciones morfológicas, en base a datos morfométricos, de escamación, y cantidad de poros precloacales, entre individuos de Liolaemus buergeri de la localidad tipo y las dos especies candidatas (L. sp. A, L. sp. C) propuestas por Morando et al. (2003); con el fin de aportar una nueva fuente de evidencia, independiente de la molecular, para el análisis del nivel de soporte de estas hipótesis de especies. Dado que los individuos referidos como L. buergeri por Morando et al. (2003) presentan diferencias, en base a caracteres moleculares (Medina et al., en prep.), con los incluidos aquí de la localidad tipo, los mismos se consideran una especie candidata que denominamos L. sp. D. En primer lugar, los resultados de este trabajo detectan diferencias estadísticamente significativas, en el nivel de dimorfismo sexual entre los cuatro taxa estudiados. Liolaemus buergeri (LT) y L. sp. A presentan dimorfismo sexual, mientras que L. sp. C y L. sp. D no presentan diferencias significativas entre machos y hembras con las variables estudiadas (Tabla 1). El dimorfismo sexual es un fenómeno común entre los animales, y las causas más frecuentemente citadas para explicar este fenómeno son selección sexual, selección por fecundidad y causas ecológicas (e.g. partición de recursos, divergencia de nicho) (Shine, 1989; Andersson, 1994). Aunque son necesarios estudios detallados para evaluar cuál de éstas puede ser la causa subyacente del dimorfismo sexual en L. buergeri (LT) y L. sp. A, las diferencias entre los sexos en estos taxa son estadísticamente significativas. Desde el punto de vista taxonómico, las diferencias halladas en esta característica son muy útiles para diferenciar estos taxa.
El análisis comparativo de las medias de los taxa (MANOVA, Tabla 2a y b) muestra que son significativamente distintos, tanto para los taxa con dimorfismo sexual, como para los que no presentaron dimorfismo. Pero, debido a que en el análisis discriminante (Fig. 2) se obtuvo un error del 38% promedio para todos los taxa, a pesar de que los mismos sean significativamente distintos en sus promedios de medidas, la discriminación entre ellos puede ser errónea. A pesar de que en el análisis discriminante (Fig. 2) se observan diferentes grados de solapamiento entre los taxa estudiados, se puede apreciar que L. sp. A posee el mayor grado de dimorfismo sexual, y que los machos de L. sp. A casi no tienen solapamiento con L. sp. C y es mínimo con L. sp. D. Por otro lado la distribución de la muestra de L. sp. C está casi por completo contenida dentro de la de L. sp. D. Cabe destacar que la distribución geográfica de estos taxa es disyunta, con una distancia de 200 km en línea recta, y están separadas por una importante barrera geográfica, que es el valle del Río Barrancas (Fig. 1). Por otro lado L. sp. D, que se encuentra geográficamente cercana a la localidad tipo de L. buergeri, casi no presenta solapamiento con los machos de L. buergeri (LT) y parcialmente con las hembras de L. buergeri (LT). Los machos de L. buergeri (LT) están parcialmente solapados con las hembras de L. buergeri (LT) y con los machos de L. sp. A, situada a 300 km en línea recta hacia el sur. A pesar de que se podría suponer que estas diferencias tienen alguna relación con las presiones ambientales diferenciales en estas áreas, estudios recientes realizados a nivel general para varias especies de Liolaemus (Schulte et al., 2004; Pincheira-Donoso et al., 2009), no encuentran relación entre el hábitat y la morfología. Sin embargo hay ejemplos en otros géneros de lagartijas (e.g. Phrynosoma, Luxbacher y Knouft, 2009), donde se demostró una correlación entre las características morfológicas con el nicho ambiental y se pudo inferir que aquellas poblaciones que se encuentran en ambientes similares en la misma región fitogeográfica, son sometidas a presiones de selección semejantes. Por lo tanto, sería interesante en el caso de los taxa estudiados en este trabajo caracterizar sus nichos para evaluar a otro nivel (de complejo de especies) si hay alguna relación entre características morfológicas y nicho.
Liolaemus buergeri posee como máximo 4 poros precloacales en los machos según Cei (1986), esto se condice con nuestros resultados con un mí-nimo de 3 y un máximo de 4 en L. buergeri (LT). El taxa L. sp. C tiene este mismo rango pero los taxa L. sp. A y L. sp. D tienen un rango de 3 a 5 y de 4 a 5 respectivamente. Si bien estas diferencias en el rango del número de poros son escasas, son informativas dentro del conjunto de evidencia para diagnosticar las hipótesis de especies estudiadas en este trabajo.
En su conjunto, los resultados de estos análisis morfológicos apoyan, de manera independiente, las hipótesis de especies planteadas en base a datos de secuencias de genes mitocondriales. Bajo el marco conceptual de la taxonomía integral, esta evidencia morfológica le otorga mayor estabilidad a estas hipótesis, avalando que estos taxa son diferentes y cada uno posee características particulares e individualizables.
AGRADECIMIENTOS
Los autores agradecen a F. Breitman, N. Feltrin, M. Kozykariski, I. Minoli, L. Martinez, C.H.F. Perez, D.R. Perez, M. Olave y N. Frutos por la asistencia en los trabajos de campo y en el procesado del material. Se agradece a las Autoridades de las Direcciones de Fauna de las provincias de Río Negro, Neuquén y Mendoza por los permisos de colecta emitidos, en particular a M. Monteverde, M. Aubone, S. DiMartino y M. Failla. Este proyecto fue realizado gracias al apoyo financiero de los subsidios: ANPCYT-FONCYT PICT 2006-506 (LJA), ANPCYT-FON-CYT 33789 (MM) y NSF (PIRE OISE 0.530.267, Especiación en Patagonia).
LITERATURA CITADA
1. Abdala, C.S. 2007. Phylogeny of the boulengeri group (Iguania: Liolaemidae, Liolaemus) based on morphological and molecular characters. Zootaxa 1538: 1-84. [ Links ]
2. Abdala, C.S. & Robles, C. 2007. Liolaemus buergeri. Argentina: Mendoza province. Herpetological Review 38: 101. [ Links ]
3. Andersson, M. 1994. Sexual Selection. Princeton University Press, New Jersey. [ Links ]
4. Avise, J.C. 2000. Phylogeography: The History and Formation of Species. Harvard University Press, Cambridge, Massachusetts & London, England. [ Links ]
5. Breitman, M.F.; Avila, L.J.; Sites Jr., J.W. & Morando, M. 2011. Lizards from the end of the world: phylogenetic relationships of the Liolaemus lineomaculatus section (Squamata: Iguania: Liolaemini). Molecular Phylogenetics and Evolution 59: 364-376. [ Links ]
6. Camargo, A.; Sinervo, B. & Sites Jr., J.W. 2010. Lizards as model organisms for linking phylogeographic and speciation studies. Molecular Ecology 19: 3250-3270. [ Links ]
7. Cei, J.M. 1972. Herpetología patagónica. 3. Relaciones de afinidad sero-proteínica y filéticas en el género Liolaemus. Physis 31: 83411-83422. [ Links ]
8. Cei, J.M. 1974. Revision of the Patagonian Iguanids of the Liolaemus elongatus complex. Journal of Herpetology 8: 219-229. [ Links ]
9. Cei, J.M. 1986. Reptiles del centro, centro-oeste y sur de la Argentina. Museo Regionale di Scienze Naturali, Torino Monografie 4: 1-527. [ Links ]
10. Cei, J.M. 1993. Reptiles del noroeste, nordeste y este de la Argentina. Herpetofauna de las selvas subtropicales, Puna y Pampas. Museo Regionale di Scienze Naturali Torino Monografie 14: 1-949. [ Links ]
11. Crochet, P.A.; Geniez, P. & Ineich, I. 2003. A multivariate analysis of the fringe-toed lizards of the Acanthodactylus scutellatus group (Squamata: Lacertidae): systematic and biogeographical implications. Zoological Journal of the Linnean Society 137: 117-155. [ Links ]
12. Dayrat, B. 2005. Towards integrative taxonomy. Biological Journal of the Linnean Society 85: 407-415. [ Links ]
13. Donoso-Barros, R. 1966. Reptiles de Chile. Ediciones Universidad de Chile, Santiago, Chile. [ Links ]
14. Espinoza, R.E.; Wiens, J.J. & Tracy, C.R. 2004. Recurrent evolution of herbivory in small, cold-climate lizards: Breaking the ecophysiological rules of reptilian herbivory. Proceedings of the National Academy of Sciences USA 101: 16819-16824. [ Links ]
15. Etheridge, R. 1992. A new psammophilus lizard of the genus Liolaemus (Squamata: Tropiduridae) from northwestern Argentina. Bolletino del Museo Regionale di Scienze Naturali, Torino 10: 1-19. [ Links ]
16. Etheridge, R. 1995. Redescription of Ctenoblepharis adspersa Tschudi, and the taxonomy of Liolaemidae (Reptilia, Squamata, Tropiduridae). American Museum Novitates 3142: 1-34. [ Links ]
17. Etheridge, R. & Christie, M.I. 2003. Two new species of the lizard genus Liolaemus (Squamata: Liolaemidae) from northern Patagonia, with comments on Liolaemus rothi. Journal of Herpetology 37: 325-341. [ Links ]
18. Laurent, R.F. 1983. Contribución al conocimiento de la estructura taxonómica del género Liolaemus Wiegmann (Iguanidae). Boletín de la Asociación Herpetológica Argentina 1: 15-18. [ Links ]
19. Lobo, F. 2001. A phylogenetic analysis of lizards of the Liolaemus chiliensis group (Iguania: Tropiduridae). Herpetological Journal 11: 137-150. [ Links ]
20. Lobo, F. 2005. Las relaciones filogenéticas dentro del grupo chiliensis (Iguania: Liolaemidae: Liolaemus): sumando nuevos caracteres y taxones. Acta Zoológica Lilloana 49: 65-87. [ Links ]
21. Lobo, F.; Espinoza, R.E. & Quinteros, S. 2010. A critical review and systematic discussion of recent classification proposals for Liolaemid lizards. Critique 30: 1-30. [ Links ]
22. Luxbacher, A.M. & Knouft, J.H. 2009. Assessing concurrent patterns of environmental niche and morphological evolution among species of horned lizards (Phrynosoma). Journal of Evolutionary Biology 22: 1669-1678. [ Links ]
23. Morando, M.; Avila, L.J. & Sites Jr, J.W. 2003. Sampling strategies for delimiting species: genes, individuals, and populations in the Liolaemus elongatus-kriegi complex (Squamata: Liolaemidae) in Andean-Patagonian South America. Systematic Biology 52: 159-185. [ Links ]
24. Morando, M. 2004. Sistemática y filogenia de grupos de especies de los géneros Phymaturus y Liolaemus (Squamata: Tropiduridae: Liolaeminae) del oeste y sur de Argentina. Tesis Doctoral inédita. Universidad Nacional de Tucumán. [ Links ]
25. Padial, J.M. & De La Riva, I. 2007. Integrative taxonomists should use and produce DNA barcodes. Philosophical Transactions of the Royal Society of London 68: 67-68. [ Links ]
26. Pincheira-Donoso, D.; Hodgson, D.J.; Stipala, J. & Tregenza, T. 2009. A phylogenetic analysis of sex-specific evolution of ecological morphology in Liolaemus lizards. Ecological Research 24: 1223-1231. [ Links ]
27. Renoult, J.P.; Geniez, P.; Bacquet, P.; Benoit, L. & Crochet, P.A. 2009. Morphology and nuclear markers reveal extensive mitochondrial introgressions in the Iberian Wall lizard species complex. Molecular Ecology 18: 4298-4315. [ Links ]
28. Schulte, J.A.; Macey, J.R.; Espinoza, R.E. & Larson, A. 2000. Phylogenetic relationships in the iguanid lizard genus Liolaemus: multiple origins of viviparous reproduction and evidence for recurring Andean vicariance and dispersal. Biological Journal of the Linnean Society 69: 75-102. [ Links ]
29. Schulte, J.A.; Losos, J.B.; Cruz, F.B. & Núñez, H. 2004. The relationship between morphology, escape behaviour and microhabitat occupation in the lizard clade Liolaemus (Iguanidae: Tropidurinae: Liolaemini). Journal for Evolutionary Biology 17: 408-420. [ Links ]
30. Scolaro, J.A.; Videla, F.; Puig, S. & Marcus, A. 2007. Diferencias morfológicas y status taxonómico de las especies simpátricas Liolaemus coeruleus y Liolaemus neuquensis (Reptilia: Iguania: Liolaemidae). Multequina 16: 53-63. [ Links ]
31. Shine, R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence. The Quarterly Review of Biology 64: 419-464. [ Links ]
32. Sites Jr, J.W. & Marshall, J.C. 2003. Delimiting species: a renaissance issue in systematic biology. Evolution 18: 462-470. [ Links ]
33. Sites Jr, J.W. & Marshall, J.C. 2004. Operational criteria for delimiting species. Annual Review of Ecology, Evolution, and Systematics 35: 199-227. [ Links ]
34. Werner, F. 1907. Sobre algunos lagartos nuevos clasificados i descritos. En: Bürger, O. Estudios sobre reptiles chilenos. Anales de la Universidad de Chile 121: 149-155. [ Links ]













