Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.27 no.1 San Salvador de Jujuy mayo 2013
TRABAJOS
Composición y riqueza de anfibios y sus relaciones con las características de los sitios de reproducción en un sector de la Selva Atlántica de Misiones, Argentina
Julián N. Lescano1, Marcelo F. Bonino2, Mauricio S. Akmentins3
1 Centro de Zoología Aplicada, F.C.E.FyN., Universidad Nacional de Córdoba - IDEA (CONICET-UNC) Rondeau 798 (5000), Córdoba, Argentina.
2 Laboratorio de Fotobiología. INIBIOMA (CONICET-UNCOMA). Centro Regional Universitario Bariloche, Quintral 1250, (8400) San Carlos de Bariloche, Río Negro, Argentina.
3 CONICET- Centro de Investigaciones Básicas y Aplicadas (CIBA), Universidad Nacional de Jujuy, Gorriti 237 (4600), S.S. Jujuy, Argentina - Instituto de Bio y GeoCiencias del NOA (IBIGEO) Museo de Ciencias Naturales, Universidad Nacional de Salta. Mendoza 2 (4400), Salta, Argentina.
Recibido: 25/07/12
Revisado: 28/08/12
Aceptado: 19/09/12
RESUMEN
La Selva Atlántica presenta un gran número de anfibios endémicos. En la actualidad solo resta el 7,5 % de la superficie original de esta ecorregión. En el presente trabajo se compara la composición y riqueza de los ensambles de anfibios asociados a distintos tipos de cuerpos de agua en un sector de la Selva Atlántica Interior (SAI) de Argentina. Los muestreos se realizaron durante cuatro meses en dos años consecutivos en cuatro ambientes reproductivos: charcas temporarias, barreros, arroyos permanentes y arroyos temporarios. En estos sitios se registró la composición y riqueza de anfibios y se cuantificaron variables de la estructura del hábitat. Las charcas temporarias presentaron mayor riqueza que el resto de los ambientes acuáticos muestreados. Además se encontraron asociaciones entre la abundancia de distintas especies de anuros y la vegetación en los cuerpos de agua. Los resultados evidencian que los cuerpos de agua de distinta naturaleza presentan presiones ambientales diferenciales para los anfibios (ej. predación; hidroperíodo) lo cual modelaría la composición y diversidad de los ensambles de anuros. Finalmente se resalta la importancia de los pequeños cuerpos de agua lénticos y la heterogeneidad de la vegetación que los rodea para la diversidad de anfibios de la SAI.
PALABRAS CLAVE: Anuros; Bosque Atlántico; Humedales; Argentina.
ABSTRACT
Atlantic forest harbors a large number of endemic amphibian's species. At present only 7.5 % of the Atlantic Forest original surface remains. In this study we compare frog's species richness and assemblage composition between different types of reproductive habitats in a sector of the Atlantic Forest of Argentina. Surveys were made during four months in two consecutive years. Four reproductive habitats were surveyed: temporary ponds, pig wallows, temporary streams and permanent streams. Frogs species richness and composition and environmental descriptors were recorded in these habitats. Temporary ponds have the greatest richness. Anuran abundance shows associations with vegetation in the bodies of water. The results suggest that different types of wetlands exert differential pressures (e.g. predation, hidroperiod) on amphibian assemblages. Finally, we highlight the importance of small ponds and vegetation heterogeneity for anuran assemblages of the Atlantic Forest of Argentina.
KEYWORDS: Anurans; Atlantic Forest; Wetlands; Argentina.
INTRODUCCIÓN
Desde hace ya varias décadas se han reportado declinaciones en numerosas especies y poblaciones de anfibios de todo el mundo. La perdida y degradación del hábitat se encuentran entre los factores más importantes involucrados en esta crisis global (Stuart et al., 2004; Gardner et al., 2007). Es por ello que el conocimiento sobre los patrones de distribución, abundancia y las interacciones de las especies y comunidades con el hábitat es necesario para la toma de decisiones en acciones de conservación.
En Sudamérica, gran parte de los trabajos que han analizado la distribución espacial de la diversidad en ensambles de anuros se han realizado en ambientes de selvas tropicales como el Amazonas (Hödl, 1977; Gascon, 1991; Neckel-Oliveira et al., 2000). Sin embargo en los últimos años el conocimiento acerca de estos patrones básicos se ha incrementado en otras regiones del continente (e.g. Vaira, 2002; Prado et al., 2005; Walting y Donelly, 2008; Gangenova et al., 2012) y particularmente en sectores tropicales y subtropicales de la Selva Atlántica de Brasil (ej. Conte y Machado, 2005; Conte y Rossa Feres, 2006; Vasconcelos y Rossa-Feres, 2005; Moraes et al., 2007; Zina et al., 2007).
La ecorregión de la Selva Atlántica es consi-derada como un "hotspot" en términos de biodiversidad (Myers et al., 2000). En ella habitan más de 400 especies de anfibios y presenta un elevado número de endemismos (Haddad y Prado, 2005). Sin embargo, esta ecorregión se encuentra entre los ecosistemas boscosos más amenazados del mundo y en la actualidad subsiste el 7,5 % de su superficie original (Morellato y Haddad, 2000; Myers et al., 2000).
La deforestación de la Selva Atlántica tiene una fuerte repercusión sobre los ensambles de anfibios que se reproducen en arroyos al crear una disrupción entre los sitios de reproducción y los sitios terrestres de forrajeo y dispersión (Becker et al., 2007). Sin embargo no existe un consenso acerca de cómo estos cambios en el ambiente repercuten en los patrones de diversidad, ya que distintos autores han sugerido que charcas o lagunas que se encuentran en áreas alteradas o deforestadas de la Selva Atlántica presentan una mayor diversidad de anfibios que aquellas situadas dentro del bosque, y sugieren que esto estaría relacionado con una facilitación para especies generalistas o típicas de formaciones vegetales abiertas (Bernarde y Anjos, 1999; Toledo et al., 2003; Vasconcelos y Rossa-Feres, 2005; Conte y Rossa Feres, 2006). También se ha propuesto que la riqueza de anuros de la Selva Atlántica se encuentra positivamente relacionada con la heterogeneidad am-biental (Eterovick y Barata, 2006; Vasconcelos et al., 2009) y negativamente relacionada con la predación en los cuerpos de agua (Eterovick y Barata, 2006).
A pesar de que el conocimiento acerca de los patrones de diversidad en anfibios de la Selva Atlán-tica se ha incrementado durante los últimos años, todos los trabajos han sido realizados en Brasil, y hasta el momento no se cuenta con antecedentes comparables en sectores de la Selva Atlántica de Argentina, a pesar de que en este país aún subsisten extensos remanentes de bosque en buen estado de conservación (Giraudo et al., 2005).
En el presente trabajo se compara la compo-sición y riqueza de ensambles de anfibios asociados a distintos tipos de cuerpos de agua y se evalúa la existencia de asociaciones entre la abundancia de las especies y las características bióticas y abióticas de estos sitios.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se llevó a cabo en el área protegida privada Reserva de Vida Silvestre Urugua-í (RVSU) y en sectores adyacentes a la misma. La reserva se encuentra en el noreste de la provincia de Misiones, Argentina y protege una superficie de 3.700 hectáreas de Selva Atlántica. La RVSU forma parte de un gran remanente de bosque continuo formado por el Parque Nacional Iguazú (67.000 ha) y el Parque Provincial Urugua-í (84.000 ha) (Fig. 1). Ciertos sectores de la RVSU fueron explotados forestalmente hasta mediados de la década de 1980, sin embargo el área presenta bosques maduros en buen estado de conservación y sin disturbio actual (Di Bitetti et al., 2006; Di Bitetti et al., 2008).

Figura 1. Ubicación de la Reserva de Vida Silvestre Urugua-í (RVSU) en la provincia de Misiones. (1) Parque Nacional Iguazú (67.000 ha), y (2) Parque Provincial Urugua-í (84.000 ha).
La RVSU pertenece a la sub-región de la Selva Atlántica conocida como Selva Atlántica Interior (SAI). La SAI es un ambiente subtropical estacional, que a diferencia de las formaciones tropicales de la porción costera de la ecorregión, está formada por unidades de vegetación semideciduas con una mar-cada estacionalidad en las temperaturas (Oliveira-Filho y Fontes, 2000; Di Bitetti et al., 2003; Giraudo et al., 2005). La vegetación primaria de esta sub-región está dominada por especies arbóreas emergentes como Laureles (Nectandra spp.) Guatambúes (Balfourodendrom riedelianum) y ocasionalmente por Palos Rosa (Aspidosperma polyneurum) con un denso sotobosque con cañaverales de Chusquea ramosissima y Merostachys clausseni (Cabrera, 1976). El terreno de la RSVU presenta un relieve quebrado con cerros de elevaciones bajas (300 m s.n.m.). La temperatura media anual es de 20ºC y las precipitaciones se encuentran entre los 1700 y 2000 mm anuales irregularmente distribuidas a la largo del año (Crespo, 1982).
El estudio se llevó a cabo durante los meses de enero y febrero de los años 2007 y 2008; dado que los anfibios de la Selva Atlántica presentan un pico de actividad en estos meses en concordancia con las elevadas temperaturas y precipitaciones (Bertoluci, 1998; Bernarde y Machado, 2000; Eterovick y Sazima, 2000; Van Sluys et al., 2012).
Cuerpos de agua y variables ambientales
Se seleccionaron un total de 13 cuerpos de agua utilizados como sitios de reproducción por los anfibios del área. De los 13 sitios, 11 se encontraron dentro del área correspondiente a la RVSU y dos en sectores adyacentes a la misma. De acuerdo con la permanencia de agua y con atributos físicos de los cuerpos de agua, los sitios fueron categorizados como charcas temporarias, barreros, arroyos temporarios y arroyos permanentes.
Las charcas temporarias analizadas son depre-siones que se llenan con agua durante las lluvias y presentan una duración de entre 2 a 6 meses al año con agua. Dichos cuerpos de agua se encuentran en áreas abiertas y se generaron por la creación del camino de acceso a la reserva. Presentan fondo barroso con abundante materia orgánica. En las charcas temporarias no se encontraron peces ni otros vertebrados acuáticos predadores. Se analizaron un total de tres charcas temporarias de las cuales dos se encontraban adyacentes al camino de acceso a la RVSU. La superficie promedio de las charcas fue de 162 m2 (DE±165,93; min = 36 m2; max = 350 m2).
Los barreros son pequeños cuerpos de agua que se encuentran en el interior de la selva y son creados y mantenidos por la actividad de mamíferos como pecaríes (Tayassu pecari) y tapires (Tapirus terrestris) que los utilizan como revolcaderos. Los barreros tienen agua estancada con poca profundidad y permanecen con agua unos pocos meses al año. El fondo es barroso con poca materia orgánica. No se registraron peces ni otros vertebrados acuáticos en estos sitios. La superficie promedio de los tres barreros analizados fue de 153,33 m2 (DE ±128,58; min = 65 m2; max = 320 m2).
Los sitios categorizados como arroyos permanentes fueron cuatro tramos de 300 metros de arroyos que presentan agua durante todo el año. Los arroyos permanentes corren sobre un lecho de roca basáltica y en ellos se encuentran más de 15 especies de peces, muchas de ellas depredadoras como la "tararira" Hoplias malabaricus, "dientudos" Oligosachus spp., "cabezas amargas" Crenicichla spp. y "bagre" Rhamdia cf. quelen, además de la tortuga acuática predadora Phrynops williamsi (López et al., 2005; observación personal). El ancho promedio de estos cuerpos de agua es de 3,8 m y la superficie de los mismos fue de 433,75 m2 en promedio (DE ±91,0; min. = 310 m2; max = 520 m2).
Ciertos sectores de los arroyos permanentes se encontraron asociados con pequeñas charcas de inundación (n=3) (0,8 -2 m de largo) que se encontraban a uno o dos metros del cauce principal de los arroyos. Estos sitios se muestrearon en forma conjunta con los arroyos ya que estas charcas son formadas por las crecidas de los cursos de agua y no son independientes del cauce principal, sin embargo, se discriminó si los anfibios se encontraban utilizando charcas de inundación o el cauce principal de los arroyos permanentes.
Los arroyos temporarios presentan agua por algunos meses luego de la temporada de lluvias y corren sobre lecho rocoso. Se analizaron tres tramos de 300 m de arroyos temporarios. La superficie promedio de estos sitios fue de 151,67 m2 (DE ± 61,71; min = 100 m2; max = 220 m2). Dado que los arroyos temporarios son pequeños tributarios de los arroyos permanentes, durante la estación de lluvias diversas especies de peces son comunes en estos sitios.
En cada cuerpo de agua se registraron seis variables de la estructura del hábitat. Estas fueron: porcentaje de vegetación arbórea proyectada sobre la superficie del sitio de reproducción (ARBOL); porcentaje del perímetro del cuerpo de agua con cobertura arbustiva (ARBUST); porcentaje del perímetro del sitio de reproducción con cobertura herbácea (PER), profundidad promedio del sitio (PROF); pocentaje de vegetación acuática emergente (EMERG) y porcentaje de cobertura del fondo de los sitios de reproducción con cobertura vegetal acuática sumergida (SUM). Las variables ARBOL, EMERG y SUM se estimaron visualmente por un único observador. Para calcular las variables ARBUST y PER se midió el perímetro de los cuerpos de agua y luego se calculó la proporción que se encontró ocupada por vegetación herbácea (vegetación con ramificación a menos de 10 cm del suelo y altura inferior a 50 cm) y arbustos (vegetación con ramificaciones entre 10 y 50 cm de altura y con una altura de entre 50 y 300 cm). Para la variable PROF se midió la profundidad en 3 puntos de los cuerpos de agua a partir de los cuales se obtuvo un valor promedio.
Pese al esfuerzo de campo realizado para hallar sitios lénticos, solo los tres barreros y las tres charcas temporarias analizadas fueron localizados, lo que da una idea de la baja disponibilidad de este tipo de ambientes en el área. Todos los sitios se encontraron distantes entre sí al menos por 500 metros.
Muestreos de anfibios
Cada uno de los 13 sitios fue relevado en cinco oportunidades durante las dos temporadas de muestreo utilizando una combinación de muestreos por rele-vamientos por encuentros visuales y muestreos de ejemplares en actividad de vocalización (Scott y Woodward, 1994; Dorcas et al., 2010) identificando a cada uno de los ejemplares observados y/o escuchados.
Las búsquedas nocturnas fueron realizadas entre las 20:00 y 02:00 hs por los tres autores recorriendo la totalidad de la superficie y márgenes de los sectores de arroyos y cuerpos de agua muestreados. Debido a la escasa superficie de los sitios, los mismos pudieron ser recorridos en su totalidad en menos de una hora en todos los casos. Además se visitaron los sitios durante el día para registrar la presencia de puestas y larvas de las distintas especies (capturadas mediante el uso de redes de mano). Cuando fue necesario, las larvas colectadas fueron criadas y llevadas a metamorfosis en una estación biológica ubicada dentro de la RVSU para la posterior identificación de los ejemplares. La abundancia de cada especie fue considerada como el número máximo de individuos contabilizados en los muestreos. Si bien este método no considera la sucesión o el posible el recambio de individuos dentro de una población (lo que puede llevar a realizar una sub-estimación de la abundancia real), los valores observados de abundancia máxima ofrecen un indicador razonable de la abundancia relativa de las distintas especies en un momento dado (Parris, 2004).
Análisis de datos
La eficiencia de los muestreos en los distintos tipos de cuerpos de agua así como en la totalidad de los sitios analizados se estableció mediante la comparación de la riqueza observada y un valor de riqueza teórico obtenido a partir de estimadores de riqueza especifica utilizando el programa EstimateS (Colwell, 2009). Los índices utilizados fueron Chao 1 y Chao 2 ya que los mismos han sido recomendados como robustos estimadores de riqueza (Magurran, 2004; Walther y Moore, 2005).
Para comparar la riqueza de especies entre los distintos tipos de ambientes acuáticos se utilizaron curvas de rarefacción (Magurran, 2004). Este mé-todo permite hacer comparaciones entre hábitats cuando el tamaño de la muestra no es igual, al comparar la riqueza entre sitios utilizando como medida general el tamaño de muestra más pequeño (Moreno, 2001; Magurran, 2004).
Las variaciones en la composición de especies entre las comunidades asociadas a los distintos tipos de cuerpos de agua (diversidad ß) se calculó mediante el índice de complementariedad (C) de Colwell y Coddington, (1994). Este índice expresa las diferencias en los listados de especies de dos hábitats. El índice de complementariedad va de 0 a 1 y puede ser transformado a porcentaje, donde un valor de cero se da cuando los listados de especies entre hábitats son idénticos, mientras que un valor de 100 indica que los listados son completamente distintos (Moreno, 2001).
Para establecer la relación entre las variables ambientales de los cuerpos de agua y la estructura de los ensambles de anuros se utilizó una técnica de ordenación no paramétrica (non-metric multidimensional scaling anlisys, NMDS) (Kruskal, 1964; Faith et al., 1987). Este método produce una ordenación de las muestras en un espacio de pocas dimensiones a partir de la separación de las muestras en el espacio multidimensional generado por las abundancias de las especies en los sitios (Urban et al., 2002). El método NMDS no posee supuestos sobre la naturaleza de la respuesta de las especies a gradientes subyacentes y el algoritmo ha demostrado ser robusto ante la falta de linealidad en los datos (Minchin, 1987). La medida de distancia ecológica utilizada fue en índice de Bray-Curtis. Este análisis se llevó a cabo con el software Pc-ord 4 (McCune y Mefford, 1999).
RESULTADOS
Se registró un total de 20 especies en la reserva, de las cuales 16 se encontraron en actividad reproductiva en los sitios muestreados. Estas 16 especies pertenecen a cinco familias: Hylidae (nueve especies), Leptodactylidae (cuatro especies), Bufonidae (una especie), Cycloramphidae (una especie) y Leiuperidae (una especie).
En la Tabla 1 se detallan las especies y su distri-bución en los distintos tipos de ambientes acuáticos analizados. Las especies registradas de forma ocasional que no se observaron en actividad reproductiva en los sitios de muestreo fueron: Trachycephalus typhonius, Leptodactylus fuscus, Elachistocleis cf. bicolor y Melanophryniscus devincenzii. Una colección de referencia se encuentra depositada en la colección de anfibios del Centro de Zoología Aplicada, Universidad Nacional de Córdoba.
Tabla 1. Especies registradas en la Reserva de Vida Silvestre Urugua-í entre Enero y Febrero de 2007 y 2008. Se detallan los porcentajes del total de ejemplares de cada una de las especies registradas en los distintos tipos de cuerpos de agua muestreados. El número entre paréntesis corresponde al número de replicas por tipo de ambiente acuático. La presencia de larvas (L) y puestas (O) se detalla para las distintas especies en los cuerpos de agua. En la última columna se presentan los modos reproductivos de las especies de acuerdo al criterio de Haddad y Prado (2005). 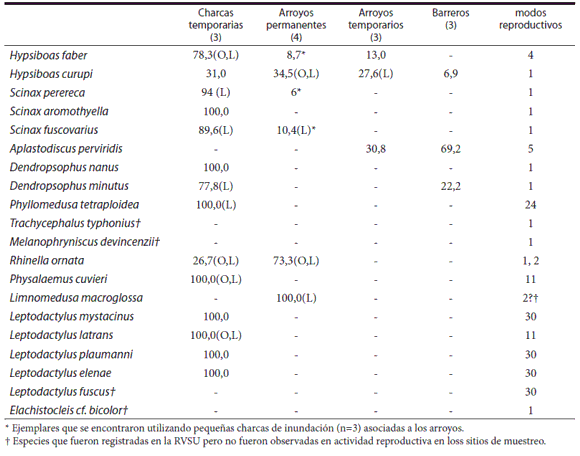
Las estimaciones de riqueza para los distintos tipos de ambientes acuáticos indican que los valores observados de riqueza encontrados superan en todos los casos el 89% de la riqueza esperada (Tabla 2). Las charcas temporarias presentaron una mayor riqueza de especies que el resto de los cuerpos de agua anali-zados (riqueza promedio en charcas temporarias=10 especies; rango=9-13 especies; riqueza acumulada= 14 especies) (Fig. 2). La riqueza de especies en los arroyos permanentes fue de 3 especies en promedio (rango=2-4 especies; riqueza acumulada: 6 especies). En los arroyos temporarios la riqueza promedio fue de 2,33 especies (rango=2-3 especies; riqueza acumulada= 3 especies) y en los barreros la riqueza promedio fue de 2 especies (rango= 1-3 especies; riqueza acumulada= 3 especies).
Tabla 2. Riqueza de especies acumulada observada y estimada para los distintos cuerpos de agua analizados así como para el total de los sitios. CT: charcas temporarias; AP: arroyos permanentes; AT: arroyos temporarios; B: barreros. 

Figura 2. Curvas de rarefacción (y desvío estándar asociado) obtenidas a partir del número de ejemplares capturados en cada uno de los distintos tipos de ambientes acuáticos. Los rombos representan la curva de rarefacción para las charcas tempora-rias; los triángulos para los arroyos permanentes; los círculos blancos para los arroyos temporarios y los círculos negros para los barreros.
Estandarizando las muestras a un mismo tamaño de 14 ejemplares, la riqueza en las charcas temporarias fue significativamente mayor (7,54 especies) que en los otros tres tipos de hábitat, entre los cuales no hay diferencias significativas en su número de especies (Fig. 2).
Los valores de complementariedad obtenidos ponen de manifiesto una elevada diversidad ß, demostrando que los distintos tipos de ambientes acuáticos poseen ensambles con una composición particular. Particularmente los valores mas elevados de complementariedad se obtuvieron al comparar las charcas temporarias con el resto de los ambientes (Tabla 3).
Tabla 3. Valores de complementariedad (%) entre hábitats obtenidos con el índice de complementariedad de Colwell y Coddington (1994). 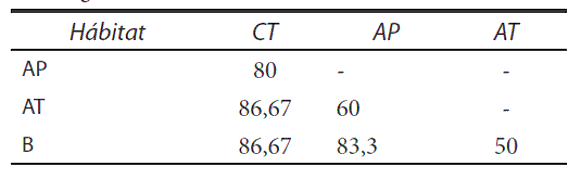
Cuatro variables ambientales mostraron asociaciones con los ejes del análisis de ordenación NMDS (valor de estrés final= 11,3). El coeficiente de determinación acumulado r2 para los tres ejes (distancia de ordenación vs. distancia en el espacio multivariado original) fue de 0,62. El eje dos del NMDS se correlacionó de forma positiva con la vegetación sumergida y con la profundidad de los sitios (r=0,58, p<0,05 y r=0,87; p<0,01 respectivamente) y negativamente con los porcentajes de vegetación arbórea y arbustiva (r=-0,71, p<0,01 y r=-0,77, p<0,01).
En la Figura 3 se observa la ordenación obtenida con el análisis NMDS, donde se aprecia un grupo bien definido de especies asociadas a los sitios correspondientes a charcas temporarias. Un segundo grupo de especies compuesto por Limnomedusa macroglossa y Rhinella ornata, se encontró asociado a la profundidad y el porcentaje de vegetación sumergida en arroyos permanentes. Finalmente Aplastodiscus perviridis aparece asociada a mayores porcentajes de cobertura arbórea y arbustiva en barreros y arroyos temporarios, sin que exista una diferenciación evidente entre estos dos últimos ambientes respecto a la abundancia y composición de especies de anuros.
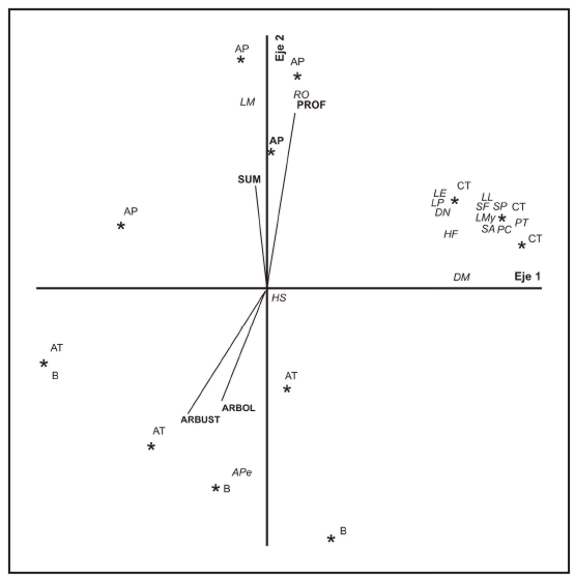
Figura 3. Gráfico de la ordenación obtenida mediante el análisis NMDS. En el mismo se puede apreciar el grado de asociación entre las especies y los diferentes tipos de cuerpo de agua. (HF) Hypsiboas faber, (HS) Hypsiboas curupi, (SP) Scinax perereca, (SA) Scinax aromothyella, (SF) Scinax fuscovarius, (APe) Aplastodiscus perviridis, (DN) Dendropsophus nanus, (DM) Dendropsophus minutus, (PT) Phyllomedusa tetraploidea, (RO) Rhinella ornata, (PC) Physalaemus cuvieri, (LM) Limnomedusa macroglossa, (LMy) Leptodactylus mystacinus, (LL) Leptodactylus latrans, (LP) Leptodactylus plaumanni, (LE) Leptodactylus elenae, (AP) arroyos permanentes, (AT) arroyos temporarios, (CT) charcas temporarias, (B) barreros, (PROF) profundidad promedio, (SUM) porcentaje de cobertura del fondo con vegetación acuática sumergida, (ARBUST) porcentaje del perímetro del cuerpo de agua con cobertura arbustiva, (ARBOL) Porcentaje de vegetación arbórea proyectada sobre la superficie del sitio de reproducción.
DISCUSIÓN
Los resultados obtenidos en le presente trabajo evidencian que la riqueza de anuros en este sector de la SAI es claramente mayor en las charcas temporarias en comparación con los barreros, arroyos temporarios y arroyos permanentes. Además, se observó un elevado recambio en la composición de especies entre los ensambles asociados a los distintos cuerpos de agua. A continuación se discuten los principales resultados referentes a la composición del ensamble de anuros de ésta área, y su relación con atributos del hábitat.
Listado de especies
El número de especies de anuros registrado en la RVSU (20 especies) es similar a los valores encontrados por diversos autores en otras localidades con Selva Atlántica estacional del sudeste de Brasil (Bernarde y Machado, 2000; Conte y Machado, 2005; Conte y Rossa-Feres, 2006; Lucas y Fortes, 2008). De acuerdo con los estimadores de riqueza de especies utilizados, el número de anuros registrado es representativo de la riqueza anuros esperada en los ambientes analizados.
De las especies encontradas en la RVSU Aplastodiscus perviridis, Phyllomedusa tetraploidea, Scinax aromothyella, Rhinella ornata, Scinax perereca, Hypsiboas curupi, Hypsiboas faber y Leptodactylus plaumanni son especies principalmente asociadas o endémicas de distintas formaciones de la Selva Atlántica (Kwet et al., 2001; Faivovich, 2005; Garcia et al., 2007; Frost, 2011) mientras que el resto son especies ampliamente distribuidas en otras ecorregiones de Sudamérica tales como la Caatinga, el Cerrado, el Chaco y las Yungas (Cei, 1980; Vaira, 2002; Dinz-Filho et al., 2004; da Silva Vieira, 2009). Cabe aclarar que ninguna de las especies registradas en el área de estudio presenta algún grado de amenaza (Vaira et al., 2012).
La distribución de las especies por familias en la RSVU (53% Hylidae y 26% Leptodactylidae) mantiene proporciones similares a las encontradas por otros autores en distintas localidades con SAI (véase Conte y Rossa-Feres, 2005 y citas dentro; Conte y Rosa-Feres, 2006). Este patrón conservado a lo largo de distintas localidades podría estar reflejando tendencias biogeográficas-históricas que definen la predominancia de determinados grupos filogenéticos a escala regional (Savage, 1973; Lynch, 1979; Duellman, 1988).
Relaciones con el hábitat
La cobertura arbórea es determinante para la riqueza y composición de las comunidades de anuros (Werner et al., 2007). Los sitios con elevada cobertura arbórea son menos productivos y poseen recursos de menor calidad para determinadas especies de anfibios, lo cual afecta al desarrollo larval (Skelly et al., 2002, 2005). Esto último podría estar relacionado con la baja riqueza encontrada en los sitios con elevada cobertura arbórea como los barreros y arroyos temporarios. Sin embargo, nuestros resultados y algunos antecedentes previos (Bernarde y Anjos, 1999; Bernarde y Machado, 2000) evidencian que los sitios de reproducción en ambientes boscosos serian importantes para especies con hábitos de vida arborícolas y modos reproductivos especializados como es el caso de Aplastodiscus perviridis (Haddad y Prado, 2005; Haddad et al., 2005).
Por otra parte, nuestros datos sugieren que la presencia de grandes mamíferos como Pecaríes y Tapires podría ser relevante para ciertas especies de anfibios de la SAI. Al igual que ocurre en la selva amazónica, estos mamíferos modifican su entorno generando y manteniendo cuerpos de agua tem-porarios propicios para la reproducción de ciertas especies de anuros (Beck et al., 2010). Si bien los barreros generados por mamíferos en la RSVU son utilizados por pocas especies en comparación con lo que ocurre en otras selvas neotropicales (Gascon, 1991, Zimmerman y Simberloff, 1996; Beck et al., 2010), las especies que los utilizan se encuentran en baja densidad en el área y son endémicas de la Selva Atlántica (ej. Aplastodiscus perviridis).
Los sitios lóticos con agua permanente en la RVSU poseen una baja riqueza especifica y un patrón similar ha sido hallado por otros autores en sectores de la Selva Atlántica del sudeste de Brasil (Grandinetti y Jacobi, 2005; Vasconcelos y Rossa-Feres, 2005; Conte y Rossa-Feres, 2006). Los arroyos de montaña de la RVSU son torrentosos y están sometidos a crecientes repentinas, lo cual resultaría limitante para los estadios larvales de muchas especies del área, ya que a diferencia de lo que ocurre en ensambles de anuros de otras selvas tropicales (Keller et al., 2009), la mayor parte de las especies de la Selva Atlántica no presentan adaptaciones morfológicas especificas para la vida en aguas corrientes (Cei, 1980; Heyer et al., 1990).
Sumado a esto, la presencia de agua permanente permite el establecimiento de vertebrados y macroinvertebrados predadores, lo cual limita a la riqueza de anuros (Heyer et al., 1975; Eterovick, 2003; Eterovick y Barata, 2006). En el caso particular de la RVSU, en los arroyos permanentes y sus pequeños tributarios habitan diversos predadores potenciales como tortugas acuáticas (Phrynops williamsi) y numerosas especies de peces de las familias Characidae, Cichlidae y Pimelodidae (observación personal). A pesar de estas presiones ambientales, algunas especies utilizan activamente el cauce principal de los arroyos como sitios de reproducción (e.g. Hypsiboas curupi; Rhinella ornata; Limnomedusa macroglossa). Las larvas de R. ornata (al igual que otras especies del grupo crucifer) forman agregaciones de individuos (observación personal; Eterovick, 2000) lo cual permitiría disminuir la presión de predación sobre las larvas (Spieler, 2003). Además, muchos Bufónidos se caracterizan por presentar defensas químicas (i.e. impalatabilidad de los huevos y larvas) (Litch, 1968; Hero et al., 2001). Estas estrategias le otorgarían a R. ornata la capacidad de explotar efectivamente los arroyos del interior de la selva ampliamente habitados por predadores.
Hypsiboas curupi se reproduce activamente en cuerpos de agua lóticos, donde los machos vocalizan aperchados sobre la vegetación de las riberas con elevada cobertura de bambúceas. Las puestas y renacuajos de esta especie fueron observadas en el cauce de los arroyos tal como lo describen García et al. (2007). Por su parte, la rana de las correderas (Limnomedusa macroglossa) es una de las pocas especies que se comporta como especialista de hábitat, encontrándose solo en arroyos que corren sobre afloramientos basálticos. Esta especie deposita sus huevos en charcas de inundación mientras que los renacuajos utilizan tanto estas charcas como el cauce del arroyo. Esto coincide con el comportamiento reproductivo de L. macroglossa descripto por Kaefer et al. (2009). Las estrategias de las larvas de esta especie para sobrevivir a las crecidas sin presentar adaptaciones morfológicas evidentes y su capacidad para mantener grandes poblaciones en sitios con elevada densidad de predadores acuáticos merecen la pena ser estudiadas en el futuro. El resto de las especies (n=3) que presentaron evidencias de actividad reproductiva en ambientes lóticos permanentes fueron registradas utilizando ocasionalmente las charcas de inundación asociadas a los arroyos (ver Tabla 1). La presencia de estas especies en este tipo de formaciones adyacentes a arroyos también fue registrada en Tres Barras do Paraná, Brasil (Bernarde y Machado, 2000).
En las charcas temporarias hubo una gran representación de especies características de am-bientes abiertos y ampliamente distribuidas como Dendropsophus nanus; Dendropsophus minutus; Leptodactylus latrans; L. elenae; L. mystacinus y Physalaemus cuvieri; junto con especies que utilizan distintos estratos de vegetación como Phyllomedusa tetraploidea; Scinax perereca; S. fuscovarius; S. aromothyella e Hypsiboas faber (Cei, 1980; Heyer et al., 1990; Prado et al., 2005; Conte y Rossa Feres, 2006). Las charcas temporarias presentan una mayor estabilidad ambiental en comparación con los arroyos, dado que no se encuentran sometidas a inundaciones repentinas. Por otro lado, en estas no se observaron vertebrados acuáticos predadores. La ausencia de estos dos factores sumado a que las charcas temporarias no presentan una cobertura arbórea tan elevada como los barreros podrían explicar la mayor diversidad de especies de anfibios y hábitos de vida.
Por lo tanto, factores tales como la predación y su interacción con el hidroperíodo de los distintos tipos de cuerpos de agua, en conjunto con otras ca-racterísticas bióticas (i.e. cobertura vegetal) podrían ser importantes modeladores de la estructura de los ensambles de anuros de la SAI.
Si bien los cuerpos de agua permanentes y una pequeña porción del bosque de ribera gozan de protección legal en la SAI de Argentina (artículo 137 de la ley provincial 1838 de la provincia de Misiones), los pequeños cuerpos de agua lénticos de origen natural como los barreros no son considera-dos en la legislación vigente a pesar de la relevancia que presentan para la reproducción de especies de anfibios características de la SAI. Por lo tanto, se recomienda que tanto los arroyos como las pequeñas charcas temporarias que se encuentran dentro de la selva sean considerados en los planes de manejo de las áreas protegidas por su particular valor para especies de anfibios de la SAI.
AGRADECIMIENTOS
A los guardaparques Laura Arejola y Ariel Tombo por su compañía y su imprescindible ayuda en el campo así como con la logística de todas las campañas. Los autores agradecen a Laura Olmos y Emiliano Galli por su activa colaboración en las tareas a campo. Se agradece el apoyo de la Fundación Vida Silvestre Argentina (Programa Selva Paranaense) por permitir los muestreos dentro de la RVSU así como por permitir el uso de las instalaciones de la estación biológica Urugua-í. A Diego Baldo por su colaboración aclarando el estatus taxonómico de algunas de las especies de la RVSU. A Javier Nori por su colaboración con la confección del manuscrito. Se agradece a los dos revisores anónimos por las valiosas sugerencias realizadas. El Ministerio de Ecología de la Provincia de Misiones otorgó los permisos correspondientes para la colecta de ejemplares. Los autores son becarios del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
LITERATURA CITADA
1. Beck, H., Thebpanya, P. & Filiaggi, M. 2010. Do neotropical peccary species (Tayassuidae) function as ecosistema engineers for anurans? Journal of Tropical Ecology 26: 407-414. [ Links ]
2. Becker, C.G.; Fonseca, C.R.; Haddad, C.F.B.; Batista, R.F. & Prado, P.I. 2007. Habitat split and the global decline of Amphibians. Science 318: 1775-1776. [ Links ]
3. Bernarde, P.S. & Anjos, L. 1999. Distribuição espacial e temporal da anurofauna no parque estadual Matas dos Godoy, Londrina, Paraná, Brazil (Amphibia: Anura). Comunicaçoes do Museu de Ciencia y Tecnologia PUCRS, Serie Zoologia, Porto Alegre 12: 127-140. [ Links ]
4. Bernarde, P.S. & Machado, R.A. 2000. Riqueza de espécies, ambientes de reprodução e temporada de vocalização da anurofauna em Três Barras do Paraná, Brasil (Amphibia: Anura). Cuadernos de Herpetología 14: 93-104. [ Links ]
5. Bertoluci, J. 1998. Annual patterns of breeding activity in Atlantic rainforest anurans. Journal of Herpetology 32: 607-611. [ Links ]
6. Cabrera, A.L. 1976. Regiones fitogeográficas de la República Argentina. Enciclopedia Argentina de Agricultura y Jardinería. ACME 2: 1-85. [ Links ]
7. Cei, J.M. 1980. Amphibians of Argentina. Monitore Zoologico Italiano, Monograph 2: 1-609. [ Links ]
8. Colwell, R.K. & Coddington, J.A. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions of the Royal Society of London Series B 345: 101-118. [ Links ]
9. Colwell, R.K. 2009. EstimateS: Statistical estimation of species richness and shared species from samples. Version 8. Persistent. Disponible en:
10. Conte, C.E. & Rossa-Feres, D.C. 2006. Diversidade e ocurrencia temporal da anurofauna (Amphibia, Anura) em São José dos Pinhais, Paraná, Brasil. Revista Brasileira de Zoología 23: 162-175. [ Links ]
11. Conte, C.E. & Machado, R.A. 2005. Riqueza de espécies e distribuição espacial e temporal em comunidade de anfibios anuros (Amphibia, Anura) em uma localidade de Tijucas do Sul, Paraná, Brasil. Revista Brasileira de Zoología 22: 940-948. [ Links ]
12. Crespo, J.A. 1982. Ecología de la comunidad de mamíferos del Parque Nacional Iguazú, Misiones. Revista del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia", Ecología 3: 45-162. [ Links ]
13. da Silva Vieira, W.L.; Santana, G.G. & Arazabe, C. 2009. Diversity of reproductive modes in anurans communities in the Caatinga (dryland) of northeastern Brazil. Biodiversity and Conservation 18: 55-66. [ Links ]
14. Di Bitetti, M.S.; Paviolo, A.; Ferrari, C.A.; De Angelo, C.& Di Blanco, Y. 2008. Differential responses to hunting in two sympatric species of Brocket Deer (Mazama americana and M. nana). Biotropica 40: 636-645. [ Links ]
15. Di Bitetti, M.S.; Placci, G. & Dietz, L.A. 2003. Una visión de biodiversidad para la Ecorregión del Bosque Atlántico del Alto Paraná: Diseño de un paisaje para la conservación de la biodiversidad y prioridades para las acciones de conservación. World Wildlife Fund, Washington. D.C. [ Links ]
16. Di Bitetti, M.S.; Paviolo, A. & De Angelo, C. 2006. Density, habitat use and activity patterns of ocelots (Leopardus pardalis) in the Atlantic Forest of Misiones, Argentina. Journal of Zoology 270: 153-163. [ Links ]
17. Diniz-Filho, J.A.F.; Bini, L.M.; Bastos, R.P.; Vieira, C.M.; Souza, M.C.; Motta, J.A.O.; Pombal, J.P. & Peixoto, J.C. 2004. Anurans from a local assemblage in Central Brazil: linking local processes with macroecological patterns. Brazilian Journal of Biology 64: 41-52. [ Links ]
18. Dorcas, M.E.; Price, S.J.; Walls, S.C. & Barichivich, W.J. 2010. Auditory monitoring of anuran populations: 281-298. En: Dodd, C.K. (ed.), Amphibian ecology and conservation, a handbook of techniques. Oxford University Press, Oxford. [ Links ]
19. Duellman, W.E. 1988. Patterns of species diversity in anuran amphibians in the American tropics. Annals of the Missouri Botanical Garden 75: 79-104. [ Links ]
20. Ernst, R.; Linsenmair, K.E.; Thomas, R. & Rödel, M. 2007. Amphibian communities in disturbed forests: lessons from the Neo and Afrotropics: 61-87. En: Tscharntke, T.; Leuschner, C.; Zeller, M.; Guhardja, E.; & Bidin, A. (eds.). The stability of tropical rainforest margins, linking ecological, economic and social constraints of land use and conservation, Springer Verlag, Berlin. [ Links ]
21. Ernst, R. & Rödel, M.O. 2008. Patterns of community composition in two tropical tree frog assemblages: separating spatial structure and environmental effects in disturbed and undisturbed forests. Journal of Tropical Ecology 24: 111-120. [ Links ]
22. Eterovick, P.C. 2000. Effects of aggregation on feeding of Bufo crucifer tadpoles (Anura, Bufonidae). Copeia 2000: 210-215. [ Links ]
23. Eterovick, P.C. & Sazima, I. 2000. Structure of an anuran community in a montane meadow in southeastern Brazil: effects of seasonality, habitat, and predation. Amphibia-Reptilia 21: 439-461. [ Links ]
24. Eterovick, P.C. & Barata, I.M. 2006. Distribution of tadpoles within and among Brazilian streams: the influence of predators, habitat size and heterogeneity. Herpetologica 62: 365-377. [ Links ]
25. Eterovick, P.C. 2003. Distribution of anuran species among montane streams in south-eastern Brazil. Journal of Tropical Ecology 19: 219-228. [ Links ]
26. Faith, D.P.; Minchin, P.R. & Belbin, L. 1987. Compositional dissimilarity as a robust measure of ecological distance. Vegetatio 69: 57-68. [ Links ]
27. Faivovich, J. 2005. A new species of Scinax (Anura: Hylidae) from Misiones, Argentina. Herpetologica 61: 69-77. [ Links ]
28. Faivovich, J.; Haddad, C.F.B.; Garcia, P.C.A.; Frost, D.R.; Campbell, J.A. & Weeler, W.C. 2005. Systematic review of the frog family Hylidae, with special reference to Hylinae: phylogenetic analysis and taxonomic revision. Bulletin of the American Mususeum of Natural History 94: 1-240. [ Links ]
29. Frost, D.R. 2011. Amphibian Species of the World: an Online Reference. Version 5.5 (31 January, 2011). Disponible en: research.amnh.org/vz/herpetology/amphibia/
30. Gangenova, E.; Guzmán, A. & Marangoni, F. 2012. Diversidad de anfibios anuros del Parque Nacional El Palmar (Provincia de Entre Ríos, Argentina). Cuadernos de Herpetología 26: 1-8. [ Links ]
31. Garcia, P.C.A.; Faivovich, J. & Haddad, C.F.B. 2007. Redescription of Hypsiboas semiguttatus, with the description of a new species of the Hypsiboas pulchellus group. Copeia 2007: 933-951. [ Links ]
32. Gardner, T.A.; Barlow, J. & Peres, C.A. 2007. Paradox, presumption and pitfalls in conservation biology: The importance of habitat change for amphibians and reptiles. Biological Conservation 138: 166-179. [ Links ]
33. Gascon, C. 1991. Population and communitie level analyses of species ocurrence of central Amazonian rainforest tadpoles. Ecology 72: 1731-1746. [ Links ]
34. Giraudo, A.R.; Povedano, H.; Belgrano, M.J.; Krauczuk, E.; Pardiñas, U.; Miquelarena, A.; Ligier, D.; Baldo, D. & Castelino, M. 2005. Status da biodiversidade da Mata Atlântica de Interior da Argentina: 160-180. En: Leal, G. & Câmara, G. (eds.). Mata Atlântica Biodiversidade, Ameaças e Perspectivas. Conservaçao Internacional, Belo Horizonte. [ Links ]
35. Grandinetti, L. & Jacobi, C.M. 2005. Distribuição estacional e espacial de uma taxocenose de anuros (Amphibia) em uma área antropizada em Rio Acima - MG. Lundiana 6: 21-28. [ Links ]
36. Haddad, C.F.B.; Faivovich, J. & Garcia, P.C.A. 2005. The specialized reproductive mode of the tree frog Aplastodiscus perviridis (Anura: Hylidae). Amphibia-Reptilia 26: 87-92. [ Links ]
37. Haddad, C.F.B. & Prado, C.P.A. 2005. Reproductive modes in frogs and their unexpected diversity in the Atlantic Forest of Brazil. Bioscience 55: 207-217. [ Links ]
38. Hecnar, S.J. & M´Closkey, R.T. 1998. Species richness patterns of amphibians in southwestern Ontario ponds. Journal of Biogeography 25: 763-772. [ Links ]
39. Hero, J-M.; Magnusson, W.E.; Rocha, C.F.D. & Catterall, C.P.. 2001. Antipredator defenses influence the distribution of amphibian prey species in the central Amazon rain forest. Biotropica 33: 131-141. [ Links ]
40. Herrmann, H.L.; Babbitt, K.J.; Baber, M.J. & Congalton, R.G. 2005. Efects of landscape characteristics on amphibian distribution in a forest-dominated landscape. Biological Conservation 123: 139-149. [ Links ]
41. Heyer, W.R.; Rand, A.S.; Cruz, C.A.G.; Peixoto, O.L. & Nelson, C.E. 1990. Frogs of Boracéia. Arquivos de Zoologia 31: 231-410. [ Links ]
42. Heyer, W.R.; McDiarmid, R.W. & Weigmann, D.E. 1975. Tadpoles, predation and pond habitats in the tropics. Biotropica 7: 100-111. [ Links ]
43. Hödl, W. 1977. Call differences and calling site segregation in anuran species from central Amazonian floating meadows. Oecologia 28: 351-363. [ Links ]
44. Kaefer, I.L.; Both, C. & Cechin, S.Z. 2009. Breeding biology of the rapids frog Limnomedusa macroglossa (Anura: Cycloramphidae) in southern Brazil. Journal of Natural History 43: 1195-1206. [ Links ]
45. Keller, A.; Rödel, M.; Linsenmair, K.E. & Grafe, T.U. 2009. The importance of environmental heterogeneity for species diversity and assemblage structure in Bornean stream frogs. Journal of Animal Ecology 78: 305-314. [ Links ]
46. Kruskal, J. 1964. Multidimensional scaling by optimizing goodness of fit to nonmetric hypothesis. Psychometrika 29: 1-27. [ Links ]
47. Kwet, A.; Di-Bernardo, M. & Garcia, P.C.A. 2001. The taxonomic status of Leptodactylus geminus Barrio, 1973. Journal of Herpetology 35: 56-62. [ Links ]
48. Lane, S.J.; Hamer, A.J. & Mahony, M.J. 2007. Habitat correlates of five amphibian species and of species-richness in a wetland system in New South Wales, Australia. Applied Herpetology 4: 65-82. [ Links ]
49. Lavilla, E.O.; Barrionuevo, J.S. & Baldo, J.D. 2002. Los anfibios insuficientemente conocidos en Argentina. Una reevaluación. Cuadernos de Herpetología 16: 99-118. [ Links ]
50. López, H.L.; A.M. Miquelarena y J. Ponte Gómez. 2005. Biodiversidad y Distribución de la Ictiofauna Mesopotámica, Fauna: 311-353. En: Aceñolaza, F.G. (coord./ed.), Temas de la Biodiversidad del Litoral Fluvial Argentino II. INSUGEO, Universidad Nacional del Tucumán, Tucumán. [ Links ]
51. Lucas, E.M. & Forters, V.B. 2008. Frog diversity in the Floresta Nacional de Chapecó, Atlantic Forest of southern Brazil. Biota Neotropica 8: 051-061. [ Links ]
52. Lynch, J.D. 1979. The amphibians of the lowland tropical forests: 189-215 En: Duellman, W.E. (ed.). The South American herpetofauna: its origin, evolution, and dispersal. Monographs of the Museum of Natural History. Lawrence, University of Kansas, Kansas. [ Links ]
53. Magurran, A. 2004. Measuring biological diversity. Blackwell Science Ltd., Oxford. [ Links ]
54. McCune, B. & Mefford, M.J. 1999. Multivariate Analysis of Ecological Data Version 4.25 MjM Software. [ Links ]
55. Minchin, P.R. 1987. An evaluation of the relative robustness of techniques for ecological ordination. Vegetatio 69: 89-107. [ Links ]
56. Moraes, R.A.; Sawaya, R.J. & Barrella, W. 2007. Composição e diversidade de anfíbios anuros em dois ambientes de Mata Atlântica no Parque Estadual Carlos Botelho, São Paulo, sudeste do Brasil. Biota Neotropica 7: 27-36. [ Links ]
57. Morellato, L.P.C. & Haddad, C.F.B. 2000. Introduction: The Brazilian Atlantic Forest. Biotropica 32: 786-792. [ Links ]
58. Moreno, C.E. 2001. Métodos para medir la biodiversidad. MyT-Manuales & Tesis SEA, Zaragoza. [ Links ]
59. Myers, N.; Mittermeier, R.A.; Mittermeier, C.G.; da Fonseca, G.A.B. & Kent, J. 2000. Biodiversity hotspots for conservation priorities. Nature 403: 853-858. [ Links ]
60. Neckel-oliveira, S.; Magnusson, W.E.; Lima, A.P. & L.K. Albernaz. 2000. Diversity and distribution of frogs in an Amazonian savanna in Brazil. Amphibia-Reptilia 21: 317-326. [ Links ]
61. Oliveira-Filho, A. & Fontes, M.A.L. 2000. Patterns of floristic differentiation among Atlantic forests in southeastern Brazil, and the influence of climate. Biotropica 32: 793-810. [ Links ]
62. Parris, K.M. & McCarthy, M.A. 1999. What influences the structure of frog assemblages at forest streams? Australian Journal of Ecology 24: 495-502. [ Links ]
63. Parris, K.M. 2004. Environmental and spatial variables influence the composition of frog assemblages in sub-tropical eastern Australia. Ecography 27: 392-400. [ Links ]
64. Prado, C.P.; Uetanabaro, M. & Haddad, C.F.B. 2005. Breeding activity patterns, reproductive modes, and habitat use by anurans (Amphibia) in a seasonal environment in the Pantanal, Brazil. Amphibia-Reptilia 26: 211-221. [ Links ]
65. Savage, J.M. 1973. The geographic distribution of frogs: patterns and predictions: 351-445. En: Vial, J. L. (ed.). Evolutionary biology of the anurans. University of Missouri Press, Missouri. [ Links ]
66. Scott, N.J. & Woodward, B.D. 1994. Relevamiento de lugares de reproducción: 80-86. En: Medición y monitoreo de la diversidad biológica: Métodos estandarizados para anfibios. Heyer, W.R.; Donnelly, M.A.; McDiarmid, R.W.; Hayek, L.C. & Foster, M.S. (eds.). Smithsonian Institution Press & Editorial Universitaria de la Patagonia, Washington. [ Links ]
67. Skelly, D.K.; Halverson, M.A.; Freidenburg, L.K. & Urban, M.C. 2005. Canopy closure and amphibian diversity in forested wetlands. Wetlands Ecology and Management 13: 261-268. [ Links ]
68. Skelly, D.K.; Freidenburg, L.K. & Kiesecker, J.M. 2002. Forest canopy and the performance of larval amphibians. Ecology 83: 983-992. [ Links ]
69. Spieler, M. 2003. Risk of predation affects aggregation size: a study with tadpoles of Phrynomantis microps (Anura: Microhylidae). Animal Behaviour 65: 179-184. [ Links ]
70. Stuart, S.N.; Chanson, J.S.; Cox, N.A.; Young, B.E.; Rodrigues, A.S.L.; Fischman, D.L. & Waller, R.W. 2004. Status and trends of amphiban declines and extinctions worldwide. Science 307: 1783-1786. [ Links ]
71. Toledo, L.F.; Zina, J. & Haddad, C.F.B. 2003. Distribuição espacial e temporal de uma comunidade de Anfíbios Anuros do Município de Rio Claro, São Paulo, Brasil. Holos Environment 3: 136-149. [ Links ]
72. Urban, D.; Goslee, S.; Pierce, K. & Lookingbill, T. 2002. Extending commmunity ecology to landscapes. Ecoscience 9: 200-230. [ Links ]
73. Vaira, M. 2002. Anurans of a subtropical montane forest in northwestern Argentina: ecological survey and a proposed list of species of conservation concern. Biodiversity and Conservation 11: 1047-1062. [ Links ]
74. Vaira, M.; Akmentins, M.; Attademo, A.; Baldo, D.; Barrasso, D.; Barrionuevo, S.; Basso, N.; Blotto, B.; Cairo, S.; Cajade, R.; Céspedez, J.; Corbalán, V.; Chilote, P.; Duré, M.; Falcione, C.; Ferraro, D.; Gutierrez, F.; Ingaramo. M.R.; Junges, C.; Lajmanovich, R.; Lescano, J.N.; Marangoni, F.; Martinazzo, L.; Marti, R.; Moreno, L.; Natale, G.S.; Pérez Iglesias, J.; Peltzer, P.; Quiroga, L.; Rosset, S.; Sanabria, E.; Sanchez, L.; Schaefer, E.; Úbeda, C.; Zaracho, V. 2012. Categorización del estado de conservación de los Anfibios de la República Argentina. Cuadernos de Herpetología 26: 131-159. [ Links ]
75. Vasconcelos, T.S. & Rossa-Feres, D.C. 2005. Diversidade, distribuição espacial e temporal de anfíbios anuros (Amphibia, Anura) na região noroeste de estado de São Paulo, Brasil. Biota Neotropica 5: 1-14. [ Links ]
76. Vasconcelos, T.S.; Santos, T.G.; Rossa-Feres D.C. & Haddad, C.F.B. 2009. Influence of the environmental heterogeneity of breeding ponds on anuran assemblages from southeastern Brazil. Canadian Journal of Zoology 87: 699-707. [ Links ]
77. Van Sluys, M.; Marra, R.V.; Boquimpani-Freitas, L. & Rocha, C.F.D.. 2012. Environmental factors affecting calling behavior of sympatric frog species at an Atlantic Rain Forest area, Southeastern Brazil. Journal of Herpetology 46: 41-46. [ Links ]
78. Walther, B.A. & Moore, J.L. 2005. The concepts of bias, precision and accuracy, and their use in testing the performance of species richness estimators, with a literature review of estimator performance. Ecography 28: 815-829. [ Links ]
79. Walting, J.I. & Donnelly, M.A. 2008. Species richness and composition of amphibians and reptiles in a fragmented forest landscape in northeastern Bolivia. Basic and Applied Ecology 9: 523-532. [ Links ]
80. Werner, E.E.; Skelly, D.K.; Relyea, R.A. & Yurewicz, K.L. 2007. Amphibians species richness across environmental gradients. Oikos: 116: 1697-1712. [ Links ]
81. Zimmerman, B.L. & Simberloff, D. 1996. An historical interpretation of habitat use by frogs in a central amazonian forest. Journal of Biogeography 23: 27-46. [ Links ]
82. Zina, J.; Ennser, J.; Pinheiro, S.C.P.; Haddad, C.F.B. & Toledo, L.F. 2007. Taxocenose de anuros de uma mata semidecídua do interior do Estado de São Paulo e comparações com outras taxocenoses do Estado, Brasil. Biota Neotropica 7: 49-58. [ Links ]













