Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.27 no.2 San Salvador de Jujuy set. 2013
PUNTOS DE VISTA
Aprendizaje en Anfibios, el eslabón perdido: Un modelo simple cerebral en el estudio de conductas complejas
Rubén N. Muzio1,2
1 Grupo de Aprendizaje y Cognición Comparada. Laboratorio de Biología del Comportamiento, Instituto de Biología y Medicina Experimental (IBYME-CONICET), Vuelta de Obligado 2490, (1428) Buenos Aires.
2 Cátedra de Biología del Comportamiento, Facultad de Psicología, Universidad de Buenos Aires (UBA), Argentina.
Recibido: 04/06/12
Revisado: 15/07/12
Aceptado: 17/10/12
RESUMEN
El cerebro de los grupos filogenéticamente más antiguos, como peces y anfibios, no presenta neocorteza cerebral, teniendo una organización más simple que la observada en los mamíferos. En particular, los anfibios son un grupo clave dentro de los vertebrados pues representan la transición desde el agua a la tierra. Desde la perspectiva de la evolución cerebro-conducta, este grupo sirve especialmente para interpretar cuáles son las implicaciones que tal transición pudo haber tenido en la organización cerebral. Por lo tanto, los anfibios ofrecen la oportunidad única de encontrar los mecanismos básicos de una amplia variedad de comportamientos sin una fuerte modulación cortical.
Este artículo incluye la descripción de tres procedimientos en anfibios que se han desarrollado en nuestro laboratorio para estudiar diversos aspectos del aprendizaje, tanto apetitivo como aversivo, así como sus bases neurales. En primer lugar, el aprendizaje en una situación de corredor recto, en la que el pallium medial (área homóloga al hipocampo de mamíferos) está implicado funcionalmente en la extinción de la respuesta. En segundo lugar, el aprendizaje espacial, donde la activación del pallium medial también juega un papel fundamental. Por último, varias situaciones de aprendizaje aversivo de evitación, donde el striatum (área homóloga a la amígdala de mamíferos) asumiría un importante papel funcional.
Globalmente, el estudio del modelo de los anfibios está empezando a dar las claves sobre los mecanismos neurales básicos de estos comportamientos aprendidos. Además, el conjunto de estos datos muestran que estos procesos de aprendizaje son muy generales entre los distintos grupos de vertebrados, lo que sugiere que estos caracteres han sido altamente conservados a lo largo de la evolución.
PALABRAS CLAVE: Anfibios; Rhinella arenarum; Aprendizaje; Pallium medial-hipocampo; Striatumamígdala; Evolución cerebro-conducta.
ABSTRACT
The brain of phylogenetically older groups (such as fish and amphibians) does not present neocortex, taking a simpler organization than that observed in mammals. Particularly, amphibians are a key group in vertebrates as they represent the transition from water to land. From the perspective of brain-behavior evolution, this group is especially useful to elucidate what the implications of such a transition might have had on brain organization. Therefore, amphibians offer the unique opportunity to find basic mechanisms of a wide variety of behaviors without a strong cortical modulation.
This article includes a description of three procedures in amphibians that we have developed in our laboratory to study several aspects of learning, both appetitive as aversive, and their neural basis. First, learning in a runway situation, in which the medial pallium (homologous to the mammalian hippocampus) is functionally involved in the extinction of response. Second, spatial learning, where activation of the medial pallium also play an essential role. Finally, several aversive learning situations of avoidance, where the striatum (homologous to the mammalian amygdala) would assume an important functional role.
As a whole, the study of the amphibian model is beginning to provide keys about the basic neural mechanisms of these learned behaviors. Moreover, all these data show that these learning processes are very general among different groups of vertebrates, suggesting that these characters have been highly conserved in the course of evolution.
KEYWORDS: Amphibians; Rhinella arenarum; Learning; Pallium medial-hippocampus; Striatum-amygdala; Brain-behavior evolution.
INTRODUCCIÓN
Evolución de los sistemas cognitivos cerebrales: Los anfibios, el eslabón perdido
Desde la perspectiva de la evolución cerebro-conducta, los anfibios son un grupo crucial dentro de los vertebrados pues representan la transición desde el agua a la tierra y todas las consecuencias que dicha transición generó en la organización cerebral. Si bien hay estudios morfológicos acerca de la anatomía del sistema nervioso en anfibios (por ejemplo, Northcutt, 1974; Northcutt y Kicliter, 1980; Northcutt y Ronan, 1992), es sorprendente entonces la escasa información con la que se cuenta acerca de la organización del cerebro de los anfibios en relación a sus capacidades de comportamiento en general, y con el aprendizaje y la memoria en particular.
La conjunción de estudios desde la neurociencia, la biología evolutiva, la fisiología del comportamiento y la psicología comparada ha revelado mucho sobre cómo las características de organización del cerebro han sido moldeadas por la evolución para explicar el alcance de las capacidades cognitivas que se encuentra en los animales.
La metodología cladística derivada de la sistemática filogenética es esencial para estudiar la evolución de caracteres que, como el cerebro y la conducta, conservan un escaso registro fósil (Papini et al., 1999). Probablemente, la razón más importante para estudiar los sistemas de aprendizaje y memoria mediante comparaciones entre especies es que éstos pueden ser una vía para comprender las complejas relaciones entre estructura y función; es decir, entre los patrones de conducta y los arreglos estructurales y de organización del sistema nervioso central que hacen posible tales conductas (Bingman, 1990). Sin embargo, para que esta estrategia comparativa sea consistente se requiere el análisis de una variedad suficiente de especies y grupos zoológicos, y realizar estudios en múltiples niveles de análisis (Nadel, 1990). Esto es especialmente cierto en el caso de la investigación sobre los mecanismos de comportamientos complejos. Tales conductas son esenciales para la supervivencia y derivan en su mayor parte de procesos de aprendizaje. Así, dentro del conjunto de rasgos adaptativos esenciales cobra relevancia el estudio de: (i) el aprendizaje apetitivo (que implica obtener una recompensa; por ej., comida), incluyendo el efecto de cambios sorpresivos en estas recompensas y el aprendizaje de orientación en el espacio; y (ii) el aprendizaje aversivo (donde se recibe un castigo; por ej., una descarga eléctrica), como las conductas de escape y de evitación.
Dada la importancia evolutiva de los anfibios en la comprensión de las relaciones entre la estructura del sistema nervioso y el comportamiento, hemos desarrollado en nuestro laboratorio desde hace más de veinte años una amplia serie sistemática de trabajos que han permitido recolectar una buena cantidad de información acerca de las capacidades de aprendizaje de una especie de anfibio anuro, el sapo Rhinella arenarum (= Bufo arenarum) (Anura: Bufonidae) (Hensel, 1867) (ver por ejemplo, Muzio et al., 1992, 1993, 2006, 2011; Papini et al., 1995; Muzio, 1999; Daneri et al., 2007, 2011). Parte de este conjunto de resultados serán desarrollados en el presente artículo, resaltando el papel que tienen los anfibios en el entendimiento de los mecanismos neurales básicos que subyacen a estos fenómenos de aprendizaje en todos los vertebrados.
Estructura cerebral de los anfibios y homologías
A nivel comparativo, el cerebro de grupos filogenéticamente antiguos (como peces y anfibios) no presenta neocorteza, mostrando así una organización más simple que en mamíferos (Fig. 1).
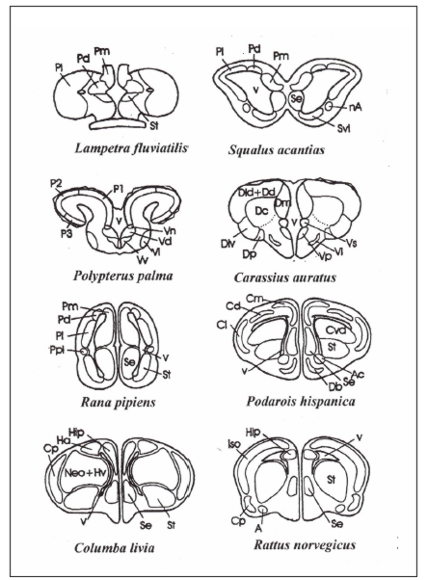
Figura 1. Representación esquemática de un corte transversal del telencéfalo de varias especies de vertebrados de los grupos más estudiados: Agnatha (Lampetra), Chondrichthyes (Squalus), Actinopterygii (Polypterus y Carassius), Amphibia (Rana), Reptilia (Podarois), Aves (Columba) y Mammalia (Rattus). Abreviaturas: A, amígdala; Hip, hipocampo; Pd, pallium dorsal; Pl, pallium lateral; Pm, pallium medial; Ppl, prominencia palial lateral; Se, septum; St, striatum; V, ventrículo lateral. (Nota: sólo se especifican las áreas representativas que se mencionan en el texto). Adaptado de Papini et al. (1999).
En particular, la estructura cerebral de los anfibios muestra las subdivisiones básicas del telencéfalo de los vertebrados, sin la presencia de neocorteza (Fig. 2).
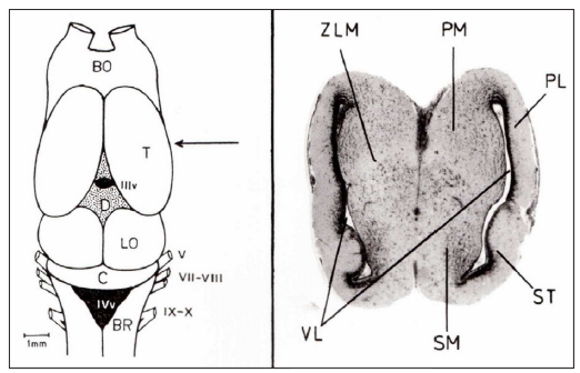
Figura 2. Izquierda: Vista dorsal del cerebro del sapo Rhinella arenarum. La flecha señala la posición de la sección transversal mostrada en el sector derecho. Derecha: Corte transversal (x50) del telencéfalo de Rhinella arenarum. La línea peduncular de la zona limitante medial (ZLM) termina en un área relativamente más blanca que separa el MP de la parte más ventral del telencéfalo. Las áreas se distinguen por zonas donde disminuye la densidad de somas celulares. Abreviaturas: C, cerebelo; D, diencéfalo; LP, pallium lateral; LV, ventrículos laterales; MP, pallium medial; MS, Septum medial; OB, bulbos olfatorios; OL, lóbulos ópticos o tectum; ST, striatum; T, telencéfalo; ZLM, zona limitante medial; IIIv/IVv, tercer/cuarto ventrículo; V/VII-VIII/IX-X, pares de nervios craneanos. (Fotografía y dibujo Rubén N. Muzio).
En el sapo Rhinella arenarum, como en todos los anfibios, la porción dorsomedial de su cerebro anterior, llamada pallium medial, generalmente se asemeja al hipocampo encontrado en los vertebrados plenamente terrestres (de hecho, vulgarmente se lo describe como "primordium hipocampal"). Lo propio ocurre con la porción ventrolateral, llamada striatum (incluyendo a sus principales componentes amigdaloides o "sistema amígdalo-striatal"), que se sugiere semejante a la amígdala de los mamíferos. Es importante señalar aquí que en ambos casos: (a) existe un consenso generalizado acerca de la homología de estas regiones en base a evidencia anátomo-fisiológica y neuroinmunohistoquímica; a pesar que (b) la organización citoarquitectónica de cada región carece de la complejidad anatómica encontrada en los demás grupos terrestres, al menos basada en sus tipos celulares y su distribución (para homología Pallium medial-hipocampo ver: Northcutt, 1974; Northcutt y Kicliter, 1980; Walaas, 1983; Contestabile et al., 1990; Northcutt y Ronan, 1992; para Striatum-amígdala: Wilczynski y Northcutt, 1983; Moreno y González, 2004). En la actualidad también se cuenta con información que contribuye a sustentar la validez de las homologías de estas áreas proveniente del campo de la genoarquitectura neural (término usado para definir el análisis de la arquitectura de un centro neural sobre la base de su patrón de expresión génica; Ferran et al., 2009). Así, se sumó numerosa evidencia de áreas homólogas en todas las principales subdivisiones cerebrales, reconocidas a partir de patrones comunes de expresión de numerosos genes del desarrollo (para las dos áreas mencionadas, ver Wulliman y Rink, 2002; Moreno y González, 2006, 2007; González y Northcutt, 2009; Medina et al., 2011; Morona et al., 2011; Martínez-García et al., 2012).
El hipocampo es una de las estructuras del cerebro que ha demostrado ser particularmente interesante para los investigadores. El papel del hipocampo en los procesos de aprendizaje y memoria es una característica general compartida por un amplio número de grupos de vertebrados (Rodríguez et al., 2002; Bingman et al., 2009); sin embargo, la organización neural del hipocampo y su papel en la cognición presentan diferencias interesantes en las especies animales con distintas ecologías de comportamiento (Pravosudov y Clayton, 2002; Bingman et al., 2006). A partir de la importante pérdida de memoria en el paciente HM después de una lesión quirúgica de la formación hipocampal hace más de 50 años (Scoville y Milner, 1957), la relación entre el hipocampo y la memoria ha sido un área destacada de investigación en neurociencias (Anderson et al., 2007). El descubrimiento de las llamadas células de lugar del hipocampo en la década de 1970 (O'Keefe y Dostrovsky, 1971), y en particular los efectos persistentes del daño hipocampal sobre la cognición espacial en animales, ha creado un interés particular en cómo la actividad neuronal en el hipocampo trata de representar el espacio y cómo esta representación se utiliza para guiar la memoria y los procesos de navegación. Es importante señalar también que el papel del hipocampo en la cognición no está limitado al espacio (Wood et al., 2000), encontrándose por ejemplo equivalencias entre varias clases de vertebrados en cuanto a su función en la inhibición de respuestas previamente aprendidas (Jarrad e Isaacson, 1965; Rawlins et al., 1980).
Es llamativa la similitud del papel del hipocampo de los mamíferos, aves y reptiles en la cognición espacial (Colombo y Broadbent, 2000). Naturalmente esto ha planteado la cuestión de cuáles son las presiones evolutivas que, por un lado, han llevado a este papel similar en la cognición, mientras que por otro lado, han permitido al mismo tiempo (i) diferencias a gran escala en la organización anatómica y fisiológica entre las distintas clases amniotas (Bingman y Sharp, 2006), y (ii) diferencias a pequeña escala en especies estrechamente relacionadas con diversas historias naturales (por ejemplo, Pravosudov y Clayton, 2002). Así, sabemos bastante acerca de la organización comparativa y la función del hipocampo, aunque restringida fundamentalmente a mamíferos, aves y reptiles (véase Papp et al., 2007).
Por su parte, la amígdala es una de las regiones más relacionadas con el establecimiento del aprendizaje aversivo en sus distintas modalidades sensoriales. Específicamente, lesiones de la amígdala impiden la adquisición de este tipo de aprendizaje (Gallagher et al., 1990; Antoniadis y McDonald, 2001; LeDoux, 2003; Pare et al., 2004). En términos generales también se relaciona a esta área con los circuitos responsables de los miedos aprendidos (LeDoux, 2000; Blair et al., 2001). Y en particular, parece actuar no sólo ante condiciones aversivas (por ej., una situación de castigo), sino también ante la omisión inesperada de una recompensa (Papini, 2002, 2003). Como en el caso del hipocampo, se sabe bastante acerca de la organización y funciones comparadas de la amígdala y regiones homólogas en varias clases de vertebrados (incluyendo mamíferos, aves, reptiles y peces), pero muy poco acerca de lo que sucede en anfibios (Broglio et al., 2005).
La escasa información general disponible para el grupo de los anfibios llama particularmente la atención. Desde una perspectiva evolutiva, tal vez el momento más crítico en la evolución de los vertebrados es justamente cuando los anfibios tetrápodos invadieron la tierra. De hecho, como grupo, los anfibios representan la transición de la vida desde el agua a la tierra y todo lo que conlleva con respecto a la organización del cerebro y la conducta. Así, aunque ninguna de las especies animales existentes se puede considerar un remanente de los primeros anfibios, más que cualquier otro grupo de vertebrados, los anfibios modernos probablemente conservan características de la organización del cerebro que se asemejan a los tetrápodos anfibios de hace unos 400 millones de años y ofrecen una oportunidad única para examinar las regiones homólogas al hipocampo y la amígdala desde una perspectiva evolutiva aún más remota (Papini et al., 1999; Bingman, 2002).
En términos de organización general de la estructura cerebral, el modelo de los anfibios brinda así una posibilidad única de encontrar mecanismos básicos de una amplia variedad de comportamientos sin una fuerte modulación cortical.
Como veremos más adelante, a pesar de la organización aparentemente simple de la formación hipocampal, en nuestro laboratorio hemos demostrado que los sapos son capaces de adquirir aprendizajes relativamente complejos (Muzio et al., 1992, 2006, 2011; Daneri et al., 2011) y que el pallium medial es importante para ciertos aspectos de su capacidad de aprendizaje (Muzio et al., 1993, 1994; Papini et al., 1995). De hecho, a partir de nuestros estudios con respecto al hipocampo y la cognición, Rhinella arenarum se ha convertido en la especie de anfibio más estudiada que cualquier otra en este sentido.
Numerosas evidencias apoyan la relación funcional del hipocampo y la corteza frontal de los mamíferos, así como las áreas homólogas en otros vertebrados, con el aprendizaje apetitivo (Bingman, 1990; Nadel, 1990; Muzio, 1999; Papini et al., 1999). En forma complementaria, otro conjunto de evidencias relaciona a la amígdala de los mamíferos, así como las regiones homólogas en otros vertebrados, con el aprendizaje aversivo (Gallagher et al., 1990; Antoniadis y McDonald, 2001; Ledoux, 2003; Pare et al., 2004; Portavella et al., 2004a, 2004b). En este sentido, desde una perspectiva comparada están dadas las condiciones para abordar en anfibios el estudio de la relación funcional de estas áreas cerebrales con diversas conductas aprendidas, tanto apetitivas como aversivas.
Regulación de la absorción de agua en los anfibios
Los anfibios dependen en gran medida del agua tanto para la supervivencia como para la reproducción (Duellman y Trueb, 1986). Teniendo en cuenta esta característica, la situación de entrenamiento usada en nuestros experimentos está basada en una rehidratación después de una deprivación de agua. Estudios previos han determinado que la rehidratación en los anfibios terrestres es llevada a cabo por la absorción de agua vía cutánea a través de un área especializada de piel en la región ventral posterior, conocida como parche pélvico, altamente vascularizada e inervada (Bentley y Main, 1972; Christensen, 1974; Hillman et al., 2009). La permeabilidad de este parche pélvico puede ser incrementada a través de la acción de la hormona antidiurética de los anfibios, arginina vasotocina (AVT), aunque también interviene un control beta-adrenérgico (Segura et al., 1982; Hillyard et al., 1998; Reboreda et al., 1991). Por otra parte, este flujo de agua a través de las membranas de la piel está mediada por canales que conducen agua, las acuaporinas (Susuki et al., 2007). Finalmente, dado que la captación de iones sodio y cloro en anfibios también se realiza por piel, se encuentran en su estructura receptores a electrolitos en solución en el medio externo (Reboreda y Segura, 1984).
Así, en todos nuestros estudios la situación general de entrenamiento consistió en el desarrollo de una conducta de aprendizaje utilizando agua o distintas soluciones salinas como reforzadores.
Distintas formas de aprendizaje en anfibios y sus bases neurales
A continuación se resume a modo de ejemplo la descripción de tres procedimientos en anfibios que se han desarrollado en nuestro laboratorio utilizando el sapo Rhinella arenarum para estudiar diversos aspectos del aprendizaje, tanto apetitivo como aversivo, así como los mecanismos neurales que subyacen a estas conductas. En primer lugar, se describe el aprendizaje asociativo en una situación de corredor recto, donde se corrobora que el pallium medial (área homóloga al hipocampo de mamíferos) juega un papel funcional esencial en la extinción de la respuesta previamente aprendida. En segundo lugar, el aprendizaje espacial, donde también está implicada la activación del pallium medial mediando la repuesta de orientación en al ambiente. Por último, varias situaciones de aprendizaje aversivo de evitación, en donde es el striatum (área homóloga a la amígdala de mamíferos) el que asumiría un importante papel funcional.
I. Aprendizaje asociativo en un corredor recto
La situación de corredor recto ha mostrado ser apropiada para el estudio del aprendizaje en el sapo Rhinella arenarum. Un corredor recto consiste en un aparato experimental dividido en tres compartimientos: (i) partida, (ii) corredor propiamente dicho y (iii) meta. Dado que en nuestros experimentos se utiliza una motivación por ingesta de agua realizando una deshidratación parcial previa, durante el entrenamiento se colocaba en el compartimiento meta un recipiente con agua, permitiendo el acceso de los animales a esta recompensa o reforzador.
En estudios iniciales se verificó que el desempeño de los sapos en un corredor recto mejoraba después de una serie de sesiones de entrenamiento, y era seguido de una relativamente rápida extinción cuando el reforzamiento era retirado (Muzio et al., 1992). En particular, se observaron diversos fenómenos de aprendizaje comunes a una amplia variedad de vertebrados, tales como la adquisición bajo condiciones de entrenamiento masivo y espaciado, la extinción, la recuperación espontánea, el efecto subsiguiente al refuerzo, y los efectos de la magnitud del reforzamiento y del reforzamiento parcial en la adquisición (Mackintosh, 1974). Experimentos posteriores, aplicando el método de variación sistemática (Bitterman, 1975), donde se cambian distintos parámetros de entrenamiento -como la magnitud del refuerzo o el intervalo entre ensayos- verificaron estos mismos resultados generales (Muzio et al., 1994). Además se observaron otros fenómenos de aprendizaje, como el efecto de contraste negativo (Papini et al., 1995) y el efecto del sobreaprendizaje en la adquisición (Muzio et al., 2006). Globalmente, estos resultados sugieren que la respuesta de recorrido del sapo está basada, al menos parcialmente, en los mismos factores que subyacen a respuestas análogas en otras especies de vertebrados (Macphail, 1982; Muzio et al., 2011).
El análisis en sapos de los efectos de lesiones bilaterales del pallium medial sobre el aprendizaje ha brindado información funcional particularmente interesante en comparación con los resultados obtenidos en mamíferos (por ejemplo, ratas) donde se estudiaron los efectos de la hipocampectomía en situaciones análogas (Jarrard et al., 1964; Jarrard e Isaacson, 1965; Schmaltz e Isaacson, 1967; Winocur y Mills, 1969; Feldon et al., 1985). La Figura 3 muestra una lesión bilateral promedio en el pallium medial de Rhinella arenarum.

Figura 3. Izquierda: Vista dorsal del cerebro del sapo Rhinella arenarum mostrando el área lesionada (región rayada). La flecha señala la posición de la sección transversal mostrada en el sector derecho. Derecha: Corte transversal (x100) del telencéfalo de Rhinella arenarum en el que se puede observar una lesión bilateral promedio del pallium medial. Abreviaturas: BO, bulbo olfatorio; BR, bulbo raquídeo; C, cerebelo; D, diencéfalo; LO, lóbulo óptico o tectum; T, telencéfalo; IIIv/IVv, tercer/cuarto ventrículo; V/VII-VIII/IX-X, pares de nervios craneanos. Adaptado de Muzio et al. (1993).
En la Figura 4 se pueden observar los resultados obtenidos en nuestro laboratorio con sapos lesionados en el pallium medial, así como con sus controles de operación simulada (sham) e intactos, entrenados en un corredor recto utilizando agua como recompensa (Muzio et al., 1993). Se puede notar que las lesiones del pallium medial en sapos no produjeron efectos significativos detectables sobre la adquisición de la respuesta en un corredor recto, pero aumentaron la resistencia a la extinción cuando los animales fueron cambiados a una condición de ensayos no reforzados (extinción). Un hecho importante que vale para todos los estudios de lesiones del pallium medial en sapos, es que la lesión no afectó la tasa de captación de agua durante la adquisición (datos no mostrados), por lo que los animales lesionados tuvieron el mismo nivel de reforzamiento que los otros dos grupos. De esta forma, cualquier efecto sobre el desempeño no puede ser asignado a una captación diferencial de agua.
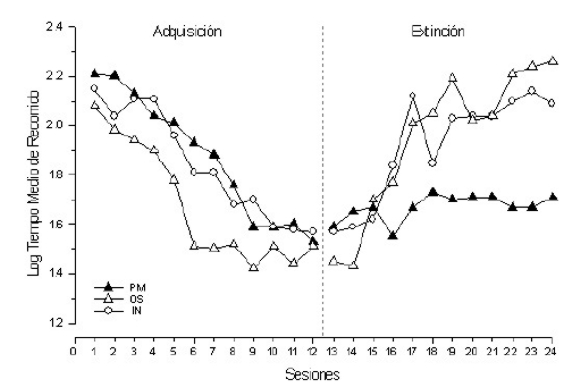
Figura 4. Tiempo medio de recorrido (en Log s) de tres grupos de sapos durante la fase de adquisición (sesiones 1 a 12) y de extinción (sesiones 13 a 24), entrenados después de uno de los siguientes tratamientos: PM (lesión bilateral del pallium medial), OS (operación simulada) o IN (animales intactos -sin operación-). Cada punto representa el desempeño de cada grupo en una sesión diaria. Adaptado de Muzio et al. (1993).
Estos resultados concuerdan con la idea de que el sistema hipocampal podría intervenir con el desarrollo de la tolerancia a la ausencia de refuerzo (Gray, 1987). Sin embargo, la evidencia disponible en anfibios en general (Macphail, 1982; Suboski, 1992), y en nuestra situación de entrenamiento en sapos en particular, sugiere que la extinción del desempeño en un corredor recto puede involucrar simplemente el debilitamiento de asociaciones desarrolladas durante la adquisición, con mediación del sistema hipocampal. Por lo tanto, el aumento de la resistencia a la extinción en los animales lesionados (tanto en anfibios como en mamíferos) podría entonces estar reflejando una falla en la inhibición de respuestas previamente aprendidas (Jarrad e Isaacson, 1965; Rawlins et al., 1980; Muzio et al., 1993).
En resumen, nuestros resultados con lesiones del pallium medial muestran que las respuestas dominantes no son afectadas durante la adquisición, pero que estas mismas respuestas son muy resistentes a modificarse después de cambios en las condiciones de reforzamiento. Además, sugieren que el pallium medial de los anfibios y el hipocampo de los mamíferos comparten ciertas propiedades funcionales, tales como su papel en la inhibición de respuestas previamente aprendidas (Muzio et al., 1993).
II. Aprendizaje espacial
Los animales emplean diferentes estrategias para orientarse y desplazarse en el espacio, aprendiendo (i) a acercarse o alejarse de una clave visual en particular (aprendizaje de guía: Morris, 1981; Clayton y Krebs, 1995), (ii) a orientarse en base a un giro centrado en su propio cuerpo en respuesta a una clave (aprendizaje de giro: O´Keefe y Nadel, 1978; Daneri et al., 2011), o (iii) aprendiendo la localización de un lugar en el espacio mediante la codificación simultánea de sus relaciones espaciales con múltiples claves ambientales ('mapas cognitivos': Tolman, 1948; O´Keefe y Nadel, 1978). Numerosas evidencias apoyan la participación del hipocampo de los mamíferos y las aves en el aprendizaje y la memoria espacial (Bingman, 1990; Nadel, 1990, 1991). En peces y reptiles, el sustrato neural implicado podría corresponder a estructuras telencefálicas homólogas al hipocampo de los mamíferos (López, 1999; Papini et al., 1999). Así, en mamíferos, aves, reptiles y peces, las lesiones del hipocampo o estructuras funcionalmente homólogas producen deficiencias en la resolución de tareas espaciales basadas en el empleo de múltiples claves distribuidas en el entorno, pero no en tareas que requieren estrategia de guía -uso de claves visuales proximales- o de giro (Peterson, 1980; Bingman, 1990; Rodríguez et al., 1994; López et al., 2000).
El hecho de que los sistemas de memoria espacial estén presentes en un rango tan amplio de grupos zoológicos sugiere que podrían haber aparecido muy tempranamente en el curso de la evolución. En este contexto resulta llamativa la falta de estudios realizados para investigar los sistemas de aprendizaje y memoria espacial en anfibios, siendo que este grupo tiene la ventaja de una organización cerebral relativamente simple donde se esperan hallar mecanismos elementales del aprendizaje espacial sin una modulación cortical.
A fin de empezar a reunir información en este sentido, nuestro grupo de investigación también ha desarrollado una serie de trabajos en anfibios analizando las reglas generales del aprendizaje espacial en anfibios (Daneri et al., 2011). Para estos estudios se entrenaron sapos en un laberinto en cruz (plus maze), el cual posee cuatro brazos. En cada ensayo de entrenamiento fueron utilizados sólo tres de ellos, uno como partida y dos como posibles metas (en un arreglo espacial en T). Para el entrenamiento los dos posibles puntos de partida fueron usados azarosamente y cada brazo meta contenía un recipiente (sólo uno con acceso a agua). Cada sapo recibió 30 sesiones de entrenamiento, una por día (tres ensayos por sesión).
En un estudio sobre los mecanismos que actúan sobre la respuesta de giro en anfibios, se desarrolló un experimento donde se entrenaron tres grupos de sapos: Giro derecha, Giro izquierda y Control (los grupos 'izquierda' y 'derecha' permitieron contrabalancear las tendencias naturales de los animales). Los sapos recibieron 20 sesiones de adquisición y luego otras 10 sesiones de reversión. En esta segunda fase el recipiente con agua fue ubicado en la dirección opuesta desde el punto de partida. Los resultados obtenidos (Fig. 5) muestran que estos animales son capaces de desplazarse en el espacio utilizando estrategias de giro (repetir patrones motores exitosos para acceder a una determinada meta en el espacio). Además, esta respuesta es rápidamente invertida (etapa de reversión), lo cual indica que los animales han aprendido una regla que pueden aplicar a una nueva condición generando una tasa de aprendizaje más rápida.
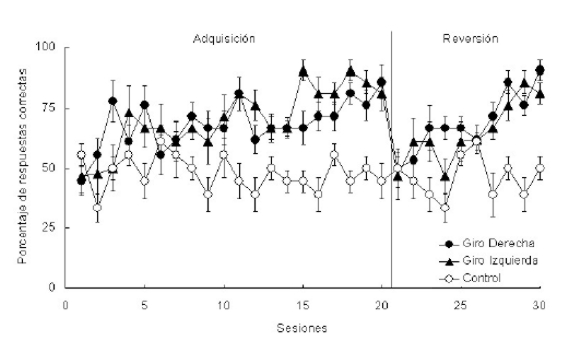
Figura 5. Porcentaje de respuestas correctas de tres grupos de sapos (Giro Derecha, Giro Izquierda y Control) durante la fase de adquisición (sesiones 1 a 20) y de reversión (sesiones 21 a 30). Cada punto representa el desempeño de cada grupo en una sesión diaria. Adaptado de Daneri et al. (2011).
En otro experimento se observó que la actividad del área homóloga al hipocampo, el pallium medial, es fundamental para este tipo de aprendizaje (datos aún no publicados). En este caso, los animales lesionados en el pallium medial fueron incapaces de realizar una respuesta fija de giro para orientarse en el espacio (Fig. 6). Este último resultado revela una diferencia fundamental con lo observado en mamíferos, donde el aprendizaje espacial de giro es independiente de la integridad hipocampal (Packard y McGaugh, 1992, 1996; Kesner et al., 1993; McDonald y White, 1993, 1994).
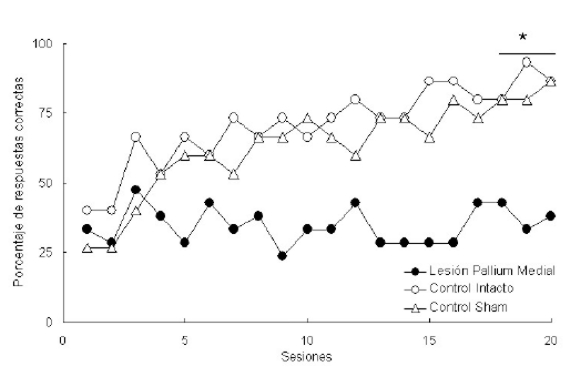
Figura 6. Porcentaje de respuestas correctas de tres grupos de sapos durante la adquisición de una repuesta de giro (sesiones 1 a 20): Lesión Pallium Medial (animales con lesión bilateral del pallium medial), Control Intacto (animales sin intervención quirúrgica) y Control Sham (animales con operación simulada). Cada punto representa el desempeño de cada grupo en una sesión diaria. [Datos aún no publicados]
Por otra parte, en otros experimentos se ha observado que los sapos son capaces de desplazarse en el espacio utilizando estrategias de guía (usando claves visuales intralaberinto cercanas al reforzador; Daneri et al., 2011) y de orientarse utilizando múltiples claves visuales distales -extralaberinto- (datos aún no publicados), pero aún se desconoce qué papel juega el pallium medial en este caso.
De esta forma, los resultados obtenidos hasta el momento en aprendizaje espacial en anfibios con lesiones del pallium medial sugieren que esta región no tiene una equivalencia funcional plena con el hipocampo de los mamíferos. Esto se debe a que la lesión del pallium medial impide el aprendizaje de una respuesta de giro (contrariamente a lo observado en mamíferos, donde la funcionalidad del hipocampo es independiente del aprendizaje de este tipo de respuesta).
III. Aprendizaje aversivo
La mayoría de los experimentos sobre aprendizaje aversivo en vertebrados utilizan una descarga eléctrica como refuerzo (Brush, 1971). Aunque se han descripto exhaustivamente las respuestas adquiridas bajo estas condiciones en varias especies de mamíferos (por ejemplo en ratas, Campbell y Masterton, 1969), las descargas eléctricas han sido relativamente ineficaces para estudiar el aprendizaje en anfibios anuros (para una revisión, ver Macphail, 1982; Suboski, 1992; Muzio, 1999; Daneri et al., 2007). Ésta es la principal razón por la que se encuentra muy poca información en el grupo de los anfibios sobre aprendizaje aversivo.
Dado que el aprendizaje aversivo está fuertemente ligado a la supervivencia (Mackintosh, 1974; Muzio, 1999; Muzio et al., 2011), es probable que esta conducta presente mecanismos muy conservados a lo largo de la evolución. Por lo tanto, es esencial entender cómo estos mecanismos operan en grupos filogenéticamente antiguos como los anfibios.
Así, se inició en nuestro laboratorio el estudio en anfibios del aprendizaje aversivo, tanto activo (donde el animal debe realizar una respuesta para escapar o evitar un estímulo aversivo) como pasivo (donde el sujeto inhibe una repuesta que lo expone a ese estímulo aversivo). Para desarrollar este procedimiento, se utilizó la capacidad de los sapos para responder a la salinidad de los fluidos externos, un sistema de respuesta con un claro valor ecológico dentro de los anfibios (Daneri et al., 2007). La salinidad del agua es una fuente importante de estrés fisiológico para los anfibios debido al riesgo de deshidratación. Sin embargo, muchos anfibios, tanto anuros como urodelos, son capaces de tolerar un medio moderadamente salino (Balinsky, 2005). Por otra parte, algunas especies de anuros se han adaptado para reproducirse en ambientes salobres, mostrando cierta variación en la tolerancia a la salinidad del agua (Gómez-Mestre y Tejedo, 2003). En particular, el sapo Rhinella arenarum tiene sensibilidad para detectar la composición salina de los fluidos externos a través de su piel ventral (parche pélvico), región utilizada también para la absorción durante el proceso de rehidratación (Christensen, 1974; Schmajuk y Segura, 1982; Reboreda et al., 1991). Específicamente, se observó que los sapos desarrollaban una aversión proporcional a la osmolaridad de la solución en la que eran colocados (Reboreda y Segura, 1984). Como hemos visto, la absorción de agua ha demostrado ser un reforzador eficaz en experimentos de aprendizaje apetitivo (por ejemplo, la velocidad de adquisición y extinción de la respuesta en un corredor recto está directamente relacionada con la cantidad de agua disponible en el compartimiento meta; Muzio et al., 1992). Pero además, debido a esta sensibilidad de los sapos para detectar la salinidad del medio externo, las soluciones de sodio también pueden ser utilizadas para generar diferentes efectos en el comportamiento (Muzio et al., 2011). Dado que la concentración de cloruro de sodio (NaCl) en el medio interno del sapo es de aproximadamente 115 mM (Reboreda et al., 1991), se ha comprobado que soluciones de NaCl entre 0-250 mM (hipotónicas a ligeramente hipertónicas) están asociadas a un aumento de peso a través de la rehidratación y a la emisión de comportamientos apetitivos, como aproximación y contacto con estas soluciones. Por el contrario, soluciones de NaCl entre 350-1000 mM (altamente hipertónicas) conducen a la pérdida de peso y se correlacionan con conductas aversivas, tales como respuestas de escape. Entre estos dos extremos, una solución de 300 mM de NaCl (moderadamente hipertónica) no produce aumento ni pérdida de peso, siendo así considerada una 'solución neutra' para la variación de peso (Loza Coll, 1998; datos aún no publicados). A partir del desarrollo de esta información general, se llevaron adelante experimentos que han evaluado la habilidad de los sapos para anticipar la aparición de estímulos aversivos.
En un estudio inicial (Daneri et al., 2007), se analizó la conducta de escape y evitación activa usando un solución salina neutra (300 mM) como estímulo discriminativo anticipatorio, seguido de una solución salina altamente hipertónica (800 mM) como estímulo aversivo. Para ello se utilizó una caja de salto, que consiste de dos compartimientos: (i) inseguro (donde los animales comenzaban los ensayos de entrenamiento y podían ser expuestos a la solución salina aversiva), y (ii) seguro (donde los animales podían escapar y/o evitar la estimulación aversiva). Se entrenaron tres grupos de sapos: Evitación (donde se apareaba el estímulo anticipatorio al estímulo aversivo, i.e., se presentaban simultáneamente), Control Estímulo anticipatorio solo (donde se presentaba el estímulo anticipatorio aislado) y Control No apareado (donde explícitamente el estímulo anticipatorio y el aversivo se presentaban separados temporalmente). Los sapos recibieron 15 sesiones de adquisición y luego otras 6 sesiones de extinción (Fig. 7). Los resultados muestran que los sapos pudieron adquirir una respuesta de evitación activa para prevenir la exposición a una solución salina altamente hipertónica que causa deshidratación.
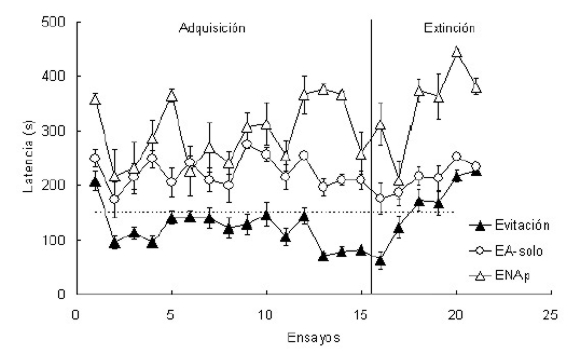
Figura 7. Tiempo de respuesta (en s) de tres grupos de sapos para moverse al compartimiento seguro de una caja de salto durante la fase de adquisición (sesiones 1 a 15) y de extinción (sesiones 16 a 21) en un aprendizaje de repuesta de evitación activa: Evitación (animales con estímulos anticipatorio y aversivo apareados), EA-solo (animales con estímulo anticipatorio solo) y ENAp (animales con ambos estímulos explícitamente no apareados). El estímulo anticipatorio fue una solución neutra de NaCl 300 mM, mientras que el reforzador aversivo fue una solución de NaCl 800 mM. La exposición del estímulo anticipatorio fue de 120 segundos en todos los grupos. Los sapos podían evitar (moviéndose al compartimiento seguro durante los 150 s iniciales de la sesión, marcado con una línea punteada) o escapar (moviéndose después, durante la presentación de la solución aversiva altamente hipertónica). Cada punto representa el desempeño de cada grupo en una sesión diaria. Adaptado de Daneri et al. (2007).
En otro experimento, se estudió en anfibios la adquisición de un aprendizaje de evitación pasiva (datos aún no publicados), usando del mismo modo una solución salina hipertónica 800 mM como estímulo aversivo. En este caso se utilizó también la misma caja de salto, pero los sapos comenzaban los ensayos en el compartimiento seguro. Si pasaban al otro compartimiento, eran expuestos al estímulo aversivo (inhibiéndose gradualmente la conducta de pasaje al compartimiento inseguro). La Figura 8 muestra los resultados obtenidos por dos grupos de sapos entrenados en estas condiciones: Evitación (expuestos al estímulo aversivo si pasaban al compartimiento inseguro) y Control (si pasaban eran expuestos a una solución salina neutra 300 mM). En este caso, el tiempo de pasaje desde el compartimiento seguro al inseguro tuvo un incremento significativamente mayor en el grupo Evitación que en el grupo Control, evidenciándose así un aprendizaje de evitación pasiva.
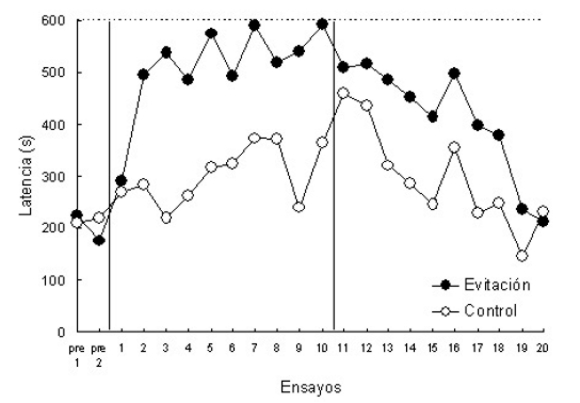
Figura 8. Tiempo de respuesta (en s) de dos grupos de sapos para moverse al compartimiento inseguro de una caja de salto durante la fase de adquisición (sesiones 1 a 10) y de extinción (sesiones 11 a 20) en un aprendizaje de repuesta de evitación pasiva: Evitación (animales que recibían como estímulo una solución aversiva de NaCl 800 mM) y Control (animales que recibían como estímulo una solución neutra de NaCl 300 mM). La exposición máxima a los estímulos fue de 120 segundos en ambos grupos. Los sapos podían evitar los estímulos permaneciendo en el compartimiento seguro. Cada punto representa el desempeño de cada grupo en una sesión diaria. [Datos aún no publicados]
Finalmente, se han realizado en sapos algunos estudios preliminares usando el procedimiento de evitación pasiva con el objeto de evaluar el efecto de lesiones del striatum (región homóloga a la amígdala de los mamíferos), los que sugieren que dicha área estaría relacionada con este fenómeno de aprendizaje aversivo (datos aún no publicados). Estos resultados proporcionan alguna información inicial acerca del circuito neural involucrado en el aprendizaje de evitación pasiva, una situación diseñada después de un amplio uso en el estudio del aprendizaje del miedo en mamíferos (Daneri et al., 2007).
De esta forma, los resultados obtenidos en sapos hasta el momento apoyan la idea que los mecanismos que subyacen al aprendizaje aversivo pueden haber evolucionado de grupos de vertebrados filogenéticamente antiguos.
DISCUSIÓN Y CONCLUSIONES
Aprendizaje asociativo en un corredor recto. Los resultados obtenidos en los experimentos de aprendizaje en un corredor recto aportan datos originales a la limitada información disponible sobre el aprendizaje en anfibios en general, y en la presente situación de entrenamiento en sapos en particular. Se ha observado una serie muy amplia de fenómenos de aprendizaje, entre ellos: adquisición bajo condiciones de entrenamiento masivo y espaciado, extinción, recuperación espontánea, efecto subsiguiente al refuerzo, efecto en la adquisición de la magnitud del reforzamiento y del reforzamiento parcial, ajustes de la tasa de adquisición en proporción directa a los cambios en la magnitud del reforzamiento y el efecto del sobreaprendizaje en adquisición (Muzio et al., 1992, 1994, 2006, 2011; Papini et al., 1995). En cierto sentido, la presencia de estos efectos valida la situación de entrenamiento, lo que sugiere que no se está ante un grupo peculiar de ajustes comportamentales sino que representan un grupo de características comunes del aprendizaje en una amplia variedad de vertebrados (Mackintosh, 1974).
Con respecto a los mecanismos cerebrales, la lesión del pallium medial de los sapos (homólogo anfibio del hipocampo de los mamíferos) no produjo efectos detectables sobre la adquisición de esta respuesta en un corredor recto, pero aumentó la resistencia a la extinción cuando los animales fueron cambiados a una sucesión de ensayos no reforzados en una fase de extinción (Muzio et al., 1993). Este resultado es el mismo que fue observado en ratas con lesión hipocampal entrenadas bajo condiciones análogas que abarcan cambios en la magnitud del refuerzo (Jarrard et al., 1964; Jarrard e Isaacson, 1965; Winocur y Mills, 1969; Rawlins et al., 1980). De esta forma, los presentes experimentos en sapos con lesiones del pallium medial muestran que las respuestas dominantes no son afectadas durante la adquisición, pero que estas mismas respuestas son muy resistentes a modificarse después de cambios en las condiciones de reforzamiento. El conjunto de resultados obtenidos en animales lesionados sugieren que el pallium medial de los anfibios y el hipocampo de los mamíferos comparten ciertas propiedades funcionales, tales como su papel en la inhibición de respuestas previamente aprendidas. Por otra parte, tanto los datos recogidos en estudios con animales intactos así como con animales lesionados en el pallium medial, sugieren que estos fenómenos de aprendizaje y los mecanismos neurales implicados habrían surgido muy tempranamente en el curso de la evolución.
Aprendizaje espacial. Nuestros estudios sobre la respuesta de giro mostraron que los sapos pueden utilizar una estrategia de giro centrado en su propio cuerpo para orientarse en un laberinto en cruz (Daneri et al., 2011). Este tipo de aprendizaje normalmente debería servir para que un individuo aprenda las rutas dentro de su territorio. Por ejemplo, se sabe que otros vertebrados (como peces y ratas), se mueven rápidamente a través de un terreno complejo para buscar la protección de su territorio cuando son amenazados por un predador (Ingle y Sahagian, 1973). Estas habilidades también pueden ser útiles para los anfibios a fin de llegar fácilmente a su refugio cuando existe riesgo de predación, o para localizar una fuente de agua cuando necesitan rehidratarse. De hecho, hay otros estudios (Adler, 1980) que sugieren que los anfibios utilizan patrones motores aprendidos para orientarse en el espacio (a través de la memorización de los caminos exitosos localizados previamente para alcanzar lugares meta).
Los resultados obtenidos en anfibios con lesiones del pallium medial muestran que dicha lesión imposibilita una orientación espacial mediante el aprendizaje de una respuesta de giro (datos aún no publicados). En contraste, en mamíferos se observa que la lesión del hipocampo no deteriora el aprendizaje de respuestas de giro. Esto sugiere que el pallium medial de los anfibios, si bien es una estructura homóloga, tendría una equivalencia funcional parcial con el hipocampo de los mamíferos.
Aprendizaje aversivo. Los resultados obtenidos hasta el momento sugieren que los mecanismos que subyacen al aprendizaje aversivo pueden haber evolucionado en vertebrados filogenéticamente antiguos. Por otra parte, también se ha verificado que mientras los anfibios tienen dificultad de aprender ante la administración de descargas eléctricas (típicamente usadas en el estudio del aprendizaje aversivo en mamíferos), adquieren sin problemas un aprendizaje aversivo, tanto activo como pasivo, cuando se usan soluciones salinas altamente hipertónicas que generan deshidratación (evitación activa: Daneri et al., 2007; evitación pasiva: datos aún no publicados). En particular, se obtuvo información acerca de la habilidad de los sapos para detectar la concentración de distintas soluciones salinas externas, siendo capaces de usar una solución neutra de NaCl como señal anticipatoria de la presencia posterior de una solución altamente hipertónica de NaCl (aversiva). La efectividad de estas soluciones salinas para inducir un aprendizaje aversivo está probablemente relacionada con su mayor relevancia ecológica en comparación con la de otros reforzadores aversivos comúnmente utilizados en estudios anteriores. Así, estos estudios proporcionan claras demostraciones de aprendizaje aversivo en sapos, una modalidad de aprendizaje que tradicionalmente ha sido difícil de demostrar en los anfibios (Macphail, 1982; Suboski, 1992; Muzio, 1999).
Aunque hasta el momento sólo existen resultados preliminares, la información acerca de los estudios sobre lesiones del striatum (homólogo a la amígdala de mamíferos) indica que esta región podría estar implicada en el aprendizaje de evitación pasiva (datos aún no publicados). Todavía son necesarios más estudios que aborden los aspectos funcionales del striatum, tanto con procedimientos de lesión como con otras técnicas, por ejemplo, neuroinmunohistoquímicas. De esta forma, se espera que el estudio de las bases neurales del aprendizaje aversivo en anfibios (tanto de evitación activa como pasiva) permita avanzar en el entendimiento de los mecanismos básicos involucrados en el aprendizaje aversivo de los vertebrados en general.
Observaciones finales. Dado que este grupo representa la transición desde el agua a la tierra, la investigación comparativa con anfibios puede proporcionar indicios interesantes acerca de la importancia evolutiva y adaptativa de todas estas estrategias de aprendizaje en los vertebrados (Muzio, 1999). En este aspecto, el estudio del cerebro y el comportamiento de vertebrados no-mamíferos y, en particular, de anfibios (como los primeros habitantes terrestres) puede ayudar a entender la historia evolutiva del cerebro de los mamíferos.
Finalmente, el conjunto de datos funcionales presentados aquí sugiere la presencia de dos sistemas de memoria diferentes en anfibios, basados en regiones telencefálicas discretas: el pallium medial, involucrado en el aprendizaje asociativo de relaciones temporales o espaciales entre eventos; y el striatum (incluyendo sus componentes amigdaloides), involucrado en el aprendizaje aversivo. Además, los efectos diferenciales generados por la lesión de estas áreas serían similares a los producidos por lesiones del hipocampo y la amígdala en mamíferos. Por otra parte, la gran similitud entre la función de áreas telencefálicas homólogas sugiere que el cerebro de los vertebrados contiene un patrón conservado de organización básica común. Llegamos así a la conclusión de que estos sistemas especializados de memoria podrían haber aparecido tempranamente durante la filogenia y haber sido conservados a través de la evolución de los vertebrados.
AGRADECIMIENTOS
Este trabajo se realizó gracias a la financiación del subsidio UBACYT-P052 de la Universidad de Buenos Aires y del subsidio PIP 3196 del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas) Argentina, dirigidos por Rubén N. Muzio.
LITERATURA CITADA
1. Anderson, P.; Morris, R.; Amaral, D.; Bliss, T. & O'Keefe, J. 2007. The hippocampal formation. En: Anderson, J.; Morris, R.; Amaral, D. et al. (eds.), The hippocampus book (First ed.). New York: Oxford University Press. [ Links ]
2. Antoniadis, E.A. & McDonald, R.J. 2001. Amygdala, hippocampus, and unconditioned fear. Experimental Brain Research 138: 200-209. [ Links ]
3. Balinsky, J.B. 2005. Adaptation of nitrogen metabolism to hyperosmotic environment in Amphibia. Journal of Experimental Zoology 215: 335-350. [ Links ]
4. Bentley P.J. & Main A.R. 1972. Zonal differences in permeability of the skin of some anuran amphibia. American Journal of Physiology 223: 361-363. [ Links ]
5. Bingman, V.P. 1990. Spatial navigation in birds: 423-447. En: Olton, D. & Kesner, R. (eds.), Neurobiology of Comparative Cognition. Erlbaum Press, Hillsdale, New Jersey. [ Links ]
6. Bingman, V.P. 2002. Neural basis of navigation and homing: 207-210. En: Nadel, L. (ed.), Encyclopedia of Cognitive Science, Vol. 3. Macmillan, London. [ Links ]
7. Bingman, V.P.; Jechura, T. & Kahn, M.C. 2006. Behavioral and neural mechanisms of homing and migration in birds. En: Brown, M.F. & Cook, R.G. (eds.), Animal Spatial Cognition: Comparative, Neural, and Computational Approaches. Disponible en: http://www.pigeon.psy.tufts.edu/asc/bingman/. Último acceso: 10 agosto 2012. [ Links ]
8. Bingman, V.P. & Sharp, P.E. 2006. Neuronal implementation of hippocampal-mediated spatial behavior: A comparative-evolutionary perspective. Behavioral and Cognitive Neuroscience Reviews 5: 80-91. [ Links ]
9. Bingman, V.P.; Salas, C. & Rodríguez, F. 2009. Evolution of the Hippocampus: 1356-1360. En: Binder, M.; Hirokawa, N. & Windhorst, U. (eds.), Encyclopaedia of Neuroscience. Springer-Verlag, Berlin. [ Links ]
10. Bitterman, M.E. 1975. The comparative analysis of learning. Science 188: 699-709. [ Links ]
11. Blair, H.T.; Schafe, G.E.; Bauer, E.P.; Rodrigues, S.M. & LeDoux, J.E. 2001. Synaptic plasticity in the lateral amygdala: A cellular hypothesis of fear conditioning. Learning and Memory 8: 229-242. [ Links ]
12. Broglio, C.; Gómez, A.; Durán, E.; Ocaña, F.M.; Jiménez-Moya, F.; Rodríguez, F. & Salas, C. 2005. Hallmarks of a common forebrain vertebrate plan: Specialized pallial areas for spatial, temporal and emotional memory in actinopterygian fish. Brain Research Bulletin 66: 277-281. [ Links ]
13. Brush, F.R. 1971. Aversive conditioning and learning. Academic Press, New York. [ Links ]
14. Campbell, B.A. & Masterton, F.A. 1969. Psychophysics of punishment: 3-42. En: B.A. Campbell, B:A & Church, R.M. (eds.), Punishment and aversive behavior. Appleton-Century-Crofts, New York. [ Links ]
15. Christensen, C.U. 1974. Adaptations in the water economy of some anuran amphibia. Comparative Biochemistry and Physiology A 47: 1035-1049. [ Links ]
16. Clayton, N.S. & Krebs, J.R. 1995. Memory of spatial and object-specific cues in food-storing and non-storing birds. Journal of Comparative Physiology A 174: 371-379. [ Links ]
17. Colombo, M. & Broadbent, N. 2000. Is the avian hippocampus a functional homologue of the mammalian hippocampus? Neuroscience and Biobehavioral Reviews 24: 465-484. [ Links ]
18. Contestabile, A.; Bissoli, R. & Niso, R. 1990. Regional distribution of neurotransmitter-related markers: A quantitative microchemical approach to the study of telencephalic evolution: 183-196. En: Schwerdtfeger, W.K. & Germroth, P. (eds.), The forebrain in non-mammals. New aspects of structure and development. Springer-Verlag, Berlin. [ Links ]
19. Daneri, M.F.; Casanave, E. & Muzio, R.N. 2011. Control of spatial orientation in terrestrial toads (Rhinella arenarum). Journal of Comparative Psychology 125: 296-307. [ Links ]
20. Daneri, M.F.; Papini, M.R. & Muzio, R.N. 2007. Common toads (Bufo arenarum) learn to anticipate and avoid hypertonic saline solutions. Journal of Comparative Psychology 121: 419-427. [ Links ]
21. Duellman, W.E. & Trueb, L. 1986. Biology of amphibians. Mc Graw-Hill, New York. [ Links ]
22. Feldon, J.; Rawlins, J.N.P., & Gray, J.A. 1985. Fornix-fimbria section and the partial reinforcement extinction effect. Experimental Brain Research 58: 435-439. [ Links ]
23. Ferran, J.L.; de Oliveira, E. D.; Merchán, P.; Sandoval, J. E.; Sánchez-Arrones, L.; Martínez de la Torre, M. & Puelles, L. 2009. Genoarchitectonic profile of developing nuclear groups in the chicken pretectum. The Journal of Comparative Neurology 517: 405-51. [ Links ]
24. Gallagher, M.; Graham, P.W. & Holland, P.C. 1990. The amygdala central nucleus and appetitive Pavlovian conditioning: lesions impair one class of conditioned behavior. Journal of Neuroscience 10: 1906-1911. [ Links ]
25. Gómez-Mestre, I. & Tejedo, M.. 2003. Local adaptation of an anuran amphibian to osmotically stressful environments. Evolution 57: 1889-1899. [ Links ]
26. González, A. & Northcutt, R.G. 2009. An immunohistochemical approach to lungfish telencephalic organization. Brain, Behavior and Evolution 74: 43-55. [ Links ]
27. Gray, J.A. 1987. The Psychology of Fear and Stress. Cambridge University Press, Cambridge. [ Links ]
28. Hillman, S.S.; Withers, P.C.; Drewes, R.C. & Hillyard, S.D. 2009. Ecological and Environmental Physiology of Amphibians. Oxford University Press, Oxford. [ Links ]
29. Hillyard, S.D.; Hoff, K.v.s. & Propper, C.R. 1998. The water absorption response: a behavioral assay for physiological processes in terrestrial amphibians. Physiological Zoology 71: 127-138. [ Links ]
30. Ingle, D. & Sahagian, D. 1973. Solution of a spatial constancy problem by goldfish. Physiological Psychology 1: 83-84. [ Links ]
31. Jarrard, L.E. & Isaacson, R.L. 1965. Hippocampal ablation in rats: Effects of intertrial interval. Nature 207: 109-110. [ Links ]
32. Jarrard, L.E.; Isaacson, R.L., & Wickelgren, W.O. 1964. Effects of hippocampal ablation and intertrial interval on acquisition and extinction of a runway response. Journal of Comparative and Physiological Psychology 57: 442-445. [ Links ]
33. Kesner, R.F.; Bolland, B.L. & Davis, M. 1993. Memory of spatial location, motor responses and objects: Triple dissociation among the hippocampus, caudate nucleus and extrastriate visual cortex. Experimental Brain Research 93: 462-470. [ Links ]
34. LeDoux, J.E. 2000. Emotion circuits in the brain. Annual Review of Neuroscience 23: 155-184. [ Links ]
35. LeDoux, J.E. 2003. The emotional brain, fear, and the amygdala. Cellular and Molecular Neurobiology 23: 727-738. [ Links ]
36. López, J.C. 1999. Memoria espacial y corteza medial en la tortuga Pseudemys scripta. Tesis Doctoral. Universidad de Sevilla. [ Links ]
37. López, J.C.; Bingman, V.P.; Rodríguez, F.; Gómez, Y. & Salas, C. 2000. Dissociation of place and cue learning by telencephalic ablation in Goldfish. Behavioral Neuroscience 114: 687-699. [ Links ]
38. Loza Coll, M.A. 1998. Comportamiento de Bufo arenarum (sapo común) frente a soluciones externas de diferente osmolaridad. Desarrollo de un modelo experimental de estimulación aversiva en la especie. Tesis de Licenciatura, Universidad de Buenos Aires. [ Links ]
39. Mackintosh, N.J. 1974. The Psychology of Animal Learning. Academic Press, New York. [ Links ]
40. Macphail, E.M. 1982. Brain and Intelligence in Vertebrates. Claredon Press, Oxford. [ Links ]
41. Martínez-García, F.; Puelles, L.; Ten Donkelaar, H.J. & González, A. 2012. Adaptive function and brain evolution. Frontiers in Neuroanatomy 6: 17. [ Links ]
42. McDonald, R.J. & White, N.M. 1993. A triple dissociation of memory system: Hippocampus, amygdala and dorsal striatum. Behavioral Neuroscience 107: 3-22. [ Links ]
43. McDonald, R.J. & White, N.M. 1994. Parallel information processing in the water maze: Evidence of independent memory system involving dorsal striatum and hippocampus. Behavioral and Neural Biology 61: 260-270. [ Links ]
44. Medina, L.; Bupesh, M. & Abellán, A. 2011. Contribution of genoarchitecture to understanding forebrain evolution and development, with particular emphasis on the amygdala. Brain, Behavior and Evolution 3: 216-236. [ Links ]
45. Moreno, N. & González, A. 2004. Localization and connectivity of the lateral amygdala in anuran amphibians. The Journal of Comparative Neurology 479: 130-148. [ Links ]
46. Moreno, N. & González, A. 2006. The common organization of the amygdaloid complex in tetrapods: new concepts based on developmental, hodological and neurochemical data in anuran amphibians. Progress in Neurobiology 78: 61-90. [ Links ]
47. Moreno, N. & González, A. 2007. Evolution of the amygdaloid complex in vertebrates, with special reference to the anamnio-amniotic transition. Journal of Anatomy 211: 151-163. [ Links ]
48. Morona, R.; Ferran, J.L.; Puelles, L. & González, A. 2011. Embryonic genoarchitecture of the pretectum in Xenopus laevis: A conserved pattern in tetrapods. The Journal of Comparative Neurology 519: 1024-1050. [ Links ]
49. Morris, R.G. 1981. Spatial localization does not require the presence of local cues. Learning and Motivation 12: 239-260. [ Links ]
50. Muzio, R.N. 1999. Aprendizaje instrumental en anfibios. Revista Latinoamericana de Psicología 31: 35-47. [ Links ]
51. Muzio, R.N.; Pistone Creydt, V.; Iurman, M.; Rinaldi, M.; Sirani, B. & Papini, M.R. 2011. Incentive or habit learning in amphibians? PLoS One 6: e25798. [ Links ]
52. Muzio, R.N.; Ruetti, E. & Papini, M.R. 2006. Determinants of instrumental extinction in terrestrial toads (Bufo arenarum). Learning and Motivation 37: 346-356. [ Links ]
53. Muzio, R.N.; Segura, E.T. & Papini, M.R. 1992. Effect of schedule and magnitude of reinforcement on instrumental acquisition and extinction in the toad, Bufo arenarum. Learning and Motivation 23: 406-429. [ Links ]
54. Muzio, R.N.; Segura, E.T. & Papini, M.R. 1993. Effects of lesions in the medial pallium on instrumental learning in the toad (Bufo arenarum). Physiology and Behavior 54: 185-188. [ Links ]
55. Muzio, R.N.; Segura, E.T. & Papini, M.R. 1994. Learning under partial reinforcement in the toad (Bufo arenarum): Effects of lesions in the medial pallium. Behavioral and Neural Biology 61: 36-46. [ Links ]
56. Nadel, L. 1990. Varieties of spatial cognition. Psychobiological considerations. Annals of the New York Academy of Sciences 608: 613-636. [ Links ]
57. Nadel, L. 1991. The hippocampus and space revisited. Hippocampus 1: 221-229. [ Links ]
58. Northcutt, R.G. 1974. Some histochemical observations on the telencephalon of the bullfrog, Rana catesbeiana Shaw. The Journal of Comparative Neurology 157: 379-390. [ Links ]
59. Northcutt, R.G. & Kicliter, E. 1980. Organization of the amphibian telencephalon: 203-255. En: Ebbesson, S.O.E. (ed.), Comparative neurology of the telencephalon. Plenum, New York. [ Links ]
60. Northcutt, R.G. & Ronan, M. 1992. Afferent and efferent connections of the bullfrog medial pallium. Brain, Behavior and Evolution 40: 1-16. [ Links ]
61. O´Keefe, J. & Nadel, L. 1978. The Hippocampus as a Cognitive map. Clarendon Press, Oxford. [ Links ]
62. O'Keefe, J. & Dostrovsky, J. 1971. The hippocampus as a spatial map. Preliminary evidence from unit activity in the freely-moving rat. Brain Research 34: 171-75. [ Links ]
63. Packard, M. & McGaugh, J. 1992. Double dissociation of fornix and caudate nucleus lesions on acquisition of two water maze tasks: Further evidence for multiple memory system. Behavioral Neuroscience 106: 439-446. [ Links ]
64. Packard, M. & McGaugh, J. 1996. Inactivation of hippocampus or caudate nucleus with lidocaine differentially affects expression of place and response learning. Neurobiology of Learning and Memory 65: 65-72. [ Links ]
65. Papini, M.R. 2002. Pattern and process in the evolution of learning. Psychological Review 109: 186-201. [ Links ]
66. Papini, M.R. 2003. Comparative psychology of surprising nonreward. Brain, Behavior and Evolution 62: 83-95. [ Links ]
67. Papini, M.R.; Salas, C. & Muzio, R.N. 1999. Análisis comparativo del aprendizaje en vertebrados. Revista Latinoamericana de Psicología 31: 15-34. [ Links ]
68. Papini, M.R.; Muzio, R.N. & Segura, E.T. 1995. Instrumental learning in toads (Bufo arenarum): Reinforcer magnitude and the medial pallium. Brain, Behavior and Evolution 46: 61-71. [ Links ]
69. Papp, G.; Witter, M.P. & Treves, A. 2007. The CA3 network as a memory storage for spatial representation. Learning and Memory 14: 732-744. [ Links ]
70. Pare, D.; Quirk, G.J. & LeDoux, J.E. 2004. New vistas on amygdala networks in conditioned fear. Journal of Neurophysiology 92: 1-9. [ Links ]
71. Peterson, E. 1980. Behavioral Studies of Telencephalic Functions in Reptiles. Comparative Neurology of the Telencephalon. Plenum Press, New York. [ Links ]
72. Portavella, M.; Torres, B. & Salas, C. 2004a. Avoidance response in goldfish: Emotional and temporal involvement of medial and lateral telencephalic pallium. The Journal of Neuroscience 24: 2335-2342. [ Links ]
73. Portavella, M.; Torres, B.; Salas, C. & Papini, M.R. 2004b. Lesions of the medial pallium, but not of the lateral pallium, disrupt spaced-trial avoidance learning in goldfish (Carassius auratus). Neuroscience Letters 362: 75-78. [ Links ]
74. Pravosudov, V.V. & Clayton, N.S. 2002. A test of the adaptive specialization hypothesis: population differences in caching, memory and the hippocampus in black-capped chickadees (Poecile atricapilla). Behavioral Neuroscience 116: 515-522. [ Links ]
75. Rawlins, J.N.P.; Feldon, J. & Gray, J.A. 1980. The effects of hippocampectomy and of fimbria section upon the partial reinforcement extinction effect in rats. Experimental Brain Research 38: 273-283. [ Links ]
76. Reboreda, J.C. & Segura, E.T. 1984. Electrolyte sensivity of the skin in the toad, Bufo arenarum Hensel. Acta Physiologica et Pharmacologica Latinoamericana 34: 37-43. [ Links ]
77. Reboreda, J.C.; Muzio, R.N.; Viñas, M.C. & Segura, E.T. 1991. b-adrenergic control of the water permeability of the skin during rehydration in the toad Bufo arenarum. Comparative Biochemistry and Physiology 100C: 433-437. [ Links ]
78. Rodríguez, F.; Durán, E.; Vargas, J.P.; Torres, B. & Salas, C. 1994. Performance of goldfish trained in allocentric and egocentric maze procedures suggests the presence of a cognitive mapping system in fishes. Animal Learning and Behavior 22: 409-420. [ Links ]
79. Rodríguez, R.; López, J.C.; Vargas, J.P.; Gómez, Y.; Broglio, C. & Salas, C. 2002. Conservation of spatial memory function in the pallial forebrain of reptiles and ray-finned fishes. Journal of Neuroscience 22: 2894-2903. [ Links ]
80. Schmajuk, N.A. & Segura, E.T. 1982. Behavioral regulation of water balance in the toad. Herpetologica 38: 296-301. [ Links ]
81. Schmaltz, L.W. & Isaacson, R.L. 1967. Effect of bilateral hippocampal destruction on the acquisition and extinction of an operant response. Physiology and Behavior 2: 291-298. [ Links ]
82. Scoville, W.B. & Milner, B. 1957. Loss of Recent Memory After Bilateral Hippocampal Lesions. The Journal of Neurology, Neurosurgery and Psychiatry 20: 11-21. [ Links ]
83. Segura, E.T.; Bandsholm, U.C. & Bronstein, A. 1982. Role of the CNS in the control of the water economy of the toad Bufo arenarum Hensel (II). Journal of Comparative Physiology B 146: 101-106. [ Links ]
84. Suboski, M.D. 1992. Releaser-induced recognition learning by amphibians and reptiles. Animal Learning and Behavior 20: 63-82. [ Links ]
85. Suzuki, M.; Hasegawa, T.; Ogushi, Y. & Tanaka, S. 2007. Amphibian aquaporins and adaptation to terrestrial environments: a review. Comparative Biochemistry and Physiology A 148: 72-81. [ Links ]
86. Tolman, E.C. 1948. Cognitive maps in rats and men. Psychological Review 55: 189-208. [ Links ]
87. Waalas, I. 1983. The hippocampus: 337-358. En: Emson, P.C. (ed.), Chemical Neuroanatomy. Raven Press, New York. [ Links ]
88. Wilczynski, W. & Northcutt, R.G. 1983. Connections of the bullfrog striatum: Afferent organization. The Journal of Comparative Neurology 214: 321-332. [ Links ]
89. Winocur, G. & Mills, J.A. 1969. Hippocampus and septum in response inhibition. Journal of Comparative and Physiological Psychology 67: 352-357. [ Links ]
90. Wood, E.R.; Dudchenko, P.A.; Robitsek, R.J. & Eichenbaum, H. 2000. Hippocampal neurons encode information about different types of memory episodes occurring in the same location. Neuron 27: 623-633. [ Links ]
91. Wulliman, M.F. & Rink, E. 2002. The teleostean forebrain: A comparative and developmental view based on early proliferation, Pax6 activity and catecholaminergic organization. Brain Research Bulletin 57: 363-370. [ Links ]













