Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Cuadernos de herpetología
versión On-line ISSN 1852-5768
Cuad. herpetol. vol.29 no.1 San Salvador de Jujuy mayo 2015
TRABAJO
Ecología trófica y dimorfismo sexual del lagarto endémico Liolaemus eleodori (Iguania: Liolaemidae) del Parque Nacional San Guillermo, San Juan, Argentina
Graciela V. Astudillo1,2, Juan C. Acosta2, Héctor J. Villavicencio2, Mariela A. Córdoba1,2
1 Centro de Investigaciones de la Geósfera y la Biósfera, Diversidad y Biología de Vertebrados del Árido (Grupo DIBIOVA), Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de San Juan. Av. Ignacio de la Roza 590, 5402, San Juan, Argentina.
2 Departamento de Biología, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de San Juan, Argentina. Av. Ignacio de la Roza 590, 5402, San Juan, Argentina.
Recibido: 03/06/13
Revisado: 08/04/14
Aceptado: 04/12/14
ABSTRACT
A study of the diet composition and its seasonal (December 2004 and February 2005) and intersexual variation was performed in Liolaemus eleodori. Moreover, trophic niche breadth, trophic diversity and predator-prey ratio was determined; this latter measure was made between the length, width and maximum volume of prey and morphology (LHC and head measures) from predators. Also information on sexual dimorphism was supplied. For trophic analysis digestive tracts were used. Each prey item found was reconstructed for its identification and its volume, numerosity, and frequency of occurrence were estimated. It was used the Relative Importance Index (RII) to estimate the contribution of each food category to the diet. To examine sexual dimorphism, 14 morphological variables were measured. Liolaemus eleodori showed a tendency to the omnivore feed, consume arthropods: insects, spiders, mites and centipedes; being also frequent the presence of vegetal material. Males were significantly larger than females in length, width and maximum height of head, femur length, tail length and exhibited a greater number of precloacal pores.
Key words: Liolaemus; San Guillermo; Diet; Sexual Dimorphism.
RESUMEN
Se realizó un estudio de la composición de la dieta y su variación intersexual y estacional (diciembre 2004 y febrero 2005) en Liolaemus eleodori. Además, se determinó la amplitud del nicho trófico, la diversidad trófica y la relación depredador-presa; esta última medida se realizó entre el largo, ancho y volumen máximos de las presas y la morfología (LHC y medidas de la cabeza) de los depredadores. También se aporta información sobre el dimorfismo sexual. Para el análisis trófico se utilizaron los tractos digestivos. Cada ítem presa encontrado fue reconstruido para su identificación y se estimó su volumen, numerosidad y frecuencia de ocurrencia. Se utilizó el Índice de Importancia Relativa (IRI) para estimar la contribución de cada categoría de alimento a la dieta. Para examinar el dimorfismo sexual se midieron 14 variables morfológicas. Liolaemus eleodori mostró una tendencia a la alimentación omnívora, consume artrópodos: insectos, arañas, ácaros y ciempiés; siendo también frecuente la presencia del material vegetal. Los machos resultaron significativamente más grandes que las hembras en la longitud, el ancho y la altura máxima de la cabeza, en la longitud de fémur, la longitud de la cola y presentaron un mayor número de poros precloacales.
Palabras clave: Liolaemus; San Guillermo; Dieta; Dimorfismo Sexual.
INTRODUCCION
El estudio de la dieta es un requerimiento fundamental para entender los diferentes fenómenos ecológicos y evolutivos en los animales (Pincheira Donoso, 2008) y proporciona información para la conservación de algunas especies escasamente conocidas (Reca et al., 1994; Villavicencio et al., 2005).
Los caracteres morfológicos de los depredadores, como las dimensiones de la cabeza, longitud de la mandíbula y la dentición podrían tener relación con la selección del recurso trófico (Pianka, 1973; Belver y Avila, 2002; Villavicencio et al., 2005).
En general, la mayoría de los lagartos son insectívoros y a menudo oportunistas (Pianka, 1973). Si consideramos los hábitos en la alimentación, muchas especies pueden oscilar entre la carnivoría, omnivoría o la herbivoría, fluctuando entre uno u otro tipo de alimentación dependiendo de diferentes factores (Roca, 1999). Del mismo modo, los cambios en las condiciones ambientales pueden variar entre las estaciones y esto podría influir en la composición de la dieta. Por ejemplo, la preferencia por el material vegetal cuando las presas animales son deficientes o no tan abundantes (Brown y Pérez-Mellado, 1994). Muchas especies generalmente llamadas "herbívoras" son probablemente simples omnívoros, y en el mejor de los casos son herbívoros facultativos (Iverson, 1982).
El dimorfismo sexual en lagartos se puede expresar en el tamaño corporal (Pough et al., 2001; Valdecantos y Lobo, 2007) y podría estar relacionado con funciones ecológicas como estrategias de alimentación o simplemente para reducir la competencia interespecífica, debido a que diferentes tamaños corporales son más efectivos en la utilización de distintos tipos de recursos (Pianka, 1986; Herrel et al., 2004). El tamaño de las distintas estructuras corporales es el resultado evolutivo de presiones selectivas que actúan diferencialmente en machos y hembras. Estas presiones pueden llegar a reducir el solapamiento de nichos y la competencia entre sexos (Pianka, 1982; Villavicencio et al., 2003). Existen algunos registros en los cuales la dieta está relacionada con el dimorfismo sexual, como es el caso de Tropidurus melanopleurus, en donde los machos consumen una variedad de artrópodos, mientras que las hembras son estrictamente mirmecófagas. Además, los machos subadultos capturan presas más grandes que las hembras adultas (Pérez Mellado y De la Riva, 1993).
El género Liolaemus incluye un grupo muy elevado de especies, llegando a más de 260 especies descriptas, siendo su distribución geográfica muy amplia, se lo encuentra en la región fitogeográfica del Monte, Estepa Patagónica y la Puna (Abdala y Quinteros, 2014). En cuanto a su dieta existen especies insectívoras, omnívoras y herbívoras (Espinoza et al., 2004), tales como, L. bibronii (Belver y Avila, 2001), L. crepuscularis (Semhan et al., 2013), L. cuyanus (Moreno Azócar y Acosta, 2011), L. elongatus (Quatrini et al., 2001), L. lutzae (Rocha, 1989), L. multicolor (Valdecantos, 2011), L. nigromaculatus (Ortiz y Riveros, 1976), L. poecilochromus (Valdecantos et al., 2012.), L. ruibali (Villavicencio et al., 2005), L. wiegmannii (Aun et al., 1999). El grado de dimorfismo sexual en el tamaño corporal, en su forma y/o la coloración (Rocha, 1999; Halloy y Robles, 2002; Fox y Shipman, 2003; Frutos et al., 2007; Pincheira Donoso et al., 2009) sugiere una gran variación en la selección sexual (Stuart Fox y Ord, 2004; Vanhooydonck et al., 2010). Existen antecedentes de investigaciones sobre dimorfismo sexual en el género Liolaemus, en Argentina, en L. cuyanus (Laspiur y Acosta, 2007), L. elongatus y L. pictus (Ibargüengoytia y Cussac, 1999), L. gracilis, L. multimaculatus, L. wiegmannii, (Vega, 1999), L. multicolor y L. irregularis (Valdecantos y Lobo, 2007), L. olongasta (Cánovas et al., 2006), L. pseudoanomalus (Villavicencio et al., 2003), L. riojanus (Laspiur et al., 2006), L. sanjuanensis (Cei et al., 1983), L. saxatilis (Avila et al, 1992); en Brasil, L. arambarensis (Verrastro et al., 2003), L. lutzae (Rocha, 1999), L. occipitalis (Verrastro, 2004); en Chile, en diversas especies del grupo nigromaculatus (Ortiz, 1981), L. tenuis (Vidal et al., 2005), entre otros.
Liolaemus eleodori (Cei et al., 1983) es una especie endémica del Parque Nacional San Guillermo (Acosta et al., 2007), se encuentra aproximadamente sobre los 3500 m s.n.m. y habita en los llanos de San Guillermo, que fitogeográficamente pertenecen a la Puna. Actualmente está categorizada como especie no amenazada (Abdala et al., 2012). Los antecedentes de estudios en L. eleodori, incluyen la confirmación del modo reproductivo vivíparo de la especie (Cabrera y Monguillot, 2007) y aspectos sobre la ecología térmica (Villavicencio et al., 2012). No se ha publicado información sobre su ecología trófica ni la existencia de dimorfismo sexual. Por ello el objetivo del presente trabajo es conocer la composición de la dieta de una población de L. eleodori, determinando la existencia de variaciones estacionales y sexuales. Además, aportar información sobre el dimorfismo sexual, su relación depredador- presa y la dieta.
MATERIALES AND METODOS
Área de estudio. El estudio fue llevado a cabo en el Parque Nacional San Guillermo, ubicado en el Departamento Iglesia en el extremo Norte de la Provincia de San Juan (29°20'12"S; 69°24'19"O). El clima de la región es árido-desértico, con elevada heliofanía e insolación, escasa humedad y muy reducida nubosidad. La temperatura media anual es de 6,7 ° C, con una precipitación media anual de 150 mm, con vientos frecuentes de 10 km/h (Salvioli, 2007). Entre las unidades fitogeográficas se mencionan: Monte, Puna y Altoandino (pastizales) (Martínez Carretero, 2007). Lycium chanar es la especie vegetal que conforma la comunidad de mayor extensión en el área y como acompañantes se encuentran Fabiana denudata (Tola o Pichanilla), Chuquiraga erinacea ssp. hystrix (Cuete), Maihueniopsis ovata (Gatito), Acantholippia deserticola, Azorella cryptantha y A. trifurcata (Llareta), entre otras (Martínez Carretero et al., 2007).
Trabajo de campo. Los muestreos se realizaron durante las siguientes estaciones: principios de verano 2004 (diciembre) y finales de verano 2005 (febrero), debido a que las condiciones climáticas del área de estudio son marcadamente diferentes. La técnica de captura fue mediante el método de lazo o por captura manual. Un total de 33 ejemplares adultos fueron capturados, de los cuales 20 fueron machos y 13 hembras. El número de individuos con el que se trabajó fue reducido debido a que la zona de estudio es un área protegida y además esta investigación formó parte de un proyecto más amplio destinado a conocer la biología de los ensambles del área protegida. Los individuos fueron sacrificados inmediatamente después de su captura por administración intraperitoneal de tiopental sódico, fijados al 10% con formaldehído por 24 horas y finalmente preservados en etanol al 70% (Aun y Martori, 1998; Villavicencio et al., 2005; Semhan et al., 2013). Los datos de la colección científica se encuentran en el apéndice.
Trabajo de laboratorio. Se procedió a la disección de los tractos gastrointestinales, luego el material obtenido fue colocado en cajas de petri e hidratado. La identificación de presas se realizó utilizando una lupa binocular estereoscópica (10-40x), utilizando la clave de identificación de Bland y Jaques (1978), Brewer y Argüello (1980) y también se consultó la propuesta de Regier et al. (2010) sobre los nuevos arreglos taxonómicos de los artrópodos basados en estudios sistemáticos con base molecular. A los ítems vegetales se los consideró como una sola categoría y cuando fue posible se diferenció en flores y frutos. Los individuos-presas encontrados se agruparon en ítems presas siguiendo el criterio de unidad taxonómica operacional (OTU) (Sneath y Sokal, 1973).
Se midieron 14 variables morfológicas con calibre de precisión Vernier 0.02 mm. Las variables utilizadas fueron: longitud hocico-cloaca, desde el margen anterior de la escama mental hasta la abertura cloacal (LHC); longitud de la cabeza, desde el borde posterior de la abertura auricular hasta la escama rostral (LCA); ancho de la cabeza, entre las comisuras de la boca (ANCA); altura máxima de la cabeza, a la altura del tímpano (ALCA); distancia de separación entre los miembros anteriores y posteriores, desde las axilas de los miembros anteriores hasta la unión del tronco con los miembros posteriores (DM); longitud del húmero, desde la axila hasta el codo (LH); longitud radio cúbito, desde el codo hasta el ángulo interno entre la mano y el brazo (LRC); longitud de la mano, desde el extremo proximal de la mano hasta la punta del cuarto dedo (LM); longitud de fémur, desde la ingle hasta la rodilla (LF); longitud tibio-fíbula, desde la rodilla hasta el ángulo interno con el pie (LTF); longitud de la pata, desde el extremo proximal del pie hasta la punta del cuarto dedo (LP); distancia narina-rostral, desde el borde de la abertura nasal hasta la escama rostral (NR) y longitud de la cola, desde el borde de la cloaca hasta su extremo distal (LC) y el número de poros precloacales (NPC).
Análisis de los datos. En el análisis de la dieta sólo se utilizaron los tractos gastrointestinales que se encontraban llenos o semi-llenos. Para asignar una categoría alimentaria al total de la muestra (población) se utilizó el método propuesto por Espinoza et al. (2004), que se basa en el porcentaje de volumen (%Vol.) de vegetales consumidos tomando en cuenta las siguientes definiciones: 0-10%: insectívoro; 11-50%: omnívoro y 51-100%: herbívoro. Además, se analizó la existencia de variaciones sexuales para cada estación. El %Vol. vegetal se calculó en relación al contenido total del tracto digestivo de cada individuo. Para probar si existen diferencias significativas entre los porcentajes de volumen vegetal y animal se realizó la prueba U de Mann-Whitney ya que los datos no cumplieron los supuestos de normalidad. Este método también se utilizó para analizar las variaciones sexuales en cada estación.
Para cada ítem presa se calculó la numerosidad (número de un tipo de presa en particular en cada estómago) y frecuencia relativa (número de individuos con un tipo de presa particular en su estómago) de aparición de los distintos ítems presa así como sus respectivos volúmenes. Para esta última variable se midió, con una cuadrícula graduada, el ancho y largo de cada presa, luego de su reconstrucción (Aun y Martori, 1998). El volumen se calculó empleando la fórmula propuesta por Dunham (1983) para una esfera elipsoide: V= 4/3π (a/2) (b/2)2, donde a = largo y b = ancho. En el caso del ítem flores y frutos, para la estimación de su volumen se formó un paquete de forma esferoide y se midió su volumen de la misma manera que se hizo para los ítems animales. Para el total de la muestra se calculó el índice de importancia relativa (IRI) (Pinkas et al., 1971) a fin de determinar la contribución de cada ítem en la dieta. IRI= %FO (%N+%V); donde %N expresa la importancia numérica, %V la importancia volumétrica y %FO expresa la proporción de estómagos conteniendo una categoría específica. Además se calculó el IRI para analizar las variaciones sexuales en cada estación.
La diversidad trófica se determinó en cada estación, sexo y para la muestra total mediante el índice de diversidad de Brillouin (B) usando PAST 1.86 (Hammer et al., 2001). Para realizar comparaciones estacionales y sexuales se utilizaron pruebas t.
La amplitud trófica del nicho se obtuvo mediante el índice de Levins (Duré, 1998):
Nb = (Σ Pi j2)-1. Donde Pij es la probabilidad del número de veces que apareció el ítem presa i en la muestra total j.
Para evaluar la relación del tamaño del depredador (en cada sexo) con respecto a la selección de presas se realizaron correlaciones de Spearman entre el largo, ancho y volumen máximos de las presas en relación a la longitud de la cabeza, altura máxima de la cabeza, ancho de la cabeza y longitud hocico-cloaca de los depredadores.
Para evaluar el dimorfismo sexual entre machos y hembras adultas las variables fueron comparadas con pruebas U de Mann-Whitney ya que los datos no cumplieron los supuestos de normalidad.
RESULTADOS
Composición de la dieta. Del total de individuos (n= 33), 20 se encontraron con el estómago lleno o semi-lleno (13 machos y 7 hembras grávidas) y 13 estaban vacíos.
Liolaemus eleodori es omnívoro ya que el %Vol. de vegetal consumido es del 45,35 %. Los valores medios de %Vol. animal fueron mayores con respecto a los de %Vol. vegetal, no existiendo diferencias significativas entre dichos porcentajes (Mann-Whitney U= 374,5; p= 0,33; n= 20; Medianaanimal= 55, Medianavegetal= 45).
Para el total de la muestra se identificaron 395 presas y se agruparon en 12 ítems presa: Acariina, Araneae, Coleoptera, Diptera, Flores, Frutos, Hemiptera, Hymenoptera (Formicidae), Hymenoptera (no formícidos), Larvas, Myriapoda y Orthoptera.
Se observa que el ítem más importante en cuanto a la numerosidad fue Hemiptera (%N= 47), seguido por Coleoptera (%N= 14) y Flores (%N= 13,5). Con respecto al Porcentaje de Frecuencia de Ocurrencia (%FO), el ítem que apareció en la mayoría de los estómagos fue Coleoptera (%FO= 47,5), luego se destacaron Hemiptera (%FO= 45), Hymenoptera (Formicidae) (%FO= 27,5). El ítem presa que mayor %Vol. es Flores (55,26%) seguido por Frutos con un 16,98 % y Coleoptera con un 12,07 % (Tabla 1).
Tabla 1. Composición de la dieta para una población de Liolaemus eleodori (n= 20), para machos y hembras de diciembre (n= 8) y machos y hembras de febrero (n= 12). %N= porcentaje de numerosidad en el total de las presas, %FO= porcentaje de frecuencia de ocurrencia en el total de estómagos, %Vol.= porcentaje volumétrico de las presas, IRI= índice de importancia relativa.
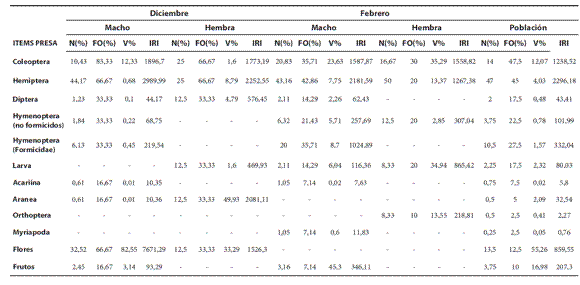
Al calcular el Índice de Importancia Relativa para el total de la muestra se obtuvo que el ítem presa fundamental fue Hemiptera (IRI= 2296,18). El ítem presa secundaria fue Coleoptera (IRI= 1238,52) (Tabla 1).
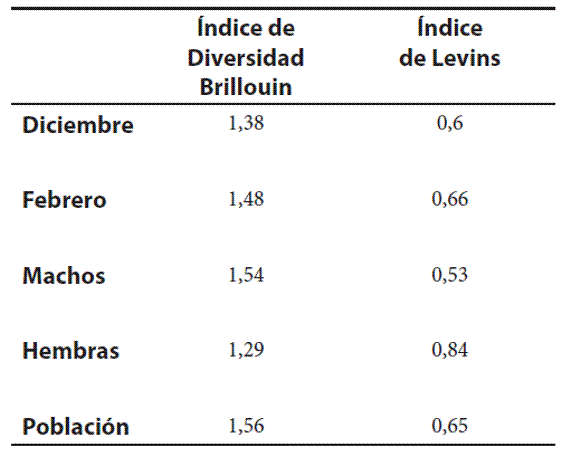
El valor de la diversidad trófica que se obtuvo con el índice de Brillouin para el total de los individuos fue de B= 1,56. La amplitud del nicho trófico (Nb) para esta especie fue de 0,65 (Tabla 2).
Tabla 2. Índice de diversidad de Brillouin e Índice de Levins (amplitud trófica del nicho) para una población de Liolaemus eleodori, para diciembre y febrero y para machos y hembras.
Del total de estómagos e intestinos analizados se encontró que el 12,5% contenía piedras y el 30% Nematoda de al menos dos especies, localizados en diferentes partes del tracto gastrointestinal.
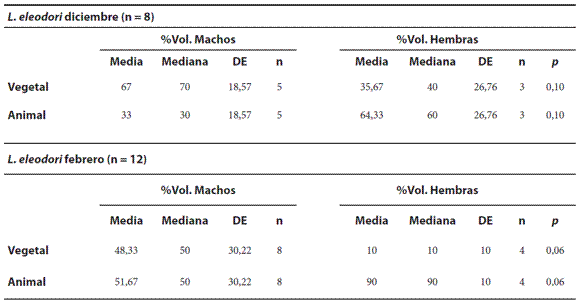
Variación estacional y sexual. En diciembre (n= 8) los machos consumieron el 67% de material vegetal y las hembras el 35,67 %. Para febrero (n=12) los machos presentaron un %Vol. vegetal del 48,33% y las hembras un 10%. Sin embargo, no se observaron diferencias significativas entre sexos en ambas estaciones (Tabla 3).
Tabla 3. Medias, medianas, desviación estándar (DE) y tamaño muestral (n) del porcentaje de volumen (%Vol.) vegetal y animal de Liolaemus eleodori para diciembre y febrero; * indica diferencias estadísticamente significativas (p< 0,05), Prueba U de Mann-Whitney.
Tanto en diciembre como en febrero los machos presentaron un dominio numérico de Hemiptera (%Ndiciembre= 44,17; %Nfebrero= 43,16). En hembras de diciembre los ítems de mayor numerosidad fueron Coleoptera y Hemiptera con un 25% para cada ítem. En las hembras de febrero el ítem presa Hemiptera presentó mayor numerosidad (%N= 50). Teniendo en cuenta el Porcentaje de Frecuencia de Ocurrencia, el ítem que apareció en la mayoría de los estómagos de diciembre tanto en machos como en hembras fue Coleoptera (%FOmachos= 83,33; %FOhembras= 66,67). En febrero esto se mantuvo para las hembras (%FO= 30,00) pero en machos estuvo representado por Hemiptera (%FO= 42,86). En diciembre las flores ocuparon el mayor porcentaje de volumen en los machos (%V= 82,55) y en hembras el mayor porcentaje de volumen estuvo representado por arañas (%V= 49,93).
Según el IRI, en machos y hembras de diciembre el ítem presa Hemiptera cambió de categoría accesoria a fundamental (IRImachos= 2989,99; IRIhembras= 2252,55). El ítem Flores resultó fundamental (IRI= 7671,29) en los machos de diciembre, y secundaria (IRI= 1526,30) para las hembras de la misma estación. El ítem presa Coleoptera resultó accidental en machos (IRI=1896,70) y fundamental en hembras (IRI= 1773,19). Por otro lado, el ítem fundamental en machos de febrero fue Hemiptera (IRI = 2181,59) y como categoría secundaria se observó a Coleoptera (IRI = 1587,87). En las hembras de la misma estación se observaron como categorías fundamentales a los ítems Hemiptera (IRI= 1267,38) y Coleoptera (IRI= 1558,82) y como secundaria Larva (IRI= 865,42). En ambas estaciones el ítem Frutos fue accidental en machos y ausente en hembras (Tabla 1).
El nicho trófico aumentó levemente en febrero (Nb= 0,66) con respecto a diciembre (Nb= 0,60). Se observó que los machos (Nb= 0,84) presentaron un nicho trófico más amplio que las hembras (Nb= 0,53) (Tabla 2).
La diversidad trófica para diciembre fue de B=1,38 y para febrero fue de B= 1,48. En machos su valor fue de B=1,54 y en hembras fue de B=1,29 (Tabla 2). No se observaron diferencias estacionales (prueba t= -1,07; p= 0,28) ni sexuales (prueba t= 0,88; p= 0,37).
Relación depredador-presa. En las hembras el largo de la presa se correlacionó negativamente con la LCA y LHC. Por otra parte, los machos no muestran relaciones significativas (Tabla 4).
Tabla 4. Análisis de correlación de Spearman (rs) entre el tamaño corporal de los depredadores [longitud de la cabeza (LCA), altura máxima de la cabeza (ALCA), ancho de la cabeza (ANCA) y longitud hocico-cloaca (LHC)] y las variables morfométricas de las presas;
* indica relaciones estadísticamente significativas (p< 0,05).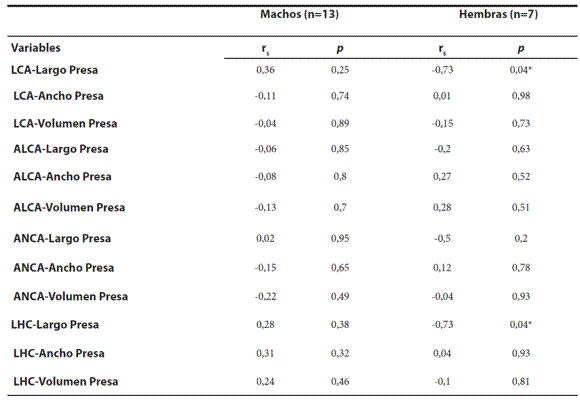
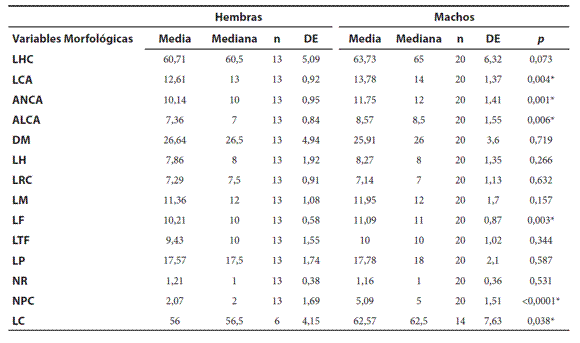
Dimorfismo sexual. El tamaño corporal (LHC) no varió entre machos y hembras (Mann-Whitney, U= 204; p= 0,07; nmachos= 20, nhembras= 13; Medianamachos= 65; Medianahembras= 60,5). Las dimensiones relacionadas con la cabeza (LCA, ANCA, ALCA), la LF, el NPC y la LC fueron mayores en los machos. No resultaron significativas las comparaciones en DM, LH, LRC, LM, LTF, LP y NR (Tabla 5). La LC se analizó con un tamaño muestral (n) diferente al resto de las variables morfológicas debido a la presencia de colas regeneradas, las cuales no se tuvieron en cuenta para el análisis.
Tabla 5. Media, mediana, tamaño muestral (n), desviación estándar (DE) y valor p de la longitud hocico-cloaca (LHC), longitud de la cabeza (LCA); ancho de la cabeza (ANCA), altura máxima de la cabeza (ALCA), distancia de separación entre los miembros anteriores y posteriores (DM), longitud del húmero (LH), longitud radio cúbito (LRC), longitud de la mano (LM), longitud de fémur (LF), longitud tibio-fíbula (LTF), longitud de la pata (LP), distancia narina-rostral (NR), número de poros precloacales (NPC) y la longitud de la cola (LC) en milímetros; * indica diferencias estadísticamente significativas (p< 0,05), Prueba U de Mann- Whitney.
DISCUSION
Los resultados de este estudio indican que Liolaemus eleodori es una especie omnívora y su dieta está compuesta por artrópodos y material vegetal, esto coincide en gran parte con los ítems descriptos en la dieta de L. multicolor para ambientes puneños similares (Valdecantos, 2011) y para la especie endémica de altura L. crepuscularis (Semhan et al., 2013).
La baja amplitud trófica observada coincide con la alta preferencia de hemípteros y coleópteros, similar a lo observado por Villavicencio et al. (2005) para Liolaemus ruibali, también para la puna en la Reserva Don Carmelo (Dpto. Ullum), donde se observó un dominio numérico y volumétrico de Hemiptera, siendo la categoría fundamental de la dieta. Halloy et al. (2006) proponen que en L. pacha la mayoría de los ítems presa corresponden a los grupos Coleoptera, Hemiptera e Hymenoptera.
En Liolaemus eleodori es frecuente la presencia de material vegetal, se observó en el 90% de la muestra analizada para la dieta y representan una categoría alimenticia más dentro de la dieta. Espinoza et al. (2004) proponen que en Liolaemidae el consumo de plantas podría ser explicado por una combinación de condiciones ambientales, como climas fríos y hábitats de alta montaña. El material vegetal también ha sido observado en la dieta de L. multicolor (Valdecantos, 2011), L. cuyanus (Moreno Azócar y Acosta, 2011), L. poecilochromus (Valdecantos et al., 2012) y L. crepuscularis (Semhan et al., 2013).
Estacionalmente, tanto en machos como en hembras, la dieta de Liolaemus eleodori osciló entre la insectivoría-omnivoría-herbivoría. En diciembre, los machos tienen una dieta herbívora y las hembras presentan una dieta omnívora. Estas diferencias podrían estar dadas por la alta preferencia de los machos por las flores y en el caso de las hembras al menor consumo de este ítem vegetal. Espinoza et al. (2004) proponen que la herbivoría probablemente sea favorecida en climas fríos debido a los efímeros y menos abundantes que pueden ser los insectos como recurso alimenticio, en comparación con la posibilidad de fácil obtención de plantas como recurso en hábitats de alta montaña. Por otra parte, en los machos y hembras de febrero aumenta la presencia de artrópodos, por lo que los machos cambian a una dieta omnívora y las hembras son estrictamente insectívoras. Asimismo, la preferencia por los hemípteros se observó en machos y en hembras. Posiblemente la menor amplitud trófica observada en hembras y en diciembre se deba al principal consumo de estos artrópodos. Es decir que los machos además de ingerir artrópodos también prefieren flores y a diferencia de las hembras sólo las incluyen como una categoría accidental. Existen revisiones que argumentan que los lagartos pertenecientes a la familia Iguanidae consumen principalmente las partes reproductivas de las plantas, como flores y/o frutos (Godínez, 2004). Nyhagen et al. (2001) explican que es muy probable que se sientan atraídos por las plantas con flores, principalmente por su néctar y polen y por los insectos que las visitan. Esto justificaría lo observado en los machos de L. eleodori. También en otros Liolaemus se observó el consumo de material vegetal, especialmente de frutos en L. nigromaculatus (Ortiz y Riveros, 1976), L. lutzae (Rocha, 1989), L. wiegmannii (Aun et al., 1999), L. bibronii (Belver y Avila, 2001), L. ruibali (Villavicencio et al., 2005). Acosta et al. (1996) informaron sobre la ingesta de flores en L. boulengeri y Vanhooydonck et al. (2010) observaron que seis especies de Liolaemus consumen frutas, tres se alimentan de semillas y dieciocho especies (e.g. L. baguali y L. zullyi) comen flores. Y en el caso de las hembras, se observó que en diciembre se encontraron grávidas, es posible que hayan consumido mayor cantidad de insectos que flores y frutos debido al estado reproductivo en el que se encontraban restringiendo su campo de acción y limitándose a alimentarse de presas que no requieran recorrer el territorio, como lo hicieron las hembras de L. wiegmannii (Aun et al., 1999) y de L. crepuscularis (Semhan et al., 2013).
Si bien en los machos de Liolaemus eleodori las variables morfométricas de las presas no se correlacionaron con el tamaño corporal de los depredadores, en un estudio de Vanhooydonck et al. (2010) proponen que en algunos Liolaemus los machos con cabezas más grandes comen presas grandes. Por otro lado, ellos obtienen que las hembras con medidas de la cabeza más cortas probablemente coman presas más duras y tal vez el principal consumo de hemípteros en las hembras de L. eleodori pueda ser explicado por esta relación, pero esto no fue investigado en L. eleodori.
Liolaemus eleodori no presenta dimorfismo en el tamaño del cuerpo, al igual que en L. multicolor (Valdecantos et al., 2007), L. riojanus (Laspiur et al., 2006), L. olongasta (Cánovas et al., 2006), L. elongatus (Quatrini et al., 2001). Por otro lado, en L. pseudoanomalus (Villavicencio et al., 2003), L. irregularis (Valdecantos et al., 2007), L. cuyanus (Laspiur y Acosta, 2007), L. tenuis (Vidal et al., 2005) y L. occipitalis (Verrastro, 2004) el tamaño del cuerpo es más grande en los machos. Con menor frecuencia, también existen casos de lagartijas donde las hembras son de mayor tamaño que los machos como en el caso de L. calchaqui, L. chacoensis, L. crepuscularis, L. darwinii, L. ornatus (Cabrera et al., 2013), entre otros. Este carácter no dimórfico en L. eleodori, podría deberse a lo propuesto por Valdecantos y Lobo (2007) para L. multicolor, en el cual mencionan que el tamaño mínimo de madurez sexual es mayor en las hembras y que ambos sexos invertirían similar cantidad de energía en el crecimiento del cuerpo y no presentando diferencias en los tamaños de los adultos.
Las dimensiones relacionadas con la cabeza (LCA, ANCA y ALCA), la longitud de fémur, el largo de la cola y el número de poros precloacales son significativamente más grandes en los machos. Las medidas cefálicas también resultaron dimórficas en Liolaemus multicolor y al igual que en L. eleodori, en las especies L. cuyanus (Laspiur y Acosta, 2007), L. pictus y L. elongatus las medidas de la cabeza resultaron mayores en los machos (Ibargüengoytía y Cussac, 1999). Según Carothers (1984), Rocha (1995) y Valdecantos y Lobo (2007) la selección sexual podría estar relacionada con interacciones agresivas entre los sexos y con la defensa territorial y llevaría a reducir la competencia por recursos actuando a favor de los machos con dimensiones de la cabeza mayores. Herrel et al. (1999) mencionan una hipótesis a poner a prueba en la cual las hembras elegirían a los machos más fuertes, con cabezas más grandes. Por otro lado, también proponen una relación entre la hipótesis de partición de nicho trófico y el dimorfismo sexual que presenta Gallotia galloti en las dimensiones relacionadas con la cabeza y encuentran que una mayor fuerza de mordida es requerida para consumir el material vegetal y así poder explotar una nueva fuente de alimento, las plantas. Esto permitiría a los machos capturar presas no accesibles por las hembras e ingerir más material vegetal. Dado que los machos de L. eleodori consumieron mayor cantidad de material vegetal posiblemente el dimorfismo sexual en el tamaño de la cabeza esté relacionado con su ecología trófica. Pero en G. galloti el análisis trófico no indica diferencias entre los sexos en la cantidad de vegetales ingeridos, concluyendo que la divergencia del nicho trófico del lagarto canario no mantiene el dimorfismo en el tamaño de la cabeza. Además, la relación entre la fuerza de la mordida y la morfología de la cabeza también se estudió en algunos lagartos del género Liolaemus, esto se observó en un estudio realizado por Vanhooydonck et al. (2010) en el que reportan que solamente en las hembras la variación en la fuerza de mordida y el tamaño de la cabeza puede ser explicada por la variación en la dieta y que en los machos la variación en la fuerza de la mordida se debería a las diferencias morfológicas en el ancho de la cabeza. Valdecantos y Lobo (2007) proponen que L. multicolor podría ser territorial y la selección sexual estar actuando a favor de los machos con dimensiones de la cabeza mayores. Lo antes mencionado se ve reforzado por el hecho de haberse encontrado también dimorfismo en las dimensiones de la extremidad posterior, más larga en los machos. Esta característica ha sido relacionada con una mayor habilidad para la carrera y las peleas (Garland y Losos, 1994; Molina Borja, 2003; Valdecantos y Lobo, 2007). La longitud de fémur resultó dimórfica entre los individuos de L. eleodori. Estas diferencias a favor de los machos en las dimensiones de los miembros posteriores sugieren que estas partes del cuerpo también están sometidas a selección, y posiblemente también estén relacionadas con su mayor movilidad en las áreas de actividad (Halloy y Robles, 2002; Laspiur y Acosta, 2007). Al igual que en L. olongasta (Cánovas et al., 2006) y L. cuyanus (Laspiur y Acosta, 2007), en L. eleodori, la longitud de la cola fue de mayor tamaño en los machos. Por otro lado, se observó la presencia de poros precloacales en ambos sexos, sin embargo los machos presentaron un mayor NPC. Este aspecto también se observa en L. pseudoanomalus (Villavicencio et al., 2003), L. irregularis (Valdecantos y Lobo, 2007), L. scapularis (Laurent, 1982), L. wiegmanni (Ramírez Pinilla, 1991). En otros Liolaemus sólo los machos presentan poros precloacales [e.g. L. olongasta (Cánovas et al., 2006), L. occipitalis (Verrastro, 2004), L. lutzae, L. multimaculatus, L. rabinoi, L. riojanus (Cei, 1974, 1979; Laurent, 1986; Rocha, 1996), L. multicolor (Valdecantos et al., 2007) y L. cuyanus (Laspiur y Acosta, 2007)]. Esta característica, junto con la longitud de la cola, probablemente esté asociada al comportamiento de cortejo. Sin embargo, estos aspectos en L. eleodori son desconocidos hasta el momento.
Es importante destacar que la información obtenida en este estudio representa un aporte substancial en el conocimiento de la ecología de esta especie endémica debido a la imposibilidad de aumentar los estudios en esta zona de la puna de San Juan por dificultades relacionadas con el acceso y logística, no obstante más estudios serían necesarios para fortalecer las contribuciones halladas en esta investigación.
Agradecimientos
Deseamos agradecer a Carrizo A., Montañez A. (Parque Nacional San Guillermo), a Recabarren D. y Jordán M. (Secretaría de Medio Ambiente de la Provincia de San Juan) por la logística y asistencia en el campo. A Marinero J. por su ayuda en las tareas de campo. A los revisores anónimos que contribuyeron a mejorar sustancialmente el manuscrito inicial. Este trabajo fue parcialmente financiado por la Universidad Nacional de San Juan CICITCA- E/881 (director JCA).
UNSJ-H 1628 Llano de San Guillermo Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J. UNSJ-H 1629 Vega Los Salineros Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J. UNSJ-H 1630 Tambería Grande Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J. UNSJ-H 1631 Vega Los Salineros Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J. UNSJ-H 1632 Tambería Grande Depto Iglesia San Juan Argentina 06/12/2004 Marinero J. UNSJ-H 1633 Tambería Grande Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio H.J., Acosta .C., Marinero J. UNSJ-H 1634 Tambería Grande Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1635 Tambería Grande Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1636 Tambería Grande Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio H.J; Acosta J.C. UNSJ-H 1638 Caserones Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio .J., Acosta J.C., Marinero J. UNSJ-H 1639 Caserones Depto Iglesia San Juan Argentina 11/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1640 Llano de los Leones 16 km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1641 Llano de los Leones 16 km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1642 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1643 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1651 Caserones Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1652 Llano de San Guillermo Depto Iglesia San Juan Argentina 08/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1653 Llano de San Guillermo Depto Iglesia San Juan Argentina 08/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1654 Llano de San Guillermo Depto Iglesia San Juan Argentina 08/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1655 Margen Sur del Río Santa Rosa 34km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1656 Ladera sur del Río Agua Hedionda 28 km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1657 Llano de los leones 16km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1658 Llano de San Guillermo Depto Iglesia San Juan Argentina 08/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1659 Margen Sur del Río Santa Rosa 34km al Norte de Refugio Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1660 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1661 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1662 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1663 Vega Los Salineros Depto Iglesia San Juan Argentina 10/02/2005 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1664 Tambería Grande Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J., Acosta J.C., Marinero J. UNSJ-H 1665 Vega Los Salineros Depto Iglesia San Juan Argentina 06/12/2004 Villavicencio H.J UNSJ-H 1666 Llano de San Guillermo Depto Iglesia San Juan Argentina 06/12/2004 Marinero J. UNSJ-H 1667 Llano de San Guillermo Depto Iglesia San Juan Argentina 06/12/2004 Marinero J.
LITERATURA CITADA
1. Abdala, C.S.; Acosta, J.C.; Acosta, J.L.; Álvarez, B.B.; Arias, F.; Avila, L.J.; Blanco, M.G.; Boretto, J.M.; Brancatelli, G.; Breitman, M.F; Cabrera, M.R.; Cairo, S.; Corbalán, V.; Hernando, A.; Ibargüengoytía, N.R.; Kacoliris, F.; Laspiur, A.; Montero, R.; Morando, M.; Pelegrin, N.; Fulvio Pérez, C.H.; Quinteros, A.S.; Semhan, R.V.; Tedesco, M.E.; Vega, L. & Zalba, S.M. 2012. Categorización del estado de conservación de las lagartijas y anfisbenas de la República Argentina. Cuadernos de Herpetología 26: 215-248. [ Links ]
2. Abdala, C.S & Quinteros, A.S. 2014. Los últimos 30 años de estudios de la familia de lagartijas más diversa de Argentina. Actualización taxonómica y sistemática de Liolaemidae. Cuadernos de Herpetología 28: 55-82. [ Links ]
3. Acosta, J.C.; Avila L.J. & Blanco, G. 1996. Ecología de Liolaemus boulengeri (Sauria: Tropiduridae) en el noroeste de la estepa patagónica (Ing. Jacobacci, Río Negro, Argentina). Cuadernos de Herpetología 9: 100-107. [ Links ]
4. Acosta, J.C.; Villavicencio, H.J. & Marinero, J.A. 2007. Anfibios y Reptiles. Biodiversidad, Bio-Ecología y Especies de valor especial para monitoreo: 167-179. En: Martínez Carretero, E. (ed.), Diversidad biológica y cultural de los Altos Andes Centrales de la Argentina-Línea de Base de la Reserva de Biosfera San Guillermo- San Juan. Editorial Fundación Universidad Nacional de San Juan, San Juan. [ Links ]
5. Aun, L. & Martori, R. 1998. Reproducción y dieta de Liolaemus koslowskyi Etheridge 1993. Cuadernos de Herpetología 12: 1-9. [ Links ]
6. Aun, L.; Martori, R. & Rocha, C. 1999. Variación estacional de la dieta de Liolaemus wiegmannii (Squamata: Tropiduridae) en un Agroecosistema del Sur de Córdoba, Argentina. Cuadernos de Herpetología 13: 69-80. [ Links ]
7. Avila, L.J.; Cei, J.M.; Martori, R.A. & Acosta, J.C. 1992. A new species of Liolaemus of the bibroni group from granitic ravines of Achiras Sierra de Comechingones, Córdoba Argentina (Reptilia: Tropiduridae). Museo Regionale di Scienze Naturali Bollettino 10: 101-111. [ Links ]
8. Belver, L.C. & Avila, L.J. 2002. Diet composition on Liolaemus bibroni (Iguania: Liolaemidae) in southern Rio Negro Province, Argentina. Herpetological Journal 12: 39-42. [ Links ]
9. Bland, R.G. & Jaques, H.E. 1978. How to know the Insects. The Pictured Key Nature Series. WC Brown Company Publishers Dubuque, Iowa. [ Links ]
10. Brewer, M.M. & Argüello, N.V. 1980. Guía ilustrada de insectos comunes de la Argentina. Miscelánea Nº 67. Fundación Miguel Lillo. Tucumán. [ Links ]
11. Brown, R.P. & Pérez Mellado, V. 1994. Ecological energetics and food acquisition in dense Menorcan islet populations of the lizard Podarcis lilfordi. Functional Ecology 8: 427-434. [ Links ]
12. Cabrera, R.A & Monguillot, J. 2007. Liolaemus eleodori (San Guillermo's lizard): Reproduction. Herpetological Bulletin 101: 34-35. [ Links ]
13. Cabrera, M.P.; Scrocchi, G.J. & Cruz, F.B. 2013. Sexual size dimorphism and allometry in Liolaemus of the L. laurenti group (Sauria: Liolaemidae): Morphologic lability in a clade of lizards with different reproductive modes. Zoologischer Anzeiger 252: 99-106. [ Links ]
14. Cánovas, M.G.; Villavicencio, H.J.; Acosta, J.C. & Marinero, J.A. 2006. Dimorfismo sexual y morfometría de una población de Liolaemus olongasta (Iguania: Liolaeminae) en la Laja, Albardón, San Juan, República Argentina. Cuadernos de Herpetología 19: 57-61. [ Links ]
15. Carothers, J.H. 1984. Sexual selection and sexual dimorphism in some herbivorous lizards. American Naturalist 124: 244-254. [ Links ]
16. Cei, J.M. 1974. Two new species of Ctenoblepharis (Reptilia, Iguanidae) from the arid environments of the central Argentina (Mendoza Province). Journal of Herpetology 8: 71-75. [ Links ]
17. Cei, J.M. 1979. A reassessment of the genus Ctenoblepharis (Reptilia, Sauria, Iguanidae) with a description of new subspecies of Liolaemus multimaculatus from western Argentina. Journal of Herpetology 13: 297-302. [ Links ]
18. Cei, J.M.; Etheridge, R. & Videla, F. 1983. Especies nuevas de Iguánidos del noroeste de la Provincia de San Juan (Reserva Provincial San Guillermo), Argentina. Deserta 7: 316-323. [ Links ]
19. Dunham, A.E.1983. Realizad niche overlap, resource abundance, and intensity of interspecific competition: 261-280. En: Huey, R.B.; Pianka, E.R. & Schoener, T.W. (eds.), Lizard Ecology. Harvard University Press, Cambridge, Massachusets. [ Links ]
20. Duré, M. 1998. Alimentación de Physalaemus santafecinus Barrios, 1965 (Anura, Leptodactylidae). Facena 14: 45-52. [ Links ]
21. Espinoza, R.E.; Wiens, J.J. & Tracy, R.C. 2004. Recurrent evolution of herbivory in small, cold- climate lizards: Breaking the ecophisiological rules of reptilian herbivory. Proceedings of the National Academy of Sciences USA 101: 16819-16824. [ Links ]
22. Fox, S.F. & Shipman, P.A. 2003. Social behavior at high and low elevations: environmental release and phylogenetic effects in Liolaemus: 310-355. En: Fox, S.F.; McCoy, J.K. & Baird, T.A. (eds.). Lizard social behavior. Johns Hopkins University Press, Baltimore. [ Links ]
23. Frutos, N.; Camporro, L.A; Avila, L.J. 2007. Ámbito de hogar de Liolaemus melanops Burmeister, 1888 (Squamata: Liolaemini) en el centro de Chubut, Argentina. Gayana 71: 142-149. [ Links ]
24. Garland, T. & Losos, J.B. 1994. Ecological morphology of locomotor performance in squamate reptiles: 240-302. En: Wainwright, P.C. & Reily, S.M. (eds.), Ecological Morphology: Integrative Organismal Biology. University of Chicago Press, Chicago. [ Links ]
25. Godínez Álvarez, H. 2004. Pollination and seed dispersal by lizards: a review. Revista Chilena de Historia Natural 77: 569-577. [ Links ]
26. Halloy, M. & Robles, C. 2002. Spatial distribution in a neotropical lizard, Liolaemus quilmes quilmes (Liolaemidae): site fidelity and overlapping among males and females. Bulletin of the Maryland Herpetological Society 38: 118-129. [ Links ]
27. Halloy, M.; Robles, C. & Cuezzo, F. 2006. Diet in two syntopic Neotropical lizard species of Liolaemus (Liolaemidae): interspecific and intersexual differences. Revista Española de Herpetología 20: 47-56. [ Links ]
28. Hammer, O; Harper, D.A.T. & Ryan, P.D. 2001. Past: paleontological statistics software package for education and data analysis. Paleontología Electrónica 1: 4- 9. [ Links ]
29. Herrel, A.; Spithoven, L.; Van Damme, R. & De Vree, F. 1999. Sexual dimorphism of head in Gallotia galloti: Testing the niche divergence hypotesis by functional analyses. Functional Ecology 13: 289-297. [ Links ]
30. Herrel, A.; Vanhooydonck, B.; Joachim, R. & Irschick, D.J. 2004. Frugivory in polychrotid lizards: effects of body size. Oecologia 140: 160-168. [ Links ]
31. Ibargüengoytía, N.R. & Cussac, V.E. 1999. Male response to low frequency of female reproduction in the viviparous lizard Liolaemus (Tropiduridae). Herpetological Journal 9: 111-117. [ Links ]
32. Iverson, J.B. 1982. Adaptations to herbivory in iguanine lizards: 60-76. En: Rand, G.M.B. & Rand, A.S. (eds.), Iguanas of the World, they behavior, ecology and conservation. Noyes Publications, New Jersey. [ Links ]
33. Laspiur, A.; Ripoll, Y. & Acosta, J.C. 2006. Dimorfismo Sexual de Liolaemus riojanus (Iguania: Liolaemidae) en una población de un desierto arenoso del Monte de San Juan, Argentina. Revista Española de Herpetología 20: 87-94. [ Links ]
34. Laspiur, A. & Acosta, J.C. 2007. Dimorfismo sexual de Liolaemus cuyanus Cei & Scolaro, 1980 (Iguania: Liolaemidae) en una población de San Juan, Argentina. Revista Peruana de Biología 14: 47-50. [ Links ]
35. Laurent, R.F. 1982. Description de trois espèces nouvelles du genre Liolaemus (Sauria, Iguanidae). Spixiana 5: 139-147. [ Links ]
36. Laurent, R.F. 1986. Descripciones de nuevos Iguanidae del género Liolaemus. Acta Zoológica Lilloana 38: 87-105. [ Links ]
37. Martínez Carretero, E. 2007. Diversidad biológica y cultural de los Altos Andes Centrales de la Argentina-Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan. San Juan. [ Links ]
38. Martínez Carretero, E.; Dalmasso, A.; Márquez, J. & Pastrán, G. 2007. Vegetación: 115-152. En: Martínez Carretero, E. (ed.), Diversidad biológica y cultural de los Altos Andes Centrales de la Argentina- Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan, San Juan. [ Links ]
39. Molina Borja, M. 2003. Sexual dimorphism of Gallotia atlantica atlantica and Gallotia atlantica mahoratae (Lacertidae) from the eastern Canary Islands. Journal of Herpetology 37: 769-772. [ Links ]
40. Moreno Azócar, D.L. & Acosta, J.C. 2011. Feeding habits of Liolaemus cuyanus (Iguania: Liolaemidae) from the Monte Biogeographic Province of San Juan, Argentina. Journal of Herpetology 45: 283-286. [ Links ]
41. Nyhagen, D.F.; Kragelund, C.; Olesen, J.M. & Jones, C.G. 2001. Insular interactions between lizards and flowers: flower visitation by an endemic Mauritian gecko. Journal of Tropical Ecology 17: 755-761. [ Links ]
42. Ortiz, J.C. & Riveros, G.M. 1976. Hábitos alimenticios de Liolaemus nicromaculatus kuhlmani, Muller y Hellmich. Anales del Museo de Historia Natural de Valparaíso 9: 131-140. [ Links ]
43. Ortiz, J.C. 1981. Estudio multivariado de las especies de Liolaemus del grupo nigromaculatus (Squamata, Iguanidae). Anales del Museo de Historia Natural de Valparaíso 14: 247-265. [ Links ]
44. Pérez Mellado, V. & De La Riva, I. 1993. Sexual size dimorphism and ecology: the case of a tropical lizard, Tropidurus melanopleurus (Sauria: Tropiduridae). Copeia 1993: 969-976. [ Links ]
45. Pianka, E.R. 1973. The structure of lizard communities. Annual Review in Ecology and Systematics 4: 53-74. [ Links ]
46. Pianka, E.R. 1982. Ecología Evolutiva. Ediciones Omega S. A. Barcelona. [ Links ]
47. Pianka, E.R. 1986. Ecology and Natural History of Desert Lizards. Princeton University Press, Princeton, New Jersey. [ Links ]
48. Pincheira Donoso, D. 2008. Testing the accuracy of fecal-based analyses in studies of trophic ecology in lizards. Copeia 2008: 322-325. [ Links ]
49. Pincheira Donoso, D.; Hodgson, D.J.; Stipala, J. & Tregenza,T. 2009. A phylogenetic analysis of sex-specific evolution of ecological morphology in Liolaemus lizards. Ecological Research 24: 1223-1231. [ Links ]
50. Pinkas, L.; Oliphanat, M. & Iverson, Z. 1971. Food habits of albacore bluefin tuna and bonito in California waters. California. Department of Fish and Games. Fish Bulletin 152: 1-105. [ Links ]
51. Pough, F.H.; Andrews, R.M.; Cadle, J.E.; Crump, M.L.; Savitzky, A.H. & Wells, K.D. 2001. Herpetology. Prentice Hall. New Jersey. [ Links ]
52. Quatrini, R.; Albino, A. & Barg, M. 2001. Variación morfológica y dieta en dos poblaciones de Liolaemus elongatus Koslowsky, 1896 (Iguania: Tropiduridae) del noroeste patagónico. Revista Chilena de Historia Natural 74: 639-651. [ Links ]
53. Ramírez Pinilla, M.P. 1991. Reproductive and fat body cycles of the lizard Liolaemus wiegmanni. Amphibia Reptilia 12(2):195-202. [ Links ]
54. Reca, A.; Ubeda, C. & Grigera, D. 1994. Conservación de la fauna de tetrápodos. Un índice para su evaluación. Mastozoología Neotropical 1: 17-28. [ Links ]
55. Regier, J.C.; Shultz, J.W.; Zwick, A.; Hussey, A.; Ball, B.; Wetzer, R.; Martin, J.W. & Cunningham, C.W. 2010. Arthropod relationships revealed by phylogenomic analysis of nuclear protein-coding sequences. Nature 463: 25. [ Links ]
56. Roca, V. 1999. Relación entre las faunas endoparásitos de reptiles y su tipo de alimentación. Revista Española de Herpetología 13:101-121. [ Links ]
57. Rocha, C.F. 1989. Diet of a tropical lizard (Liolaemus lutzae) of southeastern Brazil. Journal of Herpetology 23:292-294. [ Links ]
58. Rocha, C.F.D. 1995. Growth of the tropical sand lizard Liolaemus lutzae in southeastern Brazil. Amphibia-Reptilia 16: 257-264. [ Links ]
59. Rocha, C.F.D. 1996. Sexual dimorphism in the sand lizard Liolaemus lutzae of southeastern Brazil: 131-140. En: Péfaur, J.E. (ed), Herpetologia Neotropical. Editorial Conselho de Publicaciones, Universidad de los Andes. Mérida. [ Links ]
60. Rocha, C.F.D. 1999. Home range of the tropidurid lizard Liolaemus lutzae: sexual and body size differences. Revista Brasileira de Biología 59: 125-130. [ Links ]
61. Salvioli, G. 2007. Caracterización hidrometeorológica: 63-87. En: Martínez Carretero, E. (ed.), Diversidad biológica y cultural de los Altos Andes Centrales de la Argentina- Línea de Base de la Reserva de Biosfera San Guillermo-San Juan. Editorial Fundación Universidad Nacional de San Juan, San Juan. [ Links ]
62. Semhan, R.V.; Halloy, M. & Abdala, C.S. 2013. Diet and Reproductive States in a High Altitude Neotropical Lizard, Liolaemus crepuscularis (Iguania: Liolaemidae). South American Journal of Herpetology 8:102-108. [ Links ]
63. Sneath, P.H. & Sokal, R.R. 1973. Numerical taxonomy. W.H. Freeman and Co., San Francisco. [ Links ]
64. Stuart Fox, D.M. & Ord, T.J. 2004. Sexual selection, natural selection and the evolution of dimorphic coloration and ornamentation in agamid lizards. Proceedings of the Royal Society of London B 271: 2249-2255. [ Links ]
65. Valdecantos, M.S. & Lobo, F. 2007. Dimorfismo sexual en Liolaemus multicolor y L. irregularis (Iguania: Liolaemidae). Revista Española de Herpetología 21:55-69. [ Links ]
66. Valdecantos, S.; Lobo, F. & Martínez, V. 2007. Estimación de edades, tamaño corporal y adquisición de la madurez sexual en dos especies de Liolaemus (Iguania: Liolaemidae). Cuadernos de Herpetología 21: 27-40. [ Links ]
67. Valdecantos, M.S. 2011. Coexistencia entre especies: competencia, agresión o indiferencia en lagartijas de la puna del género Liolaemus (Squamata: Iguania: Liolaeminae). Tesis doctoral. Facultad de Ciencias Exactas, Físicas y Naturales. Universidad Nacional de Córdoba. 1-157 pp. [ Links ]
68. Valdecantos, M.S.; Arias, F. & Espinoza, R.E. 2012. Herbivory in Liolaemus poecilochromus, a small, cold-climate lizard from the Andes of Argentina. Copeia 2012: 203-210. [ Links ]
69. Vanhooydonck, B.; Cruz, F.B.; Abdala, C.S.; Moreno Azócar, D.L.; Bonino, M.F. & Herrel, A. 2010. Sex-specific evolution of bite performance in Liolaemus lizards (Iguania: Liolaemidae): the battle of the sexes. Biological Journal of the Linnean Society 101: 461-475. [ Links ]
70. Vega, L.E. 1999. Ecología de saurios arenícolas de las dunas costeras Bonaerenses. Tesis doctoral. Facultad de Ciencias Exactas y Naturales. Universidad Nacional de Mar del Plata. 1-102 pp. [ Links ]
71. Verrastro, L.; Veronese, L.; Bujes, C. & Dias Filho, N.M. 2003. A new species of Liolaemus from Southern Brazil. (Iguania: Tropiduridae). Herpetológica 59: 105-118. [ Links ]
72. Verrastro, L. 2004. Sexual dimorphism in Liolaemus occipitalis (Iguania, Tropiduridae). Iheringia Série Zoológica 1: 45-48. [ Links ]
73. Vidal, M.A.; Ortiz, J.C.; Ramirez, C.C. & Lamborot, M. 2005. Intraspecific variation in morphology and sexual dimorphism in Liolaemus tenuis (Tropiduridae). Amphibia- Reptilia 26: 343-351. [ Links ]
74. Villavicencio, H.J.; Acosta, J.C.; Cánovas, M.G. & Marinero, J.A. 2003. Dimorfismo sexual de Liolaemus pseudoanomalus (Iguania: Liolaemidae) en el centro-oeste de Argentina. Revista Española de Herpetología 17: 87-92. [ Links ]
75. Villavicencio, H.J.; Acosta, J.C. & Cánovas, M.G. 2005. Dieta de Liolaemus ruibali Iguanidae: Liolaeminae) en la reserva de usos múltiples Don Carmelo, San Juan, Argentina. Multequina 14: 47-52. [ Links ]
76. Villavicencio, H.J.; Acosta, J.C.; Blanco, G.M. & Marinero, J.A. 2012. Ecología térmica de la lagartija endémica Liolaemus eleodori (Iguania: Liolaemidae) en el Parque Nacional San Guillermo, San Juan, Argentina. Multequina 21: 17-23. [ Links ]














